Method Article
체적 조절 출혈성 쇼크의 돼지 유아 모델에 대한 설명
요약
이 기사는 연구자들에게 출혈성 쇼크의 유아 돼지 모델을 설정하기 위한 상세하고 접근 가능한 가이드를 제공하는 것을 목표로 합니다.
초록
출혈성 쇼크는 소아 환자의 이환율과 사망률의 주요 원인입니다. 소생술을 안내하기 위해 성인에서 검증된 임상 지표의 해석 및 다양한 치료법 간의 비교는 이 집단의 고유한 이질성으로 인해 어린이에게 어렵습니다. 그 결과, 성인에 비해 소아 출혈성 쇼크의 적절한 관리는 아직 잘 확립되어 있지 않습니다. 또한 출혈성 쇼크가 있는 소아 환자가 드물기 때문에 임상적으로 관련된 연구의 개발이 불가능합니다. 이러한 이유로, 소아 출혈의 영향과 다양한 치료법에 대한 반응을 연구하기 위해 실험용 소아 동물 모델이 필요합니다. 우리는 마취된 어린 돼지에서 부피 조절 출혈성 쇼크의 유아 동물 모델을 제시합니다. 출혈은 미리 계산된 혈액량을 빼내어 유도되며, 이후 돼지를 모니터링하고 다양한 치료법으로 소생시킵니다. 여기에서, 우리는 미성숙 돼지의 출혈성 쇼크에 대한 정확하고 재현성이 높은 모델을 설명합니다. 이 모델은 심각한 출혈에 대한 반응으로 활성화되는 보상 메커니즘을 특성화하는 혈류역학적 데이터를 생성합니다.
서문
외상으로 인한 생명을 위협하는 출혈은 흔하지는 않지만 소아 환자의 주요 사망 원인입니다 1,2. 출혈성 쇼크의 또 다른 원인으로는 출혈열, 위장관 출혈, 간 수술, 심장 수술 등이 있으며, 특히 심폐 우회술을 사용하는 경우3.
성인 인구와 달리 소아 출혈성 쇼크의 관리에 대한 데이터는 불충분하며, 이는 주로 전문가의 의견에 근거하거나 성인 진료에서 직접 번역된 것이다 2,4. 그러나 성인의 경영 전략을 번역하는 것은 적절하지 않을 수 있습니다. 예를 들어, 성인에서 검증된 임상 지표는 다양한 연령 그룹에 걸쳐 존재하는 생리학적 이질성과 소아 인구에서 우세한 다양한 부상 패턴으로 인해 소아 환자에게 외삽하기 어렵습니다. 결과적으로, 소아 환자에 대한 중재를 촉발할 수 있는 특정 종점은 잘 정의되어 있지 않다. 더욱이, 현재 성인을 대상으로 시행되고 있는 치료법이 소아에게 미칠 수 있는 해로운 영향에 대한 충분한 근거가 없다 2,4,5.
이 모든 것을 고려할 때, 신속한 개입을 위한 특정 소생술 임계값을 설정하고 소아 출혈성 쇼크에 가장 적합한 치료법을 더 잘 결정하기 위해 추가 조사가 필요합니다. 그러나 신생아기부터 청소년기까지 소아 인구의 이질성과 환자 부족으로 인해 소아의 생명을 위협하는 출혈에 대한 양질의 임상적으로 관련된 연구의 개발은 어렵습니다.
출혈성 쇼크의 임상적 관련성은 소아 환자에 대한 임상 연구 수행의 어려움 외에도 소아 출혈성 쇼크 후 병태생리를 연구하고 다양한 치료법을 비교하기 위해 동물 모델에 대한 전임상 평가의 필요성을 강조합니다. 출혈성 쇼크를 연구하기 위한 연구에서 여러 동물 모델이 널리 사용되어왔다 6,7,8,9. 인간과의 해부학적, 생리학적 유사성으로 인해 돼지는 생물 의학 연구에서 높은 평가를 받고 있습니다. 특정 유아 모델을 사용하는 것의 이점과 관련하여, 미성숙한 돼지 혈류역학과 호흡계, 혈액계, 대사계가 젊은 사람의 혈류역학과 매우 유사하다는 증거가 있다9. 이것은 소아의 출혈성 쇼크의 임상 시나리오를 시뮬레이션할 수 있는 독특한 기회를 제공합니다.
이 모델에서는 이전에 계산된 혈액량을 빼내어 출혈을 유도합니다. 그 후, 돼지를 모니터링하고 다양한 소생액을 투여합니다.
여기에서, 우리는 미성숙 돼지의 출혈성 쇼크에 대한 정확하고 재현성이 높은 모델을 설명합니다. 이 모델은 심각한 출혈에 대한 반응으로 활성화되는 보상 메커니즘을 특성화하는 혈류역학적 데이터를 생성합니다.
프로토콜
이 의정서의 실험은 스페인 마드리드에 있는 그레고리오 마라뇽 대학 병원의 동물 연구를 위한 기관 윤리 위원회와 마드리드 자치 정부의 농업 및 환경 위원회(허가 번호: 12/0013)의 승인을 받았습니다. 윤리적 치료와 실험 동물 사용에 대한 유럽과 스페인의 지침이 연구 전반에 걸쳐 적용되었습니다. 실험은 스페인 마드리드의 그레고리오 마라뇽 대학 병원의 실험 의학 및 외과에서 수행되었습니다.
참고: 선택된 동물 모델은 건강한 2-3개월(8-12kg) 미니피그(Sus scrofa domestica)로 구성되었습니다. Minipigs는 생물 의학 연구에 적합하도록 만드는 세 가지 다른 품종의 교배의 결과입니다. 이 동물들은 거의 동일한 계통이며 마드리드에 있는 특별히 승인된 사육 시설(IMIDRA)에서 제공하며, 이 시설은 3개의 동형접합 유전계를 순수하게 유지합니다. 수컷과 암컷 동물은 같은 의미로 사용되었다. 동물에게 표준 돼지 사료를 먹이고 건강을 보장하기 위해 최소 2일 동안 관찰했습니다. 흡인의 위험을 줄이기 위해 수술 전날 밤에 물을 제외한 음식을 빼냈다. 일반적인 실험은 마취 유도 및 수술 준비에 30분, 기구 사용에 60분, 회복에 30분, 출혈 유도 및 후방 안정화에 60분, 소생술에 30분, 후속 조치에 120분을 포함하여 완료하는 데 약 120시간이 소요됩니다.
1. 마취, 삽관 및 기계적 환기
- 케타민(10mg/kg)과 아트로핀(0.02mg/kg)을 목 옆, 귀 뒤 또는 대퇴골 뒤쪽에 근육 주사하여 돼지를 사전 투여합니다.
참고: 아트로핀과 같은 항콜린제는 돼지가 마취 상태에서 과도하게 침을 흘릴 수 있으므로 유용하다10. 경험상 이 용량의 케타민은 스트레스를 줄여주기에 충분하며 부작용 없이 돼지의 적절한 진정 및 진통을 유도합니다. 그러나 동물이 제대로 진정되지 않거나 하우징에서 수술실까지의 거리가 긴 경우 케타민(10mg/kg)을 안전하게 투여할 수 있습니다.
주의 : 동물을 다룰 때는 장갑이 필요합니다. - 진정제를 투여한 동물을 수술실로 옮기고 따뜻한 담요가 제공된 수술대 위에 올려 놓습니다.
- 돼지의 귀에 끼운 센서로 말초 산소 포화도(Sp02)를 측정하고 지속적인 3리드 심전도(EKG) 모니터링을 시작합니다.
- 포비돈-요오드 또는 클로르헥시딘 스크럽과 알코올을 최소 3회 번갈아 가며 피부를 소독합니다. 말초 정맥 카테터(22-24G)를 귀 정맥에 삽입합니다. 소독액으로 피부를 미리 소독하십시오.
- 펜타닐(5μg/kg), 프로포폴(4mg/kg), 아트라큐리움(0.5mg/kg)을 정맥 주사하여 마취를 유도합니다. 자발적 호흡이 사라지고 반사 신경이 없는 것이 확인되면 동물을 등쪽 누운 자세로 놓고 흡기 산소 비율(Fi02)을 100%로 설정한 개 마스크로 즉시 핸드백 마스크 환기를 시작합니다.
알림: 신경근 차단제의 사용과 관련된 우발적 인식의 위험을 줄이기 위해 돼지에서 알려진 효과와 더 높은 수준의 용량을 가진 마취제를 사용하여 적절한 수준의 마취를 보장해야 합니다. 또한 심박수, 혈압, 체온과 같은 심혈관 징후를 지속적으로 모니터링하고 금단 반사(페달 철수, 손발 반사 및 턱 긴장도)가 없고 근육 긴장도가 이완된 경우에만 신경근 차단제를 투여합니다. - 기관내 삽관을 수행합니다. 이 절차에는 두 명 이상의 연산자가 필요합니다.
- 기관 내 삽관에 필요한 기본 장비와 수술 도구가 준비되었는지 확인하십시오: 입을 벌리고 튜브를 고정하기 위한 넥타이 거즈, 길이 17-25cm의 직선 칼날이 있는 수의학 후두경, 일반 기관내 튜브(ID 4-5), 탐침, 공기가 담긴 주사기 및 접착 테이프.
- 혀를 살짝 빼고 위아래 송곳니 뒤에 있는 타이 거즈를 사용하여 턱을 벌린 상태로 유지합니다.
- 후두경 검사를 실시하고 후두개가 보이면 후두경 끝을 사용하여 후두개를 혀 밑을 향해 위쪽으로 누릅니다.
알림: 후두개가 연구개에 붙어 있으면 튜브 끝으로 등쪽으로 변위될 수 있습니다. 연산자 1은 1.6.2단계를 수행하고 연산자 2는 1.6.3단계를 수행합니다. - 성대가 시각화되면 튜브를 기관으로 약간 회전시키면서 부드럽게 전진시킵니다.
알림: 기관의 가장 좁은 지점은 성문하 수준에 있습니다. 튜브 삽입이 어려운 경우 약간 회전하거나 더 작은 튜브를 사용해 보십시오. - 탐침을 제거하고 5mL 주사기를 사용하여 커프를 팽창시킵니다.
- 대칭 흉부 상승, 적절한 산소 포화도(95%-100%), 적절한 파형 및 호기말 CO2 (EtCO2) 판독값을 관찰하여 기관내관의 배치를 확인합니다.
주의: 돼지는 후두 점막의 후두 경련과 부종에 매우 취약하며, 삽관을 여러 번 시도하거나 진정제가 불충분한 경우에도 후두 천공이 발생할 수 있다10.
- 삽관을 확인한 후 분당 20회 호흡수, 일회 호흡량 8mL/kg, FiO2 40%, 호기말 양압 4cm H2O의 기계식 인공호흡기를 사용하여 기계적 환기를 시작합니다. 이산화탄소(PaCO2)의 부분 압력이 35mmHg에서 45mm 사이가 되도록 환기를 조정합니다.
- 펜타닐(10μg/kg/h), 프로포폴(10mg/kg/h) 및 아트라큐리움(2mg/kg/h)을 지속적으로 주입 하여 실험 내내 깊은 마취를 유지합니다.
2. 계측
- 혈관 카테터 삽입을 위해 대퇴골 부위를 준비합니다. 붕대를 사용하여 다리를 뒤로 당기고 포비돈-요오드 또는 클로르헥시딘 스크럽과 알코올을 최소 3회 번갈아 가며 서혜부 부위를 소독합니다.
- 초음파로 대퇴부 혈관을 평가하고 도플러 기법을 사용하여 동맥과 정맥을 구별합니다. 정맥의 크기에 따라 연속 초음파 관찰 하에 Seldinger 기술11,12를 사용하여 대퇴 정맥 중 하나에 3개의 포트가 있는 5.5-7.5 프랑스(F) 중심 정맥 카테터를 삽입합니다.
- 중심 정맥 카테터 삽입 직후 변환기 시스템을 연결하여 중심 정맥압을 측정합니다.
- 포도당 주입(20mL/h)이 있는 전해질이 중앙 라인 포트 중 하나에 연결되어 있고 유지 식염수 주입(5mL/h)이 나머지 포트를 통해 주입되어 카테터의 폐색을 방지합니다.
- 심박출량 모니터링을 위해 특별히 설계된 4F 동맥 카테터로 반대쪽 대퇴 동맥을 캐뉼레이션하는 데 동일한 기술을 사용합니다. 초음파 확인이 불가능한 경우 카테터의 정확한 위치를 확인하기 위해 혈액 가스 검사를 수행합니다.
참고: 심한 경련이나 혈종의 경우 반대쪽 대퇴 동맥으로 건너가십시오. - 동맥 카테터가 삽입되면 심박출량 모니터 시스템의 동맥선과 동맥 변환기를 모니터 포트에 직접 연결합니다. 모니터의 정맥 측정 장치를 중앙 정맥 변환기에 동시에 연결합니다.
알림: 이 실험에 사용된 심박출량 모니터는 재료 표에 명시되어 있습니다. 설정, 보정 및 측정에 대해서는 제조업체 지침13을 참조하십시오. - 정맥 및 동맥 변환기가 모두 0으로 보정되었는지 확인합니다.
- 절단 기법을 통해 좌측 내경동맥과 좌측 외경정맥을 노출시킵니다.
- 메스, 뭉툭한 수술용 가위, 조직 집게, 소형 자체 유지 조직 견인기, 바늘 홀더, 수술 스왑, 바늘이 있는 봉합사, 18G IV 캐뉼라 1개, 도입기가 있는 5F 카테터 덮개 1개, Seldinger 가이드 와이어 1개 등 필요한 장비와 수술 도구를 사용할 수 있는지 확인합니다.
- 동물이 등쪽 누운 자세를 취한 상태에서 소독액으로 목 피부를 소독하십시오.
- 메스를 사용하여 ~10cm의 왼쪽 기관주를 절개하여 마누브리움과 턱 각도 사이의 선을 이등분합니다.
- 외부 경정맥을 노출시키려면 SCM 측면 조직을 절개하고 주변 근막에서 정맥을 분리합니다.
- 격리 후 정맥 주위에 고리가 있는 두 개의 비흡수성 실크 봉합사(USP-0)를 사용하여 구멍을 뚫기 전에 혈관을 고정합니다.
- 벤프론 바늘(18g)로 정맥을 절개합니다. 정맥 안으로 들어가면 바늘을 집어넣고 벤프론 튜브를 통해 가이드 와이어를 삽입합니다.
- Venflon 튜브를 제거하고 와이어 위에 인듀서(5F)가 있는 피복을 삽입합니다. 삽입 후 인듀서와 와이어를 모두 제거합니다.
- 삽입 직후 혈전 형성을 방지하기 위해 0.9% NaCl(5mL/h)로 외피를 헹굽니다.
- 칼집 주위에 근위 실크 봉합사를 묶어 고정합니다. 그런 다음 칼집의 손잡이를 SCM에 고정하고 스테이플로 피부를 닫습니다.
- 수술 준비 후, 기준선 모니터링 값과 혈액 샘플을 얻기 전에 동물을 30분 동안 안정화시킵니다.
- 실험 내내 열 담요와 오버헤드 워머를 사용하여 혈액 온도를 37-39°C로 유지합니다.
알림: 온도는 열희석 동맥 카테터 팁에 있는 서미스터로 측정됩니다.
3. 혈류역학 및 관류 모니터링
- EKG, 말초 산소 포화도, 호흡량 및 압력, Fi02를 모니터링합니다.
- 폐활량계를 기관내관과 멀티파라미터 모니터 사이에 연결하여 정성적 및 정량적 EtC02를 측정합니다.
참고: 다중 매개변수 모니터에 대한 자세한 내용은 재료 표를 참조하십시오. - 근적외선 분광법(NIRS)을 사용하여 뇌 조직 산소화 지수(bTOI) 및 스플랑크닉 조직 산소화 지수(aTOI)를 모니터링합니다. 센서를 이마의 피부와 전방 복벽(간하 영역)에 놓습니다.
알림: 뇌 센서는 상부 시상동 정맥혈에 오염될 수 있으므로 정중선에 두지 마십시오14. - 내경동맥에 부착된 혈류탐침을 유량계에 연결하여 경동맥혈류량(CaBF)을 측정합니다.
- 피부 가슴 혈류(CuTBF)를 지속적으로 측정하기 위해 전복벽의 피부 위에 레이저 도플러 센서를 놓습니다.
알림: 경동맥 및 피부 가슴 송풍 센서에 대한 자세한 내용은 재료 표를 참조하십시오. - 기준선에서 30분마다 다음 매개변수를 기록합니다: 혈액 온도, 흡기 일회 호흡량, EtCO2, 심장 리듬, 심박수(HR), 수축기 및 이완기 혈압, 평균 동맥 혈압(MAP), 충격 지수(HR/수축기 혈압)15, 중심 정맥압, 심장 지수(CI), 전체 말단 이완기 용적 지수(GEDVI), 뇌졸중 용적 지수(SVI), 좌심실 수축률(Dt/Dpmax), 전신 혈관 저항 지수(SVRI), 혈관외 폐수 지수(ELWI), 압력 펄스 변화(PPV), 말초 헤모글로빈 포화도, 중심 정맥 포화도(ScvO2), 대뇌(bTOI) 및 스플랑크닉(aTOI) NIRS, CaBF 및 CuTBF에 의한 조직 산소화 지수.
- CI 값을 얻으려면 중심 정맥 카테터를 통해 8°C 미만의 온도에서 0.9% 생리식염수 5mL 볼루스를 주입합니다. 연속된 두 측정값의 평균을 기록합니다.
- 대퇴 혈관에서 30mL의 혈액을 채취하여 동맥 및 정맥혈 가스 프로필과 젖산 농도를 0.3분마다 결정합니다. 기준선, 출혈 유도 후 및 실험 종료 시 표준 전체 혈구 수, 응고 연구 및 생화학을 수행합니다.
- 채혈 후 100IU/mL 헤파린 0.5mL로 혈액을 씻어냅니다.
4. 출혈성 쇼크 유도
- 기기 및 기준선 데이터를 수집한 후 정상 상태에 도달하면 30분에 걸쳐 경정맥에서 30mL/kg의 혈액을 빼내어 저혈량성 쇼크를 유도합니다.
- 안정화를 위해 30분 동안 기다립니다. 이 기간 동안 응급 의료진의 도착이 지연되는 것을 모방하기 위해 소생술을 시도하지 마십시오.
5. 주입 및 후속 조치
- 안정화 기간 후 30분 동안 부피 확장제 또는 혈관 활성제의 덩어리를 주입합니다.
알림: 테스트된 부피 확장제 및 혈관 활성제의 예로는 생리식염수, 고긴장성 알부민, 안지오텐신 및 테리프레신이 있습니다. 이 연구에서는 30mL/kg 생리식염수(NS)(n=13), 15mL/kg 5% 알부민과 3% 고긴장성 식염수(AHS)(n=13) 또는 15μg/kg 테리프레신과 15mL/kg 5% 알부민 및 3% 고긴장성 식염수(TAHS)(n=13)의 단일 정맥 주사 볼루스를 사용했습니다. - 주입 후 120분 동안 동물을 추적하십시오. 혈류역학적 매개변수를 기록하고 동맥 및 정맥혈 가스 프로필과 젖산 농도 측정을 위해 30분마다 혈액 샘플을 얻습니다. 이 기간 동안 소생술을 시도하지 마십시오.
6. 실험의 종료와 안락사
- 실험이 완료되면 진정제 과다 투여(펜타닐 5μg/kg 및 프로포폴 10mg/kg)와 염화칼륨 정맥 주사(2mEq/kg)를 사용하여 성공적으로 소생한 모든 동물을 희생시킵니다.
- 연속 EKG 디스플레이에서 무수축 또는 맥박이 없는 전기 활동에 의한 순환의 부재, 침습적 동맥압 모니터링 중 박동 흐름의 부재 및 기타 활력 징후의 부재를 확인합니다.
- 추적 관찰 기간 동안 동맥 혈압이 25mmHg 미만으로 감소하면 더 이상의 고통을 피하기 위해 동물을 희생하십시오.
결과
제시된 모델은 출혈성 쇼크 및 후속 소생술에 따른 거대 순환 및 미세 순환 변화를 연구하기 위한 여러 실험에서 성공적으로 사용되었으며, 다양한 체액 및 혈관 활성 약물을 비교합니다16,17,18,19.
쇼크에 대한 반응을 고려할 때, 이 모델은 통제된 출혈이 혈류역학적 매개변수와 뇌 및 조직 관류에 현저한 변화를 일으킨다는 것을 일관되게 보여주었습니다.
용적 인출 후 전신 혈관 저항 지수의 증가와 함께 상당한 빈맥과 MAP, CI, SVI, 혈액량 매개변수(GEDVI 및 ITBI) 및 경동맥 혈류의 감소가 감지됩니다(그림 1 및 그림 2).
전신 관류 파라미터와 관련하여 젖산은 크게 증가하는 반면 ScvO2, CuTBF 및 bTO는 감소합니다(그림 3). 중심 정맥압, Dt/Dpmax 및 ELW의 변화는 일반적으로 등록되지 않습니다.
실험실 매개변수의 경우, 헤모글로빈 함량과 헤마토크릿은 수액을 투여할 때까지 감소하지 않습니다. 알부민 농도는 감소하고 출혈이 조절된 후에는 트로포닌 수치가 크게 증가합니다. 심부 온도, PaO2, PaCO2, 동맥 산소 포화도, EtCO2, 전해질, 신장 및 간 기능 매개변수를 포함한 기타 매개변수는 일반적으로 안정적으로 유지됩니다.
쇼크에 대한 심혈관 및 생화학적 반응을 분석하는 데 유용할 뿐만 아니라 이 모델은 다양한 소생액을 성공적으로 구별하는 것으로 나타났습니다.
이전 연구에서 우리는 출혈성 쇼크의 유아 동물 모델에서 고긴장성 수액을 단독으로 또는 다른 승압제와 함께 소량 주입하는 것이 일반 식염수와 비교할 때 전체 혈류역학 및 관류 매개변수를 개선하는지 확인하는 것을 목표로 했습니다.
이전에 보고된 바와 같이, 우리는 고긴장성 유체의 주입이 등장성 유체 16,17,18 부피의 두 배의 주입과 유사한 반응을 일으킨다는 것을 일관되게 관찰했습니다.
보다 구체적으로, 알부민과 고긴장성 식염수를 함께 사용하면 생리식염수 또는 고긴장성 식염수를 단독으로 사용할 때보다 더 크고 더 긴 부피 팽창을 일으켰으며, HR, SVI 및 PPV에서 유의한 차이가 있었으며, 다른 그룹에서 관찰된 바와 같이 혈압 및 GEDVI의 부피 팽창 후 점진적인 감소가 없었습니다(그림 1 및 그림 2). 또한, 고긴장성 알부민을 섭취한 경우 관류 매개변수가 더 크게 개선되는 것을 관찰했으며, 이는 체액 팽창 시작과 비교하여 다른 그룹보다 bTOI 및 CaBF가 더 많이 증가하고 젖산 수치가 더 많이 감소하는 것으로 나타났습니다(그림 3). 우리는 이러한 차이가 혈액량을 증가시키고 생리식염수보다 혈관 내 구획 내에 더 오랜 기간 동안 머무르는 알부민의 능력에 부차적일 수 있다고 생각합니다. 흥미롭게도, 우리는 유체 소생술의 시작 시 단일 덩어리의 terlipressin을 첨가하는 것이 혈류역학적 또는 관류 매개변수 17,18 측면에서 추가적인 이점 없이 고긴장성 알부민 그룹에서 관찰된 것과 유사한 결과를 산출하는 것을 보았습니다17,18.

그림 1: 혈류역학적 매개변수. (A) 심박수의 변화, (B) 평균 동맥압, (C) 기준선에서의 심장 지수(t0') 및 (D) 기준선에서의 전신 혈관 저항 지수(t0'). 실험 과정 내내: 통제된 출혈의 끝(Shock30'); 주입 시작, 통제된 출혈 종료 후 30분(Res0'); 주입 종료 (Res30'); 주입 종료 후 30분 추적 관찰(Obs30'); 주입 종료 후 60분 추적 관찰(Obs60'); 주입 종료 후 90분 추적 관찰(Obs90'). (*) 기준선, 동일 그룹과의 유의한 차이(p < 0.05). (‡) 출혈로 인한 P < 0.05, 같은 그룹. (#) 그룹 NS에서 p< 0.05입니다. 약어: NS = 생리식염수; AHS = 고긴장성 식염수 알부민; TAHS = 테를리프레신과 고긴장성 식염수 알부민. 데이터는 평균과 표준편차로 표시됩니다. 이 그림은 Urbano et al.17의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 혈액량 매개변수. (A) 기준선에서 뇌졸중 용적 지수, (B) 맥압 변화 및 (C) 전체 말단 이완기 용적 지수의 변화(t0'). 실험 과정 내내: 통제된 출혈의 끝(Shock30'); 주입 시작, 조절된 출혈 종료 후 30분(Res0'); 주입 종료 (Res30'); 주입 종료 후 30분 추적 관찰(Obs30'); 주입 종료 후 60분 추적 관찰(Obs60'); 주입 종료 후 90분 추적 관찰(Obs90'). (*) 기준선, 동일 그룹과의 유의한 차이(p < 0.05). (‡) 출혈로 인한 P < 0.05, 동일 그룹. (#) 그룹 NS에서 p< 0.05입니다. 약어: NS = 생리식염수; AHS = 고긴장성 식염수 알부민; TAHS = 테를리프레신과 고긴장성 식염수 알부민. 데이터는 평균과 표준편차로 표시됩니다. 이 그림은 Urbano et al.17의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
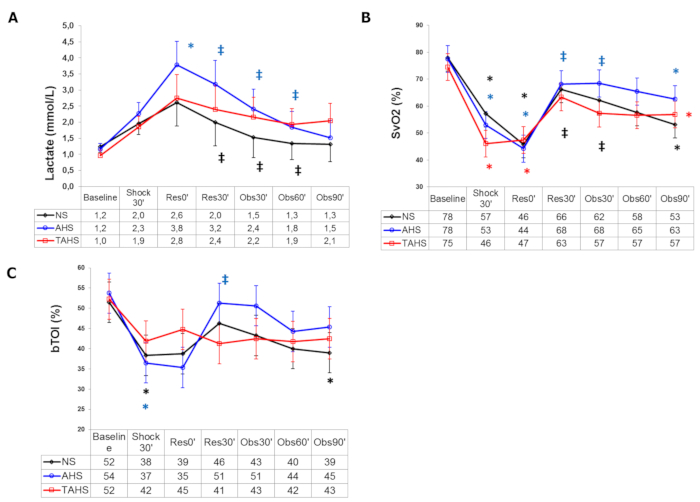
그림 3: 전신 관류 매개변수. (A) 동맥혈 젖산염의 진화, (B) 중심 정맥 혈중 산소 포화도 및 (C) 기준선에서의 뇌 조직 산소화 지수(t0'). 실험 과정 내내: 통제된 출혈의 끝(Shock30'); 주입 시작, 조절된 출혈 종료 후 30분(Res0'); 주입 종료 (Res30'); 주입 종료 후 30분 추적 관찰(Obs30'); 주입 종료 후 60분 추적 관찰(Obs60'); 주입 종료 후 90분 추적 관찰(Obs90'). (*) 기준선, 동일 그룹과의 유의한 차이(p < 0.05). (‡) 출혈로 인한 P < 0.05, 동일 그룹. (#) 그룹 NS에서 p< 0.05입니다. 데이터는 평균과 표준편차로 표시됩니다. 이 그림은 Urbano et al.17의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
어린 돼지에 대한 시술은 복잡할 수 있으며 이러한 동물의 특정 해부학적 및 생리학적 특징으로 인해 잠재적으로 생명을 위협할 수 있습니다. 일관된 결과를 얻고 동물의 손실을 줄이려면 신중하게 고려해야 할 몇 가지 중요한 단계가 있습니다. 첫째, 적절한 수준의 진정을 달성하는 것은 동물의 스트레스 반응을 최소화하는 데 필수적이며, 과도할 경우 내인성 카테콜아민 방출로 인해 결과가 바뀔 수 있습니다. 또한 동물이 빈맥 및 비가역적 대사성 산증을 동반한 심각한 스트레스 반응을 일으켜 실험의 종료를 촉진할 수 있으므로 근육 주사와 삽관 사이의 지연을 피하는 것이 중요합니다. 다른 그룹에서는 흡입 마취제를 사용하여 좋은 결과를 얻지만20,21, 흡입 진정제는 간접 열량계로 호흡 가스 교환을 측정할 수 없기 때문에 정맥 주사 약물을 선호합니다. 경험상 프로포폴과 펜타닐의 조합은 효과적이며 부작용은 거의 없습니다. 급격한 온도 변화는 충격에 대한 동물의 혈류역학적 반응에 상당한 영향을 미쳐 결과를 왜곡하거나 궁극적으로 실험 실패로 이어질 수 있기 때문에 실험 전반에 걸쳐 신중한 온도 관리는 프로토콜의 또 다른 핵심 측면입니다.
기구의 또 다른 중요한 부분은 돼지 해부학의 특수성과 후두 경련에 대한 민감성을 감안할 때 삽관입니다. 그러므로, 시술은 이전 경험이 있는 적어도 한 명의 시술자에 의해 수행되어야 하며, 탐침과 근육 이완의 사용이 바람직하다10,22. 혈관의 카테터 삽입은 동물의 크기가 작기 때문에 어려울 수 있습니다. 대퇴골 접근의 경우, 초음파 유도 천자가 바람직한데, 이는 혈관이 깊숙이 위치하고, 일반적으로 직경이 작으며, 상이한 코스와 위치를 보여주기 때문이다22. 자궁 경부 접근을 위해 경동맥 흐름 프로브를 배치하기 위해 외과적 접근을 사용하지만 초음파 기술도 가능합니다23,24. 외부 경정맥의 캐뉼레이션은 일반적으로 더 넓은 직경, 표면 위치 및 주변 구조물의 수가 적기 때문에 선호됩니다22. 카테터는 폐색을 방지하기 위해 삽입 직후 식염수로 세척해야 합니다. 우리는 응고 변화를 피하기 위해 헤파린을 사용하지 않습니다. 또한, 초기에는 여분의 체액 투여에 의한 혈역학적 반응의 잠재적 왜곡을 방지하기 위해 포도당 주입을 피했지만, 동물에서 심각한 초기 저혈당증이 발생한다는 것을 발견했습니다. 마지막으로, 오늘날 사용되는 마취 및 덜 침습적인 기술에도 불구하고 기구는 동물에게 상당한 스트레스 반응을 일으키므로 혈액 제거를 시작하기 전에 회복을 위한 충분한 시간을 두는 것이 바람직합니다. 출혈성 쇼크의 유도와 관련하여, 30mL/kg의 제거는 생존율이 높은 유의미한 병태생리학적 반응을 생성하므로 제거하는 것이 좋습니다. 우리의 경험에 비추어 볼 때, 어린 돼지는 더 많은 양의 출혈을 견디지 못하며 폐사율이 높습니다. 혈액을 점진적으로 빼내는 것도 중요한데, 혈액을 빨리 빼면 심각한 혈역학적 불안정과 동물의 조기 폐사를 초래할 수 있기 때문입니다.
연구자들이 이용할 수 있는 다양한 종과 실험 모델이 있지만, 동물 출혈성 쇼크의 이상적인 모델(단순하고 쉽게 재현 가능하며 임상 상황을 정확하게 복제하는 것)은 여전히 어려운 과제입니다. 주로 생쥐와 쥐와 같은 작은 동물 모델은 쇼크의 병태생리학적 메커니즘을 조사하는 데 사용됩니다. 그러나 크기가 작기 때문에 수술 및 샘플링 절차의 수행이 상당히 복잡합니다. 개나 돼지와 같은 대형 동물은 취급하기가 더 비싸고 복잡하지만, 크기와 인간과의 생리학적 유사성으로 인해 치료 전략의 전임상 평가에 더 적합합니다. 그러나 과거에도 그랬고 지금도 여전히 개를 사용하는 것은 윤리적으로 의심스럽다. 그들은 실험 동물 모델로서 돼지보다 어떤 이점도 제공하지 않으며, 그들의 지능과 인간과 개 사이의 특별한 양자 관계는 계통 발생 척도 6,7,8에서 더 높은 위치에 그들을 배치합니다.
이 모든 것을 고려할 때, 성체 돼지는 성인 인간의 생리학, 크기 및 해부학과의 유사성으로 인해 심혈관 연구에 광범위하게 사용되어 왔으며 이는 대부분의 종보다 우수합니다. 그러나 문헌에서 잘 확립된 바와 같이, 심혈관계, 혈액량, 체온 조절 및 충격에 대한 반응 측면에서 성인 환자와 소아 환자 사이에는 상당한 차이가 있다 2,3,4. 동시에 이러한 차이가 돼지에게도 적용된다는 증거가 있으며, 새끼 돼지는 심혈관, 뇌혈관, 혈액 및 전해질 프로파일이 소아 인간 환자와 매우 유사한 것으로 밝혀졌습니다 9,25. 마지막으로, 두 종의 성인과 유아 간의 해부학적 및 생리학적 차이 외에도 유아 동물 모델, 특히 미니피그를 사용하면 모니터링을 위해 실제 임상 환경에서 사용되는 것과 동일한 장치를 테스트할 수 있습니다. 많은 경우 이러한 장치의 신뢰성은 성인용 알고리즘, 센서 또는 저울의 간단한 적응으로 인해 낮은 것으로 입증되었습니다. 이러한 모든 측면은 특정 소아 동물 모델 개발의 중요성과 소아 임상 환경에 대한 중개 유용성 측면에서 관련성을 뒷받침합니다.
동물의 종류 외에도 출혈성 쇼크 연구에 일반적으로 사용되는 세 가지 기본 모델이 있습니다 : 조절 된 출혈 (부피 또는 압력에 의한 출혈)과 통제되지 않은 출혈. 이 기사에 제시된 프로토콜은 일반적으로 체중의 백분율로 계산되는 고정된 혈액량이 관찰자가 설정한 기간 동안 제거되는 고정된 부피 출혈 모델을 설명합니다. 반대로, 고정 압력 출혈 모델에서 동물은 미리 결정된 MAP에 따라 출혈된 다음 동물 종과 쇼크의 정도 또는 결과에 따라 지정된 기간 동안 주기적인 출혈 또는 수액 주입으로 유지됩니다. 고정 부피 및 고정 압력 출혈성 쇼크 모델 모두 통제된 조건에서 쇼크로 인한 병태생리학적 변화를 연구할 수 있어 재현성 및 표준화 측면에서 분명한 이점을 제공합니다. 그러나 주요 한계는 혈전 형성 억제 및 평균 혈압 상승으로 인해 출혈을 외과적으로 조절하기 전에 적극적인 수액 소생술이 출혈을 증가시키고 생존율을 감소시키는 것으로 알려진 활동성 출혈에 대한 다양한 소생 전략의 효과에 대한 연구를 허용하지 않는다는 것입니다. 표준화된 혈관 외상(간 및 비장의 압착/열상, 동맥 손상 또는 부속기 절단)에 의해 유발된 조절되지 않는 출혈 모델은 임상 상황을 더 잘 반영하여 다양한 유체 소생술 전략 및 저체온증 및 지혈 제품과 같은 기타 중재의 효과를 더 잘 이해할 수 있도록 제안되었습니다. 그러나 임상적으로 가장 관련성이 높음에도 불구하고 이러한 통제되지 않은 출혈 모델은 표준화 및 재현성 측면에서 몇 가지 분명한 단점을 발휘합니다. 이 모든 것을 고려할 때, 이상적인 모델은 존재하지 않는 것으로 보이며, 따라서 이 분야의 연구는 임상적 관련성과 실험 표준화 및 신뢰성의 균형을 맞춰야 한다 6,7,8,9,26.
이 연구에서 기술된 모델은 다양한 혈류역학적 모니터링 시스템의 검증뿐만 아니라 쇼크 시 내피 기능 장애 및 미세 순환 변화(18)의 조사와 같은 심혈관 연구에서 광범위한 잠재적 응용 프로그램을 제공할 수 있습니다. 또한 다른 연구 분야에서도 사용할 수 있어 심각한 출혈 후 내분비 또는 면역 반응을 연구하고 다양한 체액 및 승압제의 부작용을 결정할 수 있습니다. 그러나, 다양한 소생술 전략에 대한 연구와 관련하여, 임상 환경에서 변화를 시행하기 전에 조절되지 않는 출혈 모델에서의 효과를 연구하는 것이 바람직하다 7,26.
결과를 실생활로 외삽하기 어렵다는 점 외에도 이 모델에는 다른 한계가 있습니다. 우선, 마취제 사용 또는 기계적 환기와 같은 실험 설정과 관련된 몇 가지 혼란스러운 변수가 있어 쇼크 중 생리적 반응을 약화시키고 결과 해석을 복잡하게 만들 수 있습니다. 또한, 동물에 대한 기기 응력 반응 및 온도 제어는 다양한 메커니즘을 통해 거시 및 미세 순환에 영향을 미칠 수 있습니다. 실험적 필요성 및 자원의 가용성과 관련된 이 모델의 또 다른 중요한 한계는 외상 후 관찰 기간이 제한되어 출혈성 쇼크의 장기적인 결과에 대한 연구를 더욱 제한한다는 것입니다. 또한 인간과 돼지의 생리학적 유사성에도 불구하고 종 간에는 고려해야 할 몇 가지 차이점이 있습니다. 예를 들어, 응고 시스템은 돼지27,28에서 더 효과적인 것으로 보인다. 또한, 젖산염과 숙신산염 혈장 수치는 종마다 다르며, 돼지는 기저 알칼리증을 앓고 있어 출혈이 산-염기 균형에 미치는 영향을 과소평가할 수 있다29. 마지막으로, 염증 반응과 면역 반응, 그리고 일부 승압제 수용체가 돼지에서 다르다는 것도 잘 알려져 있다9. 특정 동물의 차이도 영향 요인으로 고려되어야 합니다. 여러 연구에서 쇼크에 대한 감수성 측면에서 성별 차이가 나타났으며, 여성이 남성보다 생존율이 현저히 높은 것으로 나타났습니다 6,9. 그럼에도 불구하고 이 연구에서 수행된 실험에서는 종에 내재된 잠재적 변동성을 최소화하기 위해 동일한 연령대의 동물과 유사한 유전적 배경을 가진 동물을 사용합니다.
결론적으로, 이 기사는 소아 출혈성 쇼크의 돼지 모델을 설정하기 위한 실용적이고 단계적인 가이드를 제공합니다. 다른 기존 모델과 비교할 때 이 프로토콜은 중증 출혈 후 병태생리학적 반응 조사 또는 다양한 소생 전략 평가를 위해 생물의학 연구에 광범위하게 적용할 수 있는 신뢰할 수 있고 따르기 쉬운 프로토콜입니다.
공개
이 저작물의 저자는 이해 상충이 없습니다.
감사의 말
이 연구는 "PI20/01706" 프로젝트를 통해 ISCIII(Instituto de Salud Carlos III)의 자금 지원을 받았으며 유럽 연합이 공동 설립했습니다. 연구비 지원자들은 연구 설계, 자료 수집 및 분석, 출판 결정, 원고 준비에 아무런 역할도 하지 않았다. 그레고리오 마라뇽 소아 집중 치료실과 그레고리오 마라뇽 실험 연구소의 모든 동료들의 노고가 없었다면 이 프로젝트는 불가능했을 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| ADA swabs | Albino Dias de Andrade, S.A. | 300575750400 | Non-woven swabs |
| Alaris SE | Carefusion | N/A | Volumetric infusion pump |
| Atracurium | Aspen Pharma Trading Limited. Dublin, Ireland | N/A | Muscle relaxant |
| Atropine 1 mg/mL | B. Braun | 481377/1013 | |
| Barrier adhesive aperture drape | Mölnlycke | 63621 | |
| BD emerald syringe 5 mL, 10 mL, 20 mL | Becton Dickinson S.A | https://www.bd.com/en-eu/offerings/capabilities/syringes-and-needles/injection-syringes/bd-emerald-3-piece-syringe | various options available |
| BLF21A laser doppler monitor | Transonic Systems Inc. | BLF21A | Skin blood flow monitor |
| BlueSensor NF ECG electrodes | Ambu | NF-50-A/12 | |
| Check-Flo performer introducer set 5Fr | Cook Medical | G12018 | Vascular Sheath |
| Datex ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | M1162897 | Hemodynamic monitor |
| Fentanyl 0.05 mg/mL | Kern Pharma | N/A | Anesthesia |
| GE Vivid S5 | GE Healthcare | S series | Ultrasound machine |
| Introcan Safety 18 G, 22 G, 24 G | B. Braun | Introcan series | Safety intravenous catheter |
| INVOS cerebral/somatic oximetry adult sensors | Medtronic PLC, USA | https://www.medtronic.com/covidien/en-us/products/cerebral-somatic-oximetry/invos-cerebral-somatic-oximetry-adult-sensors.html | |
| INVOS OXIMETER cerebral/somatic | Somanetics | 08-10566 | Regional oxygenation monitor |
| Ketamin 50 mg/mL | Pfizer, S.L. | 47034 | Sedation |
| Leon plus | Heinen + Löwenstein | N/A | Ventilator |
| Life scope VS | Nihon Kohden | N/A | Bedside monitor |
| Miller laryngoscope blade 12″ | Jorgensen Labs, USA | J0449F | Laryngoscope |
| Multi-lumen central venous catheterization set 7 French, 3 lumen, 30 cm | Arrow | CS-14703 | Central venous catheter |
| Nellcor WarmTouch 5300A | Covidien | Thermal blancket | |
| Nitrile gloves | Medihands | KS-ST RT021 | Single use gloves |
| Pediatric SomaSensor INVOS cerebral/somatic | Covidien | https://www.medtronic.com/covidien/en-us/products/cerebral-somatic-oximetry.html | Disposable regional oxygen saturation sensor |
| PICCO monitoring kit | Pulsion Medical Systems | PV8215 | |
| PICCO thermodilution catheter 5F/20 cm | Pulsion Medical Systems | N/A | |
| Propofol Lipoven 10 mg/mL | Fresenius Kabi, Spain | N/A | Anesthesia |
| Pulse contour cardiac output (PiCCO2) | Pulsion Medical Systems | N/A | Hemodynamic monitor |
| Rüsch flexislip | Teleflex Medical | 503700 | Endotracheal tube stylet |
| Softa swabs | B. Braun | 19579 | Alcohol pads |
| Surgical silk sutures USP 0 | Aragó, Barcelona, Spain. | 6245 | |
| TruWave pressure monitoring set | Edwards | T001767A | Pressure monitoring set |
| Ultrasound transmission gel | Ultragel Hungary 2000 Kft. | UC260 |
참고문헌
- Disease Control and Prevention (CDC). Vital signs: Unintentional injury deaths among persons aged 0-19 years-United States, 2000-2009. MMWR. Morbidity and Mortality Weekly Report. 61, 270-276 (2012).
- Russell, R. T., et al. Pediatric traumatic hemorrhagic shock consensus conference recommendations. The Journal of Trauma and Acute Care Surgery. 94, S2-S10 (2023).
- Leonard, J. C., et al. Life-threatening bleeding in children: A prospective observational study. Critical Care Medicine. 49 (11), 1943-1954 (2021).
- Cannon, J. W. Hemorrhagic shock. The New England Journal of Medicine. 378 (4), 370-379 (2018).
- Dehmer, J. J., Adamson, W. T. Massive transfusion and blood product use in the pediatric trauma patient. Seminars in Pediatric Surgery. 19 (4), 286-291 (2010).
- Fülöp, A., Turóczi, Z., Garbaisz, D., Harsányi, L., Szijártó, A. Experimental models of hemorrhagic shock: a review. European Surgical Research. 50 (2), 57-70 (2013).
- Moochhala, S., Wu, J., Lu, J. Hemorrhagic shock: an overview of animal models. Frontiers in Bioscience. 14 (12), 4631-4639 (2009).
- Lomas-Niera, J. L., Perl, M., Chung, C. S., Ayala, A. Shock and hemorrhage: an overview of animal models. Shock. 24, 33-39 (2005).
- Hildebrand, F., Andruszkow, H., Huber-Lang, M., Pape, H. C., van Griensven, M. Combined hemorrhage/trauma models in pigs-current state and future perspectives. Shock. 40 (4), 247-273 (2013).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Leibowitz, A., Oren-Grinberg, A., Matyal, R. Ultrasound guidance for central venous access: Current evidence and clinical recommendations. Journal of Intensive Care Medicine. 35 (3), 303-321 (2020).
- Lockwood, J., Desai, N. Central venous access. British Journal of Hospital Medicine. 80 (8), C114-C119 (2019).
- Operator's Manual PiCCO2. Version 3.1. Pulsion Medical Systems Available from: https://www.manualslib.com/manual/2821743/Pulsion-Picco2.html#manual (2013)
- Acker, S. N., Ross, J. T., Partrick, D. A., Tong, S., Bensard, D. D. Pediatric specific shock index accurately identifies severely injured children. Journal of Pediatric Surgery. 50 (2), 331-334 (2015).
- Urbano, J., et al. Comparison of normal saline, hypertonic saline and hypertonic saline colloid resuscitation fluids in an infant animal model of hypovolemic shock. Resuscitation. 83 (9), 1159-1165 (2012).
- Urbano, J., et al. Comparison of normal saline, hypertonic saline albumin and terlipressin plus hypertonic saline albumin in an infant animal model of hypovolemic shock. PLoS One. 10 (3), e0121678 (2015).
- González, R., et al. Microcirculatory alterations during haemorrhagic shock and after resuscitation in a paediatric animal model. Injury. 47 (2), 335-341 (2016).
- López-Herce, J., Rupérez, M., Sánchez, C., García, C., García, E. Haemodynamic response to acute hypovolaemia, rapid blood volume expansion and adrenaline administration in an infant animal model. Resuscitation. 68 (2), 259-265 (2006).
- Gil-Anton, J., et al. Addition of terlipressin to initial volume resuscitation in a pediatric model of hemorrhagic shock improves hemodynamics and cerebral perfusion. PLoS One. 15 (7), e0235084 (2020).
- Williams, A. M., et al. Complete and partial aortic occlusion for the treatment of hemorrhagic shock in swine. Journal of Visualized Experiments. (138), e58284 (2018).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment, and heart disease research. Lab Animal. 51 (2), 46-67 (2022).
- Chiesa, O. A., et al. Minimally invasive ultrasound-guided technique for central venous catheterization via the external jugular vein in pigs. American Journal of Veterinary Research. 82 (9), 760-769 (2021).
- Anderson, J. H., et al. Ultrasound guided percutaneous common carotid artery access in piglets for intracoronary stem cell infusion. Laboratory Animals. 52 (1), 88-92 (2018).
- Hughes, H. C. Swine in cardiovascular research. Laboratory Animal Science. 36 (4), 348-350 (1986).
- Mayer, A. R., et al. A systematic review of large animal models of combined traumatic brain injury and hemorrhagic shock. Neuroscience and Biobehavioral Reviews. 104, 160-177 (2019).
- Velik-Salchner, C., et al. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood. Thrombosis Research. 117 (5), 597-602 (2006).
- Siller-Matula, J. M., Plasenzotti, R., Spiel, A., Quehenberger, P., Jilma, B. Interspecies differences in coagulation profile. Thrombosis and Haemostasis. 100 (3), 397-404 (2008).
- Reisz, J. A., et al. All animals are equal but some animals are more equal than others: Plasma lactate and succinate in hemorrhagic shock-A comparison in rodents, swine, nonhuman primates, and injured patients. The Journal of Trauma and Acute Care Surgery. 84 (3), 537-541 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유