Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Entretien en captivité et extraction du venin de Tityus serrulatus (scorpion jaune du Brésil) pour la production d’antivenin
Dans cet article
Résumé
Nous présentons ici des protocoles d’entretien et d’extraction du venin réussis pour l’élevage à grande échelle de Tityus serrulatus Lutz et Mello, 1922 (scorpion jaune brésilien), dans le but de fournir du venin pour la production ultérieure d’antivenin de scorpion afin de répondre à la demande du système de santé brésilien.
Résumé
L’envenimation du scorpion est un problème de santé publique dans plusieurs pays tropicaux et subtropicaux. Tityus serrulatus Lutz et Mello, 1922 (scorpion jaune brésilien) sont responsables d’environ 150 000 cas d’envenimation par an au Brésil, dont 10 % nécessitent un traitement antivenimeux pour inverser les effets du venin potentiellement mortels. Par conséquent, des milliers d’individus de T. serrulatus sont maintenus dans des conditions de captivité contrôlées pour l’extraction du venin, qui est ensuite utilisé dans la production de l’approvisionnement national en sérum antivenimeux de scorpion. L’Instituto Butantan est le principal laboratoire de fabrication de sérum antivenimeux au Brésil, fournissant environ 70 000 flacons d’antivenin de scorpion au système de santé brésilien. Ainsi, les protocoles d’élevage et les méthodologies d’extraction du venin sont des points clés pour le succès de la production de venin standardisée à grande échelle. L’objectif de cet article est de décrire les protocoles de captivité de l’élevage de T. serrulatus , englobant la routine d’élevage et les procédures d’extraction du venin, en suivant les bonnes pratiques de fabrication et en assurant le bien-être des animaux. Ces pratiques permettent de maintenir jusqu’à 20 000 animaux en captivité, avec une routine de 3 000 à 5 000 scorpions traits par mois selon la demande de fabrication de sérum antivenimeux, atteignant une moyenne de 90 % d’extraction positive.
Introduction
Les scorpions sont des arthropodes appartenant à la classe des Arachnides, ordre des Scorpiones, qui comprend environ 2 621 espèces 1,2. Ces animaux ont une large aire de répartition géographique et sont présents sur tous les continents à l’exception de l’Antarctique1. L’envenimation causée par les scorpions entraîne la morbidité ou la mort de milliers de personnes chaque année dans le monde3. En 2019, on estimait qu’il y avait plus de 1,2 million d’accidents et 3 500 décès annuels causés par ces animaux. Au Brésil, le nombre de cas augmente de façon exponentielle, atteignant plus de 100 000 cas par an depuis 2017 4,5,6. L’urbanisation incontrôlée observée au Brésil au cours des dernières décennies, sans traitement adéquat des eaux usées et sans collecte et élimination régulières des ordures, associée à la dégradation de l’environnement et aux changements climatiques, a créé les conditions propices à la prolifération de scorpions envahissants, tels que T. serrulatus, augmentant le contact avec les humains et entraînant ainsi des accidents dangereux 4,7,8. Il existe environ 178 espèces de scorpions au Brésil, mais les piqûres d’importance médicale sont causées par le genre Tityus, quatre espèces (T. serrulatus, T. bahiensis, T. stigmurus et T. obscurus) étant préoccupantes sur le plan médical, Tityus serrulatus étant responsable des cas les plus graves et des décès 7,9.
L’Instituto Butantan est le principal laboratoire de fabrication de sérum antivenimeux au Brésil, fournissant environ 70 000 flacons d’antivenin de scorpion au système de santé brésilien. En bref, les étapes impliquées dans la fabrication d’un sérum antivenimeux comprennent l’inoculation d’antigènes dérivés du venin chez les équidés, la collecte et la purification du plasma d’anticorps riches, ce qui donne des flacons de 5 ml d’antivenin de scorpion. Chaque flacon est capable de neutraliser, au moins, 1 mg de venin de scorpion par mL de sérum antivenimeux. Le Bioterium des arthropodes fait partie intégrante du centre industriel, responsable de l’approvisionnement en matière première de l’antivenin du scorpion.
Le Bioterium des Arthropodes de l’Instituto Butantan s’appelait à l’origine le Laboratoire des Arthropodes et a été créé en 1967. Cependant, ce n’est qu’en 1995 que le Laboratoire a déménagé dans une installation exclusive dédiée à l’hébergement d’arthropodes venimeux10,11. À cette époque, les scorpions étaient gardés dans une pièce de 12m2 sans température contrôlée et répartis dans environ 13 enclos, chacun abritant un maximum de 300 animaux10. En raison de la demande croissante de venin au fil des ans et de la nécessité conséquente d’augmenter le nombre d’animaux, ainsi que de l’amélioration du processus d’extraction du venin, un changement majeur s’est produit en 2016. Le laboratoire a été intégré dans le centre industriel de l’Instituto Butantan et a été rebaptisé Arthropodes Bioterium. De plus, en 2016, le Bioterium a déménagé dans de nouvelles installations construites à cet effet. La nouvelle salle des scorpions couvre une superficie de 24m2 et contient environ 48 enclos en polypropylène, chacun pouvant accueillir jusqu’à 300 animaux, comme le montre la figure 1. Il en résulte un total de 10 000 à 20 000 individus maintenus dans des conditions de captivité contrôlées, avec des variations tout au long de l’année. Les scorpions sont soigneusement gérés selon des protocoles d’élevage stricts pour assurer leur bien-être tout en répondant aux exigences élevées de production et en adhérant aux bonnes pratiques et aux normes éthiques en matière de soins aux animaux. Pour l’extraction du venin, une pièce spécifique a été conçue et construite, abritant deux armoires de circulation d’air, comme le montre la figure 2A. Ces armoires servent de mesures de sécurité pour empêcher les techniciens d’inhaler des particules de venin pendant la procédure d’extraction. Les équipements de protection individuelle (EPI) sont obligatoires pour les techniciens, notamment les tabliers synthétiques et les masques FFP2, afin d’éviter toute contamination et d’assurer leur sécurité.

Figure 1 : Vue générale de la chambre des scorpions du Bioterium des Arthropodes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Zone de travail. (A) Vue générale de la salle d’extraction du venin du Bioterium des Arthropodes. (B) Surface de travail de l’armoire à circulation d’air. Tout le matériel et l’équipement sont préparés et disposés sur le dessus de la surface de travail de l’armoire à circulation d’air. La flèche noire indique l’électrostimulateur et la flèche rouge indique la pince. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Environ 90 % des scorpions T. serrulatus du Bioterium des arthropodes proviennent de différents sites, collectés par les agents de santé municipaux dans le cadre d’un programme de surveillance et de contrôle de ces animaux. Les scorpions sont capturés dans les zones urbaines, puis envoyés à l’Instituto Butantan dans le cadre d’un programme collaboratif. Les scorpions T. serrulatus sont parthénogénétiques, c’est-à-dire que la naissance se produit à la suite du développement de la progéniture à partir d’œufs non fécondés, sans la présence d’un individu du sexe opposé12. En raison de ce type de reproduction, certains animaux naissent en captivité dans notre établissement et sont maintenus jusqu’à ce qu’ils atteignent la phase adulte, en suivant un protocole d’élevage similaire à celui décrit ci-dessous. Une fois qu’ils atteignent le stade adulte, ils sont ajoutés à la routine d’extraction du venin. À leur arrivée, les scorpions font l’objet d’un premier dépistage, et ceux qui sont en bonne santé sont gardés dans des enclos collectifs contenant un maximum de 350 individus, répartis en fonction de leur origine. Pour chaque enclos, un formulaire de contrôle est rempli quotidiennement, fournissant des données sur la date d’alimentation et le type de proie offerte (grillon ou cafard), l’approvisionnement en eau, les procédures de nettoyage, le nombre d’animaux morts et le nombre d’animaux vivants restants à l’intérieur de l’enclos.
Dans un programme préprogrammé, les animaux sont soumis à une stimulation électrique, et le venin résultant de centaines d’individus est ensuite lyophilisé, ce qui donne des lots de venin lyophilisé. Le venin standardisé obtenu à partir de ce procédé est destiné à l’immunisation des chevaux dans le cadre du processus de fabrication, ainsi qu’à fournir un matériau de référence pour le contrôle de la qualité de la substance active et du produit final.
Il existe très peu d’installations dans le monde capables de garder un si grand nombre de scorpions et d’effectuer le volume d’extractions de venin conformément aux bonnes pratiques de fabrication et à l’utilisation éthique des animaux, comme cela se fait dans le Bioterium des Arthropodes de l’Instituto Butantan. Par conséquent, notre objectif est de décrire les protocoles d’entretien des scorpions et les procédures d’extraction du venin utilisés dans l’élevage de T. serrulatus , qui fournissent avec succès la quantité de venin nécessaire à la production d’un sérum antivenimeux pour le scorpion.
Protocole
Les protocoles impliquant des animaux invertébrés sont exemptés de l’approbation du Comité sur l’utilisation et le soin des animaux de l’Instituto Butantan. Cependant, l’entretien des scorpions décrit ici suit des paramètres éthiques, et le bien-être animal est respecté en fonction des besoins de l’espèce.
1. Logement
- Conservez les scorpions dans des conteneurs communs en polypropylène comme enclos (hauteur 35 cm, largeur 35,5 cm, longueur 72 cm) contenant un maximum de 350 animaux.
- Maintenez la pièce où se trouvent les enclos des animaux à une température contrôlée de 24 °C (±0,5 °C) dans un cycle d’éclairage de 10 h avec les lumières allumées et de 14 h avec les lumières éteintes.
- Tapisser le fond de l’enclos de chaque contenant de papier kraft fixé avec du ruban de masquage sur les bords de tous les côtés afin que les animaux ne puissent pas passer sous le papier (figure 3A).
- Utiliser quatre plateaux en carton (plateaux à œufs) comme substrats verticaux, empilés sur un côté du contenant, avec une feuille de carton rigide placée entre chaque plateau (figure 3B,C).
- Placez un plateau en polypropylène peu profond (bac à eau) sur le côté opposé de l’enclos, contenant du coton imbibé comme source d’eau pour les animaux (figure 3B).
- Gardez les récipients sans couvercle pour augmenter le flux d’air. Placez une bande d’environ 10 cm de ruban adhésif en plastique sur le dessus de la surface interne de l’enclos et sur les coins supérieurs pour rendre les parois suffisamment lisses pour empêcher les animaux de s’échapper du conteneur (figure 3A).

Figure 3 : Préparation du boîtier et de l’enceinte. (A) Les flèches indiquent le papier kraft sur le fond, fixé avec du ruban adhésif sur les bords. Les lignes pointillées indiquent le ruban plastique autocollant placé sur le dessus de la surface interne du boîtier. (B) Substrat vertical (plateaux d’œufs empilés d’un côté du récipient) et plateau en polypropylène peu profond (bac à eau) placé du côté opposé. (C) Détail du substrat vertical : plateaux d’oeufs boulochés avec une feuille de carton rigide entre deux plateaux. (D) Feuilles de carton et plateaux à œufs disposés en couches, simulant l’habitat naturel sombre et humide de T. serrulatus. (E) Animaux logés dans le substrat. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Routine d’hygiène
REMARQUE : La routine d’hygiène est divisée en deux procédures d’entretien : l’entretien complet et l’entretien partiel. La première est effectuée 2 jours après l’alimentation des animaux ou lorsque l’enclos est sélectionné pour l’extraction du venin. L’entretien partiel est effectué lorsque les animaux ne sont pas nourris.
- Entretien complet
- Préparez un enclos propre avec un nouveau substrat (plateaux à œufs, carton et papier kraft) et un bac à eau propre, comme décrit à la section 1.
- À l’aide d’une longue pince, retirez le bac à eau de l’enceinte. S’il y a des scorpions sur le bac à eau, retirez-les et placez-les dans l’enceinte propre.
- Répétez la même procédure décrite à l’étape 2.1.2 avec tous les plateaux à œufs et les feuilles de carton, en retirant tous les scorpions et en les plaçant dans l’enclos propre.
- Après avoir retiré les plateaux, retirez tous les scorpions laissés sur le sol de l’enclos et placez-les dans l’enclos propre. Assurez-vous de tenir compte de toutes les carcasses et de les jeter correctement. Ramassez toutes les proies vivantes restantes (insectes) et retirez-les de l’enclos.
- Retirez tous les substrats jetables de l’enceinte (plateaux à œufs, feuille de carton et papier kraft) et jetez-les correctement. Envoyez les articles réutilisables (bac à eau et récipient en polypropylène) pour l’assainissement.
REMARQUE : L’assainissement des articles réutilisables est effectué avec de l’hypochlorite à 0,5% combiné à un détergent neutre. Il est obligatoire que les matériaux soient soigneusement et abondamment rincés à l’eau courante après l’utilisation de tout produit ou solution d’assainissement.
- Entretien partiel
NOTE : L’entretien partiel consiste à inspecter tous les substrats (plateaux à œufs et papier kraft) dans le but d’enlever les carcasses de scorpions morts et autres débris indésirables, mais sans jeter les substrats ni changer l’enclos.- Effectuez l’inspection à l’aide d’une longue pince pour soulever doucement chaque plateau à œufs et retirer les déchets.
- Si nécessaire, remplacez un ou plusieurs plateaux à œufs par un plateau propre.
- Remplacez complètement le bac à eau par un bac propre à l’aide d’une longue pince. Transférez les scorpions sur le bac à eau dans le bac à œufs dans une autre partie de l’enclos.
3. Alimentation
- Nourrissez les animaux tous les 15 jours selon le calendrier d’extraction du venin. Nourrissez les animaux qui seront traits 7 jours avant et 7 jours après l’extraction du venin.
- Pour l’alimentation, fournissez des cafards (Phoetalia pallida) et des grillons (Gryllus sp.) en alternance.
- Calculer la quantité de nourriture en fonction de l’apport énergétique des animaux ; Offrez 1 proie pour 3 ou 5 scorpions dans l’enclos.
- Comptez la quantité calculée de proies et placez-les vivantes à l’intérieur de l’enclos, en les laissant pendant 2 jours avant l’entretien complet (section 2.1).
- Lorsque vous offrez des cafards, appliquez un carbonate de calcium avec une solution d’alcool autour du haut des enclos. La solution fait que les cafards glissent et ne peuvent pas grimper sur la surface latérale de l’enclos, empêchant ainsi les insectes de s’échapper.
4. Extraction du venin
REMARQUE : Les animaux utilisés dans la routine d’extraction du venin sont des adultes ou des pré-adultes. En raison de la difficulté de déterminer la maturité sexuelle complète du scorpion jaune brésilien (phase adulte), il a été déterminé que les animaux d’une longueur totale de 5 à 7 cm sont éligibles à la procédure.
- Traitez chaque animal tous les 2-3 mois.
- Le jour de l’extraction du venin, comptez tous les animaux vivants dans l’enclos et transférez-les dans un récipient en verre à l’aide d’une longue pince (figure 4).
- Préparez et disposez tout le matériel et l’équipement à utiliser sur le dessus de la surface de travail de l’armoire à circulation d’air. Branchez le cordon d’alimentation de l’électrostimulateur dans la prise et mettez l’électrostimulateur et l’armoire de circulation d’air sous tension (Figure 2B).
- Utilisez les paramètres suivants de l’électrostimulateur : potentiel (différence de potentiel entre les électrodes) : 540 mV, contrainte (durée de l’impulsion électrique) : 2 ms, action (intermittence pour modérer la puissance utilisée, ce qui réduirait l’échauffement du tissu organique telson) : 70 %, cycle (ajuster la répétition cyclique) : 1 s, et intensité (courant électrique qui circule dans le muscle de l’animal) : 0,75 mA.
- Immobilisez manuellement chaque animal de manière à ce que le telson reste immobile, en suivant les étapes suivantes :
- Tenir le metassoma de l’animal à l’aide d’une pince droite (figure 5A).
- Immobiliser le telson à l’aide d’une pince courbe (figure 5B).
- Attachez le telson avec la main (Figure 5C,D).
- Après la contention, placez le telson en contact direct avec le conducteur de l’électrostimulateur, sans qu’il soit nécessaire d’utiliser une solution conductrice. Le choc électrique provoque une contraction musculaire involontaire de la glande à venin et l’éjection conséquente du venin.
- Recueillir les gouttes de venin directement dans un microtube en plastique placé à proximité du conducteur de l’électrostimulateur (Figure 6).
- Ensuite, relâchez l’animal dans le récipient en verre, en suivant les étapes suivantes :
- Transférez le telson de l’animal de la main à la pince incurvée.
- Placez délicatement l’animal sur le fond du récipient en verre.
- Effectuez les étapes 4.4 à 4.7 avec chaque animal dans le récipient en verre.
- Une fois que tous les animaux dans le récipient en verre ont été traits, remettez-les dans l’enclos.
- Conservez le venin collecté à -20 °C jusqu’au processus de lyophilisation.

Figure 4 : Scorpions dans le récipient en verre. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Procédure de contention pour l’extraction du venin. (A) Metassoma retenu à l’aide d’une pince droite (flèche noire). (B) Telson immobilisé à l’aide d’une pince courbe (flèche noire). (C) Transfert du telson retenu de la pince à la main. (D) Telson retenu par la main. Il est recommandé de manipuler les animaux à mains nues car lorsqu’ils utilisent des gants, les scorpions peuvent saisir le matériau avec leurs griffes, ce qui rend difficile leur libération à la fin de la procédure et augmente considérablement le risque d’accidents. Veuillez cliquer ici pour voir une version agrandie de cette figure.
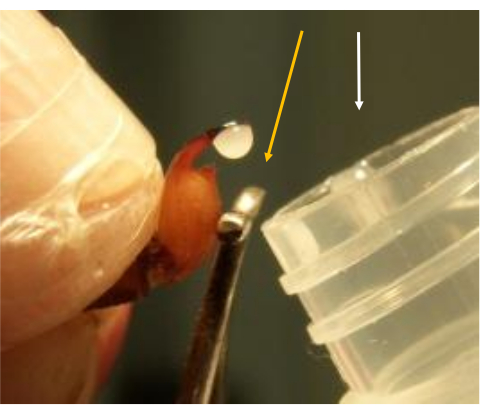
Figure 6 : Extraction du venin. Un microtube en plastique (flèche blanche) placé à proximité de l’électrostimulateur (flèche jaune). Les gouttes de venin sont recueillies directement dans le tube maintenu à température ambiante pendant la procédure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Une trentaine de procédures opérationnelles normalisées (SOP) ont été élaborées pour chaque procédure, garantissant la répétabilité des procédures entre les techniciens et le respect des paramètres de qualité. Le taux de mortalité moyen après la procédure d’extraction est d’environ 12%, ce qui peut être considéré comme faible, compte tenu de la routine d’électrostimulation et de l’environnement de captivité, où les facteurs de stress sont réduits avec succès par l’application des procé...
Discussion
L’application des méthodes décrites nous permet de conserver un grand nombre d’individus de T. serrulatus et nous donne une prévisibilité constante du nombre de scorpions nécessaires à la production annuelle de venin. De cette façon, nous sommes en mesure de fournir suffisamment de lots de venin à l’avance pour alimenter le processus de fabrication du sérum antivenimeux. Dans le même temps, l’élaboration de calendriers préétablis pour l’entretien, l’alimentation et l’extraction du veni...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Aucun
matériels
| Name | Company | Catalog Number | Comments |
| Carboard sheet | NA | NA | |
| Egg tray | NA | NA | cardboard 36 places egg trays |
| Electro stimulator device | Instituto Butantan | ART-FV-01 | Internally designed for the venom extraction |
| Kraft paper | NA | NA | regular kraft paper |
| Making tape | NA | NA | White masking tape (24 mm x 50 m) |
| Polyproplene container | NA | NA | 70 L Polypropylene box (H – 35 cm, W – 35.5 cm, L - 72 cm) |
| Polyproplene tray | NA | NA | Polypropylene tray (H – 3.0 cm, W – 18.5 cm, L - 30 cm) |
| Self-adhesive plastic | NA | NA |
Références
- Polis, G. A. . The biology of scorpions. , (1990).
- Lacerda, A. B., et al. Scorpion envenomation in the state of São Paulo, Brazil: Spatiotemporal analysis of a growing public health concern. PLoS One. 17 (4), 0266138 (2022).
- Reckziegel, G. C., Pinto, V. L. Scorpionism in Brazil in the years 2000 to 2012. Journal of Venomous Animals and Toxins Including Tropical Diseases. 20, 46 (2014).
- Guerra-Duarte, C., et al. Scorpion envenomation in Brazil: Current scenario and perspectives for containing an increasing health problem. PLoS Neglected Tropical Diseases. 17 (2), 0011069 (2023).
- Pimenta, R. J. G., et al. Selected to survive and kill: Tityus serrulatus, the Brazilian yellow scorpion. PLoS One. 14 (4), e0214075 (2019).
- Lacerda, A. B., et al. Detection of areas vulnerable to scorpionism and its association with environmental factors in São Paulo, Brazil. Acta Tropica. 230, 106390 (2022).
- Torrez, P. P. Q., Dourado, F. S., Bertani, R., Cupo, P., França, F. O. d. e. S. Scorpionism in Brazil: exponential growth of accidents and deaths from scorpion stings. Journal of the Brazilian Society of Tropical Medicine. 52, 20180350 (2019).
- Amado, T. F., et al. Vulnerable areas to accidents with scorpions in Brazil. Tropical Medicine & International Health. 26 (5), 13561 (2021).
- Brasil, Ministérioda da Saúde, Fundação Nacional de Saúde. . Manual de diagnóstico e tratamento de acidentes por animais peçonhentos. , (2001).
- Candido, D. M., Lucas, S. Maintenance of scorpions of the genus Tityus Koch (Scorpiones, Buthidae) for venom obtention at Instituto Butantan, São Paulo, Brazil. Journal of Venomous Animals and Toxins including Tropical Diseases. 10 (1), 000100007 (2004).
- Lucas, S. O. Laboratório de Artrópodes do Instituto Butantan e os aracnídeos peçonhentos. História Ciências Saúde Manguinhos. 10 (3), 000300011 (2003).
- Braga-Pereira, G. F., Santos, A. J. Asexual reproduction in a sexual population of the Brazilian yellow scorpion (Tityus serrulatus, Buthidae) as evidence of facultative parthenogenesis. The Journal of Arachnology. 49 (2), (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon