Method Article
Rotation du lambeau auriculaire postérieur du donneur pour la reconstruction du ballonnet auriculaire gauche lors d’une transplantation pulmonaire
Dans cet article
Résumé
Ce protocole décrit une nouvelle méthode pour reconstruire efficacement les défauts de la paroi antérieure du ballonnet auriculaire du donneur lors d’une transplantation pulmonaire grâce à la rotation du lambeau auriculaire postérieur du donneur.
Résumé
Nous décrivons en détail une nouvelle technique chirurgicale pour réparer in vivo l’anomalie de la paroi auriculaire antérieure gauche du donneur en faisant pivoter le lambeau auriculaire postérieur lors d’une transplantation pulmonaire. Cette méthode peut traiter de manière sûre et efficace le type le plus courant d’anomalie du ballon auriculaire gauche du donneur : l’anomalie de la paroi antérieure, avec la paroi postérieure intacte, généralement conservée lorsque le cœur du donneur est également utilisé. Lors de l’anastomose du ballonnet auriculaire lors d’une transplantation pulmonaire, l’excès de paroi auriculaire postérieure du donneur est découpé en un lambeau auriculaire. Une fois l’anastomose de la paroi postérieure terminée, le lambeau auriculaire est tourné à 180° et utilisé comme patch pour l’anastomose de reconstruction de la paroi antérieure.
Après rétablissement du flux sanguin, le débit de la veine pulmonaire est normal et régulier, comme le confirme l’échocardiographie transœsophagienne. Par rapport à la méthode traditionnelle de reconstruction par patch, la nouvelle méthode réduit efficacement le temps d’anastomose du ballonnet auriculaire. Nos résultats n’ont montré aucune différence significative dans l’obstruction de la veine pulmonaire après reconstruction. La pression artérielle systolique de l’artère pulmonaire était significativement plus basse et la fonction pulmonaire s’est améliorée postopératoire dans tous les groupes, sans différences significatives entre les groupes. La nouvelle technique fournit une stratégie réalisable pour la reconstruction des défauts du brassard auriculaire gauche et peut améliorer le taux d’utilisation efficace des poumons du donneur.
Introduction
La transplantation pulmonaire, le seul traitement efficace pour la plupart des maladies pulmonaires en phase terminale, est limitée par une pénurie d’organes de donneurs. Par conséquent, il est nécessaire d’optimiser la procédure de transplantation pour utiliser efficacement les organes du donneur potentiel1. La technique chirurgicale d’extraction du poumon du donneur est un aspect important de cette procédure. Actuellement, il est essentiel de préserver intacte la coiffe auriculaire gauche, qui est couramment utilisée pour l’anastomose de préférence aux veines pulmonaires 2,3. L’anomalie de la coiffe auriculaire gauche est la lésion pulmonaire la plus fréquente chez le donneur, survenant dans 2,7 % des cas lors de la séparation du cœur et des poumons du donneur. La rétention de la paroi auriculaire postérieure gauche chez les receveurs d’une transplantation cardiaque signifie que le tissu de la paroi auriculaire postérieure du donneur est généralement entièrement conservé par le poumon du donneur (Figure 1A), ce qui fait des défauts de la paroi antérieure de la coiffe auriculaire gauche le type le plus courant de lésion de la coiffe auriculaire (Figure 1B), représentant environ 71 % des cas4. En raison du sillon interauriculaire, une anomalie de la paroi auriculaire antérieure se produit plus souvent sur le poumon droit du donneur 5,6.
Cet article présente une nouvelle méthode de reconstruction du brassard auriculaire qui peut résoudre efficacement et en toute sécurité le problème de l’anomalie du ballon auriculaire gauche causé lors de l’acquisition de poumons de donneur, améliorant ainsi le taux d’utilisation des poumons du donneur. L’aspect clé de cette nouvelle méthode est la conservation de la paroi auriculaire postérieure intacte du poumon du donneur. En élaguant l’excès de paroi auriculaire postérieure, elle forme un lambeau auriculaire, et la rotation du lambeau auriculaire fournit un patch pour la réparation de la paroi antérieure défectueuse.
En cas d’anomalies du ballonnet auriculaire, il faut plus de temps pour façonner et reconstruire le ballonnet auriculaire afin de lisser le canal d’écoulement veineux et de prévenir la sténose5. Le type traditionnel de reconstruction par patch est effectué in vitro avant que le poumon du donneur ne soit placé dans le thorax, ce qui augmente le temps d’ischémie froide. La reconstruction du brassard nécessite la disponibilité d’un matériau de patch ; L’excès de tissu péricardique du donneur est le plus couramment utilisé, bien que l’excès de tissu artériel puisse également être utilisé 4,5,6. Quel que soit le type de matériau de patch utilisé, la reconstruction du ballonnet est associée à une durée d’opération accrue et à un risque accru de complications chirurgicales telles que l’obstruction de la voie d’éjection veineuse causée par une anastomose vasculaire non homologue.
La nouvelle méthode peut réparer le défaut de la paroi antérieure in vivo en utilisant l’excès de tissu auriculaire gauche du donneur. L’opération est plus pratique et le temps d’anastomose est efficacement réduit pour réduire le temps d’ischémie froide. Cette méthode, que nous avons nommée reconstruction du brassard auriculaire gauche rotatif par lambeau auriculaire postérieur, offre une stratégie nouvelle et réalisable pour traiter l’anomalie de la paroi auriculaire antérieure qui est le type le plus courant d’anomalies de la coiffe auriculaire du poumon du donneur dans la transplantation pulmonaire.
Protocole
Cette étude a été approuvée par le comité d’éthique de l’hôpital (numéro d’approbation ChiCTR2400085507), et un consentement éclairé écrit a été obtenu de tous les sujets.
1. Préparation préopératoire
- Confirmez les informations de correspondance du donneur et du receveur.
REMARQUE : Dans notre cas, la confirmation a été faite en vérifiant les dossiers du Système national d’intervention en matière de transplantation d’organe. - Retirez les cheveux de la zone chirurgicale et assurez-vous qu’ils ont jeûné pendant plus de 12 heures.
- Transférez le receveur du service à la salle d’opération en attendant l’opération.
- S’assurer que tous les instruments et matériaux nécessaires au protocole sont disponibles (voir le tableau des matériaux).
- Confirmer que les poumons du donneur sont disponibles et qu’ils peuvent être utilisés.
REMARQUE : Tous les indices du poumon du donneur, y compris les indices des voies respiratoires, de la texture et du laboratoire, étaient conformes aux normes, à l’exception du défaut du manchon auriculaire antérieur qui devait être réparé. - Initier les procédures d’anesthésie et d’oxygénation par membrane extracorporelle (ECMO).
2. Anesthésie et ECMO
- Établir l’accès vasculaire.
- Administrer une anesthésie intraveineuse. Induire l’anesthésie en administrant 0,05 à 0,1 mg/kg de midazolam injectable, 0,1 à 0,3 mg/kg d’émulsion injectable d’étomidate, 0,8 mg/kg de bromure de rocuronium injectable et 0,5 à 1 μg/kg de chlorhydrate de rémifentanil injectable par voie intraveineuse. Maintenez l’anesthésie en administrant 5 à 10 mg∙kg-1∙h-1 de Diprivan injectable et 0,5 à 2 μg∙kg-1∙h-1 de chlorhydrate de rémifentanil injectable par voie intraveineuse.
- Insérez l’intubation trachéale à double cavité et ajustez les positions des ouvertures gauche et droite de la sonde trachéale.
- Insérez un cathéter SwanGanz dans la veine jugulaire interne.
- Insérez l’ECMO via la veine fémorale et la veine jugulaire interne.
REMARQUE : En fonction de la pression artérielle pulmonaire et de l’état cardiaque du patient, le chirurgien peut choisir d’autres modes ECMO.
3. Ablation du poumon malade du receveur
- Positionnez le patient horizontalement, le dos légèrement surélevé et les mains écartées horizontalement en position « croisée » et solidement fixées.
- Désinfecter la peau de la zone chirurgicale. Utilisez le désinfectant à l’iodophor 3x de l’intérieur vers l’extérieur. Stérilisez jusqu’au cou, jusqu’à l’ombilic et latéralement jusqu’à la ligne axillaire postérieure.
- Assurez-vous que le poumon controlatéral est ventilé indépendamment et faites une incision de 15 à 20 cm à partir du quatrième espace intercostal de la paroi thoracique antérieure vers le thorax sans traverser le sternum.
REMARQUE : Pour une greffe de deux poumons, sur la base de l’évaluation préopératoire, le poumon avec l’état le plus grave doit être transplanté en premier. Si la gravité est similaire des deux côtés, le poumon droit doit être transplanté en premier. - Exposez la zone d’incision. Sondez le poumon malade et libérez les adhérences thoraciques.
- Relâchez les ligaments pulmonaires inférieurs et libérez l’artère pulmonaire et la veine pulmonaire.
- Bloquez l’extrémité proximale de l’artère pulmonaire droite à l’aide d’une pince de blocage de l’artère pulmonaire. Sectionner les veines pulmonaires supérieures et inférieures à l’aide d’un dispositif de coupe et de fermeture vasculaire. Clampez l’extrémité distale de l’artère pulmonaire et sectionnez l’artère.
- Coupez la bronche principale droite et le tissu conjonctif environnant au niveau de la deuxième branche.
- Retirez le poumon malade et contrôlez complètement le saignement dans la poitrine.
4. Traitement des résidus vasculaires et de la trachée du receveur
- Coupez 1 à 2 anneaux cartilagineux pour exposer la bronche principale droite et coupez-les à plat pour assurer une hémostase complète.
- Taillez le moignon de l’artère pulmonaire du receveur à une distance de 8 à 10 mm de la pince de blocage.
- Libérer les veines pulmonaires supérieures et inférieures du péricarde. Assurez-vous que l’oreillette gauche à la jonction des veines pulmonaires supérieure et inférieure peut être clampée avec une pince auriculaire.
5. Séparation et parage du poumon du donneur
- Divisez la paroi auriculaire postérieure, en vous assurant que l’excès de paroi auriculaire postérieure est inclus du côté où se trouve le défaut de la paroi antérieure.
REMARQUE : En raison de la position du sillon interauriculaire, des défauts de la paroi antérieure se produisent généralement sur le côté droit. L’excès de paroi auriculaire postérieure obtenu du côté droit peut fournir une source pour la réparation de la paroi antérieure courte (Figure 1B). - Sectionner les artères pulmonaires gauche et droite à la jonction des artères pulmonaires gauche et droite.
- Libérez la bronche principale gauche et sectionnez la bronche. Séparez les poumons gauche et droit du donneur.
- Placez le poumon gauche du donneur dans une solution de préservation d’organe à 4 °C. Coupez le poumon du donneur droit. Assurez-vous que la bronche principale a 2-3 anneaux cartilagineux. Libérez complètement l’artère pulmonaire et le brassard auriculaire.
6. Anastomose de la bronche primitive et de l’artère pulmonaire
- Placez le poumon droit du donneur réparé dans le thorax droit.
- Suturez la membrane bronchique avec une ligne PDS 4-0 et le cartilage bronchique avec une ligne poly 4-0. À l’aide d’un bronchoscope, vérifiez que les voies respiratoires sont dégagées et ouvertes une fois l’anastomose bronchique terminée.
- Suturez les tissus mous autour de l’anastomose bronchique avec une ligne poly 4-0 et assurez-vous que l’anastomose des voies respiratoires est couverte.
- Anastomose l’artère pulmonaire avec une suture continue en poly line 5-0.
7. Reconstruction et anastomose de la coiffe auriculaire gauche
- Clampez l’oreillette gauche du receveur à l’extrémité proximale de l’intersection des veines pulmonaires supérieure et inférieure, en veillant à ce que la jonction ait 1 à 2 cm d’espace pour l’anastomose.
- Coupez l’excès de paroi postérieure du brassard auriculaire du donneur de bas en haut en comparant la distance entre le bord auriculaire postérieur du donneur et du receveur. Ne laissez pas l’excès de paroi postérieure se détacher complètement. Coupez l’excès de paroi postérieure pour former un lambeau auriculaire, relié au bord supérieur du brassard auriculaire du donneur par le pédicule (Figure 2A et Figure 3A).
- Anastomose les bords postérieurs des brassards auriculaires de bas en haut à l’aide d’une suture continue 4-0 Prolene (Figure 2B et Figure 3B). Continuez la suture (avec 4-0 Prolene) en atteignant le lambeau auriculaire postérieur pour anastomoser le bord du lambeau auriculaire le plus proche du poumon avec le bord auriculaire antérieur du receveur. Assurez-vous que les extrémités de la suture se rejoignent au bord inférieur de l’anastomose et attachez-les (Figure 2C et Figure 3C).
- Anastomose l’autre bord du lambeau auriculaire et le bord auriculaire antérieur du donneur de haut en bas avec une suture continue à ligne Prolene 4-0, et laisse les deux dernières aiguilles non serrées pour servir de trous d’évacuation (Figure 2D et Figure 3D).
8. Ouverture du flux sanguin
- Aérez et dilatez le poumon transplanté pour ouvrir complètement les alvéoles. Relâchez temporairement la pince bloquant l’artère pulmonaire, permettant au sang de s’écouler par le trou d’échappement de l’anastomose auriculaire. Clampez l’artère pulmonaire avec une pince de blocage, desserrez et retirez la pince auriculaire, puis serrez la suture Prolene de l’anastomose du manchon auriculaire après avoir complètement évacué l’air.
- Relâchez et retirez la pince bloquant l’artère pulmonaire pour permettre une circulation sanguine complète. Vérifiez que la paroi antérieure de l’anastomose est large et bien remplie, sans manifestations de saignement.
9. Fermeture de la poitrine
- Vérifiez à nouveau toutes les anastomoses et la cavité thoracique pour détecter les saignements et les exsudations. Confirmez une hémostase suffisante dans le thorax.
- Rincez la cavité thoracique, placez le tube de drainage, ventilez le poumon transplanté et fermez la poitrine couche par couche à l’aide des sutures de fermeture de la poitrine.
- Exciser le poumon malade controlatéral et anastomose le poumon donneur.
REMARQUE : Le processus d’excision et d’anastomose du poumon controlatéral est le même que celui du poumon droit, et l’anastomose auriculaire gauche controlatérale est courante en raison de la coiffe auriculaire du donneur intacte. - Après une fermeture bilatérale de la poitrine, surveiller et enregistrer le débit des veines pulmonaires bilatérales par échographie œsophagienne.
10. Enregistrement des données et sortie de la salle d’opération
- Adopter une stratégie de ventilation pulmonaire protectrice pour que le poumon transplanté soit entièrement ventilé, par exemple avec des niveaux de pression positive en fin d’expiration (PEP) de 5 à 7 cmH2O et des valeurs de marée (VT) de 5 à 7 mL/kg, tandis que les pics de pression des voies respiratoires < 30 cmH2O ont été surveillés.
- Enregistrer la pression artérielle pulmonaire.
- Insérez la sonde à ultrasons œsophagienne dans la bouche. Surveiller et enregistrer le débit des veines pulmonaires bilatérales.
- Passer à l’intubation trachéale à cavité unique et transférer le patient aux soins intensifs pour un traitement ultérieur.
11. Suivi
- Mesurer la pression artérielle cardiaque et pulmonaire par échographie cardiaque externe 30 jours après la transplantation et analyser régulièrement les gaz du sang artériel. Examinez la fonction pulmonaire et les autres résultats d’analyses biochimiques de routine.
12. Analyse statistique
- Effectuer des analyses statistiques et exprimer les données sous forme de moyenne ± d’écart-type.
- Comparez des groupes à l’aide de l’analyse de variance, du test de Kruskal-Wallis, du test U de Mann-Whitney ou du test de Wilcoxon par paires appariées. Fixer la signification statistique à P < 0,05.
Résultats
Les patients ont été sélectionnés en examinant les dossiers de 931 greffes de poumons effectuées au Centre de transplantation pulmonaire du deuxième hôpital affilié de la faculté de médecine de l’Université du Zhejiang ou au Centre de transplantation pulmonaire de l’Hôpital populaire de Wuxi de 2021 à 2023. Les deux centres avaient le même directeur de chirurgie à la tête de l’équipe opératoire, qui comprenait des médecins et des infirmières chevronnés ayant une vaste expérience. Tous les organes des donneurs ont été attribués équitablement à partir du système COPO selon les principes d’attribution et de notation des organes.
Les principales maladies des receveurs comprenaient la fibrose pulmonaire idiopathique, la maladie pulmonaire interstitielle associée à une maladie du tissu conjonctif, le syndrome de bronchiolite oblitérante et la bronchopneumopathie chronique obstructive. Au total, 71 patients ont eu besoin d’une reconstruction du brassard auriculaire d’un donneur, dont 13 ont reçu une greffe de poumon unique et 58 ont reçu une greffe de double poumon, ce qui représente un taux d’incidence de 6,2 % pour la reconstruction du brassard auriculaire dans la transplantation de deux poumons. Parmi les 58 receveurs d’une double transplantation pulmonaire inclus dans cette étude, 23 ont subi une reconstruction de la coiffe auriculaire par rotation antérieure de la paroi postérieure (la technique privilégiée, groupe 1 : groupe de lambeau auriculaire postérieur) et 35 ont subi une reconstruction par patch traditionnel. En cas de reconstruction de patchs ; Le chirurgien a déterminé le matériau de patch le plus approprié en fonction de l’état du poumon du donneur. L’aorte du donneur a été utilisée chez 20 patients (groupe 2 : groupe du patch aortique) et le péricarde du donneur a été utilisé chez les 15 autres patients (groupe 3 : groupe du patch péricardique) Les caractéristiques de base des donneurs et des receveurs sont résumées dans le tableau 1 ; Aucune différence significative n’a été observée entre les groupes.
Cas de reconstruction du lambeau auriculaire postérieur rotatif gauche
En octobre 2023, un jeune homme de 17 ans (taille, 165 cm ; poids, 50 kg) a été admis à l’hôpital en raison d’une toux avec expectorations persistante depuis 6 mois et aggravée par de l’asthme depuis 3 mois. Six ans avant son admission, la patiente a développé une toux accompagnée de grandes quantités d’expectorations de pus jaune, qui a été diagnostiquée comme une bronchectasie avec infection ; Cependant, le traitement anti-infectieux n’a pas été efficace. Les tests génétiques ont révélé la présence de mucoviscidose pulmonaire. Trois mois avant son admission, le patient a attrapé un rhume et a développé de l’asthme, nécessitant une oxygénothérapie continue. Après le traitement et la sortie, mais avec une oxygénothérapie continue à domicile, l’endurance d’activité du patient a diminué de manière significative et une évaluation complète a identifié des indications pour la transplantation pulmonaire ; Le patient a donc été ajouté à la liste d’attente. Après 46 jours sur la liste d’attente, un donneur compatible a été identifié.
Le donneur était un homme de 20 ans (taille, 170 cm, poids, 60 kg) admis à l’hôpital en novembre 2023 pour un traumatisme crânien dû à un accident de voiture. Le rapport entre la pression partielle d’oxygène dans le sang artériel et la fraction de la concentration d’oxygène dans l’intervalle était de 450 et les résultats de l’imagerie thoracique étaient normaux. Le patient a été déclaré en état de mort cérébrale le cinquième jour après son admission. Les membres de la famille ont accepté le don d’organes conformément aux souhaits du patient et les poumons ont été évalués pour déterminer s’ils étaient aptes. Après la perfusion d’intubation cardiopulmonaire, l’ensemble du système cardiopulmonaire a été isolé et le cœur et les poumons ont été séparés in vitro. Lors de la séparation de l’oreillette gauche, l’allocation d’une quantité suffisante de tissu de la paroi antérieure au cœur du donneur a entraîné une anomalie de la paroi antérieure de la coiffe auriculaire du poumon droit du donneur (Figure 1B).
La procédure de double transplantation pulmonaire a été réalisée le 23 novembre 2023. La ventilation monopulmonaire du receveur a permis une circulation stable de l’oxygène, et la transplantation pulmonaire a donc été réalisée sans soutien d’oxygénation par membrane extracorporelle. Au cours de l’opération, la paroi postérieure du brassard auriculaire pulmonaire droit a été reconstruite à l’aide de la technique de reconstruction du lambeau auriculaire gauche rotatif postérieur. L’anastomose de la coiffe auriculaire de la veine pulmonaire gauche était normale. Le temps d’anastomose pour les brassards auriculaires pulmonaires droit et gauche était de 24 min et 16 min, respectivement. Une fois toutes les anastomoses terminées, la circulation sanguine a été rétablie et une ventilation pulmonaire double normale a été effectuée. L’échographie transœsophagienne a indiqué un débit anastomotique bilatéral normal du ballonnet auriculaire (<140 cm/s) (Figure 4). Aucun dysfonctionnement primaire du greffon (DPI) n’est survenu et le receveur est sorti de l’hôpital 20 jours après la transplantation pulmonaire. À ce jour, le receveur s’est bien rétabli, avec une qualité de vie nettement améliorée après l’opération.
Comparaison du temps d’anastomose du brassard auriculaire chez 56 patients
Parmi les 56 patients qui ont subi une reconstruction du brassard auriculaire droit, 23 ont subi une reconstruction du lambeau auriculaire gauche rotatif et 33 ont subi une reconstruction par patch, 20 avec un patch aortique et 13 avec un patch péricardique. Le temps d’anastomose du brassard auriculaire droit était de 20,5 ± 1,99 min, 22,8 ± 5,2 min et 23,3 ± 5,3 min dans les groupes du lambeau auriculaire postérieur, du patch aortique et du patch péricardique, respectivement. L’analyse avec le test de Kruskal-Wallis a révélé que le temps d’anastomose du lambeau auriculaire postérieur était significativement plus court que celui des plaques aortiques et péricardiques (P < 0,01) ; Cependant, il n’y avait pas de différence significative entre le patch aortique et le patch péricardique.
Parmi les 54 patients avec reconstruction du côté droit et aucune reconstruction du côté gauche, 21 ont subi une reconstruction du lambeau auriculaire postérieur avec pivot du brassard auriculaire gauche, et 33 ont subi une reconstruction par patch aortique - 20 avec un patch aortique et 13 avec un patch péricardique. Le temps d’anastomose du ballonnet auriculaire gauche non réparé était de 17,5 ± 2,8 min, 17,7 ± 3,8 min et 17,6 ± 4,3 min dans les groupes du lambeau auriculaire postérieur, du patch aortique et du patch péricardique, respectivement. Le test de Kruskal-Wallis n’a révélé aucune différence statistiquement significative entre les groupes (figure 5).
Comparaison de l’incidence de la reconstruction après rétablissement du flux sanguin
Une hémorragie anastomotique nécessitant une reconstruction après restauration du flux sanguin est survenue chez deux patients (8,6 %) ayant subi une reconstruction du lambeau auriculaire gauche rotatif par lambeau auriculaire postérieur, trois (15,0 %) ayant subi une reconstruction par patch aortique et trois (20,0 %) ayant subi une reconstruction par patch péricardique. Malgré l’incidence plus faible de reconstruction après reconstruction de la coiffe auriculaire gauche rotative par lambeau auriculaire postérieur, l’analyse à l’aide du test du chi carré n’a révélé aucune différence significative entre les groupes (χ2 = 0,808, P = 0,667).
Comparaison de la vitesse d’écoulement
La vitesse d’écoulement, mesurée par échographie œsophagienne (Figure 6), a révélé que les patients des trois groupes présentaient des canaux d’écoulement veineux pulmonaires normaux, sans différences significatives de débit entre les groupes ni pour le droit (lambeau auriculaire postérieur rotation du brassard auriculaire gauche, 53,94 ± 16,3 cm/s ; reconstruction par patch aortique, 60,0 ± 21,5 cm/s ; reconstruction par patch péricardique, 56,4 ± 17,9 cm/s ; P > 0,05) ou gauche (reconstruction du lambeau auriculaire postérieur tournant du brassard auriculaire gauche, 64,8 ± 18,1 cm/s ; reconstruction du patch aortique, 68,8 ± 19,8 cm/s ; reconstruction du patch péricardique, 59,5 ± 16,8 cm/s ; P > 0,05) veine pulmonaire (Figure 7).
Comparaison de l’échographie cardiaque 30 jours postopératoires
Les résultats de l’échographie Doppler cardiaque couleur préopératoire et postopératoire n’ont montré aucune différence statistiquement significative dans la pression artérielle systolique pulmonaire préopératoire ou postopératoire entre les trois groupes (P > 0,05) (Figure 8). Cependant, la pression artérielle systolique postopératoire de l’artère pulmonaire était significativement inférieure à la pression artérielle systolique de l’artère pulmonaire préopératoire dans les trois groupes (lambeau auriculaire postérieur rotation de la coiffe auriculaire gauche, 24,5 ± 7,5 vs 41,4 ± 16,6 mmHg, P < 0,01 ; reconstruction du patch aortique, 27,6 ± 8,6 vs 35,2 ± 11,1 mmHg, P < 0,05 ; reconstruction du patch péricardique 27,7 ± 7,5 vs 35,9 ± 14,6 mmHg, P < 0,05).
Comparaison du DPI postopératoire et de la survie périopératoire
Une incidence plus élevée de DPI a été observée dans le groupe de reconstruction du lambeau auriculaire gauche en rotation du lambeau auriculaire postérieur (8,6 %) que dans les groupes de reconstruction du patch aortique (5,0 %) ou péricardique (13,3 %) ; cependant, cette différence n’était pas statistiquement significative (χ2 = 0,431, P = 0,806). Quatre patients sont décédés au cours de la période périopératoire, dont l’un a subi une reconstruction par lambeau auriculaire postérieur rotatif de la coiffe auriculaire gauche, tandis que trois ont subi une reconstruction par patch aortique (χ2 = 2,515, P = 0,284).
Comparaison des données cliniques 90 jours postopératoires
À 90 jours après l’opération, il n’y avait pas de différences significatives dans les caractéristiques cliniques pertinentes entre les groupes (tableau 2). La fonction pulmonaire, mesurée par le volume expiratoire forcé/la capacité vitale forcée et les gaz sanguins artériels, a été significativement améliorée 90 jours après l’opération par rapport à la période préopératoire ; cependant, il n’y avait pas de différences significatives dans cette amélioration entre les trois groupes (tableau 1 et tableau2).
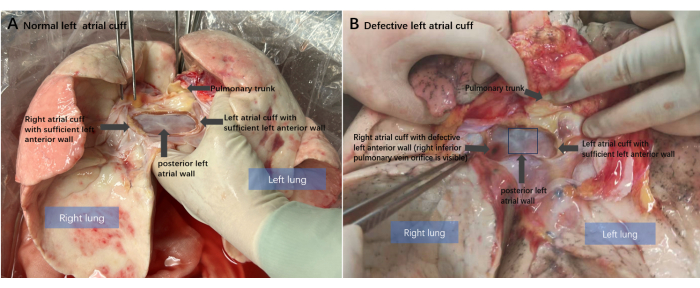
Figure 1 : Schéma anatomique du poumon du donneur. (A) État normal du ballonnet auriculaire gauche du poumon donneur après séparation cœur-poumon. La paroi postérieure postérieure postérieure gauche intacte et une paroi antérieure suffisante préservée. (B) L’anomalie classique de la paroi antérieure du ballon auriculaire gauche du donneur : la paroi auriculaire antérieure du poumon droit du donneur est manquante. Veuillez cliquer ici pour voir une version agrandie de cette figure.
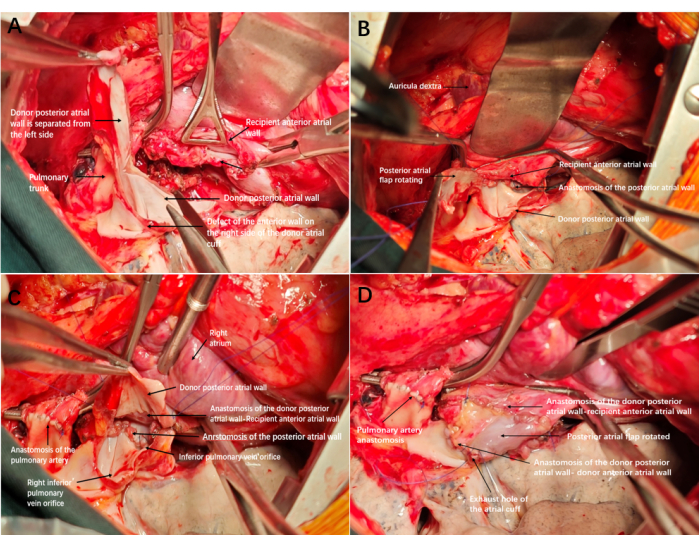
Figure 2 : Schéma de reconstruction et d’anastomose du brassard auriculaire gauche. (A) Défaut de la paroi antérieure du côté droit du brassard auriculaire donneur ; Une fois l’anastomose de la trachée et de l’artère terminée, l’excès de paroi postérieure de l’oreillette est coupé de bas en haut pour former un lambeau auriculaire. (B) Compléter l’anastomose de la paroi auriculaire postérieure. (C) Le bord du lambeau auriculaire était anastomosé à la paroi antérieure du brassard auriculaire du receveur, la membrane interne du lambeau auriculaire étant tournée vers l’intérieur. (D) Le bord restant du ballonnet auriculaire a été anastomosé à la paroi antérieure du receveur. Après avoir serré et ouvert l’échappement, le brassard s’est bien dilaté, sans saignement et sans besoin de reconstruction. Veuillez cliquer ici pour voir une version agrandie de cette figure.
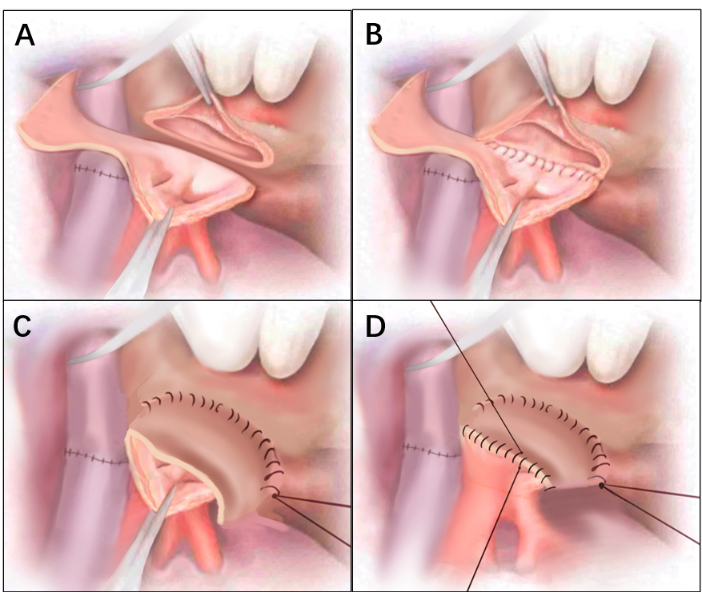
Figure 3 : Dessins au trait de la figure 2. (A) Défaut de la paroi antérieure du côté droit du brassard auriculaire donneur. Une fois l’anastomose de la trachée et de l’artère terminée, l’excès de paroi postérieure de l’oreillette est coupé de bas en haut pour former un lambeau auriculaire. (B) Compléter l’anastomose de la paroi auriculaire postérieure. (C) Le bord du lambeau auriculaire a été anastomosé à la paroi antérieure du ballonnet auriculaire du receveur, la membrane interne du lambeau auriculaire étant tournée vers l’intérieur. (D) Le bord restant du ballonnet auriculaire a été anastomosé à la paroi antérieure du receveur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
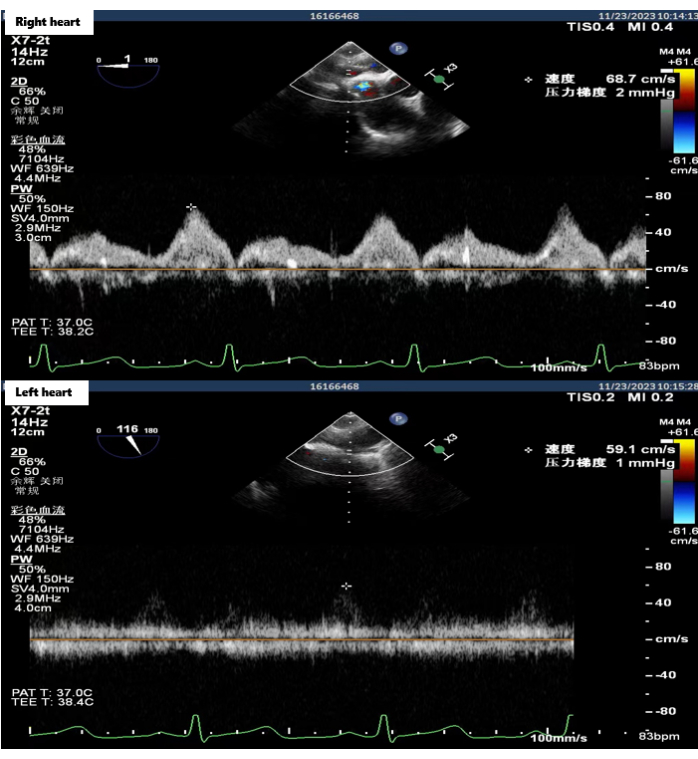
Figure 4 : Échographie œsophagienne du débit anastomotique auriculaire bilatéral. Des images échographiques transœsophagiennes ont été acquises dans la salle d’opération après la fin de l’anastomose, montrant que le débit anastomotique auriculaire bilatéral était normal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
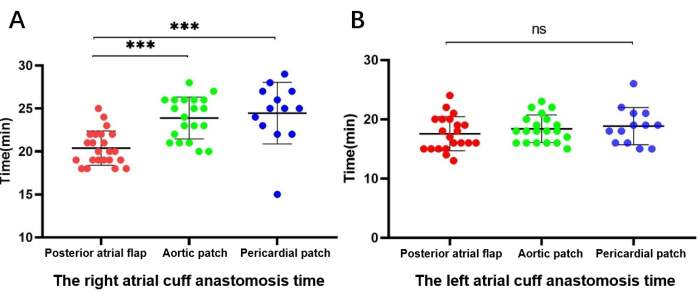
Figure 5 : Comparaison de la durée de l’anastomose de la coiffe auriculaire. (A) Temps d’anastomose de la coiffe auriculaire du côté droit (reconstruction). (B) Temps d’anastomose de la coiffe auriculaire gauche (non reconstruite). Veuillez cliquer ici pour voir une version agrandie de cette figure.
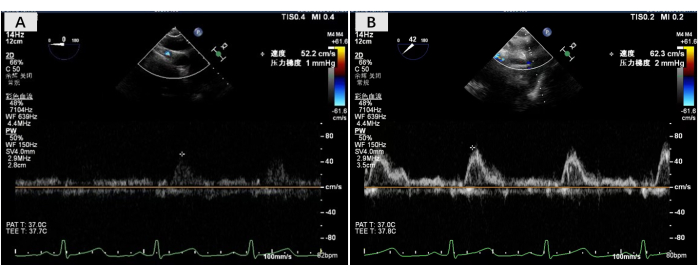
Figure 6 : Échographie œsophagienne du débit sortant bilatéral. (A) Mesure de la vitesse d’écoulement à l’anastomose auriculaire pulmonaire droite. (B) Mesure de la vitesse d’écoulement au niveau de l’anastomose auriculaire pulmonaire gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
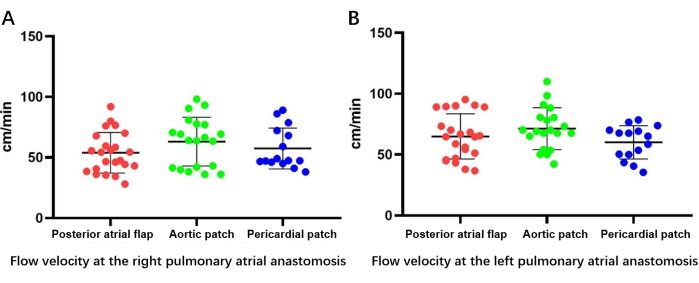
Figure 7 : Vitesse d’écoulement bilatérale déterminée par échographie œsophagienne. (A) Mesure de la vitesse d’écoulement à l’anastomose auriculaire pulmonaire droite. (B) Mesure de la vitesse d’écoulement au niveau de l’anastomose auriculaire pulmonaire gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
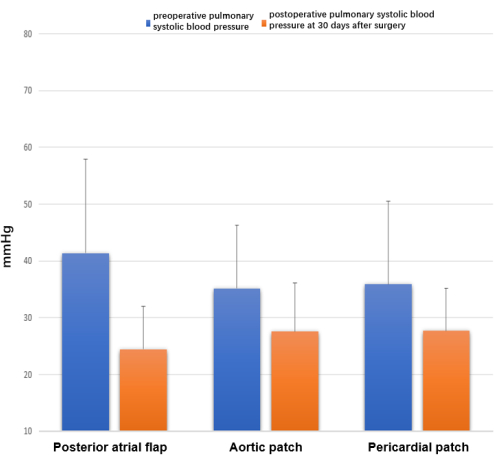
Figure 8 : Échocardiographie à 30 jours après l’intervention. Des différences ont été observées dans la pression artérielle systolique pulmonaire préopératoire et postopératoire, mesurée en 4V²TR + RPA mmHg. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Caractéristique | Technique utilisée pour la reconstruction du brassard | Valeur P | ||
| Lambeau auriculaire postérieur (N = 23) | Patch aortique (N = 20) | Patch péricardique (N = 15) | ||
| Donneur | ||||
| Sexe (F/H) | 5/18 | 4/16 | 4/11 | Ns |
| Âge (années) | 35,0 ± 12,9 | 36.1± 12.1 | 36,7± 10,9 | 0.86 |
| PO2/FiO2 artérielle | 401 ± 102 | 422± 106 | 426 ± 101 | 0.14 |
| Destinataire | ||||
| Sexe (F/H) | 2/21 | 4/16 | 6/9 | - |
| Âge (années) | 47,3 ± 21,0 | 52,3± 16,2 | 49,5 ± 21,4 | Ns |
| PO2 (mmHg) | 91,6 ± 21,6 | 106.7±38.3 | 102.2±35.2 | Ns |
| PCO2 (mmHg) | 55,2 ± 21,7 | 54,6 ± 17,3 | 47,4 ± 11,2 | Ns |
| SatO2 ( %) | 96,6 ± 2,1 | 92,9 ± 20,3 | 91,9 ± 17,3 | Ns |
| VEMS/CVF | 49,4 ± 23,9 | 48,7 ± 30,0 | 63,7 ± 26,0 | Ns |
| PAP (cm/s) | 38,8 ± 17,9 | 44,4± 23,0 | 39,1 ± 24,4 | Ns |
Tableau 1 : Caractéristiques de base des donneurs et des receveurs de greffe de poumon. Les valeurs sont présentées sous forme de moyenne ± d’écart-type. Le test de Kruskal-Wallis a été utilisé pour comparer les groupes. Abréviations : F = femme ; VEMS1 = volume expiratoire forcé ; FiO2 = fraction de l’oxygène inspiré ; CVF = capacité vitale forcée ; M = mâle ; PAP = pression artérielle pulmonaire ; PCO2 = pression partielle de dioxyde de carbone ; PO2 = pression partielle de l’oxygène ; SatO2 = saturation en oxygène.
| Caractéristique | Technique utilisée pour la reconstruction du brassard | Valeur P | ||
| Lambeau auriculaire postérieur (N = 23) | Patch aortique (N = 20) | Patch péricardique (N = 15) | ||
| PO2 | 113.2 ± 24.1 | 97,3 ± 27,5 | 98,8 ± 27,0 | Ns |
| PCO2 | 40,4 ± 5,7 | 39,2 ± 10,8 | 36,4 ± 7,2 | Ns |
| SatO2 | 98,1 ± 0,9 | 93,0 ± 21,1 | 93,7 ± 16,7 | Ns |
| VEMS/CVF | 86,1 ± 10,3 | 87,1 ± 19,4 | 81,9 ± 17,6 | Ns |
Tableau 2 : Caractéristiques cliniques des receveurs d’une greffe de poumon 90 jours après l’opération. Les valeurs sont présentées sous forme de moyenne ± d’écart-type. Le test de Kruskal-Wallis a été utilisé pour comparer les groupes. Abréviations : VEMS1 = volume expiratoire forcé ; CVF = capacité vitale forcée ; PCO2 = pression partielle de dioxyde de carbone ; PO2 = pression partielle de l’oxygène ; SatO2 = saturation en oxygène.
Discussion
Entre 2021 et 2023, l’équipe du deuxième hôpital de l’Université du Zhejiang/Centre de transplantation pulmonaire de Wuxi a effectué 931 greffes de poumons, dont 71 impliquaient une reconstruction de la coiffe auriculaire gauche d’un donneur. Pour réduire l’hétérogénéité, seules 58 greffes de deux poumons ont été incluses dans cette étude. Les patchs artificiels sont rarement utilisés dans notre centre, et ils n’ont donc pas été inclus dans cette étude.
Le temps d’anastomose du côté de reconstruction était significativement plus court dans le groupe de reconstruction du lambeau auriculaire rotatif postérieur que dans les groupes de reconstruction par patch aortique et péricardique, ce qui indique que la nouvelle technique chirurgicale a effectivement raccourci le temps de l’opération. Il n’y avait pas de différence dans le temps d’anastomose du côté non réparé, ce qui suggère une cohérence chirurgicale, indiquant que la différence de temps d’anastomose du côté réparé était due à la différence de technique.
L’échographie œsophagienne a indiqué qu’il n’y avait pas de différence significative dans la vitesse de l’écoulement bilatéral, démontrant la faisabilité de la nouvelle approche. L’échographie cardiaque et les résultats pour les patients ont également indiqué une bonne récupération à court terme après la nouvelle technique, sans différence significative dans les complications à court terme et les effets indésirables par rapport à la méthode traditionnelle de reconstruction par patch. Cette hypothèse a été confirmée par des évaluations de la fonction pulmonaire et des gaz du sang artériel 90 jours après la transplantation.
Pour assurer une circulation sanguine fluide dans la veine pulmonaire, le ballonnet auriculaire gauche doit être anastomosé lors de la transplantation pulmonaire3. Lors de l’extraction du poumon du donneur, la séparation cardiopulmonaire idéale nécessite la préservation du ballonnet auriculaire gauche intact, y compris la paroi auriculaire postérieure intacte et la paroi auriculaire antérieure adéquate2. Les anomalies de la coiffe auriculaire sont des blessures courantes subies lors de l’extraction du poumon du donneur3, lorsque la nécessité d’utiliser à la fois le cœur et le poumon du donneur entraîne souvent une concurrence dans certaines zones anatomiques, en particulier la zone auriculaire gauche, ce qui peut entraîner une anomalie de la coiffe auriculaire dans le poumon du donneur7. La question de savoir si la séparation cardiorespiratoire du donneur doit être effectuée in vivo ou in vitro reste controversée.
À l’heure actuelle, la séparation cardiopulmonaire in vivo est la technique privilégiée 2,8. Cependant, la séparation cardiopulmonaire in vitro peut mieux exposer la région auriculaire gauche, où une compétition cardiopulmonaire peut exister5. Une anomalie de la paroi auriculaire antérieure du poumon droit du donneur est le type le plus courant de malformation de la coiffe auriculaire du donneur en raison de la présence du sillon interauriculaire4. Une dissection et une dissociation méticuleuses du sillon interauriculaire permettent de mieux exposer la paroi auriculaire antérieure gauche du côté droit et de prévenir les défauts du brassard auriculaire du poumon droit du donneur3.
Lorsque des anomalies du ballonnet auriculaire se produisent, l’anastomose peropératoire devient plus difficile et il est souvent nécessaire de façonner et de reconstruire le ballonnet auriculaire pour prévenir les saignements et les complications associées du canal d’écoulement veineux, ce qui augmente le temps d’ischémie froide. Des études ont montré que bien que la durée prolongée de l’ischémie à froid due à l’augmentation de la durée anastomotique n’ait aucun effet sur la survie à long terme, elle peut affecter la survie à 90 jours postopératoires et augmenter le risque de complications des voies respiratoires9. Les défauts du ballonnet auriculaire entraînent également le déclassement des donneurs d’idéal àmarginal 10.
Lorsque des anomalies du ballonnet auriculaire se produisent, une anastomose forcée avec tension ou une anastomose séparée des veines pulmonaires supérieures et inférieures augmente le risque d’obstruction du canal d’éjection veineuse11. Au lieu de cela, une anastomose auriculaire postérieure légèrement plus compacte et une anastomose antérieure plus lâche et sans tension peuvent ouvrir le canal d’éjection auriculaire gauche. Hammond et al.5 ont introduit l’utilisation de tissu péricardique adjacent à la veine pulmonaire pour la reconstruction, ce qui a entraîné une anastomose large et lisse du ballonnet auriculaire et un débit de perfusion bilatéral correspondant au receveur. Il a été avancé que l’anastomose directe du péricarde périphérique sans renforcer le moignon de la veine pulmonaire au péricarde peut réduire le risque de blocage ou de rétrécissement de l’ouverture de la veine12. La disponibilité du tissu péricardique et ses bons résultats en font le matériau le plus important pour la reconstruction du patch du brassard auriculaire. Sugimoto et al.6 ont rapporté une méthode d’utilisation de l’excès d’artère pulmonaire du donneur pour reconstruire les brassards auriculaires, avec de bons résultats chirurgicaux. Cependant, il n’y a pas eu de rapports sur l’utilisation de la paroi auriculaire postérieure gauche excédentaire du poumon donneur pour reconstruire les défauts de la paroi antérieure.
Ici, nous présentons cette nouvelle méthode de reconstruction du brassard auriculaire du donneur, appelée technique de reconstruction du brassard auriculaire gauche rotatif du lambeau auriculaire postérieur, et comparons et analysons son innocuité. En termes de chirurgie, la méthode de reconstruction du brassard auriculaire gauche rotatif par lambeau auriculaire postérieur est plus pratique et rapide, car elle ne nécessite pas la formation in vitro du brassard auriculaire mais peut être réparée directement lors de l’anastomose. De plus, parce que la zone reconstruite est faite du même tissu auriculaire, la compatibilité tissulaire est bonne et il y a une préservation maximale de l’apport sanguin à la zone réparée. En ce qui concerne le pronostic, la méthode du lambeau auriculaire postérieur peut maintenir le ballonnet auriculaire antérieur lâche après l’anastomose et réduire l’apparition de complications liées à l’écoulement veineux, aux saignements et à la reconstruction par rapport aux méthodes de reconstruction par patch, ainsi que diminuer le temps d’ischémie froide grâce à une anastomose plus rapide. Cette méthode chirurgicale simple fournit une stratégie réalisable pour la reconstruction des défauts de la coiffe auriculaire dans la veine pulmonaire du donneur, avec de bons résultats cliniques.
Cette étude présente certaines limites. Par exemple, la différence statistique dans le rapport entre les hommes et les femmes entre les trois groupes et l’incapacité de maintenir la même qualité de poumons de donneurs en raison de la complexité de la transplantation pulmonaire peuvent avoir influé sur les résultats de l’étude. Cette méthode n’est applicable qu’au type le plus courant d’anomalie du ballonnet auriculaire, l’anomalie de la paroi auriculaire antérieure, et nécessite une paroi auriculaire postérieure intacte. Si la paroi auriculaire postérieure est incomplète, une reconstruction par patch ou d’autres méthodes de formation sont nécessaires.
En conclusion, cette étude décrit une nouvelle méthode de reconstruction de la coiffe auriculaire gauche du poumon du donneur. Cette nouvelle méthode permet de traiter efficacement les anomalies de la paroi antérieure du ballonnet auriculaire lors d’une transplantation pulmonaire en faisant pivoter le lambeau auriculaire postérieur. Bien qu’aucune différence significative n’ait été observée à court terme entre les méthodes de reconstruction par lambeau auriculaire postérieur et par patch, l’utilisation de la méthode du lambeau auriculaire postérieur a permis de réduire efficacement le temps d’anastomose du ballonnet auriculaire. Par rapport à la méthode traditionnelle de reconstruction par patch, elle réduit également la difficulté de l’opération et a le potentiel de réduire le risque de complications à long terme telles que l’ischémie anastomotique et la thrombose murale. Cette technique fournit donc une stratégie réalisable pour la reconstruction des défauts de la coiffe auriculaire et peut améliorer le taux d’utilisation efficace des poumons du donneur.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Cette recherche a été soutenue par le Programme national de recherche et de développement clés de la Chine. (Projet n° 2023YFC2507100).
matériels
| Name | Company | Catalog Number | Comments |
| ACE+7 SHEARS | ETHICON | HARH23 | |
| Articulating Endoscopic Linear Cutter | ETHICON | PSEE45A | |
| Atraumatic tissue forceps | Delacroix-Chevalier | DC13200-24/DC13200-20 | |
| Atrial blocjing forceps | Delacroix-Chevalier | DC40672-26/DC40673-26 | |
| Blue monofilament non-absortable suture (4-0) | ETHICON | REF8521 | |
| Blue monofilament non-absortable suture (5-0) | ETHICON | HS6856 | |
| Bronchoscope | OLYMPUS | BF-Q170 | |
| Coated vicryl plus antibacterial suture (1-0) | ETHICON | VCP359 | |
| Diagnostic Ultrasound System | PHILIPS | EPIQ 7C | |
| Diprivan Injection | AstraZeneca | 1%w/v | |
| Disposable Skin Stapler | Pride | P-PF-35R | |
| ECMO | Maquet | CARDIOHELP-i | |
| Electrosurgical Pencil | AESCULAP | GN300 | |
| Needle Holder | Delacroix-Chevalier | DC51170-24/G30154 | |
| Negative pressure suction device | SMAF | YX930 | |
| PDS II absorbable suture (4-0) | ETHICON | W9109 | |
| Pulmonary artery blocking forceps | Delacroix-Chevalier | DC13010-23/DC13010-23 | |
| Remifentanil Hydrochloride Injection | CNPIC | H20223422 | |
| Thoratrak MICS Retractor System | Medtronic | 28605 | |
| Tissue scissors | Delacroix-Chevalier | B25925 |
Références
- Young, K. A., Dilling, D. F. The future of lung transplantation. Chest. 155 (3), 465-473 (2019).
- Copeland, H., et al. Donor heart and lung procurement: A consensus statement. J Heart Lung Transplant. 39 (6), 501-517 (2020).
- Sundaresan, S., Trachiotis, G. D., Aoe, M., Patterson, G. A., Cooper, J. D. Donor lung procurement: assessment and operative technique. Ann Thorac Surg. 56 (6), 1409-1413 (1993).
- Oto, T., et al. Techniques of reconstruction for inadequate donor left atrial cuff in lung transplantation. Ann Thorac Surg. 81 (4), 1199-1204 (2006).
- Hammond, G. L., Franco, K. L., Baldwin, J. C. Method of single-lung transplantation in the absence of a left atrial cuff. Ann Thorac Surg. 54 (2), 379-380 (1992).
- Sugimoto, S., et al. Pulmonary artery patch for an inadequate donor atrial cuff in the absence of donor pericardium in lung transplantation. Surg Today. 47 (3), 399-401 (2017).
- Contreras, F. J., et al. Dual procurement of lung and heart allografts does not negatively affect lung transplant outcomes. J Surg Res. 259, 106-113 (2021).
- Copeland, H., Copeland, J., Hayanga, J. W. A. Cardiac and pulmonary donor procurement. Curr Opin Organ Transplant. 23 (3), 281-285 (2018).
- Mulvihill, M. S., et al. The association of donor age and survival is independent of ischemic time following deceased donor lung transplantation. Clin Transplant. 31 (7), (2017).
- Courtwright, A., Cantu, E. Evaluation and management of the potential lung donor. Clin Chest Med. 38 (4), 751-759 (2017).
- Gamez, P., Alvarez, R., Hernández, H., Córdoba, M., De Pablo, A. Lung transplantation: how to do the venous anastomosis when the pulmonary graft has no auricular cuff. J Heart Lung Transplant. 24 (8), 1123-1125 (2005).
- Yarbrough, W. M., et al. Alternative technique for salvage of donor lungs with insufficient atrial cuffs. Ann Thorac Surg. 88 (4), 1374-1376 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon