Method Article
Ротация донорского лоскута заднего предсердия для реконструкции манжеты левого предсердия при трансплантации легких
В этой статье
Резюме
В этом протоколе описывается новый метод эффективной реконструкции дефектов передней стенки манжеты предсердия донора во время трансплантации легких путем вращения донорского заднего предсердного лоскута.
Аннотация
Мы подробно описываем новую хирургическую технику восстановления донорского дефекта передней стенки левого предсердия in vivo путем вращения заднего предсердного лоскута во время трансплантации легких. Этот метод может безопасно и эффективно решить наиболее распространенный тип дефекта манжеты левого предсердия у донора: дефект передней стенки с интактной задней стенкой, обычно сохраняемой при использовании донорского сердца. Во время анастомоза манжеты предсердия при трансплантации легких избыточная задняя стенка предсердия донора обрезается в лоскут предсердия. После того, как анастомоз задней стенки завершен, лоскут предсердия поворачивается на 180° и используется в качестве пластыря для реконструкции анастомоза передней стенки.
После восстановления кровотока скорость кровотока в легочной вене нормальная и ровная, что подтверждается чреспищеводной эхокардиографией. По сравнению с традиционным методом реконструкции с помощью пластыря, новый метод эффективно сокращает время анастомоза манжеты предсердия. Наши результаты не показали существенной разницы в обструкции легочных вен после реконструкции. Систолическое артериальное давление в легочной артерии было достоверно ниже, а функция легких улучшилась после операции во всех группах, без существенных различий между группами. Новый метод обеспечивает осуществимую стратегию реконструкции дефектов манжеты левого предсердия и может улучшить эффективный коэффициент использования донорских легких.
Введение
Трансплантация легких, единственный эффективный метод лечения большинства терминальных стадий заболеваний легких, ограничена нехваткой донорских органов. Поэтому необходимо оптимизировать процедуру трансплантации для эффективного использования потенциальных донорских органов1. Хирургическая техника извлечения донорского легкого является важным аспектом этой процедуры. В настоящее время важно сохранить неповрежденную левую манжету предсердия, которая обычно используется для анастомоза, в отличие от легочных вен 2,3. Дефект манжеты левого предсердия является наиболее распространенным донорским повреждением легких, возникающим в 2,7% случаев при отделении донорского сердца и легкого. Сохранение задней стенки левого предсердия у реципиентов трансплантата сердца означает, что ткань задней стенки предсердия донора обычно полностью сохраняется в донорском легком (Рисунок 1A), что делает дефекты передней стенки левой манжеты предсердия наиболее распространенным типом травмы манжеты предсердия (Рисунок 1B), составляя примерно 71% случаев4. Из-за межпредсердной борозды дефект передней стенки предсердия чаще возникает на правом донорском легком 5,6.
В данной работе представлен новый метод реконструкции манжеты предсердия, который может безопасно и эффективно решить проблему дефекта манжеты левого предсердия, возникшего при приобретении донорского легкого, тем самым улучшая коэффициент использования донорских легких. Ключевым аспектом этого нового метода является сохранение интактной задней стенки предсердия донорского легкого. Обрезая избыточную заднюю стенку предсердия, он образует лоскут предсердия, а вращение лоскута предсердия обеспечивает заплатку для восстановления дефектной передней стенки.
В случаях дефектов манжеты предсердий требуется дополнительное время для формирования и реконструкции манжеты предсердия для сглаживания венозного канала оттока и предотвращения стеноза5. Традиционный тип реконструкции пластыря выполняется in vitro до того, как донорское легкое будет помещено в грудную клетку, что увеличивает время холодной ишемии. Реконструкция манжеты требует наличия заплаточного материала; Избыток донорской перикардиальной ткани является наиболее часто используемым, хотя избыток артериальной ткани также может быть использован 4,5,6. Независимо от типа используемого материала пластыря, реконструкция манжеты связана с увеличением времени операции и повышенным риском хирургических осложнений, таких как обструкция путей венозного оттока, вызванная негомологичном сосудистым анастомозом.
Новый метод позволяет восстановить дефект передней стенки in vivo с использованием избыточной ткани левого предсердия донора. Операция более удобна, а время анастомоза эффективно сокращается, что сокращает время холодной ишемии. Этот метод, который мы назвали реконструкцией вращающейся левой манжеты заднего предсердия, предлагает новую и осуществимую стратегию борьбы с дефектом передней стенки предсердия, который является наиболее распространенным типом дефектов предсердной манжеты донорского легкого при трансплантации легких.
протокол
Это исследование было одобрено советом по этике больницы (номер одобрения ChiCTR2400085507), и было получено письменное информированное согласие от всех субъектов.
1. Предоперационная подготовка
- Подтвердите совпадающую информацию донора и реципиента.
ПРИМЕЧАНИЕ: В нашем случае подтверждение было сделано путем проверки файлов из Национальной системы реагирования на трансплантацию органов. - Удалите волосы из области операции и убедитесь, что они голодали более 12 часов.
- Переведите получателя из палаты в операционную в ожидании операции.
- Убедитесь, что все инструменты и материалы, необходимые для протокола, доступны (см. Таблицу материалов).
- Убедитесь, что донорские легкие доступны и пригодны для использования.
Примечание: Все индексы донорского легкого, включая показатели дыхательных путей, текстуру и лабораторные индексы, были на должном уровне, за исключением дефекта рукава переднего предсердия, который необходимо было восстановить. - Начало процедур анестезии и экстракорпоральной мембранной оксигенации (ЭКМО).
2. Анестезия и ЭКМО
- Установите сосудистый доступ.
- Ввести внутривенную анестезию. Индуцируйте анестезию путем внутривенного введения 0,05-0,1 мг/кг мидазолама для инъекций, 0,1-0,3 мг/кг инъекционной эмульсии с этимидатом, 0,8 мг/кг для инъекций бромида рокурония и 0,5-1 мкг/кг для инъекций ремифентанила гидрохлорида. Поддерживайте анестезию, вводя 5-10 мг∙кг-1∙ч-1 инъекционного препарата Диприван и внутривенно 0,5-2 г-кг-1∙ч-1 инъекционного препарата ремифентанила гидрохлорида.
- Введите двухкамерционную интубацию трахеи и отрегулируйте положение левого и правого отверстий трахеальной трубки.
- Введите катетер SwanGanz через внутреннюю яремную вену.
- Введите ЭКМО через бедренную вену и внутреннюю яремную вену.
ПРИМЕЧАНИЕ: В зависимости от давления в легочной артерии пациента и состояния сердца, хирург может выбрать другие режимы ЭКМО.
3. Удаление больного легкого реципиента
- Расположите пациента горизонтально, слегка приподняв спину и раскинув руки горизонтально в положении «крест-накрест» и надежно зафиксировав.
- Продезинфицируйте кожу операционной области. Используйте дезинфицирующее средство йодофором 3 раза изнутри наружу. Стерилизовать до шеи, вниз до пупка и латерально до задней подмышечной линии.
- Убедитесь, что контралатеральное легкое вентилируется самостоятельно, и сделайте разрез 15-20 см от четвертого межреберья передней грудной стенки в грудную клетку без разреза грудины.
ПРИМЕЧАНИЕ: При пересадке двух легких, на основании предоперационной оценки, сначала следует пересадить легкое с более тяжелым состоянием. Если степень тяжести одинакова с обеих сторон, сначала следует пересадить правое легкое. - Обнажите область разреза. Прощупайте больное легкое и освободите грудные спайки.
- Освободите нижние связки легких и освободите легочную артерию и легочную вену.
- Заблокируйте проксимальный конец правой легочной артерии с помощью щипцов, блокирующих легочную артерию. Разрежьте верхние и нижние легочные вены с помощью сосудистого режущего и закрывающего устройства. Зажмите дистальный конец легочной артерии и перережьте артерию.
- Разрежьте правый главный бронх и окружающую соединительную ткань на уровне второй ветви.
- Удалите больное легкое и полностью остановите кровотечение в грудной клетке.
4. Лечение остаточных остатков сосудов и трахеи реципиента
- Отрежьте 1-2 хрящевых кольца, чтобы обнажить правый главный бронх, и подрежьте их ровно, чтобы обеспечить полный гемостаз.
- Обрежьте культю легочной артерии реципиента на расстоянии 8-10 мм от блокирующего зажима.
- Освободите верхние и нижние легочные вены в пределах перикарда. Убедитесь, что левое предсердие на стыке верхней и нижней легочных вен может быть пережато предсердными щипцами.
5. Отделение и обрезка донорского легкого
- Разделите заднюю стенку предсердия, убедившись, что избыточная задняя стенка предсердия включена со стороны с дефектом передней стенки.
ПРИМЕЧАНИЕ: Из-за расположения межпредсердной борозды дефекты передней стенки обычно возникают с правой стороны. Избыток задней стенки предсердия, полученный с правой стороны, может служить источником для восстановления короткой передней стенки (Рисунок 1B). - Перерезать левую и правую легочные артерии на стыке левой и правой легочных артерий.
- Освободите левый главный бронх и отрежьте бронх. Разделите левое и правое донорские легкие.
- Поместите левое донорское легкое в раствор для сохранения органов при температуре 4 °C. Обрезайте правое донорское легкое. Следите за тем, чтобы основной бронх имел 2-3 хрящевых кольца. Полностью освободите легочную артерию и манжету предсердия.
6. Анастомоз первичного бронха и легочной артерии
- Поместите восстановленное правое донорское легкое в правую грудную клетку.
- Сшить бронхиальную оболочку линией 4-0 PDS и бронхиальный хрящ линией 4-0 Poly. Используйте бронхоскоп, чтобы подтвердить, что дыхательные пути свободны и открыты после завершения бронхиального анастомоза.
- Сшить мягкие ткани вокруг бронхиального анастомоза с помощью полилинии 4-0 и убедиться, что анастомоз дыхательных путей закрыт.
- Анастомоза легочной артерии с помощью непрерывного шва 5-0 poly line.
7. Реконструкция и анастомоз манжеты левого предсердия
- Зажмите левое предсердие реципиента на проксимальном конце пересечения верхних и нижних легочных вен, следя за тем, чтобы в месте соединения было 1-2 см пространства для анастомоза.
- Разрежьте избыточную заднюю стенку манжеты предсердия донора снизу вверх, сравнивая расстояние между задним краем предсердия донора и реципиента. Не допускайте полного обламывания лишней задней стенки. Обрежьте избыточную заднюю стенку, чтобы сформировать лоскут предсердия, соединенный с верхним краем манжеты донорского предсердия ножкой (рисунок 2А и рисунок 3А).
- Анастомозируют задние края манжет предсердий снизу вверх с помощью непрерывного проленового шва 4-0 (рис. 2Б и рис. 3В). Продолжайте наложение шва (с 4-0 проленом) по достижении заднего предсердного лоскута, чтобы анастомозировать край предсердного лоскута, ближайший к легкому, с передним краем предсердия реципиента. Следите за тем, чтобы концы швов соприкасались с нижним краем анастомоза и перевяжите их (рисунок 2С и рисунок 3С).
- Анастомозируйте другой край предсердного лоскута и передний край предсердия донора сверху вниз непрерывным швом 4-0 Prolene line, а последние две иглы оставьте незатянутыми, чтобы они служили выхлопными отверстиями (Рисунок 2D и Рисунок 3D).
8. Открытие кровотока
- Проветрите и расширьте пересаженное легкое, чтобы полностью открыть альвеолы. Временно освободите щипцы, блокирующие легочную артерию, позволяя крови вытекать из выпускного отверстия предсердного анастомоза. Зажмите легочную артерию блокирующими щипцами, ослабьте и удалите предсердные щипцы, а затем затяните проленовый шов предсердного рукавного анастомоза после полного оттока воздуха.
- Освободите и снимите щипцы, блокирующие легочную артерию, чтобы обеспечить полноценный кровоток. Убедитесь, что передняя стенка анастомоза широкая и хорошо заполнена, без кровоточащих проявлений.
9. Закрытие груди
- Повторно проверьте все анастомозы и грудную полость на предмет кровотечения и экссудации. Подтвердите достаточный гемостаз в грудной клетке.
- Промойте грудную полость, установите дренажную трубку, проветрите пересаженное легкое и закройте грудную клетку слой за слоем с помощью швов для закрытия грудной клетки.
- Иссекают контралатеральное больное легкое и анастомозируют донорское легкое.
ПРИМЕЧАНИЕ: Процесс иссечения и анастомоза контралатерального легкого такой же, как и для правого, а контралатеральный анастомоз левого предсердия является рутинным из-за интактной манжеты донорского предсердия. - После двустороннего закрытия грудной клетки контролируйте и записывайте скорость кровотока в двусторонних легочных венах с помощью ультразвукового исследования пищевода.
10. Протоколирование данных и выход из операционной
- Примите стратегию защитной вентиляции легких, чтобы сделать трансплантированное легкое полностью вентилируемым, например, с положительным давлением в конце выдоха (PEEP) 5-7смН2О и приливными значениями (VT) 5-7 мл/кг, при этом контролировались пики давления в дыхательных путях < 30 смЧ2О.
- Запишите давление в легочной артерии.
- Введите ультразвуковой датчик пищевода через рот. Контролируйте и записывайте скорость потока в двусторонних легочных венах.
- Перейти на однополостную интубацию трахеи и перевести пациента в отделение интенсивной терапии для дальнейшего лечения.
11. Последующие действия
- Измерьте артериальное давление в сердце и легочной артерии с помощью внешнего ультразвукового исследования сердца через 30 дней после трансплантации и регулярно анализируйте газовый состав артериальной крови. Проанализируйте функцию легких и результаты других рутинных биохимических тестов.
12. Статистический анализ
- Выполняйте статистический анализ и выражайте данные в виде среднего ± стандартного отклонения.
- Сравнивайте группы с помощью дисперсионного анализа, критерия Краскела-Уоллиса, U-критерия Манна-Уитни или критерия пар Вилкоксона. Установите статистическую значимость на уровне P < 0,05.
Результаты
Пациенты были отобраны на основе изучения записей о 931 трансплантации легких, выполненных в Центре трансплантации легких Второй аффилированной больницы Медицинской школы Чжэцзянского университета или Центре трансплантации легких Народной больницы Уси с 2021 по 2023 год. В обоих центрах работал один и тот же хирургический директор, возглавляющий операционную бригаду, в которую входили старшие врачи и медсестры с большим опытом работы. Все донорские органы были справедливо распределены по системе COPO в соответствии с принципами распределения органов и подсчета баллов.
Первичные заболевания реципиентов включали идиопатический фиброз легких, интерстициальное заболевание легких, ассоциированное с заболеванием соединительной ткани, синдром облитерирующего бронхиолита и хроническую обструктивную болезнь легких. В общей сложности 71 пациенту потребовалась реконструкция манжеты предсердия донора, из которых 13 получили трансплантацию одного легкого и 58 получили трансплантацию двойного легкого, что отражает частоту 6,2% реконструкций манжеты предсердий при трансплантации двух легких. Среди 58 реципиентов трансплантата двойного легкого, включенных в это исследование, 23 были выполнены реконструкция манжеты предсердия передней стенки передней стенки (предпочтительная техника, группа 1: группа заднего лоскута предсердия) и 35 перенесли традиционную реконструкцию с помощью пластыря. В случаях реконструкции пластыря; Хирург определил наиболее подходящий материал пластыря в соответствии с состоянием донорского легкого. Донорская аорта была использована у 20 пациентов (группа 2: группа с аортальным пластырем), а донорский перикард был использован у остальных 15 пациентов (группа 3: группа с перикардиальным пластырем) Исходные характеристики доноров и реципиентов обобщены в таблице 1; Существенных различий между группами не наблюдалось.
Случай реконструкции лоскута заднего предсердия с вращением левой манжеты предсердия
В октябре 2023 года 17-летний юноша (рост 165 см; вес 50 кг) был госпитализирован из-за кашля с мокротой, сохраняющейся в течение 6 месяцев и усугубленной астмой в течение 3 месяцев. За шесть лет до госпитализации у пациента развился кашель с большим количеством желтой гнойной мокроты, который был диагностирован как бронхоэктазы с инфекцией; Однако противоинфекционное лечение не было эффективным. Генетическое тестирование выявило легочный муковисцидоз. За три месяца до госпитализации пациент простудился и у него развилась астма, потребовавшая непрерывной кислородной терапии. После лечения и выписки, но при непрерывной оксигенации в домашних условиях, выносливость активности пациента значительно снизилась, а при комплексной оценке были выявлены показания к трансплантации легких; Таким образом, пациент был добавлен в список ожидания. После 46 дней в листе ожидания был найден подходящий донор.
Донором стал 20-летний мужчина (рост 170 см; вес 60 кг) поступил в больницу в ноябре 2023 года с черепно-мозговой травмой в результате автомобильной аварии. Отношение парциального давления кислорода в артериальной крови к фракции концентрации кислорода на вдохе составило 450, а результаты визуализации грудной клетки были в норме. У пациента была констатирована смерть мозга на пятый день после госпитализации. Члены семьи согласились на донорство органов в соответствии с пожеланиями пациента, и легкие были оценены на пригодность. После перфузии сердечно-легочной интубации вся сердечно-легочная система была изолирована, а сердце и легкие разделены in vitro. Во время отделения левого предсердия поступление достаточного количества ткани передней стенки в донорское сердце привело к дефекту передней стенки манжеты предсердия в правом донорском легком (рис. 1B).
Процедура пересадки двух легких была проведена 23 ноября 2023 года. Однолегочная вентиляция легких реципиента привела к стабильной циркуляции кислорода, поэтому трансплантация легких была выполнена без поддержки экстракорпоральной мембранной оксигенации. Во время операции была реконструирована задняя стенка правой легочной манжеты предсердия с использованием техники реконструкции левой манжеты с помощью заднего предсердного лоскута. Анастомоз манжеты предсердия левой легочной вены был в норме. Время анастомоза для манжет правого и левого предсердий составило 24 мин и 16 мин соответственно. После того, как все анастомозы были завершены, был восстановлен кровоток и проведена нормальная двухлегочная вентиляция. Чреспищеводное ультразвуковое исследование показало нормальную скорость двустороннего кровотока в манжете предсердия (<140 см/с) (рис. 4). Первичной дисфункции трансплантата (ПГД) не произошло, и реципиент был выписан из больницы через 20 дней после трансплантации легкого. На сегодняшний день реципиент хорошо восстановился, а качество жизни после операции значительно улучшилось.
Сравнение времени анастомоза манжеты предсердия у 56 пациентов
Среди 56 пациентов, которым была выполнена реконструкция манжеты правого предсердия, 23 были выполнены реконструкция заднего предсердного лоскута с вращающейся левой манжетой предсердия, 33 — с помощью патча, 20 — с аортальным патчем и 13 — с перикардиальным патчем. Время анастомоза манжеты правого предсердия составило 20,5 ± 1,99 мин, 22,8 ± 5,2 мин и 23,3 ± 5,3 мин в группах заднего предсердного лоскута, аортального пластыря и перикардиального лоскута соответственно. Анализ с помощью теста Краскела-Уоллиса показал, что время анастомоза лоскута заднего предсердия было значительно короче, чем у аортальных и перикардиальных патчей (P < 0,01); Тем не менее, существенной разницы между аортальным и перикардиальным патчированием не было.
Среди 54 пациентов с правосторонней реконструкцией и без левосторонней реконструкции 21 был выполнен задний лоскут предсердия с вращающейся левой манжетой предсердия, а 33 — реконструкция аортального лоскута-20 с аортальным патчем и 13 — с перикардиальным лоскутом. Время невосстановленного анастомоза манжеты левого предсердия составило 17,5 ± 2,8 мин, 17,7 ± 3,8 мин и 17,6 ± 4,3 мин в группах заднего предсердного лоскута, аортального пластыря и перикардиального лоскута соответственно. Тест Краскела-Уоллиса не выявил статистически значимых различий между группами (рис. 5).
Сравнение частоты повторной реконструкции после восстановления кровотока
Кровоизлияние в анастомотик, требующее повторной реконструкции после восстановления кровотока, произошло у двух пациентов (8,6%), которым была выполнена реконструкция левого предсердного лоскута с вращением левого предсердия, у трех (15,0%) — реконструкция аортального пластыря, у трех (20,0%) — у трех (20,0%) — у тех, кто выполнил реконструкцию перикардиального лоскута. Несмотря на меньшую частоту повторной реконструкции после реконструкции заднего лоскута предсердия с помощью вращающейся манжеты левого предсердия, анализ с использованием критерия хи-квадрат не выявил существенной разницы между группами (χ2 = 0,808, P = 0,667).
Сравнение скорости оттока
Скорость оттока, измеренная с помощью ультразвукового исследования пищевода (рис. 6), показала, что пациенты во всех трех группах имели нормальные каналы оттока легочных вен, без существенных различий в скорости потока между группами как для правой группы (реконструкция задней предсердной муфты с вращающейся левой предсердной манжетой, 53,94 ± 16,3 см/с; реконструкция аортальным лоскутом, 60,0 ± 21,5 см/с; реконструкция перикардиального лоскута, 56,4 ± 17,9 см/с; P > 0,05) или слева (реконструкция заднего предсердного лоскута с вращением левой манжеты предсердия, 64,8 ± 18,1 см/с; реконструкция аортальным лоскутом, 68,8 ± 19,8 см/с; реконструкция перикардиального лоскута, 59,5 ± 16,8 см/с; P > 0,05) легочная вена (рис. 7).
Сравнение УЗИ сердца через 30 дней после операции
Результаты дооперационной и послеоперационной цветной допплерографии сердца не показали статистически значимых различий в предоперационном или послеоперационном систолическом артериальном давлении легочной артерии среди трех групп (P > 0,05) (рис. 8). Тем не менее, послеоперационное систолическое артериальное давление легочной артерии было достоверно ниже, чем до операции систолическое артериальное давление легочной артерии во всех трех группах (реконструкция заднего предсердного лоскута с вращением левой предсердной манжеты, 24,5 ± 7,5 против 41,4 против 41,4 ± 16,6 мм рт.ст., P < 0,01; реконструкция аортального пластыря, 27,6 ± 8,6 против 35,2 против 35,2 ± 11,1 мм рт.ст., P < 0,05; реконструкция перикардиального пластыря 27,7 ± 7,5 против 35,9 ± 14,6 мм рт.ст., P < 0,05).
Сравнение послеоперационной ПГД и периоперационной выживаемости
Более высокая частота ПГД наблюдалась в группе реконструкции левой манжеты заднего предсердия с вращающимся левым предсердием (8,6%), чем в группах реконструкции аортального (5,0%) или перикардиального (13,3%) патча; однако эта разница не была статистически значимой (χ2 = 0,431, P = 0,806). Четыре пациента умерли в периоперационном периоде, одному из которых была выполнена реконструкция задней предсердной лоскута с вращающейся левой манжетой предсердия, а троим – реконструкция аортальной заплаткой (χ2 = 2,515, P = 0,284).
Сравнение клинических данных через 90 дней после операции
Через 90 дней после операции достоверных различий в соответствующих клинических характеристиках между группами не выявлено (табл. 2). Функция легких, измеряемая объемом форсированного выдоха/форсированной жизненной емкостью легких и газами артериальной крови, значительно улучшилась через 90 дней после операции по сравнению с дооперационным периодом; тем не менее, не было существенных различий в этом улучшении между тремя группами (Таблица 1 и Таблица2).
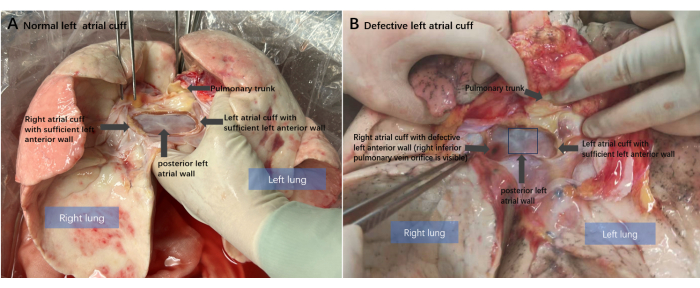
Рисунок 1: Анатомическая схема донорского легкого. (А) Нормальное состояние манжеты левого предсердия донорского легкого после отделения сердца от легкого. Сохранена интактная задняя стенка левого предсердия и достаточная передняя стенка. (Б) Классический дефект передней стенки манжеты левого предсердия донора: передняя стенка предсердия правого донорского легкого отсутствует. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
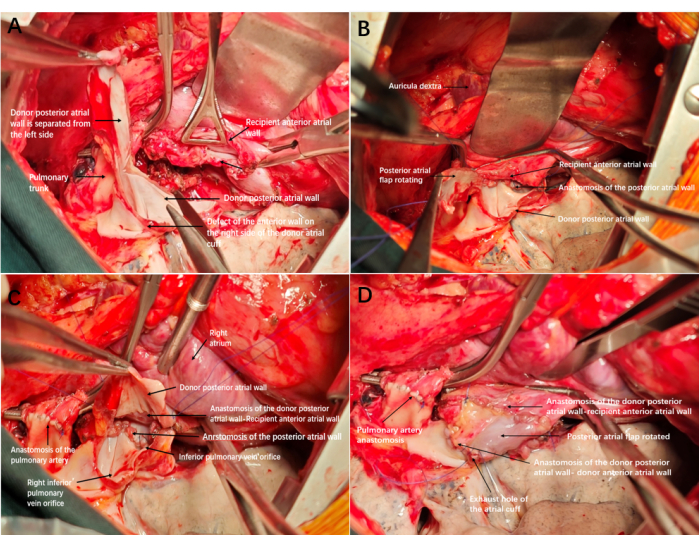
Рисунок 2: Реконструкция и схема анастомоза левой манжеты предсердия. (А) Дефект передней стенки на правой стороне донорской манжеты предсердия; После того, как анастомоз трахеи и артерии завершен, избыточная задняя стенка предсердия разрезается снизу вверх для формирования предсердного лоскута. (Б) Завершение анастомоза задней стенки предсердия. (C) Край предсердного лоскута был анастомозирован к передней стенке манжеты предсердия реципиента, при этом внутренняя мембрана предсердного лоскута была обращена внутрь. (D) Оставшийся край манжеты предсердия был анастомозирован по отношению к передней стенке реципиента. После затяжки и открытия выхлопной трубы манжета хорошо расширялась, без кровотечения и без необходимости повторной реконструкции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
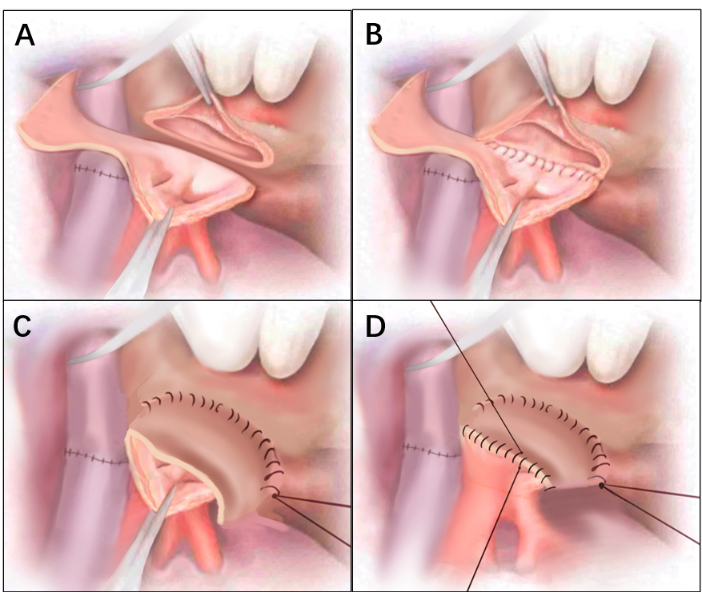
Рисунок 3: Линейные рисунки рисунка 2. (А) Дефект передней стенки на правой стороне манжеты донорского предсердия. После того, как анастомоз трахеи и артерии завершен, избыточная задняя стенка предсердия разрезается снизу вверх для формирования предсердного лоскута. (Б) Завершение анастомоза задней стенки предсердия. (C) Край предсердного лоскута был анастомозирован к передней стенке манжеты предсердия реципиента, при этом внутренняя мембрана предсердного лоскута была обращена к внутренней сторонеd. (D) Оставшийся край манжеты предсердия был анастомозирован по отношению к передней стенке реципиента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
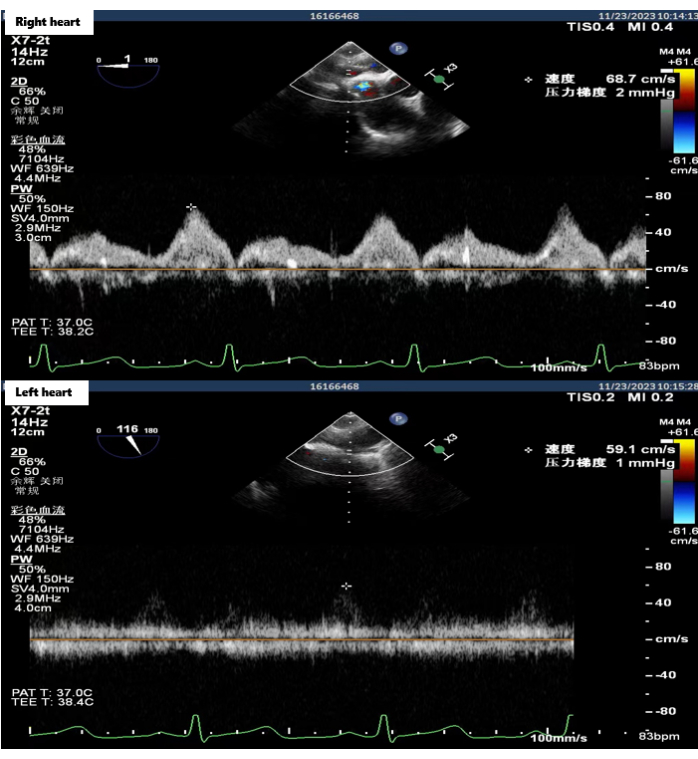
Рисунок 4: УЗИ пищевода скорости двустороннего кровотока предсердного анастомоза. Чреспищеводные ультразвуковые изображения были получены в операционной после завершения всех операций по анастомозу, показывающие, что скорость двустороннего кровотока предсердного анастомоза была нормальной. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
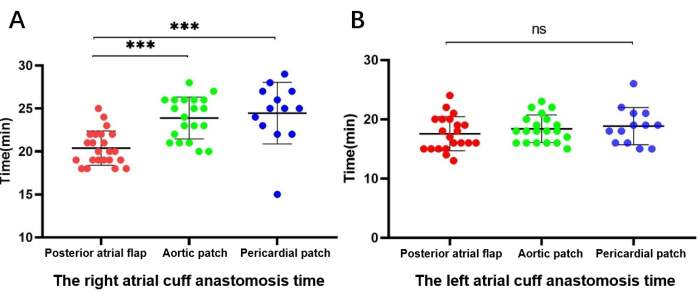
Рисунок 5: Сравнение длительности анастомоза манжеты предсердия. (А) Время анастомоза правосторонней (реконструктивной) манжеты предсердия. (Б) Время анастомоза манжеты предсердия с левой стороны (нереконструированной). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
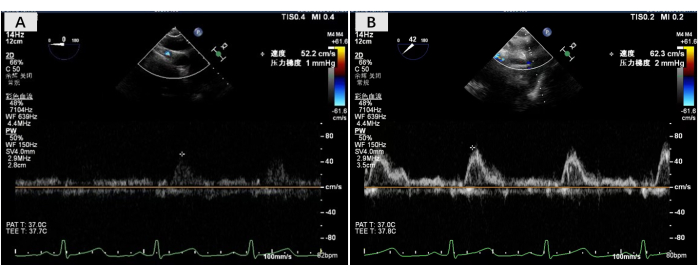
Рисунок 6: УЗИ пищевода для измерения скорости двустороннего оттока. (A) Измерение скорости потока в правом легочном предсердиальном анастомозе. (В) Измерение скорости потока при левом легочном анастомозе предсердий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
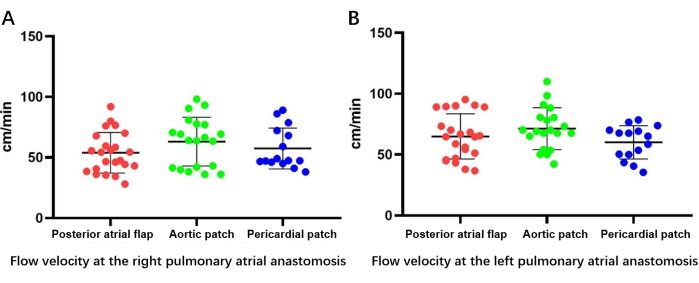
Рисунок 7: Двусторонняя скорость оттока, определенная с помощью ультразвукового исследования пищевода. (А) Измерение скорости потока при анастомозе правого легочного предсердия. (В) Измерение скорости потока при левом легочном анастомозе предсердий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
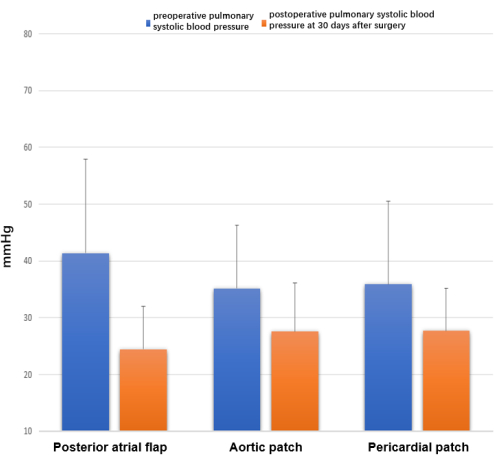
Рисунок 8: Эхокардиография через 30 дней после операции. Наблюдались различия в дооперационном и послеоперационном систолическом артериальном давлении легочной артерии, измеряемом как 4V²TR + RPA мм рт.ст. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Характерный | Методика, используемая для реконструкции манжеты | P-значение | ||
| Лоскут заднего предсердия (N = 23) | Аортальный патч (N = 20) | Перикардиальный патч (N = 15) | ||
| Донор | ||||
| Секс (Ж/М) | 5/18 | 4/16 | 4/11 | нс |
| Возраст (лет) | 35,0 ± 12,9 | 36,1± 12,1 | 36,7± 10,9 | 0.86 |
| Артериальный PO2/FiO2 | 401 ± 102 | 422± 106 | 426 ± 101 | 0.14 |
| Получатель | ||||
| Секс (Ж/М) | 2/21 | 4/16 | 6/9 | - |
| Возраст (лет) | 47,3 ± 21,0 | 52,3± 16,2 | 49,5 ± 21,4 | нс |
| PO2 (мм рт.ст.) | 91,6 ± 21,6 | 106.7±38.3 | 102.2±35.2 | нс |
| PCO2 (мм рт.ст.) | 55,2 ± 21,7 | 54,6 ± 17,3 | 47,4 ± 11,2 | нс |
| SatO2 (%) | 96,6 ± 2,1 | 92,9± 20,3 | 91,9 ± 17,3 | нс |
| ОФВ1/ФЖЕЛ | 49,4 ± 23,9 | 48,7± 30,0 | 63,7 ± 26,0 | нс |
| PAP (см/с) | 38,8 ± 17,9 | 44,4± 23,0 | 39,1 ± 24,4 | нс |
Таблица 1: Исходные характеристики доноров и реципиентов трансплантатов легких. Значения представлены в виде среднего ± стандартного отклонения. Для сравнения групп был использован тест Краскела-Уоллиса. Сокращения: F = женский; ОФВ1 = объем форсированного выдоха; FiO2 = доля вдыхаемого кислорода; ФЖЕЛ = форсированная жизненная емкость; M = мужчина; PAP = давление в легочной артерии; PCO2 = парциальное давление двуокиси углерода; PO2 = парциальное давление кислорода; SatO2 = насыщение кислородом.
| Характерный | Методика, используемая для реконструкции манжеты | P-значение | ||
| Лоскут заднего предсердия (N = 23) | Аортальный патч (N = 20) | Перикардиальный патч (N = 15) | ||
| РО2 | 113,2 ± 24,1 | 97,3 ± 27,5 | 98,8 ± 27,0 | нс |
| PCO2 | 40,4 ± 5,7 | 39,2 ± 10,8 | 36,4 ± 7,2 | нс |
| СбО2 | 98,1 ± 0,9 | 93,0 ± 21,1 | 93,7 ± 16,7 | нс |
| ОФВ1/ФЖЕЛ | 86,1 ± 10,3 | 87,1 ± 19,4 | 81,9 ± 17,6 | нс |
Таблица 2: Клинические характеристики реципиентов трансплантата легкого через 90 дней после операции. Значения представлены в виде среднего ± стандартного отклонения. Для сравнения групп был использован тест Краскела-Уоллиса. Сокращения: ОФВ1 = объем форсированного выдоха; ФЖЕЛ = форсированная жизненная емкость; PCO2 = парциальное давление двуокиси углерода; PO2 = парциальное давление кислорода; SatO2 = насыщение кислородом.
Обсуждение
В период с 2021 по 2023 год команда Второй больницы Чжэцзянского университета/Центра трансплантации легких Уси провела 931 трансплантацию легких, из которых 71 была связана с реконструкцией донорской манжеты левого предсердия. Чтобы уменьшить гетерогенность, в это исследование было включено только 58 трансплантаций двух легких. Искусственные пластыри редко используются в нашем центре, и поэтому они не были включены в данное исследование.
Время анастомоза на стороне реконструкции было значительно короче в группе реконструкции с помощью вращающейся манжеты заднего предсердного лоскута, чем в группах реконструкции аорты и перикардиального патча, что указывает на то, что новая хирургическая техника эффективно сократила время операции. Не было никакой разницы во времени анастомоза на невосстановленной стороне, что предполагает хирургическую последовательность, что указывает на то, что разница во времени анастомоза на восстановленной стороне была обусловлена разницей в технике.
Ультразвуковое исследование пищевода показало, что существенной разницы в скорости двустороннего выходного потока не было, что свидетельствует о целесообразности нового подхода. УЗИ сердца и результаты лечения пациентов также показали хорошее краткосрочное восстановление после применения нового метода, без существенных различий в краткосрочных осложнениях и побочных реакциях по сравнению с традиционным методом реконструкции с помощью пластыря. Это также было подтверждено оценкой функции легких и газов артериальной крови через 90 дней после трансплантации.
Чтобы обеспечить ровный кровоток в легочной вене, во время трансплантации легкого необходимо анастомозировать левую манжету предсердия3. При экстракции донорского легкого идеальная сердечно-легочная сепарация требует сохранения интактной манжеты левого предсердия, включая интактную заднюю и адекватную переднюю стенку предсердия2. Дефекты манжеты предсердий являются распространенными травмами, полученными во время извлечения донорского легкого3, когда необходимость использования как сердца донора, так и легкого часто приводит к конкуренции в некоторых анатомических областях, особенно в области левого предсердия, что может привести к дефекту манжеты предсердия в донорском легком7. Вопрос о том, следует ли проводить донорскую сердечно-легочную сепарацию in vivo или in vitro , остается спорным.
В настоящее время сердечно-легочная сепарация in vivo является предпочтительным методом 2,8. Тем не менее, сердечно-легочная сепарация in vitro может лучше обнажить область левого предсердия, где может существовать сердечно-легочная конкуренция5. Дефект передней стенки предсердий правостороннего донорского легкого является наиболее распространенным типом дефекта манжеты предсердия донора из-за наличия межпредсердной борозды4. Тщательная диссекция и диссоциация межпредсердной борозды позволяет лучше обнажить стенку левого переднего предсердия с правой стороны и предотвратить дефекты манжеты предсердия правого донорского легкого3.
При возникновении дефектов манжеты предсердий интраоперационный анастомоз становится более сложным, и часто необходимо формировать и реконструировать манжету предсердия для предотвращения кровотечения и связанных с ним осложнений канала венозного оттока, что увеличивает время холодной ишемии. Исследования показали, что, хотя длительное время ишемии холода из-за увеличения продолжительности анастомоза не влияет на долгосрочную выживаемость, оно может повлиять на выживаемость через 90 дней после операции и увеличить риск осложнений со стороны дыхательныхпутей. Дефекты манжеты предсердия также приводят к понижению рейтинга доноров с идеального до предельного10.
При возникновении дефектов манжеты предсердий принудительный анастомоз с натяжением или раздельный анастомоз верхних и нижних легочных вен увеличивает риск обструкции канала венозного оттока11. Вместо этого немного более компактный задний анастомоз предсердий и более свободный, не требующий напряжения передний анастомоз могут открыть канал оттока левого предсердия. Hammond et al.5 представили использование перикардиальной ткани, прилегающей к легочной вене, для реконструкции, что привело к широкому и гладкому анастомозу манжеты предсердия и скорости двустороннего перфузионного потока, соответствующей реципиенту. Было высказано мнение, что прямой анастомоз периферического перикарда без укрепления культи легочной вены к перикарду может снизить риск блокировки или сужения отверстия вены12. Доступность перикардиальной ткани и ее хорошие результаты делают ее наиболее важным материалом для реконструкции манжетного пластыря предсердия. Sugimoto et al.6 сообщили о методе использования избыточной донорской легочной артерии для реконструкции манжет предсердий с хорошими хирургическими результатами. Тем не менее, не было сообщений об использовании избыточной задней стенки левого предсердия донорского легкого для реконструкции дефектов передней стенки.
В этой статье мы представляем новый метод реконструкции донорской манжеты предсердия, названный методом реконструкции левой предсердной манжеты с вращением заднего предсердного лоскута, а также сравниваем и анализируем его безопасность. С точки зрения хирургии, метод реконструкции левой манжеты заднего предсердия с вращением лоскута предсердия является более удобным и быстрым, так как он не требует формирования манжеты предсердия in vitro , но может быть восстановлен непосредственно во время анастомоза. Более того, поскольку реконструируемый участок изготавливается из той же предсердной ткани, тканевая совместимость хорошая, и обеспечивается максимальное сохранение кровоснабжения восстановленного участка. Что касается прогноза, метод лоскута заднего предсердия может сохранить переднюю манжету предсердия свободной после анастомоза и уменьшить возникновение осложнений, связанных с венозным оттоком, кровотечением и реконструкцией, по сравнению с методами реконструкции пластыря, а также уменьшить время холодной ишемии за счет более быстрого анастомоза. Этот простой хирургический метод обеспечивает осуществимую стратегию реконструкции дефектов манжеты предсердий в донорской легочной вене с хорошими клиническими результатами.
Данное исследование имеет определенные ограничения. Например, статистическая разница в соотношении реципиентов мужского и женского пола среди трех групп и невозможность поддерживать одинаковое качество донорских легких из-за сложности трансплантации легких могли повлиять на результаты исследования. Этот метод применим только к наиболее распространенному типу дефекта манжеты предсердия, дефекту передней стенки предсердия, и требует неповрежденной задней стенки предсердия. Если стенка заднего предсердия неполная, требуется накладная реконструкция или другие методы формирования.
В заключение данного исследования описан новый метод реконструкции манжеты левого предсердия донорского легкого. Этот новый метод может эффективно устранять дефекты передней стенки манжеты предсердия во время трансплантации легких путем вращения заднего предсердного лоскута. Несмотря на то, что не наблюдалось существенных различий в частоте осложнений и венозной обструкции в краткосрочной перспективе между методами реконструкции заднего предсердного лоскута и пластыря, использование метода заднего предсердного лоскута эффективно сократило время анастомоза манжеты предсердия. По сравнению с традиционным методом реконструкции с помощью пластыря, он также снижает сложность операции и имеет потенциал для снижения риска долгосрочных осложнений, таких как ишемия анастомоза и тромбоз стенки. Таким образом, этот метод обеспечивает осуществимую стратегию реконструкции дефекта манжеты предсердия и может улучшить эффективный коэффициент использования донорских легких.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Данное исследование было поддержано Национальной программой ключевых исследований и разработок Китая. (Проект No 2023YFC2507100).
Материалы
| Name | Company | Catalog Number | Comments |
| ACE+7 SHEARS | ETHICON | HARH23 | |
| Articulating Endoscopic Linear Cutter | ETHICON | PSEE45A | |
| Atraumatic tissue forceps | Delacroix-Chevalier | DC13200-24/DC13200-20 | |
| Atrial blocjing forceps | Delacroix-Chevalier | DC40672-26/DC40673-26 | |
| Blue monofilament non-absortable suture (4-0) | ETHICON | REF8521 | |
| Blue monofilament non-absortable suture (5-0) | ETHICON | HS6856 | |
| Bronchoscope | OLYMPUS | BF-Q170 | |
| Coated vicryl plus antibacterial suture (1-0) | ETHICON | VCP359 | |
| Diagnostic Ultrasound System | PHILIPS | EPIQ 7C | |
| Diprivan Injection | AstraZeneca | 1%w/v | |
| Disposable Skin Stapler | Pride | P-PF-35R | |
| ECMO | Maquet | CARDIOHELP-i | |
| Electrosurgical Pencil | AESCULAP | GN300 | |
| Needle Holder | Delacroix-Chevalier | DC51170-24/G30154 | |
| Negative pressure suction device | SMAF | YX930 | |
| PDS II absorbable suture (4-0) | ETHICON | W9109 | |
| Pulmonary artery blocking forceps | Delacroix-Chevalier | DC13010-23/DC13010-23 | |
| Remifentanil Hydrochloride Injection | CNPIC | H20223422 | |
| Thoratrak MICS Retractor System | Medtronic | 28605 | |
| Tissue scissors | Delacroix-Chevalier | B25925 |
Ссылки
- Young, K. A., Dilling, D. F. The future of lung transplantation. Chest. 155 (3), 465-473 (2019).
- Copeland, H., et al. Donor heart and lung procurement: A consensus statement. J Heart Lung Transplant. 39 (6), 501-517 (2020).
- Sundaresan, S., Trachiotis, G. D., Aoe, M., Patterson, G. A., Cooper, J. D. Donor lung procurement: assessment and operative technique. Ann Thorac Surg. 56 (6), 1409-1413 (1993).
- Oto, T., et al. Techniques of reconstruction for inadequate donor left atrial cuff in lung transplantation. Ann Thorac Surg. 81 (4), 1199-1204 (2006).
- Hammond, G. L., Franco, K. L., Baldwin, J. C. Method of single-lung transplantation in the absence of a left atrial cuff. Ann Thorac Surg. 54 (2), 379-380 (1992).
- Sugimoto, S., et al. Pulmonary artery patch for an inadequate donor atrial cuff in the absence of donor pericardium in lung transplantation. Surg Today. 47 (3), 399-401 (2017).
- Contreras, F. J., et al. Dual procurement of lung and heart allografts does not negatively affect lung transplant outcomes. J Surg Res. 259, 106-113 (2021).
- Copeland, H., Copeland, J., Hayanga, J. W. A. Cardiac and pulmonary donor procurement. Curr Opin Organ Transplant. 23 (3), 281-285 (2018).
- Mulvihill, M. S., et al. The association of donor age and survival is independent of ischemic time following deceased donor lung transplantation. Clin Transplant. 31 (7), (2017).
- Courtwright, A., Cantu, E. Evaluation and management of the potential lung donor. Clin Chest Med. 38 (4), 751-759 (2017).
- Gamez, P., Alvarez, R., Hernández, H., Córdoba, M., De Pablo, A. Lung transplantation: how to do the venous anastomosis when the pulmonary graft has no auricular cuff. J Heart Lung Transplant. 24 (8), 1123-1125 (2005).
- Yarbrough, W. M., et al. Alternative technique for salvage of donor lungs with insufficient atrial cuffs. Ann Thorac Surg. 88 (4), 1374-1376 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены