Voltammétrie cyclique
Vue d'ensemble
Source : Laboratoire du Dr Kayla Green — Texas Christian University
Une expérience de voltampérométrie cyclique (CV) implique l’analyse d’un éventail de tensions potentielles pendant la mesure actuelles. Dans l’expérience de CV, le potentiel d’une électrode immergée, stationnaire est scanné d’un potentiel départ prédéterminé jusqu'à une valeur finale (appelée la commutation possible) puis l’analyse inverse est obtenu. Cela donne un balayage « cyclique » potentiels et le courant contre la courbe de potentiel provenant des données s’appelle un voltamogramme cyclique. Le premier volet est appelé le « scan vers l’avant » et la vague de retour est appelée le « balayage inverse ». Les potentielles extrêmes sont appelées la « fenêtre de scan ». L’ampleur de la réduction et l’oxydation des courants et la forme de la voltampérogrammes sont fortement tributaires de la concentration de l’analyte, le taux de balayage et des conditions expérimentales. En faisant varier ces facteurs, voltamétrie cyclique peut donner des informations relatives à la stabilité de l’état d’oxydation de métaux de transition dans la forme complexée, la réversibilité des réactions de transfert d’électrons et des informations concernant la réactivité. Cette vidéo vous expliquera les réglages de base pour une expérience de voltampérométrie cyclique, y compris la préparation de l’analyte et de mettre en place la cellule électrochimique. Une expérience de voltampérométrie cyclique simple sera présentée.
Procédure
1. préparation de la Solution d’électrolyte
- Préparer une solution mère d’électrolyte (10 mL), composée de 0,1 M [Bu4N] [BF4] CH3CN.
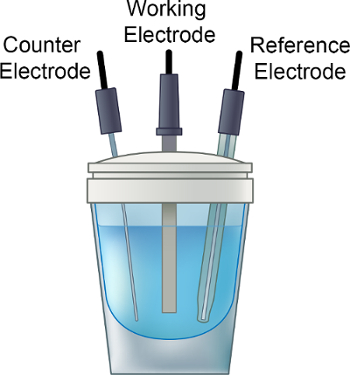
- Placer la solution d’électrolyte dans le flacon électrochimique, ajouter un petit et placer le capuchon sur le flacon, comme illustré à la Figure 1.
- Vérifier que la tête de l’azote est dans la solution d’électrolyte. Remuer et dégazer la solution d’électrolyte avec un léger courant de gaz de2 sec N (
Résultats
Une analyse de CV du ferrocène à 300 mV/s dans l’acétonitrile a été réalisée et le voltamogramme correspondant est illustré à la Figure 2.
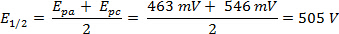
La ΔE peut être dérivé des données dans la Figure 2 , basé sur la différence entre Epa et Epc.
Log in or to access full content. Learn more about your institution’s access to JoVE content here
References
- Bard, A. J., Faulkner, L. A. Electrochemical methods: Fundamentals and Applications. 2nd ed. New York: Wiley; 833 p. (2001).
- Geiger, W. E., Connelly, N. G. Chemical Redox Agents for Organometallic Chemistry. Chem Rev. 96 (2), 877-910, (1996).