Voltametria Cíclica (CV)
Visão Geral
Fonte: Laboratório da Dra.
Um experimento de Voltammetry Cíclica (CV) envolve a varredura de uma série de tensões potenciais enquanto mede a corrente. No experimento cv, o potencial de um eletrodo estacionário imerso é escaneado a partir de um potencial inicial predeterminado para um valor final (chamado de potencial de comutação) e, em seguida, a varredura reversa é obtida. Isso dá uma varredura 'cíclica' de potenciais e a curva atual versus potencial derivada dos dados é chamada de ciclomograma cíclico. A primeira varredura é chamada de "varredura para a frente" e a onda de retorno é chamada de "varredura reversa". Os extremos potenciais são denominados de "janela de varredura". A magnitude das correntes de redução e oxidação e a forma dos voltammogramas são altamente dependentes da concentração de analitos, taxas de varredura e condições experimentais. Ao variar esses fatores, a voltametria cíclica pode produzir informações sobre a estabilidade do estado de oxidação metálica de transição na forma complexa, reversibilidade das reações de transferência de elétrons e informações sobre a reatividade. Este vídeo explicará a configuração básica para um experimento de voltametria cíclica, incluindo preparação de analitos e configuração da célula eletroquímica. Um simples experimento de voltammemetria cíclica será apresentado.
Procedimento
1. Preparação da Solução de Eletrólitos
- Prepare uma solução de estoque de eletrólitos (10 mL) composta de 0,1 M [Bu4N][BF4] em CH3CN.
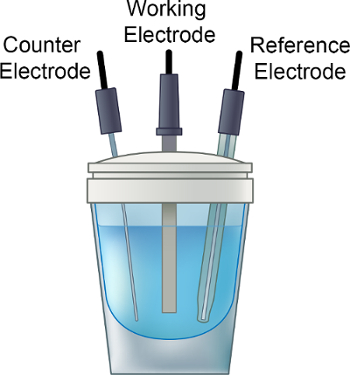
- Coloque a solução de eletrólito no frasco eletroquímico, adicione uma pequena barra de mexida e coloque a tampa no frasco, conforme mostrado na Figura 1.
- Verifique se o chumbo nitrogênio está na solução de eletrólitos. Mexa e desgase a solução de eletrólitos com um fluxo suave de gás N2 seco (~10 min
Resultados
Foi realizada uma varredura cv de ferrocene a 300 mV/s em acetonitrila e o voltammograma correspondente é mostrado na Figura 2.
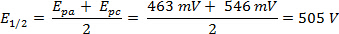
O ΔE pode ser derivado dos dados na Figura 2 com base na diferença entre Epa e Epc.
Log in or to access full content. Learn more about your institution’s access to JoVE content here
Referências
- Bard, A. J., Faulkner, L. A. Electrochemical methods: Fundamentals and Applications. 2nd ed. New York: Wiley; 833 p. (2001).
- Geiger, W. E., Connelly, N. G. Chemical Redox Agents for Organometallic Chemistry. Chem Rev. 96 (2), 877-910, (1996).
Tags
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados