A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חלקיק יחיד מיקרוסקופית אלקטרונים שיקום במתחם Exosome שימוש בשיטה אקראיים הטיה חרוטי
In This Article
Summary
מאמר זה מתאר שיטה סטנדרטית לקבל תלת ממדי (3D) שחזור של מקרומולקולות ביולוגיות באמצעות מיקרוסקופ אלקטרונים מכתים שלילי (EM). בפרוטוקול זה, אנו מסבירים כיצד לקבל את מבנה 3D של מורכבות exosome cerevisiae Saccharomyces ברזולוציה בינונית באמצעות שחזור אקראי חרוטי להטות את השיטה (RCT).
Abstract
חלקיק יחיד מיקרוסקופית אלקטרונים (EM) שחזור לאחרונה הפך לכלי פופולרי כדי לקבל את תלת ממדי (3D) מבנה של קומפלקסים macromolecular גדול. לעומת קריסטלוגרפיה רנטגן, יש לו כמה יתרונות ייחודיים. ראשית, אחד החלקיקים EM שחזור לא צריך לגבש את המדגם חלבון, המהווה את צוואר הבקבוק קריסטלוגרפיה רנטגן, במיוחד עבור מתחמי macromolecular גדול. שנית, זה לא צריך כמויות גדולות של דגימות חלבון. לעומת מיליגרם של החלבונים הדרושים התגבשות, יחיד שחזור EM החלקיקים רק צריך כמה מיקרו ליטר פתרון חלבון ננו טוחנת ריכוזים, באמצעות צביעה בשיטה שלילי EM. עם זאת, למרות כמה אסיפות macromolecular עם סימטריה גבוהה, חלקיק יחיד EM מוגבל ברזולוציה נמוכה יחסית (ברזולוציה נמוכה יותר מאשר 1 ננומטר) עבור דגימות רבים במיוחד אלה ללא סימטריה. טכניקה זו היא מוגבלת גם על ידי גודל של מולקולות הנחקרת, כלומר 100 kDa עבור דגימות מוכתם שלילי 300 kDa עבור קפוא hydrated דגימות בכלל.
עבור מדגם חדש של מבנה ידוע, אנחנו בדרך כלל להשתמש בפתרון מתכות כבדות להטביע את המולקולות על ידי מכתים שלילי. הדגימה נבדקת אז מיקרוסקופ אלקטרונים הילוכים לקחת דו ממדי (2D) micrographs של המולקולות. באופן אידיאלי, מולקולות חלבון יש מבנה 3D הומוגנית אבל התערוכה אוריינטציות שונות micrographs. Micrographs אלה דיגיטציה ומעובד מחשבים כמו "חלקיקי בודד". שימוש דו מימדי יישור וטכניקות סיווג, מולקולות הומוגנית בתצוגות אותו מקובצים לתוך הכיתות. הממוצעים שלהם לשפר את האות של צורות 2D של המולקולה. אחרי שאנחנו להקצות את חלקיקי עם אוריינטציה היחסי הנכון (זוויות אוילר), נוכל לשחזר את תמונות החלקיקים 2D לתוך נפח 3D הווירטואלי.
בשחזור חלקיק בודד 3D, צעד חיוני היא נכונה להקצות את הכיוון הנכון של כל חלקיק יחיד. ישנן מספר שיטות כדי להקצות את התצוגה עבור כל חלקיק, כולל בריאורגניזציה זוויתי 1 ו אקראי להטות חרוטי (RCT) שיטה 2. בפרוטוקול זה, אנו מתארים תרגול שלנו מקבל את שחזור 3D מורכבים תוך שימוש בשמרים exosome מכתים EM שלילי RCT. יצוין כי הפרוטוקול שלנו במיקרוסקופ אלקטרונים ועיבוד תמונה כדלקמן את העיקרון הבסיסי של RCT אבל היא לא הדרך היחידה לבצע את השיטה. אנחנו הראשונים מתארים כיצד להטביע את דגימת החלבון לתוך שכבת Formate-Uranyl עם עובי דומה לגודל חלבון, באמצעות רשת פחמן המחוררת מכוסה בשכבה של הסרט רצוף פחמן דקה. לאחר מכן הדגימה מוכנס לתוך מיקרוסקופ אלקטרונים הילוכים לאסוף untilted (0 מעלות) ו מוטה (55 מעלות) זוגות micrographs שישמש מאוחר יותר לצורך עיבוד וקבלת מודל 3D הראשונית של exosome את השמרים. לשם כך, אנו מבצעים RCT ולאחר מכן לחדד את מודל 3D הראשוני באמצעות הקרנת התאמת שיטת חידוד 3.
Protocol
1. עקרון השיטה הטיה אקראית חרוטי
- העיקרון של השיטה להטות אקראי חרוטי מחייב לקיחת זוג micrographs של אותו האזור של הדגימה בתוך מיקרוסקופ אלקטרונים. תמונה אחת נלקחת של הדגימה במצב untilted (איור 1A) והתמונה אחרים נלקחת של הדגימה נטוי בזווית שבין 50 עד 70 מעלות (במקרה שלנו, אנו משתמשים 55 מעלות). (איור 1B)
- שימוש במחשב, זוג מיקרוסקופ דיגיטציה היא לשים זה לצד זה תמונות החלקיקים זהה נבחרו. (תרשים 1C)
- ב תלת ממדי קואורדינטות, תמונות של חלקיקים untilted ושותפים מוטה שלהם מתואמים זה לזה בכיוון של ציר להטות את זווית ההטיה. (איור 1D)
- יישור של תמונות החלקיקים untilted מביא את התמונות של חלקיקים מוטה azimuthal במקומות המתאימים. (איור 1E)
- באמצעות מספר רב של תמונות של חלקיקים מוטה ממלא את החלל azimuthal, מבנה תלת ממדי של המולקולה ניתן לשחזר באמצעות אלגוריתם גב ההקרנה. (איור 1F)
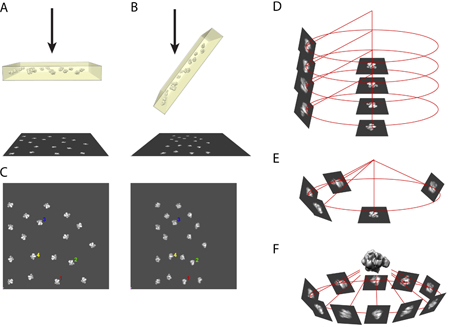
באיור 1. האיור של עקרון עבור RCT השיקום.
2. הכן את רשתות המחוררת של פחמן מכוסה פחמן דק
רציונל: אנו משתמשים בשיטה מכתים שלילי כדי לתקן את דגימת חלבון לשיקום אקראי להטות חרוטי. על מנת לשמר את מקרומולקולות בלי יותר מדי משטחת במהלך הייבוש, אנו מנסים להטביע את מולקולות החלבון כתם עמוק בעובי כ - מימד של חלבונים 4. באופן כללי, פחמן רציף המשמש בייצור דגימות מוכתם שלילי. סוג כזה של פחמן, לעומת זאת, קשה לשלוט על עובי כתם סביב חלקיקי חלבון. כך אנו לשימוש ביתי מתוצרת רשתות המחוררת פחמן מכוסים בשכבה דקה של סרט פחמן (~ 5 עובי ננומטר) לבצע דגימות מוכתם שלילי. בארות הקטנה שהוקמה על ידי החורים מאפשרים שמירה על פתרון חלבון הפתרון כתם על הרשת, כך זה הרבה יותר קל להטביע חלבון עובי כתם אופטימלית. יתרה מכך, שכבה דקה של פחמן מעל החור מפחית את רעשי הרקע באופן משמעותי.
- הכן פתרון Formvar 0.5%. ב למכסה המנוע קטר, להוסיף 0.45 גר 'שרף פוליוויניל פורמלית כלורופורם 90 מ"ל וכוס זכוכית 100 מ"ל. השתמש בנייר אלומיניום כדי לכסות את הכוס, ולהשתמש בר ומערבבים קטן כדי לעזור המסת שרף רשמית על stirrer מגנטי. זה לוקח בערך 15 דקות לפזר את שרף.
- במהלך פירוק Formvar, זכוכית מיקרוסקופ נקי שקופיות מתנול ולנגב יבש עם Kimwipes.
- אחרי שרף Formvar מתמוסס באופן מלא כלורופורם, להוסיף 1 מ"ל גליצרול 50% על פני השטח של הפתרון. התאמת עוצמת הקול של גליצרול הוסיף משפיע על צפיפות החורים הפחמן המחוררת. טובלים את קצה ultrasonicator בפתרון בעומק כ - 1 ס"מ ולהשתמש כוח מרבי sonicate 1 דקות להכין אמולסיה של טיפות גליצרול בפתרון Formvar. הפתרון הופך חלבי לאחר שלב זה. Sonication ארוכים גורמת גודל קטן יותר של חורים על הפחמן המחוררת.
- מיד לאחר sonication, לטבול את השקופיות זכוכית לנקות במאונך לתוך האמולסיה לשנייה 1, לקחת אותם החוצה, כתם תחתית של שקופיות שימוש בנייר מסנן כדי ליצור סרט פלסטי דק על פני השטח של השקופיות. לאחר מתאדה choloroform, לבדוק את צפיפות וגודל החורים בסרט תחת מיקרוסקופ אור. התאם את תנאי ההכנה על פי הצרכים. עם המצב המתואר כאן, אנחנו בדרך כלל להשיג חורים בקוטר של 3 ~ 4 מיקרו מטר 10 ~ 20 חורים כל ריבוע של רשת 400 רשת.
- לאחר שקופיות הזכוכית יבשים, לחתוך את הקצה של הסרט פלסטיק על פני השקופית. Float את הסרט על פני השטח של מים מזוקקים. הסרט דק על פני המים ניתן להבחין בזווית מציצה נגד השתקפות האור. 400-רשת Place רשתות נחושת על הסרט אחד לאחד, עם משטח חלק של רשתות כלפי מטה.
- הרם את הסרט פלסטיק עם רשתות על אותו באמצעות פיסת נייר. תהפכו את הנייר ולתת לו להתייבש בצלחת פטרי. משרים את הנייר מתנול כדי להסיר את שיירי גליצרול בתוך חורים ולתת הנייר יבש באוויר.
- המעיל רשתות בשכבה של פחמן בעובי של 20 ננומטר ב ~ המאייד פחמן. עובי יכול להיות נקבע על ידי הצבע האפור של פחמן.
- משרים את רשתות עם פחמן כלורופורם חצי שעה להסיר את Formvar. אחרי רשתות הם מיובשים, השגנו תוצרת רשתות המחוררת פחמן.
- להתאדות שכבה דקה של פחמן עם ננומטר 5 על עובי על גבי משטח מיקה ביקע טרי.
- בזהירות את רשתות פחמן המחוררת מתחת מים מזוקקים. Float הפחמן דק מפני השטח נציץ אל פני המים להפקיד אותו על הפחמן המחוררתרשתות לאט. יבש את רשתות במנדף קטר.
3. מכתים שלילי של קומפלקס Exosome
רציונל: יש בהחלט כמה פתרונות מתכות כבדות כתם שניתן להשתמש בהם עבור EM מכתים שלילי, כולל אצטט uranyl, formate uranyl, חומצה phosphotungstic, molybdate אמוניום, ואחרים. פתרון כתם שונים יש מאפיינים ייחודיים שונים. למשל, אצטט uranyl מספק ניגודיות גבוהה של החלקיקים אך עלול לקרוס קומפלקסים חלבונים שלא כמו הסביבה החומצית. לקבלת דוגמיות אלה, חומצה phosphotungestic ב-pH נייטרלי יכול להיות פתרון טוב כתם. אנחנו בוחרים Formate Uranyl רווי (UF) פתרון בשל גרעיניות קנס שלה יכולת חדירה גבוהה למולקולות.
- מרתיחים מים מזוקקים דקות 1. מגניב זה לאט לטמפרטורת החדר. צעד זה היא להסיר את החמצן המומס מהמים.
- הפוך את Formate טרי 2% Uranyl (UF) פתרון. מערבבים 1 מ"ל מים ו - 20 מ"ג UF בצינור 1.5 מ"ל. מערבולת של 10 דקות.
- כוון את ערך ה-pH ל 5.0 על ידי הוספת 2 microliter של הידרוקסיד M 10 אשלגן. מערבבים מיד. הצבע הפתרון צריך להיות צהוב יותר. ה-pH של התמיסה לא אמור להיות גבוה מדי, אחרת הכתם משקעים.
- שים את הצינור על vortexer דקות אחר 10.
- ספין הפתרון על צנטריפוגה שולחנית במהירות המרבית עבור 10 דקות.
- סנן את הפתרון דרך קרום PVDF 0.2 מיקרומטר. זהו הפתרון UF טריים. מכסים את הצינור פתרון בפיסת נייר אלומיניום כדי למנוע אור. הפתרון צריך להיות בשימוש באותו יום.
- פריקה זוהר הרזה פחמן-over-המחוררת רשת הפחמן באמצעות מנגנון זוהר פריקה למשך 30 שניות בכל 25 mA הנוכחי.
- שים חתיכת parafilm נקי על הספסל. לשים 3 טיפות של תמיסת microliter 50 UF כתם על גבי parafilm.
- לדלל את מורכבות exosome לריכוז של 50 ~ 100 ננומטר באמצעות חיץ דילול (25 מ"מ טריס-HCl pH 7.5, 100 mM NaCl, 2 מ"מ DTT). שים 4 microliter של חלבון מדוללת על הרשת, זוהר משוחררים. בואו המדגם להישאר על הרשת למשך דקה אחת. (הערה:. כזה ריכוז סופי של מולקולות בדרך כלל נותן צפיפות אופטימלי של חלקיקים מפוזרים היטב על רשת מוכתם שלילי עבור formate uranyl או acecate uranyl פתרון הכתם, פוספט או ריכוז גבוה של מלח (יותר מ 0.5 מ ') באופן כללי היא לא טוב מניב תוצאות טובות מכתים. מנסיוננו עולה כי Hepes או צינורות לעבוד היטב עם פתרונות uranyl כתם.)
- השתמש פיסת נייר סינון למחוק את הפתרון שיורית מהקצה של הרשת ולהפוך את הרשת באופן מיידי על גבי טיפות הכתם ולשטוף את הרשת למשך כ -10 שניות על כל טיפה.
- לאחר שעבר שטיפה, תנו להישאר כתם על רשת 1 דקות אחר ואז למחוק את הכתם ממנו על ידי פיסת נייר הסינון. שמור על שכבה דקה של פתרון הכתם על פני השטח רשת על מנת לקבל תוצאות טובות כתם עמוק. תנו לרשת יבש במהירות במנדף קטר.
4. מיקרוסקופית אלקטרונים של קומפלקס Exosome
רציונל: כל אלקטרון הולכה מיקרוסקופ עם שלב הטיית ניתן להשתמש כדי לאסוף זוגות הטיה של הדגימה עבור RCT השיקום. בתיאוריה, גבוה יותר את הדגימה זווית יכול להיות מוטה כדי לאסוף נתונים, כן ייטב. בפועל, בשל העיצוב של בעל הדגימה את הגיאומטריה של הרשת, זווית מפורמט המרבי מוגבל 50-70 מעלות. בפרוטוקול זה, אנו רק לתאר את ההליך שלנו באמצעות Tecnai-12 פיי מיקרוסקופ אלקטרונים. עבור דגמים אחרים של מיקרוסקופים, הפעילות צריך להיות מותאם על פי דרישה של הפרויקט רכוש של המכשיר.
- מכניסים את רשת מדגם בעל מדגם ולאחר מכן לשים את המחזיק לתוך מיקרוסקופ אלקטרונים פיי Tecnai -12. מיקרוסקופ מופעל על kV 120. אנו משתמשים Gatan Ultrascan4000 מצלמה CCD לצלם. ודא כי "פליפ סביב הציר האנכי" דיאלוג "מצלמה config" של ממשק מיקרוסקופ דיגיטלי אינה מסומנת על מנת להבטיח את הנחישות handedness הנכון. (הערה:. זה חשוב במיוחד אם הקורא מסתמך על נהלים SPIDER RCT שחזור לקבל מודל 3D)
- בדוק את רשת מדגם בהגדלה נמוכה כדי למצוא את הריבועים מוכתם הטוב ביותר. סוג כזה של ריבועים צריך תריסר חורים עם ממד של כ 1 ~ 2 מיקרומטר ושטחים כתם כהה בהם. (איור 2)

איור 2. מיקרוסקופ בהגדלה נמוכה של רשת מראה ריבועים עם כתמים טוב ורע. - הפעל מצב מינון נמוך של ממשק משתמש פיי ליישר את החיפוש, להתמקד ולחשוף עמדה במצב במינון נמוך. אנו משתמשים בהגדלה של 150,000 עבור המוקד, 52,000 עבור חשיפה מצלמה 1.5 מטר אורך עקיפה לחיפוש. זמן החשיפה מותאם 1 השני. קבע את המיקום להתמקד 2 מיקרומטר הרחק pos חשיפהition לאורך ציר הטיה.
- מצא את החורים עם מכתים טוב במצב חיפוש, ולשמור את המיקומים. החורים טוב בדרך כלל יש שיפוע כתם כהה בהם נצפתה תחת מצב החיפוש. קח תמונה CCD של הכיכר. הטה את הדגימה עד 55 מעלות, לצלם תמונה נוספת. השווה את שתי התמונות, לזהות את החורים לזווג בין שתי micrographs. (איור 3)
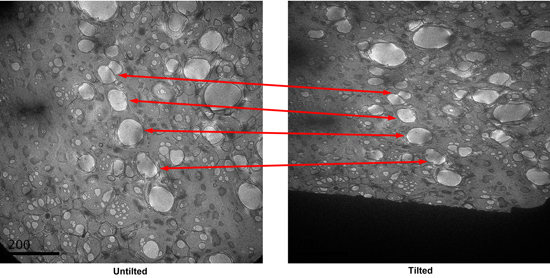
איור 3. זוג הטיה של micrographs של ריבוע במצב החיפוש. חורים לזווג מקבילים מצוינים. - הטה את הבמה בחזרה במידה 0. באמצעות ערכת במינון נמוך לצלם כל חור מזוהה במצב החיפוש בהגדלה גבוהה. Defocus משמש הוא כ -0.7 מיקרומטר.
- אחרי כל החורים ננקטו תמונות, להטות את הבמה כדי 55 מעלות. קח micrographs של הדגימה מוטה בהגדלה זהה לאלה untilted עם defocus של כ -1.2 מיקרומטר. זהה את זוגות מוטה המקביל micrographs מבוסס על דפוסים micrographs בהגדלה נמוכה. דפוס לא סדיר של תוצרת רשתות המחוררת פחמן עוזר המתאם. בדוק זוגות הטיה של micrographs ולהסיר את micrographs עם כתמים רע כמו באזורים מוכתמים רדוד (חלקיקים נראה שיש הילה סביב אותם בתנאי מוטה). (איור 4)
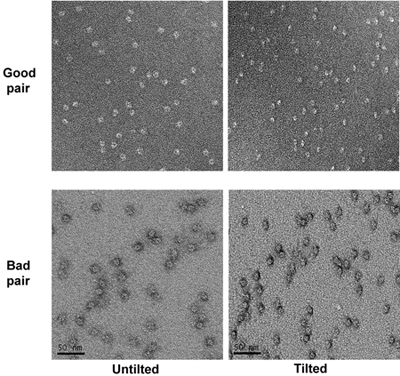
איור 4. שני זוגות הטיה של micrographs של הדגימה בהגדלה גבוהה. Micrographs טוב ורע מסומנים.
5. עיבוד תמונה של נתונים
רציונל: ישנן אפשרויות שונות חבילות תוכנה לביצוע שחזור RCT במחשב. ביותר בשימוש בדרך כלל הוא SPIDER 5. פרוטוקול בסיסי לבצע RCT ב SPIDER ניתן למצוא את דף האינטרנט http://www.wadsworth.org/spider_doc/spider/docs/techs/rancon/recn.html . פרוטוקול מפורט לביצוע RCT ב SPIDER המתואר במאמר על ידי שייח et al. 6 בפרוטוקול שלנו, אנו משתמשים בשילוב של IMAGIC-5 7 ו SPIDER בגרסת וידאו של הפרוטוקול. אנו מספקים גם הליך חלופי אך ורק להשתמש SPIDER בגירסה נוסח הפרוטוקול.
- הגדרת תוכניות. אנו משתמשים proc2d בחבילה אימאן 8 כדי לשנות את פורמט התמונה מתוך תמונה דיגיטלי Gatan כדי לעצב תמונה SPIDER. IMAGIC-5 משמש לעשות את יישור 2D. SPIDER משמש לעשות את השיקום עידון 3D ו.
תת סעיף 1: בחירת זוגות הטיה של חלקיקים.
- המרת *. dm3 Gatan תמונה דיגיטלית בפורמט SPIDER תמונה באמצעות הפקודה proc2d ב אימאן. זוגות מוטה ו untilted נקראים דפוס כמו t.spi *** ו *** u.spi, בהתאמה.
- בחר את זוגות חלקיקים באמצעות תוכנית "WEB" מופץ חבילת תוכנית SPIDER. בצע את ההוראה קואורדינטות נשמרים אוטומטית עבור חלקיקים untilted ומוטה בהתאמה DCU ***. SPI ו DCT ***. SPI. מסמך נוסף DCB ***. SPI מכיל את המידע זווית הטיה בין חלקיקים מוטה ו untilted (הערה:. הולם במהלך שלוש זוויות ב WEB בין זוגות להטות אינם מבטיחים handedness נכון של השחזור הסופי בגלל תטא אין הסימן (ערך חיובי) ו phi וגמא להסתמך על הערכים ההתחלתיים להגדיר אותם. בוחנים את כיוון השיפוע defocus על מיקרוסקופ מוטה יעזור להגדיר את הערכים ההתחלתיים הנכון של phi וגמא לפני מתאים על מנת לקבל נכונה handedness של תרשים שחזור. 5 ממחיש את האמנה הנכונה.)
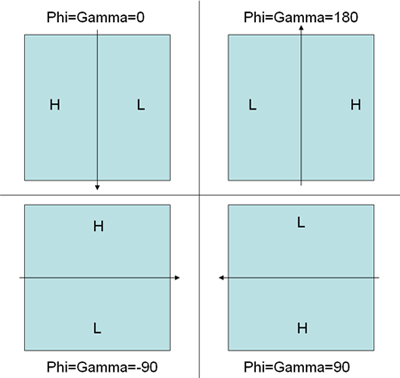
איור 5. האיור להסביר את האמנה של קביעת זווית הטיה החלקיקים WEB זוג לבחור במצב הולם נקבע על ידי השיפוע defocus. H מייצג גבוהה defocus באזור בעוד L מייצגת נמוכה defocus אזור. החץ מייצג ציר הטיה. זוויות המקביל הראשוני הנכון עבור PHI ו GAMMA מצוינים עבור כל ערכה. - קופסא את כל חלקיקי הרים משתמש בגירסה שונה של התסריט SPIDER כפי שמוצג בדף האינטרנט http://www.wadsworth.org/spider_doc/spider/docs/partpick.html . סקריפט שומר את ערימות החלקיקים untilted ומוטה כמו u.spi ו t.spi. המספרים של מיקרוסקופ שבו חלקיקים מן צריך להישמר particle_list.spi. (הערה: זה חשוב מאוד ליצירת את הקבצים הנכונים אוילר זווית עבורRCT).
תת סעיף 2: שני ממדי יישור וסיווג של תמונות החלקיקים untilted.
- המרת החלקיקים untilted לפורמט IMAGIC-5 באמצעות תוכנית em2em בחבילה Imagic-5. יישר לסווג חלקיקים לתוך כיתות הומוגניות iteratively באמצעות IMAGIC-5 תוכניות (נספח א). שימוש בפקודה MSA-שמות ב-class ב IMAGIC-5 ליצור כיתות בדיקת שולחן של חלקיקים, שבו אנו להציל imagic_classes.lis. (הערה:. הסיווג ויישור היא להגדיל את מספר חלקיקים בעלי צורה דומה, כמו גם להקטין את השונות בכיתה שונות מפה של כל מחלקה יכולה לספק מידע לגבי האיכות של הכיתה.)
- ליצור קובץ העלילה (ali_50.plt בהפגנה וידאו) עבור ערכים תרגום הסיבוב של יישור של כל חלקיק באמצעות הפקודה הכותרת IMAGIC-5.
- המר השיעורים להסתכל למעלה בטבלה לתוך מסמך SPIDER קבצים base_file ***. SPI באמצעות lis2spi.pl סקריפט perl מופץ http://cryoem.berkeley.edu .
- המרת תרגום סיבוב ערכי היישור של כל חלקיק מהקובץ העלילה שנוצר לתרגום ערכי סיבוב בשלב 5.6 לתוך ali_50.spi מסמך SPIDER הקובץ באמצעות plt2spi.pl התסריט מופץ http://cryoem.berkeley.edu .
אנו משתמשים IMAGIC-5 ליישור הסיווג 2D and כי זה נותן את הביצועים הטובים ביותר על התפקיד הזה בידינו. אסטרטגיה אלטרנטיבית SPIDER ליישור דו מימדי ואת הסיווג ניתן למצוא בכתובת http://www.wadsworth.org/spider_doc/spider/docs/align.html . השתמשנו גם SPIDER לבצע את ניתוח 2D על חלקיקים untilted של exosome. להלן הליך פשוט.
אלטרנטיבי 5.5) השתמש יישור הפניה ללא כמתואר ליישר את התמונות. שני סקריפטים פשוטה ניתן למצוא שמור את סיבוב משמרת של כל החלקיקים angular_file.spi קובץ מסמך.
אלטרנטיבי 5.6) לסווג את חלקיקי מיושר לקבוצות עם נוף זהה, כמתואר השתמשנו K-אמצעי שיטת הסיווג. צור base_file ***. SPI מבוסס על הסיווג.
תת סעיף 3: שחזור תלת ממדי באמצעות תמונות החלקיקים מוטה.
- Band-pass, פילטר המסכה במרכז חלקיקים מוטה בדיוק כמו עבור חלקיקים untilted ב IMAGIC-5. יצירת בסיס הנתונים החדש עבור חלקיקים בשם. (הערה: שלב זה הוא אופציונלי זה יכול להיעשות SPIDER..)
- יצירת קבצי מסמכים anglular מהמעמדות להסתכל למעלה מסמכים שולחן ali_50.spi, ***. DCB קבצים SPI שנוצר על ידי האינטרנט בשלב 5.3 ורשימת חלקיק קובץ partile_list.spi משלב 5.4 באמצעות סקריפט SPIDER כמו בנספח ב
- השתמש סקריפטים שיקום SPIDER לעשות שחזור של כל כיתה כפי שמתואר http://www.wadsworth.org/spider_doc/spider/docs/techs/rancon/recn.html . כל הכיתה של חלקיקים תורם נפח 3D one השיקום. מודלים 3D ניתן לבחון קליפורניה בסן פרנסיסקו, כימרה 9. היטל דו מימדי של מודל 3D ב אוילר זווית (0,0,0) יכול להיות לעומת ממוצע בכיתה המקבילה 2D מן החלקיקים untilted כדי לאמת את איכות השחזור. מצא כרכים דומה, ליישר ולמזג אותם כדי לייצר כמויות הראשונית בעקבות הליך http://www.wadsworth.org/spider_doc/spider/docs/techs/rancon/recn.html .
תת סעיף 4: עידון של השחזור 3D באמצעות תמונות החלקיקים untilted.
- האם חידוד השלכה התאמה של נפח הראשונית הממוזגת נגד כל החלקיקים untilted לקבל volum רזולוציה גבוהה יותרדואר ללא חרוט חסרים חפץ השיטוח באמצעות תסריטים SPIDER כמתואר http://www.wadsworth.org/spider_doc/spider/docs/techs/recon/refine.html .
6. נציג תוצאות:
שימוש בשיטת RCT, השגנו כ 50 שחזורים של exosome מתוך סך של 5,000 זוגות להטות (איור 6). מתוך 50 מודלים 3D, אנו יכולים לראות נטיות שונות של מורכבות יושב על הרשת בעיקר עם שתי תצוגות אורתוגונליים. חפץ משטחת גם להבחין רבים של כרכים בכיוון הניצב לפני השטח פחמן. ביצענו התאמה ומיזוג של כרכים 3D לייצר שני הכרכים הראשונים בבית צפיות אורתוגונליים. באמצעות 5000 תמונות החלקיקים untilted, השגנו את השחזור באותו 3D הסופי של exosome ברזולוציה אנגסטרום על 18 משני הדגמים הראשוני (איור 7). המבנה חשפו את הארכיטקטורה של exosome את השמרים ואת סיפק תובנות על מסלול הגיוס המצע RNA 10.

איור 6. 50 מודלים 3D של המתחם exosome ידי RCT השיקום.
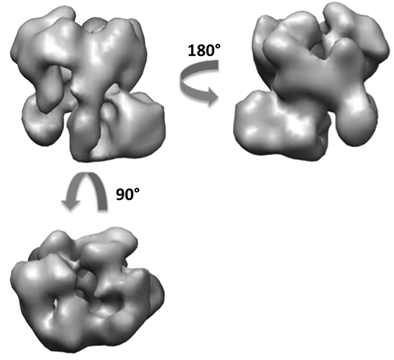
איור 7. שיחזור 3D של המתחם exosome לאחר עידון.
נספח:
נספח א 'קובץ התסריט יישור סיווג 2D ו IMAGIC-5.
קובץ: auto_align_i.sh
לחץ כאן עבור הקובץ
נספח ב 'קובץ סקריפט ליצירת קובץ זוויתי לשיקום 3D ב SPIDER.
קובץ: generate_angular_file.spi
לחץ כאן עבור הקובץ
Discussion
במאמר זה אנו מציגים פרוטוקול מפורט של הכנת המדגם ושלושה שחזור ממדי של המתחם exosome באמצעות מיקרוסקופ אלקטרונים שלילי מכתים. באמצעות שיטה זו, השגנו את השחזור באמצעות 3D להטות אקראי שיטה חרוטי ללא כל ידע מוקדם של המבנה. הטיה אקראית שיטה חרוטי לא בהכרח דורשת מדגם הומוגני אך...
Disclosures
Acknowledgements
המחברים מבקשים להודות לחברי Nogales במעבדה באוניברסיטת קליפורניה בברקלי לסייע להקים את הפרוטוקולים ראשוני חברי וואנג במעבדה באוניברסיטת ייל ב עזרתם להקים את הפרוטוקולים מלא. אנחנו גם מכירים צוותי במתקן cryo-EM ואת בעל ביצועים גבוהים מרכז החישובים בבית הספר לרפואה של אוניברסיטת ייל על תמיכתם. HW היא משפחת סמית awardee.
Materials
| Name | Company | Catalog Number | Comments |
| Polyvinyl Formal Resin | Electron Microscopy Sciences | 63450-15-7 | |
| Uranyl Formate | Electron Microscopy Sciences | 22451 | |
| Superfrost Microscope Slides | Thermo Fisher Scientific, Inc. | 4951F-001 | |
| 400 mesh grid regular | SPI Supplies | 3040C | |
| Carbon coater Auto 306 | Edwards Lifesciences | ||
| Tecnai-12 Electron Microscope | FEI | ||
| Glow Discharger | BAL-TEC | Sputter Coater SCD 005 |
References
- van Heel, M. Angular reconstitution: a posteriori assignment of projection directions for 3D reconstruction. Ultramicroscopy. 21, 111-123 (1987).
- Radermacher, M. Three-dimensional reconstruction of single particles from random and nonrandom tilt series. J Electron Microsc Tech. 9, 359-394 (1988).
- Penczek, P. A., Grassucci, R. A., Frank, J. The ribosome at improved resolution: new techniques for merging and orientation refinement in 3D cryo-electron microscopy of biological particles. Ultramicroscopy. 53, 251-270 (1994).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative staining and image classification - powerful tools in modern electron microscopy. Biol Proced Online. 6, 23-34 (2004).
- Frank, J., Radermacher, M., Penczek, P., Zhu, J., Li, Y., Ladjadj, M., Leith, A. SPIDER and WEB: processing and visualization of images in 3D electron microscopy and related fields. J Struct Biol. 116, 190-199 (1996).
- Shaikh, T. R., Gao, H., Baxter, W. T., Asturias, F. J., Boisset, N., Leith, A., Frank, J. SPIDER image processing for single particle reconstruction of biological macromolecules from electron micrographs. Nat Protoc. 3, 1941-1974 (2008).
- Heel, M. v. a. n., Harauz, G., Orlova, E. V., Schmidt, R., Schatz, M. A new generation of the IMAGIC image processing system. J Struct Biol. 116, 17-24 (1996).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: semiautomated software for high-resolution single-particle reconstructions. J Struct Biol. 128, 82-97 (1999).
- Pettersen, E. F., Goddard, T. D., Huang, C. C., Couch, G. S., Greenblatt, D. M., Meng, E. C., Ferrin, T. E. UCSF Chimera--a visualization system for exploratory research and analysis. J Comput Chem. 25, 1605-1612 (2004).
- Wang, H. W., Wang, J., Ding, F., Callahan, K., Bratkowski, M. A., Buttler, J. S., Nogales, E., Ke, A. Architecture of the yeast Rrp44 exosome complex suggests routes of RNA recruitment for 3' end processing. Proc Natl Acad Sci USA. 104, 16844-16849 (2007).
- Scheres, S. H., Nunez-Ramirez, R., Sorzano, C. O., Carazo, J. M., Marabini, R. Image processing for electron microscopy single-particle analysis using Xmipp. Nat Protoc. 3, 977-990 (2008).
- Yoshioka, C., Pulokas, J., Fellmann, D., Potter, C. S., Milligan, R. A., Carragher, B. Automation of random conical tilt and orthogonal tilt data collection using feature-based correlation. J Struct Biol. 159, 335-346 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved