Method Article
בידוד הרחבת האדם multiforme Glioblastoma גידול תאים שימוש Assay Neurosphere
In This Article
Summary
זה פרוטוקול וידאו מדגים את הבידוד והרחבת גזע כמו תאים mutliforme resected בניתוח גליובלסטומה אדם (GBM) רקמת הגידול בשיטת neurosphere תרבות assay.
Abstract
גזע דמויי תאים היו מבודדים גידולים כגון, שד ריאות בערמונית, במעי הגס ואת המוח. הנושא הקריטי בכל גידולים אלה, במיוחד mutliforme גליובלסטומה (GBM), היא לזהות לבודד תאים סרטניים באוכלוסיה ייזום (ים) לחקור את תפקידם ביצירת התקדמות הגידול, והישנות. הגידול הבנת ייזום אוכלוסיות תאים יספקו רמזים למציאת גישות טיפוליות יעיל עבור גידולים אלה. Assay neurosphere (NSA) בשל הפשטות שלה reproducibility שימש שיטת הבחירה של בידוד התפשטות של רבים זה תאים סרטניים. פרוטוקול זה מדגים את שיטת התרבות neurosphere לבודד להרחיב גזע דמויי תאים כריתה כירורגית של הרקמה האנושית הגידול GBM. הנהלים כוללים העיכול הכימי הראשוני ניתוק מכני של רקמת הגידול, ולאחר מכן ציפוי ההשעיה וכתוצאה מכך תא בודד בתרבות NSA. לאחר 7-10 ימים, neurospheres העיקרי של 150-200 מיקרומטר בקוטר ניתן לצפות ומוכנים להמשך passaging והתרחבות.
Protocol
1. אוסף של רקמות GBM ראשוני
- Mutliforme גליובלסטומה (GBM) הגידול מתקבל חולה בסרטן ועל העוברים ניתוח.
- ההסדרים חייב להיעשות עם צוות נוירוכירורגיה. הנוירוכירורג תעמיד את הגידול GBM resected בשפופרת בגודל המתאים המכיל בתאי גזע עצביים (NSC) בינוני הבסיס בתוספת אנטיביוטיקה 10-15% (Peniciline / Streptomycine). בינוני הקרה יש לספק לחדר הניתוח על ידי המעבדה. לחלופין, קר HEPES שנאגרו מדיום חיוני מינימום (שולי) או שנאגרו מלוחים פוספט (PBS) עם ריכוז גבוה של אנטיביוטיקה יכול לשמש גם למטרה זו.
- רקמת הגידול resected מועבר למעבדה על הקרח והניחו מתחת למכסה המנוע.
2. דיסוציאציה של הגידול הראשוני לתוך השעיה תא בודד
- עודף בינוני המקורי / PBS יוסר הצינור הבז ואת המדגם הוא שטף 2-3 פעמים עם 5-10mאני המדיום PBS / NSC הבסיס להסיר דם ופסולת. PBS / בינוני מסירים את רקמת הגידול GBM מושם בצלחת פטרי.
- רקמה היא לחתוך לחתיכות קטנות טחון עם להב מס '10 אזמל לחתיכות קטנות כדי להגדיל את שטח הפנים של תהליך trypsinization. ממינסינג יכול לקחת 1-3 דקות, בהתאם לגודל של הגידול.
- הרקמה טחון הוא trypsinized ב 5 מ"ל 3% של טרום חימם 0.05 טריפסין-EDTA במשך 10-15 דקות אמבט מים 37 מעלות צלזיוס. פיפטה אלקטרוני משמש להעברת החלקים גידולים זעירים טריפסין לתוך צינור פלקון 15 מ"ל.
- נפח שווה של מעכבי טריפסין סויה נוסף כדי לעצור את התגובה האנזימטית טריפסין לאחר תקופת דגירה.
- איון טריפסין מובטחת על ידי pipetting ההשעיה למעלה ולמטה מספר פעמים. לאחר מכן, ההשעיה היא pelleted על ידי centrifuging ב 800rpm (110g) של 5min.
- Supernatant נמחקת ואת פיסות רקמה resuspended ב 1ml של סטרילית NSC baסאל בינוני. הגושים הם מנותקים על ידי pipetting בעדינות מעלה ומטה (3-7 פעמים) עד ההשעיה חלק חלבי תא בודד מושגת. מספר צעדים pipetting ישירות תלוי בגודל של חלקיקים ברקמה טחון. ניתוק מכני ארוך נמרץ יש להימנע כיוון שהוא עלול לגרום למוות של תאים ירידה היווצרות כדור.
- כדי להסיר בלתי ניתק חתיכות ופסולת, 10-15 מ"ל של מדיום הבסיס מתווסף צינור לבין השעיה תא מסונן דרך מסננת 40 מיקרון תא לשפופרת 50 מ"ל.
- המתלים המסוננים centrifuged ב 800rpm (110g) של 5min. Supernatant נמחקת לאחר מכן.
- תאים Pelletted הם resuspended אז 1-2ml של המדיום NSC המלא ל ספירת תאים.
3. ספירת ו ציפוי
- 10 μL ההשעיה התא מתווסף μL 90 של 0.04% Trypan כחול בצינור Eppendorf 1ml.
הערה: שני תאים המתאימים dilutions עשוי לשמש גם. - פיפטה מעלה ומטה כדי לערבב את ההשעיה. 10 μL של תאים / תערובת trypan כחול מועבר hemocytometer כדי לספור צפיפות התאים.
- תאים הם מצופה במדיום NSC מלאה (תערובת של המדיום NSC NSC הבסיס, תוספת ריבוי ביחס 9:01) בתוספת 20ng/ml EGF, 10ng/ml bFGF ו 1μl/ml הפרין של 0.2% (2μg/ml) ב מתאים בתרבית רקמה כלי. 5, 20 ו - 40 מ"ל של מדיום המשמש צלוחיות T25, T80 ו T175, בהתאמה. אנטיביוטיקה ניתן להוסיף בינוני בריכוז של 1:100 כדי להקטין סיכוי של זיהום.
- בקבוק ממוקם להגדיר באינקובטור ב 37 מעלות צלזיוס, 5% CO 2.
4. Passaging והרחבת תחומי נגזר GBM:
- כאשר הגיעו neurospheres גודל ממוצע של 150-200 מיקרומטר קוטר, התרבות מוכן תת. התוכן של כל בקבוק מוסר והושמו tiss בגודל המתאים סטריליתצינור ue תרבות, centrifuged על 800 סל"ד (110 גרם) במשך 5 דקות בטמפרטורת החדר.
- Supernatant מוסר לבין גלולה היא resuspended ב 1 מ"ל של 0.05% טריפסין-EDTA.
- כדי להשיג trypsinization אופטימלי, השעיה התא מודגרות ב 37 מעלות צלזיוס באמבט מים במשך 2-3 דקות. כדי להפסיק את פעילות טריפסין נפח שווה של מעכבי טריפסין סויה מתווסף ההשעיה התא ההשעיה התא pipetted בעדינות מעלה ומטה.
- המתלים התא centrifuged ב 800 סל"ד (110g) עבור 5 דקות. ואז, supernatant היא להסיר את התאים הם resuspended ב 1 מ"ל של מדיום המל"ל.
- ספירת תאים מבוצעת כמתואר לעיל.
- התאים מצופה בריכוז של 4 תאים 5x10 / מ"ל במדיום המל"ל להשלים בתוספת גורמי גדילה מצופה המתאים רקמה בגודל כלי תרבות כפי שמתואר בחלק הקודם.
- Neurospheres משניות נוצרות בימים 7-10 כאשר מודגרות ב 37 מעלות צלזיוס לחified חממה עם 5% CO 2.
5. נציג תוצאות:
לאחר ציפוי תאים בודדים שנקטפו מן רקמת הגידול GBM, גידול גזע דמויי תאים להתרבות וליצור אשכולות קטנים של תאים מורכב של תאים כמה ימים 3-4 (ראו וידאו איור 1). כמו אשכולות אלה גדלים, הם רוכשים צורה כדורית יותר, כך לפי 7-8 ימים, תחומי השלב הנכון בהיר עם קוטר ממוצע של טופס מיקרון 150-200 (ראו וידאו איור 2). בהגדלה גבוהה, בתחומים בריא בדרך כלל להפגין microspikes בפריפריה שלהם. לאחר כדור גדול כמו באשכולות 1-2 ימים לאחר תחילת התרבות בשל קיומה של אי - ניתק גושים בבית binging של התרבות ואסור לטעות כמו בתחומים נכון. כמות פסולת בתרבות הגידול העיקרי בתחום משתנה בהתאם למקור הראשוני של רקמת והאם זה כולל את כל רקמת המוח שמסביב. הכנה נכונה טכניקות רקמהכולל ניתוק האנזימטית מכני, סינון הבאים של המדגם עם כמות מספקת של המדיום יכול לגרום פסולת פחות בתרבות.

באיור 1. GBM ראשוני בתחום תרבות 4 ימים לאחר ציפוי. גידול גזע דמויי תאים להתרבות וליצור אשכולות קטנים של תאים 3-4 ימים. הגדלה מקורי: 20x.
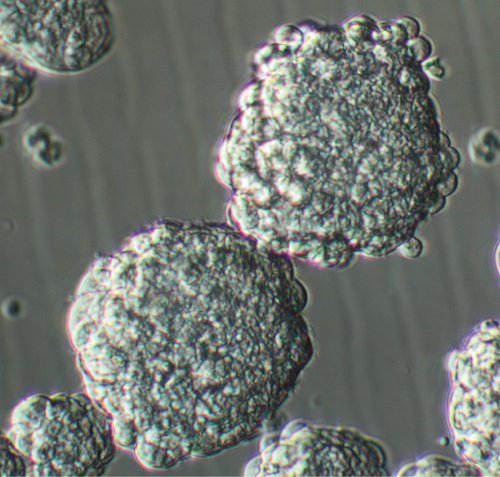
באיור 2. המעבר תרבות אחת GBM כדור 8 ימים לאחר ציפוי. הגדלה מקורי: 20x.
Discussion
כדי לבודד גזע עצביים ועל ובתאים של מבוגר נורמלי מוח עוברית 1, 2, 3, 4 ו הגידול גם גזע דמויי תאים של רקמות סרטן כגון 5 הריאות, הערמונית, 6, 7 השד והמוח 8, 9 assay neurosphere כבר שימוש תכוף כפי השיטה של בחירה. שימוש assay זה פשוט לשחזור, אפשר ליצור מספר בלתי מוגבל של תאים מרקמת הגידול resected המראים מאפיינים דומים כמו תאים סומטיים גזע; multipotency vivo לשעבר, את היכולת ליצור גידולים חדשים על ההשתלה, עצמית והתחדשות. תאים אלה יוכלו לשמש כדי לחקור את סרטן בסיסי ביולוגיה של התא, כולל תא אל תא אינטראקציות, וכן, בידול הגירה, הפלישה מוות של תאים. בנוסף, הגידול מבודדים גזע דמויי תאים לספק כלי רב ערך כדי ללמוד כיצד ליצור גידולים, התקדמות, נסיגה וגם לפענח את המנגנונים הסלולר הנובעת שבסופו של דבר יכול לספק תובנות טיפוליותאפשרויות.
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
עבודה זו נתמכה על ידי מענקים ממרכז פלורידה לחקר גידול במוח; פרסטון א ג'וניור וולס מרכז לטיפול גידול במוח.
Materials
| Name | Company | Catalog Number | Comments | |
| שם מגיב | סוג | חברה | מספר קטלוגי | תגובות |
| NeuroCult NSC בינוני בסל (אדם) | בינוני | תא גזע טכנולוגיות | 05750 | |
| NeuroCult NSC הפצת תוספי (אדם) | בינוני תוספת | תא גזע טכנולוגיות | 05753 | |
| % 0.05-EDTA טריפסין | מגיב | Gibco | 25300-062 | |
| * ממ | מגיב | Gibco | 41500-018 | מרכיב שולי |
| * HEPES | מגיב | סיגמא | H4034 | מרכיב שולי |
| * מים מזוקקים | מגיב | Gibco | 15230-147 | |
| ** אני DNase | מגיב | רוש | 104159 | |
| ** מעכב טריפסין סויה | מגיב | סיגמא | T6522 | |
| פן / סטרפטוקוקוס | מגיב | Gibco | 15140-122 | |
| מס '10 אזמל להב | כירורגי כלי | BD | 371610 | |
| צלחת פטרי | תרבות ware | BD פלקון | 353003 | |
| מלקחיים קטנים | כירורגי כלים | המדע כלים פיין | 11050-10 | |
| תא מסננת | כברה | BD פלקון | 352340 | |
| T25 צפחת | תרבות ware | Nalge נוnc הבינלאומי | 136196 | |
| T80 צפחת | תרבות ware | Nalge Nunc הבינלאומי | 178905 | |
| 15 צינורות מ"ל | תרבות ware | BD פלקון | 352096 | |
| 50 צינורות מ"ל | תרבות ware | BD פלקון | 352070 | |
| EGF | גורם צמיחה | R & D | 2028-EG | |
| b-FGF | גורם צמיחה | R & D | 3139-FB | |
| הפרין | גורם צמיחה | סיגמא | H4784 | מחדש ב PBS |
* כדי להפוך את המכפלת, לערבב מנות 1x10L של ממ and160ml של HEPES 1M ולהביא את נפח L 8.75 באמצעות מים מזוקקים. הגדר את PH הסופי 7.4ד לאחסן אותו ב 4 ° C.
** כדי להכין פתרון מעכב טריפסין, קודם לעשות 10 מ"ל של תמיסת אני DNase (100 מ"ג DNase מומס 100 מ"ל של שולי) ולאחר מכן להוסיף 0.14 גר 'של מעכבי טריפסין לפתרון DNase ולבסוף להפוך את עוצמת הקול עד 1 ליטר באמצעות שולי. שמור aliquots של המוצרים הסופיים למקפיא -20 מעלות צלזיוס.
References
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Siebzehnrubl, F. A., Vedam-Mai, V., Azari, H., Reynolds, B. A., Deleyrolle, L. P. Isolation and Characterization of Adult Neural Stem Cells. Methods Mol Biol. 750, 61-77 (2011).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and Expansion of the Adult Mouse Neural Stem Cells Using the Neurosphere Assay. J. Vis. Exp. (45), e2393-e2393 (2010).
- Azari, H., Sharififar, S., Rahman, M. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. J. Vis. Exp. (47), e2457-e2457 (2011).
- Eramo, A. Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death Differ. 15, 504-514 (2008).
- Patrawala, L. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
- Li, X. Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy. J Natl. Cancer. Inst. 100, 672-679 (2008).
- Galli, R. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Deleyrolle, L. P. Evidence for label-retaining tumour-initiating cells in human glioblastoma. Brain. 134, 1331-1343 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved