Method Article
ニューロスフェアのアッセイを用いたヒト多形性膠芽腫の腫瘍細胞の単離と拡大
要約
このビデオプロトコルは、ニューロスフェアアッセイ培養法を用いて外科的に切除したヒト神経膠芽腫mutliforme(GBM)の腫瘍組織からの細胞のような分離と茎の拡大を示しています。
要約
幹様細胞は、乳がん、肺がん、大腸、前立腺、脳などの腫瘍に分離されている。すべてのこれらの腫瘍の重要な問題は、特に神経膠芽腫のmutliforme(GBM)で、腫瘍形成、進行、および再発における役割を調べるために腫瘍開始細胞集団を同定し、分離することです。細胞集団を開始する腫瘍を理解することはこれらの腫瘍に対する効果的な治療法を見つけるための手がかりを提供します。そのシンプルさと再現性に起因するロスフェアアッセイ(NSA)は、この腫瘍細胞の多くの単離および増殖のための選択の方法として使用されています。このプロトコルは、外科的に切除したヒトGBMの腫瘍組織に幹細胞様細胞を分離して展開するニューロスフェア培養法を示しています。手順は、初期の化学的消化と腫瘍組織の機械的解離、およびその後NSAの文化の中で、その結果、単一の細胞懸濁液をめっきなどがあります。 7〜10日後に、150から2の一次ニューロスフェア直径00μmのが観察され、さらに継代と拡大のための準備が整いましたことができます。
プロトコル
1。プライマリGBMのティッシュのコレクション
- 神経膠芽腫mutliforme(GBM)の腫瘍はがんと診断され手術を受けた患者から取得されます。
- 手配は脳神経外科チームと行う必要があります。神経外科医は、神経幹細胞(NSC)10〜15%の抗生物質(Peniciline / Streptomycine)を添加した基礎培地を含む適切なサイズのチューブに切除されたGBMの腫瘍を配置します。冷たい培地は実験室で手術室に提供する必要があります。また、冷HEPES緩衝最小必須培地(HEM)またはリン酸塩は、抗生物質の高濃度で生理食塩水(PBS)もこの目的のために使用できるバッファ。
- 切除した腫瘍組織は、氷上でラボに配信され、ボンネットの下に配置されます。
2。シングルセル懸濁液中に原発腫瘍の解離
- オリジナルメディア/ PBSの過剰は、ファルコンチューブから削除され、サンプルは5〜10メートルに2〜3回洗浄し、PBS / NSC基礎培地のlは、血液や破片を除去する。 PBS /培地を除去されており、GBM腫瘍の組織をシャーレに入れられます。
- 組織を小片に切断し、トリプシン処理プロセスのための表面積を大きくする小さな部分に第10号手術用メスの刃で刻まれている。ミンチは、腫瘍の大きさに応じて1〜3分かかる場合があります。
- みじん切り組織は、予め温めておいた%0.05 37℃の水浴で10〜15分間トリプシン- EDTAの3〜5ミリリットルでトリプシン処理しています。電子ピペットは、15ミリリットルファルコンチューブに小さな腫瘍の部分とトリプシンを転送するために使用されます。
- 大豆トリプシン阻害剤の等量は、潜伏期間の後に酵素のトリプシンを加えて反応を停止されている。
- トリプシンの不活性化は、上下に数回の中断をピペッティングすることにより確保されている。その後、懸濁液は、5分間約800 rpm(110グラム)で遠心分離することによってダウンしてペレット化です。
- 上清を捨て、組織片を無菌NSC BA 1mlの中に再懸濁されているサル媒体。塊は優しく滑らかな乳白色の単細胞懸濁液が得られるまで(3-7回)上下にピペッティングして解離する。ピペッティングステップ数は、直接ミンチ組織中の粒子のサイズによって異なります。それが細胞死と球形成の減少につながる可能性があるので長いと積極的な機械的解離は避けてください。
- 非解離片や破片を除去するために、基礎培地の10〜15 mlのチューブに添加し、細胞懸濁液を50ミリリットルチューブに40ミクロンのセルストレーナーで濾過する。
- フィルタ処理された懸濁液を5分間約800 rpm(110グラム)で遠心分離する。上清はその後破棄されます。
- Pellettedその後、細胞を細胞計数のための完全なNSCの培地の1〜2ミリリットル中に再懸濁されている。
3。セル数とめっき
- 細胞懸濁液の10μLを1ミリリットルエッペンドルフチューブ0.04%トリパンブルーの90μLに追加されます。
注:他の適当なセルdilutionsを使用することもできます。 - サスペンションを混在させる上下にピペッティングし。細胞の10μL/トリパンブルー液は細胞密度をカウントするために、血球計数器に転送されます。
- 細胞は0.2%のヘパリンの20ng/ml EGF、10ng/ml bFGFおよび1μl/mlを添加した完全なNSCの培地(9:1の比率でNSC基礎培地とNSC増殖サプリメントの混合物)(2μg/ml)でメッキされています適切な組織培養容器。培地の5、20及び40mlをそれぞれ、T25、T80およびT175フラスコに使用されます。抗生物質は、汚染の可能性を減らすために1:100の濃度で培地に添加してもよい。
- フラスコを37℃、5%CO 2インキュベーターセットに置かれます。
4。継代とGBM派生球の拡大:
- ニューロスフェアは、直径150から200ミクロンの平均サイズに達したときに、文化はサブカルチャーの準備ができています。各フラスコの内容が適切なサイズ滅菌tissで削除して配置されますUEは文化チューブ、そして室温で5分間、800回転(110 g)で遠心分離。
- 上清を除去し、ペレットを%0.05トリプシン- EDTAを1mlに再懸濁されている。
- 最適なトリプシン処理を達成するために、細胞懸濁液を37℃で2〜3分間水浴中でインキュベートされる。トリプシン活性を停止するには大豆トリプシン阻害剤の等量の細胞懸濁液に添加し、細胞懸濁液を静かに上下にピペッティングしています。
- 細胞懸濁液を5分間800回転(110グラム)で遠心分離する。その後、上清を除去し、細胞はNSCの培地1mlに再懸濁する。
- 前述のように細胞数が実行されます。
- 細胞は、増殖因子や、前の部分で説明した適切なサイズの組織培養容器内のメッキを補充した完全なNSCの培地で5 × 10 4細胞/ mlの濃度で播種されています。
- 多湿で37℃でインキュベートしたときの二次ニューロスフェアは7〜10日に形成されています5%CO 2と化されたインキュベーター。
5。代表的な結果:
GBMの腫瘍組織から採取した単一の細胞を播種した後、腫瘍幹様細胞は増殖と(ビデオと図1を参照)3-4日で数個の細胞から成る細胞の小さなクラスターを生成する。これらのクラスターが成長するにつれ、彼らは150から200ミクロンの形式(ビデオおよび図2を参照)の平均粒径が7〜8日でように、より球形、適切な位相明るい球を獲得する。より高い倍率で、健康な球は通常、その周囲にmicrospikesを示しています。培養開始後1-2日以内に、クラスタと同じような大きな球を持つことは、文化の一気飲みで非解離塊の存在によるもので、真球と誤解されるべきではない。原発腫瘍の球培養での残骸の量は、組織の最初のソースで、それは周囲の脳組織を含むかどうかによって異なります。適切な組織の調製技術培地の十分な量の酵素的および機械的解離、およびサンプルのその後のろ過を含むことは文化の小さい破片になる可能性があります。

図1 4日メッキ後のプライマリGBMの球の文化。腫瘍幹様細胞は増殖と3-4日で細胞の小さなクラスターを生成する。オリジナルの倍率、20倍。
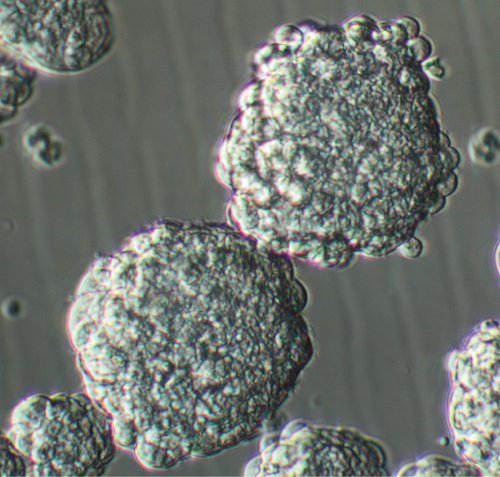
図2。8日間めっき後のパッセージone GBM球の文化を。オリジナルの倍率、20倍。
ディスカッション
神経幹細胞および正常成人と胎児の脳1、2、3、4から前駆細胞を単離するために、幹は、同じようにこのような肺5、前立腺6、乳房7、脳8、9のような癌組織由来の細胞ニューロスフェアのアッセイはまた、腫瘍されている頻繁に選択の方法として使用。 ex vivoでの多能、注入時に新しい腫瘍を作成する機能、および自己再生、このシンプルで再現性のアッセイを使用して、一つは体性幹細胞と同様の特性を示す切除した腫瘍組織からの細胞の無限数を生成することができます。これらの細胞は、細胞間相互作用、および分化、遊走、浸潤および細胞死を含む基本的な癌の細胞生物学を研究するために使用することができる。さらに、孤立した腫瘍幹様細胞はどのように腫瘍の形態、進行、および再発とも勉強し、最終的に治療するために洞察力を提供できる基盤となる派生する細胞メカニズムを解明する貴重なツールを提供オプション。
開示事項
利害の衝突は宣言されません。
謝辞
脳腫瘍の治療のためのプレストンA.ウェルズジュニアセンター、この作品は、脳腫瘍研究のためのフロリダセンターからの補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments | |
| 試薬の名前 | タイプ | 会社 | カタログ番号 | コメント |
| NeuroCult NSC基礎培地(ヒト) | 中 | セル技術を幹 | 05750 | |
| NeuroCult NSC増殖サプリメント(人間) | 培地サプリメント | セル技術を幹 | 05753 | |
| %0.05トリプシン- EDTA | 試薬 | GIBCO | 25300-062 | |
| * MEM | 試薬 | GIBCO | 41500-018 | HEMのコンポーネント |
| * HEPES | 試薬 | シグマ | H4034 | HEMのコンポーネント |
| *蒸留水 | 試薬 | ギブコ | 15230-147 | |
| ** DNase Iを | 試薬 | ロッシュ | 104159 | |
| **大豆トリプシンインヒビター | 試薬 | シグマ | T6522 | |
| ペン/連鎖球菌 | 試薬 | GIBCO | 15140-122 | |
| 10番メスの刃 | 手術道具 | BD | 371610 | |
| ペトリ皿 | 文化ウェア | BDファルコン | 353003 | |
| 小鉗子 | 手術器具 | ファイン科学ツール | 11050〜10 | |
| セルストレーナー | ふるい | BDファルコン | 352340 | |
| T25フラスコ | 文化ウェア | NalgeニュースキンNC国際 | 136196 | |
| T80フラスコ | 文化ウェア | Nalge Nunc社国際 | 178905 | |
| 15 mlチューブ | 文化ウェア | BDファルコン | 352096 | |
| 50mlチューブ | 文化ウェア | BDファルコン | 352070 | |
| EGF | 成長因子 | R&D | 2028 - EG | |
| B - FGF | 成長因子 | R&D | 3139 - FB | |
| ヘパリン | 成長因子 | シグマ | H4784 | PBSで再構成 |
* HEMを行うには、1M HEPESのMEM and160mlの1x10Lパケットを混在させると蒸留水を用いて8.75 Lにボリュームをもたらす。 7.4に最終的なPHを設定するD 4℃で保管してください
**トリプシンインヒビター溶液を調製するには、まずDNase I溶液(100mgのDNaseがHEMの100mlに溶解)の10mlを確認してから、DNase溶液にトリプシンインヒビターの0.14 gを追加し、最終的にHEMを使用して1リットルにボリュームを構成する。 -20℃の冷凍庫で最終製品のアリコートをしてください。
参考文献
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Siebzehnrubl, F. A., Vedam-Mai, V., Azari, H., Reynolds, B. A., Deleyrolle, L. P. Isolation and Characterization of Adult Neural Stem Cells. Methods Mol Biol. 750, 61-77 (2011).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and Expansion of the Adult Mouse Neural Stem Cells Using the Neurosphere Assay. J. Vis. Exp. (45), e2393-e2393 (2010).
- Azari, H., Sharififar, S., Rahman, M. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. J. Vis. Exp. (47), e2457-e2457 (2011).
- Eramo, A. Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death Differ. 15, 504-514 (2008).
- Patrawala, L. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
- Li, X. Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy. J Natl. Cancer. Inst. 100, 672-679 (2008).
- Galli, R. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Deleyrolle, L. P. Evidence for label-retaining tumour-initiating cells in human glioblastoma. Brain. 134, 1331-1343 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved