Method Article
Isolamento ed espansione di cellule umane Glioblastoma Multiforme Tumore del saggio di neurosfere
In questo articolo
Riepilogo
Questo protocollo video dimostra l'isolamento e l'espansione delle cellule staminali come da chirurgicamente asportato mutliforme glioblastoma umano (GBM) tessuti tumorali utilizzando il metodo neurosfere cultura test.
Abstract
-Come le cellule staminali sono state isolate nei tumori come mammella, polmone, colon, prostata e cervello. Un problema critico in tutti questi tumori, soprattutto in mutliforme glioblastoma (GBM), è quello di identificare e isolare popolazione di cellule tumorali di iniziare (s) per studiare il loro ruolo nella formazione del tumore, la progressione e le recidive. Tumore comprensione iniziare popolazioni di cellule fornirà gli indizi per trovare approcci terapeutici efficaci per questi tumori. Il test neurosfere (NSA) per la sua semplicità e la riproducibilità è stata utilizzata come metodo di scelta per l'isolamento e la propagazione di molte di queste cellule tumorali. Questo protocollo viene illustrato il metodo neurosfere cultura per isolare ed espandere cellule staminali, come in chirurgicamente asportato tessuto tumorale umano GBM. Le procedure comprendono una digestione iniziale dissociazione chimica e meccanica del tessuto tumorale e, successivamente, placcatura la sospensione risultante singola cellula in coltura NSA. Dopo 7-10 giorni, neurosfere primarie del 150-200 micron di diametro può essere osservato e sono pronti per un ulteriore passaging ed espansione.
Protocollo
1. Raccolta di tessuto GBM primario
- Un mutliforme glioblastoma (GBM) tumore è ottenuto da un paziente diagnosticato con il cancro e sottoposti a intervento chirurgico.
- Accordi deve essere fatta con il team di neurochirurgia. Il neurochirurgo metterà GBM il tumore asportato in un tubo di dimensioni adeguate contenente cellule staminali neurali (NSC) medio basale completato con 10-15% di antibiotici (Peniciline / streptomicina). Medium freddo devono essere fornite alla sala operatoria da laboratorio. In alternativa, freddo HEPES-buffered medio minimo indispensabile (HEM) o tampone fosfato (PBS) con elevata concentrazione di antibiotici può essere utilizzato anche per questo scopo.
- Il tessuto tumorale asportato viene consegnato al laboratorio su ghiaccio e posto sotto il cofano.
2. Dissociazione del tumore primario in cella singola Sospensione
- Eccesso del mezzo originale / PBS è stato rimosso dal tubo falco e il campione viene lavato 2-3 volte con 5-10ml di PBS / NSC medio basale per rimuovere sangue e detriti. Il PBS / Medium è stato rimosso e il tessuto tumorale GBM è posto in una capsula di Petri.
- Il tessuto viene tagliato in piccoli pezzi e macinata con una lama di 10 N. bisturi in piccoli pezzi per aumentare la superficie per il processo tripsinizzazione. Macinazione può richiedere 1-3 minuti a seconda delle dimensioni del tumore.
- Il tessuto è trypsinized tritata in 3-5ml di pre-riscaldato 0,05% tripsina-EDTA per 10-15 minuti a bagnomaria a 37 ° C. Una pipetta elettronica è utilizzato per trasferire i pezzi tumore piccolo e tripsina in un tubo 15ml Falcon.
- Un uguale volume di inibitore della tripsina di soia viene aggiunta per bloccare la reazione enzimatica tripsina dopo il periodo di incubazione.
- Inattivazione della tripsina è assicurata pipettando la sospensione su e giù diverse volte. Poi, la sospensione è pellet dalla centrifugazione a 800 giri (110 g) per 5min.
- Il supernatante viene scartato ed i pezzi di tessuto sono risospesi in 1 ml di soluzione sterile NSC basal media. Le macchie sono dissociate pipettando gentilmente su e giù (3-7 volte) fino a una superficie liscia sospensione lattiginosa singola cella è raggiunto. Il numero di passi pipettamento dipende direttamente dalla dimensione delle particelle nel tessuto tritato. Lungo e vigoroso dissociazione meccanica dovrebbe essere evitata in quanto potrebbe provocare la morte cellulare e una riduzione della formazione di sfera.
- Per rimuovere un-dissociato pezzi e detriti, 10-15 ml di terreno di base viene aggiunto il tubo e la sospensione cellulare viene filtrata attraverso un filtro a 40 micron delle cellule in una provetta da 50 ml.
- La sospensione è filtrata centrifugato a 800 giri (110 g) per 5min. Il supernatante viene scartato in seguito.
- Pellettati cellule vengono poi risospeso in 1-2ml di completo supporto NSC per il conteggio delle cellule.
3. Conteggio delle cellule e placcatura
- 10 ml di sospensione cellulare viene aggiunto a 90 ml di 0,04% tripan blu in un tubo di 1 ml Eppendorf.
Nota: altre appropriato delle cellule diluizionezioni possono anche essere utilizzati. - Pipetta su e giù per miscelare la sospensione. 10 L delle cellule / trypan miscela blu è trasferito a emocitometro per contare la densità delle cellule.
- Le cellule sono placcati in completo medio NSC (una miscela di media NSC basale e NSC supplemento di proliferazione nucleare in un rapporto 9:1) integrata con 20ng/ml EGF, bFGF 10ng/ml e 1μl/ml dello 0,2% eparina (2μg/ml) in appropriato tessuto cultura navi. Ml 5, 20 e 40 di media è utilizzato per fiaschi T25, T80 e T175, rispettivamente. Gli antibiotici possono essere aggiunti al mezzo ad una concentrazione di 1:100 per diminuire la possibilità di contaminazione.
- Il pallone viene posto in un incubatore a 37 ° C e 5% di CO 2.
4. Passaging e l'espansione del GBM sfere derivati:
- Quando il neurosfere raggiunto una dimensione media di 150-200 micron di diametro, la cultura è pronto per sottocultura. Il contenuto di ciascun pallone viene rimosso e collocato in una dimensione appropriata TISS steriletubo cultura ue, e centrifugati a 800 giri (110 g) per 5 minuti a temperatura ambiente.
- Il surnatante viene rimosso e il pellet viene risospeso in 1 ml di 0,05% tripsina-EDTA.
- Per ottenere un tripsinizzazione ottimale, la sospensione cellulare viene incubato a 37 ° C a bagnomaria per 2-3 min. Per interrompere l'attività tripsina un uguale volume di inibitore della tripsina di soia viene aggiunta alla sospensione cellulare e la sospensione cellulare viene delicatamente pipettato su e giù.
- La sospensione cellulare viene centrifugata a 800 rpm (110g) per 5 min. Poi, il surnatante viene rimosso e le cellule sono risospese in 1 ml di terreno NSC.
- Un conteggio delle cellule viene eseguita come descritto in precedenza.
- Le cellule sono placcati in una concentrazione di 5x10 4 cellule / ml in totale medio NSC completato con fattori di crescita e placcato in vasi di dimensioni adeguate alla coltura di tessuti come descritto nella parte precedente.
- Neurosfere secondarie si formano in 7-10 giorni, quando incubato a 37 ° C in ambienti umidiified incubatore con il 5% di CO 2.
5. Rappresentante dei risultati:
Dopo la placcatura singole cellule raccolte dal tessuto tumorale GBM, tumore-come le cellule staminali proliferare e generare piccoli gruppi di cellule composto da poche cellule in 3-4 giorni (vedi il video e la Figura 1). Come questi gruppi crescono, acquisiscono una forma più sferica in modo che entro 7-8 giorni, sfere in fase corretta luminoso con un diametro medio di 150-200 micron forma (Guarda il video e la Figura 2). A maggiore ingrandimento, sfere sano di solito dimostrare microspikes alla loro periferia. Avendo grande sfera come grappoli in 1-2 giorni dopo l'inizio della cultura è dovuta alla presenza di non dissociati aggregati al binging della cultura e non deve essere scambiato come sfere vero. La quantità di detriti nel campo del tumore primario cultura varia a seconda della fonte iniziale del tessuto e se non si include qualsiasi tessuto cerebrale circostante. La corretta tessuto tecniche di preparazionecompresi dissociazione enzimatica e meccanica, e successive di filtrazione del campione con una quantità sufficiente di media può portare a meno detriti nella cultura.

Figura 1. Primaria cultura sfera GBM 4 giorni dopo la placcatura. Tumore-come le cellule staminali proliferare e generare piccoli gruppi di cellule in 3-4 giorni. Ingrandimento originale; 20x.
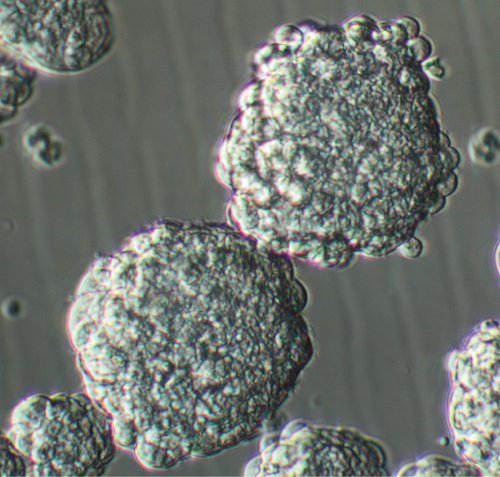
Figura 2. Passage una cultura sfera GBM 8 giorni dopo placcatura. Ingrandimento originale; 20x.
Discussione
Per isolare staminali neurali e cellule progenitrici da adulto normale e il cervello del feto 1, 2, 3, 4 e anche tumore-come le cellule staminali dai tessuti tumorali come il polmone 5, 6 della prostata, della mammella e del cervello 7 8, 9 il test neurosfere è stato frequentemente utilizzati come metodo di scelta. Da questo test semplice e riproducibile, si può generare un numero indefinito di cellule dal tessuto tumorale asportato che mostrano caratteristiche simili a quelle delle cellule staminali somatiche; multipotenza ex vivo, la possibilità di creare nuovi tumori al momento dell'impianto, e di auto-rinnovamento. Queste cellule potrebbero essere usate per studiare la biologia di base delle cellule tumorali tra cui cellula-cellula interazioni, e la differenziazione, migrazione, invasione e morte cellulare. Inoltre, isolato tumore-come le cellule staminali di fornire uno strumento prezioso per studiare come si formano i tumori, il progresso, e la ricaduta e anche per svelare i meccanismi alla base derivanti cellulari che alla fine potrebbe fornire spunti per terapeuticoopzioni.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato supportato da sovvenzioni del Centro per la ricerca della Florida Brain Tumor; Preston A. Wells Jr. Center for Brain Tumor Therapy.
Materiali
| Name | Company | Catalog Number | Comments | |
| Nome del reagente | Tipo | Azienda | Numero di catalogo | Commenti |
| NeuroCult NSC medio basale (Human) | Medio | Stem Cell Technologies | 05750 | |
| NeuroCult NSC Supplementi proliferazione (Human) | Supplemento media | Stem Cell Technologies | 05753 | |
| 0,05% tripsina-EDTA | Reagente | Gibco | 25300-062 | |
| * MEM | Reagente | Gibco | 41500-018 | HEM componente |
| * HEPES | Reagente | Sigma | H4034 | HEM componente |
| * Acqua distillata | Reagente | Gibco | 15230-147 | |
| ** DNasi I | Reagente | Roche | 104159 | |
| ** Soia inibitore della tripsina | Reagente | Sigma | T6522 | |
| Pen / Strep | Reagente | Gibco | 15140-122 | |
| N. 10 lame bisturi | Strumento chirurgico | BD | 371610 | |
| Petri Dish | Cultura software | BD Falcon | 353003 | |
| Pinzetta | Strumenti chirurgici | Strumenti Scienza multa | 11050-10 | |
| Cellulare filtro | Setaccio | BD Falcon | 352340 | |
| T25 fiasco | Cultura software | Nalge Nunc internazionale | 136196 | |
| T80 fiasco | Cultura software | Nalge Nunc internazionale | 178905 | |
| Provette da 15 ml | Cultura software | BD Falcon | 352096 | |
| 50 ml provette | Cultura software | BD Falcon | 352070 | |
| FEG | Fattore di crescita | R & S | 2028-EG | |
| b-FGF | Fattore di crescita | R & S | 3139-FB | |
| Eparina | Fattore di crescita | Sigma | H4784 | Ricostituita in PBS |
* Per fare HEM, mescolare pacchetto 1x10L di MEM and160ml di HEPES 1M e portare il volume a 8,75 L con acqua distillata. Impostare il PH finale a 7,4 unod conservarlo a 4 ° C.
** Per preparare soluzione inibitore della tripsina, per prima cosa 10 ml di soluzione di DNasi I (100 mg DNasi sciolto in 100 ml di HEM) e aggiungere 0,14 g di inibitore della tripsina alla soluzione di DNasi e, infine, portare al volume di 1 litro con HEM. Mantenere aliquote dei prodotti finali in congelatore -20 ° C.
Riferimenti
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Siebzehnrubl, F. A., Vedam-Mai, V., Azari, H., Reynolds, B. A., Deleyrolle, L. P. Isolation and Characterization of Adult Neural Stem Cells. Methods Mol Biol. 750, 61-77 (2011).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and Expansion of the Adult Mouse Neural Stem Cells Using the Neurosphere Assay. J. Vis. Exp. (45), e2393-e2393 (2010).
- Azari, H., Sharififar, S., Rahman, M. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. J. Vis. Exp. (47), e2457-e2457 (2011).
- Eramo, A. Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death Differ. 15, 504-514 (2008).
- Patrawala, L. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
- Li, X. Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy. J Natl. Cancer. Inst. 100, 672-679 (2008).
- Galli, R. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Deleyrolle, L. P. Evidence for label-retaining tumour-initiating cells in human glioblastoma. Brain. 134, 1331-1343 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon