Method Article
L'isolement et l'expansion des cellules humaines de glioblastome multiforme tumeur utilisant le test Neurosphère
Dans cet article
Résumé
Ce protocole vidéo démontre l'isolement et l'expansion des cellules souches comme des cellules de glioblastome mutliforme résection chirurgicale humaine (GBM) tissu tumoral en utilisant la méthode de dosage Neurosphère culture.
Résumé
Proche des cellules souches ont été isolées dans les tumeurs comme le sein, poumon, côlon, prostate et du cerveau. Une question essentielle dans toutes ces tumeurs, en particulier dans mutliforme glioblastome (GBM), est d'identifier et d'isoler la tumeur population cellulaire initiateur (s) pour enquêter sur leur rôle dans la formation tumorale, la progression, et les récidives. Comprendre la tumeur initier les populations de cellules fournira des indices pour trouver des approches thérapeutiques efficaces pour ces tumeurs. Le dosage de Neurosphère (NSA) en raison de sa simplicité et sa reproductibilité a été utilisée comme méthode de choix pour l'isolement et la propagation de nombreuses de cette cellules tumorales. Ce protocole illustre la méthode de culture Neurosphère à isoler et à étendre aux cellules souches dans la résection chirurgicale du tissu tumoral humain GBM. Les procédures comprennent une digestion chimique initial et de dissociation mécanique du tissu tumoral, et par la suite plaquage de la suspension cellulaire unique résultant de la culture NSA. Après 7-10 jours, primaire neurosphères du 150-200 m de diamètre peuvent être observés et sont prêts pour d'autres repiquage et d'expansion.
Protocole
1. Prélèvement de tissus GBM primaire
- Un glioblastome mutliforme (GBM) tumeur est obtenue à partir d'un patient diagnostiqué avec le cancer et subissant une chirurgie.
- Dispositions doivent être prises avec l'équipe de neurochirurgie. Le neurochirurgien aura lieu la tumeur réséquée GBM dans un tube de taille appropriée contenant des cellules souches neurales (NSC) milieu de base additionné d'antibiotiques 10-15% (Peniciline / streptomycine). Milieu froid doit être fournie à la salle d'opération par le laboratoire. Alternativement, le froid tamponné HEPES milieu essentiel minimum (HEM) ou de tampon phosphate salin (PBS) à forte concentration d'antibiotiques peuvent également être utilisés à cette fin.
- Le tissu tumoral réséqué est livré au laboratoire sur la glace et placé sous le capot.
2. La dissociation de la tumeur primitive en une seule cellule de suspension
- L'excès du support original / PBS est éliminé du tube Falcon et l'échantillon est lavé 2-3 fois avec le 5-10ml de PBS / NSC milieu basal pour enlever le sang et les débris. Le PBS / milieu est éliminé et le tissu tumoral GBM est placé dans une boîte de Pétri.
- Le tissu est coupé en petits morceaux et émincé avec une lame de bistouri n ° 10 en petits morceaux pour augmenter la surface pour le processus de traitement à la trypsine. Mincing peut prendre 1-3 minutes selon la taille de la tumeur.
- Le tissu émincé est trypsinisées en 3-5ml de pré-chauffé à 0,05% de trypsine-EDTA pendant 10-15 minutes dans un bain d'eau à 37 ° C. Une pipette électronique est utilisé pour transférer les morceaux minuscules tumeurs et de la trypsine dans un tube de 15ml Falcon.
- Un volume égal de l'inhibiteur de trypsine de soja est ajouté pour arrêter la réaction enzymatique trypsine après la période d'incubation.
- Inactivation trypsine est assurée par la suspension de pipetage de haut en bas plusieurs fois. Ensuite, la suspension est granulé par centrifugation à 800rpm (110g) pendant 5 min.
- Le surnageant est éliminé et les morceaux de tissus sont remis en suspension dans 1ml de solution stérile NSC bamoyennes sal. Les bouquets sont dissociés par un léger pipetage haut et en bas (3-7 fois) jusqu'à ce qu'une bonne suspension laiteuse seule cellule est atteint. Le nombre d'étapes de pipetage dépend directement de la taille des particules dans les tissus hachés. De longs et vigoureux dissociation mécanique devrait être évitée car elle pourrait entraîner la mort cellulaire et une réduction de la formation sphère.
- Pour supprimer l'ONU dissocié des pièces et des débris, 10-15 ml de milieu de base est ajoutée dans le tube et la suspension cellulaire est filtrée à travers une passoire de 40 microns de cellules dans un tube de 50ml.
- La suspension filtrée est centrifugé à 800rpm (110g) pendant 5 min. Le surnageant est éliminé par la suite.
- Cellules Pelletted sont ensuite resuspendues dans 1-2ml de NSC milieu complet pour le comptage cellulaire.
3. Numération cellulaire et placage
- 10 pl de la suspension cellulaire sont ajoutés à 90 uL de 0,04% bleu trypan dans un tube eppendorf 1ml.
Remarque: d'autres cellules appropriées dilutiontions peuvent également être utilisés. - Pipeter haut et en bas pour mélanger la suspension. 10 uL des cellules / bleu trypan mélange est transféré à hémocytomètre pour compter la densité cellulaire.
- Les cellules sont étalées au NSC milieu complet (un mélange de NSC milieu basal et NSC prolifération supplément à un ratio de 9:1) complété avec 20ng/ml EGF, bFGF et 10ng/ml 1μl/ml de l'héparine de 0,2% (2μg/ml) dans appropriée des récipients de culture tissulaire. 5 ml, 20 et 40 du milieu est utilisé pour des flacons T25, T80 et T175, respectivement. Des antibiotiques peuvent être ajoutés dans le milieu à une concentration de 1:100 pour diminuer risques de contamination.
- Le ballon est placé dans un incubateur réglé à 37 ° C et 5% de CO 2.
4. Le repiquage et l'expansion du GBM sphères dérivés:
- Lorsque les neurosphères atteint une taille moyenne de 150-200 m de diamètre, la culture est prêt pour la sous-culture. Le contenu de chaque flacon est retiré et placé dans une taille appropriée TISS stérilestube de culture ue, et centrifugé à 800 rpm (110 g) pendant 5 min à température ambiante.
- Le surnageant est éliminé et le culot est resuspendu dans 1 ml de 0,05% de trypsine-EDTA.
- Pour parvenir à une trypsinisation optimale, la suspension cellulaire est incubée à 37 ° C dans un bain d'eau pendant 2-3 min. Pour arrêter l'activité de la trypsine un volume égal de l'inhibiteur de trypsine de soja est ajoutée à la suspension cellulaire et la suspension cellulaire est doucement introduit à la pipette de haut en bas.
- La suspension cellulaire est centrifugée à 800 tours par minute (110g) pendant 5 min. Ensuite, le surnageant est éliminé et les cellules sont remises en suspension dans 1 ml de milieu NSC.
- Un comptage des cellules est effectué comme décrit précédemment.
- Les cellules sont étalées à une concentration de 5x10 4 cellules / ml dans NSC milieu complet additionné de facteurs de croissance et plaquées dans des navires de taille appropriée la culture de tissus tels que décrits dans la partie précédente.
- Neurosphères secondaires se forment dans les 7-10 jours lorsqu'elle est incubée à 37 ° C dans un environnement humideified incubateur avec 5% de CO 2.
5. Les résultats représentatifs:
Après étalement de la récolte des cellules individuelles à partir de tissus tumoraux GBM, une tumeur proche des cellules souches prolifèrent et génèrent de petits amas de cellules composée de quelques cellules dans 3-4 jours (voir la vidéo et graphique 1). Comme ces grappes de croître, ils acquièrent une forme plus sphérique afin que par 7-8 jours, des sphères lumineuses bonne phase avec un diamètre moyen de 150-200 microns forme (voir la vidéo et graphique 2). A plus fort grossissement, de sphères saines habituellement démontrer microspikes à leur périphérie. Ayant grande sphère comme les grappes de 1-2 jours après l'initiation de la culture est due à l'existence de non-dissociée des touffes à l'binging de la culture et ne doivent pas être confondus avec les sphères vrai. La quantité de débris dans la culture sphère tumeur primitive varie en fonction de la source initiale de tissu et si oui ou non il comprend tout tissu cérébral environnant. Techniques appropriées de préparation des tissusnotamment la dissociation enzymatique et mécanique et la filtration ultérieure de l'échantillon avec une quantité suffisante de milieu peut aboutir à moins de débris dans la culture.

Figure 1. Primaires de la culture sphère GBM 4 jours après placage. Tumeur proche des cellules souches prolifèrent et génèrent de petits amas de cellules dans les 3-4 jours. Grossissement original; 20x.
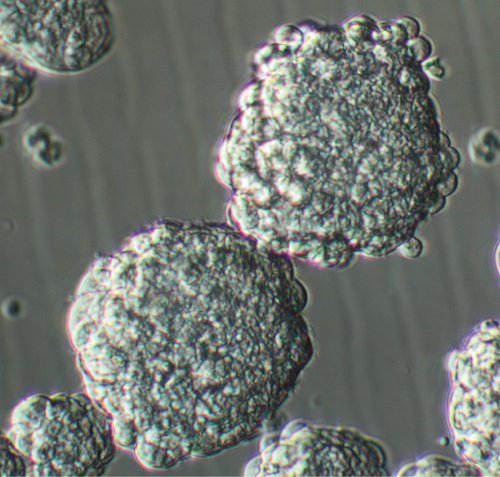
Figure 2. Passage d'une culture sphère GBM 8 jours après placage. Grossissement original; 20x.
Discussion
Pour isoler souches neurales et de cellules progénitrices d'adulte normal et le cerveau du fœtus 1, 2, 3, 4 et aussi une tumeur proche des cellules souches provenant de tissus de cancer comme le poumon 5, de la prostate 6, 7 et le cerveau maternel 8, 9 le dosage a été Neurosphère fréquemment utilisées comme la méthode de choix. L'utilisation de ce test simple et reproductible, on peut générer un nombre indéfini de cellules de tissu tumoral réséqué qui montrent les mêmes caractéristiques que les cellules souches somatiques; multipotence ex vivo, la capacité de créer de nouvelles tumeurs lors de l'implantation, et l'auto-renouvellement. Ces cellules pourraient être utilisées pour étudier la biologie fondamentale sur le cancer des cellules dont la cellule à cellule des interactions, et de la différenciation, la migration, l'invasion et la mort cellulaire. En outre, les tumeurs isolées proche des cellules souches de fournir un outil précieux pour étudier comment se forment les tumeurs, les progrès et rechutes et aussi de démêler les sous-tendent les mécanismes cellulaires dérivant qui pourraient éventuellement fournir des indications aux thérapeutiquesoptions.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par des subventions du Centre de Recherche en Floride tumeur cérébrale; Preston A. Wells Jr. Center for Therapy tumeur au cerveau.
matériels
| Name | Company | Catalog Number | Comments | |
| Nom du réactif | Tapez | Société | Numéro de catalogue | Commentaires |
| NeuroCult NSC milieu de base (l'homme) | Medium | Stem Cell Technologies | 05750 | |
| NeuroCult NSC Suppléments prolifération (Human) | Supplément de milieu | Stem Cell Technologies | 05753 | |
| 0,05% de trypsine-EDTA | Réactif | Gibco | 25300-062 | |
| * MEM | Réactif | Gibco | 41500-018 | Composante HEM |
| * HEPES | Réactif | Sigma | H4034 | Composante HEM |
| * L'eau distillée | Réactif | Gibco | 15230-147 | |
| ** DNase I | Réactif | Roche | 104159 | |
| ** Inhibiteur de la trypsine de soja | Réactif | Sigma | T6522 | |
| Pen / Strep | Réactif | Gibco | 15140-122 | |
| N ° 10 lame de bistouri | Outil chirurgical | BD | 371610 | |
| Boîte de Pétri | Culture de la céramique | BD Falcon | 353003 | |
| Une petite pince | Outils chirurgicaux | Outils Fine Science | 11050-10 | |
| Tamis cellulaire | Tamis | BD Falcon | 352340 | |
| T25 flacon | Culture de la céramique | Nalge Nunc internationale | 136196 | |
| T80 flacon | Culture de la céramique | Nalge Nunc International | 178905 | |
| Tubes de 15 ml | Culture de la céramique | BD Falcon | 352096 | |
| Tubes de 50 ml | Culture de la céramique | BD Falcon | 352070 | |
| EGF | Facteur de croissance | R & D | 2028-EG | |
| b-FGF | Facteur de croissance | R & D | 3139-FB | |
| Héparine | Facteur de croissance | Sigma | H4784 | Reconstitué en PBS |
* Pour faire HEM, mélanger des paquets 1x10L de MEM and160ml d'HEPES 1M et porter le volume à 8,75 L en utilisant de l'eau distillée. Réglez le pH final à 7,4 uned stocker à 4 ° C.
** Pour préparer la solution d'inhibiteur de trypsine, faites d'abord 10 ml de solution de DNase I (100 mg DNase dissous dans 100 ml de HEM), puis ajouter 0,14 g d'inhibiteur de la trypsine à la solution de DNase et enfin faire le volume à 1 litre avec de HEM. Gardez aliquotes des produits finaux de -20 ° C au congélateur.
Références
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Siebzehnrubl, F. A., Vedam-Mai, V., Azari, H., Reynolds, B. A., Deleyrolle, L. P. Isolation and Characterization of Adult Neural Stem Cells. Methods Mol Biol. 750, 61-77 (2011).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and Expansion of the Adult Mouse Neural Stem Cells Using the Neurosphere Assay. J. Vis. Exp. (45), e2393-e2393 (2010).
- Azari, H., Sharififar, S., Rahman, M. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. J. Vis. Exp. (47), e2457-e2457 (2011).
- Eramo, A. Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death Differ. 15, 504-514 (2008).
- Patrawala, L. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
- Li, X. Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy. J Natl. Cancer. Inst. 100, 672-679 (2008).
- Galli, R. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Deleyrolle, L. P. Evidence for label-retaining tumour-initiating cells in human glioblastoma. Brain. 134, 1331-1343 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon