A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
גנרטור ביטוי חלבון תפוקה גבוהה באמצעות פלטפורמת Microfluidic
In This Article
Summary
אנו מציגים גישת microfluidic לביטוי של מערכי חלבון. המכשיר מורכב מאלף תאי תגובה הנשלטים על ידי מייקרו שסתומים מכאניים. מכשיר microfluidic הוא הזדווגו לספריית גן microarray-מודפסת. גנים אלו אז מתועתקים ומתורגמים על שבב, וכתוצאה מכך מערך חלבון מוכן לשימוש ניסיוני.
Abstract
שדות בקצב מואץ, כגון ביולוגיה של מערכות, דורשים פיתוח והיישום של טכנולוגיות חדשות, המאפשרים מדידות גבוהות תפוקה ואיכות גבוהה של מערכות גדולות. מיקרופלואידיקה מבטיחה למלא רבים מהדרישות הללו, כגון ביצוע ניסויי תפוקה גבוהה הקרנה על שבב, הכוללת מבחנים ביוכימיים, biophysical, ומבוססי תאים 1. מאז הימים הראשונים של מכשירים מיקרופלואידיקה, תחום זה התפתח באופן דרסטי, שהוביל לפיתוח של אינטגרצית microfluidic בקנה מידה גדולה 2,3. טכנולוגיה זו מאפשרת לאינטגרציה של אלף שסתומי micromechanical במכשיר אחד עם טביעת רגל דואר בגודל (איור 1). פתחנו פלטפורמת microfluidic תפוקה גבוהה להפקה בביטוי מבחנה של מערכי חלבון (איור 2) בשם PING (גנרטור רשת אינטראקצית חלבון). מערכים אלה יכולים לשמש כתבנית לניסויים רביםכגון בין החלבונים 4, 5 חלבונים RNA או חלבון דנ"א 6 אינטראקציות.
המכשיר מורכב מאלף תאי תגובה, אשר תוכנתו בנפרד באמצעות microarrayer. יישור של microarrays המודפס אלה לתוכניות מיקרופלואידיקה התקנים כל תא עם נקודה בודדה שמבטלת אפשרות של זיהום או תגובה צולבת יתר על כן, יצירת microarrays באמצעות טכניקות תיכונה microarray הרגילות הוא גם מאוד מודולרי, המאפשר לarraying של חלבונים 7, 8 DNA, מולקולות קטנות, ואפילו השעיות colloidal. ההשפעה הפוטנציאלית של מיקרופלואידיקה במדעים ביולוגיים היא משמעותית. מספר מיקרופלואידיקה מבחנים מבוססים כבר ספק תובנה חדשות למבנה והתפקוד של מערכות ביולוגיות, ותחום מיקרופלואידיקה ימשיך להשפיע ביולוגיה.
Protocol
1. ייצור מכשיר
- רכש עובש DTPA-D SU-8 שליטה ועובש SPR220-7 זרימה מסטנפורד מיקרופלואידיקה היציקה (www.stanford.edu / קבוצה / יציקה).
- לחשוף את תבניות סיליקון לchlorotrimethylsilane (TMCS) אדים למשך 10 דקות כדי לקדם את שחרור אלסטומר לאחר צעדי אפיית 9.
- הכן תערובת של סיליקון אלסטומר המבוסס וסוכן ריפוי (לערבב היטב) בשני יחסים שונים ו05:01 20:01 לשליטה ולתבניות זרימה, בהתאמה. היחסים השונים נחוצים לקשירה נאותה של מספר שכבות.
- יוצק 05:01 PDMS על שליטת השכבה (כ 5 מ"מ גובה). דגת שכבה המלאה ולאפות אותו למשך 30 דקות ב 80 ° C. מעייל ספין (Laurell, ארה"ב) את תערובת 20:01 PDMS על שכבת הזרימה ב2600 סל"ד עבור 60 שניות ואז לאפות אותו ב 80 מעלות צלזיוס למשך 30 דקות. מהירות coater הספין היא מותאמת לactuation סתום בלחץשל 15 אטמוספרות. מסתובב מהר יותר, תגרום לשכבה דקה יותר עם לחץ הפעלה נמוך יותר ולהיפך. המכשירים שאנו משתמשים יש מגבלה של 25 psi בשליטה ו -10 psi בזרימה, ומעליו ניתוק מהמצע עלול להתרחש.
- הפרד את שכבת השליטה מהעובש. לעשות את זה לאט ולהיזהר לא לקלף SU8 הדפוס. ואז לחתוך את המכשיר סביב היקפה ולנקב חורים כדי לגשת לערוצי הבקרה.
- יישר את הזרימה ושכבות בקרה ידנית תחת סטריאוסקופ. התחל על ידי יישור בפינה השמאלית העליונה, שסתום הלחץ (שכבה מלאה) חייב להיות באמצע תגובת החדר (שכבת זרימה). בשלב בא, ליישר את השורה הראשונה ומשחרר בעדינויות את שורת שליטת השכבה אחרת שורה. ודא שכל שסתומי הכפתור נמצאים באמצע של תאי התגובה ושסתומי הכתובות וקלט חוצים את ערוצי הזרימה במיקום הנכון. התהליך ניתן לחזור באופן מקומי עד שכל השורות המיושרות. בסוף, לשחרר את כל מתח בPDMS בy הרמתו בזהירות מהצדדים ובפינות. אל תרימו יותר מדי או חוסר עלול להתרחש.
- לאפות אותו ל2 שעות ב 80 ° C.
- חותך סביב היקפו של המכשיר, ולקלף את מכשיר השכבה 2 (שבב) מעובש הזרימה. מחורר לגשת לערוצי הזרימה (איור 1).
2. Arraying DNA ויישור התקנים
- לייצר גנים סינטטיים על ידי ההרכבה PCR. הגנים הסינתטיים להלחין של אמרגן T7, אתר קישור הריבוזום (RBS), ORF עם שני תגי epitope (אחד בכל קצה), וT7 שליחות קטלנית 4. הגנים יכולים להשתנות באורך 100 נ"ב עד, לפחות, 5000 נ"ב.
- הכן את הגנים הסינתטיים לarraying: להכין תערובת של אתילן glycole פולי (1.25%) וdihydrate D-הטרהלוז (125 מ"ג / מ"ל) ולוותר על 2 μl לתגובה לתוך צלחת 384 בארות. פתרון זה יקטין מחייב בלתי הפיך של דנ"א לכוס, כמו גם להדמיה במהלך היישור 10.
- להעביר את הגנים הסינתטיים לצלחת 384 בארות. בדרך כלל ריכוזי DNA יכולים לנוע בין 10 ng / μl עד 100 ng / μl ריכוז סופי. הוסף DH 2 O לנפח סופי של 20 μl (תלוי בסוג microarrayer וסיכה).
- ספוט סדרה של גנים סינטטיים על גבי מצעי זכוכית מצופי אפוקסי באמצעות microarrayer. אנו משתמשים MicroGrid 610 (ביו רובוטיקה) עם סיכות סיליקון SMT-S75 (סינתזה מקבילה, ארה"ב). צור דפוס של דנ"א, עם הסיכות ספציפיות האלה, תוצאות בכתמים עם קוטר של כ 100 מיקרומטר על משטח הזכוכית. כל עומס סיכה הוא מספיק לכ 100 נקודות. ודא את מגרשי עמודות והשורה מתאימות למכשיר הספציפי בשימוש. המכשיר שאנו משתמשים מכיל 16 עמודים ו 40 שורות עם מגרש של 680 מיקרומטר ידי 320 מיקרומטר, בהתאמה.
- ידני ליישר את מכשיר microfluidic למערך הגנים תחת סטריאוסקופ. נקודת ה-DNA צריכה להיות באמצע תאי DNA. התחל על ידי יישור איתור השורה הראשונה של כתמים בelow השורה הראשונה של תאי DNA. ואז, להביא לתוך קו שאר השורות שסיימו עם כוונון עדין של המכשיר כולו. ברגע שהמערך מיושר טיפול יש לנקוט כדי להקל על כל לחץ בPDMS, על ידי הרמתו באופן מקומי. אם יש מתח שנותר בPDMS זה לא ייתכן קשר גם לmicroarray.
- לבסוף, אג"ח המכשיר לשקופית הזכוכית על ידי דגירת הלילה על פלטה חמה ב 80 ° C.
3. אתחול והפעלת ההתקן
- השסתומים בשכבה המלאה הם מופעלים מהמחשב באמצעות LabVIEW. תסריט LabVIEW שולט סדרה של שסתומי סולנואיד מייקר באמצעות תיבת בקרה אלקטרונית (שנרכש מאוניברסיטת סטנפורד מיקרופלואידיקה יציקה). סעפת שסתום סולנואיד מחוברת לאוויר דחוס, השולט על זרימת אוויר ולחץ לשסתומי הבקרה במכשיר.
- חבור את המכשיר לסעפת שסתומי סולנואיד באמצעות צינור פלסטי גמיש בקוטר הפנימי של 0.02 "(Tygon) ונירוסטת סיכה (ניו אינגלנד הקטנה צינורות תאגיד).
- מלא את הצינורות עם DDW ולהכניס את הפינים לחורי הגישה של השכבה המלאה. ודא שכל צינור מחובר לשליטת הערוץ המתאים לו.
- הפעל את יישום LabVIEW במחשב כדי להפעיל את ערוצי שליטה. על ידי הפעלת השסתום מתסריט LabVIEW, אנחנו מיישמים את לחץ אוויר, אשר בתורו תהיה לדחוף את המים לערוצי בקרת PDMS. קבע את לחץ האוויר ל 5 psi. מומלץ למלא את "כריך" ואת שסתומי הכתובת ראשונה, על מנת לזהות-שיחות צולבות בין ערוצי בקרה של מכשירים פגומים. במקרה של שיחות-צולבות, actuation של הקו 'סנדוויץ'' השליטה יוביל לactuation של או הצוואר או קווי בקרה של לחצנים. זה דומה לקצר במעגל חשמלי. מכשיר עם דיבור נגדי הוא פגום ולא ניתן להשתמש.
- לאחר שכל ערוצי הבקרה ושסתומים מלאים בDDW, השסתומים דרוכים ופליליdy לחסום את ערוצי הזרימה מתחת להם. הגדל את לחץ האוויר עד 15 PSI. הפעלת שסתום נשלטת מתכנית LabVIEW באמצעות מערכת של הפעלה / כיבוי מתגים המחוברים לשסתומי סולנואיד בודדים. כל מתג שולט קו שליטה מסוימת דרך שסתום סולנואיד המתאים לו. פונה על הכפתור הבורר (בתסריט) יחול לחץ אוויר בצינור המקביל. לחץ האוויר ידחוף DDW בקו השליטה ויגרום להתרחבות של שסתומי microfluidic, חוסם את הערוץ שמתחת. כיבוי שסתום בקרה, ישחרר את לחץ אוויר ולאחר מכן לשחרר את החסימה של ערוץ הזרימה המתאימה.
- כדי להבטיח שכל השסתומים פתוחים, חבר צינור לאחת תשומות הזרימה וזרימת האוויר לתוך המכשיר בpsi 4-5. זה ישחרר את כל שסתומים דביקים משקופית הזכוכית.
- לבסוף, המכשיר הוא דרוך ומוכן. סגור את כל הקלט והשסתומים 'צוואר', כדי להתחיל בכימיה של פני השטח.
- על מנת להקל על ההרכבה העצמית של מערך חלבון על פני השטח ולמנוע ספיחה לא ספציפית בתוך מכשיר microfluidic, את פני שטח שינוי כימי:
- לזרום רכיב דרך המכשיר, חבר צינור חדש עם הפתרון הנדרש לאחד מערוצי הזרימה במכשיר. חבר את הצד החופשי של הצינור לסעפת הידנית ולפתוח את זרימת לחץ האוויר (5 PSI).
- טען 40 μl של Biotinylated-BSA (מיקרוגרם 1 / μl) בצינור ותזרים חדש כמחציתו במשך 20 דקות באמצעות המכשיר, BSA יהיה לאגד את משטח אפוקסי.
- השתמש Hepes (50 מ"מ) לכביסת מצע unreacted בין כל אחד משלבי הכימיה של פני השטח השונים.
- 25 Strepavidin הזרימה μl (0.5 מיקרוגרם / μl) במשך 20 דקות על גבי-BSA biotinylated.
- לשטוף עם Hepes למשך 5 דקות.
- סגור את השסתום 'הכפתור' ולזרום שאר-BSA biotinylated (כdescriהמיטה לעיל), passivating המשטח סביב הכפתור.
- לשטוף עם Hepes למשך 5 דקות.
- שחרר את השסתום 'הכפתור' וזרימת 30 μl של המחומש-ביוטין (0.16 מיקרוגרם / μl) למשך 20 דקות. הנוגדן יהיה לאגד את strepavidin נחשף; במיוחד לאזור תחת 'הכפתור' יצירת מערך אנטי תג.
5. ביטוי חלבון
- בטא את החלבונים על המכשיר באמצעות שעתוק ארנב reticulocyte מהיר יחד ותגובת תרגום. ביטוי חלבון מהגנים הסינתטיים המנומרים על המכשיר יוצר מערך של חלבונים מוכנים לשימוש. לדוגמה, שימוש כזה הוא למסך חלבון מחייב.
- פתח את השסתומים 'צוואר' ושעתוק זרימת ארנב reticulocyte מהיר יחד ותגובת תרגום באמצעות המכשיר לתוך תא ה-DNA. בשלב הבא, לסגור את השסתומים "הכריך" ולהפריד כל גן בסביבתו. דגירת המכשיר על פלטה של 2.5 שעות ליום 30 ° C. הביע יחסי הציבורoteins יהיה לנטרל מתא ה-DNA לתגובת התא באופן הספונטני (שסתום צוואר פתוח) ולהיקשר לנוגדנים נגדו תחת הסתום 'הכפתור' לשתק את החלבון דרך התג שלו C-התחנה הסופית.
- תייג את החלבונים עם נוגדן Cy3 הגן c-myc. הנוגדן יהיה לאגד epitope המקביל שלה ממוקם בתחנה הסופית N-החלבון.
- לקבוע רמות ביטוי חלבון עם סורק microarray (LS Reloaded, טקאן) באמצעות 532 ננומטר ליזר ו575 מסנן פליטת ננומטר.
6. נציג תוצאות
1. ייצור מכשיר
עיצוב גרפי של מכשיר נוצר על ידי AutoCAD מבוסס על צרכי הניסוי שלנו. העיצוב היה מודפס על שקף, על ידי ציד תמונה ברזולוציה גבוהה. שקיפות זו משמשת כphotomask בphotolithography קשר. טכניקת micromachining משטח משמש ליצירת תבניות 3-D על פרוסות סיליקון נקבעות על ידי הדפוסים הרשומים על tהוא השתמש במסכות.
מכשיר microfluidic פוברק בתבנית הסיליקון יציקת סיליקון אלסטומר polydimethylsiloxane (PDMS, 184 SYLGARD, Dow Corning, ארה"ב) (איור 1). כל מכשיר מורכב משתי שכבות מיושרות PDMS, הזרימה ושכבה המלאה. העובש נחשף לראשונה לchlorotrimethylsilane (TMCS, אולדריץ) אדים למשך 10 דקות כדי לקדם את שחרור אלסטומר לאחר שלבי האפייה. תערובת של אלסטומר המבוסס סיליקון וסוכן ריפוי הוכנה ביחס 05:01 ו20:01 לשליטה ולתבניות זרימה, בהתאמה שתי שונים. שכבת השליטה הייתה degassed ואפתה למשך 30 דקות ב 80 ° C. שכבת הזרימה תחילה ספין מצופית (Laurell, ארה"ב) בשעת 2600 סל"ד עבור 60 שניות ולאפות ב 80 מעלות צלזיוס למשך 30 דקות. שכבת השליטה הופרדה מתבניתה וחורי גישת ערוץ בקרה היו אגרוף. בשלב בא, את שכבות זרימה ושליטה היו מיושרות באופן ידני תחת סטריאוסקופ ואפו ל2 שעות ב 80 ° C. מכשיר 2 השכבה התקלף from עובש הזרימה וחורי גישת ערוצי זרימה היה אגרוף.
2. תיאור מכשיר
קיבולת המכשיר יכולה לנוע בין 500 עד 10,000 תאי יחידה (איור 2). המכשיר מורכב משתי שכבות: שכבת זרימה (אפור) ושכבה מלאה (בצבע). השכבה המלאה מכילה מגוון של שסתומים עם תפקיד שונה. כל תא יחידה, בשכבת הזרימה, מורכב מDNA אחד ותגובת חדר אחד והוא נשלט על ידי שלושה סוגים של שסתומי micromechanical; 'צוואר', 'כפתור', ו 'סנדוויץ'' (איור 2 א). 'הגן הסינטטי' מנוקדת הופקד בתוך תא הדנ"א חסום מתגובת החדר על ידי שהסתום 'הצוואר' (ירוק). שטיפת השמנה ומכאנית של חלבונים קשורים שטח בתגובת החדר מבוצעת על ידי שהסתום 'הכפתור' (כחול). הסתום 'סנדוויץ'' מאפשר לכל תגובה להתרחש בתא היחיד שלו (אדום). שסתומי הכתובות יכולים לפצל את המכשיר עד 8 סעיפים עצמאיים, לdiffereבדיקת מצב NT. בנוסף, השכבה המלאה מכילה שסתומי קלט, המאפשרים הזרימה של נוזל נבחר לשכבת הזרימה. ערוצי בקרת PDMS מלאים עם DDW. כאשר שסתום actuated עליית הלחץ (15 psi) תוצאות בהרחבה של PDMS. במקומות בם הקרום דק מספיק (כלומר מעבר של שליטה וקווי זרימה) די בכך כדי לחסום את קו הזרימה לגמרי. גובה הממוצע תא יחיד הוא 10 מיקרומטר, ונפח תא יחידה ממוצע הוא פחות מ 1 nl.
3. ביטוי וזיהוי חלבונים
חלבונים לידי ביטוי במכשיר באמצעות שעתוק ארנב reticulocyte מהיר יחד ותגובת תרגום (Promega). הביטוי של החלבונים יצר מערך של חלבונים מוכנים לשימוש במסך מחייב (איור 3). תמהיל ביטוי (12.5 μl) הוכנס למכשיר ולאחר מכן הציף את תאי DNA על ידי פתיחת השסתומים 'הצוואר'. בשלב הבא, את השסתומים "הכריך" היונסגר עוזב כל תא יחידה נפרדת מהתאים השכנים לה ואת מכשיר הודגר על צלחת חמה תמורת 2.5 שעות ליום 30 ° C. חלבונים הביעו מתפזרים דרך חדר הגן לתגובת החדר, כאשר C-סופי תגו יכול להיקשר הנוגדן אנטי (Qiagen) מקומי תחת הסתום 'הכפתור' לשתק את החלבון אל פני השטח. חלבונים תויגו עם גן c-myc Cy3 (סיגמא), שקשור לepitope המקביל שלה ממוקם בתחנה הסופית N-החלבון וכינה אותו. רמות ביטוי החלבון נקבעו עם סורק microarray (LS Reloaded, טקאן) באמצעות ליזר ננומטר 532 ננומטר 575 וסינון. המערך מורכב מהחלבון וכתוצאה רמות שונות של ביטוי חלבון. בדרך כלל, כ 20% מספריית גן להיכשל להביע לרמות לגילוי. לא נמצאים מתאם עם גודל חלבון נצפה 3. רמות רקע נקבעו באמצעות תאים שלא מוכתמים בדנ"א. לפיכך, אותות מתאי החלבון המתאימים הם עקב או nאואז או ספיחה הלא ספציפית של נוגדני התיוג.
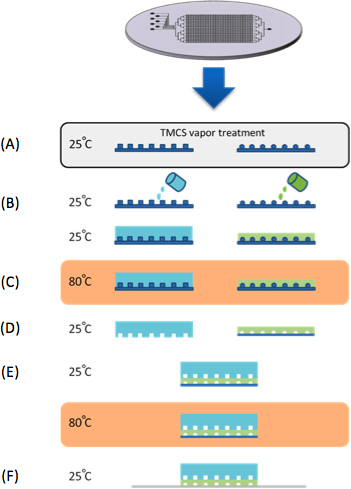
איור 1. ייצור שבבים. () תבניות טופלו באדי TMCS למשך 10 דקות. (ב) PDMS הוא casted על שליטה ותבניות סיליקון זרימה. (ג) לשליטתו ותבניות זרימה נאפות ב80 מעלות צלזיוס למשך 30 דקות. (ד) שכבת השליטה הקלופה של העובש, לחתוך לגודל פתחי כניסה ובקרה נחתכים. (ה) השכבה המלאה תיושר לשכבת הזרימה תחת סטריאוסקופ ואחר כך לאפות ב 80 מעלות צלזיוס למשך 2 שעות. במקביל לייצור מכשיר PDMS, סדרה של גנים סינטטיים microarrayed על אפוקסי זכוכית מצעים מצופים (Associates CEL). (F) המכשיר אז התאים לדנ"א microarray לכידתם של הגנים הסינתטיים המצוי בתאי ה-DNA.

איור 2. תמונה של מכשיר PING. () המכשיר consiרח משתי שכבות PDMS מיושרים (שליטה וזרימה). שכבת הזרימה מכילה תאי DNA ותגובה מקבילים (אפור) הנשלטים על ידי שסתומי micromechanical ("כפתור", "כריך" ואת "צוואר") בשכבה המלאה. (ב) בשכבות מיושר לmicroarray מודפס, שתוכניות כל תא DNA עם נקודה אחת. זו מבטלת כל אפשרות של זיהום.

איור 3. תמונות ניאון של מערך חלבון נוצר עם שבב microfluidic. גני ספוט המודפסים באו לידי ביטוי לחלבונים בתוך המכשיר (בתא ה-DNA) ונוטות כלפי מטה אל פני השטח (מתחת לשסתום "הכפתור" בתגובת החדר) דרכם C-סופי התג שלו. ביטוי חלבון אובחן באמצעות C-myc N-סופי התג ונוגדני ניאון ספציפיים. עוצמת אות שונה מצביעה על רמות ביטוי חלבון שונים. Un-הבחין תאים שמשו כקבוצת ביקורת לרקע levels.
Access restricted. Please log in or start a trial to view this content.
Discussion
במאמר זה אנו מציגים שיטה למערכי חלבון דור בתפוקה גבוהה באמצעות פלטפורמת microfluidic. דור המערך מתבסס על הדפסת microarray של DNA ותבניות ביטוי חלבון במבחנה מהדנ"א בתוך מכשיר microfluidic.
פלטפורמת microfluidic הרומן שלנו יש כמה יתרונות חשובים על ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו נתמכה על ידי מארי קירי הבינלאומי שילוב מחדש מענק.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב / ציוד | חברה | מספר קטלוגים | |
| PDMS-SYLGARD 184 | Dow Corning ארה"ב | תסקס-DC | |
| Chlorotrimethylsilane (TMCS | סיגמה אולדריץ | C72854 | |
| מצעי זכוכית מצופי אפוקסי | CEL Associates ארה"ב | VEPO-25C | |
| פולי אתילן glycole (PEG) | סיגמה אולדריץ | 81260 | |
| dihydrate D-הטרהלוז | סיגמה אולדריץ | T9531 | |
| Biotinylated-BSA | לנקב | PIR-29130 | |
| Neutravidin | לנקב | 31050 | |
| מחומש-ביוטין | Qiagen | 34440 | |
| Hepes | תעשיות ביולוגיות | 03-025-1B | |
| TNT-T7 | Promega | L5540 | |
| נוגדן הגן c-myc Cy3 | סיגמה אולדריץ | ||
| תיבת בקרה | סטנפורד מיקרופלואידיקה יציקה | ||
| עובש | סטנפורד מיקרופלואידיקה יציקה | ||
| פין | ניו אינגלנד קטנה צינורות תאגיד | ||
| צינורות Tygon microbore | Tygon | S-54-HL | |
| Microarrayer | ביו רובוטיקה | MicroGrid 610 | |
| סיכות סיליקון | במקביל Synתזה | SMT-S75 |
References
- Maerkl, S. J. Integration column: Microfluidic high-throughput screening. Integrative biology quantitative biosciences from nano to macro. 1, 19-29 (2009).
- Hong, J. W., Quake, S. R. Integrated nanoliter systems. Nature. 21, 1179-1183 (2003).
- Unger, M. A Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science. 288, 113-116 (2000).
- Gerber, D., Maerkl, S. J., Quake, S. R. An in vitro microfluidic approach to generating protein-interaction networks. Nature. 6, 71-74 (2009).
- Einav, S. Discovery of a hepatitis C target and its pharmacological inhibitors by microfluidic affinity analysis. Nature. 26, 1019-1027 (2008).
- Fordyce, P. M. De novo identification and biophysical characterization of transcription-factor binding sites with microfluidic affinity analysis. Nature Biotechnology. 28, 962-967 (2010).
- Zhu, H. Global analysis of protein activities using proteome chips. Science (New York, N.Y.). 293, 2101-2105 (2001).
- Ramachandran, N. Self-assembling protein microarrays. Science (New York, N.Y.). 305, 86-90 (2004).
- Zhong, J. F. A microfluidic processor for gene expression profiling of single human embryonic stem cells. Lab on a chip. 8, 68-74 (2008).
- Kusnezow, W., Hoheisel, J. D. Solid supports for microarray immunoassays. Journal of molecular recognition JMR. 16, 165-176 (2003).
- Lundin, M., Monne, M., Widell, A., Von Heijne, G., Persson, M. A. A. Topology of the membrane-associated hepatitis C virus protein NS4B. Journal of virology. 77, 5428(2003).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved