Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высокая пропускная способность экспрессии белков генератора с использованием платформы Микрофлюидных
В этой статье
Резюме
Мы представляем микрофлюидных подход к экспрессии белка массивов. Устройство состоит из тысяч реакционных камерах контролируется микро-механических клапанов. Микрофлюидных устройство соединяется с микрочипов печатных библиотеки генов. Эти гены затем расшифрованы и переведены на-чипе, в результате чего белок массива готово для экспериментального использования.
Аннотация
Быстро растущая областях, таких как биология систем, требующих разработки и внедрения новых технологий, обеспечивая высокую пропускную способность и высокую точность измерений больших систем. Microfluidics обещает выполнить многие из этих требований, таких как выполнение высокой пропускной экспериментов скрининга на-чипе, охватывающий биохимических, биофизических и клеточных анализов 1. С первых дней устройства микрофлюидики, это поле резко эволюционировали, что приводит к развитию микрофлюидных масштабная интеграция 2,3. Эта технология позволяет интегрировать тысяч микромеханических клапанов на одном устройстве с почтовую размера следа (рис. 1). Мы разработали высокой пропускной микрофлюидных платформой для создания в пробирке экспрессии белка массива (рис. 2) имени PING (белковые взаимодействия сети Generator). Эти массивы могут служить в качестве шаблона для многих экспериментовтаких как белок-белковых 4, белка-РНК 5 или белок-ДНК 6 взаимодействий.
Устройство состоит из тысяч реакционных камер, которые индивидуально запрограммировать с помощью microarrayer. Выравнивание этих печатных микрочипы для устройств микрофлюидики программ каждой камеры с одного места ликвидации возможного загрязнения или перекрестной реактивности Кроме того, создание микрочипов с использованием стандартных методов микрочипов кровянистые выделения также очень модульной, что позволяет выстроив белков 7, ДНК-8, малых молекул, и даже коллоидные суспензии. Потенциальное воздействие на микрофлюидики биологических наук является значительным. Число микрофлюидики на основе анализа уже представили новые идеи в структуре и функции биологических систем, и поле микрофлюидики будет продолжать влиять на биологию.
протокол
1. Устройство изготовления
- Приобретенные DTPA-D SU-8 формы контроля и SPR220-7 потоке формы из Стэнфордского Microfluidics Foundry ( www.stanford.edu / группы / литейный ).
- Expose силиконовые формы для хлортриметилсилана (TMCS) паром в течение 10 мин для содействия эластомер-релиз после выпечки шаги 9.
- Приготовить смесь из силиконовой основе эластомера и отвердителя (хорошо перемешать) в двух различных соотношениях 5:1 и 20:1 для контроля и поток форм, соответственно. Различные соотношения, необходимые для правильного склеивания нескольких слоев.
- Залить 5:01 PDMS на уровне управления (высотой приблизительно 5 мм). Дега уровня управления и выпекать в течение 30 мин при 80 ° С. Спин пальто (Лорел, США) 20:01 PDMS смесь на слой потока в 2600 оборотов в минуту в течение 60 секунд, а затем выпекать при температуре 80 ° С в течение 30 мин. Скорость спин нанесения покрытий оптимизирован для срабатывания клапана при давленииот 15 фунтов на квадратный дюйм. Быстрее вращающийся приведет к более тонкий слой с более низким давлением активации и наоборот. Устройства, которые мы используем, имеют предел в 25 фунтов на квадратный дюйм в контрольной и 10 фунтов на квадратный дюйм в потоке, над которой отрыва от подложки может произойти.
- Отделить уровень управления из формы. Делайте это медленно и быть осторожными, чтобы не чистить SU8 шаблону. Затем вырежьте устройства по периметру и пробить отверстия для доступа к каналам управления.
- Совместите потоков и управления слоями вручную в стереоскоп. Начать, совместив верхний левый угол; кнопку клапана (уровень управления) должны быть в центре реакционной камеры (поток слоя). Далее, выравнивание первой строки и осторожно выпустить ряд уровень управления по строкам. Убедитесь, что все клапаны кнопки находятся в середине реакции камеры и, что адрес и входных клапанов пересекают каналы потока в правильном положении. Этот процесс может быть повторен локально, пока все строки выровнены. В конце концов, выпустить любое напряжение в PDMS бУ подняв его тщательно от сторон и углов. Не поднимайте слишком много или смещения могут возникнуть.
- Выпекать в течение 2 часов при 80 ° C.
- Вырезать по всему периметру устройства и кожуру двух слоев устройство (чип) от потока плесень. Пробивать отверстия для доступа к потоку каналов (рис. 1).
2. Выстроив ДНК и устройств выравнивания
- Производства синтетических генов сборки ПЦР. Синтетические гены составляют Т7 промотор, сайт связывания рибосомы (RBS), ORF с двумя тегами эпитопа (по одному на каждом конце), и Т7 терминатор 4. Гены могут различаться по длине от 100 б.п. до, по крайней мере, 5.000 ВР.
- Подготовка синтетических генов для выстроив: приготовить смесь из поли этилена гликолевая (1,25%) и D-трегалозы дигидрат (125 мг / мл) и распределяют 2 мкл на реакцию в 384 пластины скважин. Это решение позволит снизить необратимым связыванием ДНК стекла, а также для визуализации при выравнивании 10.
- Передача синтетических генов в 384 пластины скважин. Обычно концентрации ДНК может варьироваться от 10 нг / мкл до 100 нг / мкл конечной концентрации. Добавить дН 2 O до конечного объема 20 мкл (в зависимости от microarrayer и контактный).
- Определить ряд синтетических генов на эпоксидным покрытием подложки стекло с помощью microarrayer. Мы используем Microgrid 610 (Bio Robotics) с SMT-S75 силиконовых штифтов (параллельного синтеза, США). Связаться с печатью ДНК, с этими конкретными контактами, приводит пятна диаметром около 100 мкм на поверхности стекла. Каждый контакт нагрузки достаточно для примерно 100 мест. Убедитесь в том, столбцов и строк смолы соответствуют конкретным устройством используется. Устройство мы используем содержит 16 столбцов и 40 строк с шагом 680 мкм 320 мкм, соответственно.
- Ручное выравнивание микрофлюидных устройство с геном массиве под стереоскоп. ДНК пятно должно быть в середине ДНК камер. Начать выравнивание за счет размещения первого ряда пятен бElow первой строке ДНК камер. Затем, привести в соответствие остальных строк заканчивая тонкой настройкой устройства в целом. После массива выравнивается следует позаботиться, чтобы облегчить любое напряжение в PDMS, подняв его на месте. Если есть напряжение остается в PDMS она не может связью хорошо микрочипов.
- Наконец, связь устройства к стеклу по инкубации в течение ночи на горячей плите при температуре 80 ° C.
3. Грунтовка и активация устройства
- Клапанами в контрольной слоя приводятся в действие с компьютера с помощью LabVIEW. Сценарий LabVIEW контролирует ряд электромагнитных клапанов микро через электронный блок управления (приобретается из Стэнфордского Microfluidics Foundry). Многообразие электромагнитный клапан подключен к сжатым воздухом, которые управляют потоком воздуха и давления в регулирующей арматуры на устройстве.
- Подключите устройство к многообразию электромагнитные клапаны использованием гибких пластиковых труб с внутренним диаметром 0,02 "(Tygon) И нержавеющей стали штифт (New England трубочки Corporation).
- Заполните труб с пониженным содержанием дейтерия и вставить штифт в доступе отверстия уровень управления. Убедитесь, что каждая трубка подключена к соответствующему каналу управления.
- Запустите приложение LabVIEW на компьютер, чтобы активировать каналы управления. При активации клапана от сценария LabVIEW, мы применяем давление воздуха, что в свою очередь будет толкать воду в каналы PDMS управления. Установить давление воздуха до 5 фунтов на квадратный дюйм. Рекомендуется, чтобы заполнить «сэндвич» и адрес клапанов первого, с целью выявления поперечных переговоры между каналами управления дефектных устройств. В случае поперечного переговоров, приведение в действие «сэндвич» линии управления приведет к срабатывание либо на шее или линий кнопки управления. Это похоже на короткое замыкание в электрической цепи. Устройство с перекрестные помехи неисправен и не может быть использован.
- После того как все каналы управления и клапаны не имеют полной DDW, клапаны загрунтовать и причинамду, чтобы блокировать поток каналов под ними. Увеличение давления воздуха до 15 фунтов на квадратный дюйм. Valve активация осуществляется с программой LabVIEW с помощью набора включения / выключения переключателя подключены к отдельным электромагнитных клапанов. Каждый переключатель управляет конкретной линии управления через соответствующий клапан. Включение выключателя кнопку (в сценарии) будет применяться давления воздуха в соответствующей трубы. Атмосферное давление будет толкать DDW в линии управления и приведет к расширению микрофлюидных клапаны, блокирующие канал под ним. Отключение клапана, выпустит давление воздуха, а затем отпустить блокировку соответствующего канала потока.
- Чтобы убедиться, что все вентили открыты, подключить трубку к одному из входов потока и потока воздуха в устройстве на 4-5 атм. Это будет выпускать любые липкие клапаны из стекло.
- Наконец, устройство загрунтованы и готовы. Закройте все входные и 'шея' клапаны, чтобы начать химии поверхности.
- В целях содействия самоорганизации белка массив на поверхности и предотвращения неспецифической адсорбции в микрофлюидных устройство, поверхность химически модифицированных:
- Для течь компонентов через устройство, подключить новые трубки с искомым решением одного из каналов потока в устройство. Подключите свободный стороне трубки к руководству многообразие и открыть воздушный поток давлением (5 фунтов на квадратный дюйм).
- Загрузите 40 мкл биотинилированных-BSA (1 мкг / мкл) в новую пробирку и потоке примерно половина ее в течение 20 мин через устройство, BSA будет связываться с эпоксидной поверхности.
- Используйте Hepes (50 мм) для стиральных непрореагировавшего субстрата между каждым из различных этапов химии поверхности.
- Поток 25 мкл Strepavidin (0,5 мкг / мл) в течение 20 мин на верхней части биотинилированного-BSA.
- Промыть Hepes в течение 5 мин.
- Закрыть 'кнопку' клапана и течь остальные биотинилированного-BSA (как descriКровать выше), пассивации поверхности вокруг кнопки.
- Промыть Hepes в течение 5 мин.
- Отпустите 'кнопки' клапана и потока 30 мкл пента-His-биотина (0,16 мкг / мкл) в течение 20 мин. Антитела будут связываться с открытой strepavidin, а именно в районе, находящемся под "кнопку" создание анти Его-теги массива.
5. Экспрессии белков
- Выразите белков на устройстве с помощью ретикулоцитов кролика быстро сопряженной транскрипции и трансляции реакции. Экспрессии белка из пятнистых синтетических генов на устройство создает массив из белков готова к использованию. Например, одним из таких является использование для связывания с белками экрана.
- Откройте 'шея' клапанов и потока ретикулоцитов кролика быстро сопряженной транскрипции и трансляции реакции через устройство в ДНК камеры. Затем закройте «сэндвич» клапанов и отделить каждый ген из ее окружения. Выдержите устройство на горячей плите в течение 2,5 часа при 30 ° C. Выразили пр.oteins будет диффундировать из ДНК камеры в реакционную камеру спонтанно (шея клапан открыт) и привязку к борьбе с Его антител под "кнопку" клапан иммобилизации белка через С-концом тега.
- Этикетка белки с C-Myc антитела Cy3. Антитела будут связываться с соответствующим эпитопу расположен на белок N-конца.
- Определение уровня экспрессии белка со сканером микрочипов (LS Reloaded, Tecan) с использованием 532 нм лазер, 575 нм излучения фильтром.
6. Представитель Результаты
1. Устройство изготовления
Графический дизайн для устройств был создан AutoCAD на основе наших экспериментальных потребностей. Конструкция была напечатана на прозрачной пленке с помощью изображений с высоким разрешением сеттера. Эта прозрачность служит фотошаблонов в контакте фотолитографии. Техника поверхностной микрообработки был использован для создания 3-D шаблонов на кремниевой подложке определяется моделей включенных тОн масок.
Микрофлюидных устройство было изготовлено на силиконовые формы литья силиконового эластомера полидиметилсилоксана (PDMS, Sylgard 184, Dow Corning, США) (рис. 1). Каждое устройство состоит из двух слоев выровненный PDMS, расхода и уровня управления. Форма впервые столкнулся с хлортриметилсилан (TMCS, Aldrich) пара в течение 10 мин для содействия эластомер-релиз после выпечки шаги. Смесь силиконового эластомера на основе и отвердителя была подготовлена в двух разных соотношении 5:1 и 20:1 для контроля и поток форм, соответственно. Уровень управления дегазировали и запеченные в течение 30 мин при 80 ° С. Поток слой был первоначально спина покрытием (Лорел, США) в 2600 оборотов в минуту в течение 60 секунд и запекать при 80 ° С в течение 30 мин. Управление слой был отделен от своей формы и контроля отверстия канала доступа были пробиты. Далее, поток и управление слоями были согласованы вручную в стереоскоп и запекают в течение 2 часов при 80 ° C. Эти два слоя устройство очищенные FROM формы потока и отверстия каналов доступа были пробиты.
2. Описание устройства
Пропускная способность устройства может варьироваться от 500 до 10000 ячеек (рис. 2). Устройство состоит из двух слоев; поток слой (серый) и уровень управления (цвет). Уровень управления содержат различные клапаны с другой функцией. Каждая ячейка, в течении слой, состоит из одной ДНК и одной реакционной камере и находится под контролем трех типов микромеханических клапанов; 'шея', 'кнопки', и 'сэндвич' (рис. 2A). «Синтетического гена" пятнистый хранение в ДНК камере их из реакционной камеры 'шея' клапана (зеленый). Захват и механической промывке поверхности связанного белка в реакционной камере осуществляется с помощью "кнопки" клапана (синий). «Сэндвич» клапан позволяет каждой реакции происходят в собственной ячейке (красный). Адрес клапаны можно разделить устройства до 8 независимых разделов, differeNT условия анализа. Кроме того, уровень управления содержат входные клапаны, которые позволяют поток выбран жидкости в потоке слоя. Каналы PDMS контроля полны DDW. Когда клапан срабатывает увеличение давления (15 бар) приводит к расширению PDMS. В местах, где мембрана является достаточно тонким (т.е. пересечения управления и линии тока) этого достаточно, чтобы полностью перекрыть трубопровод. Средняя высота ячейки составляет 10 мкм, а средний объем элементарной ячейки составляет менее 1 NL.
3. Экспрессии белков и обнаружения
Белки были высказаны на устройстве с помощью ретикулоцитов кролика быстро сопряженной транскрипции и трансляции реакции (Promega). Экспрессии белков создали массив белков готовы к использованию в привязке экрана (рис. 3). Выражение смеси (12,5 мкл) был загружен в устройство, а затем затоплен в ДНК камеры, открыв 'шея' клапанами. Далее, «сэндвич» клапаны былизакрыты оставив каждой элементарной ячейки отделены от соседних клеток и устройство инкубировали на горячей плите в течение 2,5 часа при 30 ° C. Выразил белки распространяются через ген камеры в реакционную камеру, где их C-конце тега Его можно привязать анти-His антител (Qiagen), локализованных в разделе "Кнопка" клапан иммобилизации белков на поверхности. Белки были помечены C-Myc Cy3 (Sigma), который связан с соответствующим эпитопу расположен на белок N-конца и назвал его. Уровни экспрессии белка определяли с помощью сканера микрочипов (LS Reloaded, Tecan) с использованием лазерных 532 нм и 575 нм фильтра. В результате белок массив состоит из различных уровней экспрессии белка. Как правило, около 20% генов библиотеки не в состоянии выразить заметных уровней. Никакой корреляции с белком размер наблюдался 3. Фоновые уровни были определены с использованием камер, которые не были замечены с ДНК. Таким образом, сигналы от соответствующих камер белка обусловлено либо пУаз или неспецифической адсорбции на маркировке антител.
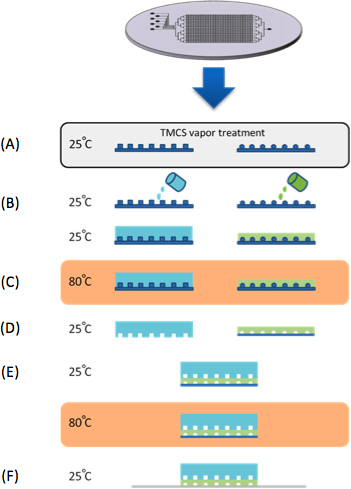
Рисунок 1. Чип изготовления. (A) Пресс-формы лечили TMCS парами в течение 10 мин. (B) PDMS кастуется по контролю и формы потока кремния. (C) Оба контроля и поток формы выпекаются в 80 ° С в течение 30 мин. (D) уровень управления очищенные формы, нарезанные по размеру и контроля входа пробиваются. (E) уровень управления выравнивается по потоку слой под стереоскоп, а затем запеченные в 80 ° C в течение 2 часов. Параллельно с изготовлением устройства PDMS, ряд синтетических генов microarrayed на эпоксидным покрытием стеклянной подложке (CEL Associates). (F) устройство затем выравнивается по ДНК-микрочипов захвата "синтетических генов в ДНК камер.

Рисунок 2. Фото PING устройства. (A) устройства ПОСЛУЖИТЬго из двух слоев выровненный PDMS (контроль и поток). Поток слой содержит параллельных камер ДНК и реакцию (серый) контролируется микромеханических клапанов ("кнопка", "сэндвич" и "шея") в контрольной слоя. (B) слоев выравниваются по печатной микрочипов, какие программы каждый ДНК камеру с одного места. Это исключает любые потенциальные загрязнения.

Рисунок 3. Флуоресцентные изображения белка массив, созданный с Микрофлюидных Chip. Печатных генов месте были выражены с белками внутри устройства (в ДНК палата) и были разобраны на поверхности (под "кнопку" клапана в реакционной камере) через их С-концом его тег. Экспрессии белка было обнаружено, используя их C-Myc N-конца теги и конкретных флуоресцентных антител. Различной интенсивности сигнала указывают на различные уровни экспрессии белка. Un-пятнистый камер служил в качестве контроля для фона леВелс.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этой статье мы представляем метод для генерации белка массивов в высокой пропускной способности, используя микрофлюидных платформы. Массив поколения на основе микрочипов печати ДНК шаблоны и в пробирке экспрессии белка с ДНК в микрофлюидных устройства.
Наш рома...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана Мари Кюри международной интеграции гранта.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент / Оборудование | Компания | Номер в каталоге | |
| PDMS-Sylgard 184 | Dow Corning США | ESSEX-DC | |
| Хлортриметилсилан (TMCS | Sigma-Aldrich | C72854 | |
| С эпоксидным покрытием стеклянных подложках | CEL Associates США | VEPO-25C | |
| Поли гликолевая этилена (PEG) | Sigma-Aldrich | 81260 | |
| D-трегалозы дигидрат | Sigma-Aldrich | T9531 | |
| Биотинилированного-BSA | Проколоть | PIR-29130 | |
| Neutravidin | Проколоть | 31050 | |
| пента-His-биотин | Qiagen | 34440 | |
| Hepes | Биологические Industries | 03-025-1B | |
| TNT-T7 | Promega | L5540 | |
| C-Myc антитела Cy3 | Sigma-Aldrich | ||
| Блок управления | Стэнфордский Microfluidics Литейное | ||
| Плесень | Стэнфордский Microfluidics Литейное | ||
| Pin | Новая Англия трубочки корпорации | ||
| Tygon microbore труб | Tygon | S-54-HL | |
| Microarrayer | Bio Robotics | Microgrid 610 | |
| Силиконовые контакты | Параллельно Synдиссертация | SMT-S75 |
Ссылки
- Maerkl, S. J. Integration column: Microfluidic high-throughput screening. Integrative biology quantitative biosciences from nano to macro. 1, 19-29 (2009).
- Hong, J. W., Quake, S. R. Integrated nanoliter systems. Nature. 21, 1179-1183 (2003).
- Unger, M. A Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science. 288, 113-116 (2000).
- Gerber, D., Maerkl, S. J., Quake, S. R. An in vitro microfluidic approach to generating protein-interaction networks. Nature. 6, 71-74 (2009).
- Einav, S. Discovery of a hepatitis C target and its pharmacological inhibitors by microfluidic affinity analysis. Nature. 26, 1019-1027 (2008).
- Fordyce, P. M. De novo identification and biophysical characterization of transcription-factor binding sites with microfluidic affinity analysis. Nature Biotechnology. 28, 962-967 (2010).
- Zhu, H. Global analysis of protein activities using proteome chips. Science (New York, N.Y.). 293, 2101-2105 (2001).
- Ramachandran, N. Self-assembling protein microarrays. Science (New York, N.Y.). 305, 86-90 (2004).
- Zhong, J. F. A microfluidic processor for gene expression profiling of single human embryonic stem cells. Lab on a chip. 8, 68-74 (2008).
- Kusnezow, W., Hoheisel, J. D. Solid supports for microarray immunoassays. Journal of molecular recognition JMR. 16, 165-176 (2003).
- Lundin, M., Monne, M., Widell, A., Von Heijne, G., Persson, M. A. A. Topology of the membrane-associated hepatitis C virus protein NS4B. Journal of virology. 77, 5428(2003).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены