Method Article
כל תא הקלטות בו זמנית מקולטני אור ועל נוירונים מסדר שני בהכנה פורסים רשתית אמפיבי
In This Article
Summary
אנו מתארים את ההכנה של פרוסות רשתית דקות ממימיות נמר סלמנדרות ( Ambystoma tigrinum) ולהסביר כיצד אנו משתמשים בפרוסות אלה ללמוד עיבוד הסינפטי ברשתית על ידי קבלת הקלטות מהדק מתח כל תא כפולים מקולטניים אור ותאים אופקיים ודו קוטביים שני מסדר.
Abstract
אחת המשימות המרכזיות במדעי מוח רשתית הוא להבין את המעגל החשמלי של תאי עצב ברשתית וכיצד קשרים אלה אחראים לעיצוב את האותות המועברים למוח. פוטונים מזוהים ברשתית על ידי מוט וקונוס קולטני אור, הממיר את האנרגיה הזאת לאות חשמלי, שמסר אותה לתאי עצב אחרים ברשתית, שם הוא מעובד ומועברים ליעדים מרכזיים במוח דרך עצב הראייה. תובנות מוקדמות חשובות לתוך מעגלי רשתית ועיבוד חזותי באו מהמחקרים היסטולוגית של 1,2 Cajal, ומאוחר יותר, מהקלטות אלקטרו של פעילות spiking של תאי הגנגליון ברשתית - תאי הפלט של הרשתית 3,4.
הבנה מפורטת של עיבוד חזותי ברשתית דורשת הבנה של האיתות בכל שלב במסלול מphotoreceptor לתא הגנגליון ברשתית. עם זאת, הרבה סוגי תאים ברשתית הם ספחתמטען חבלה עמוקה ברקמה ולכן נגיש יחסית להקלטת אלקטרו. מגבלה זו ניתן להתגבר על ידי עבודה עם פרוסות אנכיות, שבו תאים המתגוררים בתוך כל אחת משכבות הרשתית הם נראים בבירור ונגישים עבור הקלטת אלקטרו.
כאן, אנו מתארים שיטה לביצוע סעיפים אנכיים של רשתית מזחל נמר סלמנדרות (Ambystoma tigrinum). אמנם הכנה זו פותחה במקור עבור הקלטות עם microelectrodes החדים 5,6, אנו מתארים שיטה להקלטות מהדק מתח כל תא כפולים מקולטניות אור ותאים אופקיים ודו קוטביים שני מסדר שבו אנו לתפעל פוטנציאל הממברנה של photoreceptor בעת הקלטה בו זמנית לאחר תגובות הסינפטי בתאים אופקיים או דו קוטביים. את קולטני האור של סלמנדרת הנמר הוא הרבה יותר גדול מאלה של מיני יונקים, מה שהופך את זה הכנה אידיאלית שבו יתחייב לאהגישה הניסויית המאתגר מבחינה טכנית שלו. ניסויים אלה מתוארים עם עין לכיוון לחקור את המאפיינים של איתות סרט סינפטי - סינפטי מבנה מיוחד שנמצא ברק קומץ של תאי עצב, כולל מוט וקונוס קולטני אור, שהוא גם מתאים לשמירה על שיעור גבוה של טוניק שחרור הנוירוטרנסמיטר 7 , 8 - ואיך זה תורם למאפיינים הייחודיים של איתות סינפסה הרשתית הראשונה הזה.
Protocol
1. הכנת פרוסות רשתית
- להרכיב את התא (עיצוב באיור 1). מקום שני אגלי שומן ואקום, במרווחים ~ 8-10 מ"מ זו מזו, על פני חדר ההקלטה ליצירת ערוץ לsuperfusate ושבו כדי להטביע את פרוסות הרשתית. הוסף שני חרוז של שומן כמה מילימטרים רחוקים יותר מעבר לכל אחד משני אגלי שומן אלה לפעול כסכר וגלישת גבול. מניחים חתיכה קטנה של KimWipe משולשת בקצה של החדר, כדי להבטיח מגע עם נוזל אלקטרודה ההשוואתית.
- לחץ פיסת קרום nitrocellulose (~ 5 x 10 מ"מ; 0.8 נקבוביות מיקרומטר) שטוח על שקופיות מיקרוסקופ הזכוכית לשני חרוזים קטנים של שומן ואקום. יש להימנע מלמקם גריז ישירות מתחת למרכזו של קרום nitrocellulose, כמו זה יכול למנוע את הרשתית מהדבקות.
- כדי להכין את מבצע הרקמות, לשבור את סכין גילוח קצה כפול ל -4 חתיכות ולצרף אחד לזרועות חיתוך. לחתוך פרוסה דקה של nitrocellulקרום OSE כדי להבטיח שחוד החנית של סכין הגילוח מניח שטוח נגד תא ההקלטה ולכן חותך צורה נקיה דרך קרום nitrocellulose.
- שמור על כוס קטנה של תמיסת מלח דוחי (טבלת 1) על קרח בתחנה לנתיחה.
- להרדים סלמנדרה על ידי עריפת ראש. Hemisect ראש sagitally ושעם דרך חוט השדרה. מחצית במקומו של הראש על פיסת צמר גפן טבולה בתמיסת מלח דוחי על גבי בלוק הלינוליאום. החצי השני של הראש יכול להיות עטוף במגבת נייר לחה ומאוחסן על 4 מעלות צלזיוס לשימוש מאוחר יותר באותו היום.
- Enucleate העין. בעזרת מספריים Vannas קטנים, לחתוך את העור המחבר את העין למסלול הסובב. לאחר שחרור הקדמי של העין מהרקמה מסלולית שמסביב, מושך את העין קדימה והחלק את המספריים מתחת לעין כדי לחתוך את שרירי העין ואת עצב ראייה, לשחרר את העין ממסלולו.
- הנח את העין enucleated על מצע של צמר גפן עלבלוק. הלינוליאום מחק את מחצית הראש. Trim שומן מסלולית עודף מהחלק האחורי של העין.
- לעשות חתך קטן במרכזה של קרנית עם להב כירורגי חד. הסר את הקרנית על ידי הזזה מספריים Vannas עדינים לתוך החתך והארכת לחתוך רדיאלית החוצה לכיוון serrata האורה. חותכים circumferentially סביב serrata האורה על ידי ההחלפה של הבלוק לינולאום או הכותנה בין קיצוצים.
- לאחר חיתוך כל הדרך סביב העין, להסיר את הקרנית ואת העדשה על ידי משייכתם מהצד של עיינית. הזז את עיינית התוצאה על משטח קשה של גוש הלינוליאום טבולה בתמיסת מלח האמפיביים. לחתוך אותו לשלישים עם סכין גילוח חד בתנועות ניסור עדינות, כדי להבטיח שיש לך לחתוך את כל הדרך דרך לובן העין.
- מקום אחד או שתי חתיכות של עיינית על קרום nitrocellulose עם פני שטח הרשתית פונות כלפי מטה. להטביע את החתיכות שנותרו עם מי מלח נוסף ומניח אותם במקרר ב~ 4 ° C.
- גהntly לחץ על פיסת עיינית נגד קרום nitrocellulose עם מלקחיים עדינים. להטביע את קרום nitrocellulose וחתיכת עיינית עם כמה טיפות של מי מלח קר ודוחים כתם בקצוות עם KimWipe לעזור הרשתית לדבוק. שוב, להטביע את עיינית וקרום nitrocellulose עם כמה טיפות של תמיסה מי מלח קר דוחי ולקלף את האפיתל לובן העין / דמית העין / רשתית פיגמנט לבודד את הרשתית (שיכול להופיע ורוד בשל נוכחותם של rhodopsin מולבן). במידת צורך, לחתוך את עצב הראייה לשחרר את הרשתית.
- אם הרשתית אינה דבקה בחוזקה, להתנקז המלוחים עם Kimwipe למשוך את הרשתית למטה יותר בחוזקה על קרום nitrocellulose. החלף את תמיסת מלח. חזור, במידת צורך.
- למלא את התא עם מי מלח דוחי קר ולהעביר אותו לשלב של מבצעה הרקמה. פורסים את הרשתית וקרום nitrocellulose לרצועות דקות, עבודה מקצה אחד לקצה השני על ידי סיבוב מיקרומטר רניהבמרווחים של 125 מיקרומטר. לחץ על סכין הגילוח בעדינות אך בתקיפות דרך הרשתית וקרום nitrocellulose.
- העבר את פרוסות רשתית על ידי הזזת רצועות של קרום nitrocellulose לערוץ הראשי של חדר ההקלטה. הרם רצועה של קרום חופשי ולאחר מכן להחזיק אותו במקום בעת הזזת החדר מתחתיו, להיות בטוח כדי לשמור את הפרוסות מתחת למים. הטמע את הקצוות של קרום nitrocellulose ברצועות שומן ואקום, מסתובב להם 90 מעלות כדי להציג את שכבות הרשתית.
- לחץ שטוחות קרום nitrocellulose כנגד משטח הזכוכית. גם אם יש לא רשתית על כל פיסה, רצועות מקום של קרום nitrocellulose במרווחי זמן קבוע (~ 1 מ"מ זה מזה) לאורך כל אורכו של ערוץ זלוף כדי לעזור לשבור את מתח הפנים ולשפר את זרימת נוזל.
2. כל תא הקלטות לזווג
- אחרי כל את הפרוסות הועברו, להזיז את תא ההקלטה לשלב של זקוף, קבועהמיקרוסקופ הבמה ולצרף את ההובלה אלקטרודה ההשוואתית. להתמקד בפרוסות באמצעות מרחקים ארוכים עובדים, טבילה במים, 40-60x אובייקטיבי. מיקרוסקופ צריך להיות ממוקם על שולחן אוויר כדי לצנן את התנודות ומוקפות בכלוב פאראדיי כדי להפחית הפרעות חשמליות.
- Superfuse את הפרוסות ברציפות בשיעור של מ"ל / דקה 1 עם תמיסת מלח דוחי מבעבעים עם 100% O 2. חבר את היניקה, ולוודא כי יבוא והיצוא הם מאוזנים. יצוא יכול להיות מוסדר על ידי סיבוב הקצה המשופע של מחט השאיבה או על ידי העברת KimWipe בסוף התא קרובה יותר או רחוקה יותר ממחט יצוא. יכולה להיות כל הזמן ההכנה בטמפרטורת חדר או מקורר עם מכשיר פלטייה או פשוט על ידי קביעת שקית קרח על הבמה מיקרוסקופ.
- בחן את הפרוסות תחת אור עמום או אינפרא אדום ולזהות זוג תאים - photoreceptor (מוט או קונוס) ותא אופקי או דו קוטבי קרוב - ליעד להקלטה כל התא. מוטות יכולות להיות אניdentified ידי גופי התא הגדולים שלהם וכמו מוט מגזרים חיצוניים בולטים (איור 2 א). קונוסים קטנים יותר ממוטות ויש מגזרים חיצוניים מחודדים קטנים. תא דו קוטבי וsomas תא האופקי הם בשורה החיצונית ביותר של גופי תא בשכבת הגרעין הפנימי (INL; דמויות 2B ו 2 ג).
- לפני הכנת פרוסות, השתמש בחולץ פיפטה לייצר micropipettes מזכוכית ורוסיליקט (קוטר חיצוני 1.2 מ"מ, קוטר 0.95 מ"מ פנימי עם חוט זכוכית). הקצה של כל micropipette צריך להיות ~ 1-2 מיקרון בקוטר.
- באמצעות מחט מילוי לא מתכתית (לדוגמה אחד מיוצרת ממזרק 1 סמ"ק או MicroFil), למלא pipettes עם הפתרון תאי (טבלת 1) ולצרף למחזיק האלקטרודה.
- לרומם את מטרת מיקרוסקופ במקצת. מקם את פיפטה photoreceptor מתחת למטרה ולאחר מכן להוריד אותו כך שהקצה ממוקם בדיוק מעל את הפרוסות. חזור עם tהוא טפטפת שני.
- התאם כל קיזוז ברמה הנוכחית הבסיסית על המגבר. בדקו את התנגדות פיפטה עם דופק depolarizing mV 5-10. בדרך כלל אנו משתמשים בטפטפות שהטווח 10-15 MΩ, התוצאה של להתחדד הארוך של הפיר וosmolarity הנמוך של פתרונות פיפטה דו החיים. עם פתרונות יונקים osmolarity גבוהים יותר, אותם pipettes מפגין ערכי התנגדות של ~ 8-12 MΩ. אמנם יש לנו בשימוש בקטרים טיפ גדולים יותר עם ערכי התנגדות של 3-4 MΩ בפתרונות דו חיים, את היתרונות הניתנים על ידי התנגדות גישה נמוכה מתקזזים עם קשיים רבים באיטום על גבי קרום תא ומוזנח מהיר יותר של זרמי סידן ושליח שני אחר תגובות רגישות.
- תוך יישום קל חיובית לחץ, עמדת פיפטה פוסט סינפטי כך שהוא קשר גוף התא האופקי או דו קוטבי. לאחר מכן מקם את פיפטה presynaptic כך שהוא קשר גוף התא של photoreceptor מוט או קונוס. הקלטות appeAR להיות יציב יותר, כאשר טיפים פיפטה לפנות המגזר הפנימי ולא הסומא, במיוחד בקונוסים.
- תוך מעקב ההתנגדות לשחרר את הלחץ החיובי על פיפטה פוסט סינפטי. לפעמים, על שחרורו של לחץ חיובי מספיק כדי ליצור חותם gigaohm. אם לא, תחול שאיבה עדינה עם מזרק 1 מ"ל או דרך פה. לאחר התנגדות הטיפ גדלה> 100 MΩ, להחיל פוטנציאל החזקת -60 mV. לאחר קבלת חותם gigaohm, null את כל עוברי קיבול פיפטה ולחזור על תהליך האיטום לפיפטה photoreceptor, החלת פוטנציאל החזקת mV -70.
- קרע התיקון על ידי שימוש בפה שלך או מזרק ליישם יניקה לכל תא בתורו. מוטות, חרוטים, ותאים דו קוטבי יהיו בדרך כלל קרע עם שאיבה עדינה. קבלת תצורה כל תא עם תא אופקי עשויה לדרוש יניקה גדולה יותר (כלומר עם מזרק סמ"ק 3) בשילוב עם פולסים מהירים מתח חזקים נמסרו עם F "זאפ"eature של מגבר תיקון המהדק. הקרע של הקרום והקמתה של תצורה כל התא יהיה ברור על ידי הופעתו של ארעיים קיבול כל התא.
- לאשר את הזהות של תא פוסט סינפטי פיזיולוגית על ידי יישום הבזק אור ומספק שורה של צעדי מתח מ-120 ל40 mV במרווחים של 20 mV (איורים 3 ו -4).
- כדי להעריך אם זוג התאים מחובר synaptically, לספק, שלילת קוטביות קצרה (25-100 אלפיות השני) 60 mV צעד לphotoreceptor (ל -10 mV, בסמוך לשיא של L-סוג סידן מתח מגודרת הנוכחי) ולחפש לזרמי פוסט סינפטיים בנוירון הצו השני (איור 5). צעד depolarizing חזק צריך לעורר נוכחי מהר, חולף פנימה פוסט סינפטי בתא דו קוטבי האופקי או OFF פוסט סינפטי הנגרם על ידי פרץ של שחרור משלפוחית החרוט (איור 5).
תוצאות
עקבות נציג של תגובות אור מתאי עצב ברשתית פרוסות אנכיות של סלמנדרה מוצגות באיור 3. קונוס, התא אופקי, וOFF התא דו קוטבי כל להציג כלפי חוץ נוכחי, בתגובה להופעת אור. בולט פנימה הנוכחי בעקבות הבזק האור בהקלטות התא האופקיות ודו קוטביות נגרמת על ידי השחרור המוגבר של גלוטמט מקולטני אור כפי שהם depolarize באור קיזוז. בתא דו קוטבי מגיב עם זרם פנימה בתחילת האור כתוצאה ממפל הכניסה היפוך metabotropic גלוטמט רצפטור איתות והפעלה של TRPM1 ערוצים 9. ניתן להבדיל בין אחד לשני תאים אופקיים ותאים דו קוטביים במערכות היחסים שלהם IV (איור 4). תאים אופקיים יש התנגדות מבוא ליניארי או פנימי לתיקון הרביעי ונמוכה (<500 MΩ; איור 4 א) בדרך כלל, בעוד שהתאים דו קוטבי התנגדות כניסה גבוהה(0.5-2 GΩ) ו- תיקון כלפי חוץ אני - V (איור 4) איור 5 מציג תוצאות נציג מהקלטות של זוג תא חרוט אופקי (איור 5 א) וזוג תא דו קוטבי חרוט OFF (איור 5).. בכל אחד, depolarizing קונוס ל-10 mV מפוטנציאל החזקת mV -70 עורר סיד מתח מגודרת נוכחי בחרוט וEPSC פנימה מהר בתא האופקי או דו קוטבי. גירוי חזק זה מספיק כדי לרוקן את בריכת בקלות-releasable של ~ 20 שלפוחית מסרט הסינפטי, וכתוצאה מכך EPSC של 47 ~ רשות / סרט 10. EPSC התא האופקי באיור 5 א היה 232 הרשות הפלסטינית, מה שמרמז שהוא קיבל 5 מגעי סרט מקונוס presynaptic. הערכה דומה מהרשות הפלסטינית EPSC 178 בתא דו קוטבי מחוץ (איור 5) מצביעה על כך שהוא קיבל 4 קשרי סרט מקונוס presynaptic.
| דוחים מלוחים | פיפטה presynaptic | פיפטה postsynaptic | |
| NaCl | 116 מ"מ | 3.5 מ"מ | 3.5 מ"מ |
| KCl | 2.5 מ"מ | ||
| CaCl 2 | 1.8 מ"מ | 1 מ"מ | 1 מ"מ |
| MgCl 2 | 0.5 מ"מ | 1 מ"מ | 1 מ"מ |
| HEPES | 10 מ"מ | 10 מ"מ | 10 מ"מ |
| גלוקוז | 5 מ"מ | ||
| CS-גלוטמט * | 40 מ"מ | ||
| CS-גלוקונאט ** | 50 מ"מ | 90 מ"מ | |
| כלוריד Tetraethylammonium | 10 מ"מ | 10 מ"מ | |
| ATP-Mg | 9 מ"מ | 9 מ"מ | |
| GTP | 0.5 מ"מ | 0.5 מ"מ | |
| EGTA | 5 מ"מ | 5 מ"מ | |
| PH *** | 7.8 | 7.2 | 7.2 |
| Osmolarity **** | 245 mOsm | 240 mOsm | 240 mOsm |
* CS-גלוטמט נעשה על ידי נטרול חומצת 40 מ"מ L-גלוטמית עם CsOH 40 מ"מ בפתרון פיפטה. ** מניית ז 1 של CS-גלוקונאט נעשית על ידי נטרול פתרון של CsOH עם 45-50% חומצת D-gluconic. *** ה-pH צריך להיות מותאם עם NaOH לפתרון וCsOH תאיים עבור פתרונות פיפטה. **** שמירת osmolarity מפתרונות פיפטה בדיוק מתחת לזה של הפתרון תאי מונע נפיחות תא ומשפר את תוחלת חיים של ההקלטה.
שולחן1. רכיבים ופרמטרים לפתרונות תאיים וחוץ תאיים הסטנדרטיים המשמשים בפרוטוקול זה.
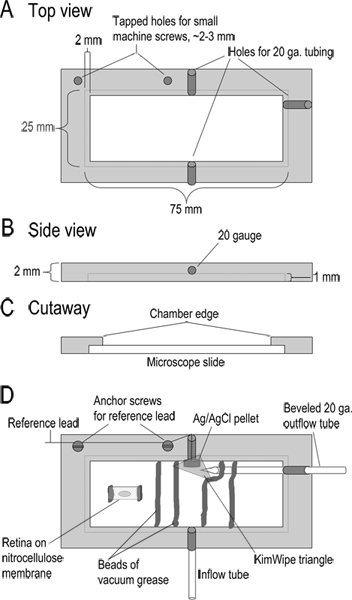
איור 1. עיצוב תא הקלטה. (AC) למעלה, בצד, ונוף של חתך של תא ההקלטה מראה ממדים. הקאמרית הוא מכונה מחתיכה עבה 2 מ"מ של אקריליק. (ד ') קאמרי מורכב. Superfusate נכנס לתא דרך אורך 10 ס"מ של צינורות טפלון (צינור זרימה; סוג 24LW). Superfusate יוסר על ידי יישום יניקה קלה לצינור מתכת מד 20 המשופע בצד השני של החדר. בסמוך לצינור פלט זה היא אלקטרודה השוואתי גלולה Ag / AgCl. להוביל מאלקטרודה השוואתית זו קשורה להתייחסות של קלט headstage. משולש קטן של KimWipeממוקם מעל אלקטרודה ההשוואתית כדי לשמור אותו במגע עם הפתרון ולווסת את זרימת פתרון לצינור יצוא. הבסיס של החדר נוצר על ידי הצבת שקופיות מיקרוסקופ זכוכית לתוך הקצוות השקועים של החדר. השקופית שנערכה במקום עם חרוז של שומן ואקום. רצועות של קרום nitrocellulose עם פרוסות רשתית משובצות באגלי שומן ואקום שיוצרים ערוץ לפתרון לזרימה. לפני קבלת פרוסות, חתיכת 5 מ"מ x 10 מתוך קרום nitrocellulose מודבקת בחדר עם שני חרוזים קטנים של שומן ואקום. חתיכת עיינית ממוקמת צד vitreal על קרום nitrocellulose זה והרימה משם פעם אחת את שומרת הרשתית. לחץ כאן לצפייה בדמות גדולה.
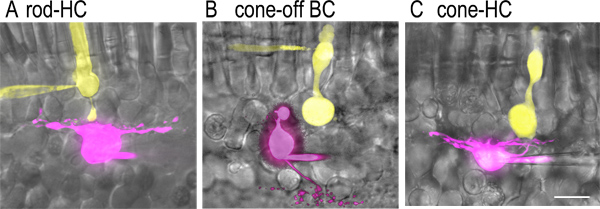
איור 2. זוגות סלולריים מלאים בצבע ישהכנת פרוסה rtical.) תמונות של מוט ותא אופקי synaptically המצמיד שהיו מלאים בניגודי צבעי ניאון הציגו באמצעות פיפטה את התיקון בזמן הקלטה כל התא בו זמנית. לוציפר צהוב (2 מ"ג / מ"ל) נכלל בפתרון פיפטה המוט (צהוב) וsulfarhodamine ב '(1 מ"ג / מ"ל) נכלל בפתרון פיפטה התא האופקי (סגול). תמונות ניאון נתפסו באמצעות מיקרוסקופ confocal דיסק מסתובב (פרקין אלמר UltraView LCI) מצויד במצלמת CCD מקוררת (אורקה ER) ועלה לבמת מיקרוסקופ הקבוע (ניקון E600 FN עם 60x, מטרת טבילה במי NA 1.0). תמונות אלה מעולף על תמונות שדה בהירות של פרוסות הרשתית המתאימות באמצעות Adobe Photoshop. ב ') תמונות של חרוט וsynaptically מצמידים OFF תא דו קוטבי. מסוף האקסון התא דו קוטבי ramifies בsublamina (S1) החיצונית ביותר של השכבה הפנימית plexiform סמוך לגבול עם שכבת הגרעין הפנימית. C) תמונות של חרוט ותא אופקי synaptically מצמידים. שימו לב שמסופי קונוס הם הרבה יותר גדולים ממסוף האקסון של המוט. למרות שניתן לזהות תאים אופקיים על ידי צורה המלבנית של גופי התא שלהם, גופי תא של-ON ולא ניתן להבחין בין תאים דו קוטביים מסוג OFF בINL קלות לפני ההקלטה. עם זאת, אפשר היעד נעקר חרוט מונע את התאים דו קוטביים שבו יש גופי תא בONL וניתן להבחין בין קונוסים בהעדר מגזרים פנימיים וחיצוניים. סרגל קנה המידה הוא 20 מיקרומטר.
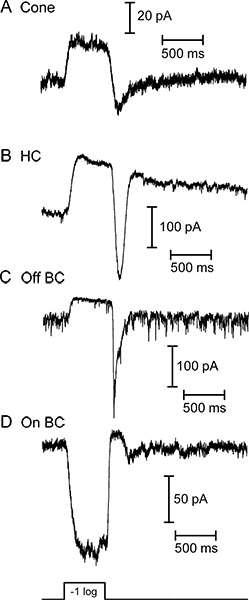
איור 3. אור עורר זרמים שנרשמו תחת מהדק מתח מארבעה תאי עצב ברשתית שונים בתגובה ל500 אלפיות שני בהיר הבזק של אור לבן. קונוס (א '), תא אופקי (ב '), ואת התא דו קוטבי (C) כל הגיב להדליק עם נוכחי כלפי חוץ. (ד') על התא דו קוטבי הגיב לאותו גירוי אור עם זרם פנימה. רעש תחילת המחקר הוצג על ידי התא דו קוטבי מ( C) משקף שחרור מתמשך של השלפוחית סינפטית בחושך שפוחת כאשר קולטני אור hyperpolarize באור. תגובות מארבעה תאים אלה התקבלו בהקלטות נפרדות באמצעות פרוסות שהוכנו תחת אור לבן. עוצמת גירוי האור הלבן השתמש בדוגמאות אלה מיוצרות תגובות בתאים אופקיים ודו קוטביים שווי ערך ל 580 ננומטר שטף פוטון של 1 x 10 5 פוטונים / שני / 2 מיקרומטר.
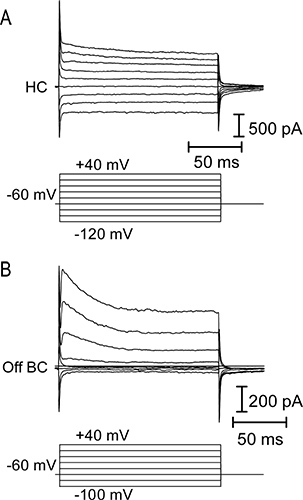
איור 4. (IV) יחסים נוכחי מתח של שעותתאים דו קוטבי ואת פקי. () פנל עליון, זרמים הממברנה עוררו על ידי סדרה של 150 צעדי מתח msec מ-120 ל +40 mV מיושם במרווחים של 20 mV (פנל תחתון) לתא אופקי. תאים אופקיים בדרך כלל יש התנגדות כניסה נמוכה ויחסי IV ליניארי או פנימי לתיקון. (ב) יחסי IV של תא דו קוטבי בתגובה לשורה של צעדי מתח. יש תאים דו קוטבי עמידות גבוהה יותר וקלט IV כלפי חוץ תיקון, עקב ההפעלה של זרמי אשלגן מתח מגודרת.
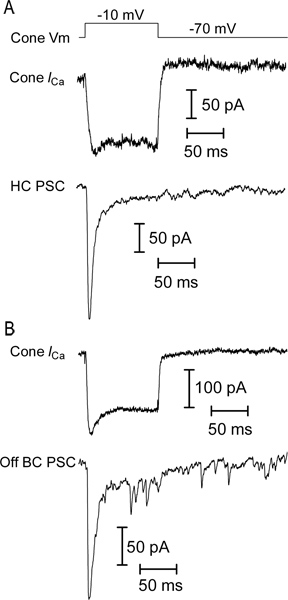
איור 5. דוגמאות של הקלטת נתונים מותאמים. (א) הקלטה של זרם סיד מתח מגודרת קונוס (חרוט אני Ca ) בתגובה לצעד 100 אלפיות שני ל-10 mV מפוטנציאל החזקת -70 mV (קון V מ '). דליפה ארעיים וקיבול נגרעו באמצעות P / 8 דליפת חיסור פרוטוקול. מהר מעורר פוסט סינפטי הנוכחי (EPSC; בג"צ PSC) נרשם בו זמנית מתא אופקי, מראה כי שני תאים אלה הם מצמידים synaptically (ב ') EPSC נרשם בתא דו קוטבי בתגובה לאותו הגירוי באחר. קונוס.
Discussion
הכנת פרוסה הרשתית הוכיחה מאוד שימושית לניתוח המעגלים ומנגנונים המועסקים על ידי הרשתית לעבד מידע חזותי. היכולת להשיג את כל הקלטות סלולריים בו זמנית מנוירונים לפני ואחרי סינפטי כבר מועילה במיוחד בתחום זה. שלמות הקלטות סלולריים מותאמים הרבה יותר קלה להשיג מאשר עם פרוסות בהכנות רשתית שטוח הר בגלל שכבות הרשתית השונות נחשפות. יתר על כן, משום שתאי העצב ברשתית הגדולים שלהם, יש לי סלמנדרות היסטוריה ארוכה כהכנה רשתית ולכן מספקות מערכת מודל טוב במיוחד מאופיינת.
בעזרת תרגול, ניתן להכין פרוסות בריאים של רשתית הסלמנדרה באופן קבוע. כמה צעדים מרכזיים יכולים לעשות את ההבדל בין הצלחה לכישלון. 1) ודא שסכין הגילוח הוא רכוב על מבצעה הרקמה, כך שהוא מניח שטוח על משטח הזכוכית ופרוסות נקי אם כי גם הרקמה וunderlyiקרום nitrocellulose ng. אם בצע חתך נקי דרך קרום nitrocellulose, כדאי שתשמע נקישה חלושה כמו סכין הגילוח מכה את פני השטח של שקופית הזכוכית. 2) ודא שהרשתית דבקה קרום nitrocellulose. אחרת, הרשתית יכולה לצוף מן הקרום במהלך כל שלב של ההליכים. 3) אל תחשפו את הפרוסות חתוכות לאוויר, כמו זה יגרום ניזק רבים של התאים השטחיים. 4) יש לוודא את הפרוסות וקרום nitrocellulose לשכב נגד שקופיות הזכוכית, כך ששכבות הרשתית הן לכאורה תחת מיקרוסקופ לנתח. 5) לאזן את שיעורי יבוא ויצוא superfusate על מנת להימנע מגדותיו לתא ההקלטה. זה מונע שינויים פתאומיים ברמות פתרון, אשר יכול לגרום לתנועות חדות רקמה. 6) בחר זוג בריא של תאים קרובים אחד לשני. תאים עם ציטופלסמה החלקה בריאים יותר מאשר תאים עם ציטופלסמה מגורענת. תאים עמוקים יותר בפרוסה יש סיכוי גבוה יותר כדי לשמור על קון הסינפטי ללא פגעtacts. 7) ודא שהקצה פיפטה לא שבור או התחכך רקמות אחרות או פסולת בדרך למטה לתאים. 8) בדקו את התנגדות פיפטה כדי לוודא שהוא לא סתום בפסולת או בועה, שניהם יכולים לעשות את זה קשה להשיג הקלטה כל תא באיכות.
במקום הצמדת הרשתית לנייר סינון nitrocellulose, כמה חוקרים להטביע רשתיות בבלוק של אגר ולהשתמש vibratome לחתוך פרוסות ברשתית. למרות שלא ניסו גישה זו, קים ואח'. -11 לדון יתרונות של שתי הגישות. בניסיון שלהם, הגישה מבוססת אגר מספקת תשואה של פרוסות שטוחות עקבית יותר עם שכבות רשתית שמסומנות היטב אך גישה המבוססת על נייר המסנן מניבה קולטנית אור בריא יותר.
מוטות קונוסים אחראיות לtransducing אור לשינויים בפוטנציאל הממברנה. עם הקלטות לזווג, פוטנציאל הממברנה של מוטות או קונוסים יכול להיות manipulated ישירות וכן את היכולת ליצור תגובות אור, ואילו מועיל לזיהוי סוגי תאים, לא יכול להיות חיוני. לפיכך, אנו לעתים קרובות להכין פרוסות באור לבן. עם זאת, גם כאשר הוכן תחת תאורה בהירה, תאי עצב ברשתית סלמנדרה יכול ליצור תגובות אור גדולות כפי שמודגם על ידי התגובות באיור. 3. זה נובע בחלקו מאגר גדול יחסית של chromophore בהיקף הקטע החיצוני הגדול, אלא גם עשוי לשקף את היכולת של תאים להתחדש מולר 11-cis-רשתית לקונוסים 12. כדי לקבל באופן מלא תגובות אור הכהה מותאמים, אפשר להכין את הפרוסות תחת תאורת אינפרא אדום. עבור ניתוחים תחת אור אינפרא אדום, אנו מייחסים GenIII התמונה intensifiers (NAV3 Nitemate, יטון תעשיות, בטמפה, אריזונה) לoculars של מיקרוסקופ לנתח ולהאיר את הרקמה עם פנס LED אינפרא אדום. לחיתוך והליכים אחרים שאינם נערכו תחת מיקרוסקופ לנתח, אנו מעסיקים הר"י ראש רכובמגבר GE. עבור מיקום של את pipettes התיקון, אנו לדמיין פרוסות באמצעות מצלמת CCD אינפרא אדום רגישה (למשל WATEC 502H, WATEC Inc, מידלטאון, ניו יורק) רכוב על מיקרוסקופ הזקוף, קבוע הבמה. עם אמצעי הזהירות הבאים, ניתן לקבל תשובות מוט מפגינות רגישות פוטון יחידה 6, 13.
מגבלה אחת של עבודה בפרוסות רשתית היא שתהליכים תאיים ארוכים של תאי עצב ברשתית שדה גדולים עלולים לאבד רבים מהדנדריטים שלהם במהלך הליך החיתוך. הכנות פרוסה רשתית ולכן שימושיות יותר ללימוד הפיסיולוגיה של תאים שבו הקשרים סינפטיים כוללים תהליכים קרובים לגוף התא. רשתיות דו חיים ויונקים חולקים רבות מאותם סוגי תאים ולנצל מנגנונים פיסיולוגיים דומים 14-16. בעוד רשתית סלמנדרה היא מודל טוב להיבטים רבים של רשתית של יונקים, הבדל חשוב אחד נראה הנוכחות של מסלול מוט ייעודי ביונקים שinvoקשר lves של תאים מיוחדים על גבי המוט דו קוטביים איי תאי amacrine 14. מגבלה נוספת של רשתית הסלמנדרה היא המספר הקטן של כלים גנטיים שפותחו במיוחד עבור מין זה. עם זאת, נוגדנים וחומרים כימיים שshRNA אזורי היעד נשמרים היטב במינים אחרים יכולים לשמש בהצלחה בסלמנדרה, כפי שניתן רבים מעכבי מולקולה קטנים וריאגנטים פפטיד. בנוסף, עם כמה שינויים בטכניקה, אפשר להכין פרוסות רשתית ממינים אחרים שבו חלק מהכלים אלה הם זמין יותר.
מעבר לשירות שלה להקלטה כל התא לזווג, הכנת פרוסה רשתית הסלמנדרה היא גם נוחה למגוון של גישות אחרות. כאמור לעיל, ניתן להשתמש בפרוסות רשתית ללמוד תגובות אור בשילוב עם פרוטוקולי מהדק מתח שונים 17. יכולים גם להיות טעונים נוירונים ברשתית עם צבעי ניאון רגישים לCa 2 +, Cl -, או Na+ הציג באמצעות פיפטה את התיקון או על ידי מרחץ יישום 15,18-20. יכול להיות הציג פפטיד ניאון שנקשר לסרט הסינפטי 21 באמצעות פיפטה את התיקון ומשמש להדמית סרט או 10, כאשר מצומד להעמסה, לחריפות ולפגוע באופן סלקטיבי 22 סרט. יש לנו גם בשימוש פרוסות ברשתית בשילוב עם נקודות קוונטיות כדי לפקח על התנועות של ערוצי סידן בודדים במוט וקונוס מסופים הסינפטיים 23. לפיכך, הפרוסה האנכית הרשתית היא תכשיר ניסיוני תכליתי ללימוד מנגנונים סינפטיים בסיסיות ואת פונקציות העיבוד הייחודיות שבוצעו בסינפסה הראשונה במסלול האיתות החזותי.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו מומנה על ידי מחקר למניעת עיוורון ומכונים הלאומי לבריאות מענק EY10542.
Materials
| Name | Company | Catalog Number | Comments |
| Tissue slicer | Stoelting | 51425 | |
| Double edge razor blades | Ted Pella, Inc | 121-6 | |
| Nitrocellulose membranes | Millipore | AAWP02500 | Type AAWP 0.8 mm pore |
| Borosilicate glass pipettes | World Precision Instruments | TW120F-4 | 1.2mm OD 0.95 mm ID |
| Ag/AgCl pellet | Warner | E206 | |
| MicroFil | World Precision Instruments | MF34G-5 | 34 ga. Filling needle, 67 mm long |
References
- Ramòn y Cajal, S., Thorpe, S. A., Glickstein, M. . The Structure of the Retina. , (1972).
- Piccolino, M. Cajal and the retina: a 100-year retrospective. Trends Neurosci. 11, 521-525 (1998).
- Hartline, H. K. The response of single optic nerve fibers of the vertebrate eye to illumination of the retina. Am. J. Physiol. 121, 400-415 (1938).
- Kuffler, S. W. Discharge patterns and functional organization of mammalian retina. J. Neurophysiol. 16, 37-68 (1953).
- Werblin, F. S. Transmission along and between rods in the riger salamander retina. J. Physiol. 280, 449-470 (1978).
- Wu, S. M. Synaptic connections between neurons in living slices of the larval tiger salamander retina. J. Neurosci. Meth. 20, 139-149 (1987).
- Heidelberger, R., Thoreson, W. B., Witkovsky, P. Synaptic transmission at retinal ribbon synapses. Prog. Retin. Eye Res. 24, 682-720 (2005).
- Schmitz, F. The making of synaptic ribbons: how they are built and what they do. Neuroscientist. 15, 611-624 (2009).
- Morgans, C. W., Brown, R. L., Duvoisin, R. M. TRPM1: the endpoint of the mGluR6 signal transduction cascade in retinal ON-bipolar cells. Bioessays. 32, 609-614 (2010).
- Bartoletti, T. M., Babai, N., Thoreson, W. B. Vesicle pool size at the salamander cone ribbon synapse. J. Neurophysiol. 103, 419-423 (2010).
- Kim, M. H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis. Exp. (59), e3345 (2012).
- Wang, J. S., Estevez, M. E., Cornwall, M. C., Kefalov, V. J. Intra-retinal visual cycle required for rapid and complete cone dark adaptation. Nat. Neurosci. 12, 295-302 (2009).
- Thoreson, W. B., Tranchina, D., Witkovsky, P. Kinetics of synaptic transfer from rods and cones to horizontal cells in the salamander retina. Neuroscience. 122, 785-798 (2003).
- Wu, S. M. Synaptic organization of the vertebrate retina: general principles and species-specific variations: the Friedenwald lecture. Invest. Ophthalmol. Vis. Sci. 51, 1263-1274 (2010).
- Babai, N., Thoreson, W. B. Horizontal cell feedback regulates calcium currents and intracellular calcium levels in rod photoreceptors of salamander and mouse retina. J. Physiol. 587, 2353-2364 (2009).
- Babai, N., Morgans, C. W., Thoreson, W. B. Calcium-induced calcium release contributes to synaptic release from mouse rod photoreceptors. Neuroscience. 165, 1447-1456 (2010).
- Thoreson, W. B., Burkhardt, D. A. Contrast encoding in retinal bipolar cells: current vs. voltage. Vis. Neurosci. 20, 19-28 (2003).
- Thoreson, W. B., Bryson, E. J., Rabl, K. Reciprocal interactions between calcium and chloride in rod photoreceptors. J. Neurophysiol. 90, 1747-1753 (2003).
- Cadetti, L., Bryson, E. J., Ciccone, C. A., Rabl, K., Thoreson, W. B. Calcium-induced calcium release in rod photoreceptor terminals boosts synaptic transmission during maintained depolarization. Eur. J. Neurosci. 23, 2983-2990 (2006).
- Luo, J., Boosalis, B. J., Thoreson, W. B., Margalit, E. A comparison of optical and electrophysiological methods for recording retinal ganglion cells during electrical stimulation. Curr. Eye Res. 37, 218-227 (2012).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Snellman, J., Mehta, B., Babai, N., Bartoletti, T. M., Akmentin, W., Francis, A., Matthews, G., Thoreson, W. B., Zenisek, D. Acute destruction of the synaptic ribbon reveals a role for the ribbon in vesicle priming. Nat. Neurosci. 14, 1135-1141 (2011).
- Mercer, A. J., Chen, M., Thoreson, W. B. Lateral mobility of presynaptic L-type calcium channels at photoreceptor ribbon synapses. J. Neurosci. 31, 4397-4406 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved