Method Article
양서류 망막 슬라이스 준비 광수와 2 차 신경 세포에서 동시에 전체 세포 녹음
요약
우리는 수생 호랑이 도롱뇽 (에서 얇은 망막 조각의 준비를 설명 Ambystoma tigrinum) 우리는 광수와 2 차 수평 및 양극성 세포에서 이중 전체 셀 전압 클램프 녹음을 획득하여 망막에있는 시냅스 처리를 공부하기 위해 이러한 분할 영역을 사용하는 방법을 설명합니다.
초록
망막 신경 과학의 중심 과제 중 하나는 망막 신경 회로와 어떻게 그 연결이 뇌에 전달되는 신호를 형성에 대한 책임을 이해하는 것입니다. 광자는 시신경을 통해 처리와 뇌의 중심 대상으로 전달됩니다 다른 망막 신경 세포에 전달, 전기 신호로 그 에너지를 변환로드와 콘 광수에 의해 망막에 감지됩니다. 망막 3,4의 출력 세포 - 망막 회로 및 영상 처리에 중요한 초기 통찰력 망막 신경절 세포의 급상승 활동의 전기 생리학 녹음에서 나중에를 Cajal 1,2의 조직 학적 연구로부터 와서.
망막에 영상 처리에 대한 자세한 이해는 광수의 망막 신경절 세포에 대한 경로의 각 단계에서의 신호에 대한 이해가 필요합니다. 그러나 많은 망막 세포 유형은 가시 있습니다전기 생리학 녹음 상대적으로 액세스 할 수 있으므로 조직에서 깊은 이었죠. 이 제한은 망막 층의 각 내에 거주 세포가 명확하게 볼 수와 전기 생리학 녹음에 액세스 할 수있는 수직 슬라이스와 협력하여 극복 할 수 있습니다.
여기, 우리는 애벌레 호랑이 도롱뇽 (Ambystoma tigrinum)에서 망막의 수직 부분을 만들기위한 방법을 설명합니다. 이 혼합물은 원래 날카로운 미세 전극 5,6와 기록을 위해 개발되었지만 동시에 녹화하는 동안, 우리는 우리가 광수의 막 잠재력을 조작하는 광수와 2 차 수평 및 양극성 세포에서 이중 전체 셀 전압 클램프 녹음하는 방법을 설명하는 포스트 - 수평 또는 양극성 세포 시냅스 반응. 호랑이 도롱뇽의 광수이 t를 수행하기에 이상적인 준비하고, 포유 동물 종에 비해 상당히 크다그의 기술적으로 도전적인 실험 방법. 잘 토닉 신경 전달 물질의 방출 7의 높은 비율을 유지하기에 적합합니다로드와 콘 광수, 등 뉴런의 단지 소수에서 발견 전문 시냅스 구조 -이 실험은 시냅스 리본의 신호 특성을 프로빙을 향해 눈을 가진 설명 8 - 그리고 방법이 처음으로 망막 시냅스의 고유 한 신호 특성에 기여한다.
프로토콜
1. 망막 슬라이스 준비
- 챔버 (디자인 그림 1)를 조립합니다. 장소에 진공 그리스의 두 구슬, superfusate 채널을 형성하고 망막 조각을 포함 할 수있는 녹음 챔버를 통해 이격 ~ 8~10mm. 제방 및 제한 파급 역할을하는 몇 밀리미터 멀리 밖으로 그리스의 두 구슬의 각 넘어 그리스의 두 번째 비드를 추가합니다. 기준 전극과 유체 접촉을 보장하기 위해 챔버의 끝에서 KimWipe의 작은 삼각형 조각을 놓습니다.
- 진공 그리스의 두 개의 작은 구슬에 유리 현미경 슬라이드에 대한 평 니트로 셀룰로오스 막 (0.8 μm의 기공 ~ 5 × 10 ㎜)의 조각을 누르십시오. 이 고착 망막을 방지 할 수 피하고, 니트로 셀룰로오스 멤브레인의 중앙 바로 아래에 기름을 넣어.
- 조직 슬라이서를 준비하려면 4 조각으로 두 배 가장자리 면도날을 중단하고 슬라이스 팔 하나를 첨부합니다. nitrocellul의 얇은 조각을 잘라OSE는 막 면도날의 최첨단의 녹음 챔버에 편평하게 놓여 있으며 따라서 니트로 셀룰로오스 멤브레인을 깨끗하게 절단 할 수 있도록합니다.
- 해부 역에서 얼음에 양서류 식염수 용액 (표 1)의 작은 비커를 유지합니다.
- 잘린 도롱뇽를 안락사. 척수를 통해 sagitally 머리 속을 Hemisect. 면의 조각에 머리의 위치를 절반 리놀륨 블록 위에 양서류 식염수에 적신. 머리의 나머지 절반은 하루에 나중에 사용하기 위해 촉촉한 종이 타월로 싸서 4 ° C에 저장할 수 있습니다.
- 눈을 명백히. 작은 Vannas 가위를 사용하여 주변의 궤도에 눈을 연결하는 피부를 잘라. 주위의 안와 조직에서 눈의 앞쪽을 확보 한 후, 궤도에서 눈을 확보, 눈의 근육과 시신경을 잘라 눈 밑에 가위 앞으로 눈을 당기고 밀어 넣습니다.
- 에 목화의 침대에 탈핵 눈에 배치리놀륨 블록. 반 머리를 폐기하십시오. 안구의 뒤쪽에서 초과 안와 지방을 트리밍합니다.
- 날카로운 수술 용 칼날로 각막의 중앙에 작은 절개를합니다. 절개에 좋은 Vannas 가위를 슬라이딩 오라 세라를 향해 방사상으로 컷을 확장하여 각막을 제거합니다. 리놀륨 블록이나 컷 사이면을 회전하여 오라 세라 주위에 원주 방향으로 잘라.
- 눈 주위의 모든 방법을 절단 한 후, 아이 컵의 측면에서 그들을 당겨 각막과 렌즈를 제거합니다. 리놀륨 블록의 하드 표면에 결과 아이 컵을 이동 양서류 식염수에 적신. 당신이 공막을 통해 모든 방법을 차단했는지 확인하는 좋은 톱질 동작을 사용하여 날카로운 면도날 분의로 컷.
- 망막 표면에 니트로 셀룰로오스 막에 아이 컵 대신 하나 또는 두 개의 조각을 아래로 향하게. 잠수함 추가 식염수 남은 조각을 1 ~ 4 ° C.에 냉장고에 배치
- 창ntly 미세 집게를 가진 니트로 셀룰로오스 막에 아이 컵의 조각을 누릅니다. 망막 준수하는 데 도움이 KimWipe와 가장자리 차가운 양서류 식염수와 오점 몇 방울 잠수함 니트로 셀룰로오스 막과 아이 컵 조각. 차가운 양서류 식염수 멀리 거피 (때문에 표백 로돕신의 존재에 분홍색 나타날 수 있음) 망막을 분리하는 공막 / 맥락막 / 망막 색소 상피 세포의 여러 방울 다시 한번 물속에 아이 컵과 니트로 셀룰로오스 막. 필요한 경우, 망막을 무료로 시신경을 잘라.
- 망막이 단단히 부착되지 않은 경우, 니트로 셀룰로오스 막에 더 단단히 망막을 당겨 KimWipe과 염분을 멀리 배수. 식염수를 교체합니다. 필요한 경우 반복합니다.
- 차가운 양서류 식염수와 챔버를 입력하고 조직 슬라이서의 단계로 전송할 수 있습니다. 버니어 마이크로 미터를 돌려 다른 한 끝에서 작업, 얇은 스트립으로 망막 니트로 셀룰로오스 막 슬라이스125 μm의 단위로합니다. 부드럽지만 확실히 망막 니트로 셀룰로오스 멤브레인을 통해 면도날을 누릅니다.
- 녹음 챔버의 주요 채널로 니트로 셀룰로오스 막 지구를 이동하여 망막 조각을 전송합니다. 무료 막 지구를 들어 올린 후 슬라이스 침수 유지해야되고, 그 아래에 실을 움직이면서 제자리에 고정. 망막 레이어를 볼 수있게 90도 회전, 진공 그리스의 스트립 니트로 셀룰로오스 멤브레인의 가장자리를 포함합니다.
- 유리 표면에 니트로 셀룰로오스 막 평면을 누릅니다. 모든 조각에 망막이없는 경우에도 표면 장력을 깰 수 있도록하고 유체의 흐름을 개선하기 위해 관류 채널의 전체 길이를 따라 일정한 간격 (간격 ~ 1mm)에서 니트로 셀룰로오스 막 장소 스트립.
2. 쌍으로 전체 세포 녹음
- 조각이 모두 전송 된 후, 고정, 수직의 단계로 녹음 챔버로 이동무대 현미경과 기준 전극 리드를 연결합니다. 긴 작동 거리, 침수, 40-60X 목표를 사용하여 슬라이스에 초점을 맞 춥니 다. 현미경은 진동을 감쇠하는 공기 테이블에 배치하고 전기 간섭을 줄이기 위해 패러데이 케이지로 묶어야합니다.
- 100 % O 2 부풀어 양서류 생리 식염수와 1 ML / 분의 속도로 지속적으로 슬라이스를 Superfuse. 유입과 유출의 균형이 있는지 확인하고, 흡입을 연결합니다. 유출은 흡입 바늘의 베벨 끝을 회전하거나 가까이 또는 멀리 유출 바늘의 실의 끝에 KimWipe를 이동하여 조절 할 수 있습니다. 준비는 상온에서 보관 또는 펠티어 장치 또는 단순히 현미경 스테이지에 얼음 팩을 설정하여 냉각 할 수 있습니다.
- 어둡거나 적외선 조명 아래 조각을 검사하고 세포의 한 쌍의 식별 - 전체 셀 녹음 대상 - 광수 (봉 또는 콘) 및 인근의 수평 또는 바이폴라 셀. 봉 내가 할 수그들의 큰 세포 기관과 탁월한 막대와 같은 외부 세그먼트 (그림 2A)에 의해 dentified. 콘로드보다 작은 작은 테이퍼 외부 세그먼트가 있습니다. 양극성 세포와 수평 세포 somas은 내부 핵 계층의 세포 기관의 가장 바깥 쪽 행 (; 그림 2B 및 2C INL)에 있습니다.
- 슬라이스를 준비하기 전에, 붕규산 유리 (1.2 mm 외부 직경, 유리 필라멘트 0.95 mm 내경)에서 마이크로 피펫을 제조하는 피펫 풀러를 사용합니다. 각 마이크로 피펫의 팁 직경 ~ 1-2 미크론이어야한다.
- 비금속 충전 바늘 (예를 들어, 한 1 cc의 주사기 또는 MicroFil에서 제조)를 사용하여, 세포 내 용액 (표 1) 피펫을 채우고 전극 홀더에 부착합니다.
- 약간 현미경 목표를 올린다. 목적 아래 광수 피펫을 배치 한 후 끝이 바로 조각 위에 오도록 내려. t와 반복그는 두 번째 피펫.
- 앰프의 기준 현재 수준에서 오프셋을 조정합니다. 5-10 MV 탈분극 펄스 피펫 저항을 확인하십시오. 우리는 일반적으로 피펫을 사용하는 MΩ 10-15의 범위, 샤프트와 양서류 피펫 솔루션의 낮은 삼투압의 긴 테이퍼의 결과. 높은 삼투압 포유류 솔루션으로, 이와 같은 피펫은 MΩ ~ 8-12의 저항 값을 나타냅니다. 우리는 3-4 MΩ 양서류 솔루션의 저항 값이 큰 팁 직경을 사용하는 동안, 낮은 접속 저항에 의해 제공되는 장점이 세포막에 바다 표범 어업에 큰 어려움과 칼슘 전류와 기타 제 메신저의 더 빠른 런에 의해 상쇄된다 민감한 반응.
- 약간의 양압 위치에게 시냅스 피펫을 적용하면서 연락처를 수평 또는 바이폴라 세포체 있도록. 다음 연접 피펫을 위치가 연락처 막대 또는 콘 광수의 세포체 있도록. 녹음 APPE피펫 팁은 오히려 소마보다 내부 세그먼트를 문의 할 때 AR 특히 콘에서 안정 될 수 있습니다.
- 저항을 모니터링하면서, 시냅스 후 피펫에 긍정적 인 압력을 놓습니다. 때때로, 긍정적 인 압력 릴리스는 기가 옴 밀봉을 형성하기에 충분합니다. 그렇지 않은 경우, 1 ML의 주사기이나 입으로 부드러운 흡입을 적용합니다. 팁 저항 MΩ> 100으로 성장 한 후, -60 MV의 개최 가능성을 적용합니다. 기가 옴 씰을 얻은 후, 모든 피펫 용량 과도을 null로 -70 MV의 개최 가능성을 적용, 광수 피펫의 밀봉 절차를 반복합니다.
- 파열 입이나 차례의 각 셀에 흡입을 적용하는 주사기를 사용하여 패치. 막대, 콘 및 양극 세포는 부드러운 흡입과 파열 일반적으로 것입니다. 가로 셀 전체 셀 구성을 얻는 것은 "기력"F와 함께 제공되는 강력한 빠른 전압 펄스와 함께 큰 흡입 (3 CC의 주사기 예)가 필요할 수 있습니다패치 클램프 증폭기의 eature. 전체 셀 구성의 막 설립의 파열은 전체 셀 용량 과도의 모양으로 분명있을 것입니다.
- 라이트 플래시를 적용하고 20 MV 증가 (그림 3과 4)의 -120 ~ +40 MV에서 전압을 일련의 단계를 제공함으로써 생리 학적 시냅스 후 세포의 ID를 확인합니다.
- 세포의 쌍 시냅스 연결되어있는 경우, 광 수용체에 대한 간단한 (25-100 밀리 초), 60 MV 단계 탈분극을 제공합니다 (-10 mV에서, L-형 전압 게이트 칼슘 전류의 피크 부근)와보고 평가하기 두 번째 순서 뉴런에서 시냅스 후 전류 (그림 5)에 대한. 강한 탈분극 단계 콘 (그림 5) 소포 릴리스의 파열에 의한 시냅스 수평 또는 OFF 바이폴라 셀에 빠른 과도 안쪽 시냅스 후 전류를 연상한다.
결과
도롱뇽 망막의 수직 조각의 뉴런에서 빛 반응의 대표적인 흔적은 그림 3에 나와 있습니다. 콘, 수평 세포와 양극 세포 OFF는 모든 빛의 발병에 대한 응답으로 외부 전류를 표시합니다. 수평 및 양극성 세포 녹음에서 빛을 플래시 다음과 탁월한 내향 전류들은 빛의 오프셋 (offset)에 탈분극과 광 수용체에서 글루타메이트의 증가 릴리스에서 발생합니다. ON 바이폴라 셀 기호 반전 대사성 글루타민산 염 수용체 신호 폭포와 TRPM1 채널 9의 활성화로 인한 빛의 발병 내향 전류로 응답합니다. 수평 세포와 쌍극 세포들은 IV의 관계 (그림 4)에 의해 서로 구별 할 수 있습니다. 양극 세포는 높은 입력 저항을 가지고있는 동안, 수평 세포는 일반적으로 선형 또는 내심 IV를 정류하고 낮은 입력 저항 (그림 4A MΩ <500)이(0.5-2 GΩ)와 나는 겉으로는 - 정류 - V (그림 4B)를 그림 5는 콘 수평 세포 페어 (그림 5A)와 콘 OFF 바이폴라 셀 쌍 (그림 5B)의 기록에서 대표적인 결과를 보여줍니다.. 각 -70 MV의 지주 잠재력 -10 mV에서 콘을 탈분극은 수평 또는 바이폴라 셀 콘 빠른 안쪽 EPSC 전류 전압 게이트 칼슘을 유발. 이 강력한 자극 ~ 47 PA / 리본 10 EPSC의 결과로 각 시냅스 리본에서 ~ 20 소포를 쉽게 - 박리 풀을 비우기에 충분합니다. 그림 5A의 수평 세포 EPSC는 연접 콘에서 5 리본 연락처를받은 것을 제안, 232 펜실바니아했다. 오프 바이폴라 셀 178 펜실바니아 EPSC (그림 5B)에서 유사한 추정치는 연접 콘에서 4 리본 연락처를 수신하는 것이 좋습니다.
| 양서류 생리 식염수 | 시냅스 피펫 | 시냅스 피펫 | |
| 염화나트륨 | 116 밀리미터 | 3.5 MM | 3.5 MM |
| KCl을 | 2.5 mM의 | ||
| 염화칼슘 | 1.8 mM의 | 1 밀리미터 | 1 밀리미터 |
| MgCl 2 | 0.5 mM의 | 1 밀리미터 | 1 밀리미터 |
| HEPES | 10 MM | 10 MM | 10 MM |
| 포도당 | 5 밀리미터 | ||
| CS-글루타민산 * | 40 mM의 | ||
| CS-글루코 ** | 50 mM의 | 90 mM의 | |
| 테트라 에틸 염화 | 10 MM | 10 MM | |
| ATP-밀리그램 | 9 개 mm | 9 개 mm | |
| GTP | 0.5 mM의 | 0.5 mM의 | |
| EGTA | 5 밀리미터 | 5 밀리미터 | |
| 산도 *** | 7.8 | 7.2 | 7.2 |
| 삼투압 **** | 245 mOsm | 240 mOsm | 240 mOSM |
* CS-글루타민산은 피펫 용액에 40 밀리미터 CsOH를 40 mM의 L-글루타민산 산을 중화에 의해 이루어집니다. * CS-글루 콘 산염의 1 M 재고가 45~50% D-글루 콘산으로 CsOH를 용액을 중화에 의해 이루어집니다. *** pH는 피펫 솔루션에 대한 세포 솔루션 CsOH를 위해 NaOH를 함께 조정되어야한다. **** 바로 아래 피펫 솔루션의 삼투압을 유지하는 것은 세포 용액의 세포 부종을 방지하고 기록의 수명을 향상시킵니다.
테이블1. 이 프로토콜에서 사용되는 표준 세포와 세포 솔루션을위한 구성 요소 및 매개 변수입니다.
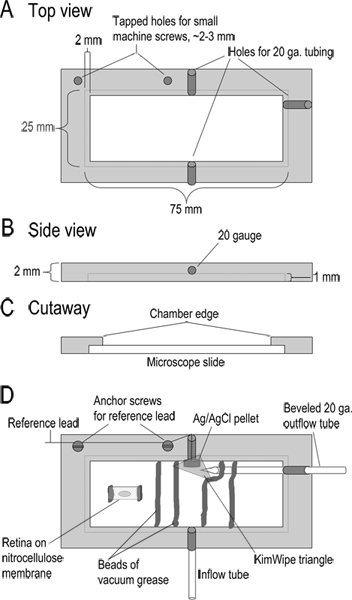
그림 1. 녹음 챔버 디자인. (AC) 상위, 측면 및 치수를 보여주는 기록 챔버의 장면 전환 전망. 챔버는 아크릴 2 mm 두께의 조각에서 가공된다. (D) 조립 챔버. Superfusate 테플론 튜빙 10 cm 길이 (; 유형 24LW 유입 관)를 통해 챔버로 들어갑니다. Superfusate은 챔버의 다른 측면에서 경 20 게이지 금속 튜브에 약한 흡입을 적용하여 제거됩니다. 이 출력 튜브에 인접한 자세 / AgCl을 펠렛 기준 전극입니다. 이 참조 전극 리드 headstage의 참조 입력에 연결됩니다. KimWipe의 작은 삼각형용액과 접촉을 유지하고 유출 관으로 솔루션의 흐름을 조절하는 기준 전극에 배치됩니다. 챔버의 기본은 챔버의 오목한 가장자리에 유리 현미경 슬라이드를 배치하여 형성된다. 슬라이드 진공 그리스의 구슬과 장소에서 개최됩니다. 망막 슬라이스로 니트로 셀룰로오스 막 스트립 흐름 솔루션을위한 채널을 형성하는 진공 그리스의 구슬에 포함됩니다. 이전 조각을 만들기 위해, 니트로 셀룰로오스 막 5 × 10 밀리미터 조각은 진공 그리스의 두 개의 작은 구슬 챔버에 부착되어 있습니다. 아이 컵의 조각이 니트로 셀룰로오스 막에 유리체면을 아래로 배치 망막을 준수되면 멀리 해제합니다. 큰 그림을 보려면 여기를 클릭하십시오 .
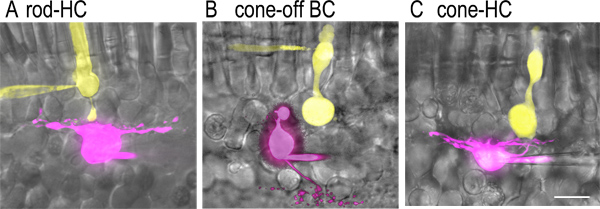
그림 2. 적이있는 염료 채워진 셀 쌍rtical 슬라이스 준비.) 동시에 전체 세포 녹음 중에 패치 피펫을 통해 소개 된 형광 염료를 대조로 가득 차 있었다 막대와 시냅스 결합 수평 세포의 이미지. 루시퍼 노란색 (2 MG / ML)로드 피펫 용액 (노란색)과 sulfarhodamine B (1 MG / ML), 수평 세포 피펫 용액 (보라색)에 포함 된에 포함되었습니다. 형광 이미지는 냉각 CCD 카메라 (오카 ER)을 탑재 고정 단계 현미경 (60X, 1.0 NA 물 침지 목적으로 니콘 E600 FN)에 장착 된 회전 디스크 공 촛점 현미경 (퍼킨 엘머 Ultraview LCI)를 사용하여 촬영 하였다. 이러한 이미지는) 콘의 이미지와 양극 세포 OFF 시냅스 결합을 어도비 포토샵. B를 사용하여 해당 망막 조각의 시야 이미지에 겹쳐 있었다. 양극 세포의 축삭 터미널 내부 핵 계층과의 국경에 가까운 내부 얼기 층의 바깥 쪽 (S1) sublamina에 ramifies. C) 콘과 시냅스 결합 수평 세포의 이미지. 콘 단자 막대의 축삭 터미널보다 훨씬 더 큰합니다. 수평 세포는 ON 및 INL에서 OFF 형 양극성 세포가 쉽게 사전 녹화 구별 할 수없는 자신의 세포 기관의 직사각형 모양, 세포 기관으로 식별 할 수 있지만. 그러나, 하나는 ONL에 세포 기관을 가지고 내부 및 외부 세그먼트의 부재로 콘 구별 할 수있는 바이폴라 세포 OFF 콘 구동 변위 타겟팅 할 수 있습니다. 스케일 바는 20 μm의 수 있습니다.
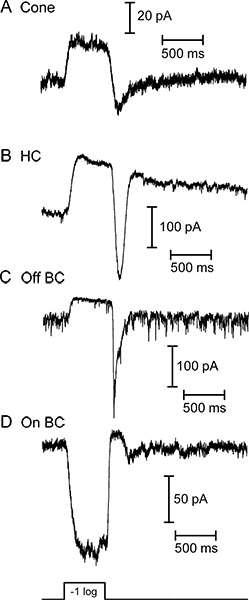
그림 3. 흰색 빛의 밝은 500 밀리 플래시 님의 질문에 네 가지 망막 신경 세포에서 전압 클램프 아래에 기록 된 전류를 빛 유발. 콘 (A), 수평 세포 (B) 및 양극 세포 오프 (C) 모든 외부 전류로 빛에 반응했다. (D)에 양극 세포 내향 전류와 같은 빛을 자극에 반응했다. 오프 양극 세포 (C)에 의해 전시 기준 잡음은 광 수용체가 빛 hyperpolarize 때 감소 어둠 속에서 시냅스 소포의 지속적인 릴리스를 반영합니다. 이 네 가지 세포 반응은 흰색 조명 아래 준비 조각을 사용하여 별도의 기록에서 얻은했다. 이 예제에 사용되는 흰색 빛 자극의 강도는 1 × 10 5 광자 / 초 / μm의 2의 580 nm의 광자 플럭스에 해당하는 수평 및 양극성 세포 반응을 생산.
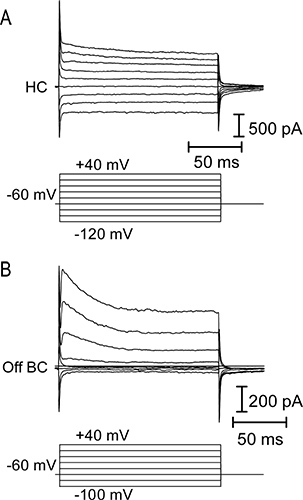
그림 4. H의 전류 - 전압 (IV)의 관계orizontal 오프 양극성 세포. (A) 상단 패널, -120에서 가로 셀에 20 MV 단위 (아래 패널)에 적용 +40 mV에서 150 밀리 초 전압 일련의 단계에 의해 유발 막 전류. 수평 세포는 일반적으로 낮은 입력 저항과 선형 또는 안쪽 정류 IV 관계가있다. 전압 일련의 단계 님의 질문에 답변 떨어져 양극 셀 (B) IV 관계. 양극 세포는 전압 문 칼륨 전류의 활성화로 인해 높은 입력 저항과 겉으로 정류 IV를 가지고.
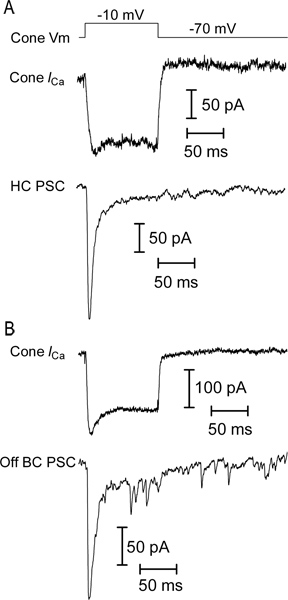
그림 5. 짝 기록 된 데이터의 예. 콘 전압 게이트 칼슘 전류 (A) 기록 (콘 I 카 (콘 V m)의 개최 가능성에서 -10 mV에서 100 밀리 단계의 질문에 답변 UB>). 누출 용량 과도은 P / 8 누수 빼기 프로토콜을 사용하여 차감 하였다. 빠른 흥분성 (EPSC, HC PSC) 현재 시냅스 후이 두 세포가 시냅스 결합을 보여주는, 수평 세포에서 동시에 기록되었다 (B) EPSC는 또 다른 동일한 자극에 대한 응답으로 떨어져 양극 셀에 기록되었다. 콘.
토론
망막 슬라이스 준비는 회로 및 시각 정보를 처리하는 망막에 의해 고용 메커니즘을 분석하기위한 매우 유용한 입증되었습니다. 사전 및 사후 시냅스 신경 세포에서 동시에 전체 세포 녹음을 얻을 수있는 능력은 이러한 노력에 특히 도움이되었습니다. 다른 망막 층이 노출되기 때문에 쌍으로 전체 세포 녹음 평면 마운트 망막 준비보다 슬라이스로 달성하기가 훨씬 쉽습니다. 또한, 때문에 그들의 큰 망막 신경 세포의, 도롱뇽은 망막 준비로 오랜 역사를 가지고 있으므로 특히 잘 특성화 모델 시스템을 제공합니다.
연습으로, 도롱뇽 망막의 건강 조각은 정기적으로 준비 할 수 있습니다. 몇 가지 주요 단계가 성공과 실패의 차이를 만들 수 있습니다. 1) 그것은 완전히 유리 표면과 조각에 평평 있도록 면도날이 조직 슬라이서에 장착되어 있는지 확인하지만 조직과 underlyi 모두NG 니트로 셀룰로오스 막. 당신은 니트로 셀룰로오스 막을 통해 깨끗한 컷 한 경우 면도날은 유리 슬라이드의 표면을 공격, 당신은 희미한 클릭 소리가납니다. 2) 망막 니트로 셀룰로오스 막에 부착 가지고 있는지 확인하십시오. 그렇지 않으면, 망막의 절차 단계에서 막에서 멀리 떠 있습니다. 3)이 표면 세포의 대부분을 손상시킬 수로 공기를 잘라 조각을 노출하지 마십시오. 4) 망막 층이 해부 현미경 명백한가되도록 슬라이스와 니트로 셀룰로오스 막 유리 슬라이드에 평평하게 거짓말을해야합니다. 5) 녹음 챔버를 넘쳐 방지하기 위해 superfusate 유입과 유출의 비율을 균형. 이 갑작스러운 조직의 움직임을 일으킬 수 있습니다 솔루션 수준의 급격한 변화를 방지 할 수 있습니다. 6) 서로 가까운 세포의 건강한 쌍을 선택합니다. 부드러운 세포질을 가진 세포는 거친 세포질을 가진 세포보다 건강이다. 슬라이스 깊은 세포는 그대로 시냅스 죄수를 유지 가능성이 더 높습니다찾아낸 연락처. 7) 피펫 팁 세포에가는 길에 분해 또는 다른 조직이나 이물질에 대하여 닦았되지 않았는지 확인합니다. 8)는 파편이나 어려운 품질을 전체 셀 녹음을 얻을 수 있습니다 둘 다 거품으로 막혀 있지 않은지 확인하기 위해 피펫 저항을 확인하십시오.
오히려 니트로 셀룰로오스 필터 종이에 망막을 붙이는 것보다, 일부 연구자들은 한천 블록에 망막을 포함하고 망막 조각을 잘라 vibratome를 사용합니다. 우리는이 방법을 시도하지 않았지만, 김 등은 11.는 두 가지 방법의 장점을 설명합니다. 자신의 경험에서, 한천 기반의 접근 방식은 잘 묘사 망막 층과 평면 조각의 더 일관된 수익률을 제공하지만 필터 종이 기반의 접근 방식은 건강한 광수를 얻을 수 있습니다.
막대와 콘 멤브레인 전위의 변화로 빛을 transducing에 대한 책임이 있습니다. 쌍 녹음과 함께, 막대 또는 콘 막 잠재력은 속임수 장난감이 될 수 있습니다세포 유형을 식별하는 데 도움이 동안 중요하지 않을 수 있습니다, 직접 이렇게 빛이 응답을 생성 할 수있는 능력을 ated. 따라서 우리는 종종 하얀 빛의 조각을 준비합니다. 그림 반응에 의해 설명 그러나, 밝은 조명 아래에서 준비하는 경우에도 도롱뇽 망막 뉴런은 큰 빛 응답을 생성 할 수 있습니다. 3. 이 큰 외부 세그먼트 볼륨 발색단의 비교적 큰 저수지에 부분적으로 기인하지만 콘 12 11 시스 망막 재생하는 뮐러 세포의 능력을 반영 할 수 있습니다. 완전히 어두운 적응 빛의 응답을 얻기 위해, 하나는 적외선 조명 아래 조각을 준비 할 수 있습니다. 적외선 빛 아래에서 해부를 위해, 우리는 해부 현미경의 접안에 GenIII 이미지 승압기를 (Nitemate NAV3, 리튼 산업, 템피, 애리조나) 첨부 적외선 LED 플래쉬와 조직을 조명. 슬라이스 및 해부 현미경하에 실시되지 않는 다른 절차를 위해, 우리는 헤드 마운트 IMA를 고용GE의 증강. 패치 피펫의 배치를 위해, 우리는 똑바로 고정 단계 현미경에 장착 된 적외선에 민감한 CCD 카메라 (예 : Watec 502H, Watec 주식 회사, 미들, NY)를 사용하여 조각을 시각화. 이러한 예방 조치로, 하나는 단일 광자 감도 6, 13을 전시 막대 반응을 얻을 수 있습니다.
망막 조각에서 하나의 작업 제한이 큰 분야 망막 뉴런의 긴 세포 프로세스는 깔끔히 절차를 수행하는 동안 자신의 수상 돌기의 많은 손실 될 수 있습니다. 망막 슬라이스 준비 따라서 시냅스 연락처 세포체에 가까운 공정을 포함하는 세포의 생리학을 공부에 더 유용합니다. 양서류와 포유류의 망막은 동일한 세포 유형의 많은을 공유하고 유사한 생리적 메커니즘에게 14-16를 사용합니다. 도롱뇽 망막 포유류의 망막의 여러 측면에 대한 좋은 모델이지만, 한 가지 중요한 차이점은 포유류의 전용로드 경로의 존재로 나타납니다 invoAII 무 축삭 세포 14 위에 특수 막대 양극 세포의 아이브 연락처. 도롱뇽 망막의 추가 제한이 종을 위해 특별히 개발 된 유전 도구의 작은 수입니다. 그러나 다른 종의 타겟이 잘 보존 된 지역이 도롱뇽 성공적으로 사용할 수있는 항체 shRNA 시약, 등 수 많은 작은 분자 억제제 및 펩티드 시약. 또한, 기술에 몇 가지 수정을 망막 슬라이스는 이러한 도구 중 일부는 더 쉽게 사용할 수있는 다른 종에서 준비 할 수 있습니다.
짝을 전체 셀 녹음에 대한 유틸리티를 넘어 도롱뇽 망막 슬라이스 준비는 다른 접근 방식의 다양한 의무이다. 위에서 언급 한 바와 같이, 망막 슬라이스는 다양한 전압 클램프 프로토콜 17과 함께 빛 반응을 연구하는 데 사용할 수 있습니다. 망막 신경 세포는 칼슘에 민감한 형광 염료와 함께로드 할 수있는 +, 염소 - 또는 나+ 패치 피펫을 통해 또는 목욕 응용 프로그램 15,18-20으로 소개했다. 시냅스 리본 21에 바인딩 형광 펩타이드 패치 피펫을 도입 할 때 형광을 결합, 심하게 선택적 리본 22 손상에 대한 이미지 리본 10에 사용할 수 있습니다. 우리는 또한 막대에서 개별 칼슘 채널과 콘 시냅스 터미널 (23)의 움직임을 모니터링하는 양자점과 함께 망막 슬라이스를 사용했습니다. 따라서, 수직 망막 슬라이스 기본 시냅스 메커니즘과 시각 신호 전달 경로의 첫 번째 시냅스에서 수행 고유 한 처리 기능을 연구하기위한 다양한 실험 준비입니다.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 실명 보건 부여 EY10542의 국립 연구소를 방지하기 위해 연구에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| Tissue slicer | Stoelting | 51425 | |
| Double edge razor blades | Ted Pella, Inc | 121-6 | |
| Nitrocellulose membranes | Millipore | AAWP02500 | Type AAWP 0.8 mm pore |
| Borosilicate glass pipettes | World Precision Instruments | TW120F-4 | 1.2mm OD 0.95 mm ID |
| Ag/AgCl pellet | Warner | E206 | |
| MicroFil | World Precision Instruments | MF34G-5 | 34 ga. Filling needle, 67 mm long |
참고문헌
- Ramòn y Cajal, S., Thorpe, S. A., Glickstein, M. . The Structure of the Retina. , (1972).
- Piccolino, M. Cajal and the retina: a 100-year retrospective. Trends Neurosci. 11, 521-525 (1998).
- Hartline, H. K. The response of single optic nerve fibers of the vertebrate eye to illumination of the retina. Am. J. Physiol. 121, 400-415 (1938).
- Kuffler, S. W. Discharge patterns and functional organization of mammalian retina. J. Neurophysiol. 16, 37-68 (1953).
- Werblin, F. S. Transmission along and between rods in the riger salamander retina. J. Physiol. 280, 449-470 (1978).
- Wu, S. M. Synaptic connections between neurons in living slices of the larval tiger salamander retina. J. Neurosci. Meth. 20, 139-149 (1987).
- Heidelberger, R., Thoreson, W. B., Witkovsky, P. Synaptic transmission at retinal ribbon synapses. Prog. Retin. Eye Res. 24, 682-720 (2005).
- Schmitz, F. The making of synaptic ribbons: how they are built and what they do. Neuroscientist. 15, 611-624 (2009).
- Morgans, C. W., Brown, R. L., Duvoisin, R. M. TRPM1: the endpoint of the mGluR6 signal transduction cascade in retinal ON-bipolar cells. Bioessays. 32, 609-614 (2010).
- Bartoletti, T. M., Babai, N., Thoreson, W. B. Vesicle pool size at the salamander cone ribbon synapse. J. Neurophysiol. 103, 419-423 (2010).
- Kim, M. H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis. Exp. (59), e3345 (2012).
- Wang, J. S., Estevez, M. E., Cornwall, M. C., Kefalov, V. J. Intra-retinal visual cycle required for rapid and complete cone dark adaptation. Nat. Neurosci. 12, 295-302 (2009).
- Thoreson, W. B., Tranchina, D., Witkovsky, P. Kinetics of synaptic transfer from rods and cones to horizontal cells in the salamander retina. Neuroscience. 122, 785-798 (2003).
- Wu, S. M. Synaptic organization of the vertebrate retina: general principles and species-specific variations: the Friedenwald lecture. Invest. Ophthalmol. Vis. Sci. 51, 1263-1274 (2010).
- Babai, N., Thoreson, W. B. Horizontal cell feedback regulates calcium currents and intracellular calcium levels in rod photoreceptors of salamander and mouse retina. J. Physiol. 587, 2353-2364 (2009).
- Babai, N., Morgans, C. W., Thoreson, W. B. Calcium-induced calcium release contributes to synaptic release from mouse rod photoreceptors. Neuroscience. 165, 1447-1456 (2010).
- Thoreson, W. B., Burkhardt, D. A. Contrast encoding in retinal bipolar cells: current vs. voltage. Vis. Neurosci. 20, 19-28 (2003).
- Thoreson, W. B., Bryson, E. J., Rabl, K. Reciprocal interactions between calcium and chloride in rod photoreceptors. J. Neurophysiol. 90, 1747-1753 (2003).
- Cadetti, L., Bryson, E. J., Ciccone, C. A., Rabl, K., Thoreson, W. B. Calcium-induced calcium release in rod photoreceptor terminals boosts synaptic transmission during maintained depolarization. Eur. J. Neurosci. 23, 2983-2990 (2006).
- Luo, J., Boosalis, B. J., Thoreson, W. B., Margalit, E. A comparison of optical and electrophysiological methods for recording retinal ganglion cells during electrical stimulation. Curr. Eye Res. 37, 218-227 (2012).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Snellman, J., Mehta, B., Babai, N., Bartoletti, T. M., Akmentin, W., Francis, A., Matthews, G., Thoreson, W. B., Zenisek, D. Acute destruction of the synaptic ribbon reveals a role for the ribbon in vesicle priming. Nat. Neurosci. 14, 1135-1141 (2011).
- Mercer, A. J., Chen, M., Thoreson, W. B. Lateral mobility of presynaptic L-type calcium channels at photoreceptor ribbon synapses. J. Neurosci. 31, 4397-4406 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유