Method Article
Bir Amfibi Retina Dilim hazırlanması Fotoreseptörler ve İkinci dereceden nöronlar eş zamanlı tam hücreli Kayıtlar
Bu Makalede
Özet
Biz su kaplan semender (gelen ince retina dilim hazırlanması tarif Ambystoma tigrinum) Ve fotoreseptör ve ikinci derece yatay ve bipolar hücrelerden çift tam hücreli gerilim kelepçe ölçümler ile retinada sinaptik işleme incelemek için bu dilim nasıl kullandıklarını açıklar.
Özet
Retina nörobilim merkezi görevlerden biri retinal nöronların devresi ve nasıl bu bağlantıları beyne iletilen sinyalleri şekillendirme sorumludur anlamaktır. Fotonlar bu optik sinir yoluyla işlenmiş ve beyinde merkezi hedeflere iletilen diğer retinal nöronların, onu verici, bir elektrik sinyali içine enerji dönüştürmek çubuk ve koni fotoreseptör tarafından retinada tespit edilir. Retina 3,4 çıkışını hücreleri - retina devresi ve görsel işleme içine önemli erken anlayışlar retina ganglion hücrelerinin spike faaliyet elektrofizyolojik kayıtları, daha sonra, Cajal 1,2 histolojik çalışmalar geldi ve.
Retinada görsel işlem ayrıntılı bir anlayış fotoreseptör retina ganglion hücre için yolunda her adımda sinyal bir anlayış gerektirir. Ancak, birçok retinal hücre tipleri burelektrofizyolojik kayıt için nispeten ulaşılmaz bu nedenle dokusunda derin ve ied. Bu sınırlama, retina katmanlarının her birinde ikamet eden hücreleri açıkça görülebilir ve elektrofizyolojik kayıt için erişilebilir olduğu dikey dilimleri, çalışma aşılabilir.
Burada, larva kaplan semender (Ambystoma tigrinum) gelen retina dikey bölümleri yapmak için bir yöntem açıklanmaktadır. Bu hazırlık aslında keskin Mikroelektronlar 5,6 ile kayıtları için geliştirilmiştir iken aynı anda kaydederken, biz fotoreseptör en membran potansiyeli manipüle edildiği fotoreseptör ve ikinci dereceden yatay ve bipolar hücrelerden çift tam hücreli gerilim kelepçe kayıtları için bir yöntem tarif sonrası Yatay ya da bipolar hücreleri sinaptik tepkilerine neden olur. Kaplan semender fotoreseptör bu t üstlenmek için ideal bir hazırlık yapma, memeli türlerin bu çok daha büyük olanonun teknik olarak zor deneysel bir yaklaşım. Iyi tonik nörotransmitter serbest 7 gibi yüksek bir oranda korumak için uygundur çubuk ve koni fotoreseptör, dahil olmak üzere nöronların bir sadece bir avuç, bulunan özel bir sinaptik yapısı - Bu deneyler sinaptik şerit sinyal özellikleri sondalama doğru bir göz ile açıklanmıştır - 8, ve ne kadar bu ilk retina sinaps eşsiz sinyal özelliklerine katkıda bulunur.
Protokol
1. Retina Dilimleri hazırlanması
- Bölme (tasarım Şekil 1 'de gösterildiği gibi) birleştirin. Yeri vakum gres iki boncuk, superfusate için bir kanal oluşturmak ve retina dilimleri gömmek için hangi kayıt odasına genelinde ayrı aralıklı ~ 8-10 mm,. Bir kabul töreni ve sınır yayılma olarak hareket için birkaç milimetre uzak dışarı yağ bu iki boncuk her ötesinde gres ikinci bir boncuk ekleyin. Referans elektrot ile sıvı teması sağlamak için odasının sonunda Kimwipe küçük üçgen bir parçası yerleştirin.
- Vakum gres iki küçük boncuk içine cam mikroskop lamı karşı düz; nitroselüloz membran (0.8 mikron gözenekleri ~ 5 x 10 mm) bir parça basın. Bu yapışmasını retina engelleyebilir kaçının, nitroselüloz membran merkezinde hemen altında yağ koyarak.
- Doku dilimleme makinesi hazırlamak için, 4 adet bir çift kenar jilet kırmak ve dilimleme koluna bir takın. Nitrocellul ince bir dilimose membran jilet kesme kenarı kayıt odasına karşı düz durduğundan ve bu nedenle nitroselüloz zarından temiz keser sağlamak için.
- Diseksiyon istasyonunda buz üzerinde amfibi serum fizyolojik (Tablo 1) küçük bir beher tutun.
- Dekapitasyon tarafından semender Euthanize. Omurilik yoluyla sagitally baş ve öz Hemisect. Pamuk parçası üzerinde kafa yerine yarım muşamba blok üstünde amfibi tuzlu su ile nemlendirilmiş. Başın diğer yarısı gün içinde daha sonra kullanım için nemli bir kağıt havlu ile sarılmış ve 4 ° C'de muhafaza edilebilir.
- Göz tanıttılar. Küçük Vannas makas kullanarak, çevresindeki yörünge için göz bağlayan cilt kesti. Çevreleyen yörünge dokudan gözün ön serbest bıraktıktan sonra, yörüngesinden göz kurtararak, göz kasları ve optik sinir kesmek için göz altında makas ileri göz çekin ve kaydırın.
- Pamuk bir yatakta enüklee göz yerleştirinmuşamba blok. Yarım kafa atın. Gözün arkasından aşırı yörünge yağ kesin.
- Keskin bir cerrahi bıçak ile kornea merkezinde küçük bir kesi yapmak. Kesi içine mükemmel Vannas makas sürgülü ve ora serrata doğru radyal kesme dışarı uzatarak kornea çıkarın. Muşamba blok veya kesim arasındaki pamuk çevirerek ora serrata çevresel olarak kesin.
- Göz çevresindeki tüm yol kestikten sonra, Göz yuvası yan dışına çekerek kornea ve lens çıkarın. Muşamba blok sert bir yüzeye çıkan Göz yuvası hareket amfibi serum fizyolojik ile nemlendirilmiş. Eğer sklera üzerinden tüm yol kestik sağlamak için iyi bir kesme hareketi kullanarak, keskin bir jilet ile üçte içine kesti.
- Retina yüzeyi ile nitroselüloz membran üzerinde Göz yuvası yerine bir veya iki adet aşağı bakacak. Daldırın olmayan ilave tuz çözeltisi ile birlikte geri kalan parçaları ve ~ 4 ° C de buzdolabına koyun
- Gently ince forseps ile nitroselüloz membran karşı Vizör adaptör parçası basın. Retina uymak için KimWipe ile kenarları soğuk amfibi tuzlu ve leke birkaç damla ile Batmak nitroselüloz membran ve Göz yuvası parçası. Soğuk amfibi serum fizyolojik ve sıyırın (nedeniyle ağartılmamış rodopsin varlığı pembe görünebilir olan) retina izole etmek için sklera / koroid / retina pigment epiteli birkaç damla ile bir kez daha, daldırın Göz yuvası ve nitroselüloz membran. Gerekirse retinaya boşaltmak için optik sinir kesilmiş.
- Retina sıkıca yapışık değilse, nitroselüloz membran üzerine daha sıkıca retina çekmek için bir KimWipe ile tuzlu akıtmak. Tuzlu değiştirin. Gerekirse, tekrar edin.
- Soğuk amfibi tuzlu su ile oda doldurun ve doku dilimleme makinesi aşamasına aktarın. Sürmeli mikrometre çevirerek bir uçtan diğer uca çalışan, ince şeritler halinde retina ve nitroselüloz membran dilim125 mikron artışlarla. Yavaşça ama sıkıca retina ve nitroselüloz zarından jilet basın.
- Kayıt odasının ana kanala nitroselüloz membran şeritler hareket ettirerek retina dilimleri aktarın. Ücretsiz membran bir şerit kaldırın ve sonra dilim su altında tutmak için emin olmak, altındaki odasına taşırken bir yerde tutun. Retina katmanları görmek için onları 90 derece döner, vakum yağ şeritler nitroselüloz membran kenarları embed.
- Cam yüzey karşı nitroselüloz membran düz basın. Her parça retina var olmasa bile, yüzey gerilimi kırmak yardımcı ve sıvı akışını geliştirmek için perfüzyon kanalın tüm uzunluğu boyunca düzenli aralıklarla (ayrı ~ 1 mm) nitroselüloz membran yerine şeritler.
2. Eşli tam hücreli Kayıtlar
- Dilim tüm aktarıldıktan sonra, sabit, dik aşamasına kayıt odasına taşıyınaşamasında mikroskop ve referans elektrot kurşun takın. Uzun çalışma mesafesi, su altında, 40-60X objektif kullanarak dilimleri odaklanın. Mikroskop titreşimleri engellemek için bir hava masaya yerleştirilir ve elektrik paraziti azaltmak için bir Faraday kafesi içine alınmalıdır.
- % 100 O2 ile kabarmış amfibi tuzlu su çözeltisi ile 1 ml / dak 'lık bir hızla sürekli dilim Superfuse. Giriş ve çıkış dengeli olduğundan emin olarak, emme bağlayın. Çıkış emme iğnenin kesik sonuna döndürerek ya da yakın veya uzakta çıkış iğne odasının sonunda KimWipe hareket ile kontrol edilebilir. Hazırlık, oda sıcaklığında ya da muhafaza bir Peltier cihazı ile ya da sadece mikroskop aşamasında bir buz torbası ayarlayarak soğutulabilir.
- Loş veya kızıl-ötesi ışık altında dilimleri inceleyin ve hücrelerin bir çift tanımlamak - tam hücreli kayıt için hedef için - bir fotoreseptör (çubuk veya koni) ve yakın yatay veya bipolar hücre. Çubuklar i olabilironların büyük hücre gövdeleri ve belirgin çubuk benzeri dış kesimleri (Şekil 2A) tarafından dentified. Koniler çubuklar daha küçüktür ve küçük konik dış segmentleri var. Bipolar hücre ve yatay hücre somas iç nükleer tabakada hücre gövdeleri en dış satır (; Şekil 2B ve 2C INL) bulunmaktadır.
- Dilimleri hazırlamadan önce, borosilikat cam (1.2 mm dış çapı, bir cam elyaf ile 0.95 mm iç çapı) den mikropipetler üretimi için bir pipet çektirmenin kullanın. Her mikropipet ucu çapı ~ 1-2 mikron olmalıdır.
- Metal olmayan bir doldurma iğnesi (örneğin, bir 1 cc şırınga ya da bir MICROFIL imal) kullanarak, hücre içi çözelti (Tablo 1) ile pipetler girip elektrot tutucu bağlanırlar.
- Biraz mikroskop objektif yükseltmek. Amaç altında fotoreseptör pipet yerleştirin ve daha sonra ucu sadece dilimleri üzerinde pozisyonlanır, böylece daha düşük. T tekrarlayıno ikinci pipet.
- Amplifikatör temel mevcut düzeyde ofset herhangi bir ayarlayın. 5-10 mV depolarizan darbe ile pipet direnci kontrol edin. Biz genellikle pipet kullanın MQ 10-15 arasında değişen, şaft ve amfibi pipet çözümleri düşük osmolaritesi uzun konik sonucu. Yüksek osmolaritesi memeli çözümleri ile, bu aynı pipet MQ ~ 8-12 direnci değerleri göstermelidir. Biz 3-4 MQ amfibi çözümlerinde direnci değerleri ile büyük ucu çapları kullanmış olsa da, daha düşük bir erişim direnç sağladığı avantajlar hücre zarları üzerine sızdırmazlık daha büyük bir zorluk ve kalsiyum akımları ve diğer ikincil haberci daha hızlı bir özet ile mahsup edilir duyarlı tepkilerine neden olur.
- Hafif pozitif basınç, pozisyon post-sinaptik pipet uygularken temas yatay veya bipolar hücre vücut o kadar. Daha sonra presinaptik pipet yerleştirmek temas bir çubuk veya koni fotoreseptör ve hücre gövdesi o kadar. Kayıtlar Appepipet uçları yerine soma daha iç kesimi başvurduğunuzda ar özellikle koniler, daha istikrarlı olmak.
- Direncini izlerken, post-sinaptik pipet üzerinde pozitif basınç bırakın. Bazı durumlarda, pozitif basınç serbest gigaohm bir sızdırmazlık oluşturmak için yeterlidir. Aksi takdirde, bir 1 ml şırınga ile veya ağız yoluyla negatif basınç uygulayın. Ucu direnci M> 100 büyüdü sonra, -60 mV bir holding potansiyeli geçerlidir. Bir gigaohm mühür elde ettikten sonra, herhangi bir pipet kapasitans geçici dışarı boş ve -70 mV bir holding potansiyel uygulayarak, fotoreseptör pipet için sızdırmazlık işlemi tekrarlayın.
- ACL ağzınıza veya sırayla her hücreye emme uygulamak için bir şırınga kullanarak düzeltme eki. Çubuklar, koni ve bipolar hücreleri hafif bir emme ile kopma tipik olacak. Yatay bir hücre ile tam hücre konfigürasyonu elde "zap" F ile birlikte güçlü bir pratik voltaj darbeleri ile kombinasyon halinde yüksek emiş gücü (örneğin, 3 cc şırınga yani) gerektirebiliryama kelepçe amplifikatör eature. Tam hücreli yapılandırma membran ve kuruluş ACL tam hücreli kapasite geçici bir görünümünü belli olacak.
- Hafif flaş uygulayarak ve 20 mV artışlarla (Şekil 3 ve 4) -120 ile +40 mV gerilim bir dizi adım sunarak fizyolojik post-sinaptik hücrenin kimliklerini doğrular.
- Hücrelerin çift synaptically bağlıysanız, fotoreseptör kısa bir (25-100 msn), 60 mV adım depolarizasyon teslim (-10 mV, L-tipi voltaj bağımlı kalsiyum akımının tepe yakın) ve görünüm değerlendirmek ikinci dereceden nöron sonrası sinaptik akımları (Şekil 5). Güçlü bir depolarize adım konisi (Şekil 5) vezikül serbest bir patlama neden post-sinaptik yatay ya da kapalı bipolar hücre hızlı bir, geçici içe post-sinaptik akım uyandırmak gerekir.
Sonuçlar
Semenderin retina dikey dilim nöronların ışık yanıtları Örnek izleri Şekil 3 'de gösterilmiştir. Koni, yatay hücre ve bipolar hücre OFF tüm ışık başlangıcı yanıt olarak bir dışa akımı görüntüler. Yatay ve bipolar hücre kayıtlarında ışığı yanıp izleyen belirgin içe mevcut onlar ışık ofset de depolarize olarak fotoreseptör gelen glutamat artan serbest neden olur. AÇIK bipolar hücre bir işaret-ters metabotropik glutamat reseptör sinyal akışında ve TRPM1 kanallarının 9 aktive edilmesinden kaynaklanan hafif başlangıç içeri doğru bir akım verir. Yatay hücreleri ve çift kutuplu hücreler IV ilişkileri (Şekil 4) birbirinden ayırt edilebilir. Bipolar hücreleri yüksek giriş direnci varken; Yatay hücreler genellikle doğrusal ya da içsel IV rektifiye ve düşük giriş direnci (Şekil 4A MQ <500) var(0.5-2 GΩ) ve dıştan-rektifiye - V (Şekil 4B) Şekil 5 bir koni-yatay hücre çifti (Şekil 5A) ve koni-OFF bipolar hücre çifti (Şekil 5B) kayıtları bir temsilci sonuçlarını gösterir.. Her birinde, -70 mV'luk bir tutma potansiyelinden -10 mV koni depolarize yatay ya da bipolar hücre içinde koni ve hızlı EPSC içe doğru akım voltaj-bağımlı kalsiyum uyarılmış. Bu güçlü bir uyarıcı ~ 47 pA / şerit 10 bir EPSC ile sonuçlanan her sinaptik kurdele gelen ~ 20 veziküller kolayca-açıklanmaması havuzu, boş yeterlidir. Şekil 5A yatay hücre EPSC bu presinaptik koni 5 şerit rehber aldığını düşündüren, 232 pA oldu. Kapalı uçlu hücreye 178 pA EPSC (Şekil 5B) Benzer bir şekilde, bu tahmin presinaptik koni 4 şerit temas alınan olduğunu göstermektedir.
| Amfibi tuzlu | Presinaptik pipet | Postsinaptik pipet | |
| NaCl | 116 mM | 3.5 mM | 3.5 mM |
| KCl | 2.5 mM | ||
| CaCl2 | 1.8 mM | 1 mM | 1 mM |
| MgCl2 | 0.5 mM | 1 mM | 1 mM |
| HEPES | 10 mM | 10 mM | 10 mM |
| Glikoz | 5 mM | ||
| Cs-glutamat * | 40 mM | ||
| Cs-glukonat ** | 50 mM | 90 mM | |
| Tetra-etilamonyum klorit | 10 mM | 10 mM | |
| ATP-Mg | 9 mm | 9 mm | |
| GTP | 0.5 mM | 0.5 mM | |
| EGTA | 5 mM | 5 mM | |
| pH *** | 7.8 | 7.2 | 7.2 |
| Osmolaritesi **** | 245 mOsm | 240 mOsm | 240 mOsm |
* Cs-glutamat pipet çözeltisi içinde 40 mM CsOH ile 40 mM L-glutamik asidin nötrleştirilerek yapılır. ** Cs glukonat bir 1 M stok% 45-50 D-glukonik asit ile CsOH eden bir çözelti nötralize tarafından yapılır. *** PH pipet çözümleri için hücre dışı çözeltisi ve CsOH NaOH ile ayarlanır. **** Sadece aşağıdaki pipet çözümlerin ozmolarite tutulması dışı çözelti bu hücre şişmesi engeller ve kaydın ömrü artırır.
Tablo1. Bu protokolde kullanılan standart hücre içi ve hücre dışı çözüm bileşenleri ve parametreleri.
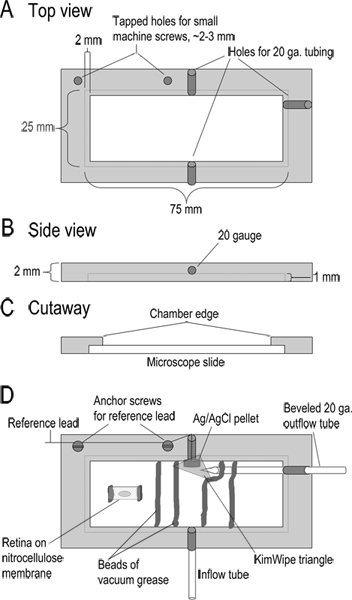
Şekil 1. Kayıt odası tasarımı. (AC) Top, yan ve boyutlarını gösteren kayıt odasının kesit manzarası. Odası akrilik bir 2 mm kalınlığında parça işlenmiştir. (D) Montajlı odası. Superfusate Teflon boru 10 cm uzunluğunda (; tipi 24LW girişi tüp) yoluyla odasına girer. Superfusate odasının diğer tarafında eğimli bir 20 gauge, metal boruya hafif emme uygulanarak çıkarılır. Bu çıkış tüp bitişik bir Ag / AgCl pelet referans elektrot. Bu referans elektrodundan talebi headstage referans girişine bağlıdır. KimWipe küçük bir üçgençözeltisi ile temas içinde tutmak ve çıkış tüp içine çözelti akışını düzenlemek için referans elektrotu üzerine yerleştirilir. Odasının tabanına odasının girintili kenarlarını içine bir cam mikroskop lamı yerleştirilmesi ile oluşturulur. Slayt vakum gres bir boncuk ile yerinde tutulur. Retina dilimleri ile nitroselüloz membran şeritler akışına çözüm için bir kanal oluşturmak vakum yağ boncuk yerleştirilmiştir. Önce dilim yapmak için, nitroselüloz membran 5 x 10 mm parça vakum gres iki küçük boncuklar ile odasına yapıştırılmıştır. Göz yuvası bir parça bu nitroselüloz membran üzerinde vitre tarafı aşağı yerleştirilir ve retina yapışır kez uzak kaldırdı. büyük rakam görmek için buraya tıklayın .
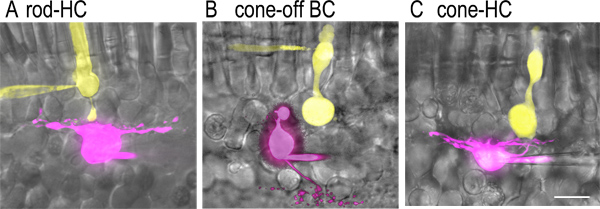
Şekil 2. Ve boyanın dolu hücre çiftlerirtical dilim hazırlık. A) aynı anda tam hücreli kayıt sırasında yama pipet ile tanıtıldı floresan boyalar zıt dolu olduğu bir çubuk ve synaptically-birleştiğinde yatay hücre görüntüleri. Lucifer sarının (2 mg / ml) ve çubuğun pipet çözeltisi (sarı) ve sulfarhodamine A (1 mg / ml), yatay hücre pipet çözeltisi (mor) eklenmiştir dahil edilmiştir. Floresan görüntüleri soğutmalı CCD kamera (Orca ER) ile donatılmış ve sabit sahne mikroskobu (60X, 1.0 NA suya daldırma hedefi ile Nikon E600 FN) monte bir iplik disk konfokal mikroskop (Perkin Elmer Ultraview LCI) kullanılarak ele geçirildi. Bu görüntüler) bir koni Görüntü ve bipolar hücre OFF synaptically-birleştiğinde Adobe Photoshop. B kullanarak ilgili retina dilim parlak bir alan görüntülerde üst üste edildi. Bipolar hücre akson terminali iç nükleer tabaka ile sınırı yakınlarındaki iç pleksiform tabakasının en dış (S1) sublamina içinde ramifies. C) bir koni ve synaptically-birleştiğinde yatay hücre görüntüleri. Koni terminalleri çubuğun akson terminali çok daha büyük olduğunu unutmayın. Yatay hücreler ON-ve INL OFF-tipi bipolar hücreleri kolayca kayıttan önce ayırt edilemez kendi hücre gövdeleri dikdörtgen şekli, hücre organları tarafından tespit edilebilir olsa da. Bununla birlikte, bir onl hücre gövdeleri ve iç ve dış bölümleri olmaması ile koni ayırt edilebilir iki kutuplu hücrelerini koni tahrik olmuş hedef olabilir. Ölçek çubuğu 20 mm.
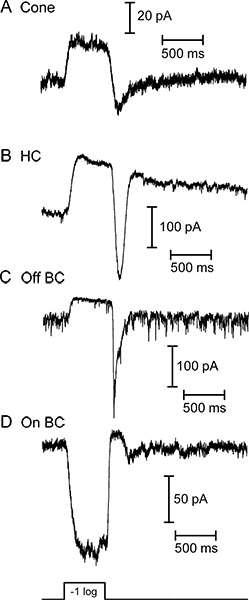
Şekil 3,. Beyaz parlak bir ışık 500 msn flaş yanıt olarak dört farklı retina nöronlardan gerilim kelepçe nda izlenen akımları Işık uyarılmış. Konisi (A), yatay hücre (B) ve bipolar hücre kapalı (C) tüm dışa akım ışık cevap verdi. (D) üzerinde bipolar hücre içe dönük bir akım ile aynı ışık uyarana yanıt verdi. Kapalı bipolar hücre (C) tarafından sergilenen temel gürültü fotoreseptör ışığında hiperpolarize zaman azalır karanlıkta sinaptik veziküllerin sürekli bir sürümü yansıtır. Bu dört hücre verdiği beyaz ışık altında hazırlanan dilimleri kullanarak ayrı kayıtları elde edilmiştir. Bu örneklerde kullanılan beyaz ışık uyaran yoğunluğu 1 x 10 5 fotonlar / sn / 2 um ile 580 nm foton huzmesine eşdeğer yatay ve bipolar hücre yanıtları üretti.
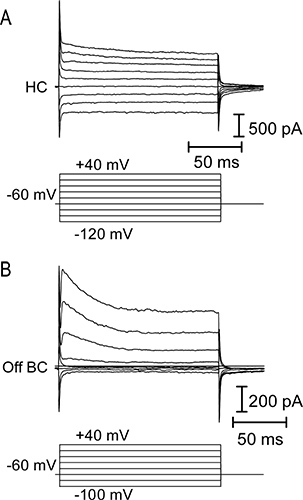
Şekil 4. H akım-gerilim (IV) ilişkileriorizontal ve kapalı bipolar hücreleri. (A) Üst panel, -120 bir yatay hücreye 20 mV artışlarla (alt panel) uygulanan +40 mV 150 msn gerilim bir dizi adım tarafından uyarılmış membran akımları. Yatay hücreleri tipik olarak düşük bir giriş direnci ve doğrusal ya da içeri doğru rektifiye IV ilişkilere sahiptir. Voltaj adımları bir dizi yanıt olarak bir bipolar hücre dışı bölgesinin (B) IV ilişkisi. Bipolar hücre voltaj kapılı potasyum akımlarının aktivasyonuna bağlı olarak daha yüksek bir giriş direnci ve bir dışa doğru düzeltici IV sahiptir.
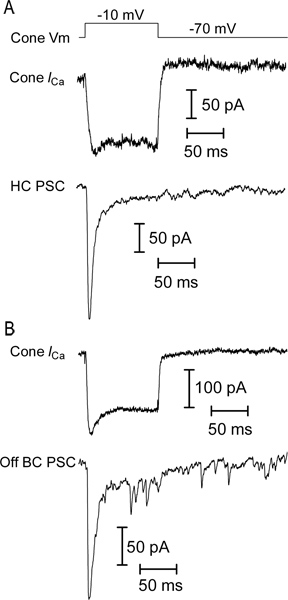
Şekil 5,. Eşleştirilmiş veri kayıt örnekleri. Koni voltaj bağımlı kalsiyum akımı (A) Kayıt (Koni I Ca (Koni V m) bir tutma potansiyeli -10 mV'a bir 100 ms adımına cevap olarak UB>). Kaçak ve kapasite geçici bir P / 8 kaçak çıkarma protokolü kullanılarak çıkartılmıştır. Hızlı bir uyarıcı (EPSC; HC PSC) mevcut sinaptik-sonrası, bu iki hücre sinaptik birleştirilmiştir gösteren yatay bir hücre aynı anda kaydedildi (B) EPSC başka bir aynı uyarıya cevap olarak kapalı bir bipolar hücre kaydedildi. koni.
Tartışmalar
Retina dilim hazırlık devresi ve görsel bilgi işlem için retina tarafından istihdam mekanizmaları analiz için çok yararlı olduğu kanıtlanmıştır. Öncesi ve sonrası-sinaptik nöron aynı anda tüm hücre kayıtları elde etmek için yeteneği bu çaba içinde özellikle yardımcı olmuştur. Farklı retina katmanları maruz çünkü eşleştirilmiş tüm hücre kayıtları düz montaj retina hazırlıkları ile daha dilimleri elde etmek çok daha kolaydır. Ayrıca, çünkü onların büyük retina nöron, semender bir retina hazırlık olarak uzun bir geçmişi var ve bu nedenle özellikle well-karakterize model sistem sağlar.
Uygulama ile, semender retinanın sağlıklı dilim düzenli olarak hazırlanabilir. Birkaç önemli adımlar başarı ve başarısızlık arasındaki fark yaratabilir. 1) bu temiz cam yüzey ve dilim karşı düz bırakır böylece jilet doku dilimleme makinesi monte emin olun rağmen doku ve underlyi hemng nitroselüloz zar. Eğer nitroselüloz zarından temiz bir kesim yaptıysanız, jilet cam slayt yüzeyi vurur gibi, bir soluk klik sesi duyacaksınız. 2), retina nitroselüloz zarına yapışmış olan emin olun. Aksi takdirde, retina işlemlerin herhangi bir adım sırasında membran uzak yüzebilirler. 3) Bu yüzeysel hücrelerin çok zarar verir gibi, havaya kesme dilim maruz bırakmayın. 4) retina katmanları mikroskop altında belirgin şekilde dilimleri ve nitroselüloz membran cam slayt karşı düz yalan emin olun. 5) kayıt odasına taşan önlemek için superfusate giriş ve çıkış oranları Dengesi. Bu ani doku hareketlere neden olabilir çözüm düzeylerinde ani değişiklikler, önler. 6), birbirine yakın hücreler, sağlıklı bir çift seçin. Düzgün sitoplazmalı hücrelerin grenli sitoplazmalı hücreler daha sağlıklıdır. Dilim derin hücreleri sağlam sinaptik con korumak için olasılığı daha yüksektirtaklar. 7) pipet hücrelere yolda bozuldu veya diğer doku ya da enkaz karşı fırçaladı değil emin olun. 8) bu enkaz ya da zor bir kalite tam hücreli kayıt elde etmek için yapabileceğiniz her ikisi de bir balon ile tıkalı olmadığından emin olmak için pipet direncini kontrol ediniz.
Aksine nitroselüloz filtre kağıdı için retina bağlama daha, bazı araştırmacılar agar bir blok retina embed ve retina dilim kesmek için bir vibratome kullanın. Biz bu yaklaşımı hiç denemedim rağmen, Kim ve ark. 11. Her iki yaklaşımın avantajları tartışacağız. Kendi deneyim, agar dayalı bir yaklaşım iyi tarif retina katmanları düz dilim daha tutarlı bir verim sağlar, ancak filtre kağıdı dayalı bir yaklaşım sağlıklı fotoreseptör verir.
Çubuk ve koni membran potansiyeli değişiklikleri ışık iletici sorumludur. Eşleştirilmiş kayıtları ile, çubuk veya koni membran potansiyeli MANIPUL olabilirhücre tipleri tanımlamak için yararlı ise, gerekli olmayabilir, doğrudan ve çok hafif yanıtları oluşturma yeteneğine ated. Bu nedenle sık sık beyaz ışık dilimleri hazırlamak. Şekil tepkiler gösterildiği Ancak, parlak aydınlatma altında hazırlanan bile, semender retinal nöronların büyük ışık yanıtları oluşturabilir. 3. Bu, geniş dış kademeli bir hacimde kromofor, görece geniş bir hazneye kısmen, aynı zamanda koni 12 boyunca 11 cis-retinal yeniden oluşturmak için Müller hücrelerinin yeteneği yansıtabilir. Tam koyu adapte ışık yanıtları elde etmek için, bir kızılötesi aydınlatma altında dilimleri hazırlayabilirsiniz. Kızılötesi ışık altında diseksiyonu için, diseksiyon mikroskop Okülerin için GenIII görüntü şiddetlendirici (Nitemate NAV3, Litton Industries, Tempe, AZ) takın ve kızılötesi LED el feneri ile doku aydınlatmak. Dilimleme ve mikroskop altında yürütülen olmayan diğer işlemler için, kafa monte ima istihdamge yoğunlaştırıcı. Yama pipetler yerleştirilmesi için, dik, sabit aşamalı mikroskop monte kızılötesi duyarlı CCD kamera (örneğin WATEC 502H, WATEC Inc, Middletown, NY) kullanarak dilimleri görselleştirmek. Bu önlemlere, tek bir foton hassasiyet 6, 13 sergileyen çubuk yanıtları alabilirsiniz.
Retina dilim çalışan bir sınırlama büyük alanda retinal nöronların uzun hücresel süreçleri dilimleme işlemi sırasında dendritler birçok kaybedebilirsiniz olmasıdır. Retina müstahzarlar dilim bu nedenle sinaptik iletişim hücre gövdesine yakın işlemleri de kapsayan bir hücre fizyolojisi eğitim için daha yararlıdır. Amfibi ve memeli retina aynı hücre tiplerinin çok paylaşmak ve benzer fizyolojik mekanizmaları 14-16 kullanmaktadır. Semender retina memeli retina birçok açıdan için iyi bir model olsa da, önemli bir fark memelilerde özel bir çubuk yolun varlığı gibi görünüyor bu invoAII amacrine hücreleri 14 üzerine özel çubuk bipolar hücrelerin lves kişiler. Semender retinanın ek bir sınırlama bu tür için özel olarak geliştirilmiş genetik araçları küçük bir sayıdır. Bununla birlikte, diğer türlerde de hedef iyi konserve edilmiş bölgelerde semenderin başarılı bir şekilde kullanılabileceğini antikorlar ve shRNA reaktifler olarak bir çok küçük molekül inhibitörleri ve peptit reaktifler. Buna ek olarak, teknik içinde birkaç değişiklik ile, retina dilim bu araçlardan bazıları daha kolay kullanılabilir hangi diğer türlerden hazırlanabilir.
Eşleştirilmiş tam hücreli kayıt için kendi programını ötesinde, semender retina dilim hazırlık da diğer yaklaşımlar çeşitli müsait. Yukarıda ele alındığı gibi, retina dilimleri çeşitli voltaj kıskaç protokolleri, 17 ile birlikte ışık yanıtları incelemek için kullanılabilir. Retina nöronlar da Ca 2 duyarlı floresan boyalar ile yüklenebilir +, Cl -, veya Na+ Yama pipet aracılığıyla veya banyo-uygulama 15,18-20 tarafından tanıtıldı. Sinaptik şerit 21 ile bağlanan bir floresan peptid yama pipet ile başlandığında floresein konjuge, akut ve selektif bir şerit 22 zarar verdiği için görüntüleme, şerit 10 ya da için kullanılabilir. Ayrıca çubuk, tek tek kalsiyum kanalları ve koni sinaptik terminallerindeki 23 hareketlerini izlemek için kuantum noktalar ile birlikte retina dilimleri kullandık. Bu nedenle, dikey retina dilim temel sinaptik mekanizmaları ve görsel sinyal yolunun ilk sinaps gerçekleştirilen özel işleme fonksiyonlarını incelemek için çok yönlü bir deney preparattır.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma Körlük ve Sağlık hibe EY10542 National Institutes Önleme Araştırma tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Tissue slicer | Stoelting | 51425 | |
| Double edge razor blades | Ted Pella, Inc | 121-6 | |
| Nitrocellulose membranes | Millipore | AAWP02500 | Type AAWP 0.8 mm pore |
| Borosilicate glass pipettes | World Precision Instruments | TW120F-4 | 1.2mm OD 0.95 mm ID |
| Ag/AgCl pellet | Warner | E206 | |
| MicroFil | World Precision Instruments | MF34G-5 | 34 ga. Filling needle, 67 mm long |
Referanslar
- Ramòn y Cajal, S., Thorpe, S. A., Glickstein, M. . The Structure of the Retina. , (1972).
- Piccolino, M. Cajal and the retina: a 100-year retrospective. Trends Neurosci. 11, 521-525 (1998).
- Hartline, H. K. The response of single optic nerve fibers of the vertebrate eye to illumination of the retina. Am. J. Physiol. 121, 400-415 (1938).
- Kuffler, S. W. Discharge patterns and functional organization of mammalian retina. J. Neurophysiol. 16, 37-68 (1953).
- Werblin, F. S. Transmission along and between rods in the riger salamander retina. J. Physiol. 280, 449-470 (1978).
- Wu, S. M. Synaptic connections between neurons in living slices of the larval tiger salamander retina. J. Neurosci. Meth. 20, 139-149 (1987).
- Heidelberger, R., Thoreson, W. B., Witkovsky, P. Synaptic transmission at retinal ribbon synapses. Prog. Retin. Eye Res. 24, 682-720 (2005).
- Schmitz, F. The making of synaptic ribbons: how they are built and what they do. Neuroscientist. 15, 611-624 (2009).
- Morgans, C. W., Brown, R. L., Duvoisin, R. M. TRPM1: the endpoint of the mGluR6 signal transduction cascade in retinal ON-bipolar cells. Bioessays. 32, 609-614 (2010).
- Bartoletti, T. M., Babai, N., Thoreson, W. B. Vesicle pool size at the salamander cone ribbon synapse. J. Neurophysiol. 103, 419-423 (2010).
- Kim, M. H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis. Exp. (59), e3345 (2012).
- Wang, J. S., Estevez, M. E., Cornwall, M. C., Kefalov, V. J. Intra-retinal visual cycle required for rapid and complete cone dark adaptation. Nat. Neurosci. 12, 295-302 (2009).
- Thoreson, W. B., Tranchina, D., Witkovsky, P. Kinetics of synaptic transfer from rods and cones to horizontal cells in the salamander retina. Neuroscience. 122, 785-798 (2003).
- Wu, S. M. Synaptic organization of the vertebrate retina: general principles and species-specific variations: the Friedenwald lecture. Invest. Ophthalmol. Vis. Sci. 51, 1263-1274 (2010).
- Babai, N., Thoreson, W. B. Horizontal cell feedback regulates calcium currents and intracellular calcium levels in rod photoreceptors of salamander and mouse retina. J. Physiol. 587, 2353-2364 (2009).
- Babai, N., Morgans, C. W., Thoreson, W. B. Calcium-induced calcium release contributes to synaptic release from mouse rod photoreceptors. Neuroscience. 165, 1447-1456 (2010).
- Thoreson, W. B., Burkhardt, D. A. Contrast encoding in retinal bipolar cells: current vs. voltage. Vis. Neurosci. 20, 19-28 (2003).
- Thoreson, W. B., Bryson, E. J., Rabl, K. Reciprocal interactions between calcium and chloride in rod photoreceptors. J. Neurophysiol. 90, 1747-1753 (2003).
- Cadetti, L., Bryson, E. J., Ciccone, C. A., Rabl, K., Thoreson, W. B. Calcium-induced calcium release in rod photoreceptor terminals boosts synaptic transmission during maintained depolarization. Eur. J. Neurosci. 23, 2983-2990 (2006).
- Luo, J., Boosalis, B. J., Thoreson, W. B., Margalit, E. A comparison of optical and electrophysiological methods for recording retinal ganglion cells during electrical stimulation. Curr. Eye Res. 37, 218-227 (2012).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Snellman, J., Mehta, B., Babai, N., Bartoletti, T. M., Akmentin, W., Francis, A., Matthews, G., Thoreson, W. B., Zenisek, D. Acute destruction of the synaptic ribbon reveals a role for the ribbon in vesicle priming. Nat. Neurosci. 14, 1135-1141 (2011).
- Mercer, A. J., Chen, M., Thoreson, W. B. Lateral mobility of presynaptic L-type calcium channels at photoreceptor ribbon synapses. J. Neurosci. 31, 4397-4406 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır