Method Article
זרימת עבודה ללא כתמים V3 לבקרת טעינת חלבונים מעשית, נוחה ואמינה ב-Blotting המערבי
In This Article
Summary
זרימת עבודה V3 היא הליך כתם מערבי באמצעות ג'לים ללא כתמים. הטכנולוגיה נטולת הכתמים מאפשרת לחוקרים לדמיין את איכות הפרדת החלבון, לאמת את יעילות ההעברה, והכי חשוב, לאמת את השינוי בחלבון המעניין באמצעות כימות חלבונים כולל כבקרת טעינה אמינה.
Abstract
הכתם המערבי הוא טכניקת מעבדה שימושית מאוד מאומצת נרחב, אבל הביצוע שלה הוא מאתגר. זרימת העבודה מאופיינת לעתים קרובות כ"קופסה שחורה "מכיוון שניסוי אינו יודע אם היא בוצעה בהצלחה עד האחרון מבין מספר שלבים. יתר על כן, איכות הנתונים כתם המערבי הוא לפעמים מאותגר בשל היעדר כלי בקרת איכות יעילים במקום לאורך כל תהליך סופג המערבי. כאן אנו מתארים את זרימת העבודה המערבית V3, אשר מיישמת טכנולוגיה ללא כתמים כדי לטפל בדאגות העיקריות הקשורות לפרוטוקול הכתם המערבי המסורתי. זרימת עבודה זו מאפשרת לחוקרים: 1) להפעיל ג'ל בכ 20-30 דקות; 2) כדי לדמיין את איכות ההפרדה מדגם בתוך 5 דקות לאחר ריצת הג'ל; 3) להעביר חלבונים ב 3-10 דקות; 4) כדי לאמת את יעילות ההעברה כמותית; והכי חשוב 5) כדי לאמת שינויים ברמת החלבון של עניין באמצעות בקרת טעינת חלבון הכוללת. גישה חדשנית זו מבטלת את הצורך בהפשטה ובשכפול של הכתם עבור חלבונים לניקיון הבית כגון β-אקטין, β-טובולין, GAPDH וכו 'זרימת העבודה נטולת הכתמים V3 הופכת את תהליך הכתם המערבי למהיר יותר, שקוף, כמותי ואמין יותר.
Introduction
כתם מערבי הוא טכניקה שימושית מאוד9, עם זאת, ישנם שני אתגרים עיקריים עם סופג המערבי: תהליך ארוך עבודה אינטנסיבי ואיכות הנתונים. פרוטוקול מסורתי דורש בערך יומיים. זה כרוך בצעדים רבים כולל הכנת מדגם, יציקת ג'ל, אלקטרופורזה חלבון והעברה, חסימת קרום ואחריו דגירה נוגדנים, הדמיה, ולעתים קרובות למדי הפשטה, תוכחה, ולבסוף ניתוח נתונים. לאורך כל התהליך הזה, אין כלים אמינים וגמישים לבקרת תהליכים. ככזה, שגיאות ניתן להציג בכל שלב, ושגיאות אלה יש פוטנציאל ליצור חפצי נתונים; לכן, טעינת פקדים חיוניים בנפח המערבי כדי לזהות ולתקן את השגיאות. בקרת הטעינה נעשית בדרך כלל על ידי בדיקת רמת החלבון של חלבון ייחוס בכל מדגם כדי לראות אם הוא מוצג באותה מידה. אנשים משתמשים לעתים קרובות בחלבונים של משק בית, כגון β-אקטין, β-טובולין, GAPDH, כבקרת טעינה.
איכות נתוני הכתמים המערביים תלויה בבקרת טעינה אמינה. אבל יש שני חששות לגיטימיים בעת שימוש בחלבונים משק בית לטעינת פקדים: 1) immunodetection מבוסס נוגדנים של להקות חלבון משק הבית הם לעתים קרובות רווי ולכן אי אפשר להבחין את הבדלי הטעינה בין הדגימות30; 2) רמת ביטוי חלבון משק הבית עשויה להשתנות בדגימות בתנאים ניסיוניים מסוימים , למשל, טיפול siRNA, מוות תאי, בידול תאים וכו'11,28,3,6,10,21. בשל חששות אלה, כתבי עת מדעיים דורשים כעת כי "להשוואות כמותיות, ריאגנטים מתאימים, פקדים ושיטות הדמיה עם טווחי אותות ליניאריים יש להשתמש" (הנחיות הטבע). באופן דומה, עורכי כתב העת של חקירה קלינית מבקשים פקדי טעינה אמינים יותר24. מסיבות אלה, חלבון משק בית צריך להיות מאומת על מנת לשמש בקרת טעינה. ראשית, יש לוודא שהוא נמדד בטווח הדינמי הליניארי של שיטת האימונודטיקציה14,29. שנית, יש לוודא שזה בא לידי ביטוי באופן עקבי בכל הדגימות26,31,25,19,20.
פתרון חלופי לבקרת טעינה אמינה הוא להשתמש במדידת חלבון כוללת מהכתם. כמה חוקרים הכתימו את הכתמים בכתמי חלבון כוללים, כגון קומאסי, פלמינגו פינק, סיפרו רובי, אמידו בלאק, פונסאו S וטכנולוגיה נטולת כתמים, כדי למדוד את אות החלבון הכולל בכל נתיב כבקרת טעינה16,20,13,27,1,4,12. בקרת טעינת החלבון הכוללת מונעת את החסרונות הקשורים לחלבוני משק בית. ראשית, זוהי השתקפות אמיתית של כמות החלבון טעון עבור כל מדגם. שנית, כתם החלבון הכולל מציג טווח דינמי ליניארי מעולה בטווח הטעינה המשותף לניתוח כתם מערבי (10-50 מיקרוגרם חלבון של ליזלת תא מורכבת) ומבדיל במדויק את הפרש הטעינה בין הדגימות12.
טכנולוגיה נטולת כתמים היא שיטת כתמי חלבון כוללת חדשנית שבה תרכובת ייחודית מעורבבת בתמיסת ג'ל אקרילאמיד ומופצת באופן שווה בג'ל יצוק. לאחר השלמת האלקטרופורזה, הג'ל נחשף לאור UV למשך דקה לפחות, כך שתרכובת הכתם מגיבה עם שאריות הטריפטופן בחלבון. החלבונים הופכים נרגשים תחת אור UV כדי לתת אות פלואורסצנטי חזק שניתן לדמיין ולכמת בתמונה מופעלת ללא כתמים כגון מערכת MP ChemiDoc. המתחם ללא כתמים עצמו, לעומת זאת, אינו סופג אור UV, וכתוצאה מכך רקע נמוך של תמונת הג'ל. השינוי של שאריות טריפטופן הוא בלתי הפיך וחלבונים ניתן לדמיין לא רק בג'ל, אלא גם על הכתם בכל עת לאחר העברת חלבון.
הטכנולוגיה נטולת הכתמים מיושמת בזרימת העבודה המערבית V3 (איור 1) כדי לטפל בתלונות העיקריות על זרימת העבודה המסורתית, במיוחד החששות משימוש בחלבוני משק בית כבקרות טעינה. באמצעות זרימת עבודה זו, אפשר: 1) להפעיל ג'ל בערך 20-30 דקות, 2) לבדוק את שלמות הדגימה ואת איכות הפרדת החלבון ב 5 דקות לאחר ריצת ג'ל; 3) להעביר חלבונים ב 3-10 דקות; 4) לבדוק את יעילות ההעברה כמותית; ו -5) והכי חשוב, לאמת שינויים ברמת החלבון של עניין באמצעות בקרת טעינת חלבון הכוללת.
Protocol
1. הכנת דגימת חלבון
(מתואר הליך אופייני להפקת חלבונים מתרבית התאים)
- מניחים את צלחת תרבות התא HeLa בקרח ולשטוף את התאים עם מלח קר כקרח Tris-אגירה (TBS; 20 mM Tris-HCl, pH 7.5, 150 mM NaCl).
- לשאוף את TBS, ולאחר מכן להוסיף 1 מיליליטר לכל 100 מ"מ צלחת קר כקרח מאגר RIPA (50 mM Tris-HCl pH 8.0, 150 מ"מ NaCl, 1% NP-40, 0.5% נתרן deoxycholate, 0.1% SDS) בתוספת מעכבי פוספטאז ופרוטה.
- לגרד תאים חסידים את המנה באמצעות מגרד תא פלסטיק קר; מעבירים בעדינות את השעיית התא לצינור מיקרוצנטריפוגה מקולק מראש.
- לשמור על תסיסה מתמדת במשך 30 דקות ב 4 מעלות צלזיוס על מסובב.
- ספין ב 16,000 x גרם במשך 20 דקות בצנטריפוגה 4 °C (60 °F).
- מוציאים בעדינות את הצינור מהצנטריפוגה ומניחים על הקרח. מעבירים את הסופרנט לצינור טרי שנשמרו על קרח, וזורקים את הכדור.
- הסר נפח קטן (10-20 μl) של lysate לבצע בדיקה חלבון. קבעו את ריכוז החלבון עבור כל דגימה באמצעות ערכת מבחני RC DC.
- במידת הצורך, יש לאסוף את דגימות החלבון לאחסון לטווח ארוך ב-20°C(20°C). מחזורי הקפאה והפשרה חוזרים גורמים להשפלת חלבונים ויש להימנע מהם.
- קח בערך 20 מיקרוגרם של כל מדגם, להוסיף נפח שווה של 2x Laemmli מאגר מדגם (4% SDS, 10% 2-mercaptoethanol, 20% גליצרול, 0.004% כחול ברומופנול, 125 mM Tris-HCl, pH 6.8).
- מחממים כל תא lysate במאגר מדגם ב 95 °C (70 °F) במשך 5 דקות.
- צנטריפוגה ב 16,000 x g במיקרוצנטריפוגה במשך דקה.
2. ג'ל אלקטרופורזה עם ג'לים ללא כתמים (~ 30 דקות)
- קח קריטריון TGX כל ג'ל precast ללא כתמים KD (ג'ל בפורמט midi), להסיר את המסרק ואת הקלטת מתחתית הקלטת.
- הנח את הקלטת בתא הקריטריון ומלא את תא החיץ העליון המשולב במאגר פועל של 60 מ"ל (25 מטר טריס, גליצין 190 מ"מ, 0.1% SDS, pH 8.3). יש לשטוף את הבארות באמצעות חיץ פועל.
- מלא כל מחצית ממיכל החיץ התחתון במאגר פועל של 400 מ"ל לקו המילוי המסומן.
- טען את דגימות החלבון ואת סמני החלבון המתאימים.
- מניחים את המכסה על המיכל, מיישרים את תקעי הבננה המקודדים בצבע עם שקעים מתאימים על המכסה.
- הפעל את הג'ל במשך ~ 30 דקות ב 200 V או 20 דקות ב 300 V.
3. הדמיית ג'ל ללא כתמים באמצעות מערכת MP Chemidoc לבדיקת איכות הפרדת חלבונים (~ 5 דקות)
- הסר את קלטת הג'ל מהתא. השתמש בכלי פתיחת קלטת הג'ל במכסה תא הקריטריון כדי לפצח את הקלטת ולשחרר את הג'ל.
- החל כמה מיליליטרים של מים למרכז מגש מדגם UV של הדמיה MP ChemiDoc. בזהירות להרים את הג'ל מהקלטת ומניחים אותו על המגש.
- הפעל את תוכנת Image Lab ולכוד את תמונת הג'ל נטולת הכתמים (איור 1A) עם ההגדרות הבאות:
יישום: ג'ל ללא כתמים
זמן הפעלת ג'ל: דקה אחת
אזור הדמיה: ג'ל קריטריון
זמן חשיפה לתמונה: ממוטב אוטומטית ללהקות האינטנסיביות ביותר - מוציאים את הג'ל מהמגש לדוגמה וממשיכים מיד לשלב ההעברה.
4. העברת חלבון עם מערכת טורבו טרנס-כתם (~ 10 דקות)
- פתח חבילת העברה טרנס-כתם טורבו מידי PVDF; מניחים את הערימה התחתונה (הכוללת את הממברנה) על בסיס קלטת ההעברה.
- מניחים את הג'ל על גבי הממברנה, מניחים את הערימה העליונה על הג'ל, ומרדים בועות.
- הנח את המכסה על בסיס הקלטת וסובב את החוגה כדי לנעול אותה.
- הכנס את הקלטת לתא הגוש.
- התחל את ההעברה על-ידי בחירת תוכנית טורבו מוגדרת מראש ובחירת גודל ג'ל הקריטריון (midi) ולאחר מכן הקש RUN. ריצה טיפוסית אורכת רק 7 דקות.
- כאשר ההעברה נגמרת, לפרק את כריך סופג ומניחים הן את הכתם ואת הג'ל במיכל עם מים deionized.
5. ג'ל ללא כתמים והדמיית כתמים באמצעות מערכת MP Chemidoc לבדיקת יעילות ואיכות העברת חלבונים (~ 5 דקות)
- מניחים את הג'ל שלאחר ההעברה על מגש הדגימה של הדמיה ChemiDoc MP.
- הפעל את תוכנת Image Lab ולכוד את התמונה נטולת הכתמים של הג'ל שלאחר ההעברה (איור 1B) עם ההגדרות הבאות:
יישום: ג'ל ללא כתמים
זמן הפעלת ג'ל: ללא
אזור הדמיה: ג'ל קריטריון
זמן חשיפה לתמונה: זהה לזמן החשיפה לתמונת הג'ל שלפני ההזעה - הסר את הג'ל מהמגש לדוגמה ולאחר מכן תמונה של הכתם (איור 1C) עם ההגדרות הבאות. שמור על הכתם רטוב עם כמה טיפות מים או TBST בעת הדמיה.
יישום: כתם ללא כתמים
אזור הדמיה: ג'ל קריטריון
זמן חשיפה לתמונה: ממוטב אוטומטית ללהקות האינטנסיביות ביותר - הסר את קרום סופג ממגש המדגם ומניחים אותו במיכל עם TBST (0.1% Tween 20 ב- TBS).
6. דגירת נוגדנים
- חסום על ידי הצבת הכתם בתמיסה של 3% אלבומין סרום שור (BSA) ב TBST בטמפרטורת החדר במשך 1 שעה.
- דגירה הכתם לילה ב 4 מעלות צלזיוס בתמיסה המכילה נוגדן ראשוני העכבר הרים נגד חלבון היעד הראשון נוגדן ראשי ארנב הרים נגד חלבון היעד השני.
- יוצקים את הפתרון המכיל את הנוגדן העיקרי. לאחר מכן, לשטוף את הכתם על ידי נסער ב 20 מ"ל של TBST במשך 5 דקות. חזור על 4x עבור סך של 5 שוטף.
- דגירה במשך שעה בטמפרטורת החדר בתמיסת הנוגדנים המשנית המכילה נוגדן עז נגד עכבר Dylight 650 מצומד ונוגדן עז נגד עכבר Dylight 549 מצומד עז נגד ארנב.
- יוצקים את הפתרון המכיל את הנוגדן העיקרי. לאחר מכן, לשטוף את הכתם על ידי נסער ב 20 מ"ל של TBST במשך 5 דקות. חזור על 4x עבור סך של 5 שוטף.
7. הדמיה וניתוח נתונים על ידי תוכנת מעבדת תמונה- נורמליזציה כוללת של חלבונים (~ 5 דקות)
- השג תמונה פלואורסצנטית מרובת ערכים של הכתם (איור 1E) על-ידי פתיחת פרוטוקול רב-ערוצי חדש, קביעת תצורה של שלושה ערוצי פלואורסצנט והפעלת הפרוטוקול.
ערוץ 1:
יישום: כתמים Dylight 650
אזור הדמיה: ג'ל קריטריון
זמן חשיפה לתמונה: ממוטב אוטומטית ללהקות האינטנסיביות ביותר
ערוץ 2:
יישום: כתם דילייט 549
אזור הדמיה: ג'ל קריטריון
זמן חשיפה לתמונה: ממוטב אוטומטית ללהקות האינטנסיביות ביותר
ערוץ 3:
יישום: כתם ללא כתמים
אזור הדמיה: זמן חשיפה לתמונת ג'ל קריטריון: ממוטב אוטומטית ללהקות האינטנסיביות ביותר - לחץ על סמל נורמליזציה מתיבת כלי הניתוח ולחץ על כן כדי לזהות נתיבים ורצועות.
- בחר והשתמש ב"כלים של נתיבים ולהקות" כדי לבצע התאמות לנתיבים וללהקות במידת הצורך.
- בחרו תמונה נטולת כתמים כערוץ הנורמליזציה.
- בחר כלי ניתוח MW והקצה את הנתיבים הסטנדרטיים של MW על-ידי סימון התיבות שמתחתיהם.
- כדי להציג את אמצעי האחסון המנורמלים, לחץ על טבלת הניתוח בסרגל הכלים. כל החישובים יבוצעו באופן אוטומטי על-ידי התוכנה, כולל פקטור הנורמליזציה ואמצעי אחסון מנורמלים. ערכי עוצמת רצועת החלבון המשמשים כיעד מותאמים כעת לשינויים בעומס החלבון. זה יאפשר השוואות מדויקות של חלבוני היעד בין הדגימות.
תוצאות
1. הערכת שלמות הדגימה, איכות הפרדת החלבון והעברת היעילות עם תמונות ג'ל ללא כתמים.
תמצית חלבון מתאי HeLa הופרדו ב 300 V במשך 20 דקות על קריטריון 18-well AnyKD TGX ג'ל ללא כתמים. דגימות החלבון היו טעון 3x בארבע כמויות שונות (נתיבים 1-3, 40 מיקרוגרם; נתיבים 4-6, 30 מיקרוגרם; נתיבים 7-9, 20 מיקרוגרם; נתיבים 10-12, 10 מיקרוגרם). הג'ל הופעל תחת אור UV במשך דקה. איור 2A מציג את תמונת הג'ל שנרכשה מיד לאחר הפרדת החלבון. תקינות דגימת חלבון(למשל השפלה) ואיכות ההפרדה(למשל משקעים בחלבון) ניתנות להערכה ויזואלית עם תמונת ג'ל זו. חלבונים הועברו לאחר מכן במשך 7 דקות לקרום nitrocellulose באמצעות טרנס-כתם טורבו. איור 2B מציג את התמונה נטולת הכתמים של הג'ל שלאחר ההעברה. שתי התמונות נרכשו באותו זמן חשיפה (6.8 שניות). נתיב 3 ו-12 נבחרו כדי למדוד את יעילות ההעברה. באמצעות כלי עוצמת הקול בתוכנת Image Lab, קופסה מלבנית (כחולה) נמשכה כדי לכסות את נתיב 3 ו -12 בשתי תמונות הג'ל. החישוב המבוסס על ערכי הנפח מתיבות אלה הצביע על כך שהיעילות בהעברה של שני הנתיבים הייתה 80%(איור 2C). בניסוי זה, ג'ל AnyKD TGX נבחר לחקור חלבוני יעד קטנים עד בינוניים והוא לא היה ממוטב להעברת חלבונים גדולים. אופטימיזציה של יעילות ההעברה תחייב שימוש בג'ל באחוזים נמוכים יותר(למשל 4-20%) ו/או התאמה של זמן ההעברה כדי להקל על העברת חלבונים גדולים. 2. בקרת טעינת חלבון כוללת נטולת כתמים היא חלופה אמינה לבקרת טעינת משק בית בכתימה המערבית כדי לכמת שינוי קטן ברמת החלבון המעניין.
MCM-7 הוא גורם שכפול רישוי DNA שרמתו יורדת ב -20-50% בקווי תאים לימפובלסטואידים (LCL) לאחר טיפול הקרנה. בניסוי זה, lysates (30 מיקרוגרם כל אחד) של ארבעה תרביות קו תאים לימפובלסטואידים שטופלו בקרה (LCL) הופרדו על 12-well קריטריון AnyKD TGX ללא כתמים ג'ל. הג'ל הופעל במשך דקה תחת אור UV והועבר על ידי טרנס-בלוט טורבו לקרום PVDF לכשל חיסוני. חלבון משק הבית GAPDH (ירוק) נבדק עם נוגדן ארנב (טכנולוגיית איתות תאים, ארה"ב, 1:2,500) ונוגדן עז נגד ארנב 549 מצומד (רוקלנד, ארה"ב, 1:20,000). החלבון של עניין MCM-7 (אדום) נבדק באמצעות נוגדן עכבר (Abcam, ארה"ב, 1:1,000) ו Dylight 649 מצומד עז נגד עכבר נוגדן (רוקלנד, 1:10,000).
איור 3A מציג תמונה פלואורסצנטית מרובת ערכים של סך כל החלבונים (כחול), MCM-7 (אדום) ו- GAPDH (ירוק) שזוהו בארבע דגימות LCL שטופלו בבקרה ובהקרנה. איור 3B הוא תמונה נטולת כתמים של אותו כתם המציגה את סך תבניות החלבון בכל דגימה (30 מיקרוגרם). תוכנת מעבדת תמונות בחרה את הנתיבים לדוגמה (תיבות כחולות) כדי למדוד MCM-7, GAPDH, ואת נפח החלבון הכולל בכל נתיב. רמות MCM-7 היו מנורמל או נגד מדידת חלבון הכולל ללא כתמים או נגד GAPDH. רמות החלבון המנורמלות של MCM-7 נותחו סטטיסטית ונפח רצועת החלבון הממוצעת MCM-7 וסטיית התקן (n=4) מוצגים בתרשים (איור 3C). שתי שיטות הנורמליזציה חשפו ירידה קטנה (כ-25%) ברמות החלבון MCM-7 לאחר טיפול הקרנה. הנתונים עם נורמליזציית החלבון הכוללת הציגו סטיית תקן קטנה יותר מזו עם GAPDH כבקרת הטעינה.
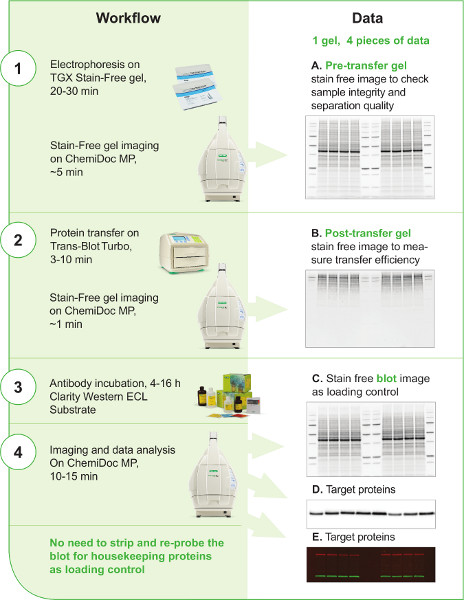
איור 1. זרימת עבודה מערבית V3. זרימת העבודה של V3 מתוארת בעמודה הימנית ב- 4 שלבים. המכשירים העיקריים והריאגנטים המשמשים בזרימת העבודה מוצגים בכל שלב. הזמן המשוער עבור כל שלב כלול גם הוא. העמודה השמאלית מראה שניתן להפיק לפחות 4 תמונות בזרימת העבודה של V3. השימוש בכל פיסת נתונים מתואר. התמונות ללא כתמים של ג'ל pretransfer, ג'ל לאחר ההעברה, ואת הכתם (A, B, C) לא ניתן ליצור בקלות עם טכניקות סופג המערבי המסורתי; תמונות ונתונים אלה מספקים מידע חשוב ומחסומים לאורך ההליך כדי לשפר את השליטה של המדען ואת הרבייה של זרימת העבודה כתם המערבי. אותות חלבון היעד ניתן ללכוד או על תמונה כתם chemiluminescent (D) אם נוגדן משני HRP מצומד הוחל בזיהוי או על תמונה כתם פלואורסצנטי (E) אם כתמים פלואורסצנטיים פלואורסצנטיים מרובים בוצעו כדי לזהות יותר מחלבון יעד אחד בו זמנית על אותו כתם.
לחץ כאן כדי להציג תמונה גדולה יותר.

איור 2. תמונות ללא כתמים של ג'לים לפני טרנזיור ולאחר העברה בזרימת העבודה המערבית V3 כדי להעריך את שלמות הדגימה, איכות ההפרדה ויעילות ההעברה. (A)תמונה נטולת כתמים של ג'ל טרום טרנזינר. (B)תמונה נטולת כתמים לאחר ההעברה. (C)מדידת יעילות העברת חלבונים.
לחץ כאן כדי להציג תמונה גדולה יותר.
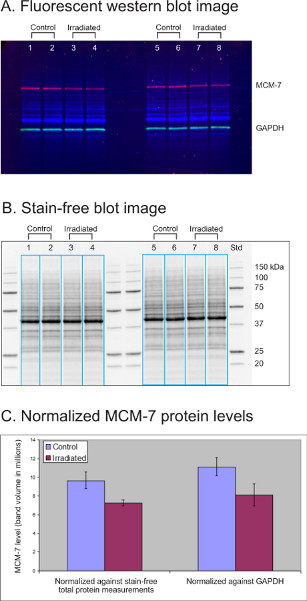
איור 3. השוואת מדידת חלבון כוללת נטולת כתמים ל- GAPDH כשליטת טעינה כדי לנרמל את רמת החלבון המעניין. (A) תמונת כתם מערבי פלואורסצנטי. (B)תמונה כתם ללא כתמים. (C)רמות חלבון מנורמלות MCM-7.
לחץ כאן כדי להציג תמונה גדולה יותר.
Discussion
פרוטוקול V3 ללא כתמים המתואר לעיל הוא עבור כתמים מערביים פלואורסצנטיים מולטיפלקסים. זה יכול להיות מיושם גם סופג המערבי באמצעות זיהוי chemiluminescent. בפרוטוקול הכתם המערבי הפלואורסצנטי מולטיפלקס, התמונות כתם ללא כתמים נרכשים בשתי נקודות זמן: 1) מיד לאחר העברת חלבון; 2) בשלב הדמיה פלואורסצנטית מולטיפלקס לאחר דגירה נוגדן. התמונה הראשונה ללא כתמים משמשת לחישוב יעילות ההעברה והתמונה השנייה נטולת הכתמים משמשת כבקרת הטעינה. כאשר השיטה chemiluminescent מוחל, לא ניתן לקחת תמונה מולטיפלקס עבור אותות חלבון ללא כתמים ויעד, כי האות chemiluminescent יופיע בערוץ ללא כתמים מדי. במקרה זה, אנו ממליצים להשתמש בתמונה נטולת כתמים שצולמה מיד לאחר שלב העברת החלבון לניתוח בקרת טעינה ונורמליזציה.
זרימת העבודה המערבית V3 מספקת את היתרונות הייחודיים הבאים בהשוואה לזרימת העבודה המסורתית של כתמים מערביים המשתמשת בחלבוני משק בית כפקדי טעינה:
ראשית, זרימת העבודה של V3 מספקת בקרת טעינה מעשית, נוחה ואמינה יותר כדי לאמת את השינויים ברמת החלבון המעניין. פרוטוקול V3 משתמש בבקרת טעינת חלבונים כוללת כדי לנרמל את רמת החלבון המעניין הנמדדת בכל דגימה. היא מונעת שתי מלכודות של שימוש בחלבוני משק הבית כבקרות טעינה: כשל חיסוני רווי ורמות ביטוי חלבון משק בית לא עקביות בין הדגימות בתנאים ניסיוניים מסוימים. צעדי הפשטה ותדלוק עם נוגדנים המכוונים נגד משק בית אינם נחוצים עוד. באמצעות טכנולוגיה נטולת כתמים, אין צורך להכתים ולהכתים כתם עם כתמים כגון קומאסי או Sypro Ruby למדידת חלבון כוללת. זה לוקח רק כמה שניות כדי לרכוש תמונה כתם על 5 דקות לעשות נורמליזציה חלבון הכולל באמצעות תוכנת Image Lab.
שנית, זרימת העבודה V3 מאפשרת למדענים לקחת שליטה טובה יותר על ההליך המערבי כי זה עושה את ההליך שקוף יותר ומציג מספר מחסומים לבקרת איכות. בעזרת טכנולוגיה נטולת כתמים, החוקרים יכולים לדמיין את דגימות החלבון שלהם הן על הג'ל והן על הכתם. מדענים יכולים להעריך את שלמות דגימת החלבון (מושפלת או לא), איכות ההפרדה (מזורזת או לא), יעילות העברה ואיכות העברה (אפילו העברה או לא). נקודות ביקורת אלה מסייעות למחקרים לסיים את הניסוי כאשר רואים פגמים גדולים בתהליך ולהימנע מבזבוז זמן על דגימות וכתמים ירודים. טכנולוגיה זו גם מסייעת למדענים להעריך אם יש כמות משמעותית של אובדן חלבון לאחר הפשטת קרום והאם הכתם מתאים לתוכחת מטרה אחרת 4.
להלן כמה עצות להבטחת ניסיון טוב ונתונים איכותיים באמצעות זרימת עבודה מערבית של V3.
- תמונה ג'ל מיד לאחר ריצת ג'ל. אין להשרות את הג'ל בכל חיץ לפני ההדמיה הראשונה בהליך מכיוון שהוא עלול לשטוף את תרכובת הכתם.
- השתמש באותו אזור דימות כדי להשיג את כל התמונות בפרוטוקול. זה יאפשר לתוכנה לכסות תמונות לניתוח נתונים כגון נורמליזציה מוחלטת של חלבונים.
- שמור על זמן החשיפה עקבי בעת הדמיה של ג'לים לפני טרנזיור ולאחר העברה. פעולה זו תאפשר לתוכנה למדוד כמותית את יעילות ההעברה.
- שמור על הממברנה רטובה עם כמה טיפות מים או TBST בעת רכישת התמונה כתם. זה ימנע בעיות רקע מלוכלכות אפשריות לגילוי חלבון היעד.
- השתמש קרום PVDF פלואורסצנטי נמוך עבור כתמים פלואורסצנטיים פלואורסצנטיים מרובים.
חשוב לציין כי מולקולה ללא כתמים לאחר הפעלת UV קשורה באופן בלתי הפיך לשאריות טריפטופן. שינוי בלתי הפיך זה עלול להשפיע על זיהוי אנטיגן בעת שימוש בנוגדנים חד שבטיים אם האפיטופ מכיל טריפטופן. נוגדנים פוליקלונליים לא צפויים להיות מושפעים כי הם מזהים אפיטופים מרובים על האנטיגן. מולקולות נטולות כתמים לא מאוגדות נשטפות בקלות מהג'ל והממברנה ולכן לא יפריעו לאינטראקציות נוגדנים-אנטיגן.
לסיכום, זרימת העבודה המערבית V3 הופכת את תהליך הכתם המערבי למהיר יותר, שקוף יותר, כמותי ואמין יותר. חוקרים יכולים כעת ליישם בקלות בקרת טעינת חלבון מוחלטת בניסוי כתם מערבי כדי להפוך את הנתונים שלהם למהימנים יותר. זרימת העבודה ללא כתמים V3 אומצה על ידי מספר מעבדות, ופרסומיהם הוכיחו כי כתבי עת מקבלים נתונים ללא כתמים כבקרת טעינה בכתם המערבי22,17,7,8,5,23,18,15.
Disclosures
המחברים, אנטון פוש, ג'ונתן קון, קנת הו, מאט האמונד ונינג ליו הם עובדים של מעבדות ביו-ראד בע"מ.
Acknowledgements
המחברים מודים לד"ר וולף-דיטר סטאלס, ד"ר ארנו רמי, ד"ר אנטון פוש, ד"ר פטרישיה פיאטי, טום דייויס, קריס סימוני וג'ף דרבן על הביקורת והעריכה של כתב היד. המחברים מודים גם לאליסון שוורץ על התמיכה הטכנית.
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| 4-20% Criterion TGX Stain-Free Precast Gel | Bio-Rad | 567-8093 | Choose a gel size and percentage that meet the specific need in a experiment |
| Trans-Blot Turbo Midi PVDF Transfer Packs | Bio-Rad | 170-4157 | Choose either PVDF or nitrocellulose and match the membrane size to the gel size |
| Clarity Western ECL Substrate, 500 ml | Bio-Rad | 170-5061 | |
| EQUIPMENT | |||
| Criterion Cell | Bio-Rad | 165-6100 | |
| Trans-Blot Turbo Transfer Starter System | Bio-Rad | 170-4155 | |
| ChemiDoc MP System | Bio-Rad | 170-8280 | |
References
- Aldridge, G. M., Podrebarac, D. M., Greenough, W. T., Weiler, I. J. The use of total protein stains as loading controls: an alternative to high-abundance single-protein controls in semi-quantitative immunoblotting. J. Neurosci. Methods. 172 (2), 250-254 (2008).
- Bauer, D. E., Haroutunian, V., McCullumsmith, R. E., Meador-Woodruff, J. H. Expression of four housekeeping proteins in elderly patients with schizophrenia. J. Neural. Transm. 116 (4), 487-491 (2009).
- Castaño, Z., Kypta, R. M. Housekeeping Proteins: Limitations as References During Neuronal Differentiation. Open Neurosci. J. 2, 36-40 (2008).
- Colella, A. D., Chegenii, N., Tea, M. N., Gibbins, I. L., Williams, K. A., Chataway, T. K. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal. Biochem. 430 (2), 108-110 (2012).
- Cully, T. R., Edwards, J. N., Friedrich, O., Stephenson, D. G., Murphy, R. M., Launikonis, B. S. Changes in plasma membrane Ca-ATPase and stromal interacting molecule 1 expression levels for Ca2+ signaling in dystrophic mdx mouse muscle. Am. J. Physiol. Cell Physiol. 303 (5), (2012).
- Dittmer, A., Dittmer, J. Beta-actin is not a reliable loading control in Western blot analysis. Electrophoresis. 27 (14), 2844-2845 (2006).
- Dutka, T. L., Lamboley, C. R., McKenna, M. J., Murphy, R. M., Lamb, G. D. Effects of carnosine on contractile apparatus Ca2+ sensitivity and sarcoplasmic reticulum Ca2+ release in human skeletal muscle fibers. J. Appl. Physiol. 112 (5), 728-736 (2012).
- Elliott, S., Busse, L., Swift, S., McCaffery, I., Rossi, J., Kassner, P., Begley, C. G. Lack of expression and function of erythropoietin receptors in the kidney. Nephrol. Dial. Transplant. 27 (7), 2733-2745 (2012).
- Eslami, A., Lujan, J., Western, Blotting: Sample Preparation to Detection. J. Vis. Exp. (44), (2010).
- Ferguson, R. E., Carroll, H. P., Harris, A., Maher, E. R., Selby, P. J., Banks, R. E. Housekeeping proteins: a preliminary study illustrating some limitations as useful references in protein expression studies. Proteomics. 5 (2), 566-571 (2005).
- Greer, S., Honeywell, R., Geletu, M., Arulanandam, R., Raptis, L. Housekeeping genes; expression levels may change with density of cultured cells. J. Immunol. Methods. 355 (1-2), 76-79 (2010).
- Gürtler, A., Kunz, A., Gomolka, M., Hornhardt, S., Friedl, A. A., McDonald, K., Kohn, J. E., Posch, A. Stain-Free Technology as Normalization Tool in Western Blot Analysis. Anal. Biochem. 433 (2), 105-111 (2013).
- Hagiwara, M., Kobayashi, K., Tadokoro, T., Yamamoto, Y. Application of SYPRO Ruby- and Flamingo-stained polyacrylamide gels to Western blot analysis. Anal. Biochem. 397 (2), 262-264 (2010).
- Heidebrecht, F., Heidebrecht, A., Schulz, I., Behrens, S. E., Bader, A. Improved semiquantitative Western blot technique with increased quantification range. J. Immunol. Methods. 345 (1-2), 40-48 (2009).
- Jensen, R. B., Ozes, A., Kim, T., Estep, A. Kowalczykowski SC BRCA2 is epistatic to the RAD51 paralogs in response to DNA damage. DNA Repair. , (2013).
- Lanoix, D., St-Pierre, J., Lacasse, A. A., Viau, M., Lafond, J., Vaillancourt, C. Stability of reference proteins in human placenta: general protein stains are the benchmark. Placenta. 33 (3), 151-156 (2012).
- Larkins, N. T., Murphy, R. M., Lamb, G. D. Influences of temperature, oxidative stress, and phosphorylation on binding of heat shock proteins in skeletal muscle fibers. Am. J. Physiol. Cell Physiol. 3 (6), (2012).
- Laurie, K. J., Dave, A., Straga, T., Souzeau, E., Chataway, T., Sykes, M. J., Casey, T., Teo, T., Pater, J., Craig, J. E., Sharma, S., Burdon, K. P. Identification of a Novel Oligomerization Disrupting Mutation in CRYΑA Associated with Congenital Cataract in a South Australian. , (2012).
- Li, X., Bai, H., Wang, X., Li, L., Cao, Y., Wei, J., Liu, Y., Liu, L., Gong, X., Wu, L., Liu, S., Liu, G. Identification and validation of rice reference proteins for western blotting. J. Exp. Bot. 62 (14), 4763-4772 (2011).
- Liu, N. K., Xu, X. M. Beta-tubulin is a more suitable internal control than beta-actin in western blot analysis of spinal cord tissues after traumatic injury. J. Neurotrauma. 23 (12), 1794-1801 (2006).
- Lowe, D. A., Degens, H., Chen, K. D., Alway, S. E. Glyceraldehyde-3-phosphate dehydrogenase varies with age in glycolytic muscles of rats. J. Gerontol. A Biol. Sci. Med. Sci. 55 (3), 160-164 (2000).
- Mollica, J. P., Dutka, T. L., Merry, T. L., Lamboley, C. R., McConell, G. K., McKenna, M. J., Murphy, R. M., Lamb, G. D. S-glutathionylation of troponin I (fast) increases contractile apparatus Ca2+ sensitivity in fast-twitch muscle fibres of rats and humans. J. Physiol. 590, 1443-1463 (2012).
- Murphy, R. M., Dutka, T. L., Horvath, D., Bell, J. R., Delbridge, L. M., Lamb, G. D. Ca2+-dependent Proteolysis of Junctophilin 1 and Junctophilin 2 in Skeletal and Cardiac. 591, 719-729 (2012).
- Neill, U. S. All Data are not created Equal. J. Clin. Invest. 119, 224 (2009).
- Pérez-Pérez, R., López, J. A., García-Santos, E., Camafeita, E., Gómez-Serrano, M., Ortega-Delgado, F. J., Ricart, W., Fernández-Real, J. M., Peral, B. Uncovering suitable reference proteins for expression studies in human adipose tissue with relevance to obesity. PLoS One. 7 (1), (2012).
- Rocha-Martins, M., Njaine, B., Silveira, M. S. Avoiding Pitfalls of Internal Controls: Validation of Reference Genes for Analysis by qRT-PCR and Western Blot throughout Rat Retinal Development. PLoS One. 7 (8), (2012).
- Romero-Calvo, I., Ocón, B., Martínez-Moya, P., Suárez, M. D., Zarzuelo, A., Martínez-Augustin, O., de Medina, F. S. Reversible Ponceau staining as a loading control alternative to actin in Western blots. Anal. Biochem. 401 (2), 318-320 (2010).
- Said, H. M., Polat, B., Hagemann, C., Anacker, J., Flentje, M., Vordermark, D. Absence of GAPDH regulation in tumor-cells of different origin under hypoxic conditions in-vitro. BMC Res. Notes. 13 (2), 8 (2009).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative western blots. Exp. Anim. 60 (2), 193-196 (2011).
- Welinder, C., Ekblad, L. Coomassie staining as loading control in Western blot analysis. J. Proteome Res. 10 (3), 1416-1419 (2011).
- You, J., Hodge, C., Wen, L., McAvoy, J. W., Madigan, M. C., Sutton, G. Using soybean trypsin inhibitor as an external loading control for Western blot analysis of tear proteins: application to corneal disease. Exp. Eye Res. 99, 55-62 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved