Method Article
Batı Blotting'de Pratik, Kullanışlı ve Güvenilir Toplam Protein Yükleme Kontrolü için V3 Lekesiz İş Akışı
Bu Makalede
Özet
V3 iş akışı lekesiz jeller kullanan batı lekeli bir prosedürdür. Lekesiz teknoloji, araştırmacıların protein ayırma kalitesini görselleştirmelerine, transfer verimliliğini doğrulamalarına ve en önemlisi güvenilir bir yükleme kontrolü olarak toplam protein nicelemesini kullanarak ilgi proteinindeki değişimi doğrulamalarına olanak tanır.
Özet
Batı lekesi çok kullanışlı ve yaygın olarak benimsenen bir laboratuvar tekniğidir, ancak yürütülmesi zordur. Bir deneyci birkaç adımın sonuncusuna kadar başarıyla gerçekleştirilip gerçekleştirilmediğini bilmediğinden, iş akışı genellikle "kara kutu" olarak karakterize edilir. Ayrıca, batı blot verilerinin kalitesi, batı blotting süreci boyunca etkili kalite kontrol araçlarının eksikliği nedeniyle bazen zorlanmaktadır. Burada, geleneksel batı blot protokolüyle ilgili önemli endişeleri gidermek için lekesiz teknoloji uygulayan V3 batı iş akışını açıklıyoruz. Bu iş akışı araştırmacılara izin verir: 1) bir jeli yaklaşık 20-30 dakika içinde çalıştırmak; 2) jel çalışmasından sonra 5 dakika içinde numune ayırma kalitesini görselleştirmek; 3) proteinleri 3-10 dakika içinde aktarmak; 4) aktarım verimliliğini nicel olarak doğrulamak; ve en önemlisi 5) toplam protein yükleme kontrolünü kullanarak ilgi proteini seviyesindeki değişiklikleri doğrulamak. Bu yeni yaklaşım, β-actin, β-tübulin, GAPDH gibi temizlik proteinleri için lekenin soyulması ve yeniden işlenmesi ihtiyacını ortadan kaldırır.
Giriş
Batı blot çok yararlı bir tekniktir9, ancak, batı şişkinliği ile ilgili iki büyük zorluk vardır: uzun ve emek yoğun süreç ve veri kalitesi. Geleneksel bir protokol yaklaşık 2 gün gerektirir. Numune hazırlama, jel dökümü, protein elektroforezi ve transferi, membran bloke etme ve ardından antikor inkübasyonu, görüntüleme ve oldukça sık sıyırma, yeniden işleme ve son olarak veri analizi gibi birçok adımı içerir. Bu süreç boyunca, proses kontrolü için güvenilir ve esnek araçlar yoktur. Bu nedenle, her adımda hatalar ortaya çıkabilir ve bu hatalar veri yapıtları oluşturma potansiyeline sahiptir; bu nedenle, batı blotting'de yükleme kontrolleri hataları tanımlamak ve düzeltmek için gereklidir. Yükleme kontrolü genellikle her numunedeki bir referans proteinin protein seviyesini kontrol ederek eşit olarak sunulup sunulmamasını kontrol ederek yapılır. İnsanlar genellikle yükleme kontrolü olarak β-actin, β-tubulin, GAPDH gibi temizlik proteinlerini kullanırlar.
Batı blot verilerinin kalitesi güvenilir yükleme kontrolüne bağlıdır. Ancak, kontrolleri yüklemek için temizlik proteinlerini kullanırken iki meşru endişe vardır: 1) temizlik protein bantlarının antikor bazlı immünodeteksiyonları genellikle doymuş ve bu nedenle numuneler arasındaki yükleme farklılıklarını ayırt edemez30; 2) temizlik proteini ifade düzeyi belirli deneysel koşullar altında örneklerde değişebilir, örneğin, siRNA tedavisi, hücre ölümü, hücre farklılaşması, vb. Bu kaygılar nedeniyle, bilimsel dergiler artık "nicel karşılaştırmalar için, doğrusal sinyal aralıklarına sahip uygun reaktifler, kontroller ve görüntüleme yöntemlerinin kullanılmasını" gerektirmektedir (Doğa kılavuzu). Benzer şekilde, Klinik Araştırma Dergisi editörleri daha güvenilir yükleme kontrolleri istiyor24. Bu nedenlerden dolayı, yükleme kontrolü olarak kullanılabilmesi için bir temizlik proteini doğrulanması gerekir. İlk olarak, immünodeteksiyon yönteminin doğrusal dinamik aralığında ölçüldüğünden emin olmak gerekir14,29. İkincisi, tüm örneklerde tutarlı bir şekilde ifade edildiğinden emin olmak gerekir26,31,25,19,20.
Güvenilir bir yükleme kontrolüne alternatif bir çözüm, blottan toplam protein ölçümü kullanmaktır. Bazı araştırmacılar, her şeritteki toplam protein sinyalini yükleme kontrolü olarak ölçmek için Coomassie, Flamingo Pink, Sypro Ruby, Amido Black, Ponceau S ve lekesiz teknoloji gibi toplam protein lekeleri ile lekeleri16,20,13,27,1,4,12. Toplam protein yükleme kontrolü, temizlik proteinleri ile ilişkili tuzakları önler. İlk olarak, her örnek için yüklenen protein miktarının gerçek bir yansımasıdır. İkincisi, toplam protein lekesi batı blot analizi için ortak yükleme aralığında mükemmel doğrusal dinamik aralık sergiler (karmaşık bir hücre lisatının 10-50 μg proteini) ve numuneler arasındaki yükleme farkını doğru bir şekilde ayırt eder12.
Lekesiz teknoloji, benzersiz bir bileşiğin akrilamid jel çözeltisinde karıştırıldığı ve atılan jelde eşit olarak dağıtıldığı yeni bir toplam protein boyama yöntemidir. Elektroforezi tamamlandıktan sonra jel en az 1 dakika UV ışığına maruz kalır, böylece leke bileşiği proteindeki triptofan kalıntıları ile reaksiyona sokulur. Proteinler, ChemiDoc MP sistemi gibi lekesiz etkin bir görüntüleyicide görselleştirilebilen ve ölçülebilen güçlü bir floresan sinyali vermek için UV ışığı altında heyecan verici hale gelir. Lekesiz bileşiğin kendisi, UV ışığını emmez, bu da jel görüntünün düşük arka planına neden olur. Triptofan kalıntılarının modifikasyonu geri döndürülemez ve proteinler sadece jelde değil, aynı zamanda protein transferden sonra herhangi bir zamanda leke üzerinde de görselleştirilebilir.
Lekesiz teknoloji, geleneksel iş akışıyla ilgili önemli şikayetleri, özellikle temizlik proteinlerini yükleme kontrolleri olarak kullanma endişelerini gidermek için V3 Western workflow'da(Şekil 1)uygulanmaktadır. Bu iş akışını kullanarak, biri olabilir: 1) yaklaşık 20-30 dakika içinde bir jel çalıştırmak, 2) jel çalışmasından sonra 5 dakika içinde numune bütünlüğünü ve protein ayırma kalitesini kontrol edin; 3) proteinleri 3-10 dakika içinde aktarın; 4) transfer verimliliğini nicel olarak kontrol edin; ve 5) en önemlisi, toplam protein yükleme kontrolünü kullanarak ilgi proteini seviyesindeki değişiklikleri doğrulayın.
Protokol
1. Protein Numune Hazırlığı
(Hücre kültüründen protein çıkarmak için tipik bir prosedür açıklanmıştır)
- HeLa hücre kültürü çanağını buza yerleştirin ve hücreleri buz gibi Tris tamponlu Salin (TBS; 20 mM Tris-HCl, pH 7.5, 150 mM NaCl) ile yıkayın.
- TBS'yi aspire edin, daha sonra fosfataz ve proteaz inhibitörleri ile desteklenmiş 100 mm bulaşık buz gibi RIPA tamponu (50 mM Tris-HCl pH 8.0, 150 mM NaCl, % 1 NP-40, % 0.5 sodyum deoksikollat, % 0.1 SDS) ekleyin.
- Soğuk bir plastik hücre kazıyıcı kullanarak yapışan hücreleri tabaktan kazıyın; hücre süspansiyonu önceden soğmuş bir mikrosantrifüj tüpüne hafifçe aktarın.
- Bir rotatörde 4 °C'de 30 dakika boyunca sabit ajitasyon sağlayın.
- 4 °C önceden ısıtılmış santrifüjde 20 dakika boyunca 16.000 x g'da döndürün.
- Tüpü santrifüjden yavaşça çıkarın ve buza yerleştirin. Süpernatant'ı buzda tutulan taze bir tüpe aktarın ve peletiği atın.
- Bir protein tahlili yapmak için küçük bir hacim (10-20 μl) lysate çıkarın. RC DC test kitini kullanarak her numune için protein konsantrasyonu belirleyin.
- Gerekirse, -20 °C'de uzun süreli depolama için protein örneklerini aliquot. Tekrar dondurma ve çözülme döngüleri protein bozulmasına neden olur ve kaçınılmalıdır.
- Her numuneden yaklaşık 20 μg alın, eşit hacimde 2x Laemmli Örnek Tamponu ekleyin (%4 SDS, %10 2-mercaptoethanol, %20 gliserol, %0,004 bromofenol mavisi, 125 mM Tris-HCl, pH 6,8).
- Her hücre lisat'ı 5 dakika boyunca 95 °C'de numune tamponunda ısıtın.
- 1 dakika boyunca bir mikrosantrifüjde 16.000 x g'da santrifüj.
2. Lekesiz Jeller ile Jel Elektroforezi (~ 30 dk)
- Bir Kriter TGX Herhangi bir KD lekesiz prekast jel (bir midi format jel) alın, tarağı ve bandı kasetin altından çıkarın.
- Kaseti Kriter hücresine yerleştirin ve entegre üst tampon odasını 60 ml çalışan tamponla doldurun (25 mM Tris, 190 mM glisine, %0,1 SDS, pH 8,3). Kuyuları çalışan tamponla durulayın.
- Alt tampon tankının her yarısını işaretli doldurma çizgisine 400 ml çalışan tamponla doldurun.
- Protein örneklerini ve uygun protein belirteçlerini yükleyin.
- Kapağı tankın üzerine yerleştirin, renk kodlu muz fişlerini kapaktaki ilgili krikolarla hizalayın.
- Jeli 200 V'ta ~30 dakika veya 300 V'ta 20 dakika çalıştırın.
3. Protein Ayırma Kalitesini Kontrol Etmek için Chemidoc MP Sistemini Kullanarak Lekesiz Jel Görüntüleme (~5 dk)
- Jel kaseti hücreden çıkarın. Kaseti açmak ve jeli serbest bırakmak için Kriter Hücresi kapağındaki jel kaset açma aracını kullanın.
- ChemiDoc MP görüntüleyicinin UV numune tepsisinin ortasına birkaç mililitre su uygulayın. Jeli kasetten dikkatlice kaldırın ve tepsiye yerleştirin.
- Image Lab yazılımını başlatın ve lekesiz jel görüntüsünü (Şekil 1A) aşağıdaki ayarlarla yakalayın:
Uygulama: lekesiz jel
Jel aktivasyon süresi: 1 dk
Görüntüleme alanı: kriter jel
Görüntü pozlama süresi: en yoğun bantlar için otomatik olarak optimize edilmiştir - Jeli numune tepsisinden çıkarın ve adımı aktarmak için hemen devam edin.
4. Trans-Blot Turbo Sistemi ile Protein Transferi (~10 dk)
- Trans-Blot Turbo Midi PVDF Transfer Paketi açın; alt yığını (zarı içerir) transfer kasetinin tabanına yerleştirin.
- Jeli zarın üzerine yerleştirin, üst yığını jelin üzerine yerleştirin ve kabarcıkları yuvarlayın.
- Kapağı kaset tabanına yerleştirin ve kilitlemek için kadranı çevirin.
- Kaseti leke bölmesine yerleştirin.
- Önceden ayarlanmış bir Turbo programı seçip Ölçüt jel boyutunu (midi) seçerek aktarımı başlatın ve run tuşuna basın. Tipik bir çalışma sadece 7 dakika sürer.
- Aktarım bittiğinde, şişkin sandviçi sökün ve hem lekeyi hem de jeli deiyonize su içeren bir kaba yerleştirin.
5. Protein Transfer Verimliliğini ve Kalitesini Kontrol Etmek için Chemidoc MP Sistemini Kullanarak Lekesiz Jel ve Blot Görüntüleme (~5 dk)
- Transfer sonrası jeli ChemiDoc MP görüntüleyiç numune tepsisine yerleştirin.
- Image Lab yazılımını başlatın ve transfer sonrası jelin lekesiz görüntüsünü (Şekil 1B) aşağıdaki ayarlarla yakalayın:
Uygulama: lekesiz jel
Jel etkinleştirme süresi: yok
Görüntüleme alanı: kriter jel
Görüntü pozlama süresi: ön nakil jeli görüntüsü için pozlama süresiyle aynı - Jeli örnek tepsiden çıkarın ve sonra lekeyi (Şekil 1C) aşağıdaki ayarlarla görüntüleyin. Görüntüleme yaparken lekeyi birkaç damla su veya TBST ile ıslak tutun.
Uygulama: lekesiz leke
Görüntüleme alanı: kriter jel
Görüntü pozlama süresi: en yoğun bantlar için otomatik olarak optimize edilmiştir - Şişkin zarı numune tepsisinden çıkarın ve TBST'li bir kaba yerleştirin (TBS'de% 0,1 Ara 20).
6. Antikor İnkübasyonu
- Blot'u 1 saat boyunca oda sıcaklığında TBST'de% 3 sığır serum albümini (BSA) çözeltisine yerleştirerek engelleyin.
- Blot'u 4 °C'de bir gecede, ilk hedef proteine karşı yetiştirilen fare birincil antikoru ve ikinci hedef proteine karşı yetiştirilen tavşan primer antikorunu içeren çözeltide kuluçkaya yatırın.
- Birincil antikoru içeren çözeltiyi dökün. Daha sonra, 5 dakika boyunca 20 ml TBST'de ajite ederek lekeyi yıkayın. Toplam 5 yıkama için 4x tekrarlayın.
- Dylight 650 konjuge Keçi-anti-fare antikor ve Dylight 549 konjuge Keçi-anti-tavşan antikor içeren ikincil antikor çözeltisinde oda sıcaklığında 1 saat kuluçkaya yatırın.
- Birincil antikoru içeren çözeltiyi dökün. Daha sonra, 5 dakika boyunca 20 ml TBST'de ajite ederek lekeyi yıkayın. Toplam 5 yıkama için 4x tekrarlayın.
7. Image Lab Yazılımı ile Görüntüleme ve Veri Analizi- Toplam Protein Normalleştirme (~5 dk)
- Yeni bir çok kanallı protokol açarak blot ' un çoklayıcı floresan görüntüsünü alın (Şekil 1E), üç floresan kanal yapılandırın ve protokolü çalıştırın.
Kanal 1:
Uygulama: blot Dylight 650
Görüntüleme alanı: kriter jel
Görüntü pozlama süresi: en yoğun bantlar için otomatik olarak optimize edilmiştir
Kanal 2:
Uygulama: blot Dylight 549
Görüntüleme alanı: kriter jel
Görüntü pozlama süresi: en yoğun bantlar için otomatik olarak optimize edilmiştir
Kanal 3:
Uygulama: lekesiz leke
Görüntüleme alanı: kriter jeli Görüntü pozlama süresi: en yoğun bantlar için otomatik olarak optimize edilmiştir - Çözümleme Aracı Kutusu'ndan Normalleştirme simgesini tıklatın ve şeritleri ve bantları algılamak için Evet'i tıklatın.
- Gerekirse şeritlerde ve bantlarda ayarlamalar yapmak için "Şeritler ve Bantlar araçlarını" seçin ve kullanın.
- Normalleştirme kanalı olarak lekesiz görüntüyü seçin.
- MW Analiz Araçları'nı seçin ve aşağıdaki kutuları işaretleyerek MW standart şeritlerini atayın.
- Normalleştirilmiş birimleri görüntülemek için araç çubuğundaki Çözümleme Tablosu'nu tıklatın. Tüm hesaplamalar, Normalleştirme Faktörü ve Normalleştirilmiş Birimler de dahil olmak üzere yazılım tarafından otomatik olarak gerçekleştirilecektir. Hedef protein bandı yoğunluk değerleri artık protein yükündeki değişim için ayarlanır. Bu, numuneler arasında hedef proteinlerin doğru karşılaştırılmasını sağlayacaktır.
Sonuçlar
1. Lekesiz jel görüntüleri ile numune bütünlüğünün, protein ayırma kalitesinin ve transfer verimliliğinin değerlendirilmesi.
HeLa hücrelerinden protein özü 300 V'ta 18 kuyulu Kriter AnyKD TGX lekesiz jel üzerinde 20 dakika boyunca ayrıldı. Protein örnekleri dört farklı miktarda 3x yüklendi (Şeritler 1-3, 40 μg; Şeritler 4-6, 30 μg; Şeritler 7-9, 20 μg; Şeritler 10-12, 10 μg). Jel UV ışığı altında 1 dakika aktive edildi. Şekil 2A protein ayrımından hemen sonra elde edilen jel görüntüsünü göstermektedir. Protein numune bütünlüğü(örneğin bozulma) ve ayırma kalitesi(örneğin protein çökeltme) bu jel görüntüsü ile görsel olarak değerlendirilebilir. Proteinler daha sonra Trans-Blot Turbo kullanılarak nitroselüloz membrana 7 dakika aktarıldı. Şekil 2B, transfer sonrası jelin lekesiz görüntüsünü göstermektedir. Her iki görüntü de aynı pozlama süresiyle (6,8 sn) elde edildi. Transfer verimliliğini ölçmek için 3. Image Lab yazılımındaki ses seviyesi aracı kullanılarak, her iki jel görüntüde de 3. Bu kutulardan elde edilen hacim değerlerine dayalı hesaplama, her iki şeridin aktarım verimliliğinin% 80 olduğunu gösterdi (Şekil 2C). Bu deneyde, AnyKD TGX jeli küçük ve orta ölçekli hedef proteinleri incelemek için seçildi ve büyük proteinlerin transferi için optimize edildi. Transfer verimliliğinin optimize edilmesi, daha düşük yüzdeli jel kullanımını gerektirir(örneğin% 4-20) ve/veya büyük proteinlerin transferini kolaylaştırmak için transfer süresinin ayarlanmasından. 2. Lekesiz toplam protein yükleme kontrolü, ilgi proteini seviyesindeki küçük bir değişikliği ölçmek için batı şişkinliğinde temizlik yükleme kontrolüne güvenilir bir alternatiftir.
MCM-7, ışınlama tedavisinden sonra Lenfoblastoid hücre hatlarında (LCL) seviyesi %20-50 oranında azalan bir DNA lisanslama replikasyon faktörüdür. Bu deneyde, dört kontrol ve ışınlama ile tedavi edilen Lenfoblastoid hücre hattı (LCL) kültürlerinin lysates (her biri 30 μg) 12 kuyulu Kriter AnyKD TGX lekesiz jel üzerinde ayrılmıştır. Jel UV ışığı altında 1 dakika aktive edildi ve Trans-Blot Turbo tarafından immünblotting için bir PVDF membranına aktarıldı. Temizlik proteini GAPDH (yeşil), bir tavşan antikoru (Cell Signaling Technology, ABD, 1:2,500) ve bir Dylight 549 konjuge Goat-anti-rabbit antikoru (Rockland, ABD, 1:20,000) ile araştırıldı. İlgi çekici MCM-7 (kırmızı) proteini bir fare antikor (Abcam, ABD, 1:1.000) ve bir Dylight 649 konjuge Keçi-anti-fare antikor (Rockland, 1:10.000) kullanılarak araştırıldı.
Şekil 3A, dört kontrol ve ışınlama tedavisi gören LCL örneklerinde tespit edilen toplam proteinlerin (mavi), MCM-7 (kırmızı) ve GAPDH'nin (yeşil) çok katlı floresan görüntüsünü göstermektedir. Şekil 3B, her numunedeki toplam protein desenlerini (30 μg) gösteren aynı lekenin lekesiz bir görüntüsüdür. Görüntü laboratuvarı yazılımı, her şeritte MCM-7, GAPDH ve toplam protein hacmini ölçmek için örnek şeritleri (mavi kutular) seçti. MCM-7 seviyeleri lekesiz toplam protein ölçümüne veya GAPDH'ye karşı normalleştirildi. Normalleştirilmiş MCM-7 protein düzeyleri istatistiksel olarak analiz edilmiş ve ortalama MCM-7 protein bandı hacmi ve standart sapma (n=4) grafikte sunulmuştur (Şekil 3C). Her iki normalleşme yöntemi de küçük bir düşüş olduğunu ortaya koydu (%25 civarında) ışınlama tedavisinden sonra MCM-7 protein seviyelerinde. Toplam protein normalleştirmesi ile veriler, yükleme kontrolü olarak GAPDH'den daha küçük bir standart sapma sergiledi.
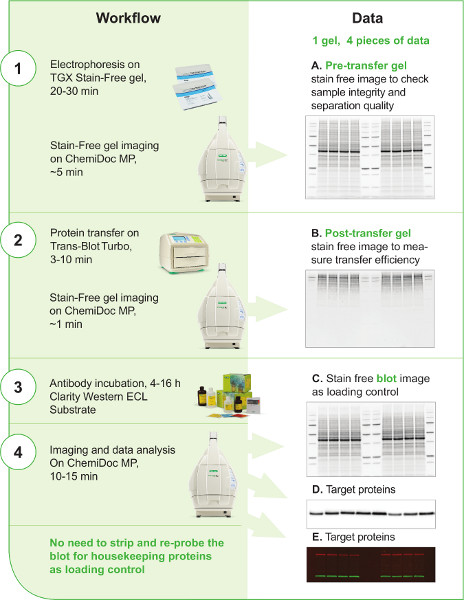
Şekil 1. V3 Batı İş Akışı. V3 iş akışı sol sütunda 4 adımda gösterilmiştir. İş akışında kullanılan başlıca araçlar ve reaktifler her adımda gösterilir. Her adım için tahmini süre de dahildir. Sağ sütun, V3 iş akışında en az 4 görüntü oluşturulabileceğini gösterir. Her veri parçasının kullanımı açıklanmıştır. Pretransfer jel, transfer sonrası jel ve lekenin lekesiz görüntüleri (A, B, C) geleneksel batı şişkinlik teknikleri ile kolayca oluşturulamaz; Bu görüntüler ve veriler, bilim adamının batı blot iş akışının kontrolünü ve tekrarlanabilirliğini iyileştirmek için prosedür boyunca önemli bilgiler ve kontrol noktaları sağlar. Hedef protein sinyalleri, tespitte HRP konjuge edilmiş ikincil antikor uygulanmışsa bir chemiluminescent blot görüntüsünde(D)veya aynı blot üzerinde aynı anda birden fazla hedef proteini tespit etmek için birden fazla floresan batı şişkinliği yapıldıysa floresan bir blot görüntüsünde(E)yakalanabilir.
Daha büyük resmi görüntülemek için burayı tıklatın.

Şekil 2. Numune bütünlüğünü, ayırma kalitesini ve aktarım verimliliğini değerlendirmek için V3 batı iş akışındaki ön nakil ve transfer sonrası jellerin lekesiz görüntüleri. (A) Öntransfer jel lekesiz görüntü. (B) Transfer sonrası jel lekesiz görüntü. (C) Protein transferi verimlilik ölçümü.
Daha büyük resmi görüntülemek için burayı tıklatın.
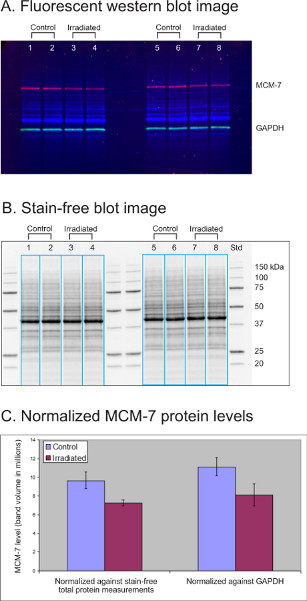
Şekil 3. Lekesiz toplam protein ölçümünün GAPDH immünodeteksiyonu ile karşılaştırılması, ilgi çekici protein seviyesini normalleştirmek için yükleme kontrolleri olarak. (A) Floresan batı leke görüntüsü. (B) Lekesiz lekeli görüntü. (C) Normalleştirilmiş MCM-7 protein seviyeleri.
Daha büyük resmi görüntülemek için burayı tıklatın.
Tartışmalar
Yukarıda açıklanan V3 lekesiz protokol, floresan batı şişkinliğinin çoklayıcı olması içindir. Ayrıca, chemiluminescent algılama kullanılarak batı şişkinliğinde de uygulanabilir. Çok katlı floresan batı blot protokolünde, lekesiz leke görüntüleri iki zaman noktasında elde edilir: 1) protein transferden hemen sonra; 2) antikor inkübasyonundan sonra multipleks floresan görüntüleme adımında. İlk lekesiz görüntü aktarım verimliliğini hesaplamak için, ikinci lekesiz görüntü ise yükleme kontrolü olarak kullanılır. Chemiluminescent yöntemi uygulandığında lekesiz ve hedef protein sinyalleri için multipleks görüntü almak mümkün değildir, çünkü chemiluminescent sinyali lekesiz kanalda da görünecektir. Bu durumda protein transfer adımından hemen sonra çekilen lekesiz görüntüyü yükleme kontrolü ve normalleşme analizi için kullanmanızı öneririz.
V3 batı iş akışı, yükleme kontrolleri olarak temizlik proteinlerini kullanan geleneksel batı blot iş akışına kıyasla aşağıdaki benzersiz avantajları sağlar:
İlk olarak, V3 iş akışı, ilgi çekici protein seviyesindeki değişiklikleri doğrulamak için pratik, kullanışlı ve daha güvenilir bir yükleme kontrolü sağlar. V3 protokolü, her örnekte ölçülen ilgi proteininin seviyesini normalleştirmek için toplam protein yükleme kontrolünü kullanır. Temizlik proteinlerini yükleme kontrolleri olarak kullanmanın iki tuzaklarından kaçınır: doymuş immünodeteksiyon ve belirli deneysel koşullar altında numuneler arasında tutarsız temizlik proteini ifade seviyeleri. Temizlik hizmetine karşı yönlendirilen antikorlarla sıyırma ve yeniden işleme adımları artık gerekli değil. Lekesiz teknolojiyi kullanarak, toplam protein ölçümü için Coomassie veya Sypro Ruby gibi lekelerle leke bırakmaya ve lekeden arındırmaya gerek yoktur. Bir blot görüntüsü elde etmek sadece birkaç saniye ve Image Lab yazılımını kullanarak toplam protein normalleştirmesini yapmak yaklaşık 5 dakika sürer.
İkinci olarak, V3 iş akışı, bilim adamlarının batı prosedürünü daha iyi kontrol etmelerini sağlar, çünkü prosedürü daha şeffaf hale getirir ve kalite kontrolü için birkaç kontrol noktası sunar. Lekesiz teknoloji yardımıyla araştırmacılar protein örneklerini hem jel hem de leke üzerinde görselleştirebilirler. Bilim adamları protein numune bütünlüğünü (bozulmuş veya bozulmamış), ayırma kalitesini (çökelenmiş veya çökememiş), transfer verimliliğini ve transfer kalitesini (hatta transfer veya değil) değerlendirebilirler. Bu kontrol noktaları, araştırmaların süreçte büyük kusurlar gördüğünde deneyi sonlandırmasına ve zayıf örnekler ve lekeler üzerinde zaman kaybetmekten kaçınmasına yardımcı oluyor. Bu teknoloji aynı zamanda bilim adamlarının membran sıyırma sonrası önemli miktarda protein kaybı olup olmadığını ve lekenin farklı bir hedefi yeniden işlemeye uygun olup olmadığını değerlendirmelerine yardımcı olur 4.
V3 western iş akışını kullanarak iyi deneyim ve kaliteli veri sağlamak için birkaç ipucu.
- Jel çalışmasından hemen sonra jeli görüntüleyin. Leke bileşiği yıkayabileceğinden, jelin işlemdeki ilk görüntülemeden önce herhangi bir tampona batırılmaması.
- Protokoldeki tüm görüntüleri elde etmek için aynı görüntüleme alanını kullanın. Bu, yazılımın toplam protein normalleştirmesi gibi veri analizi için görüntüleri kaplamasına izin verecektir.
- Ön nakil ve transfer sonrası jelleri görüntülemede pozlama süresini tutarlı tutun. Bu, yazılımın aktarım verimliliğini nicel olarak ölçmesine izin verecektir.
- Leke görüntüsünü alırken zarı birkaç damla su veya TBST ile ıslak tutun. Bu, hedef protein tespiti için olası kirli arka plan sorunlarını önleyecektir.
- Çoklayıcı floresan batı şişkinliği için düşük floresan PVDF membran kullanın.
UV aktivasyonundan sonra lekesiz molekülün triptofan kalıntılarına geri döndürülemez bir şekilde bağlı olduğunu belirtmek önemlidir. Bu geri dönüşü olmayan modifikasyon, epitop triptofan içeriyorsa monoklonal antikorlar kullanırken antijen tanımayı potansiyel olarak etkileyebilir. Poliklonal antikorların etkilenme olasılığı düşüktür, çünkü antijendeki birden fazla epitopları tanırlar. İlişkisiz lekesiz moleküller jelden ve zardan kolayca yıkanır ve bu nedenle antikor-antijen etkileşimlerine müdahale etmez.
Sonuç olarak, V3 batı iş akışı batı blot sürecini daha hızlı, daha şeffaf, nicel ve daha güvenilir hale getirir. Araştırmacılar artık verilerini daha güvenilir hale getirmek için batıdaki bir blot deneyinde toplam protein yükleme kontrolünü kolayca uygulayabilirler. V3 lekesiz iş akışı bir dizi laboratuvar tarafından benimsenmiştir ve yayınları, dergilerin lekesiz verileri batı blot22,17,7,8,5,23,18,15'de yükleme kontrolü olarak kabul ettiğini göstermiştir.
Açıklamalar
Yazarlar, Anton Posch, Jonathan Kohn, Kenneth Oh, Matt Hammond ve Ning Liu Bio-Rad Laboratories, Inc.
Teşekkürler
Yazarlar, bu makaleyi eleştirel incelemeleri ve düzenlemeleri için Dr. Wolf-Dieter Stalz, Dr. Arnaud Remy, Dr. Anton Posch, Dr. Patricia Piatti, Tom Davies, Kris Simonyi ve Jeff Durban'a teşekkür ediyorlar. Yazarlar ayrıca Allison Schwartz'a teknik destek için teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| 4-20% Criterion TGX Stain-Free Precast Gel | Bio-Rad | 567-8093 | Choose a gel size and percentage that meet the specific need in a experiment |
| Trans-Blot Turbo Midi PVDF Transfer Packs | Bio-Rad | 170-4157 | Choose either PVDF or nitrocellulose and match the membrane size to the gel size |
| Clarity Western ECL Substrate, 500 ml | Bio-Rad | 170-5061 | |
| EQUIPMENT | |||
| Criterion Cell | Bio-Rad | 165-6100 | |
| Trans-Blot Turbo Transfer Starter System | Bio-Rad | 170-4155 | |
| ChemiDoc MP System | Bio-Rad | 170-8280 | |
Referanslar
- Aldridge, G. M., Podrebarac, D. M., Greenough, W. T., Weiler, I. J. The use of total protein stains as loading controls: an alternative to high-abundance single-protein controls in semi-quantitative immunoblotting. J. Neurosci. Methods. 172 (2), 250-254 (2008).
- Bauer, D. E., Haroutunian, V., McCullumsmith, R. E., Meador-Woodruff, J. H. Expression of four housekeeping proteins in elderly patients with schizophrenia. J. Neural. Transm. 116 (4), 487-491 (2009).
- Castaño, Z., Kypta, R. M. Housekeeping Proteins: Limitations as References During Neuronal Differentiation. Open Neurosci. J. 2, 36-40 (2008).
- Colella, A. D., Chegenii, N., Tea, M. N., Gibbins, I. L., Williams, K. A., Chataway, T. K. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal. Biochem. 430 (2), 108-110 (2012).
- Cully, T. R., Edwards, J. N., Friedrich, O., Stephenson, D. G., Murphy, R. M., Launikonis, B. S. Changes in plasma membrane Ca-ATPase and stromal interacting molecule 1 expression levels for Ca2+ signaling in dystrophic mdx mouse muscle. Am. J. Physiol. Cell Physiol. 303 (5), (2012).
- Dittmer, A., Dittmer, J. Beta-actin is not a reliable loading control in Western blot analysis. Electrophoresis. 27 (14), 2844-2845 (2006).
- Dutka, T. L., Lamboley, C. R., McKenna, M. J., Murphy, R. M., Lamb, G. D. Effects of carnosine on contractile apparatus Ca2+ sensitivity and sarcoplasmic reticulum Ca2+ release in human skeletal muscle fibers. J. Appl. Physiol. 112 (5), 728-736 (2012).
- Elliott, S., Busse, L., Swift, S., McCaffery, I., Rossi, J., Kassner, P., Begley, C. G. Lack of expression and function of erythropoietin receptors in the kidney. Nephrol. Dial. Transplant. 27 (7), 2733-2745 (2012).
- Eslami, A., Lujan, J., Western, Blotting: Sample Preparation to Detection. J. Vis. Exp. (44), (2010).
- Ferguson, R. E., Carroll, H. P., Harris, A., Maher, E. R., Selby, P. J., Banks, R. E. Housekeeping proteins: a preliminary study illustrating some limitations as useful references in protein expression studies. Proteomics. 5 (2), 566-571 (2005).
- Greer, S., Honeywell, R., Geletu, M., Arulanandam, R., Raptis, L. Housekeeping genes; expression levels may change with density of cultured cells. J. Immunol. Methods. 355 (1-2), 76-79 (2010).
- Gürtler, A., Kunz, A., Gomolka, M., Hornhardt, S., Friedl, A. A., McDonald, K., Kohn, J. E., Posch, A. Stain-Free Technology as Normalization Tool in Western Blot Analysis. Anal. Biochem. 433 (2), 105-111 (2013).
- Hagiwara, M., Kobayashi, K., Tadokoro, T., Yamamoto, Y. Application of SYPRO Ruby- and Flamingo-stained polyacrylamide gels to Western blot analysis. Anal. Biochem. 397 (2), 262-264 (2010).
- Heidebrecht, F., Heidebrecht, A., Schulz, I., Behrens, S. E., Bader, A. Improved semiquantitative Western blot technique with increased quantification range. J. Immunol. Methods. 345 (1-2), 40-48 (2009).
- Jensen, R. B., Ozes, A., Kim, T., Estep, A. Kowalczykowski SC BRCA2 is epistatic to the RAD51 paralogs in response to DNA damage. DNA Repair. , (2013).
- Lanoix, D., St-Pierre, J., Lacasse, A. A., Viau, M., Lafond, J., Vaillancourt, C. Stability of reference proteins in human placenta: general protein stains are the benchmark. Placenta. 33 (3), 151-156 (2012).
- Larkins, N. T., Murphy, R. M., Lamb, G. D. Influences of temperature, oxidative stress, and phosphorylation on binding of heat shock proteins in skeletal muscle fibers. Am. J. Physiol. Cell Physiol. 3 (6), (2012).
- Laurie, K. J., Dave, A., Straga, T., Souzeau, E., Chataway, T., Sykes, M. J., Casey, T., Teo, T., Pater, J., Craig, J. E., Sharma, S., Burdon, K. P. Identification of a Novel Oligomerization Disrupting Mutation in CRYΑA Associated with Congenital Cataract in a South Australian. , (2012).
- Li, X., Bai, H., Wang, X., Li, L., Cao, Y., Wei, J., Liu, Y., Liu, L., Gong, X., Wu, L., Liu, S., Liu, G. Identification and validation of rice reference proteins for western blotting. J. Exp. Bot. 62 (14), 4763-4772 (2011).
- Liu, N. K., Xu, X. M. Beta-tubulin is a more suitable internal control than beta-actin in western blot analysis of spinal cord tissues after traumatic injury. J. Neurotrauma. 23 (12), 1794-1801 (2006).
- Lowe, D. A., Degens, H., Chen, K. D., Alway, S. E. Glyceraldehyde-3-phosphate dehydrogenase varies with age in glycolytic muscles of rats. J. Gerontol. A Biol. Sci. Med. Sci. 55 (3), 160-164 (2000).
- Mollica, J. P., Dutka, T. L., Merry, T. L., Lamboley, C. R., McConell, G. K., McKenna, M. J., Murphy, R. M., Lamb, G. D. S-glutathionylation of troponin I (fast) increases contractile apparatus Ca2+ sensitivity in fast-twitch muscle fibres of rats and humans. J. Physiol. 590, 1443-1463 (2012).
- Murphy, R. M., Dutka, T. L., Horvath, D., Bell, J. R., Delbridge, L. M., Lamb, G. D. Ca2+-dependent Proteolysis of Junctophilin 1 and Junctophilin 2 in Skeletal and Cardiac. 591, 719-729 (2012).
- Neill, U. S. All Data are not created Equal. J. Clin. Invest. 119, 224 (2009).
- Pérez-Pérez, R., López, J. A., García-Santos, E., Camafeita, E., Gómez-Serrano, M., Ortega-Delgado, F. J., Ricart, W., Fernández-Real, J. M., Peral, B. Uncovering suitable reference proteins for expression studies in human adipose tissue with relevance to obesity. PLoS One. 7 (1), (2012).
- Rocha-Martins, M., Njaine, B., Silveira, M. S. Avoiding Pitfalls of Internal Controls: Validation of Reference Genes for Analysis by qRT-PCR and Western Blot throughout Rat Retinal Development. PLoS One. 7 (8), (2012).
- Romero-Calvo, I., Ocón, B., Martínez-Moya, P., Suárez, M. D., Zarzuelo, A., Martínez-Augustin, O., de Medina, F. S. Reversible Ponceau staining as a loading control alternative to actin in Western blots. Anal. Biochem. 401 (2), 318-320 (2010).
- Said, H. M., Polat, B., Hagemann, C., Anacker, J., Flentje, M., Vordermark, D. Absence of GAPDH regulation in tumor-cells of different origin under hypoxic conditions in-vitro. BMC Res. Notes. 13 (2), 8 (2009).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative western blots. Exp. Anim. 60 (2), 193-196 (2011).
- Welinder, C., Ekblad, L. Coomassie staining as loading control in Western blot analysis. J. Proteome Res. 10 (3), 1416-1419 (2011).
- You, J., Hodge, C., Wen, L., McAvoy, J. W., Madigan, M. C., Sutton, G. Using soybean trypsin inhibitor as an external loading control for Western blot analysis of tear proteins: application to corneal disease. Exp. Eye Res. 99, 55-62 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır