Method Article
Flux de travail sans taches V3 pour un contrôle pratique, pratique et fiable de la charge totale en protéines dans Western Blotting
Dans cet article
Résumé
Le flux de travail V3 est une procédure western blot utilisant des gels sans taches. La technologie sans taches permet aux chercheurs de visualiser la qualité de la séparation des protéines, de vérifier l’efficacité du transfert et, plus important encore, de valider le changement dans la protéine d’intérêt en utilisant la quantification des protéines totales comme contrôle de charge fiable.
Résumé
Le western blot est une technique de laboratoire très utile et largement adoptée, mais son exécution est difficile. Le flux de travail est souvent caractérisé comme une « boîte noire » parce qu’un expérimentateur ne sait pas s’il a été effectué avec succès jusqu’à la dernière de plusieurs étapes. De plus, la qualité des données sur le transfert western est parfois mise à l’épreuve en raison d’un manque d’outils efficaces de contrôle de la qualité en place tout au long du processus de western blotting. Nous décrivons ici le flux de travail occidental V3, qui applique la technologie sans tache pour répondre aux préoccupations majeures associées au protocole western blot traditionnel. Ce flux de travail permet aux chercheurs: 1) d’exécuter un gel en environ 20-30 min; 2) visualiser la qualité de séparation de l’échantillon dans les 5 minutes suivant l’exécution du gel; 3) transférer des protéines en 3-10 min; 4) vérifier quantitativement l’efficacité des transferts; et surtout 5) pour valider les changements dans le niveau de la protéine d’intérêt en utilisant le contrôle de la charge totale en protéines. Cette nouvelle approche élimine le besoin de décaper et de réprouillant la tache pour les protéines d’entretien ménager telles que la β-actine, la β-tubuline, le GAPDH, etc. Le flux de travail sans tache V3 rend le processus western blot plus rapide, transparent, plus quantitatif et plus fiable.
Introduction
Western blot est une technique très utile9, cependant, il y a deux défis majeurs avec western blotting: processus long et laborieux et la qualité des données. Un protocole traditionnel nécessite environ 2 jours. Il implique de nombreuses étapes, y compris la préparation de l’échantillon, la coulée de gel, l’électrophorèse et le transfert de protéines, le blocage de la membrane suivi de l’incubation d’anticorps, l’imagerie et, bien souvent, le décapage, la réprobation et enfin l’analyse des données. Tout au long de ce processus, il n’y a pas d’outils fiables et flexibles pour le contrôle des processus. En tant que tel, des erreurs peuvent être introduites à chaque étape, et ces erreurs ont le potentiel de générer des artefacts de données ; par conséquent, les contrôles de chargement sont essentiels dans le western blotting pour identifier et corriger les erreurs. Le contrôle de la charge se fait généralement en vérifiant le niveau de protéines d’une protéine de référence dans chaque échantillon pour voir si elle est présentée de manière égale. Les gens utilisent souvent des protéines d’entretien ménager, telles que la β-actine, la β-tubuline, le GAPDH, comme contrôle de la charge.
La qualité des données sur le transfert western dépend d’un contrôle fiable du chargement. Mais il y a deux préoccupations légitimes lors de l’utilisation de protéines de ménage pour les contrôles de charge : 1) l’immunodétection à base d’anticorps des bandes de protéines de ménage sont souvent saturées et donc on ne peut pas distinguer les différences de charge entre les échantillons30; 2) le niveau d’expression des protéines d’entretien ménager peut varier dans les échantillons dans certaines conditions expérimentales, par exemple, le traitement de l’ARNsi, la mort cellulaire, la différenciation cellulaire, etc.11,28,3,6,10,21. En raison de ces préoccupations, les revues scientifiques exigent maintenant que « pour les comparaisons quantitatives, des réactifs, des contrôles et des méthodes d’imagerie appropriés avec des plages de signaux linéaires devraient être utilisés » (ligne directrice sur la nature). De même, les rédacteurs en chef du Journal of Clinical Investigation demandent des contrôles de chargement plus fiables24. Pour ces raisons, une protéine d’entretien doit être validée afin d’être utilisée comme contrôle de charge. Tout d’abord, il faut s’assurer qu’il est mesuré dans la plage dynamique linéaire de la méthode d’immunodétection14,29. Deuxièmement, il faut s’assurer qu’il est exprimé de manière cohérente dans tous les échantillons26,31,25,19,20.
Une solution alternative à un contrôle de charge fiable consiste à utiliser la mesure des protéines totales à partir de la tache. Certains chercheurs ont taché les taches avec des taches de protéines totales, telles que Coomassie, Flamingo Pink, Sypro Ruby, Amido Black, Ponceau S, et la technologie sans taches, pour mesurer le signal de protéines totales dans chaque voie comme contrôle de charge16,20,13,27,1,4,12. Le contrôle de la charge totale en protéines évite les pièges associés aux protéines d’entretien ménager. Tout d’abord, c’est un reflet fidèle de la quantité de protéines chargée pour chaque échantillon. Deuxièmement, la coloration protéique totale présente une excellente plage dynamique linéaire dans la plage de charge commune pour l’analyse western blot (protéine 10-50 μg d’un lysat cellulaire complexe) et différencie avec précision la différence de charge entre les échantillons12.
La technologie sans tache est une nouvelle méthode de coloration des protéines totales où un composé unique est mélangé dans une solution de gel d’acrylamide et distribué uniformément dans le gel coulé. Une fois l’électrophorèse terminée, le gel est exposé à la lumière UV pendant au moins 1 min afin que le composé de coloration réagisse avec les résidus de tryptophane dans la protéine. Les protéines deviennent excitables sous la lumière UV pour donner un signal fluorescent fort qui peut être visualisé et quantifié dans un imageur sans tache tel que le système ChemiDoc MP. Le composé sans tache lui-même, cependant, n’absorbe pas la lumière UV, ce qui entraîne un faible fond de l’image du gel. La modification des résidus de tryptophane est irréversible et les protéines peuvent être visualisées non seulement dans le gel, mais aussi sur la tache à tout moment après le transfert de protéines.
La technologie sans taches est appliquée dans le flux de travail V3 Western (Figure 1) pour répondre aux principales plaintes concernant le flux de travail traditionnel, en particulier les préoccupations liées à l’utilisation de protéines d’entretien ménager comme contrôles de chargement. En utilisant ce flux de travail, on pourrait: 1) exécuter un gel en environ 20-30 min, 2) vérifier l’intégrité de l’échantillon et la qualité de la séparation des protéines en 5 min après l’exécution du gel; 3) transférer des protéines en 3-10 min; 4) vérifier quantitativement l’efficacité du transfert; et 5) plus important encore, valider les changements dans le niveau de la protéine d’intérêt en utilisant le contrôle de la charge totale en protéines.
Protocole
1. Préparation de l’échantillon de protéines
(Une procédure typique pour extraire des protéines de la culture cellulaire est décrite)
- Placez le plat de culture cellulaire HeLa dans de la glace et lavez les cellules avec une solution saline tamponnée tris glacée (TBS; 20 mM Tris-HCl, pH 7,5, NaCl 150 mM).
- Aspirer le TBS, puis ajouter 1 ml par tampon RIPA glacé de 100 mm (50 mM Tris-HCl pH 8,0, 150 mM NaCl, 1% NP-40, 0,5% de désoxycholate de sodium, 0,1% SDS) complété par des inhibiteurs de la phosphatase et de la protéase.
- Gratter les cellules adhérentes du plat à l’aide d’un grattoir à cellules en plastique froid; transférer doucement la suspension cellulaire dans un tube de microcentrifugation pré-cool.
- Maintenir une agitation constante pendant 30 min à 4 °C sur un rotateur.
- Tourner à 16 000 x g pendant 20 min dans une centrifugeuse pré-recolée à 4 °C.
- Retirez délicatement le tube de la centrifugeuse et placez-le sur de la glace. Transférer le surnageant dans un tube frais conservé sur la glace et jeter le culot.
- Retirer un petit volume (10-20 μl) de lysat pour effectuer un dosage protéique. Déterminer la concentration en protéines pour chaque échantillon à l’aide de la trousse d’analyse RC DC.
- Si nécessaire, aliquotez les échantillons de protéines pour un stockage à long terme à -20 °C. Les cycles répétés de gel et de dégel provoquent la dégradation des protéines et doivent être évités.
- Prélever environ 20 μg de chaque échantillon, ajouter un volume égal de 2x tampon d’échantillon Laemmli (4 % de FDS, 10 % de 2-mercaptoéthanol, 20 % de glycérol, 0,004 % de bleu de bromophénol, 125 mM de Tris-HCl, pH 6,8).
- Chauffer chaque lysat cellulaire dans un tampon d’échantillon à 95 °C pendant 5 min.
- Centrifuger à 16 000 x g dans une microcentrifugeuse pendant 1 min.
2. Électrophorèse sur gel avec des gels sans taches (~ 30 min)
- Prenez un critère TGX Tout gel préfabriqué sans tache KD (un gel au format midi), retirez le peigne et le ruban adhésif du bas de la cassette.
- Placer la cassette dans la cellule Criterion et remplir la chambre tampon supérieure intégrée avec un tampon de fonctionnement de 60 ml (Tris 25 mM, glycine 190 mM, SDS à 0,1%, pH 8,3). Rincez les puits avec un tampon en cours d’exécution.
- Remplissez chaque moitié du réservoir tampon inférieur avec un tampon de fonctionnement de 400 ml jusqu’à la ligne de remplissage marquée.
- Chargez les échantillons de protéines et les marqueurs protéiques appropriés.
- Placez le couvercle sur le réservoir, en alignant les bouchons banane à code couleur avec les prises correspondantes sur le couvercle.
- Exécutez le gel pendant ~ 30 min à 200 V ou 20 min à 300 V.
3. Imagerie en gel sans tache à l’aide du système Chemidoc MP pour vérifier la qualité de la séparation des protéines (~ 5 min)
- Retirez la cassette de gel de la cellule. Utilisez l’outil d’ouverture de la cassette de gel dans le couvercle de Criterion Cell pour ouvrir la cassette et libérer le gel.
- Appliquez quelques millilitres d’eau au centre du plateau d’échantillonnage UV de l’imageur ChemiDoc MP. Soulevez soigneusement le gel de la cassette et placez-le sur le plateau.
- Lancez le logiciel Image Lab et capturez l’image de gel sans tache (Figure 1A) avec les paramètres suivants :
Application: gel sans taches
Temps d’activation du gel: 1 min
Zone d’imagerie: gel critère
Temps d’exposition de l’image : optimisé automatiquement pour les bandes les plus intenses - Retirez le gel du bac à échantillons et passez immédiatement à l’étape de transfert.
4. Transfert de protéines avec le système Turbo Trans-Blot (~ 10 min)
- Ouvrez un Pack de transfert Pvdf Turbo Midi Trans-Blot; placez la pile inférieure (qui comprend la membrane) sur la base de la cassette de transfert.
- Placez le gel sur le dessus de la membrane, placez la pile supérieure sur le gel et déroulez des bulles.
- Placez le couvercle sur la base de la cassette et tournez le cadran pour le verrouiller.
- Insérez la cassette dans la baie du buvard.
- Démarrez le transfert en sélectionnant un programme Turbo prédéfini et en choisissant la taille de gel Criterion (midi), puis appuyez sur EXÉCUTER. Une course typique ne prend que 7 min.
- Lorsque le transfert est terminé, démontez le sandwich buvard et placez le transfert et le gel dans un récipient contenant de l’eau désionisée.
5. Imagerie gel et tache sans tache à l’aide du système Chemidoc MP pour vérifier l’efficacité et la qualité du transfert de protéines (~ 5 min)
- Placez le gel post-transfert sur le plateau d’échantillonnage de l’imageur ChemiDoc MP.
- Lancez le logiciel Image Lab et capturez l’image sans tache du gel post-transfert (Figure 1B) avec les paramètres suivants :
Application: gel sans taches
Temps d’activation du gel: aucun
Zone d’imagerie: gel critère
Temps d’exposition de l’image: identique au temps d’exposition pour l’image de gel prétransfert - Retirez le gel du bac d’échantillonnage, puis imaginez la tache(Figure 1C)avec les réglages suivants. Gardez la tache humide avec quelques gouttes d’eau ou TBST lors de l’imagerie.
Application: tache sans taches
Zone d’imagerie: gel critère
Temps d’exposition de l’image : optimisé automatiquement pour les bandes les plus intenses - Retirez la membrane buvarde du bac d’échantillonnage et placez-la dans un récipient contenant tbst (0,1% Tween 20 dans tbs).
6. Incubation des anticorps
- Bloquer en plaçant la tache dans une solution d’albumine sérique bovine (BSA) à 3% dans TBST à température ambiante pendant 1 heure.
- Incuber la tache pendant une nuit à 4 °C dans la solution contenant de l’anticorps primaire de souris élevé contre la première protéine cible et de l’anticorps primaire de lapin élevé contre la deuxième protéine cible.
- Versez la solution contenant l’anticorps primaire. Ensuite, lavez la tache en agitant dans 20 ml de TBST pendant 5 min. Répétez 4x pour un total de 5 lavages.
- Incuber pendant 1 heure à température ambiante dans la solution d’anticorps secondaire contenant un anticorps conjugué Dylight 650 goat-anti-mouse et un anticorps conjugué Dylight 549 goat-anti-rabbit.
- Versez la solution contenant l’anticorps primaire. Ensuite, lavez la tache en agitant dans 20 ml de TBST pendant 5 min. Répétez 4x pour un total de 5 lavages.
7. Imagerie et analyse des données par le logiciel Image Lab - Normalisation des protéines totales (~ 5 min)
- Acquérir une image fluorescente multiplexante du transfert(Figure 1E)en ouvrant un nouveau protocole multicanal, configurer trois canaux fluorescents et exécuter le protocole.
Canal 1 :
Application: blot Dylight 650
Zone d’imagerie: gel critère
Temps d’exposition de l’image : optimisé automatiquement pour les bandes les plus intenses
Canal 2 :
Application: tache Dylight 549
Zone d’imagerie: gel critère
Temps d’exposition de l’image : optimisé automatiquement pour les bandes les plus intenses
Canal 3 :
Application: tache sans taches
Zone d’imagerie: gel critère Temps d’exposition de l’image: optimisé automatiquement pour les bandes les plus intenses - Cliquez sur l’icône Normalisation dans la zone Outil Analyse (Analysis Tool Box) et cliquez sur Oui pour détecter les voies et les bandes.
- Sélectionnez et utilisez « Outils voies et bandes » pour apporter des ajustements aux voies et aux bandes au besoin.
- Sélectionnez l’image sans tache comme canal de normalisation.
- Sélectionnez Outils d’analyse MW et attribuez les voies standard MW en cochant les cases en dessous.
- Pour afficher les volumes normalisés, cliquez sur la table d’analyse dans la barre d’outils. Tous les calculs seront effectués automatiquement par le logiciel, y compris le facteur de normalisation et les volumes normalisés. Les valeurs d’intensité de la bande protéique cible sont maintenant ajustées pour tenir compte de la variation de la charge protéique. Cela permettra des comparaisons précises des protéines cibles parmi les échantillons.
Résultats
1. Évaluation de l’intégrité de l’échantillon, de la qualité de la séparation des protéines et de l’efficacité du transfert avec des images de gel sans taches.
L’extrait de protéine des cellules de HeLa ont été séparés à 300 V pendant la minute 20 sur un gel sans tache du critère anyKD TGX de 18 puits. Les échantillons de protéines ont été chargés 3 fois à quatre quantités différentes (voies 1-3, 40 μg; Voies 4-6, 30 μg; Voies 7-9, 20 μg; Voies 10-12, 10 μg). Le gel a été activé sous la lumière UV pendant 1 min. La figure 2A montre l’image du gel acquise juste après la séparation des protéines. L’intégrité de l’échantillon de protéines(p. ex. dégradation) et la qualité de la séparation(p. ex. précipitation des protéines) peuvent être évaluées visuellement avec cette image de gel. Les protéines ont ensuite été transférées pendant 7 minutes dans une membrane de nitrocellulose à l’aide de Trans-Blot Turbo. La figure 2B montre l’image sans tache du gel post-transfert. Les deux images ont été acquises avec le même temps d’exposition (6.8 sec). Les voies 3 et 12 ont été choisies pour mesurer l’efficacité du transfert. À l’aide de l’outil de volume du logiciel Image Lab, une boîte rectangulaire (bleue) a été dessinée pour couvrir les voies 3 et 12 sur les deux images de gel. Le calcul basé sur les valeurs de volume de ces boîtes a indiqué que l’efficacité de transfert des deux voies était de 80 %(figure 2C). Dans cette expérience, le gel AnyKD TGX a été sélectionné pour étudier les protéines cibles de petite à moyenne taille et il n’a pas été optimisé pour le transfert de grandes protéines. L’optimisation de l’efficacité du transfert nécessiterait l’utilisation d’un pourcentage de gel inférieur(par exemple 4-20%) et/ou un ajustement du temps de transfert pour faciliter le transfert de grosses protéines. 2. Le contrôle de la charge totale en protéines sans tache est une alternative fiable au contrôle de la charge d’entretien ménager dans le western blotting pour quantifier un petit changement dans le niveau de protéines d’intérêt.
MCM-7 est un facteur de réplication d’autorisation d’ADN dont le niveau diminue de 20-50% dans les lignées cellulaires lymphoblastoïdes (LCL) après traitement par irradiation. Dans cette expérience, les lysats (30 μg chacun) de quatre cultures de lignées cellulaires lymphoblastoïdes (LCL) témoins et traitées par irradiation ont été séparés sur un gel sans coloration AnyKD TGX à 12 puits. Le gel a été activé pendant 1 minute sous la lumière UV et transféré par Trans-Blot Turbo à une membrane PVDF pour immunoblotting. La protéine d’entretien ménager GAPDH (vert) a été sondée avec un anticorps de lapin (Cell Signaling Technology, Etats-Unis, 1:2.500) et un anticorps conjugué de chèvre-anti-lapin Dylight 549 (Rockland, Etats-Unis, 1:20.000). La protéine d’intérêt MCM-7 (rouge) a été sondée à l’aide d’un anticorps de souris (Abcam, États-Unis, 1:1 000) et d’un anticorps conjugué goat-anti-souris Dylight 649 (Rockland, 1:10 000).
La figure 3A montre une image fluorescente multiplex de protéines totales (bleu), MCM-7 (rouge) et GAPDH (vert) détectées dans quatre échantillons de LCL traités par contrôle et irradiation. La figure 3B est une image sans tache du même transfert montrant les profils de protéines totales dans chaque échantillon (30 μg). Le logiciel de laboratoire d’images a sélectionné les voies d’échantillonnage (boîtes bleues) pour mesurer le MCM-7, le GAPDH et le volume total de protéines dans chaque voie. Les niveaux MCM-7 ont été normalisés contre la mesure totale sans tache de protéine ou contre GAPDH. Les niveaux normalisés de protéine MCM-7 ont été statistiquement analysés et le volume moyen de bande de protéine MCM-7 et l’écart-type (n = 4) sont présentés dans le graphique(Figure 3C). Les deux méthodes de normalisation ont révélé une légère diminution (environ 25 %) dans les niveaux de protéine MCM-7 après traitement d’irradiation. Les données avec la normalisation totale des protéines ont montré un écart-type plus petit que celui avec GAPDH comme contrôle de charge.
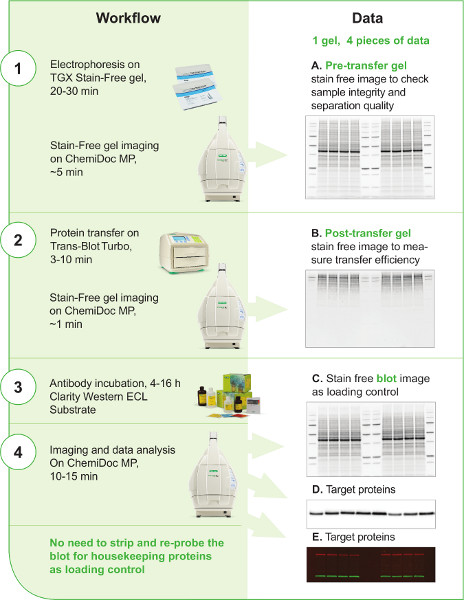
Figure 1. Flux de travail ouest V3. Le flux de travail V3 est représenté dans la colonne de gauche en 4 étapes. Les principaux instruments et réactifs utilisés dans le flux de travail sont indiqués à chaque étape. Le temps estimé pour chaque étape est également inclus. La colonne de droite indique qu’un minimum de 4 images peuvent être générées dans le flux de travail V3. L’utilisation de chaque donnée est décrite. Les images sans tache du gel prétransfert, du gel post-transfert et de la tache (A, B, C) ne peuvent pas être générées facilement avec les techniques occidentales traditionnelles de buvardage; Ces images et données fournissent des informations importantes et des points de contrôle tout au long de la procédure pour améliorer le contrôle et la reproductibilité du flux de travail du transfert western par le scientifique. Les signaux de la protéine cible peuvent être capturés soit sur une image de tache chimiluminescente(D)si un anticorps secondaire conjugué HRP a été appliqué en détection, soit sur une image fluorescente(E)si le bblotting occidental fluorescent multiplexant a été effectué pour détecter plus d’une protéine cible simultanément sur la même tache.
Cliquez ici pour agrandir l’image.

Figure 2. Images sans tache des gels prétransfert et post-transfert dans le flux de travail V3 western pour évaluer l’intégrité des échantillons, la qualité de la séparation et l’efficacité du transfert. (A) Image sans tache de gel de prétransfert. (B) Image sans tache de gel post-transfert. (C) Mesure de l’efficacité du transfert de protéines.
Cliquez ici pour agrandir l’image.
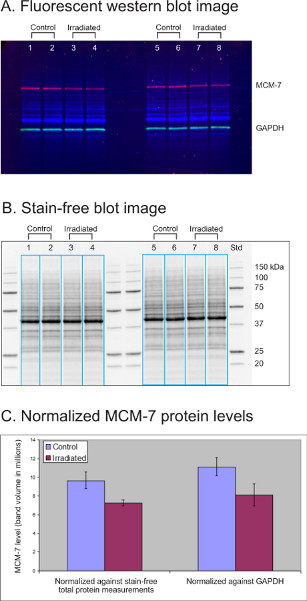
Figure 3. Comparaison de la mesure des protéines totales sans taches à l’immunodétection GAPDH en tant que contrôles de charge pour normaliser le niveau de protéine d’intérêt. (A) Image fluorescente western blot. (B) Image de tache sans tache. (C) Niveaux normalisés de protéine MCM-7.
Cliquez ici pour agrandir l’image.
Discussion
Le protocole V3 sans taches décrit ci-dessus est pour multiplexer le buvard occidental fluorescent. Il peut également être appliqué dans le western blotting en utilisant la détection chemiluminescente. Dans le protocole western de tache fluorescent multiplex, les images de tache-libre de tache sont acquises à deux points de temps : 1) juste après le transfert de protéine ; 2) à l’étape d’imagerie fluorescente multiplex après incubation d’anticorps. La première image sans tache est utilisée pour calculer l’efficacité de transfert et la seconde image sans tache est utilisée comme contrôle de chargement. Lorsque la méthode chemiluminescente est appliquée, il n’est pas possible de prendre une image multiplex pour les signaux sans tache et les protéines cibles, car le signal chimioluminescent apparaîtra également dans le canal sans tache. Dans ce cas, nous recommandons d’utiliser l’image sans tache prise juste après l’étape de transfert de protéine pour le contrôle de chargement et l’analyse de normalisation.
Le flux de travail western V3 offre les avantages uniques suivants par rapport au flux de travail western blot traditionnel qui utilise des protéines de gestion interne comme contrôles de chargement :
Tout d’abord, le flux de travail V3 fournit un contrôle de chargement pratique, pratique et plus fiable pour valider les changements dans le niveau de la protéine d’intérêt. Le protocole V3 utilise un contrôle de charge totale en protéines pour normaliser le niveau de la protéine d’intérêt mesurée dans chaque échantillon. Il évite deux pièges de l’utilisation des protéines d’entretien ménager comme contrôles de charge: immunodétection saturée et niveaux d’expression de protéines de ménage incohérents parmi les échantillons dans certaines conditions expérimentales. Il n’est plus nécessaire de décaper et de réprouiller les étapes avec des anticorps dirigés contre l’entretien ménager. En utilisant la technologie sans tache, il n’est pas nécessaire de tacher et de détaper une tache avec des taches telles que Coomassie ou Sypro Ruby pour la mesure des protéines totales. Il ne faut que quelques secondes pour acquérir une image de tache et environ 5 minutes pour effectuer la normalisation totale des protéines à l’aide du logiciel Image Lab.
Deuxièmement, le flux de travail V3 permet aux scientifiques de mieux contrôler la procédure occidentale car il rend la procédure plus transparente et introduit plusieurs points de contrôle pour le contrôle de la qualité. Avec l’aide de la technologie sans taches, les chercheurs peuvent visualiser leurs échantillons de protéines sur le gel et la tache. Les scientifiques peuvent évaluer l’intégrité des échantillons de protéines (dégradées ou non), la qualité de la séparation (précipitée ou non), l’efficacité du transfert et la qualité du transfert (même le transfert ou non). Ces points de contrôle aident les recherches à mettre fin à l’expérience lorsqu’elles voient de gros défauts dans le processus et évitent de perdre du temps sur de mauvais échantillons et des taches. Cette technologie aide également les scientifiques à évaluer s’il y a une quantité importante de perte de protéines après le décapage de la membrane et si le transfert convient pour réprouillar une cible différente 4.
Voici quelques conseils pour garantir une bonne expérience et des données de qualité à l’aide du flux de travail V3 western.
- Imagez le gel immédiatement après la course du gel. Ne trempez pas le gel dans un tampon avant la première imagerie de la procédure, car il pourrait laver le composé de coloration.
- Utilisez la même zone d’imagerie pour acquérir toutes les images du protocole. Cela permettra au logiciel de superposer des images pour l’analyse de données telles que la normalisation des protéines totales.
- Gardez le temps d’exposition cohérent lors de l’imagerie des gels prétransfert et post-transfert. Cela permettra au logiciel de mesurer quantitativement l’efficacité du transfert.
- Gardez la membrane humide avec quelques gouttes d’eau ou tbst lors de l’acquisition de l’image de tache. Cela évitera d’éventuels problèmes de fond sales pour la détection des protéines cibles.
- Utilisez une membrane PVDF à faible fluorescent pour multiplexer le buvard occidental fluorescent.
Il est important de noter que la molécule sans tache après activation UV est irréversiblement liée aux résidus de tryptophane. Cette modification irréversible peut potentiellement affecter la reconnaissance d’antigène lors de l’utilisation d’anticorps monoclonaux si l’épitope contient du tryptophane. Il est peu probable que les anticorps polyclonaux soient affectés parce qu’ils reconnaissent des épitopes multiples sur l’antigène. Les molécules non liées sans tache sont facilement lavées du gel et de la membrane et n’interféreront donc pas avec les interactions anticorps-antigène.
En conclusion, le flux de travail western V3 rend le processus western blot plus rapide, plus transparent, quantitatif et plus fiable. Les chercheurs peuvent maintenant facilement appliquer le contrôle de la charge totale en protéines dans une expérience western blot pour rendre leurs données plus fiables. Le flux de travail sans taches V3 a été adopté par un certain nombre de laboratoires, et leurs publications ont démontré que les revues acceptent les données sans taches comme contrôle de chargement dans western blot22,17,7,8,5,23,18,15.
Déclarations de divulgation
Les auteurs, Anton Posch, Jonathan Kohn, Kenneth Oh, Matt Hammond et Ning Liu sont des employés de Bio-Rad Laboratories, Inc.
Remerciements
Les auteurs remercient le Dr Wolf-Dieter Stalz, le Dr Arnaud Remy, le Dr Anton Posch, la Dre Patricia Piatti, Tom Davies, Kris Simonyi et Jeff Durban pour leur examen critique et leur édition de ce manuscrit. Les auteurs remercient également Allison Schwartz pour son soutien technique.
matériels
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| 4-20% Criterion TGX Stain-Free Precast Gel | Bio-Rad | 567-8093 | Choose a gel size and percentage that meet the specific need in a experiment |
| Trans-Blot Turbo Midi PVDF Transfer Packs | Bio-Rad | 170-4157 | Choose either PVDF or nitrocellulose and match the membrane size to the gel size |
| Clarity Western ECL Substrate, 500 ml | Bio-Rad | 170-5061 | |
| EQUIPMENT | |||
| Criterion Cell | Bio-Rad | 165-6100 | |
| Trans-Blot Turbo Transfer Starter System | Bio-Rad | 170-4155 | |
| ChemiDoc MP System | Bio-Rad | 170-8280 | |
Références
- Aldridge, G. M., Podrebarac, D. M., Greenough, W. T., Weiler, I. J. The use of total protein stains as loading controls: an alternative to high-abundance single-protein controls in semi-quantitative immunoblotting. J. Neurosci. Methods. 172 (2), 250-254 (2008).
- Bauer, D. E., Haroutunian, V., McCullumsmith, R. E., Meador-Woodruff, J. H. Expression of four housekeeping proteins in elderly patients with schizophrenia. J. Neural. Transm. 116 (4), 487-491 (2009).
- Castaño, Z., Kypta, R. M. Housekeeping Proteins: Limitations as References During Neuronal Differentiation. Open Neurosci. J. 2, 36-40 (2008).
- Colella, A. D., Chegenii, N., Tea, M. N., Gibbins, I. L., Williams, K. A., Chataway, T. K. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal. Biochem. 430 (2), 108-110 (2012).
- Cully, T. R., Edwards, J. N., Friedrich, O., Stephenson, D. G., Murphy, R. M., Launikonis, B. S. Changes in plasma membrane Ca-ATPase and stromal interacting molecule 1 expression levels for Ca2+ signaling in dystrophic mdx mouse muscle. Am. J. Physiol. Cell Physiol. 303 (5), (2012).
- Dittmer, A., Dittmer, J. Beta-actin is not a reliable loading control in Western blot analysis. Electrophoresis. 27 (14), 2844-2845 (2006).
- Dutka, T. L., Lamboley, C. R., McKenna, M. J., Murphy, R. M., Lamb, G. D. Effects of carnosine on contractile apparatus Ca2+ sensitivity and sarcoplasmic reticulum Ca2+ release in human skeletal muscle fibers. J. Appl. Physiol. 112 (5), 728-736 (2012).
- Elliott, S., Busse, L., Swift, S., McCaffery, I., Rossi, J., Kassner, P., Begley, C. G. Lack of expression and function of erythropoietin receptors in the kidney. Nephrol. Dial. Transplant. 27 (7), 2733-2745 (2012).
- Eslami, A., Lujan, J., Western, Blotting: Sample Preparation to Detection. J. Vis. Exp. (44), (2010).
- Ferguson, R. E., Carroll, H. P., Harris, A., Maher, E. R., Selby, P. J., Banks, R. E. Housekeeping proteins: a preliminary study illustrating some limitations as useful references in protein expression studies. Proteomics. 5 (2), 566-571 (2005).
- Greer, S., Honeywell, R., Geletu, M., Arulanandam, R., Raptis, L. Housekeeping genes; expression levels may change with density of cultured cells. J. Immunol. Methods. 355 (1-2), 76-79 (2010).
- Gürtler, A., Kunz, A., Gomolka, M., Hornhardt, S., Friedl, A. A., McDonald, K., Kohn, J. E., Posch, A. Stain-Free Technology as Normalization Tool in Western Blot Analysis. Anal. Biochem. 433 (2), 105-111 (2013).
- Hagiwara, M., Kobayashi, K., Tadokoro, T., Yamamoto, Y. Application of SYPRO Ruby- and Flamingo-stained polyacrylamide gels to Western blot analysis. Anal. Biochem. 397 (2), 262-264 (2010).
- Heidebrecht, F., Heidebrecht, A., Schulz, I., Behrens, S. E., Bader, A. Improved semiquantitative Western blot technique with increased quantification range. J. Immunol. Methods. 345 (1-2), 40-48 (2009).
- Jensen, R. B., Ozes, A., Kim, T., Estep, A. Kowalczykowski SC BRCA2 is epistatic to the RAD51 paralogs in response to DNA damage. DNA Repair. , (2013).
- Lanoix, D., St-Pierre, J., Lacasse, A. A., Viau, M., Lafond, J., Vaillancourt, C. Stability of reference proteins in human placenta: general protein stains are the benchmark. Placenta. 33 (3), 151-156 (2012).
- Larkins, N. T., Murphy, R. M., Lamb, G. D. Influences of temperature, oxidative stress, and phosphorylation on binding of heat shock proteins in skeletal muscle fibers. Am. J. Physiol. Cell Physiol. 3 (6), (2012).
- Laurie, K. J., Dave, A., Straga, T., Souzeau, E., Chataway, T., Sykes, M. J., Casey, T., Teo, T., Pater, J., Craig, J. E., Sharma, S., Burdon, K. P. Identification of a Novel Oligomerization Disrupting Mutation in CRYΑA Associated with Congenital Cataract in a South Australian. , (2012).
- Li, X., Bai, H., Wang, X., Li, L., Cao, Y., Wei, J., Liu, Y., Liu, L., Gong, X., Wu, L., Liu, S., Liu, G. Identification and validation of rice reference proteins for western blotting. J. Exp. Bot. 62 (14), 4763-4772 (2011).
- Liu, N. K., Xu, X. M. Beta-tubulin is a more suitable internal control than beta-actin in western blot analysis of spinal cord tissues after traumatic injury. J. Neurotrauma. 23 (12), 1794-1801 (2006).
- Lowe, D. A., Degens, H., Chen, K. D., Alway, S. E. Glyceraldehyde-3-phosphate dehydrogenase varies with age in glycolytic muscles of rats. J. Gerontol. A Biol. Sci. Med. Sci. 55 (3), 160-164 (2000).
- Mollica, J. P., Dutka, T. L., Merry, T. L., Lamboley, C. R., McConell, G. K., McKenna, M. J., Murphy, R. M., Lamb, G. D. S-glutathionylation of troponin I (fast) increases contractile apparatus Ca2+ sensitivity in fast-twitch muscle fibres of rats and humans. J. Physiol. 590, 1443-1463 (2012).
- Murphy, R. M., Dutka, T. L., Horvath, D., Bell, J. R., Delbridge, L. M., Lamb, G. D. . Ca2+-dependent Proteolysis of Junctophilin 1 and Junctophilin 2 in Skeletal and Cardiac. 591, 719-729 (2012).
- Neill, U. S. All Data are not created Equal. J. Clin. Invest. 119, 224 (2009).
- Pérez-Pérez, R., López, J. A., García-Santos, E., Camafeita, E., Gómez-Serrano, M., Ortega-Delgado, F. J., Ricart, W., Fernández-Real, J. M., Peral, B. Uncovering suitable reference proteins for expression studies in human adipose tissue with relevance to obesity. PLoS One. 7 (1), (2012).
- Rocha-Martins, M., Njaine, B., Silveira, M. S. Avoiding Pitfalls of Internal Controls: Validation of Reference Genes for Analysis by qRT-PCR and Western Blot throughout Rat Retinal Development. PLoS One. 7 (8), (2012).
- Romero-Calvo, I., Ocón, B., Martínez-Moya, P., Suárez, M. D., Zarzuelo, A., Martínez-Augustin, O., de Medina, F. S. Reversible Ponceau staining as a loading control alternative to actin in Western blots. Anal. Biochem. 401 (2), 318-320 (2010).
- Said, H. M., Polat, B., Hagemann, C., Anacker, J., Flentje, M., Vordermark, D. Absence of GAPDH regulation in tumor-cells of different origin under hypoxic conditions in-vitro. BMC Res. Notes. 13 (2), 8 (2009).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative western blots. Exp. Anim. 60 (2), 193-196 (2011).
- Welinder, C., Ekblad, L. Coomassie staining as loading control in Western blot analysis. J. Proteome Res. 10 (3), 1416-1419 (2011).
- You, J., Hodge, C., Wen, L., McAvoy, J. W., Madigan, M. C., Sutton, G. Using soybean trypsin inhibitor as an external loading control for Western blot analysis of tear proteins: application to corneal disease. Exp. Eye Res. 99, 55-62 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon