Method Article
שיטה חדשנית לExosome כימות ומדידה גודל
In This Article
Summary
A method for isolation of exosomes from whole blood and further analysis by nanoparticle tracking using a semi-automatic instrument is presented in this article. The presented technology provides an extremely sensitive method for visualizing and analyzing particles in liquid suspension.
Abstract
Although the biological importance of exosomes has recently gained an increasing amount of scientific and clinical attention, much is still unknown about their complex pathways, their bioavailability and their diverse functions in health and disease. Current work focuses on the presence and the behavior of exosomes (in vitro as well as in vivo) in the context of different human disorders, especially in the fields of oncology, gynecology and cardiology.
Unfortunately, neither a consensus regarding a gold standard for exosome isolation exists, nor is there an agreement on such a method for their quantitative analysis. As there are many methods for the purification of exosomes and also many possibilities for their quantitative and qualitative analysis, it is difficult to determine a combination of methods for the ideal approach.
Here, we demonstrate nanoparticle tracking analysis (NTA), a semi-automated method for the characterization of exosomes after isolation from human plasma by ultracentrifugation. The presented results show that this approach for isolation, as well as the determination of the average number and size of exosomes, delivers reproducible and valid data, as confirmed by other methods, such as scanning electron microscopy (SEM).
Introduction
הפונקציה של exosomes במחזור המדויקת נשארה לא ידועה לתקופה ארוכה של זמן. אפילו עכשיו מנגנון נתיב המלא של exosomes לא מובן לחלוטין. מאז exosomes לשאת אנטיגנים, חלבונים ו- RNA (mRNA ומירנה) המתייחס לתא שלהם ההורים ממוצא, תפקידם כמשדרי איתות תאי תאים יש בעיקר ניתנו עדיפות.
שיטות שונות רבות תוארו בספרות לבידוד וזיהוי כמותי של exosomes 1,2. עם זאת, לא הושגה הסכמה על "תקן זהב". בינתיים רוב המדענים הפועלים בתחום מחקר exosome מסכימים ששיטה של בידוד עקבי היא מוצדקת מאוד כדי להשיג רמה גבוהה יותר של השוואתיים בין דוחות ומחקרים שונים.
מיון הקרינה מופעל תאים (FACS) הוא הכלי הנפוץ והשכיח ביותר לניתוח exosome 3. FACS יש בןefit ש, באמצעות תיוג הקרינה, ניתן להשוות תאים ממקורות שונים בצעד אחד. החסרונות העיקריים של FACS הם ששיטה זו אינה רגישה מספיק כדי לזהות חלקיקים קטנים מ -0.5 מיקרומטר 4, ואילו exosomes הן בדרך כלל בין 30-120 ננומטר בקוטר 5, אפילו פחות כדי למדוד את הגודל שלהם.
במיקרוסקופ אלקטרונים סורק (SEM) ומיקרוסקופי אלקטרונים הילוכים (TEM) הם כלים אחרים לניתוח גודל חלקיקים ומורפולוגיה של exosomes. עם זאת, שני SEM וTEM החסרון כי הכנת הדגימות היא, בשתי השיטות כרוכות בצעדים עתיר עבודת זמן רב וכל אחד יש סיכון מסוים של דור חפץ. לא השיטה מתאימה לתפוקת מדגם גבוהה ואפיון של כמה אלפי חלקיקים בודדים של מדגם אחד. יתר על כן, ניתוח כמותי לשגרה יומית קלינית שבו דגימות יש לעתים קרובות כדי להיות מנותח בו זמנית, או לפחות בפרק זמן קצר מאוד הואקשה לביצוע. טכניקות דור חדשות עכשיו מאפשרות לנו לנתח exosomes ללא עבודה אינטנסיבית לפני ההכנה (SEM למשל, איכות הסביבה). הטכניקות המודרניות אלה הן עדיין לא נוחים לניתוח השעיות נפח גדולים המכילות exosomes לקבוע מספר הממוצע שלהם והתפלגות גודל 6.
שיטה נוספת רגישה מאוד להדמיה וניתוח של exosomes היא ניתוח מעקב ננו-חלקיקים (נת"ע). שיטה זו מנצלת את שני עקרונות שונים של פיסיקה. ראשית, חלקיקים מזוהים על ידי האור מפוזר כאשר הם מוקרנים עם קרן לייזר. התופעה השנייה ידועה בשם התנועה בראונית, לפיה דיפוזיה של חלקיקים שונים בהשעית נוזל עומד ביחס הפוך לגודלם. במקרה האחרון התנועה תלויה גם בטמפרטורה והצמיגות של הנוזלים. עם זאת, שיעור זה קשור באופן ישיר לגודל חלקיקים ומשמש את נת"ע. באמצעות רךניתוח מבוסס-ware, תמונות דיגיטליות של אור מפוזר מחלקיקים בודדים נרשמות. חלקות של כתמים מפוזרים אור ומהירות תנועה שלהם לספק נתונים המאפשרים קביעת ספירת חלקיקים כוללת והפצת גודל. טכניקה זו היא חזקה במיוחד לניתוח חלקיקים בקוטר ממוצע של פחות מ -100 ננומטר.
מדידות הגודל וריכוז מבוצעות עם ראונית ZetaView ואלקטרופורזה Motion Video ניתוח מיקרוסקופים. זהו מכשיר אוטומטי למחצה שולחן ננו-חלקיקים העליונים ניתוח לדגימות נוזליים (להלן ככלי מעקב אחר החלקיקים). זה מורכב של מנתח מעקב החלקיקים, כמו גם מחשב נייד עם התוכנה המשמשת לניתוח נתונים. דגימות ביולוגיות הטרוגנית הן כמתאימות לשיטה זו כמתלים הומוגנית יותר של חלקיקים אורגניים. מיקרוסקופ פיזור לייזר עם מצלמת וידאו משמש לזיהוי של חלקיקים ולobservation של תנועתם. בעוד ציר מיקרוסקופ הוא אופקי וממוקד לערוץ התא המלא בהשעיה מכילה exosomes, קרן הלייזר בכיוון אנכית. החלקיקים מוקרנים על ידי פיזור לייזר האור, אשר נרשם תחת 90 מעלות במצלמת וידאו דיגיטלית באמצעות מיקרוסקופ (איור 1). עוצמת האור המפוזר מאפשרת תצפית של חלקיקים גדולים יותר בקוטר 60 ננומטר. בסביבה כזו הבהירות של חלקיק היא לא האינדיקציה היחידה של גודל חלקיקים. כאשר אין שדה חשמלי מוחל, תנועת חלקיקים כדלקמן רק תנועה בראונית ועשויה לשמש כמדד לחישוב גודל חלקיקים. עם זאת, המכשיר הוא גם מסוגל החלת שדה חשמלי על פני ערוץ התא. כאשר נתון תחום זה, את הפוטנציאל, הקוטביות ורמת יונית-אחראי exosomes המושעה להיות גורמים נוספים לכיוון התנועה שלהם. מהירות וכיוון בתוצאת מו electrophoreticהיסטוגרמה bility.
תוך מציאת שיטה אופטימלית לניתוח exosomes המבודד בעיה אחת, עוד אחד נמצא בבידוד היעיל של exosomes מהתחומים שונים, כגון דם, מיימת, שתן, חלב, מי שפיר או תקשורת סלולארי. שיטות שונות תוארו עד כה, אשר מבוססות על ultracentrifugation 1, ריאגנטים תעשייתיים הפרדה (כגון Exoquick) 7, חרוזים מגנטיים לאנטיגן העסקת הפרדה 8 או 9 אולטרה שלבים.
בפרוטוקול זה אנו מראים את כל התהליך של בידוד exosome באמצעות ultracentrifugation ולהראות כיצד לנתח את exosome כתוצאה מכיל השעיה באמצעות מכשיר מעקב אחר חלקיקים. שיקולים ספציפיים לניתוח exosomes נגזר בינוני פלזמה או תרבית תאים האנושיות מסופקים.
Protocol
הערה: הניסויים שהוצגו בעבודה זו אושרו על ידי הדירקטוריון האתי המוסדי של אוניברסיטת דיסלדורף.
1. הכנת Exosome
- לאסוף את כל דם בצינורות 3 ציטראט באמצעות venipuncture (כולל של 9 מיליליטר). שופך את הדם לתוך צינור פלקון 15 מיליליטר.
- צנטריפוגה המדגם ב 1500 XG במשך 20 דקות ב 4 ° C ליזום הפרדה של תאי פלזמה. מעביר את supernatant לצינור בז 15 מיליליטר חדש.
- צנטריפוגה המדגם ב2,800 XG במשך 20 דקות ב 4 ° C כדי להסיר את כל התאים מפלזמה (פלזמה תא ללא; CFP). העבר את CFP לצינורות ultracentrifugation, 1 מ"ל לכל צינור.
- צנטריפוגה ב100,000 XG למשך 90 דקות ב 4 ° C כדי לרוקן exosomes. הסר 900 μl של supernatant. מחדש להשעות את גלולה בצינור ultracentrifugation 100 μl שנותר. להוסיף 900 μl PBS.
- צנטריפוגה שוב ב100,000 XG במשך 30 דקות ב 4 מעלות צלזיוס. הסר 900 μl של supernatant. מחדש להשעות את גלולה עם 100 μl שנותר.
- העברה 5 עד 20 μl מחדש השעיה ב -40 מיליליטר מים מזוקקים. סנן את ההשעיה דרך מסנן 450 ננומטר להפריד exosomes מחלקיקים גדולים יותר. השתמש השעיה סופית למדידת חלקיקים.
2. הפעלת נוהל של החלקיקים המעקב Instrument
- הפעל את התכנית על ידי לחיצה כפולה על התוכנה-הסמל. לחץ על כרטיסיות תוכנה השונות ("צ'ק תא", "מדידה", "ניתוח") כדי לעבור ביניהם בכל הפרוטוקול.
- בצע את ההוראות שעל המסך ליישום אוטומטי של הליך ההפעלה. בחר בתיבות עבור שניהם בדיקת איכות התא ויישור אוטומטי.
הערה: או של השלבים הבאים ניתן לחזור בנפרד במידת צורך על ידי לחיצה על לחצן () או (ב) בכרטיסיית "תא הבדיקה". - פתח הכניסה ופתח יציאה של מכשיר נת"ע ולהזריק 10 מ 'l מים מזוקק על ידי מזרק לתוך ערוץ התא דרך נמל הכניסה. סגור את פתח היציאה כסכום האחרון של מים שהוזרק. מניחים כוס תחת פתח היציאה לאיסוף פסולת פתרון. ודא שתא המדידה הוא ללא בועות אוויר ולא מזרק בועות אוויר לתוך המערכת. סגור את נמל הכניסה באופן מיידי.
- לבצע את בדיקת איכות תא על ידי לחיצה על "אישור". התוכנה תציג את התוצאות באיכות התא לאחר מספר שניות.
- אם כל חלקיקים עדיין הם דמיינו במסך החי-המבט של התוכנה או אם התוצאה של בדיקת האיכות היא טובה או גרועה רק, חזרו על שלב 2.3 עד החלקיקים שנותרו יוסרו מתא המדידה. גם לחזור על שלב 2.3 לאחר כל מדידה, כדי למנוע הצטברות של חלקיקים. אם חוזר על הזרקת מים המזוקקת ותא בדיקה אינו מייצרת תוצאה "טובה", המשך 2.9.
- הכן השעיה שליטה המכילה pol בגודל nm 200 האחידחלקיקי ystyrene לשמש כדי ליישר את המוקדים של הלייזר ומיקרוסקופ. הוסף טיפה אחת של תרכיז ההשעיה, הניתנת על ידי יצרן המכשיר, 500 מיליליטר של מים מזוקקים כדי לקבל את הריכוז הנדרש כך ש600 ± 100 חלקיקים מוצגים כל מסך בשידור החי-הנוף.
- להזריק את ההשעיה היישור למכשיר נת"ע כמתואר בשלב 2.3. לחץ על "אישור" כדי להתחיל יישור אוטומטי, שיגרתי אוטומטי דרכו במערכת באופן אוטומטי למצוא את המיקום האופטימלי של שני מוקדים.
- כאשר מופיעה הודעה לפיה המערכת מוכנה כעת לניסויים, לחץ על אישור כדי להתחיל את המדידה.
- מדי פעם, לנקות את ערוץ התא באופן ידני בין ניסויים על ידי שטיפת התא עם פתרון 30% אתנול. נקה את הערוץ בכל פעם שהתוכנה מציגה דוח שגיאות אוטומטי.
3. מדידה של מדגם
- לשטוף את הערוץ עם מים מזוקקים לפני eaמדידת ch מדגם (כמתואר בשלב 2.3).
- להזריק את ההשעיה exosome (מוכנה בסעיף 1) לערוץ, כפי שמתואר בשלב 2.3.
- להתאים את הפרמטרים העיקריים הבאים בתוכנה בהתאם לצורך:
- רגישות. כדי למצוא את טווח הרגישות האופטימלי, לחץ על "מספר החלקיקים לעומת רגישות" כדי להציג עקומה לחלקיקים שנמדדו בכל מסך לרמות רגישות שונות. בחר רמת רגישות לפני השיפוע המרבי של העקומה. רמת רגישות גבוהה יותר מאפשרת הדמיה של חלקיקים יותר קטנים, אלא גם מגבירה את נושאים הקשורים לרעשי רקע.
- בהירות מינימאלית. בחר בהירות החל מ -20 למדידת exosome להשתמש בפונקציה זו כמסנן. להסדיר בפרמטר זה עד ריק החוצה בעוצמה חלקיקי פיזור האור. לווסת אותו כדי להגביר חלש פיזור חפצים. להשתנות בהירות בהתאם לצורך לאורך כל הניסוי.
הערה: חלקיקים הקלים כלפיזור חזק מדי חפיפה וניתן לשלול מהניתוח בטעות. - גודל מינימום והמקסימום. להגדיר מסנן דיגיטלי לחסל רעש פיקסל ופיזור לא רצוי מחלקיקים גדולים מדי על ידי ויסות הגודל המינימאלי ומקסימאלי. השתמש במגוון של 10 עד 500 פיקסלים למדידת exosomes.
- תריס. התאם את משך זמן שהמצלמה פתוחה ל1 / 300 שניות.
- לחיות פרמטרים לקרוא את:
- מעבר בין דיגיטלי ומודוס תצוגה אנלוגי בכל נקודה על ידי לחיצה על הכפתור "Live-התמונה".
- לאורך כל הניסוי, לפקח על הבר עצמת פיזור, המציג את מצב הרוויה של המדגם כמחוון צבע מקודד. לא לנתח exosomes אם שורת הפיזור היא אדומה. במקרה כזה לדלל עוד יותר את המדגם כדי להימנע מתופעה זו. אם תנאי הניסוי אוסר מניפולציה של ההשעיה המדגם, מטה-להסדיר את הרגישות או-להסדיר את הבהירות בתוכנה-settings כדי לשפר את תוצאות המדידה.
הערה: כאשר דגימות עם ריכוז גבוה מאוד של חלקיקים מנותחות הפיזור יהיה הפתיל חלקיקים בודדים והם נספרים כחלקיק אחד בודד. - שים לב למספר החלקיקים נספרו בשדה ראייה מהתצוגה.
- לחץ על הלשונית "המדידה".
- בחר הגדרות במערך "האפשרויות לרוץ".
- לפני כל רכישה, בחר "תנועת המחאה" לבדיקה להיסחף חלקיקי בדיקה חוזרת ונשנית. בצע את הבדיקה לפחות פעם אחת לפני שמתחיל כל הניתוח. אם להיסחף גבוה מ -20 מיקרומטר / sec, לחכות לפני שתמשיך המדידה כך שהמדגם מפסיק לזרום.
- בחר את מספר הניסויים (5) והשהיית הזמן ביניהם (0).
- לבצע "בדיקה מדגמית" במידת צורך. בדיקה זו היא חלק מהיישור האוטומטי בהליך להתחיל וניתן לחזור לאחר מכן במידת הצורך.
- לבסוף לחץ על הכפתור "רכישת וידאו לרוץ". בחלון החדש, להגדיר את מספר המחזורים (15) ומספר משרות מדידה (11).
הערה: ראש הלייזר ומיקרוסקופ ניתן להעביר לנתח את מספר החלקיקים בשעה 11 בתנוחות שונות. בהתאם לדרישת ניסיוני, להחליט אם הניסוי צריכה להתבצע על עמדה אחת או בעמדות שונות.- לאשר את משך הזמן המינימלי חלקיקים יש להיות במעקב לייספר כחלקיק אחד בודד על ידי הגדרת הרזולוציה וידאו (הנמוך). תוצאות רזולוציה נמוכות יותר בזמן קצר יותר מעקב.
- בחר שם קובץ ולחץ על "אישור" כדי להתחיל מדידה.
4. פרשנות של התוצאות
- הצג את התוצאות הבאות ופרמטרים המוצגים לאחר מדידה בכרטיסיית "תוצאות": (1) מספר כולל של חלקיקים לייחס, (2) מספר ממוצע של חלקicles למשרה, ו- (3) ריכוז חלקיקים.
- להציג את הטבלה ממוצעת התוצאה ליחס המספרי של גודל חלקיקים (קוטר, שטח ונפח) לשיעור של מספרי חלקיקים, כמו גם ערכים של ממוצע ובידול סטנדרטי.
- השתמש בטבלת ניתוח שיא אם שיא אחד או יותר קיים בניתוח הגרפי. טבלה זו מציגה את ההתפלגות של חלקיקים שהם קטנים יותר מאשר השיא הראשון או שני בהתאמה.
- הצג את הגרף מחושב לאחר המדידה כדי לראות הפצה של חלקיקים לפי גודל. השתמש בסמלים במצב התצוגה ומעל הגרף כדי לשנות את ההגדרות.
תוצאות
המדגם המשמש להפגנה זה מראה הגדרה אופטימלית למדידה עם רגישות של 85%, לפני השיפוע המרבי של עקומת הרגישות (איור 2). הבהירות, דקות / ערכי מקסימום נבחרו כמומלץ בפרוטוקול. ריכוז של 5.3 חלקיקים / ml x 10 6 נמדדו, ואילו הגודל הממוצע של החלקיקים היה 0.149 מיקרומטר, רובם היו 0.137 מיקרומטר.
הערכים שהתקבלו לאחר המדידה ניתן לשמור בדו"ח עם פורמט קובץ של Pdf או כ.txt ליצוא למסד נתונים. הגרף יכול להיות מותאם כמועדף כפי שתואר בפרוטוקול (סעיף 4). רצף הווידאו נשמר גם וניתן להשתמש בם לשימוש מאוחר יותר מחדש ניתוח off-line. עם זאת, בניתוח off-line כגון, ההגדרות מראש רכישת המצלמה לא ניתן לשנות למפרע.
כדי למצוא את ההגדרות אופטימליות עבור פרמטר מדידה, אנחנו כאן לתאר האופטימיזציה דואר של הגדרות מכשיר על הדוגמא של תקן גודל קלקר 100 ננומטר. ההשפעה של שני פרמטרים, רגישות ודקות / גודל מקסימלי על הפצת תמונת וידאו וגודל חלקיקים נדונה בפירוט. כל הפרמטרים האחרים מסוכמים בטבלה 1.
רושם חזותי של ההשפעה של רגישות (הנעה 50-94) על תמונות אנלוגיות ודיגיטליות הוא מדמיין באיור 3. המידע כמותי נגזר מהתמונות מוצג באיור 4, המבוסס על ההגדרות בטבלה 1, גודל Min = 5 וגודל מקס = 200. מערכת יחסים אופייניים למספר החלקיקים שאותרו מול הרגישות מוצג באיור 4 א. בין 50 ל -90, מספר החלקיקים זוהו עלייה ברגישות ובעלה באופן דרמטי לרגישויות> 90. טווח אופטימלי של רגישות נמצא בין 66 ו -86 (א). הפצות גודל חלקיקים שהושגו עם DIFהגדרות רגישות שונה זו מוצגות באיור 4. הפצות גודל חלקיקים מייצגות את הממוצע של שלוש מדידות בודדות. לנמוכה מדי רגישות (רגישות = 62, עקומה אדומה) רק כמה חלקיקים נותחו וכתוצאה מכך בסטטיסטיקה די גרועה. מספר החלקיקים ניתחו גדל ברגישות ובהגיע אופטימלי בין 70 (עקומה צהובה) ו -86 (עקומת שיזוף). בהמשך הגדיל את יתרון הרגישות להידרדרות של התפלגות גודל חלקיקים עם מספר החלקיקים יורדים והתפלגות גודל הסטה לכיוון גדלים קטנים יותר (רגישות = 94, עקומה כחולה). איור 4C מראה את המגמה של קוטר x50 מבוסס המספר (50% מ חלקיקים קטנים יותר בקוטר זה) כפונקציה של רגישות. במרווח בצבע בז ', RSD של גודל חלקיקים היה פחות מ -8% ותואם את המרווח האופטימלי בא האזורים האדומים מצביעים RSD> 8% כתוצאה מנתונים סטטיסטיים עלובים (רגישות נמוכה מדי) או distri הרחבbutions עם מעבר לגדלים קטנים יותר (רגישות גבוהה מדי).
ההגדרות של גודל מינימאלי וגודל המקסימלי הן מסננים להחיל תמונות דיגיטליות על מנת להסיר חלקיקים בגדלים קטנים יותר מגודל נקודת מינימום וגדולים יותר מגודל מקסימלי. בשל היכולת לפזר אור, חלקיקים יוצרים נקודה בגודל מסוים בתמונה דיגיטלית. גודלו של המקום נמדד כמספר הפיקסלים (פיקסלים). כאשר חלקיק מפזר אור טוב מאוד (למשל, חלקיקים> 200 ננומטר או אגרגטים), גודל הנקודה הוא די גדול, למשל,> px 500. גודל הנקודה הוא די קטן (למשל, <10 px) לחלקיקים קטנים (למשל, <20 ננומטר) בתלות בחומר החלקיקים. גודל נקודה (פיקסלים) עשוי שלא להיות להחלפה עם גודל חלקיקים (ננומטר) כפי שהם אינם זהים, ואין קשר ישיר בין שני המשתנים הללו. אופטימיזציה של גודל מינימום ומקס מאפשרת למשתמש לסנן אובייקטים לא רצויים כגון agglomerates (גודל מקסימלי) או קטןאובייקטים כגון רעשי רקע (גודל מינ '). ההשפעה של גודל מינימום / מקסימום בגודל חלקיקי ההפצה של סטנדרטי בגודל 100 ננומטר מוצגת באיור 4D (רגישות = 82). כאשר המרווח מוגדר גדלי נקודה קטנים (למשל, דקות = 1, מקסימום = 52; עקומה כתומה), מספר החלקיקים ניתחו מצטמצם וקוטר x50 מבוסס המספר מעט השתנה לכיוון גדלים קטנים יותר. הגדרה לכתמים גדולים יותר (מינימום = 40, מקסימום = 1000, עקומה אדומה) תוצאות בהתפלגות גודל חלקיקים רחבות הוסטה לעבר גדלים גדולים יותר. על מנת לקבל את המספרים מוחלט שווים של חלקיקים, גבולות המרווח של הפצות שני כתומות ואדומות הותאמו כדי להתאים 80 חלקיקים. ההפצה עם הגדרות אופטימליות (דקות = 5, מקסימום = 200; עקומת שיזוף) מורכבת מחלקיקים 360.
סדרת ניסויים מוצלחים בוצעה עם exosomes מבודד על ידי ultracentrifugation ונמדד על ידי נת"ע שימוש במערכת שהוצגה. נתונים שהתקבלו היו מאודעולה בקנה אחד ואישרתי ברמה גבוהה של שחזור. שיטות בידוד אחרות צריכים להראות תוצאות דומות. עם זאת, צעד הדילול זוהה כצעד קריטי במיוחד והשפעתה על המספרים הכולל המחושבים של חלקיקים יש הערכה מחדש.
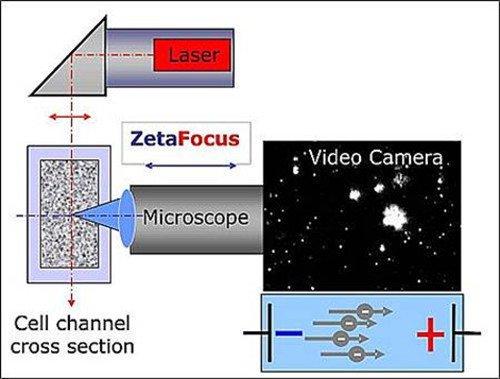
איור 1. סכמטי של ההתקנה של נת"ע. מיקרוסקופ / ציר הווידאו וקרן לייזר מכוון orthogonally זה לזה, שחצו בחתך ערוץ תא. האור מפוזר על ידי החלקיקים מוצג בחלון "חי-הנוף" של התוכנה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
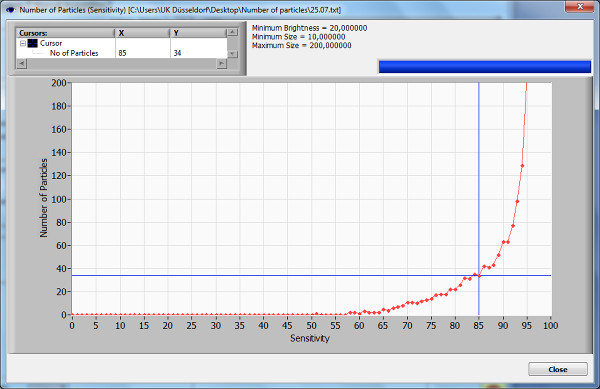
מספר איור 2. חלקיקים לעומת עקומת רגישות. מספר החלקיקים לעומת עקומת רגישות מציג את החלקיקים בעמדה אחת ברגע אחד במהלך סריקת רגישות אוטומטית. הדמיה גרפית זה משמשת כדי לקבוע את ההעדפות הטובות ביותר עבור המדידות הראשוניות. ערך רגישות נבחר לפני השיפוע המרבי של הגרף. חשוב לזכור כי ממצאים אינם בוטלו בניסוי בדיקה זו ויכולים להשפיע על הגרף. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. השפעה של רגישות על אנלוגי ותמונה דיגיטלית. יזואליזציה של חלקיקים על מסך התצוגה החיה מוצגת לרגישויות בין 50 ל 94 לאנלוגית (שורה העליונה)צפיות ד דיגיטליות (בשורה התחתונה). כאשר הרגישות נמוכה מדי, רק כמה חלקיקים מזוהים (משמאל). ברגישות אופטימלית החלקיקים מופיעים נקודות בודדות כמבודדות היטב אחד מהשני (באמצע). בחלקיקי רגישות גבוהים יחסית יחד למזג מובילים לאיכות תמונה ירודה (מימין). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
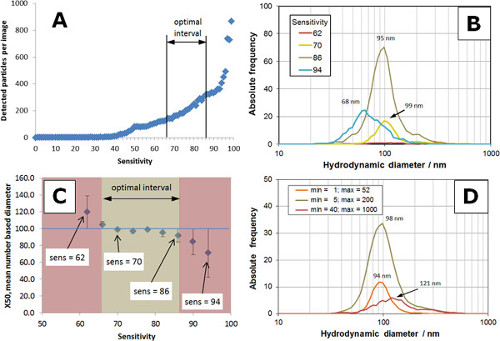
השפעה של איור 4. דקות רגישות והגדרות גודל מרביות למדגם חלקיקי פוליסטירן 100 ננומטר שליטה (א) מגרש של רגישות לעומת מספר מזוהה של חלקיקים.; המרווח האופטימלי הוא 66-86, לפני השיפוע המרבי של העקומה. הפצות גודל (B) חלקיקים שהושגו עם כמה הגדרות רגישות (62-94); גרפים לנמוכים מדי (62) או גבוה מדי (94) רגישות אינה ממצה את התפלגות גודל חלקיקים במדגם שליטת קלקר 100 ננומטר. קוטר x50 מספר מבוסס לעומת רגישות (ג); השגיאה של x50 במרווח בצבע בז 'היא פחות מ 8%, מרווח אופטימלי הוא מ -66 ל86. (ד) השפעה של גודל מינימאלי והמקסימאלי על התפלגות גודל חלקיקים; פרמטרים אופטימליים (דקות = 5 ומקסימום = 200) ללכוד את החלוקה הנכונה למדגם השליטה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| פרמטרים טרום רכישה | |
| רגישות | משתנה |
| תריס | 40 |
| קצב פריימים | 30 fps |
| רזולוציה | הייGH |
| מחזורים | 10 |
| רכישות מרובות | 3 |
| עמדה | 1 |
| פרמטרים שלאחר רכישה | |
| דקות בהירות | 30 |
| גודל מקסימלי | משתנה |
| גודל דקות | משתנה |
סיכום 1. טבלה של פרמטרים של לפני ואחרי רכישה להגדרה של מכשיר מעקב אחר חלקיקים.
Discussion
אנחנו מדגימים פרוטוקול מפורט לבידוד exosome מהדם ומעקב ננו-חלקיקים נוכחי כחדשני ושיטה חדשנית למדידת גודל exosome וריכוז בנוזל ביולוגי. בניסויים שהוצגו דם היקפי אדם שימש כמקור exosomes. עם זאת, מקורות אחרים, כגון שתן, כיח, supernatant תרבית תאים, וכו ', יכולים לשמש גם כחומר למבחן.
בהתבסס על השונות הביולוגיות של ריכוז exosome בבני אדם, מבחני מאנשים שונים עשויים כוללים ריכוז להפליא משתנה של exosomes. עם זאת, הריכוז של חלקיקים בבדיקת המבחן הביולוגית עלול להיות השפעה על התוצאות. לכן, יש צורך בגישה אמינה וסטנדרטית לדילול של בדיקות. בשיטה המוצגת הפלזמה exosome מכיל נוצרה מ9 מיליליטר של כל דם היקפי. באמצעות צנטריפוגה ההפרש צעדים גלולה exosome הייתה מבודדת מ פלזמה ו 1 מיליליטר מחדש תלויה 5 מיליליטר מים מזוקקים לתוצאה במדגם העבודה של exosomes המושעה. הגדרה מוגדרת מראש זה סיפקה לנו ריכוז נכון של חלקיקים, כלומר, עוצמת פיזור מתאימה במהלך נת"ע. לצד היבט הנפח ודילול, ההרכב של הפתרונות המשמשים גם הוא בעל חשיבות. יש לנו להשתמש במים מזוקקים במשך מחדש ההשעיה הסופית של exosomes. כמובן, עשויה לשמש גם אמצעי תקשורת שונה לצעד הדילול הסופי, בהתאם לדרישות של ניסיוני ההגדרה. עם זאת, במקרה של מדידות zeta פוטנציאל של פתרונות-יוניים, במיוחד כאשר בודקים דגימות עם קיבולת חציצה, דילול זהיר בתנאים חופשיים מערבולת שימושי. לשם ההשוואה הישירה של דגימות מרובות אנו ממליצים לשמור על אותה רמת דילול עבור כל הדגימות. כל ההגדרות, מלבד הרגישות ורזולוצית וידאו ניתן לשנות לאחר מכן על ידי שימוש בתוכנת ZetaView ניתוח.
"Jove_content"> למרות שהחוקרים מאמינים כי המערכת הציגה במסמך זה כרגע מייצגת את המכשיר המתאים ביותר, זה לא מערכת נת"ע זמינה רק. מספר הדיווחים הקודמים מועסק מערכות אחרות שחלות אותם עקרונות נת"ע אבל מספקים עיצוב מכשיר אחר שהולך יחד עם כמה תכונות שונות 10. אנו מאמינים כי היבטים מעשיים הנוגעים לטיפול במדגם ושחזור של התוצאות הם בעלי חשיבות מרכזית בבחירת הרצף מתודולוגיים להערכת exosome. כמו כן, אנו מאמינים כי מערכת איתור אידיאלית צריכה לחסל גורמים-תלוי משתמש שעלול להפריע לתוצאות של המדידות. גישת ניתוח exosome שמוצג כאן מקיימת את המבחן של טיפול קל לרמה גבוהה. כיתרון נוסף, הניתוח אוטומטי למחצה של הדגימות מתבצע בתהליך מהיר, שהניבו תוצאות בזמן קצר. הדמיה מקוונת של exosomes מסייעת המנתח לgaברעיון מיידי של מאפייני exosome, למשל, ריכוז ברוטו.
בנוסף מאוד פשוט אך אלגנטי לטכניקת המדידה שהוצגה כאן הוא השימוש בנוגדן שכותרתו exosomes והלכידה של קרן הלייזר מפוזרת באמצעות מסנן הקודם מול הגלאי. בדרך זו תת-אוכלוסיות exosome ניתן להבחין על פי אנטיגנים פני השטח ומאפיינים רלוונטיים מבחינה ביולוגית אחרים, כי הם מבחינה טכנית נגישות לצביעת ניאון סלקטיבית.
אחד חסרונות של הגרסה הנוכחית של מכשיר מעקב חלקיקים שלנו הוא העובדה כי ברמות רגישות גבוהות מאוד חפצים כגון רעשי רקע יכולים להיות נוכחים, המבוסס על קיר ערוץ תא. פתרון טכני ושיפור למערכת הנוכחית עשויים להיות זמינים בעתיד הקרוב. על ידי השתקפויות שיטה זו של אור לייזר הפיזור על קיר הערוץ יקטן, ובכך להגדיל הדיוק של האותות הנמדדים ונתונים המתקבלים והוריד את המגבלה של זיהוי.
אף על פי הפרוטוקול המשמש כיום לבידוד exosome מבוסס היטב ויש לו מכשיר מעקב חלקיקים מיושם רזולוציה מדויקת להפליא עם התפלגות גודל נמוכה יותר של 30 ננומטר, אין ערובה לכך שהחלקיקים זוהו אכן exosomes לגמרי נכון. חלקיקים אחרים, כגון שברי תאים מתים או קומפלקסי חלבונים גדולים יותר עשויים גם להיות נוכחים בהשעית exosome ולהוביל לאותות חיוביים כוזבים. שיטה אמינה אחד שבו "זיהום" כזה יכול להיות שלילי עשוי להיות במיקרוסקופ אלקטרונים (EM), או EM שידור או EM סריקה. למרבה הצער, אין סמן כללי וספציפי לexosomes זוהה עד כה, אם כי מספר סמני משטח הציעו בעבר זכה כמות הולך וגדלה של תשומת לב, כוללים tetraspanin (Tspan), CD81, C63, CD9, וכו '11.
"> ללא קשר להתקדמות בעתיד של מחקר על הביולוגיה exosome, בעיקר בכל הנוגע סמנים ספציפיים exosome, הפרוטוקול המוצג כאן יספק שיטה רבת עוצמה לבידוד וזיהוי של exosomes. ריכוז וגודל יכולים להיקבע בקלות בסיוע תוכנה אופנה פשוטה. התוספת של סמני ניאון סלקטיבית או נוגדני fluorophore בשילוב צפוי לשפר עוד יותר את היישומים האפשריים של הגישה שהוצגה של נת"ע.Disclosures
This work was supported by the institutional funds of the Dept. of Cardiovascular Surgery, Medical Faculty, HHU. The publication costs of this study were provided by Particle MetrixGmbH.
Acknowledgements
The authors would like to thank Christina Ballázs, Hug Aubin and Jörn Hülsmann for the critical reading of the manuscript and excellent editorial assistance. Moreover, the authors thank Gisela Mueller for the technical assistance. The authors thank Particle Metrix GmbH for providing the funds covering the publication costs.
Materials
| Name | Company | Catalog Number | Comments |
| Citrate tube | BD | 364305 | BD Vacutainer |
| Distilled water | Braun | 3880087 | Aqua ad iniectabilia |
| Falcon tube | Greiner Bio One | 188271 | PP Tube, Steril 15 ml |
| Ultracentrifugation tube | Beckman | 357448 | Microfuge Tube Polyallomer 1.5 ml |
| Polybead | Polysciences, Inc. | 07304 | 2.6% Solids-Latex Alignment Solution |
| Syringe (Filter) | Braun | 4617053V | 5 ml |
| Syringe (ZetaView) | Braun | 4606051V | 5 ml |
| Needle | BD | 305180 | BD Blunt Fill Needle |
| Filter | Sartorius Stedim | 16555 | Syringe filter, hydrophilic, 450 µm |
| Ultracentrifuge | Beckman | L8-M | Rotor: 70Ti Ser. No E21078 |
| ZetaView | Particle Metrix | PMX 100, Type 101 | |
| Centrifuge | Eppendorf | 5804R | Rotor: A-4-44 |
References
- Thery, C., Amigorena, S., Raposo, G., Clayton, A., Bonifacino, J. S., et al. Chapter 3. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. . Current protocols in cell biology / editorial board. (3.22), (2006).
- Taylor, D. D., Zacharias, W., Gercel-Taylor, C. Exosome isolation for proteomic analyses and RNA profiling. Methods in molecular biology. 728, 235-246 (2011).
- Lasser, C., Eldh, M., Lotvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. , e3037 (2012).
- Konokhova, A. I., et al. Light-scattering flow cytometry for identification and characterization of blood microparticles. Journal of biomedical. 17, 057006 (2012).
- Vlassov, A. V., Magdaleno, S., Setterquist, R., Conrad, R. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials. Biochimica et biophysica acta. 1820, 940-948 (2012).
- Sokolova, V., et al. Characterisation of exosomes derived from human cells by nanoparticle tracking analysis and scanning electron microscopy. Colloids and surfaces. B, Biointerfaces. 87, 146-150 (2011).
- Clayton, A., et al. Analysis of antigen presenting cell derived exosomes, based on immuno-magnetic isolation and flow cytometry. Journal of immunological. 247, 163-174 (2001).
- Cheruvanky, A., et al. Rapid isolation of urinary exosomal biomarkers using a nanomembrane ultrafiltration concentrator. Amer. J. Phys. Renal Phys. 292, F1657-1661 (2007).
- Carr, B., Warren, J. Company profile: NanoSight: delivering practical solutions for biological nanotechnology. Nanomedicine. 7, 1129-1132 (2012).
- Caby, M. P., Lankar, D., Vincendeau-Scherrer, C., Raposo, G., Bonnerot, C. Exosomal-like vesicles are present in human blood plasma. International immunology. 17, 879-887 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved