Method Article
Инновационный метод для экзосома количественной и измерения размера
В этой статье
Резюме
A method for isolation of exosomes from whole blood and further analysis by nanoparticle tracking using a semi-automatic instrument is presented in this article. The presented technology provides an extremely sensitive method for visualizing and analyzing particles in liquid suspension.
Аннотация
Although the biological importance of exosomes has recently gained an increasing amount of scientific and clinical attention, much is still unknown about their complex pathways, their bioavailability and their diverse functions in health and disease. Current work focuses on the presence and the behavior of exosomes (in vitro as well as in vivo) in the context of different human disorders, especially in the fields of oncology, gynecology and cardiology.
Unfortunately, neither a consensus regarding a gold standard for exosome isolation exists, nor is there an agreement on such a method for their quantitative analysis. As there are many methods for the purification of exosomes and also many possibilities for their quantitative and qualitative analysis, it is difficult to determine a combination of methods for the ideal approach.
Here, we demonstrate nanoparticle tracking analysis (NTA), a semi-automated method for the characterization of exosomes after isolation from human plasma by ultracentrifugation. The presented results show that this approach for isolation, as well as the determination of the average number and size of exosomes, delivers reproducible and valid data, as confirmed by other methods, such as scanning electron microscopy (SEM).
Введение
Точное функция циркулирующих экзосом оставалось неизвестным в течение длительного периода времени. Даже сейчас полноценный механизм путь экзосом до конца не изучен. С экзосомы нести антигены, белки и РНК (мРНК и микроРНК), что связывает их с их родителей ячейке происхождения, их функции в качестве передатчиков сигнализации межклеточных в основном уделялось приоритетное внимание.
Многие различные методы были описаны в литературе для выделения и количественного определения экзосом 1,2. Тем не менее, нет единого мнения на "золотого стандарта" не была достигнута. Между тем большинство ученых, работающих в области экзосома исследования соглашаются, что последовательный метод изоляции высоко оправданным для достижения более высокой степени сопоставимости между различными докладов и исследований.
Активацией флуоресценции сортировки клеток (FACS) является наиболее распространенным и широко распространены инструмент для анализа экзосома 3. FACS имеет бенefit, что, с помощью флуоресцентного мечения, клетки различного происхождения могут быть сопоставлены в одну стадию. Основными недостатками являются FACS, что этот метод не достаточно чувствительны, чтобы определить частиц меньше, чем 0,5 мкм 4, в то время как экзосомы как правило, от 30-120 нм в диаметре 5, даже меньше, чтобы измерить их размер.
Сканирующая электронная микроскопия (СЭМ) и просвечивающей электронной микроскопии (ПЭМ) и другие инструменты для анализа размера частиц и морфологии экзосом. Тем не менее, как СЭМ и ТЭМ имеют тот недостаток, что подготовка проб которое отнимает много времени, оба метода включают трудоемкие стадии, и каждая имеет некоторый риск артефактов поколения. Ни метод пригоден для высокой пропускной способности и характеристик нескольких тысяч отдельных частиц одного образца пробы. Кроме того, количественный анализ в клинической повседневной жизни, где образцы часто будут анализироваться одновременно или, по крайней мере, в течение очень короткого периодатрудно выполнить. Методы нового поколения теперь позволяют нам анализировать экзосомы без предварительного напряженной подготовительной работы (например, окружающей среды SEM). Эти современные методы все еще довольно неудобно для анализа больших суспензий, объем, содержащий экзосомы, чтобы определить их среднее число и распределение по размерам 6.
Другим весьма чувствительным методом для визуализации и анализа экзосом является наночастиц отслеживания анализ (NTA). Этот способ использует преимущества двух различных принципов физики. Во-первых, частицы будут обнаружены с помощью света, рассеянного при их облучении лазерным лучом. Второй явление известно как броуновское движение, в соответствии с которым диффузии различных частиц в жидкой суспензии обратно пропорциональна их размеру. В последнем случае движение также зависит от температуры и вязкости жидкости. Тем не менее, этот показатель напрямую связан с размером частиц и используется НТА. Использование мягкойИзделия на основе анализа, цифровые изображения рассеянного света от одиночных частиц записываются. Земельные участки рассеянных световых пятен и их скорость движения обеспечивают данными, которые облегчают определение общего количества частиц и распределением по размерам. Этот метод особенно мощным для анализа частиц со средним диаметром менее 100 нм.
Измерения размеров и концентрации осуществляется с ZetaView броуновского и электрофорез движения видео микроскопического анализа. Это полуавтоматический настольный наночастиц инструмент для анализа жидких образцов (далее, как отслеживая инструмент частиц). Он состоит из отслеживания анализатора частиц, а также ноутбук с программным обеспечением, используемым для анализа данных. Гетерогенные биологические образцы в качестве пригодных для этого метода, как более однородных суспензий неорганических частиц. Рассеяния лазерного излучения микроскопа с видеокамерой, используется для обнаружения частиц и для OBSErvation их движения. В то время как ось микроскопа горизонтально и направлены в канал ячейку, заполненную суспензией, содержащей экзосомы, лазерный луч направлен вертикально. Частицы облучении лазерным разброса света, который регистрируется в соответствии с 90 ° с цифровой видеокамеры с помощью микроскопа (рис 1). Интенсивность рассеянного света позволяет наблюдать частицы большего диаметра 60 нм. В такой обстановке яркость частицы не только указание размера частиц. При отсутствии электрическое поле не приложено, движение частиц только следует броуновское движение, и может служить индикатором для вычисления размера частиц. Тем не менее, прибор также может подаче электрического поля через клеточную канала. При воздействии этой области, потенциал, полярность и уровень ионной заряда взвешенных экзосом стать еще детерминанты направлении их движения. Скорость и результат направление в электрофоретической месяцевность гистограмма.
Хотя найти оптимальный метод для анализа изолированных экзосомы одна проблема, еще один находится в эффективной изоляции экзосом из различных средств массовой информации, таких как кровь, асцит, мочу, молоко, амниотической жидкости или клеток массовой информации. Различные способы были описаны до сих пор, которые основаны на ультрацентрифугирования 1, промышленные реагенты разделения (например, Exoquick) 7, магнитные шарики для антигена, использующей разделение 8 или 9 ультрафильтрации шаги.
В этом протоколе мы демонстрируем весь процесс изоляции экзосома через ультрацентрифугированием и показать, как анализировать полученную экзосома, содержащий суспензию с помощью отслеживания частиц инструмента. Особые соображения для анализа человеческой плазмы или клеточной культуральной среды, полученных экзосом предоставляются.
протокол
ПРИМЕЧАНИЕ: эксперименты, представленные в этой работе были одобрены институциональные этические совета университета Дюссельдорфа.
1. экзосома Подготовка
- Сбор цельной крови в 3 пробирки с помощью цитрата вены (в общей сложности 9 мл). Налейте крови в 15 мл сокола трубки.
- Центрифуга образца при 1500 х г в течение 20 мин при 4 ° С, чтобы инициировать выделение клеток из плазмы. Передача супернатант к новому 15 мл трубки сокола.
- Центрифуга образца при 2800 х г в течение 20 мин при 4 ° С, чтобы удалить все клетки из плазмы (бесклеточной плазмы, CFP). Передача CFP ультрацентрифугированию труб, 1 мл на пробирку.
- Центрифуга при 100000 х г в течение 90 мин при 4 ° С, чтобы истощить экзосомы. Удалить 900 мкл надосадочной жидкости. Повторное приостановить осадок в оставшихся 100 мкл в ультрацентрифугирования трубки. Добавить 900 мкл PBS.
- Центрифуга снова в 100000 мкг в течение 30 мин при 4 ° С. Удалить 900 мкл Суpernatant. Повторное приостановить гранул с остальными 100 мкл.
- Передача от 5 до 20 мкл ресуспендирования в 40 мл дистиллированной воды. Суспензию фильтруют через 450 нм фильтром для отделения экзосомы от крупных частиц. Используйте этот конечной суспензии для измерения частиц.
2. Ввод в эксплуатацию Процедура отслеживания частиц инструмент
- Запустите программу, дважды щелкнув на софт-иконы. Нажмите на различных вкладках программного обеспечения ("Cell Check", "Измерение", "Анализ") для переключения между ними на протяжении протокола.
- Следуйте инструкциям на экране для автоматизированного выполнения процедуры запуска. Установите флажки для обоих проверки качества ячеек и авто выравнивания.
ПРИМЕЧАНИЕ: В любом из этих этапов можно повторить отдельно, если необходимо, нажав кнопку (А) или (В), нажав на вкладке "CHECK клеток". - Откройте входной и выходной порт инструмента NTA и ввести 10 мл дистиллированной воды с помощью шприца в канал клеток через впускное отверстие. Закройте выпускное отверстие, как в прошлом количество воды впрыскивают. Поместите стакан под выпускным отверстием для сбора отработанного раствора. Убедитесь, что измерительная ячейка свободна от пузырьков воздуха и не шприц воздушных пузырьков в системе. Сразу же закрыть входное отверстие.
- Выполните проверку качества клеток, нажав на кнопку "OK". Программное обеспечение будет отображать результаты качества клеток через несколько секунд.
- Если какие-либо частицы все еще визуализируются на экране живого просмотра программного обеспечения, или если результат проверки качества является только хорошим или плохим, повторите шаг 2,3 до остальных частиц удаляются из измерительной ячейки. Также повторите шаг 2,3 после каждого измерения, чтобы избежать накопления частиц. Если повторять инъекцию дистиллированной воды и проверить клетка не производят "хороший" результат, переходите к 2,9.
- Подготовьте управления суспензии, содержащей однородную нм размера Pol 200ystyrene частицы, которые будут использоваться для выравнивания фокусы лазера и микроскопа. Добавьте одну каплю концентрата суспензии, предоставляемая производителем приборов, 500 мл дистиллированной воды, чтобы получить требуемую концентрацию, так что 600 ± 100 частиц отображаемых на экране в прямом зрения.
- Вводят выравнивания суспензии в приборе NTA, как описано в стадии 2,3. Нажмите "OK", чтобы начать автоматический выравнивание, процедуры автоматической, через который система будет автоматически находить оптимальное положение двух фокусов.
- Когда появится приглашение с указанием система теперь готова для экспериментов, нажмите на кнопку ОК, чтобы начать измерение.
- Иногда очистки клеток канал вручную между экспериментами с помощью промывки клетки с 30% -ным раствором этанола. Очистите канал, когда программа отображает автоматический отчет об ошибке.
3. Измерение образца
- Промойте канал дистиллированной водой до еач измерение образца (как описано в стадии 2,3).
- Вводят экзосом суспензии (полученного в разделе 1) и канала, как описано в стадии 2,3.
- Измените следующие основные параметры в программном обеспечении по мере необходимости:
- Чувствительность. Для того, чтобы найти оптимальный диапазон чувствительности, нажмите на кнопку "числа частиц против Чувствительность", чтобы отобразить кривую для измеренных частиц в экране для различных уровней чувствительности. Выбрали уровень чувствительности до максимального наклона кривой. Выше уровень чувствительности позволяет визуализировать более мелких частиц, но также увеличивает вопросы, связанные с фоновым шумом.
- Минимальная яркость. Выберите начальную яркость 20 для измерения экзосом использовать эту функцию в качестве фильтра. Регулировать этот параметр до пустых решительно частиц рассеивающих свет. Регулировать его вниз, чтобы усилить слабо рассеяния артефакты. Вары яркость по мере необходимости в течение всего эксперимента.
ПРИМЕЧАНИЕ: Частицы, которые СВЕТАрассеивать слишком сильно перекрываются и могут быть исключены из анализа по ошибке. - Минимальная и Максимальный размер. Установите цифровой фильтр для устранения пикселей шума и нежелательных разброс от негабаритных частиц путем регулирования минимального и максимального размера. Используйте диапазон от 10 до 500 пикселей для измерения экзосом.
- Затвор. Отрегулируйте период времени, который находится камера открыты для 1/300 сек.
- Жить считаны параметры:
- Переключение между цифровым и аналоговым зрения модуса в любой момент, нажав на кнопку "Live-образа».
- В течение всего эксперимента контролировать интенсивность рассеяния бар, который отображает состояние насыщения образца в цвет, закодированный индикатора. Не анализируйте экзосомы если бар рассеяния красный. В таком случае дополнительно разбавить образец, чтобы избежать этого явления. Если условия эксперимента запрещает манипуляции образца суспензии, вниз регулировать чувствительность или до-регулировать яркость в программе-хettings, чтобы улучшить результаты измерений.
ПРИМЕЧАНИЕ: Когда образцы с чрезвычайно высокой концентрацией частиц анализируются разброс сольются отдельные частицы, и они считаются одной частицы. - Обратите внимание на количество подсчитанных частиц в поле зрения с дисплея.
- Перейдите на вкладку «Измерение».
- Выберите настройки в "Параметры запуска" массив.
- Перед каждым приобретения, выбора "ПРОВЕРКА движение» для испытания дрейфа частиц в повторной проверки. Выполните проверку по крайней мере, один раз перед началом весь анализ. Если смещение превышает 20 мкм / сек, ждать, прежде чем продолжить измерения таким образом, чтобы образец перестает течь.
- Выберите количество экспериментов (5), а время задержки между ними (0).
- Выполните "образец проверку", если это необходимо. Этот тест является частью автоматического выравнивания в процедуры запуска и может быть повторен затем по мере необходимости.
- Наконец, нажмите на кнопку "Выполнить приобретения видео". В новом окне определите количество циклов (15) и количество позиций измерения (11).
ПРИМЕЧАНИЕ: лазерная головка и микроскоп может быть перемещен анализировать количество частиц в 11 различных положениях. В зависимости от экспериментальной спроса, решить, следует ли выполнять эксперимент на одном положении или на разных позициях.- Подтвердите продолжительность минимального времени частица должна быть отслежены, должны считаться одной отдельной частицы, установив разрешение экрана (LOW). А более низкая разрешения в более короткий срок слежения.
- Выберите имя-файла и нажмите "ОК", чтобы начать измерение.
4. Интерпретация результатов
- Просмотреть следующие результаты и параметры отображаются после измерения на вкладке "Результаты": (1) полное число частиц прослеживается, (2) средняя численность частиicles в положении, и (3) концентрации частиц.
- Просмотр среднюю таблицу результатов численного соотношения размеров частиц (диаметр, поверхности и объема) в процентах от числа частиц, а также значения среднего и стандартного дифференциации.
- Используйте таблицу пик анализа, если более чем один пик существует в графическом анализе. Эта таблица показывает распределение частиц, меньший, чем первый или второй соответственно пика.
- Просмотр графика, рассчитанное после измерения, чтобы увидеть распределение частиц по размеру. Используйте значки в режиме отображения и выше графике, чтобы изменить настройки.
Результаты
Образец, который использовался для демонстрации показывает оптимальные настройки для измерения с чувствительностью 85%, до максимального наклона кривой чувствительности (рис 2). Яркость, мин / макс значения были выбраны в соответствии с рекомендациями в протоколе. Концентрация 5,3 частиц / мл × 10 6 была измерена, в то время как средний размер частиц был 0,149 мкм, большинство из них были 0,137 мкм.
Значения, полученные после измерения могут быть сохранены в отчете в формате файла .pdf или как .txt для экспорта в базу данных. График можно регулировать как предпочтительный, как описано в протоколе (раздел 4). Видеопоследовательность также сохраняется и может быть использован для последующего офф-лайн повторного анализа. Тем не менее, при таком анализе офф-лайн, настройки предварительно приобретение камеры не могут быть изменены ретроспективно.
Для того, чтобы найти оптимальные настройки параметров для измерения мы опишем здесь тысе оптимизация настроек прибора на примере стандартного размера полистирол 100 нм. Влияние двух параметров, чувствительности и мин / макс размера на видеоизображение и распределение размеров частиц обсуждается в деталях. Все остальные параметры приведены в таблице 1.
Визуальное впечатление о влиянии чувствительности (от 50 до 94) на аналоговых и цифровых изображений визуализируется на рисунке 3. Количественное информация, полученная из изображений представлена на рисунке 4, в соответствии с настройками в таблице 1, Минимум = 5 и Максимальный размер = 200. Типичный отношение числа регистрируемых частиц против чувствительности показано на фиг.4А. Между 50 и 90, количество обнаруженных частиц увеличивается с чувствительностью и резко выросли чувствительности> 90. Оптимальный диапазон чувствительности было обнаружено между 66 и 86 (A). Распределение размеров частиц получены с DIFНастройки чувствительности личных показаны на рис 4В. Распределение размера частиц представляют собой среднее из трех отдельных измерений. Для слишком низкой чувствительности (чувствительность = 62, красная кривая) были проанализированы только несколько частиц, в результате чего небогатых статистики. Число анализируемых частиц увеличивается с чувствительностью и достигли оптимума между 70 (желтая кривая) и 86 (TAN кривой). Кроме того увеличил разрыв в счете чувствительности к ухудшению распределения частиц по размерам с числом частиц снижается и распределение по размерам людей в сторону меньших размеров (чувствительность = 94, синяя кривая). На рисунке 4в тенденция основе диаметра номер x50 (50% частицы меньше, чем этот диаметр) как функции чувствительности. В бежевом интервала, RSD размера частиц менее 8% и соответствует оптимальный интервал в А. Красные области указывают RSD> 8% в результате слабой статистики (чувствительность слишком низкая) или широкой DISTRIпределения со сдвигом в сторону меньших размеров (чувствительность слишком высокая).
Настройки Минимум и максимальный размер фильтры, применяемые к цифровых изображений с целью удаления частиц с спот, размер которых меньше, чем Минимум и больше, чем максимальный размер. Из-за способности рассеивать свет, частица создает пятно определенного размера на цифровом изображении. Размер пятна измеряется как количество пикселей (ПВ). Когда частица рассеивает свет очень хорошо (например, частицы> 200 нм или агрегатов), размер пятна довольно большая, например,> 500 пикс. Размер пятна весьма мала (например, <10 пикселей) для малых частиц (например, <20 нм) в зависимости от материала частиц. Размер пятна (ПВ), не могут быть взаимозаменяемыми с размером частиц (нм), поскольку они не являются идентичными, и нет прямой связи между этими двумя переменными. Оптимизация мин и максимальный размер позволяет пользователю отфильтровать нежелательные объекты, такие как агломератов (максимальный размер) и маленькихобъекты, такие как фоновый шум (Минимум). Влияние Мин / Макс Размер по распределению частиц по размерам стандартного размера 100 нм показана на рис 4D (чувствительность = 82). Когда интервал установлен на малых размерах пятна (например, не менее = 1, макс = 52; оранжевый кривая), число анализируемых частиц уменьшается, и на основе диаметр количество x50 слегка смещена в сторону меньших размеров. Установка для больших пятен (мин = 40, макс = 1000; красная линия) приводит к широкому распределению частиц по размерам смещается в сторону больших размеров. Для того чтобы получить равные суммарные количества частиц, границы интервала обоих оранжевый и красный распределений были скорректированы, чтобы соответствовать 80 частиц. Распределение с оптимальными настройками (мин = 5, макс = 200; загар кривая) состоит из 360 частиц.
Ряд успешных экспериментов проводились с экзосом изолированных ультрацентрифугированием и измеренных НТА использованием представленной системы. Полученные данные были высокопоследовательным и подтвердили высокий уровень воспроизводимости. Другие методы изоляции должно показать аналогичные результаты. Тем не менее, шаг разведения был идентифицирован как особенно важный шаг, и его влияние на расчетных общего числа частиц должен быть пересмотрены.
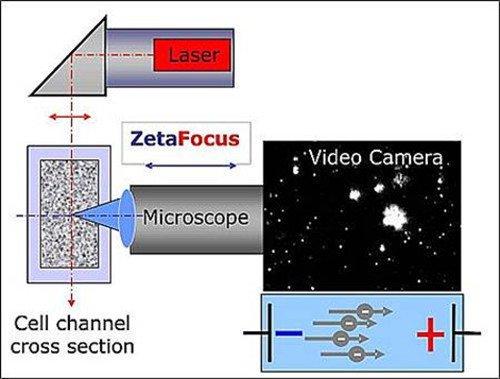
Рисунок 1. Схема установки НТА. Микроскоп / видео и осью лазерного луча ориентированы ортогонально друг к другу, пересекая в поперечном сечении канала клеток. Свет рассеивается частицами отображается в окне "живой взгляд» программного обеспечения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
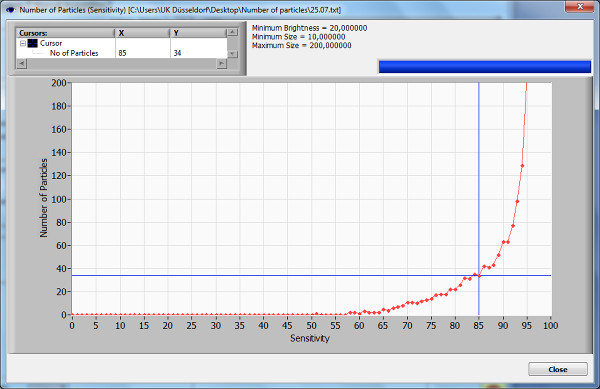
Рисунок 2. Число частиц кривой зависимости чувствительности. Число частиц кривой зависимости чувствительности отображает частицы в одном положении в какой-то момент во время автоматического сканирования чувствительности. Это графическое отображение используется, чтобы определить наилучшие настройки для исходных измерений. Значение чувствительности выбран до максимального наклона графика. Важно помнить, что артефакты не устраняются тестового эксперимента и может повлиять на график. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 3. Влияние чувствительности на аналоговые и цифровые изображения. Визуализация частиц на экране просмотра в реальном времени отображается чувствительности между 50 и 94 для аналогового (верхний ряд) апD Digital (нижний ряд) просмотров. Если чувствительность слишком низкая, только несколько частиц обнаружено (слева). При оптимальной чувствительности частицы появляются как отдельные точки и изолированы друг от друга (в середине). На сравнительно высоком частицы чувствительности сливаются приводит к плохому качеству изображения (справа). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
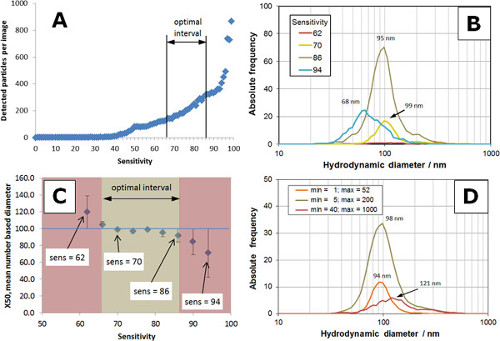
Рисунок 4. Влияние чувствительности мин и макс настройках размер для контрольного образца 100 нм полистирола частиц () Земельный чувствительностью по сравнению обнаруженного числа частиц.; оптимальный интервал составляет от 66 до 86, до максимального наклона кривой. Распределения (B) размер частиц, полученные с несколькими настройками чувствительности (от 62 до 94); Графики на слишком низкое (62) или слишком высокое (94) чувствительности не отражают распределение частиц по размерам для 100 нм контрольного образца полистирола. (C) Количество основана диаметр x50 по сравнению с чувствительностью; ошибка x50 в бежевом интервале менее чем на 8%, оптимальный интервал составляет от 66 до 86. (D) влияние мин и максимальный размер на распределение частиц по размерам; Оптимальные параметры (мин = 5 и Max = 200) захвата правильное распределение для контрольного образца. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
| Параметры до приобретения | |
| Чувствительность | переменная |
| Затвор | 40 |
| Частота кадров | 30 кадров в секунду |
| Разрешение | ПриветGH |
| Циклы | 10 |
| Несколько поглощения | 3 |
| Позиция | 1 |
| Параметры после приобретения | |
| Минимальная яркость | 30 |
| Максимальный размер | переменная |
| Минимум | переменная |
Таблица 1. Резюме до и после приобретения параметров для настройки отслеживания частиц инструмента.
Обсуждение
Мы демонстрируем подробный протокол для экзосома изоляции от крови и настоящим отслеживания наночастиц в качестве нового и инновационного метода измерения размера экзосома и концентрацию в биологической жидкости. В представленных экспериментах периферической крови человека использовали в качестве происхождения экзосом. Тем не менее, другие происхождение, такие как моча, мокрота, супернатант клеточной культуры и т.д., также могут быть использованы в качестве тестового материала.
Основываясь на биологической изменчивости концентрации экзосома у людей анализы из разных людей может обладать удивительно изменению концентрации экзосом. Тем не менее, концентрация частиц в биологических тест-пробы, может оказать влияние на результаты. Таким образом, надежность и стандартизированный подход для разбавления проб необходимо. В представленном способе экзосом содержащий плазмы, полученные от 9 мл периферической цельной крови. Использование дифференциального центрифугирования шаги экзосом осадок, выделенный из1 мл плазмы, и ресуспендировали в 5 мл дистиллированной воды, чтобы привести в рабочее образца взвешенных экзосом. Это предустановленных настроек предоставил нам с надлежащей концентрации частиц, т.е. соответствующей интенсивности рассеяния во НТА. Кроме объема и разбавления аспекте композиция из решений, которые используются также имеет значение. Мы использовали дистиллированную воду для окончательного ресуспензии экзосом. Конечно, различные носители для окончательной стадии разбавления также могут быть использованы, в соответствии с требованиями экспериментальной установки. Тем не менее, в случае дзета-потенциал измерений ионной решений, в частности, при тестировании образцов с буферной емкости, разбавление в разумных турбулентности свободных условиях полезно. Для прямого сравнения нескольких образцов мы рекомендуем держать тот же уровень разбавления для всех образцов. Все настройки, кроме чувствительности и разрешению видео может быть изменен после с помощью программного обеспечения ZetaView анализа.
Хотя авторы считают, что здесь введенная система в настоящее время представляет собой наиболее подходящий инструмент, это не единственный доступный система NTA. Количество предыдущих докладах использовали другие системы, которые применяются те же принципы НТА, но обеспечивают другой дизайн инструмент, который идет вместе с некоторыми различных функций 10. Мы считаем, что практические аспекты, касающиеся обращение с пробами и воспроизводимость результатов имеет решающее значение в выборе методологической последовательности для оценки экзосома. Мы также считаем, что идеальная система обнаружения должна устранить пользователем в зависимости факторов, которые могут повлиять на результаты измерений. Экзосом анализа подход, который представлен здесь выполняет критерий простоты управления в высокой степени. В качестве дополнительного преимущества, полуавтоматическое анализ образцов выполняется в быстром процессе, генерировать результаты в короткий промежуток времени. Онлайн визуализация экзосом помогает анализатор Г.А.в одно мгновение идеи экзосом характеристик, например, валовой концентрации.
Очень простой, но элегантный дополнение к измерительной технике, представленной здесь является использование антител помечены экзосом и захвата рассеянного лазерного луча с помощью предыдущим фильтром перед детектором. Таким образом экзосома субпопуляции можно выделить в соответствии с их поверхностных антигенов и других биологически соответствующих характеристик, которые технически доступны селективного флуоресцентного окрашивания.
Одним из недостатков текущей версии нашей отслеживания частиц инструмента является то, что при очень высоких уровней чувствительности артефакты, такие как фоновый шум может стать настоящее, который основан на стенке канала клеток. Техническое решение и улучшение существующей системы могут стать доступны в ближайшем будущем. С помощью этого метода отражений лазерного рассе ни света на стенки канала будет уменьшен, тем самым увеличивая Точность измеряемых сигналов и полученных данных и снижения предела обнаружения.
Хотя в настоящее время используется протокол для изоляции экзосома хорошо известна и применяется отслеживания частиц Прибор имеет чрезвычайно точное решение с распределением по размерам нижней части 30 нм, что нет никакой гарантии, что обнаруженные частицы действительно совсем верно экзосомы. Другие частицы, такие как клеточные фрагменты мертвых или больших белковых комплексов могут также присутствовать в экзосома суспензии и привести к ложных положительных сигналов. Один надежный способ, с помощью которого, например "загрязнение" может быть исключено, может быть электронной микроскопии (ЭМ), либо Е. передачи или сканирования ЭМ. К сожалению, ни вообще и специфическим маркером для экзосом выявлено не было до сих пор, хотя ряд ранее предложенных поверхностных маркеров получили большее количество внимания, в том числе Тетраспанины (Tspan), CD81, C63, CD9 и т.д. 11.
"> Независимо от дальнейшего прогресса исследований по экзосома биологии, особенно в отношении экзосома специфические маркеры, протокол, который представлен здесь даст мощный метод для выделения и обнаружения экзосом. Концентрация и размер могут быть легко определены в программно-помощь просто мода. Добавление селективных флуоресцентных маркеров или флуорофорных сочетании антител, скорее всего, дальнейшего повышения возможности применения представленной подхода НТА.Раскрытие информации
This work was supported by the institutional funds of the Dept. of Cardiovascular Surgery, Medical Faculty, HHU. The publication costs of this study were provided by Particle MetrixGmbH.
Благодарности
The authors would like to thank Christina Ballázs, Hug Aubin and Jörn Hülsmann for the critical reading of the manuscript and excellent editorial assistance. Moreover, the authors thank Gisela Mueller for the technical assistance. The authors thank Particle Metrix GmbH for providing the funds covering the publication costs.
Материалы
| Name | Company | Catalog Number | Comments |
| Citrate tube | BD | 364305 | BD Vacutainer |
| Distilled water | Braun | 3880087 | Aqua ad iniectabilia |
| Falcon tube | Greiner Bio One | 188271 | PP Tube, Steril 15 ml |
| Ultracentrifugation tube | Beckman | 357448 | Microfuge Tube Polyallomer 1.5 ml |
| Polybead | Polysciences, Inc. | 07304 | 2.6% Solids-Latex Alignment Solution |
| Syringe (Filter) | Braun | 4617053V | 5 ml |
| Syringe (ZetaView) | Braun | 4606051V | 5 ml |
| Needle | BD | 305180 | BD Blunt Fill Needle |
| Filter | Sartorius Stedim | 16555 | Syringe filter, hydrophilic, 450 µm |
| Ultracentrifuge | Beckman | L8-M | Rotor: 70Ti Ser. No E21078 |
| ZetaView | Particle Metrix | PMX 100, Type 101 | |
| Centrifuge | Eppendorf | 5804R | Rotor: A-4-44 |
Ссылки
- Thery, C., Amigorena, S., Raposo, G., Clayton, A., Bonifacino, J. S., et al. Chapter 3. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. . Current protocols in cell biology / editorial board. (3.22), (2006).
- Taylor, D. D., Zacharias, W., Gercel-Taylor, C. Exosome isolation for proteomic analyses and RNA profiling. Methods in molecular biology. 728, 235-246 (2011).
- Lasser, C., Eldh, M., Lotvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. , e3037 (2012).
- Konokhova, A. I., et al. Light-scattering flow cytometry for identification and characterization of blood microparticles. Journal of biomedical. 17, 057006 (2012).
- Vlassov, A. V., Magdaleno, S., Setterquist, R., Conrad, R. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials. Biochimica et biophysica acta. 1820, 940-948 (2012).
- Sokolova, V., et al. Characterisation of exosomes derived from human cells by nanoparticle tracking analysis and scanning electron microscopy. Colloids and surfaces. B, Biointerfaces. 87, 146-150 (2011).
- Clayton, A., et al. Analysis of antigen presenting cell derived exosomes, based on immuno-magnetic isolation and flow cytometry. Journal of immunological. 247, 163-174 (2001).
- Cheruvanky, A., et al. Rapid isolation of urinary exosomal biomarkers using a nanomembrane ultrafiltration concentrator. Amer. J. Phys. Renal Phys. 292, F1657-1661 (2007).
- Carr, B., Warren, J. Company profile: NanoSight: delivering practical solutions for biological nanotechnology. Nanomedicine. 7, 1129-1132 (2012).
- Caby, M. P., Lankar, D., Vincendeau-Scherrer, C., Raposo, G., Bonnerot, C. Exosomal-like vesicles are present in human blood plasma. International immunology. 17, 879-887 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены