Method Article
Eine innovative Methode zur Quantifizierung und Exosom Size Measurement
In diesem Artikel
Zusammenfassung
A method for isolation of exosomes from whole blood and further analysis by nanoparticle tracking using a semi-automatic instrument is presented in this article. The presented technology provides an extremely sensitive method for visualizing and analyzing particles in liquid suspension.
Zusammenfassung
Although the biological importance of exosomes has recently gained an increasing amount of scientific and clinical attention, much is still unknown about their complex pathways, their bioavailability and their diverse functions in health and disease. Current work focuses on the presence and the behavior of exosomes (in vitro as well as in vivo) in the context of different human disorders, especially in the fields of oncology, gynecology and cardiology.
Unfortunately, neither a consensus regarding a gold standard for exosome isolation exists, nor is there an agreement on such a method for their quantitative analysis. As there are many methods for the purification of exosomes and also many possibilities for their quantitative and qualitative analysis, it is difficult to determine a combination of methods for the ideal approach.
Here, we demonstrate nanoparticle tracking analysis (NTA), a semi-automated method for the characterization of exosomes after isolation from human plasma by ultracentrifugation. The presented results show that this approach for isolation, as well as the determination of the average number and size of exosomes, delivers reproducible and valid data, as confirmed by other methods, such as scanning electron microscopy (SEM).
Einleitung
Die genaue Funktion des zirkulierenden Exosomen blieb lange Zeit unbekannt. Selbst jetzt der vollständige Pfad Mechanismus Exosomen ist nicht vollständig geklärt. Seit Exosomen tragen Antigene, Proteine und RNA (mRNA und miRNA), die sie bezieht sich auf ihre elterlichen Ursprungszelle, ihre Funktion als Zell-Zell-Signalgeber wurde vor allem im Vordergrund.
Viele unterschiedliche Verfahren werden in der Literatur für die Isolierung und quantitativen Nachweis von Exosomen 1,2 beschrieben. Jedoch keinen Konsens über eine "Goldstandard" erreicht wurde. Inzwischen ist die Mehrheit der Wissenschaftler auf dem Gebiet der Forschung tätig Exosom einig, dass eine konsistente Methode der Isolation ist sehr gerechtfertigt, um ein höheres Maß an Vergleichbarkeit zwischen verschiedenen Berichten und Studien zu erzielen.
Fluoreszenz-aktivierte Zellsortierung (FACS) ist die häufigste und verbreitet Werkzeug zur Analyse exosome 3. FACS hat die beneFit, die über Fluoreszenzmarkierung, Zellen verschiedener Herkunft kann in einem Schritt verglichen werden. Die Hauptnachteile FACS sind, dass dieses Verfahren nicht empfindlich genug ist, um Teilchen, die kleiner als 0,5 um 4 zu identifizieren, während Exosomen sind im Allgemeinen zwischen 30-120 nm Durchmesser 5, sogar noch weniger, um ihre Größe zu messen.
Rasterelektronenmikroskopie (SEM) und Transmissionselektronenmikroskopie (TEM) sind andere Werkzeuge für die Analyse der Partikelgröße und die Morphologie der Exosomen. Sowohl SEM und TEM haben jedoch den Nachteil, dass die Probenvorbereitung ist zeitaufwendig, wobei beide Verfahren beinhalten arbeitsintensive Schritte, und jeder hat ein gewisses Risiko einer Artefakterzeugung. Beide Verfahren sind für einen hohen Probendurchsatz und Charakterisierung von mehreren tausend Einzelpartikeln einer Probe. Darüber hinaus, um eine quantitative Analyse der klinischen Alltag, wo Proben oft gleichzeitig oder zumindest in einem sehr kurzen Zeitraum analysiert werdenschwierig durchzuführen. Techniken der neuen Generation jetzt können wir Exosomen ohne vorherige intensive Vorbereitungsarbeiten (zB Umwelt SEM) analysiert. Die modernen Techniken sind immer noch für die Analyse von großen Volumen Suspensionen, die Exosomen, ihre durchschnittliche Anzahl und Größenverteilung 6 bestimmen eher unbequem.
Ein weiteres hochempfindliche Methode zur Visualisierung und Analyse von Exosomen ist Nanopartikel-Tracking-Analyse (NTA). Dieses Verfahren nutzt den Vorteil von zwei unterschiedlichen physikalischen Prinzipien. Zunächst werden Teilchen, die durch das Licht gestreut, wenn sie mit einem Laserstrahl bestrahlt werden erkannt. Das zweite Phänomen ist als Brownsche Bewegung bekannt, wonach die Diffusion verschiedener Partikel in einer flüssigen Suspension ist umgekehrt proportional zu ihrer Größe. Im letzteren Fall hängt die Bewegung auch von der Temperatur und der Viskosität der Flüssigkeit. Dennoch ist diese Rate direkt an Partikelgröße bezogen und wird von NTA verwendet. Über Software-basierte Analyse, digitale Bilder von Streulicht aus einzelnen Teilchen werden aufgezeichnet. Grundstreulichtflecken und ihre Bewegungsgeschwindigkeit liefern die Daten, die die Bestimmung der Gesamtpartikelanzahl und Größenverteilung zu erleichtern. Diese Technik ist besonders leistungsfähig für die Analyse von Teilchen mit einem mittleren Durchmesser von weniger als 100 nm.
Die Größe und Konzentrationsmessungen mit dem Zetaview Brownsche Bewegung und Elektrophorese Videoanalyse-Mikroskop durchgeführt. Dies ist ein halbautomatisches Tischnanopartikelanalysegerät für flüssige Proben (im folgenden als der Partikelverfolgungsinstrument bezeichnet). Es besteht aus der Partikelbewegung Analysator sowie einen Laptop mit der für die Datenanalyse verwendet Software. Heterogenen biologischen Proben sind für dieses Verfahren geeignet als homogener Suspensionen von anorganischen Partikeln. Ein Laserstreuung-Mikroskop mit einer Videokamera zur Erfassung von Teilchen und für die Obse verwendetrvation ihrer Bewegung. Während die Mikroskopachse horizontal ist und in den Zellkanal mit einer Suspension, die Exosomen gefüllt fokussiert, wird der Laserstrahl vertikal ausgerichtet. Die Teilchen, die durch die Laserlichtstreuung, die unter 90 ° von einer digitalen Videokamera über die Mikroskop (siehe Abbildung 1) bestrahlt wird. Die Intensität des gestreuten Lichts ermöglicht die Beobachtung der Teilchen größer 60 nm Durchmesser. In einer solchen Einstellung wird die Helligkeit eines Teilchens ist nicht die einzige Indikation der Partikelgröße. Wenn kein elektrisches Feld angelegt wird, nur Teilchenbewegung folgt Brownsche Bewegung und kann als Indikator für die Berechnung der Teilchengröße dienen. Jedoch ist das Gerät auch in der Lage, das Anlegen eines elektrischen Feldes über dem Zellenkanal. Wenn zu diesem Feld ausgesetzt wird, das Potential, Polarität und das Niveau der Ionenladung der suspendierten Exosomen werden weitere Determinanten für die Richtung der Bewegung an. Geschwindigkeit und Richtung ergeben eine elektrophoretische mokeit Histogramm.
Während der Suche nach einer optimalen Methode isoliert Exosomen analysieren ist ein Problem, liegt ein weiterer in der wirksamen Isolierung von Exosomen aus unterschiedlichen Medien, wie etwa Blut, Aszites, Urin, Milch, Fruchtwasser oder Zellmedien. Verschiedene Methoden wurden bisher die basieren beschrieben, auf Ultrazentrifuge 1, industrielle Trennung Reagenzien (wie Exoquick) 7, magnetische Kügelchen für Antigen Einsatz Trennung 8 oder Ultrafiltration Schritte 9.
In diesem Protokoll zeigen wir den gesamten Prozess der Exosom Trennung über Ultrazentrifugation und zeigen, wie man die resultierende Exosom enthaltende Suspension über die Partikelverfolgung Instrument analysieren. Besondere Erwägungen für die Analyse von menschlichem Plasma oder Zellkulturmedium abgeleitete Exosomen bereitgestellt.
Protokoll
HINWEIS: Die in dieser Arbeit vorgestellten Experimente wurden von der institutionellen ethischen Vorstand der Universität Düsseldorf zugelassen.
1. Exosom Vorbereitung
- Vollblut in 3 Zitratröhrchen über Venenpunktion (insgesamt 9 ml). Gießen Sie das Blut in ein 15 ml Falcon-Röhrchen.
- Zentrifugieren der Probe bei 1500 × g für 20 min bei 4 ° C, um die Trennung von Zellen aus dem Plasma zu initiieren. Den Überstand in ein neues 15 ml Falcon-Röhrchen.
- Zentrifugieren Sie die Probe bei 2800 g für 20 min bei 4 ° C, um alle Zellen vom Plasma zu entfernen (zellfreie Plasma; GFP). Übertragen Sie die GFP einer Ultrazentrifugation Rohre, 1 ml pro Röhrchen.
- Zentrifugieren bei 100.000 · g für 90 min bei 4 ° C bis Exosomen abzureichern. Entfernen 900 ul des Überstands. Resuspendieren des Pellets in den verbleibenden 100 ul in der Ultrazentrifuge Rohr. Fügen Sie 900 ul PBS.
- Zentrifuge erneut bei 100000 × g für 30 min bei 4 ° C. Entfernen 900 Mikroliter supernatant. Resuspendieren Sie das Pellet mit den verbleibenden 100 ul.
- Transfer von 5 bis 20 & mgr; l Resuspension in 40 ml destilliertem Wasser. Filtern der Suspension durch ein 450 nm Filter, Exosomen von größeren Teilchen zu trennen. Verwenden Sie diese endgültige Suspension zur Partikelmessung.
2. Startvorgang des Tracking-Instrument Particle
- Starten Sie das Programm durch einen Doppelklick auf die Software-Symbol. Klicken Sie auf die verschiedenen Software-Registerkarten ("Zell Check", "Messung", "Analyse"), um zwischen ihnen in der gesamten Protokoll wechseln.
- Folgen Sie den Anweisungen auf dem Bildschirm für eine automatisierte Umsetzung der Inbetriebnahme. Wählen Sie die Kontrollkästchen für beide Zellqualitätsprüfung und automatische Ausrichtung.
HINWEIS: Jeder dieser Schritte kann separat bei Bedarf durch Drücken der Taste (A) oder (B) auf der "Zellkontrolle" Registerkarte wiederholt werden. - Öffnen Sie die Eingangs- und Ausgangsanschluss des NTA Instrument und injizieren 10 ml destilliertem Wasser mit einer Spritze in den Zellenkanal durch die Einlaßöffnung. Schließen der Austrittsöffnung, wie die letzte Menge an Wasser eingespritzt wird. Stellen Sie ein Becherglas unter der Austrittsöffnung an Abfalllösung zu sammeln. Stellen Sie sicher, dass die Messzelle ist frei von Luftblasen und keine Spritze Luftblasen in das System. Schließen Sie die Einlassöffnung sofort.
- Führen Sie die Zelle Qualitätskontrolle, indem Sie auf "OK". Die Software wird die Zellqualität Ergebnisse nach ein paar Sekunden angezeigt.
- Falls Partikel noch in der Live-View-Bildschirm der Software visualisiert oder wenn das Ergebnis der Qualitätsprüfung ist nur gut oder schlecht ist, werden wiederholen Sie Schritt 2.3, bis die verbleibenden Partikel aus der Messzelle entfernt. Auch wiederholen Sie Schritt 2.3 nach jeder Messung, um die Ansammlung von Partikeln zu vermeiden. Bei Wiederholung der destilliertes Wasser Injektion und Zellprüfung keine "guten" Ergebnis nicht zu produzieren, auf 2,9 fortzufahren.
- Bereiten Sie eine Steuer Suspension, die gleichmäßige 200 nm Größe polystyrene Teilchen verwendet, um die Schwerpunkte der Lasermikroskop und auszurichten. Geben Sie einen Tropfen des Suspensionskonzentrats, vom Hersteller des Instruments vorgesehen ist, zu 500 ml destilliertem Wasser auf die erforderliche Konzentration, so dass 600 ± 100 Partikel pro Bildschirm im Live-Ansicht angezeigt zu erhalten.
- Spritzen Sie die Ausrichtung Suspension in die NTA Instrument wie in Schritt 2.3 beschrieben. Drücken Sie "OK", um die automatische Ausrichtung, eine automatisierte Routine, durch die das System automatisch die optimale Position der beiden Schwerpunkte finden starten.
- Bei der entsprechenden Meldung besagt, das System ist jetzt bereit für Experimente, klicken Sie auf OK, um die Messung zu starten.
- Gelegentlich Reinigung der Zelle Kanal manuell zwischen den Experimenten durch Spülen der Zelle mit einer 30% igen Lösung von Ethanol. Reinigen Sie den Kanal, wenn die Software zeigt einen automatischen Fehlerbericht.
3. Messung der Proben
- Spülen Sie den Kanal mit destilliertem Wasser vor each Probenmessung (wie in Schritt 2.3 beschrieben).
- Spritzen Sie die Suspension in Exosom an den Kanal (in Abschnitt 1 hergestellt), wie in Schritt 2.3 beschrieben.
- Passen Sie die folgenden wichtigsten Parameter in der Software je nach Bedarf:
- Empfindlichkeit. Um den optimalen Empfindlichkeitsbereich zu finden, klicken Sie auf die Schaltfläche "Anzahl der Partikel gegen Sensitivity", um eine Kurve für die gemessenen Partikel pro Bildschirm für verschiedene Empfindlichkeitsstufen anzuzeigen. Wählen Sie eine Empfindlichkeitsstufe, bevor die maximale Steigung der Kurve. Eine höhere Empfindlichkeit ermöglicht die Visualisierung von kleinen Partikeln, sondern erhöht auch Fragen im Zusammenhang mit Hintergrundgeräuschen zusammen.
- Minimale Helligkeit. Wählen Sie einen Anfangshelligkeit von 20 für Exosom Messung, um diese Funktion als Filter zu verwenden. Regeln Sie diesen Parameter, bis zu leer aus stark lichtstreuenden Teilchen. Regulieren Sie es auf schwach verstärken Streuartefakten. Variieren Helligkeit während des Experiments nötig.
HINWEIS: Partikel, die licht-streuen zu stark überlappen, und kann aus der Analyse aus Versehen ausgeschlossen werden kann. - Min- und Max-Größe. , Einen digitalen Filter, um Pixelrauschen und unerwünschte Streuung von übergroßen Teilchen durch Regulierung der Minimal- und Maximalgröße zu eliminieren. Verwenden Sie einen Bereich von 10 bis 500 Pixel zur Messung von Exosomen.
- Shutter. Stellen Sie die Zeit, die die Kamera ist für 1/300 sec.
- Live-Auslesen von Parametern:
- Wechseln Sie zwischen einem digitalen und einem analogen Ansicht Modus jederzeit durch Klicken auf die "Live-Bild" -Taste.
- Während des Experiments überwacht die Streuintensität Leiste, die den Sättigungszustand der Probe als eine farbcodierte Anzeige zeigt. Exosomen analysieren nicht, wenn die Streubalken rot. In einem solchen Fall weiterhin die Probe zu verdünnen, um dieses Phänomen zu vermeiden. Wenn die Versuchsbedingung verhindert eine Manipulation der Probensuspension, herunterregulieren die Empfindlichkeit oder hochregulieren die Helligkeit in der Software-sinstellungen um die Messergebnisse zu verbessern.
ANMERKUNG: Bei Proben mit einer extrem hohen Konzentration von Partikeln analysiert die Streuung werden einzelne Teilchen zu verschmelzen, und sie werden als ein einzelnes Teilchen gezählt. - Beachten Sie die Anzahl von Teilchen in dem Sichtfeld der Anzeige gezählt.
- Klicken Sie auf der Registerkarte "Messen".
- Wählen Sie die Einstellungen in der "Ausführungsoptionen" Array.
- Vor jeder Akquisition, wählen Sie "Check Bewegung" für eine wiederholte Prüfung Partikeldrift Test. Führen Sie den Test mindestens einmal vor dem Start der gesamten Analyse. Wenn die Drift höher als 20 & mgr; m / sec, zu warten, bevor die Fortsetzung der Messung, so daß die Probe nicht mehr fließt.
- Auswahl der Anzahl von Versuchen (5) und die Zeitverzögerung zwischen ihnen zu (0).
- Führen Sie eine "Stichprobenkontrolle", wenn nötig. Dieser Test ist Teil des Auto-Ausrichtung in der Startprozedur und können anschließend nach Bedarf wiederholt werden.
- Schließlich klicken Sie auf den "Run Videoerfassung" -Taste. In dem neuen Fenster definieren die Anzahl der Zyklen (15) und die Anzahl der Messpositionen (11).
HINWEIS: Der Laserkopf und das Mikroskop bewegt, um die Partikelzahl bei 11 verschiedenen Positionen analysiert werden. Je nach experimentellen Nachfrage, ob der Versuch sollte auf einer einzelnen Position oder an unterschiedlichen Positionen durchgeführt werden.- Bestätigen Sie die minimale Zeitdauer ein Teilchen verfolgt, als eine einzelne Partikel gezählt werden, indem Sie die Videoauflösung (low). Eine geringere Auflösung führt zu einer kürzeren Dauer Tracking.
- Wählen Sie einen Dateinamen und klicken Sie auf "OK", um die Messung zu starten.
4. Interpretation der Ergebnisse
- Sehen Sie die folgenden Ergebnisse und Parameter nach der Messung angezeigt auf der Registerkarte "Ergebnisse": (1) Gesamtzahl der Partikel zurückzuführen, (2) durchschnittliche Zahl der Teilicles pro Position, und (3) Partikelkonzentration.
- Sehen Sie das Ergebnis durchschnittlich Tabelle für das Zahlenverhältnis der Teilchengröße (Durchmesser, Oberfläche und Volumen) auf den Anteil der Partikelanzahl sowie die Werte der Mittelwert und die Standard Differenzierung.
- Verwenden Sie die Spitzenanalysetabelle, wenn mehr als ein Höhepunkt in der grafischen Analyse vorhanden ist. Diese Tabelle zeigt die Verteilung von Teilchen, die kleiner als die erste bzw. zweite Spitze sind.
- Sehen Sie sich die Grafik berechnet nach der Messung, um eine Verteilung der Partikel nach Größe zu sehen. Verwenden Sie die Symbole in den Anzeigemodus und über der Grafik, um die Einstellungen zu ändern.
Ergebnisse
Die für diese Demonstration verwendete Probe zeigt eine optimale Einstellung für die Messung mit einer Sensitivität von 85%, bevor die maximale Steigung der Empfindlichkeitskurve (Figur 2). Die Helligkeit, die Min / Max-Werte wurden ausgewählt, wie im Protokoll empfohlen. Eine Konzentration von 5,3 Teilchen / ml x 10 6 wurde gemessen, während die mittlere Größe der Teilchen 0,149 um, die meisten von ihnen 0,137 um.
Die nach der Messung empfangenen Werte können in einem Bericht mit einem Dateiformat PDF oder als TXT für den Export in eine Datenbank gespeichert werden. Die Grafik kann eingestellt Bevorzugt seien wie im Protokoll (Abschnitt 4) beschrieben. Die Videosequenz wird ebenfalls gespeichert und kann für die spätere off-line erneute Analyse verwendet werden. Jedoch in solch einem off-line-Analyse, die vor der Akquisition Einstellungen der Kamera können nachträglich nicht verändert werden.
Um die optimalen Parameter für eine Messung zu finden, beschreiben wir hier the Optimierung der Geräteeinstellungen am Beispiel eines 100 nm Polystyrolgrößenstandard. Der Einfluss von zwei Parametern, die Empfindlichkeit und Min / Max Größe für Videobild und die Partikelgrößenverteilung wird im Detail diskutiert. Alle anderen Parameter sind in Tabelle 1 zusammengefasst.
Eine visuelle Eindruck der Auswirkungen der Empfindlichkeit (im Bereich von 50 bis 94) über analoge und digitale Bilder ist in Figur 3 sichtbar gemacht. Die quantitative Informationen aus den Bildern abgeleitet ist, ist in 4 dargestellt, basierend auf den Einstellungen in der Tabelle 1 Min Size = 5 und Max.Grösse = 200. Ein typisches Verhältnis der Anzahl der detektierten Teilchen vs. Empfindlichkeit wird in 4A gezeigt. Zwischen 50 und 90, die Zahl der detektierten Partikel erhöht mit Sensibilität und stieg dramatisch für Empfindlichkeiten> 90. Ein optimaler Bereich der Empfindlichkeit zwischen 66 und 86 (A) gefunden. Partikelgrößenverteilungen mit dif erhaltenschiedliche Empfindlichkeitseinstellungen sind in 4B gezeigt. Die Partikelgrößenverteilungen stellen den Mittelwert aus drei Einzelmessungen. Bei einer zu geringen Empfindlichkeit (Sensitivität = 62, rote Kurve) nur wenige Partikel wurden analysiert, was zu eher schlechte Statistik. Die Anzahl der analysierten Partikel erhöht mit Sensibilität und erreicht ein Optimum zwischen 70 (gelbe Kurve) und 86 (tan Kurve). Eine weitere Erhöhung der Empfindlichkeit führen zu einer Verschlechterung der Partikelgrößenverteilung mit der Anzahl der Partikel fallen und Grßenverteilung Verschiebung zu kleineren Größen (Empfindlichkeit = 94, blaue Kurve). 4C zeigt den Trend der Anzahl basiert x50 Durchmesser (50% der Teilchen kleiner sind als dieser Durchmesser) als eine Funktion der Sensitivität. In der beige-Intervall, die RSD der Teilchengröße betrug weniger als 8% und entspricht dem optimalen Intervall in A. Die roten Bereiche zeigen als Folge der schlechten Statistik (Empfindlichkeit zu gering) oder breit distri RSD> 8%träge mit Verschiebung zu kleineren Größen (Empfindlichkeit zu hoch).
Die Einstellungen der Mindestgröße und Maximale Größe sind Filter, digitale Bilder, um Teilchen mit Spotgrößen kleiner als Mindestgröße und größer als Max Größe zu entfernen. Aufgrund der Fähigkeit, Licht zu streuen, erzeugt ein Teilchen eine Stelle mit einer bestimmten Größe auf einem digitalen Bild. Die Größe des Punktes als eine Anzahl von Bildpunkten (Pixel) gemessen. Wenn ein Teilchen streut das Licht sehr gut (zB Partikel> 200 nm oder Aggregate), ist die Punktgröße recht groß, zB> 500 px. Die Punktgrße ist ziemlich klein (zB <10 Pixel) für kleine Teilchen (zB <20 nm) in Abhängigkeit von der Partikelmaterial. Fleckgrße (px) nicht mit Teilchengröße (nm) gegeneinander ausgetauscht werden, wenn sie nicht identisch sind, und es gibt keine direkte Beziehung zwischen diesen beiden Variablen. Eine Optimierung der Min- und Max-Größe ermöglicht es dem Benutzer, wie Agglomerate (Max Size) oder kleine Ausfiltern unerwünschter ObjekteObjekte wie Hintergrundgeräusche (Min Size). Der Einfluss der Min / Max Größe von der Partikelgrößenverteilung eines 100 nm-Größenstandard ist in Figur 4D (Empfindlichkeit = 82) gezeigt. Wenn das Intervall auf kleine Messfelder gesetzt ist (zB min = 1, max = 52; orange Kurve), die Anzahl der analysierten Partikel reduziert und die Anzahl der Basis x50 Durchmesser leicht nach kleineren Größen verschoben. Eine Einstellung für größere Flecken (min = 40, max = 1.000; rote Kurve) führt zu einer breiten Partikelgrößenverteilung verschoben hin zu größeren Größen. Um gleiche Gesamtzahl der Partikel zu erhalten, wurden die Intervallgrenzen der beiden orange und rot-Distributionen angepasst werden, um 80 Teilchen entsprechen. Die Verteilung mit den optimalen Einstellungen (min = 5, max = 200; tan Kurve) besteht aus 360 Teilchen.
Eine Reihe von erfolgreichen Experimente wurden mit Exosomen durch Ultrazentrifugation isoliert und NTA, gemessen unter Verwendung des dargestellten Systems durchgeführt. Die erhaltenen Daten waren höchstkonsistent und bestätigten eine hohe Reproduzierbarkeit. Andere Isolierungsmethoden sollten ähnliche Ergebnisse. Jedoch wurde der Verdünnungsschritt als ein besonders kritischer Schritt identifiziert und neu bewertet werden die Auswirkungen auf die berechnete Gesamtanzahl von Partikeln aufweist.
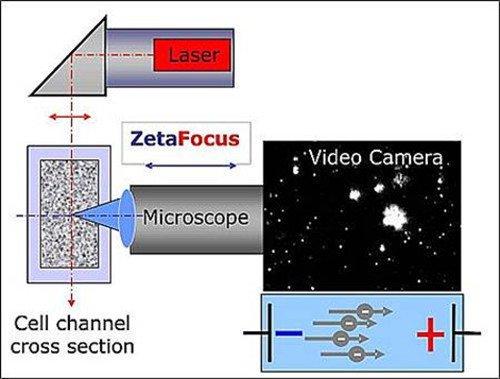
Abbildung 1. Schematische Darstellung des Aufbaus der NTA. Das Mikroskop / Video-Achse und Laserstrahl sind orthogonal zueinander orientiert, kreuzen an der Zellkanalquerschnitt. Licht von den Teilchen gestreut wird im Fenster "Live-Ansicht" der Software angezeigt. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
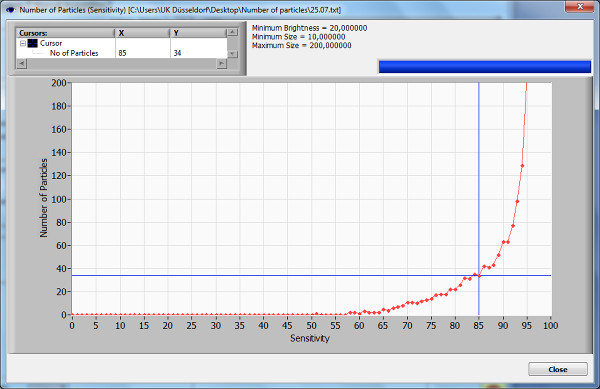
Abbildung 2. Anzahl der Partikel gegen Empfindlichkeitskurve. Die Anzahl der Partikel gegen Empfindlichkeitskurve zeigt die Partikel in einer Position in einem Moment während einer automatischen Empfindlichkeits Scan. Diese grafische Darstellung wird verwendet, um die besten Einstellungen für die ersten Messungen zu bestimmen. Eine Empfindlichkeitswert gewählt wird, bevor die maximale Steigung des Graphen. Es ist wichtig, sich daran zu erinnern, dass Artefakte werden in diesem Testversuch beseitigt und können den Graphen beeinflussen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 3. Auswirkungen der Empfindlichkeit an analogen und digitalen Bild. Visualisierung von Partikeln auf der Live-Bildansicht wird Empfindlichkeiten zwischen 50 und 94 für analoges (obere Reihe) eine Anzeiged digital (untere Reihe) Blick. Wenn die Empfindlichkeit zu niedrig ist, sind nur wenige Teilchen detektiert (links). Auf optimale Empfindlichkeit erscheinen die Partikel als einzelne Punkte gut voneinander (Mitte) isoliert. Auf einem vergleichsweise hohen Empfindlichkeit Partikel verschmelzen mit der schlechten Bildqualität (rechts) führen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
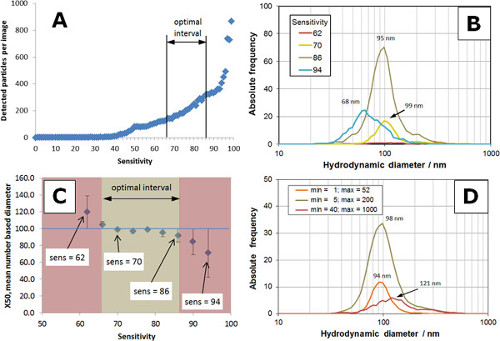
Abbildung 4. Einfluss von Empfindlichkeit min und max Formateinstellungen für eine Steuer 100 nm Polystyrolpartikelprobe (A) Plot der Empfindlichkeit gegenüber erkannt Anzahl der Teilchen. das optimale Intervall von 66 bis 86, vor der der maximalen Steigung der Kurve. (B) Partikelgrößenverteilungen mit verschiedenen Empfindlichkeitseinstellungen (62-94 erhalten); Graphen für zu niedrig (62) oder zu hoch (94) Empfindlichkeit erfassen nicht die Partikelgrößenverteilung für die 100 nm Polystyrol Kontrollprobe. (C) Anzahl der Basis x50 Durchmesser gegenüber Empfindlichkeit; der Fehler in der x50 beige Intervall weniger als 8%, ist von 66 auf 86 (D) Auswirkungen von Min- und Max-Größe auf der Partikelgrößenverteilung optimal Intervall; optimalen Parametern (min = 5 und max = 200) erfassen die korrekte Verteilung für die Kontrollprobe. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
| Pre-Erfassungsparameter | |
| Empfindlichkeit | Variable |
| Verschluss | 40 |
| Bildrate | 30 fps |
| Auflösung | Hallogh |
| Cycles | 10 |
| Mehrere Übernahmen | 3 |
| Position | 1 |
| Post-Erfassungsparameter | |
| Min Helligkeit | 30 |
| Max Größe | Variable |
| Mindestgröße | Variable |
Tabelle 1. Zusammenfassung der vor und nach der Aufnahme-Parameter zur Einstellung der Partikelverfolgung Instrument.
Diskussion
Wir zeigen ein detailliertes Protokoll für Exosom isoliert von Blut und Gegenwart Nanopartikel Tracking als neuartige und innovative Methode, um Exosom Größe und Konzentration in einer biologischen Flüssigkeit zu messen. In den vorgestellten Experimenten wurde menschlichem peripheren Blut als Ursprung der Exosomen verwendet. Jedoch können auch andere Ursachen, wie etwa Urin, Sputum, Zellkulturüberstand etc., die auch als Testmaterial verwendet werden.
Basierend auf der biologischen Variabilität exosome Konzentration beim Menschen kann von Tests verschiedener Individuen einen bemerkenswert unterschiedlichen Konzentration von Exosomen verfügen. Jedoch kann die Konzentration der Teilchen in dem biologischen Testsonde eine Auswirkung auf die Ergebnisse. Daher wird eine zuverlässige und Standardansatz für die Verdünnung der Proben notwendig. In der vorgestellten Methode wurde Exosom haltigen Plasma von 9 ml peripheres Vollblut erzeugt. Mit Differentialzentrifugation Schritte ein Exosom Pellet aus isoliert1 ml Plasma und in 5 ml destilliertem Wasser, um in der Arbeitsprobe ausgesetzt Exosomen führen resuspendiert. Diese vordefinierten Einstellung hat uns mit einer geeigneten Konzentration von Partikeln, dh entsprechende Streuintensität während NTA zur Verfügung gestellt. Neben dem Volumen und Verdünnen Aspekt ist die Zusammensetzung der Lösungen, die verwendet werden, von Bedeutung. Wir haben destilliertem Wasser für den letzten Resuspension von Exosomen verwendet. Natürlich können verschiedene Medien für die endgültige Verdünnung verwendet werden, je nach den Anforderungen des experimentellen Aufbaus. Im Fall des Zetapotentialmessungen von ionischen Lösungen, insbesondere für die Prüfung Proben mit Pufferkapazität ist jedoch eine vorsichtige Verdünnung in Turbulenz freien Bedingungen nützlich. Für den direkten Vergleich mehrerer Proben empfehlen wir halten die gleiche Verdünnungsstufe für alle Proben. Alle Einstellungen außer der Empfindlichkeit und der Bildauflösung kann anschließend mit der Zetaview Analysis Software geändert werden.
Obwohl die Autoren glauben, dass die hier vorgestellte System stellt derzeit das am besten geeignete Instrument, es ist nicht die einzige verfügbare NTA-System. Eine Reihe von früheren Berichten haben andere Systeme, die die gleichen Grundsätze gelten NTA, bieten aber ein anderes Instrument Design, das zusammen mit einigen unterschiedlichen Funktionen 10 geht beschäftigt. Wir glauben, dass die praktischen Aspekte bezüglich der Handhabung der Proben und die Reproduzierbarkeit der Ergebnisse sind von zentraler Bedeutung bei der Auswahl der Methodensequenz für Exosom Auswertung. Wir glauben auch, dass eine ideale Erkennungssystem sollte benutzerabhängige Faktoren, die die Ergebnisse der Messungen stören, zu beseitigen. Die Exosom Analyse Ansatz, der hier präsentiert wird erfüllt das Kriterium der einfachen Handhabung zu einem hohen Grad. Als weiterer Vorteil ist die halbautomatische Analyse der Proben in einem schnellen Prozess durchgeführt wird, Erzeugen Ergebnisse in kurzer Zeit. Eine Online-Visualisierung von Exosomen hilft dem Analysator gain einem Augenblick Idee der Exosom Eigenschaften, zB Brutto-Konzentration.
Eine sehr einfache, aber eleganten Neben der Meßtechnik präsentierten die Verwendung von Antikörper markiert Exosomen und die Erfassung der gestreuten Laserstrahl durch Verwendung eines vorhergehenden Filter vor dem Detektor. Auf diese Weise kann Exosom Subpopulationen entsprechend ihrer Oberflächenantigenen und anderen biologisch relevanten Eigenschaften, die technisch zugänglich selektiver Fluoreszenzfärbung sind zu unterscheiden.
Ein Nachteil der gegenwärtigen Version unserer Particle Tracking Instrument ist die Tatsache, dass bei sehr hohen Empfindlichkeitsniveaus Artefakte wie Hintergrundrauschen vorhanden sein, die auf der Zellkanalwand basiert. Eine technische Lösung und Verbesserung des derzeitigen Systems verfügbar sein werden in der nahen Zukunft. Durch diese Methode Reflexionen des Laserlichtstreuung an der Kanalwand reduziert werden, wodurch die die Genauigkeit der gemessenen Signale und erhaltenen Daten und Absenken der Nachweisgrenze.
Obwohl die derzeit verwendete Protokoll für Exosom Isolierung ist gut etabliert und die aufgebrachte Partikelverfolgung Instrument hat eine bemerkenswert genaue Auflösung mit einer geringeren Größenverteilung von 30 nm, gibt es keine Garantie, dass die detektierten Partikel sind in der Tat ganz richtig Exosomen. Andere Teilchen, wie tot Zellfragmente oder größere Proteinkomplexe können auch im Exosom Suspension vorliegen und führen zu falsch positiven Signalen. Ein zuverlässiges Verfahren, mit denen solche "Verschmutzung" ausgeschlossen kann Elektronenmikroskopie (EM), entweder Übertragungs EM oder Scannen EM sein. Leider hat sich kein allgemeiner und spezifischer Marker für Exosomen wurden bisher identifiziert, obwohl eine Reihe von bisher vorgeschlagenen Oberflächenmarker haben eine zunehmende Menge an Aufmerksamkeit, einschließlich Tetraspanin (tspan), CD81, C63, CD9 usw. 11 gewonnen.
"> Unabhängig von der künftigen Fortschritte der Forschung auf Exosom Biologie, insbesondere in Bezug auf Exosom spezifische Marker, das Protokoll, das hier vorgestellt wird, wird ein leistungsfähiges Verfahren zur Isolierung und zum Nachweis von Exosomen Verfügung zu stellen. Die Konzentration und Größe können leicht in einem softwaregestützten bestimmt werden einfache Art und Weise. Der Zusatz von selektiven Fluoreszenzmarkern oder Fluorophor gekoppelt Antikörper wird wahrscheinlich weiter erhöhen die Einsatzmöglichkeiten der vorgestellten Ansatz der NTA.Offenlegungen
This work was supported by the institutional funds of the Dept. of Cardiovascular Surgery, Medical Faculty, HHU. The publication costs of this study were provided by Particle MetrixGmbH.
Danksagungen
The authors would like to thank Christina Ballázs, Hug Aubin and Jörn Hülsmann for the critical reading of the manuscript and excellent editorial assistance. Moreover, the authors thank Gisela Mueller for the technical assistance. The authors thank Particle Metrix GmbH for providing the funds covering the publication costs.
Materialien
| Name | Company | Catalog Number | Comments |
| Citrate tube | BD | 364305 | BD Vacutainer |
| Distilled water | Braun | 3880087 | Aqua ad iniectabilia |
| Falcon tube | Greiner Bio One | 188271 | PP Tube, Steril 15 ml |
| Ultracentrifugation tube | Beckman | 357448 | Microfuge Tube Polyallomer 1.5 ml |
| Polybead | Polysciences, Inc. | 07304 | 2.6% Solids-Latex Alignment Solution |
| Syringe (Filter) | Braun | 4617053V | 5 ml |
| Syringe (ZetaView) | Braun | 4606051V | 5 ml |
| Needle | BD | 305180 | BD Blunt Fill Needle |
| Filter | Sartorius Stedim | 16555 | Syringe filter, hydrophilic, 450 µm |
| Ultracentrifuge | Beckman | L8-M | Rotor: 70Ti Ser. No E21078 |
| ZetaView | Particle Metrix | PMX 100, Type 101 | |
| Centrifuge | Eppendorf | 5804R | Rotor: A-4-44 |
Referenzen
- Thery, C., Amigorena, S., Raposo, G., Clayton, A., Bonifacino, J. S., et al. Chapter 3. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. . Current protocols in cell biology / editorial board. (3.22), (2006).
- Taylor, D. D., Zacharias, W., Gercel-Taylor, C. Exosome isolation for proteomic analyses and RNA profiling. Methods in molecular biology. 728, 235-246 (2011).
- Lasser, C., Eldh, M., Lotvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. , e3037 (2012).
- Konokhova, A. I., et al. Light-scattering flow cytometry for identification and characterization of blood microparticles. Journal of biomedical. 17, 057006 (2012).
- Vlassov, A. V., Magdaleno, S., Setterquist, R., Conrad, R. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials. Biochimica et biophysica acta. 1820, 940-948 (2012).
- Sokolova, V., et al. Characterisation of exosomes derived from human cells by nanoparticle tracking analysis and scanning electron microscopy. Colloids and surfaces. B, Biointerfaces. 87, 146-150 (2011).
- Clayton, A., et al. Analysis of antigen presenting cell derived exosomes, based on immuno-magnetic isolation and flow cytometry. Journal of immunological. 247, 163-174 (2001).
- Cheruvanky, A., et al. Rapid isolation of urinary exosomal biomarkers using a nanomembrane ultrafiltration concentrator. Amer. J. Phys. Renal Phys. 292, F1657-1661 (2007).
- Carr, B., Warren, J. Company profile: NanoSight: delivering practical solutions for biological nanotechnology. Nanomedicine. 7, 1129-1132 (2012).
- Caby, M. P., Lankar, D., Vincendeau-Scherrer, C., Raposo, G., Bonnerot, C. Exosomal-like vesicles are present in human blood plasma. International immunology. 17, 879-887 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten