A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הקרנת siRNA לזיהוי יוביקוויטין ורגולטורים מערכת דמויות יוביקוויטין של מסלולים ביולוגיים בתאי יונקים בתרבית
In This Article
Summary
כאן, אנו מתארים מתודולוגיה לבצע siRNA ממוקד מסך "ubiquitome" לזהות היוביקוויטין רומן ורגולטורים כמו היוביקוויטין של התגובה התאית בתיווך HIF1A להיפוקסיה. זה יכול להיות מותאם לכל מסלול ביולוגי שבו חזקה לקריאה מהפעילות העיתונאית היא זמינה.
Abstract
שינוי שלאחר translational של חלבונים עם מולקולות יוביקוויטין וכמו היוביקוויטין (UBLs) מתגלה כרשת איתות תאית דינמית המווסתת את המסלולים ביולוגיים מגוונים כולל תגובת היפוקסיה, proteostasis, תגובת הנזק לדנ"א ושעתוק. כדי להבין טוב יותר כיצד UBLs להסדיר מסלולים רלוונטיים למחלות בבני אדם, יש לנו מלוקט siRNA אנושי "ubiquitome" ספרייה בהיקף של 1,186 בריכות דופלקס siRNA מיקוד כל ידוע וחזויי רכיבים של מסלולי מערכת UBL. ספרייה זו יכולה להיות מוקרנת נגד מגוון רחב של שורות תאים להביע כתבים של מסלולים ביולוגיים מגוונים כדי לקבוע אילו רכיבי UBL לפעול כרגולטורים חיוביים או שליליים של המסלול בשאלה. כאן אנו מתארים פרוטוקול ניצול בספרייה זו כדי לזהות ubiquitome-רגולטורים של התגובה התאית בתיווך HIF1A היפוקסיה באמצעות כתב בלוציפראז מבוסס שעתוק. שלב פיתוח assay ראשונימבוצע כדי לקבוע פרמטרים הקרנה מתאימים של הקו הסלולרי לפני ביצוע המסך בשלושה שלבים: הקרנה / deconvolution ראשונית, שניונית ושלישוניים. השימוש ממוקד על ספריות siRNA הגנום כולו הופך לפופולרי יותר ויותר כפי שהוא מציע את היתרון של דיווח רק על חברים של המסלול שבו החוקרים מעוניינים ביותר. למרות מגבלות מובנות של הקרנת siRNA, בפרט שווא חיובי שנגרם על ידי siRNA השפעות מחוץ היעד, זיהוי של רגולטורים רומן אמיתיים של המסלולים בשאלה עולה ליקויים אלה, אשר ניתן להתגבר על ידי ביצוע סדרה של ניסויי שליטה התחייבו בזהירות.
Introduction
שינוי של חלבונים עם מולקולות יוביקוויטין וכמו היוביקוויטין (UBLs) מייצג מערכת ביוכימית רחבת ידיים המווסתת את המסלולים ביולוגיים מגוונים ותגובות לחץ. הקובץ המצורף קוולנטיים של UBLs לחלבוני היעד שלהם יכול להיות תוצאות שונות המסדירות את היציבות, לוקליזציה, פונקציה או interactome של המצע 1. הצעדים האנזימטית שבבסיס שינוי UBL הוקמו ראשון ליוביקוויטין, וכעת משמשים כמופת לשינוי עם רוב UBLs, כולל SUMO, NEDD8, ISG15 וFAT10. ללהתרחש שינוי, קבוצת carboxylate של מוטיב diglycine UBL מופעלת לראשונה על ידי אנזים הפעלת E1 כדי ליצור תיאול עתירה אנרגיה שמועברת לציסטאין הפעיל באתר של אנזים conjugating E2. E2 אז אינטראקציה עם האנזים E3 בכריכת מצע לתווך העברת UBL על (בדרך כלל) שאריות ליזין יעד יצירת מסועפת שרשרת (isopeptide) הצמדה 2. סיבובים רצופים של שינוי יכולים להתרחש לבנות רשתות isopeptide על גבי המצע, אשר להיוביקוויטין יכול להתרחש דרך כל השבעה lysines, או באמצעות מתיונין N-המסוף שלה כדי ליצור שרשרות יוביקוויטין ליניארי. שינויים אלה יוצרים טופולוגיות דיסקרטיות עם מטרות מגוונות כגון יצירת מוטיבים אינטראקציה חדשות ומיקוד חלבונים להשפלה לפני הסרת UBL ידי פרוטאזות מומחה. במקרה של היוביקוויטין יש שני E1 אנזימים, 30-40 אנזימי conjugating E2, לפחות 600 E3 ligases וכ 100 אנזימים deubiquitylating (ממכנים). בעוד שהמסלולים הם פחות מרחיב לאחר 10 או כך UBLs, מורכבות ubiquitome הכוללות מאפשרת גיוון עצום בתוצאה הביולוגית של שינוי UBL מסוים. עם זאת, בעוד התקדמות גדולה בביולוגיה UBL נעשה, התפקידים הסלולריים המדויקים של רוב רכיבי ubiquitome אלה אינם ידועים.
השימוש בint הקצרחומצת erfering ריבונוקלאית (siRNAs) התפתחה ככלי רב עוצמה בגנטיקה הפוכה בשל היכולת של siRNAs למקד במיוחד mRNAs הסלולרי להשמדה, מה שמאפשר את תפקידם של גנים בודדים כדי להיבחן בהקשרים ביולוגיים שונים 3. מסכי הגנום כולו נעשו שימוש כדי לזהות ולאמת רגולטורים חדשים של תהליכים תאיים רבים, ויצרו שפע של מידע שימושי לנגיש לקהילה המדעית הרחבה יותר. עם זאת, בעוד מסכי הגנום כולו הוכיחו מאוד שימושיים, מסכי ממוקדים הופכים פופולריים יותר ויותר כמו שהם זולים יותר, מהירים יותר, כרוכים בפחות ניהול נתונים ודיווח רק על חברים של הגנום שבו החוקר הוא מעוניין ביותר. לכן, כדי להבין טוב יותר אילו רכיבי משפחת התהליכים תאיים UBL מעורבים, יש לנו מלוקט ספרייה אנושית siRNA מיקוד כל ידוע וחזויי מרכיבי ubiquitome. זה כולל את UBLs, אנזימי הפעלת E1, E2 conjugatingאנזימים, ligases E3, מחייב רישום היוביקוויטין (UBD) המכיל חלבונים וממכנים. ספרייה זו יכולה לשמש למסך נגד מגוון רחב של שורות תאי כתב של בעיות ביולוגיות שונות, ובכך מאפשרת זיהוי משוחד של רכיבי UBL רומן המסדירים מסלולים אלה.
הפרוטוקול הבא מתאר כיצד לבצע siRNA ממוקד קפדני ubiquitome מסך לזהות רגולטורים רומן של תגובת HIF1A תלויה להיפוקסיה. תחת מתח חמצן רגיל, HIF1A כפוף להידרוקסילציה prolyl שגורם לו להיות מוכרים וממוקדות לשפלה על ידי פון היפל לינדאו (VHL) מורכב האנזים E3 4. היפוקסיה מעכבת הידרוקסילציה prolyl המובילה להתייצבות HIF1A ובה לאחר מכן מחייב אלמנטי תגובת היפוקסיה (HREs) לנהוג ביטוי גנים. כאן, אנו מתארים מסך באמצעות תאי אוסטאוסרקומה U20S יציבות להביע גחלילית בלוציפראז תחת שליטתו של שלושה עותקי טנדם של Hypoxia תגובת אלמנט (תאי U20S-HRE) 5. פרוטוקול זה יכול להיות מותאם לכל מסלול ביולוגי אם קריאה מתוך חזק של פעילות העיתונאית הוא בר השגה והוא יכול להיות בשילוב עם בקרות חיוביות ושליליות מתאימות.
Protocol
1. Assay פיתוח שלב ב
הערה: לפני שאזם את מסך siRNA, שלב פיתוח assay הוא קריטי כדי לקבוע את פרמטרים חשובים להקרנה עם שורת תאי הכתב. זה חיוני להשקיע מאמץ משמעותי בשלב זה כמו זה יהיה לחזק את ההצלחה העתידית של המסך.
- כדי לאפיין את היפוקסיה, ההיענות של שורת תאי כתב U20S-HRE, לגדול 2 x 75 סנטימטר 2 צלוחיות של תאי U20S-HRE למפגש 80-90% בDulbeccos השתנה נשר בינוני (DMEM) בתוספת 10% FBS.
- לשאוב התקשורת מבקבוק אחד של תאים, לשטוף פעמיים עם 10 מיליליטר PBS ולנתק תאים על ידי הוספת 2 מיליליטר 0.05% פתרון טריפסין-EDTA ודוגר על 37 מעלות צלזיוס למשך 5 דקות. תאי resuspend ב 8 מיליליטר DMEM FBS 10% ופיפטה מעלה ומטה כדי ליצור השעיה תא הומוגנית.
- פיפטה 20 μl של ההשעיה לתא ספירת תאים, בשני עותקים, והכנס את התא לתא אוטומטי counter. לחץ על "תמונת תצוגה" על תוכנת דלפק התא ולהבטיח את התאים נמצאים בפוקוס. לחץ על "רוזן" ולעשות לעצמך את צפיפות התאים. חזור על פעולה זו לכפולות האחרות ולחשב את צפיפות תאים בממוצע. לדלל את התאים עם 10% FBS DMEM לריכוז של 60,000 תאים / מיליליטר.
- בעזרת פיפטה רבה, להוסיף 100 μl (6,000 תאים) של התאים בדילול מלא לאותו שלוש עמודות (למשל A5-H5, A6-H6 וA7-H7) של 5 96 גם צלחות assay בעלי קירות הלבנות סטרילי, ולהעביר חממת humidified 37 ° C ב 5% CO 2 בלילה. הערה: צלחות אלה ישמשו כדי לקבוע את פלט היפוקסיה תלויה לוציפראז עבור מגוון של חשיפות היפוקסיה: 0 שעות, 2 שעות, 6 שעות, 10 שעה ו24 שעות.
- בסופו של היום הבא, שים לב לזמן ולהוסיף את צלחת היפוקסיה 24 שעות לסט תחנת העבודה היפוקסיה לחמצן 1%. למחרת בבוקר, לחשב את שעות זמן 10, 6 שעות ושעה 2 לפני צלחת HR 24 נובעת יוסר frאום תחנת העבודה היפוקסיה. בזמנים אלה, להוסיף שעות 10, 6 שעות ו -2 צלחות שעות לתחנת העבודה היפוקסיה.
- הכן 30 מיליליטר של 2x חיץ תמוגה לוציפראז / assay משולב (50 מ"מ טריס פוספט pH 7.8; 16 מ"מ MgCl 2; 2 מ"מ DTT; 2% Triton-X-100; גליצרול 30%; 1 מ"מ ATP; BSA 1%; 0.25 מ"מ וציפרין ו8 מיקרומטר Na 4 P 2 O 7). הערה: להוסיף את המרכיבים לפי הסדר הרשום ולאפשר BSA דקות לפחות 30 לפזר לפני התוספת של וציפרין ו4 Na P 2 O 7.
- הסר את כל הצלחות מתחנת העבודה של היפוקסיה בזמן המתאים. הוספה של מאגר תמוגה לוציפראז / assay 2x 100 μl לבארות המתאימות צלחת assay ומכסים בסרט ברור. נער את הצלחות על שייקר צלחת דקות 10 ב 500 סל"ד lyse ביסודיות את התאים.
- מעביר את ערימת הצלחת לארון תקשורת luminometer הצלחת אוטומטית 96 כן. תחת תפריט "פרוטוקולים", בחר "שרירי בטן של 595" ולסמן את כל wells יש לקרוא במפת הצלחת על המסך תחת תפריט "גם בחירה". לחץ על "הפעל" כדי למדוד את הארה של כל אחד גם לאחר מכן לחשב את הקריאה הממוצעת של כל צלחת. לחשב את מתקפל עליית היפוקסיה תלויה פעילות כתב על ידי חלוקת הקריאה הממוצעת של כל צלחת היפוקסיה ידי הקריאה הממוצעת של normoxia (0 היפוקסיה hr) צלחת בקרה. שים לב: זה הכרחי כדי להתבונן תגובת לוציפראז היפוקסיה תלויה חזקה כדי להיות מתאים להקרנה. גידול של פי חמש ועשרה דקות בפעילות עיתונאית נחשב מצוין.
- צור צלחת יחידת שליטה המכילה ארבע גבוהה שליטת משכפל (HIF1A siRNA) (בארות A1-D1), ארבע שליטה נמוכה (FIH1 siRNA) משכפל (A12-D12 בארות), ארבעה חיץ לשלוט רק משכפל (בארות E1-H1) וארבעה משכפל שליטת siRNA יעד הלא (E12-H12), שבו כל בריכות siRNA הן בריכוז של 200 ננומטר. הערה: בקרה גבוהה ונמוכה נקבעת על בסיס רגולטורים מסלול ידועים שיגדלו וdecrלהקל על תגובת היפוקסיה בהתאמה. לחלופין, פיתוח assay באמצעות קבוצת משנה של הספרייה עשוי לשמש לזיהוי בקרות מתאימות.
- בעזרת פיפטה רבה, להעביר 10 μl של כל siRNA שליטה לצלחת assay סטרילי לבן מוקפת חומה. הכן תערובת transfection של מגיב transfection 0.1 μl ב10 μl בינוני מופחת סרום (1:100) לכל טוב, והעברה 10 μl של תערובת transfection לכל פקד היטב. פיפטה מעלה ומטה כדי לערבב בקצרה, ולהשאיר את הצלחת לנוח 20-60 דקות, כדי לאפשר היווצרות מורכבת transfection.
- הכן את ההשעיה תא של 75,000 תאים / מיליליטר בבקבוקון השני של תאי U20S-HRE. בעזרת פיפטה רבה, להוסיף 80 μl (6,000 תאים) של ההשעיה תא לכל תערובת transfection. להעביר את הצלחת לאינקובטור 37 מעלות צלזיוס humidified עם 5% CO 2 למשך 24 שעות, ולאחר מכן להעביר לתחנת עבודה היפוקסיה לשעה 24 נוספת ולבצע מבחני לוציפראז כמתואר בשלבי 1.61.8.
- לחשב את Z-הגורם לבקרה הגבוהה ונמוכה באמצעות Z הנוסחה = 1 - [3 X (סטיית תקן גבוהה שליטה + סטיית התקן של שליטה נמוכה) / (ממוצע גבוהה של שליטה - ממוצעת של שליטה נמוכה)]. הערה: ערך של בין 0.5-1 מציין assay מצוין ויש שאף ל.
2. מסך ראשי
הערה: ברגע שהתנאים הבסיסיים אלה משלב פיתוח assay נמצאים במקום, המסך הראשי יכול להתבצע בשלושה עותקים ב96 פורמט היטב צלחת באמצעות הפרוטוקול הבא.
- לגדול 7 x 75 סנטימטר 2 צלוחיות של תאי U20S-HRE למפגש 80-90% DMEM בתוספת 10% v / v בסרום שור העובר (FCS).
הערה: ביצוע השלבים 2.2-2.13 צריכים להתבצע ביום 1. - ליזום לשכפל 1 על ידי הכנת צלחת יחידת שליטה המכילה 200 μl של כל שליטה כמתואר בשלב 1.9 והפשרה מתוך סדרת דילול של ליטר ubiquitome siRNAibrary למינימום של 30 דקות. הערה: כל אחד גם מכיל מאגר של 4 siRNAs התאסף ב17 צלחות x 96 היטב עם עמודות 1 ו 12 נותר ריק עבור פקדים.
- בזרימה למינרית, תווית (או בר קוד) 17 צלחות סטרילי הלבנות מוקפות חומה assay עם מכסים ממספרי 1-17, מתאים לכל צלחת של סדרת ספריית siRNA.
- צנטריפוגה את צלחת יחידת השליטה וsiRNA ubiquitome בקצרה ספרייה (1 דקות ב2,000 XG) כדי להבטיח את כל siRNAs מצטבר בתחתית הבאר.
- השתמש מנפק נוזל אוטומטי לרובוט "חותמת" 10 μl של כל פקד מצלחת יחידת השליטה לצלחות assay 17, תוך שימוש באותה ערימת קצה 96 היטב לכל צלחת.
- שימוש במחסנית טרי 96, גם טיפ לכל אחת מצלחות ספריית 17, העברת 10 μl של כל ubiquitome siRNA לצלחת assay המקביל שלה באמצעות מתקן נוזלי אוטומטי.
- הכן 40 מגיב transfection מיליליטר ל17 צלחות assay באמצעות es היחסtablished ב1.10. הערה: זה כולל 20 מיליליטר נוסף כדי להסביר את "הנפח המת" במתקן הסלולרי. "הנפח המת" מתייחס לנפח של נוזל ההווה ללא הרף בתוך רשת צינורות במתקן הסלולרי.
- השתמש במתקן תא אוטומטי להעביר 10 μl של מגיב transfection לכל אחד גם בצלחות assay 17. בקצרה לנער את צלחות assay על שייקר (1 דקות ב500 סל"ד) כדי לאפשר ערבוב יסודי של siRNA ומגיב transfection, ולאחר מכן לעזוב את עדיין בטמפרטורת חדר למשך 20-60 דקות, כדי לאפשר siRNA: היווצרות מורכבת מגיב transfection.
- שטוף שני 75 סנטימטר 2 צלוחיות של תאי U20S-HRE פעמיים עם 10 מיליליטר PBS ולנתק עם 2 מיליליטר טריפסין-EDTA על 37 מעלות צלזיוס למשך 5 דקות. הוסף 8 מיליליטר DMEM FBS 10% לכל בקבוק ופיפטה מעלה ומטה מספר פעמים כדי ליצור השעיה תא הומוגנית. שלב את התאים משני צלוחיות ולהעביר לצינור פלסטיק 50 מיליליטר סטרילי.
- חישוב ריכוז תא על ידי pipetting20 תאי μl בשני עותקים לחדר ספירת תא ולחשב את ריכוז התא הממוצע משתי קריאות של מונה תא אוטומטי כמתואר בשלב 1.3.
- הכן 155 מיליליטר של השעיה תא על ידי דילול עם 10% FBS DMEM לריכוז של 75,000 תאים לכל מיליליטר במכל פלסטיק סטרילית. הערה: כרך זה מספיק עבור 17 צלחות וכולל 25 מיליליטר נוסף לנפח המת במתקן הסלולרי.
- הוספת stirrer מגנטי סטריליים להשעית התא ומניחים על stirrer להקים בתוך הזרימה למינרית להגביל clumping תא. לאזן את מתקן התא האוטומטי עם ההשעיה התא ולהגדיר אותו לוותר 80 μl של תאים לכל טוב (6,000 תאים).
- מניחים כל אחד מ17 הצלחות, בתורו, על מתקן התא האוטומטי ולוותר על תאים. רשום את הזמן וצלחות ערימה בקבוצות של 5 ואז למקם את הערימות בחממה 37 מעלות צלזיוס לחה ב 5% CO 2 למשך 24 שעות. שים לב: הריכוז הסופי שלבריכת siRNA תהיה 20 ננומטר ב100 μl נפח כולל.
הערה: ביצוע השלבים 2.14-2.15 צריכים להתבצע ביום 2. - ליזום לשכפל השני ביום 2, בעקבות ההליך המתואר ביום 1 ללשכפל 1 (2.2-2.13).
- לאחר 24 שעות של transfection, צלחות העברה מ1 לשכפל בסביבת סטרילית לתחנת עבודה היפוקסיה מוגדרת בחמצן 1% ולהשאיר ל24 שעות כדי לגרום לכתב HRE.
הערה: ביצוע השלבים 2.16-2.20 צריכים להתבצע ביום 3. - ליזום לשכפל השלישי, בעקבות ההליך המתואר ביום 1 ללשכפל 1 (2.2-2.13).
- לאחר 24 שעות של transfection, צלחות העברה מ2 לשכפל בסביבת סטרילית לתחנת עבודה היפוקסיה מוגדרת בחמצן 1% ולהשאיר ל24 שעות כדי לגרום לכתב HRE.
- שעות לפני לשכפל 1 צלחות הן שיש להסירו מתחנת העבודה של היפוקסיה, להכין 200 מיליליטר של חיץ תמוגה לוציפראז 2x / assay כמתואר ב1.6. הערה: כרך זה בcludes 20 מיליליטר נוסף כדי להבטיח את מאגר החיץ נשאר מכוסה היטב.
- הסר לשכפל צלחות assay 1 מתחנת העבודה היפוקסיה לאחר חשיפת היפוקסיה 24 שעות ושימוש במתקן נוזלי אוטומטי, להוסיף למאגר תמוגה לוציפראז 2x / assay 100 μl לכל צלחת assay ומכסים בסרט ברור.
- נער את הצלחות על שייקר תא 10 דקות ב 500 סל"ד lyse ביסודיות את התאים. העבר את כל צלחת בתורו לקורא צלחת luminometer והארת שיא כמתואר בשלב 1.8.
הערה: ביצוע השלבים 2.21-2.22 צריכים להתבצע ביום 4. - לאחר 24 שעות של transfection, צלחות העברה מ3 לשכפל בסביבת סטרילית לתחנת עבודה היפוקסיה מוגדרת בחמצן 1% ולהשאיר ל24 שעות כדי לגרום לכתב HRE.
- קראו לשכפל 2 צלחות על ידי השלבים הבאים 2.18-2.20 משמשים ללשכפל 1.
הערה: צעד 2.23 הבא צריכה להתבצע ביום 5. - קראו את 3 הצלחות לשכפל על ידי ביצועצעד 2.18-2.20 משמשים ללשכפל 1.
- לאסוף את כל 3 משכפל של המסך הראשי, ולחשב את גורם Z עבור כל צלחת באמצעות נוסחת נתונה ב1.12. הערה: אם כל צלחת יש גורם Z של פחות מ 0.5, לשקול חזרה על צלחת זה כדי לשפר את איכות הנתונים.
- לחשב את המקדם של שונות (CV) לגבוה ובקרות נמוכות על ידי שימוש בנוסחה הבאה: 100 סטיית תקן x שליטה / ממוצעת מכלל שליטה. הערה: קורות חיים צריכים להיות נמוכים ככל האפשר, סביר לצפות לוריאצית 10-15%. אם השינוי הוא גבוה יותר באופן משמעותי, לשקול חזרה על הצלחת.
- חישוב הפעלת אחוזים מכל siRNA לכל צלחת על ידי שימוש בנוסחה הבאה: [(ממוצעים גבוהה שליטה - ציון siRNA) / (ממוצע גבוה שליטה - ממוצע של שליטה נמוכה)] x 100 בנוסף, לחשב את היעד הלא (NT. ) פי של כל siRNA באמצעות הנוסחה [נתונים / ממוצע מדגם של NT]. עבור שני אחוזים וההפעלה NT פי, לחשב את הממוצע של שלוש replicאטס ולעבד את הערכים.
- שימוש בנתונים הגולמיים, לחשב מקדם מתאם הדירוג של ספירמן (SRCC) כדי לקבוע כיצד מקרוב שלוש הצלחות לשכפל לתאם באמצעות הנוסחה:
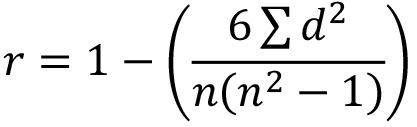
כאשר r = SRCC; ד = הבדל בין שני מספרים בכל זוג של שורות וn = מספר הזוגות של נתונים. הערה: מתאם טוב בין משכפל צלחת ייתן ערכים קרובים ל 1 אם לשכפל אחד מציג SRCC הנמוך נגד 2 צלחות האחרות, לחקור ולשקול חזרה על הצלחת ש.. - להחליט איזה siRNAs הם עניין מספיק להקרנה משנית (עד 80). מעסיק offs משתמש מוגדר חתך (למשל בחירה כל siRNAs מראה פחות מ -5% או מעל 95% הפעלת אחוז, או פחות מ 0.5 NT-קיפול או מעל 1.5 NT פי) או להחיל ביואינפורמטיקה או הנמקה מבוססת ידע כדי לחפש אשכולות של להיטים נופלים בתוך אותו מסלול UBL. הערה:בדרך כלל, שילוב של גישות אלו קובע אילו siRNA נלקחים בהקרנה משנית.
3. מסך משני
הערה: מסך המשני מאשרים מתבצע על בסיס מרבי של 80 siRNAs של עניין מהמסך הראשי. מספר זה יכול להתבצע בנוחות עם כל לשכפל מצופה על צלחת גם אחת 96 עם פקדים מלאים כמו לכל המסך הראשי (ראה 2.2). זה מאוד שימושי כדי לאשר שהרגולטורים זיהו במסך הראשי reproducibly לעורר את אותו הפנוטיפ, וזה יסייע בשיפור החלטות קביעת סדרי עדיפויות שבפוגעות צריכה להתבצע דרך מסך שיישונים / deconvolution הסופית.
- לגדול 1 x 75 סנטימטר 2 בקבוק של תאי U20S-HRE למפגש 80-90% בDMEM עם 10% FBS.
- שים לב למספר הלוחית והמיקום של להיטי המסך הראשיים, ולתכנן את מיקומם החדש בדובדבן המסך המשני הרים צלחת הראשית, עוזב עמודות 1ד 12 חינם לפקדים. הכן צלחת אמן השליטה כמו ב1.9 אבל עם נפח כולל של כל פקד של 50 μl.
- להפשיר סדרה שנייה דילול של ספריית ubiquitome (להפריש עבור בריכות siRNA בודדות קטיף דובדבן) למינימום של 30 דקות. צנטריפוגה בקצרה צלחות (1 דקות ב2,000 XG) ולאחר מכן להוסיף 50 μl של siRNAs המסך המשני למקומות הצלחת החדשים שלהם על הדובדבן הרים צלחת הראשית.
- לבצע את המסך המשני תוך שימוש באותו הפרוטוקול בסיסי שהותווה למסך הראשי בשינויים הבאים: (א) להפעיל את כל שלושת משכפל באותו היום בצלחת assay אחד ללשכפל ו (ב) להתאים את הכמויות של חומרים כימיים בהתאם.
4. / מסך Deconvolution על תיכונית
הערה: הקרנה שלישוני או deconvolution מבוצעת על מקסימום של 20 siRNAs מהמסך המשני. צעד זה הוא לבחון את ההשפעה של מציאה שימוש בכל siRNA בודד מקקי המקוריl של ארבעה. בדרך כלל, לפחות שני דופלקסים siRNA בודדים מכל בריכה צריכים לא חוקיים באותו הפנוטיפ יש מידה סבירה של ביטחון שהפנוטיפ שנצפה אינו נובע siRNA מחוץ יעד תופעות. כדי להגביר את הביטחון בשלב זה עוד יותר, יכול להיות מתוכנן דופלקסים siRNA פרט נוספים מיקוד הגן מדובר ונבדקו ליכולתם לעורר את הפנוטיפ נתון. תוצאות מניסויים אלה עשויות לאחר מכן ניתן להשתמש כדי לחשב את ציון H, כאשר H = 0.6 ומעלה (כלומר שבו לפחות 3 מתוך 5 siRNAs הבודד לעורר פנוטיפ) נחשב מקובל 6.
- לגדול סנטימטר אחד 75 2 בקבוק של תאי U20S-HRE למפגש 80-90% בDMEM עם 10% FBS.
- יצירת מפת צלחת למסך שהיישונים על ידי תכנון מיקומם של ארבעה דופלקסים siRNA האישיים של כל להיט על צלחת אדון מסך שלישוני, והשאיר את עמודות 1 ו 12 חינם לפקדים. הכן צלחת אמן השליטה כמו ב1.9 אבל עם סךנפח של כל שליטת 50 μl.
- להפשיר את צלחות deconvolution / siRNA הבודד ולהוסיף 50 μl של siRNAs הבודד (200 ננומטר) לבאר כל צלחת אדון מסך שיישונים על פי מפת הצלחת (4.2) כדי לאפשר לשלושה x 10 משכפל μl ועודף 20 μl נוח .
- לבצע את המסך שהיישונים משתמש באותו פרוטוקול בסיסי שהותווה למסך הראשי בשינויים הבאים: (א) להפעיל את כל שלושת משכפל באותו היום בצלחת assay אחד ללשכפל ו (ב) להתאים את הכמויות של חומרים כימיים בהתאם
הערה: באופן אידיאלי הסף לדופלקסים siRNA אדם צריך להיות מוגדר באותו ההחמרה חתוך כלברכה. עם זאת, זה עשוי להיות מקובל להירגע הסף על ידי 10-20% לsiRNAs פרט, במיוחד כאשר דופלקס לפחות אחד אחר נופל בתוך הסף שנקבע. זה נושא ראוי לזכור כי את ההשפעה נפרדת של siRNAs עשויה להיות פחות מזה שלהבריכה, ולעומת זאת, במקרים מסוימים siRNAs פרט עשויה להראות השפעה חזקה יותר על הפנוטיפ הסלולרי בבידוד מאשר כאשר הוא קיים בבריכה (גם כאשר ריכוז מטופלת).
תוצאות
לפני ההקרנה, היפוקסיה, יכולת התגובה של תאי U20S-HRE היא הוקמה. תאי U20S-HRE להביע לבנות כתב בהיקף של גחלילית בלוציפראז התמזגו במורד הזרם של שלושה עותקי טנדם של אלמנט תגובת היפוקסיה, שהוא מחויב heterodimer HIF1A/HIF1B בחשיפה להיפוקסיה (איור 1 א). תאים ממוקמים בתחנת עבודה היפוקסי?...
Discussion
השימוש במסכי siRNA הגנום בתאי יונקים הוכיחו להיות יקר מאוד בזיהוי רגולטורים רומן של מסלולים ביולוגיים מובהקים. הנה, יש לנו תיארתי את השימוש במסך siRNA ubiquitome ממוקד לזהות רגולטורים של התגובה התאית בתיווך HIF1A להיפוקסיה. מסכי ממוקדים הופכים אטרקטיביים יותר ויותר כמו שהם בדרך...
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי קרן Wellcome, GlaxoSmithKline (GSK) ואת המכון הסקוטי לאיתות סלולרי (כיום חלק של זירחון חלבון MRC ויחידת Ubiquitylation).
Materials
| Name | Company | Catalog Number | Comments |
| Automated Liquid Dispenser | Fluid-X | XPP-721 | http://www.fluidx.eu/BIOTRACK/xpp-721-liquid-handling-system.html |
| White Walled Assay Plate | Greiner Bio One | 655083 | http://www.greinerbioone.com/en/row/articles/catalogue/article/37_11/13221/ |
| Clear Plate Film | Perkin Elmer | 1450-461 | http://www.perkinelmer.co.uk/Catalog/Product/ID/1450-461 |
| siRNA library | Thermo Scientific | On-Target Plus | http://www.thermoscientificbio.com/rnai-and-custom-rna-synthesis/sirna/on-targetplus-sirna/search-gene/ |
| Transfection reagent | Invitrogen | Lipofectamine RNAimax | http://www.invitrogen.com/site/us/en/home/Products-and-Services/Applications/Protein-Expression-and-Analysis/Transfection-Selection/lipofectamine-rnaimx.html |
| Reduced Serum Medium | Invitrogen | Optimem | http://products.invitrogen.com/ivgn/product/31985062?ICID=search-product |
| DMEM | Invitrogen | 41965-039 | http://products.invitrogen.com/ivgn/product/41965039# |
| FBS | Invitrogen | 16000-044 | https://products.invitrogen.com/ivgn/product/16000044?ICID=search-product# |
| Tryspin-EDTA | Invitrogen | 25300-054 | https://products.invitrogen.com/ivgn/product/25300054?ICID=search-product# |
References
- Hochstrasser, M. Origin and function of ubiquitin-like proteins. Nature. 458, 422-429 (2009).
- Schulman, B. A., Harper, J. W. Ubiquitin-like protein activation by E1 enzymes: the apex for downstream signalling pathways. Nat Rev Mol Cell Biol. 10, 319-331 (2009).
- Siomi, H., Siomi, M. C. On the road to reading the RNA-interference code. Nature. 457, 396-404 (2009).
- Kaelin, W. G., Ratcliffe, P. J. Oxygen sensing by metazoans: the central role of the HIF hydroxylase pathway. Mol Cell. 30, 393-402 (2008).
- Melvin, A., Mudie, S., Rocha, S. The chromatin remodeler ISWI regulates the cellular response to hypoxia: role of FIH. Mol Biol Cell. 22, 4171-4181 (2011).
- Bhinder, B., Djaballah, H. A simple method for analyzing actives in random RNAi screens: introducing the "H Score" for hit nomination & gene prioritization. Comb Chem High Throughput Screen. 15, 686-704 (2012).
- Bett, J. S., et al. The P-body component USP52/PAN2 is a novel regulator of HIF1A mRNA stability. Biochem J. 451, 185-194 (2013).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. J Biomol Screen. 4, 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nat Methods. 6, 569-575 (2009).
- Stagg, H. R., et al. The TRC8 E3 ligase ubiquitinates MHC class I molecules before dislocation from the ER. J Cell Biol. 186, 685-692 (2009).
- Zhang, Y., et al. RNF146 is a poly(ADP-ribose)-directed E3 ligase that regulates axin degradation and Wnt signalling. Nat Cell Biol. 13, 623-629 (2011).
- Jackson, A. L., et al. Expression profiling reveals off-target gene regulation by RNAi. Nat Biotechnol. 21, 635-637 (2003).
- Birmingham, A., et al. 3' UTR seed matches, but not overall identity, are associated with RNAi off-targets. Nat Methods. 3, 199-204 (2006).
- . Whither RNAi. Nat Cell Biol. 5, 489-490 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved