Method Article
טרנספורמציה הפרחוני-Dip של פשתן (
In This Article
Summary
כאן, אנו מציגים פרוטוקול להפוך פשתן באמצעות Agrobacterium שינוי צמח בתיווך באמצעות פרחוני לטבול. פרוטוקול זה הוא פשוט לביצוע ולא יקר, עדיין מניב שיעור שינוי גבוה יותר מאשר בשיטות הזמינות הנוכחיות לשינוי פשתן.
Abstract
שינוי צמח בתיווך Agrobacterium באמצעות פרחוני לטבול הוא טכניקה המשמשת באופן נרחב בתחום של שינוי צמח וכבר דווח כמוצלח עבור מיני צמחים רבים. עם זאת, פשתן שינוי (Linum usitatissimum) על ידי פרחוני לטבול כבר דווח. לא המטרה של פרוטוקול זה היא להקים Agrobacterium ושהשיטה הפרחונית לטבול יכולה לשמש כדי ליצור פשתן מהונדס. אנו מראים כי טכניקה זו היא פשוטה, זולה, יעילה, ויותר מכך, נותנת שיעור שינוי גבוה יותר מאשר בשיטות הזמינות הנוכחיות של שינוי פשתן.
לסיכום, תפרחות של פשתן היו טבולות בתמיסה של Agrobacterium ביצוע פלסמיד ינארי וקטור (בר T-DNA בתוספת רצף הכנסת Linum, LIS-1) 1 - 2 דקות. הצמחים הונחו שטוחים בצד שלהם למשך 24 שעות. לאחר מכן, צמחים נשמרו בתנאי גידול נורמלים עד הטיפול הבא. לעיבודים של טבילה חזר על עצמו 2-3 פעמים, עם כ 10 - מרווחי יום 14 בין הטבילה. זרעי T1 נאספו ומונבטים על אדמה. לאחר כשבועיים, progenies טופל נבדקו על ידי PCR הישיר; 2-3 עלים שמשו לכל צמח בתוספת פריימרים T-DNA המתאימים. transformants החיובי נבחרו וגדל לפדיון. שיעור השינוי היה באופן בלתי צפוי גבוה, עם 50 - 60% מהזרעים מצמחים שטופלו להיות transformants החיובי. זהו שיעור שינוי גבוה יותר מאלו שדווחו לthaliana ארבידופסיס ומיני צמחים אחרים, באמצעות שינוי פרחוני לטבול. זה גם הגבוה ביותר, אשר כבר דיווח עד כה, לשינוי פשתן בשיטות אחרות לשינוי.
Introduction
פשתן (usitatissimum Linum) הוא יבול חשוב גדל באופן נרחב לסיבים ושמניה. הפיכתו של הגנום הפשתן אפשרית עם טכניקות כגון פציעה, זיהום Agrobacterium, ושיתוף טיפוח בתרבית רקמה, יישום חלקיקי biolistic או sonication אולטרסאונד ואחריו התחדשות. עם זאת, יש טכניקות אלה חסרונות רבים, כולל נטייה לאירועי מוטאציות רבות וזמן ממושך כדי להשיג את הקווים מהונדסים. חלק משיטות אלה יכולים להיות גם יקר ודורש מניפולציה מיומנת ויעילה של המכשירים, וכתוצאה מכך שתילי התאוששות נמוכים. והכי חשוב, טכניקה אלה לעתים קרובות מובילה לשיעורי שינוי נמוכים 2,6.
שינוי צמח בתיווך Agrobacterium באמצעות פרחוני לטבול הוא גישה פשוטה ויעילה ליצירת צמחים מהונדסים. כבר זה באופן שיגרתי ומשמש בהצלחה למיני צמחים רבים כגון ארבידופסיס thalian1,4, truncatula Medicago 11, עגבניות 12, חיטה ותירס 13 10. עם זאת, זה לא היה נחשב כטכניקה מעשית עבור שינוי פשתן בשל מספר גורמים, כגון מספרים הנמוכים של פרחים המיוצרים על ידי פשתן, מספר מצומצם של זרעים המתקבלים מכל פרח, גודל הזרע הגדול, והמעייל העבה, אשר יכול גם להיות בעייתי עבור תהליך שינוי גנטי כזה. בנוסף, מגזר הבחירה של הטכניקה הפרחונית לטבול דורש נובט זרעים הפכו בתקשורת צמח המכילה אנטיביוטיקה, עם progenies הפך מכובד המבוסס על היכולת שלהם לנבוט ולהישאר ירוקים, בעוד שאינו הופך progenies גם לא לנבוט או לנבוט אבל אקונומיקה במהירות ולמות. בספרות הנוכחית, זה כבר ציין כי פשתן wild-type נוטה לברוח ריכוז גבוה של בחירות אנטיביוטיקה, לייצר תוצאות חיוביות שגויות, ומה שהופך את הבחירה של progenies T1 מבוססעל עמידות לאנטיביוטיקה קשה 6,14 יותר. כמו כן, כאשר ריכוז גבוה של אנטיביוטיקה נוסף לבחירה בינונית, שיעור השינוי שנצפה ירידה דרמטית 9.
בפרוטוקול זה, השתמשנו Agrobacterium והשיטה הפרחונית לטבול להפוך קו של פשתן סיבים, נוצה סטורמונט (תגובה ופלסטיק), אשר הוכח להגיב ללחצים בסביבה על ידי שינוי הגנום שלו 3.5. כדי להתגבר על הבעיה בריחת האנטיביוטיקה, בחרנו לעשות בדיקות PCR ישירות של DNA מעלי T1, במקום בחירה על ידי הוספת האנטיביוטיקה לתקשורת הצמח. אנחנו ניצלנו את האנטומיה הפשוטה של פשתן כדי לעקוב אחר פרחים ספציפיים בעת הטיפול. מערכת מעקב זה אפשרה בחירה של זרעים מפרחים מסוימים ונביטה על אדמה מבלי להוסיף אנטיביוטיקה. transformants החיובי פשוט זוהו על ידי בדיקות DNA המתקבל מעלים באמצעות o השיטה מהירה והיעילהPCR הישיר f. התוצאות שלנו מראות כי השיטה הפרחונית לטבול עבדה טוב מאוד בקו הזה של פשתן והביאה באופן מפתיע בשיעור גבוה מאוד שינוי (50 - 60%), גבוה מאלו שנצפו בעבר עבור thaliana ארבידופסיס, אשר דווח להיות 0.1-1 1%, וגבוהים גם ממיני צמחים אחרים 10,12. גם בדקנו מגוון נוסף של פשתה (פשתן שמן), בתון (יציב ושאינם מגיב), ונתונים הראשוניים שלנו מצביעים על כך שפרחים לטבול פועל גם עבור מגוון זה של פשתן.
המטרה של פרוטוקול זה היא להראות שAgrobacterium ופרחונית לטבול יכולים לשמש כדי ליצור פשתן מהונדס. אנו מראים כי טכניקה זו היא פשוטה, זולה, ומהירה יותר מאשר שיטות אחרות של שינוי פשתן. יותר חשוב זה תוצאות בשיעור שינוי גבוה בהרבה מהשיטות האחרות של שינוי פשתן 2,6. האנטומיה של thaliana ארבידופסיס, שיש לו סניפים ופרחים רבים, maKES זה קשה להבחין טבל ולא טבל פרחים על אותו הצמח. לכן, מספר גדול של זרעים, כ -20,000 זרעים לכל צמח, צריכים להיות מוקרנים לזהות transformants החיובי 8. פשתן, לעומת זאת, יש פחות סניפים (סניף אחד עיקרי ומעט תופעות סניפים) ופחות פרחים, הפקה כ -100 זרעים לצמחים, המאפשרים לעקוב אחר פרחים בודדים וכדי לבחור זרעים מסוימים במהלך הקרנת תהליך.
אנו מציעים כי פרחוניים לטבול הוא שיטה ישימה כדי להפוך כל מינים קרובים של פשתן, סוג של כ -200 מינים. שיטה זו נותנת שיעור שינוי גבוה בהרבה מאשר שיטות אחרות של שינוי פשתן. כמו כן, אנו מציעים שהקרנת PCR הישירה של T1 עלה DNA היא דרך יעילה כדי להתגבר על הבעיה של בריחת עמידות לאנטיביוטיקה, כי לעתים קרובות מייצרת הרבה תוצאות חיוביות שגויות. הקרנת PCR ישירה יכולה להיות מיושמת על כל מיני צמחים אחרים ואינה מוגבלת to פשתן. טכניקת מעקב זרע הפשוטה המועסקות בפרוטוקול זה יכול להיות מיושמת על כל מיני צמחים אחרים עם הסתעפות האנטומיה דומה לפשתן.
Protocol
1. גידול הצמחים
- 6 שבועות לפני הטבילה, למלא 5 סירי אינץ 'עם אדמה ולזרוע זרעי פשתן ¼ אינץ' עמוק באדמה (4 זרעים לכל סיר). הקפד למצק את האדמה על הזרעים. להשקות את הצמחים באופן קבוע ולשמור אותם באור יום ארוך (14 שעות אור ו -10 שעות חשכה).
- בדקו צמחים באופן קבוע לתפרחות עיקריות (אשכולות של האיברים 'הפרחים). הצמחים מוכנים לשינוי כאשר הניצנים גלויים ויש לי רק נוצרו בתפרחת (איור 1 ו -2). כדי לראות את הניצנים, לחתוך את העלים סביבו במידת צורך.
הערה: שימוש בשלב הפרח הטוב ביותר היא קריטית ומפורט בדיון.- השתמש בסניף הראשי של המפעל לטיפול ניסיוני כפי שהיא מייצרת יותר מאשר פרחי braches הצד. השתמש בענפים בצד או כקבוצת ביקורת (שלא להיות טבולים) או לטיפולים ניסיוניים אחרים.
- לחלופין, השתמש בענפים העיקריים ואת הצד שלאותו מפעל לטיפול ניסיוני ולהשתמש בצמח אחר כמו שליטה או לטיפולים ניסיוניים אחרים. להשתמש במדבקות כדי לסמן ענפי פרט ופרחים בודדים עם התאריך וסוג הטיפול.
2. שיבוט וטרנספורמציה לEscherichia coli (E. coli) תאים
- לשכפל את הבר / הגן של עניין לאתר השיבוט מרובה של וקטור בינארי צמח חסת T-DNA.
- לבצע שיבוט בצעד אחד או שני צעדים.
- ישירות לשכפל מוסיף קטן בפרוטוקול זה (~ 500 נ"ב) לווקטור בינארי הצמח. בפרוטוקול זה, השתמש בצמח הווקטור בינארי (PRI909). אחרת, להשתמש בכל וקטורים בינאריים צמח אחרים באסטרטגיה דומה.
- לחלופין, לשכפל מוסיף גדול (≥6.5 kb) בשני שלבים: ראשון באמצעות ערכת שיבוט מסחרית כללית (לא לשתול ספציפי), ואז subclone לתוך הווקטור בינארי הצמח.
- לבצע שיבוט בצעד אחד או שני צעדים.
- הגדרת reac PCRtion כדי להגביר את הגן של עניין. עיצוב פריימרים עם אתרי הגבלה בסוף '5 (על פי אתר השיבוט מרובה של הווקטור בינארי הצמח בשימוש).
- לבצע PCR סטנדרטי באמצעות DNA פשתן הגנומי עם תנאי רכיבה על אופניים הבאים: אחיזה ראשונית של 24 מעלות צלזיוס, ולאחר מכן 2 דקות ב 94 מעלות צלזיוס, ואחריו 30 מחזורים של 98 מעלות צלזיוס למשך 5 שניות, 60 מעלות צלזיוס למשך 15 שניות, ו C ° 72 למשך 2 דקות. לבצע צעד ארכה סופי על 72 מעלות צלזיוס למשך 5 דקות ואחריו אחיזה בלתי מוגבלת על 4 מעלות צלזיוס.
- מוצרי PCR נפרדים על 1% agarose ג'ל טריס / Borate / EDTA (TBE), הפעילו את הג'ל על 100 V עבור שעה 1. לטהר את המוצרים מן הג'ל ולכמת באמצעות Nanodrop.
- להגדיר את תמהיל קשירה לשבט מוצר PCR בוקטור השיבוט המסחרי. עקוב הפרוטוקול של היצרן.
- להפוך את תערובת קשירה לE. כימי המוסמך תאי coli כדלקמן.
- הוסף 2 μl של תמהיל קשירה לבקבוקון אחד של chE. emically המוסמך תאי coli. דגירה על קרח למשך 30 דקות.
- חום לזעזע את התאים למשך 30 שניות על 42 מעלות צלזיוס (זמן הלם חום וטמפרטורה תלוי בסוג של תאים בשימוש).
- דגירה על קרח ולהוסיף 250 μl של מרק סופר אופטימלי RT עם דיכוי catabolite בינוני (SOC).
- שווי צינור דגירה שבייקרה מסלולית ב 200 סל"ד ב 37 מעלות צלזיוס במשך שעה אחת.
- מורחים 10-50 μl מכל שינוי על צלחת prewarmed LB (prewarmed על 37 מעלות צלזיוס) + אנטיביוטיקה סלקטיבית מתאימה (לקבוע את האנטיביוטיקה סלקטיבית המבוססת על הסוג של וקטור שיבוט מסחרי בשימוש). דגירה צלחות ב 37 מעלות CO / N.
- פיק ~ 10 מושבות לטיהור פלסמיד הכנת מיני, באמצעות ערכה מסחרית. טיהור פלסמיד הכנת Mini מבוצעת בדרך כלל כבא.
הערה: שמות מאגר ספציפיים לערכה המסחרית המשמשת אך הפונקציות הכלליות שלהם דומות.- לחסן מושבות אחת ב 2- 5 מיליליטר LB בינוני המכיל אנטיביוטיקה סלקטיבית המתאימה (נקבע בהתבסס על הסוג של וקטור מסחרי בשימוש).
- דגירה של כ 8 שעות ב 37 ° C עם (~ 300 סל"ד) הטלטול הנמרץ.
- קציר התאים על ידי צנטריפוגה ב6,000 XG במשך 10 דקות.
- Resuspend גלולה במאגר resuspension 250 μl. לערבב ומערבולת כדי לפזר את גלולה לחלוטין.
- Lyse תאי חיידקיים ידי הוספת 250 μl של מאגר תמוגה, ומערבב היטב על ידי היפוך הצינורות 4-6 פעמים.
- לנטרל את lysate במאגר הנטרול ולהפוך 4-6 פעמים כדי לערבב. צנטריפוגה למשך 10 דקות ב XG ~ 17900 על microcentrifuge טבלה העליון.
- העבר את supernatants משלב קודם לטור ספין. צנטריפוגה שוב ב ~ XG 17900 ל30-60 שניות.
- לשטוף את עמודת הספין על ידי הוספת חיץ כביסה 0.75 מיליליטר ו צנטריפוגות במשך 30 - 60 שניות. מחק את הזרימה דרך.
- צנטריפוגה ל1 דקות נוספות לרמהve חיץ לשטוף שיורי. מניחים את טור הספין בצינור microcentrifuge 1.5 מיליליטר נקי. לelute DNA, להוסיף מים 50 μl למרכז של כל עמודה. לתת לעמוד במשך דקות 1, ו צנטריפוגות 1 דקות.
3. ניתוח פלסמידים מזוקקים לנוכחות של Insert
- ההגבלה Digest:
- הגדרת הגבלה לעכל כדי לקבוע את הנוכחות של הכנס על ידי לעכל את הפלסמיד עם אנזימי ההגבלה בשימוש לשבט את הכנס. הגבלה כפולה טיפוסית לעכל תגובה כדלקמן: 1 מיקרוגרם של פלסמיד המטוהר, μl 1 של כל אנזימי הגבלה, 2 μl 10x הגבלה לעכל חיץ + 2 BSA μl (אם רלוונטי), X μl מים (לסך של 20 μl)
- מערבבים בעדינות ודגירה בטמפרטורה מומלצת (משתנה מאנזים אחד למשנהו).
- נתח את ההגבלה לעכל תגובה על 1% agarose ג'ל TBE, לרוץ ב -100 V עבור שעה 1 ולחפש נשירה בגודל מתאים.
- ניתוח PCR:
- הגדרת PCR עם פלסמיד המטוהר, באמצעות פריימרים מאזור הווקטור המסחרי כדי להגביר בתוך להוסיף או הצומת בין הווקטור ולהוסיף. פריימרים נפוצים הם M13 קדימה הפוך ופריימרים T3 / T7.
- בפרוטוקול זה, השתמש בתנאי הרכיבה על אופניים PCR הבאים: אחיזה ראשונית של 24 מעלות צלזיוס, ולאחר מכן 2 דקות ב 94 מעלות צלזיוס, ואחריו 18 מחזורים של 98 מעלות צלזיוס למשך 5 שניות, 60 מעלות צלזיוס למשך 15 שניות, ו -72 מעלות צלזיוס 2 דקות. לבצע צעד ארכה סופי על 72 מעלות צלזיוס למשך 5 דקות ואחריו אחיזה בלתי מוגבלת על 4 מעלות צלזיוס.
- מוצרי PCR עומס על 1% agarose ג'ל TBE ולרוץ ל100-120 V עבור שעה 1.
- רצף:
- שלח פלסמיד המטוהרים למתקן רצף מסחרי לנתח ולאשר את קיומו של הכנס.
- ברגע שהמבנה הנכון מתקבל, להשתמש בו לשלב השני של שיבוט (לתוך צמח הווקטור בינארי).
הערה: שלבי 2.3-3.3ניתן למנוע אם השיבוט יושלם בשלב אחד.
4. שיבוט לתוך הצמח בינארי וקטור (PRI909) וא ' טרנספורמציה coli
- הגדרת הגבלה כפולה לעכל תגובות לlinearize הווקטור בינארי הצמח ולבודד את הכנס המשובט בעבר שימוש באתרי אנזים ההגבלה אותו שנוספו לפריימרים (שלב 2.2).
- לנתח מעכלי הגבלת שימוש בג'ל אלקטרופורזה, לרוץ ב -100 V ל1-2 שעות. חותך את הכנס ואת הווקטור בינארי לינארית הצמח מג'ל.
- השתמש בערכה מסחרית לטהר את מוצרי ג'ל. עיין במדריך של היצרן.
- הגדר את תגובת קשירה ולקשור את התוסף לתוך הווקטור בינארי הצמח. ההוספה ליחס וקטור תלוי בגודל של הכנס והווקטור בינארי הצמח. בפרוטוקול זה להכניס LIS1 היה 6.5 kb וצמח הווקטור בינארי היה 9 kb. לפיכך, להשתמש 1: 2 להכניס ליחס וקטור.
- חזור על שלבים 2.4-3 לשינוי בקטריאלי, טיהור פלסמיד וניתוח. ברגע שהמבנה הנכון (להוסיף + וקטור בינארי צמח) מתקבל, המשך לelectroporation בשלב 5.
5. Electroporation לAgrobacterium tumefaciens תאים חשמלי מוסמכות
- להפשיר בקבוקון של Agrobacterium tumefaciens תאים חשמליים מוסמכים על קרח.
- להוסיף ng 1 של פלסמיד דנ"א הווקטור בינארי 20 μl של תאים מוסמכים, על קרח, ומערבבים בעדינות.
- צ'יל קובט electroporation 0.1 סנטימטר על קרח.
- העבר את תערובת התא / DNA המוסמך cuvettes electroporation, והקש כדי לאסוף את התערובת בתחתית. שים את קובט במכונה electroporator והדופק (תנאי מתח והזמן תלויים בגודל של קובט וelectroporator בשימוש).
- הוסף 1 מיליליטר של תקשורת SOC ותאים להעביר צינור 15 מיליליטר.
- דגירה עבור שעה 1 ב28-30° C, רועד ב 100 סל"ד. צלחת 50-100 μl של תאים על אגר LB + אנטיביוטיקה סלקטיבית מתאימה (תלוי בפלסמיד ינארי הצמח והזן של Agrobacterium משמש בשימוש זה פרוטוקול 50 מיקרוגרם / מיליליטר kanamycin ו -100 מיקרוגרם / מיליליטר סטרפטומיצין.).
- דגירה הצלחות עד 48 שעות ב 28 - C ° 30.
- חזור על שלב 2.5 לבחירת מושבה וטיהור פלסמיד.
- חזור על שלב 3 כדי לנתח את פלסמיד ולבדוק את התקינות של הכנס וT-DNA לפני השימוש במבנה לפרחים בעירום. חזור על שלב 3.2, באמצעות פריימרים PCR מרובים על פני האזור כולו להוסיף ועל פני אזורי T-DNA ועל ידי רצף כמו בשלב 3.3.
הערה: בפרוטוקול זה 4 פריימרים שונים תוכננו על פני T-DNA ו- 10 פריימרים על פני להוסיף. - ברגע שהנוכחות של פלסמיד בינארי הצמח במושבה Agrobacterium נבחרה הוא אישר, תאי מקום in גליצרול 50% ולאחסן ב -80 ° C. חנות שנותרה מושבות על הצלחת על 4 מעלות צלזיוס אם הם לשימוש בתוך שבוע אחד 7.
6. פרחים-לטבול
הערה: 2 ימים לפני פרחונית-טבילה:
- לגדל תאי Agrobacterium לשלב הנייח (OD 600 בין 0.5-1 מקובל) בLB + אנטיביוטיקה מתאימה בתקשורת נוזלית.
הערה: אלה הם אותם האנטיביוטיקה כמו בשלב 5.6, המבוסס על הווקטור בינארי הצמח והסוג של מתח Agrobacterium בשימוש. - התחל התרבות עם 1: 100 דילולים של (5 מיליליטר) O / N תרבות רוויה ולגדול ל24-48 שעות ב28-30 ° C תוך רועד בסל"ד 150. התרבות צריכה להגיע שלב midlogarithmic וסבירה יותר תהיה מתקרבת או בשלב נייח 1. OD של כ 0.8 (OD שוב בין 0.5-1 כל מקובל) 8. לאסוף את התאים על ידי צנטריפוגה ב 5000 xg ב RT.
- Resuspend התאים בינוני הסתננות (5.0% סוכרוז + .05-0.003% Silwet L-77). לסיבוב הראשון של טבילה, להשתמש 0.05% Silwet-77. לסיבובים השניה והשלישי, להפחית את הריכוז ל0.03% (מפורט בדיון).
- להמשיך לשלב הפרחוני לטבול. להניח את הצמח בצד שלה ולטבול רק את הניצנים נראו במדיום ההסתננות במשך 1-2 דקות. השאר את הצמח בצד שלה ולכסות אותו בניילון הנצמד כדי לשמור על לחות גבוהה בכיפה (איור 3).
- ביום המחרת, למקם את המפעל בתנוחה זקופה ולשמור בדרך כלל.
- כאשר הניצן גדל גדול יותר (בדרך כלל לאחר כ 10-14 ימים), חזור על שלבים 6.1-6.4. לצמצם את זמן טבילה ל30-60 שניות וSilwet-77 לריכוז 0.003%.
- לשמור על הצמחים בדרך כלל עד הזרעים שלהם בשלים ומוכנים לאיסוף (איור 4).
7. בחירת החיובית Transformants עם PCR הישיר
- לזרוע את זרעי T1 על אדמה כמו בשלב 1.1.
- לחלופין, לעשות בינוני מלח בסיסי Murashige וSkoog (בינוני MS) על ידי הוספת 2.2 גרם של המדיום + 4 g MS של אגר ב500 מיליליטר מים. החיטוי ויוצקים לתוך עציצים קטנים. שמור בC 4 מעלות עד בשימוש.
- לזרוע את הזרע על ידי הצבת אותם במדיום MS הקרושה. לשמור תחת אור יום ארוך (14 שעות אור ו -10 שעות של חושך). זרעים ינבטו בכ 4-6 ימים (איור 5).
- השתמש זרע אחד מכל פרח כנקודת התחלה. אם לא transformant חיובי מתקבל, לחזור על פעולה זו על ידי בחירת זרע אחר מהפרח.
הערה: זרעים שונים מבחן מאותו הפרחים, כי במקרים מסוימים לא כל הזרעים מפרח אחד יהיה להפוך. בחירת זרעים נוספים מפרחים ניסיוניים לפעמים יש צורך.
- בדוק על השתילים באופן קבוע. בכ -10 - 14 ימים לאחר נביטה, כאשר נכוןמשאיר לפתח, לבדוק את הצמחים עם PCR הישיר.
- הכן את תמצית ה- DNA עלה על ידי חיתוך 2-3 עלים (5 - 10 מ"ג במשקל) מכל שתיל ולמקם אותם בצינור microcentrifuge.
- להוסיף 180 μl של 50 מ"מ NaOH על צינור אחד, ודגירה של 10 דקות על 95 מעלות צלזיוס.
- לנטרל את התמצית על ידי הוספת 20 μl של 1 M טריס- HCl (pH 8.0).
- השתמש 1 μl של התמצית בתגובת PCR הישירה, באמצעות פריימרים המיועדים על פני T-DNA או להוסיף (איור 7), כדי לבחור עבור transformants החיובי.
- בפרוטוקול זה, להשתמש PCR הישיר עם אחיזה ראשונית של 24 מעלות צלזיוס, ולאחר מכן 2 דקות על 98 מעלות צלזיוס, ואחריו 40 מחזורים של (98 מעלות צלזיוס למשך 10 שניות, צעד חישול במשך 15 שניות, וצעד ארכה 68 ° C). לבצע צעד ארכה סופי ב 68 מעלות צלזיוס למשך 5 דקות ואחריו אחיזה בלתי מוגבלת על 4 מעלות צלזיוס. (עיין בטבלה 1 לפרטים על פריימרים, טמפרטורות חישול ופעמים ארכה למחזורים).
- לזהות transformants החיובי ולגדל אותם לפדיון. אם הזרעים מונבטים במדיום MS, השתלה לאדמה בסיר גדול (איור 5).
תוצאות
איור 1 - 4 להמחיש כמה הצעדים בתוך הפרוטוקול. באיורים 1 ו -2, העלים סביב ניצני התפרחת נחתכים לחשוף אותם לתאי Agrobacterium והשלבים השונים הניצן ששמשו לפיתוח הפרוטוקול. איור 3 מציג את התהליך של פרחים לטבול פשתן. איור 4, תערוכות דוגמא לאופן שיכול להיות מתויגים הענפים העיקריים ולוואי וכיצד פרט פרחים יכול להיות במעקב ומזוהה. איור 5 מראה כיצד ניתן מונבטים progenies T1 בתקשורת צמח MS ולאחר מכן הושתל בקרקע לבגרות. איור 6 מדגים כיצד רושף פשתן סוג יכול לברוח ריכוזים גבוהים של kanamycin, המאשר ממצאים קודמים בספרות 6,9,14.
איור 7 מראה דוגמא של ההגברה PCR ישירה מtransformants T1 החיובי. פרחי T1 נאספו ממ ' יורה עין והצד השני של מפעל T0 יחיד. כפי שניתן לראות מPCR הישיר, 8/12 צמחי T1 נבדקו חיוביים על ידי PCR והעצימו אזורים השונים ברחבי T-DNA. פריימרים שלנו גם נועדו בין LIS-1 הכנס ומספר אתרי שיבוט (איור 7 ו- C). אנחנו השתמשנו פריימרים נוספים מהווקטור בינארי הצמח כדי להגביר מגזרים שונים של T-DNA, כגון הגבול השמאלי ושליחות קטלנית NOS (מידע לא מוצג) או גבול הימני ואתר מרובה שיבוט (איור 7D). פריימרים ספציפיים להוספת LIS-1 גם בשימוש בפרוטוקול זה (מידע לא מוצג). רשימה של פריימרים מסופקת בטבלה 1. עם זאת, הרצפים של פריימרים אלה תלויים ברצף של הווקטור בינארי צמח T-DNA ולהוסיף המשמש את הפרחים לטבול. אנחנו גם ציינו כי לא היה הבדל משמעותי בשיעור השינוי בין הפרחים שנאספו מהענפים הראשיים וצד.
p-together.within-page = "תמיד"> 
איור 1. חיתוך העלים סביב ניצני התפרחת העיקריים לחשוף אותם לתאי Agrobacterim. () הניצנים מכוסים על ידי עלים. עלים (ב) קוצצו סביב הניצנים לחשוף אותם. (ג) מוגדל תמונה ממפעל ב (א) לאחר החיתוך לחשוף ניצנים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. שלבי הניצן השונים ששמשו בפרוטוקול זה כדי לקבוע את השלב הטוב ביותר לשימוש עבור לטבול הפרחוני. () ניצן השלב מוקדם הוא approxima tely 2 מ"מ. ניצן שלב ביניים (B) הוא כ 5 מ"מ. (C) ניצן השלב המאוחר הוא כ כ 1 סנטימטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. התהליך של פרחים-טבילת פשתן. () התפרחות העיקריות הם טבלו בתקשורת החדירה המכילה את תאי Agrobacterium. (B) מוגדל מ(). (ג) הצמחים טבולים מונחים שטוחים עד ליום המחרת, והסניפים טבלו מכוסים בפלסטיק כדי לשמור על לחות גבוהה. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

סניפי איור 4. התהליך של אוספי מעקב פרחים וזרעים, מצמחי T0 טופל () דוגמא של הצמח כולו עם הסניף הראשי (הסניף הגבוה ביותר במרכז) והן בצד (B - D).. . דוגמא של פרחים מהענפים השונים (E) דוגמא של הזרעים שנאספו מפרחים בודדים (שכותרתו - k). מהסניף הראשי לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5. שתילי T1 גדלים ללא בחירת אנטיביוטיקה. (א) זרעי T1 הםמונבטים על תקשורת צמח MS. (B) transformants חיובי, כפי שנקבע על ידי PCR הישיר, מושתלים לאדמה וגדל לפדיון. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 6. בריחה אנטיביוטיות, בעיה לבחירת T1, הוא להתגבר על ידי הקרנת PCR ישירה. זרעי פשתן () Wild הסוג מונבטים בתקשורת צמח MS ללא אנטיביוטיקה. זרעי פשתן (B) Wild הסוג מונבטים בתקשורת צמח MS + ריכוזי הגדלת של kanamycin (200 מיקרוגרם / מיליליטר, 600 מיליליטר / ק"ג, 1 מ"ג / מיליליטר). הזרעים (C) Wild סוג פשתן מונבטים בתקשורת צמח MS עם 2 מ"ג / מיליליטר kanamycin. (ד) PCR מפשתן wild-type וT1 שתיל באמצעות פריימרים kanamycin, כל amplified גן kanamycin (אגדות: EZ1: סמן DNA, FlaxS, flaxS wild-type, C: לשלוט שאינו טבול סניף, מא: צאצאי T1 מפרח "" שנאסף מהסניף הראשי, Sc, SD, Se, מדע בדיוני: progenies T1 של פרחים שונים "ג, ד, ה, ו" שנאספו מהענף הצדדי, W:. לא-DNA) אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
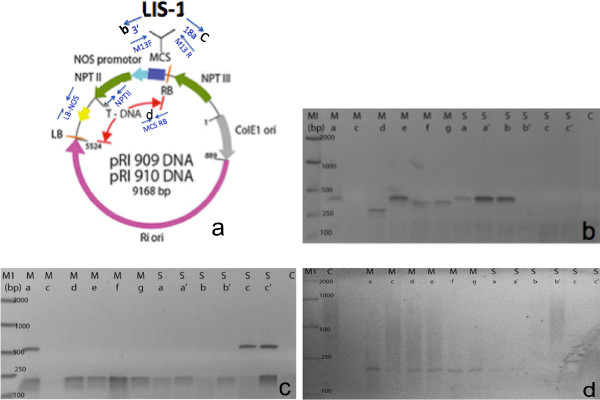
איור 7. דוגמא של amplifications PCR המוצלח של progenies T1 בשיטת PCR הישירה. (א) תרשים של הווקטור בינארי הצמח + להוסיף LIS-1 המשובט. חיצים כחולים מציינים את המיקום של פריימרים PCR משמשים בהקרנה הישירה PCR (שונה מTakara). (ב) PCR עם פריימרים M13F + 3 '(C) PCR עם פריימרים M13R + 18a (D) PCR עם פריימרים גבול תקין (RB) ואתר שיבוט מרובה (MCS) ** כל נתיב מייצג T1 מפרחים בודדים שנאספו מC: סניף שליטה (לא טבל), M: ag פרח הסניף הראשי, S: bc פרח ענף הצדדי '. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| מקור רצף פריימר קדימה | רצף 5'-3 " | מקור רצף פריימר הפוך | רצף 5'-3 " | טמפ חישול (° C) | הארכת זמן (שניות) | גודל צפוי (נ"ב) |
| M13F (T-DNA) | CTGCAAGGCG ATTAAGTTGG | 3 '(LIS-1 להוסיף) | GAGGATGGAA GATGAAGAAGG | 57 | 40 | 450 |
| 18 א (LIS-1 להוסיף) | TATTTTAACCC TATCTCCCAACAC | M13R (T-DNA) | ATTAGGCACC CCAGGCTTTA | 57 | 40 | 520 |
| MCS (T-DNA) | TGGTCATAGC TGTTTCCTGTG | RB (T-DNA) | TTTAAACTGA AGGCGGGAAA | 60 | 20 | 200 |
| LB (T-DNA) | TTTGATGGTG GTTCCGAAAT | NOS (T-DNA) | GAATCCTGTT GCCGGTCTT | 60 | 30 | 380 |
| NPTII (T-DNA) | GCGATACCGT AAAGCACGAG | NTPII (T-DNA) | GCTCGACGTT GTCACTGAAG | 65 | 45 | 502 |
טבלה 1. חלק מפריימרים המשמשים לבדיקת PCR הישירה.
Discussion
בחלק ממיני צמחים, כגון פשתן (usitatissimum Linum), שינוי מפעל מוצלח היה מוגבל. בעבר, שינוי בפשתן דרש זיהום Agrobacterium ידי פצע ושיתוף טיפוח, יישום חלקיקי biolistic או באמצעות sonication אולטרסאונד, ואחריו התחדשות; תהליך שהוא גם ארוך ונוטה להיות מלווה באירועי מוטאציות רבים. יתר על כן, תהליך הבחירה של טכניקות אלה מחייב השימוש בסמנים לבחירת אנטיביוטיקה כגון kanamycin. עם זאת, זה כבר ציין בספרות כי שיטה זו של בחירה מייצרת הרבה תוצאות חיוביות שגויות, כפשתן נוטה לברוח ריכוזים גבוהים של אנטיביוטיקה 6,9,14. חסרון נוסף של הטכניקות הקודמות בשינוי פשתן היה שיעורי שינוי הנמוכים 2,6.
בפרוטוקול המתואר כאן, שינוי צמח בתיווך Agrobacterium באמצעות פרחונית-טבילה הוצגלהביא לשיעור שינוי גבוה לפשתן (50 - 60%). Transformants התקבל מפרחים טבלו ונאספו מענפים ראשיים וצד. בחירה של transformants החיובי פשוט על ידי גידול צמחי T1 על אדמה והקרנת העלים שלהם זמן קצר לאחר שהם נבטו, השימוש באנטיביוטיקת הבחירה עובר-ידי, צעד ששמש בעבר כנורמה בפרחוני לטבול למיני צמחים אחרים. על ידי ביצוע בדיקות PCR ישירות של עלים, ותוך שימוש בפריימרים T-DNA המתאימים, transformants החיובי ניתן לבחור במהירות. טכניקה זו היא פשוטה, זולה וקלה לביצוע, אך תוצאות בשיעור שינוי גבוה בהרבה מאלה שדווחו בעבר לארבידופסיס ומיני צמחים אחרים בשיטה זו 1,10,12. כמו כן, שיעור השינוי המדווח הגבוה ביותר לפשתן.
עם זאת, ישנם צעדים קריטיים בהליכים, לרבות הבחירה של שלב הפרח הטוב ביותר ואת ריכוז החומרים פעילי השטח הטוב ביותר, כך שAgrobacterium יכולה לחדור לתוך תאי הצמח בלי להרוג את איברי הפרח. אם שלב מוקדם ניצן משמש (איור 2 א) עם Silwet-77 ריכוז גבוה של יותר מ 0.05%, הפרח לא יתפתח ולא להגדיר זרעים. אם שלב מאוחר ניצן משמש (איור 2 ג), אם כי ייתכן שהשינוי יעבוד, זה יתרחש בקצב נמוך בהרבה. תוצאות דומות התקבלו עם שינוי לטבול פרחוני ארבידופסיס 1,4. לפרוטוקול זה, את כל השלבים פרחוניים נבדקו עם Silwet-77 ריכוזים שונים והבמה הטובה ביותר הייתה נחושה להיות שלב ניצן האמצע (איור 2 ג) עם Silwet-77 על 0.05% לטבילה הראשונה, ואחריו טבילה שנייה ב שלב הניצן המאוחר (איור 2 ג) עם ריכוז Silwet-77 מעט מופחת של 0.03%. השינוי גם עבד היטב באמצעות שלב הניצן המוקדם (איור 2 א) עם silwet-77 ריכוז נמוך של 0.003%, ואחריוטבילה שנייה עם שלב ניצן אמצע (איור 2) בSilwet-77 ריכוז גבוה יותר של 0.05%.
בפרוטוקול זה, כמה פרמטרים אחרים ניסו לייעל את שיעור השינוי, אבל מצאו שאין לו השפעה על התוצאה הסופית. דוגמאות כוללות הארכת הזמן לאחר הטבילה שהצמחים שכבו על הצד שלהם ומכוסים בפלסטיק מיום אחד ליומיים; באמצעות OD של יותר מ 1 לתרבות Agrobacterium, במקום 0.5-1; להגדיל את זמן טבילה - 5, 15 דקות במקום 1-2 דקות. שוב אנחנו לא שמתנו לב כל השפעה על שיעור השינוי באמצעות אסטרטגיות אלה. הגורמים היעילים ביותר, עם זאת, נמצאו כי שימוש בצמחים בריאים בשלבי הפרח הנכונים, ובאמצעות ריכוז Silwet-77 הטוב ביותר. שם לב ששני מרווחי טבילה, עובד איכשהו זמן טוב יותר מאשר אחד, אף על פי שטבילת פעם אחת גם עובדת.
שינוי לפרוטוקול זה יכול להיות מושגת על ידי reducin g ריכוז Silwet-77 לקטנים כמו 0.003% בטבילה השנייה או שלישית. מאז Silwet-77 הוא רעילים, תוצאות ריכוז גבוהות מדי בפרחים מתפתחות בצורה גרועה, וכתוצאה מכך אין תשואת זרע. תדירות הטבילה יכולה להיות מופחתת לאחד, עם האירועים שני או שלישיים בוטלו אם הצמחים לא מחפשים בריאים והניצנים אינם מתפתחים היטב.
מגבלה העיקרית של שיטה זו היא המספר הנמוך של פרחים המיוצרים על ידי הפשתן, המספר המצומצם של זרעים המתקבלים מכל פרח, ומחזור החיים הארוך של פשתן. זה לוקח 6-8 שבועות מזריעת זרע יש ניצנים הראשוניים מוכנים לטבילה הראשונה ו8 נוספים - לאחר טבילה-10 שבועות כדי להגיע לדור T1. בסך הכל, טווח של 5 - יש צורך 6 חודשים כדי לקבל את דור T1. שלא כמו מיני צמחים אחרים, שפרח בכל עת של השנה, איזה פרח זני פשתן טוב יותר בזמנים מסוימים בשנה. תכנון כל כך מתחשב לטכניקה זו הוא חשוב.
התחת = "jove_content"> לסיכום, התוצאות שלנו לטבול פרחוני עם שני סוגי פשתן שונים: פשתן הסיבים, סטורמונט Cirrus (פלסטיק מגיב ו), ופשתן השמן, בתון (היציב ושאינו מגיב), מראים כי Agrobacterium - שינוי צמח בתיווך באמצעות פרחוני לטבול הוא שיטה ישימה ויעילה לשינוי פשתן והוא יכול לשמש כדי להחליף את הטכניקות ששמשו בעבר לשינוי פשתן. השינויים בשיטה הפרחוני לטבול בפרוטוקול זה יהיו ישימים לשימוש עם כל מיני צמחים אחרים ואינו מוגבל לפשתן.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the Ogelbay fund.
Materials
| Name | Company | Catalog Number | Comments |
| Flax seeds of the original Stormont Cirrus variety (PL) | |||
| 5" pots | |||
| Potting soil | |||
| Greenhouse with appropriate light setting | |||
| Thermocycler | |||
| Agarose gel electropheresis equipment | |||
| Digital imaging setup | |||
| Silwet-77 | LEHLE SEEDS | VIS-01 | Toxic, wear gloves |
| GoTaq Green Master Mix | Promega | Part# 9PIM712 | |
| Terra PCR Direct Polymerase Mix | Clontech | 639270 | |
| Binary vector PRI 909 | Takara | 3260 | |
| Agrobacterium tumefaciens LBA4404 E | Takara | 9115 | |
| TOPO TA cloning kit | Invitrogen | K4595-01 | |
| Sucrose | Fisher Scientific | ||
| Electroporator and cuvettes | Bio-Rad | 165-2092 | |
| Shaker | |||
| Spinner | |||
| Plastic wrap and aluminum foil wrap | |||
| speedSTAR DNA polymerase | Takara | RR070A/B | |
| QlAquick gel extraction kit | Qiagen | 28704 | |
| QIAGEN plasmid mini kit | Qiagen | 12123 | |
| SalI-HF enzyme | NEB | R3138S | |
| SacI-HF enzyme | NEB | R3156S | |
| T4 DNA ligation kit | NEB | M0202 | |
| Murashige Skoog | Sigma | M5524 | |
| Agar | Fisher Scientific | A360-500 |
References
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods Mol Biol. 343, 87-103 (2006).
- Beranova, M., Rakousky, S., Vavrova, Z., Skalicky, T. Sonication assisted Agrobacterium-mediated transformation enhances the transformation efficiency in flax (Linum usitatissimum L.). Plant Cell Tiss Organ Cult. 94, 253-259 (2008).
- Chen, Y., Schneeberger, R. G., Cullis, C. A. A site-specific insertion sequence in flax genotrophs induced by environment. New Phytol. 167, 171-180 (2005).
- Clough, S. J., Bent, A. F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Cullis, C. A. Mechanisms and Control of Rapid Genomic Changes in Flax. Ann Bot. 95, 201-206 (2005).
- Dong, J. Z., McHughen, A. An improved procedure for production of transgenic flax plants using Agrobacterium tumefaciens. Plant Sci. 88, 61-71 (1993).
- Logemann, E., Birkenbihl, R. P., Ulker, B., Somssich, I. S. An improved method for preparing Agrobacterium cells that simplifies the Arabidopsis transformation protocol. Plant Methods. 2 (16), (2006).
- Mara, C., Grigorova, B., Liu, Z. Floral-dip transformation of Arabidopsis thaliana to examine pTSO2::β-glucuronidase reporter gene expression. J Vis Exp. (40), (2010).
- Mlynarova, L., Bauer, M., Nap, J. -P., Pretova, A. High efficiency Agrobacterium-mediated gene transfer to flax. Plant Cell Rep. 13, 282-285 (1994).
- Mu, G., et al. Genetic transformation of maize female inflorescence following floral dip method mediated by agrobacterium. Biotechnology. 11 (3), 178-183 (2012).
- Trieu, A. T., et al. Transformation of Medicago truncatula via infiltration of seedlings or flowering plants with Agrobacterium. Plant J. 22 (6), 531-541 (2000).
- Yasmeen, A., et al. In Planta transformation of tomato. Plant Mol Biol Rep. 27, 20-28 (2009).
- Zale, J. M., Agarwal, S., Loar, S., Steber, C. M. Evidence for stable transformation of wheat by floral dip in Agrobacterium tumefaciens. Plant Cell Rep. 28, 903-913 (2009).
- Zhan, X. C., Jones, D. A., Kerr, A. Regeneration of flax plants transformed by Agrobacterium rhizogenes. Plant Mol Biol. 11, 551-559 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved