Method Article
Keten Çiçekli-Dip Dönüşüm (
Bu Makalede
Özet
Burada, biz çiçek daldırma yoluyla Agrobacterium aracılı bitki dönüşümü kullanarak keten dönüştürmek için bir protokol mevcut. Bu protokol için basit ve ucuzdur, ancak keten transformasyonu için mevcut veriler yöntemlere göre daha yüksek bir dönüşüm oranını verir.
Özet
Çiçeksi-daldırma yoluyla, Agrobacterium aracılı bitki transformasyon bitki transformasyonu alanında yaygın olarak kullanılan bir teknik olan ve çok sayıda bitki türleri için başarılı olduğu rapor edilmiştir. Ancak, çiçek daldırma ile keten (Linum usitatissimum) dönüşümü rapor edilmemiştir. Bu protokolün amacı bu Agrobacterium kurmak ve çiçek daldırma yöntemi transgenik keten oluşturmak için de kullanılabilir. Bu teknik, basit, pahalı olmayan ve etkili olan ve daha da önemlisi, keten dönüşüm akımı mevcut yöntemlere göre daha yüksek bir dönüşüm oranı elde edildiğini göstermektedir.
2 dakika - Özetle, keten inflorescences 1, bir ikili vektör plazmid (T-DNA fragmanı ayrıca Linum ekleme dizisi, Lis-1) taşıyan Agrobacterium çözeltisi içinde bekletilir. Bitkiler 24 saat kendi tarafında düz atıldı. Daha sonra, bitkiler bir sonraki işlem yapana dek, normal gelişim koşulları altında muhafaza edilmiştir. süreçdaldırma ile, 14 günlük aralıklarla - yaklaşık 10 ile 3 kez, - daldırma s 2 tekrarlandı. T1 tohumları toplanır ve toprağa çimlendirilmiştir. Yaklaşık iki hafta sonra, muamele edilen nesiller, doğrudan PCR ile test edilmiştir; 2-3 yaprak bitki artı uygun T-DNA primerleri başına kullanılmıştır. Pozitif transformantlar seçilir ve olgunlaşana kadar büyütülmüştür. pozitif dönüştürücüleri olarak muameleden geçirilmiş olan bitkilerin tohumlarının% 60 - dönüşüm hızı 50 ile, beklenmedik bir şekilde yüksek olmuştur. Bu Arabidopsis thaliana ve çiçek daldırma dönüşüm kullanarak diğer bitki türleri için bildirilenlerden daha yüksek bir dönüşüm oranıdır. Bu transformasyon için başka yöntemler kullanarak keten transformasyonu için, aynı zamanda bugüne kadar rapor edilmiş olan, en yüksek düzeydedir.
Giriş
Keten (Linum usitatissimum) kendi lifleri ve yağlar için yaygın olarak yetiştirilen önemli bir üründür. Keten genomunun dönüşüm örneğin yaralanma, Agrobacterium enfeksiyonuna ve doku kültürü içinde ko-kültivasyonu, rejenerasyonunun ardından biyolistik tanecikleri veya ultrason sonikasyon uygulama gibi tekniklerle mümkündür. Ancak, bu teknikler çok mutasyon olayları eğilimi ve transjenik çizgiler elde etmek üzere uzun bir süre de dahil olmak üzere pek çok dezavantajları vardır. Bu yöntemlerin bazıları, aynı zamanda pahalı olabilir ve düşük kurtarma fide sonuçlanan araçların yetenekli ve etkili manipülasyon gerektirebilir. En önemlisi, bu teknik genellikle düşük dönüşüm oranları 2,6 sonuçlanır.
Çiçek-daldırma yoluyla Agrobacterium aracılı bitki transformasyon transgenik bitkiler oluşturmak için basit ve etkili bir yaklaşımdır. Bu rutin olarak ve başarılı Arabidopsis thaliana gibi birçok bitki türleri için kullanılmaktadırbir 1,4-ta, medicago truncatula 11, domates 12, buğday 13 ve mısır 10. Ancak, bu tür nedeniyle keten tarafından üretilen çiçekler düşük sayılar gibi çeşitli faktörlere, keten dönüşümü için uygun bir teknik olarak düşünülmüş değil, her çiçek, tohum boyutu büyük ve kalın ceket elde edilen tohumların sınırlı sayıda, aynı zamanda genetik transformasyon süreci için sorunlu olabilir hangi. Yavrularıyla olmayan transforme ya çimlenme veya çimlenme ama çamaşır suyu yok iken Ayrıca, çiçek daldırma tekniği seçimi segmenti, filizlenmeye ve yeşil kalmak için kendi yeteneklerine göre ayırt dönüştürülmüş progeny'lerinde bir antibiyotik içeren bir bitki medyada dönüştürülmüş tohumların çimlenme gerektirir dışarı hızlı ve ölür. Mevcut literatürde, vahşi tip keten esaslı yalancı pozitif sonuçlar üreten, ve T1 progeny'lerinin seçim yapmak, antibiyotik seçimleri yüksek konsantrasyon kaçmak eğiliminde olduğu görülmüştürAntibiyotik direnci 6,14 daha zor. Antibiyotiğin yüksek konsantrasyon seçim ortamına ilave edildi, ayrıca, gözlenen dönüşüm oranı önemli ölçüde 9 düştü.
Bu protokol, biz onun genomu 3,5 değiştirerek ortamda streslere cevap gösterilmiştir elyaf keten, Stormont cirrus (duyarlı ve plastik), bir çizgi dönüştürmek için Agrobakteriyi ve çiçek daldırma yöntemi kullanılmıştır. Antibiyotik kaçış sorunu aşmak için, biz bitki medyaya antibiyotik ekleyerek yerine seçim, T1 yapraklarından DNA'nın doğrudan PCR testi yapmak için seçtiniz. Biz tedavi sırasında belirli çiçekler izlemek için keten basit anatomi yararlandı. Bu izleme sistemi antibiyotik eklemeden toprağa belirli çiçekler ve çimlenme gelen tohum seçimi izin. Pozitif transformantlar sadece DNA hızlı ve etkili bir yöntem kullanılarak o yapraklarından elde edilen testlerin yapılmasını tespit edildif direkt PCR. Bizim sonuçlarımız çiçek daldırma yöntemi keten bu hat çok iyi çalıştı ve şaşırtıcı bir çok yüksek dönüşüm oranı sonuçlandı göstermek - daha önce olduğu bildirildi Arabidopsis thaliana, gözlemlenen daha yüksek, (50% 60) 0,1-1 % 1 ve diğer bitki türlerinin 10,12 daha da yüksektir. Biz de keten tohumu (keten yağı) başka çeşitli Bethune test (stabil ve duyarlı olmayan), ve bizim ön veriler çiçek daldırma da keten bu çeşitli çalıştığını gösterir.
Bu protokolün amacı, Agrobacterium ve çiçek daldırma transgenik keten oluşturmak için kullanılabileceğini göstermektir. Bu teknik, basit, pahalı olmayan ve keten dönüşümün diğer yöntemlere göre daha hızlı olduğunu göstermektedir. Daha da önemlisi, keten dönüşüm 2,6 diğer yöntemlere göre çok daha yüksek bir dönüşüm oranı ile sonuçlanır. Birçok şubesi ve çiçekleri vardır Arabidopsis thaliana'nın anatomisi, makes zor daldırma ve aynı bitki üzerinde çiçek olmayan daldırma ayırt etmek üzere. Bu nedenle, tohumların çok sayıda, bitki başına yaklaşık 20,000 tohum, pozitif dönüştürücüleri 8 tanımlamak amacıyla taranması gerekir. Keten, diğer taraftan, mümkün bireysel çiçekler izlemek ve süreci tarama sırasında belirli tohum seçmek için yapar bitkilerin başına yaklaşık 100 tohum üreten az sayıda şube (bir ana dal ve yan dal birkaç) ve daha az çiçek vardır.
Biz çiçek daldırma keten ilgili herhangi bir tür, yaklaşık 200 türün bir cins dönüştürmek için uygulanabilir bir yöntem olduğunu öneriyorum. Bu yöntem keten dönüşümün diğer yöntemlere göre çok daha yüksek dönüşüm oranı verir. Biz de T1 yaprak DNA'nın doğrudan PCR taraması genellikle birçok yanlış pozitif üretir antibiyotik direnç kaçış sorunu aşmak için etkili bir yol olduğunu öneriyorlar. Doğrudan PCR taraması herhangi bir başka bitki türlerine uygulanabilir ve t sınırlı değildirketen o. Bu protokolde kullanılan basit bir tohum izleme yöntemi keten benzer anatomik dallanma ile herhangi bir diğer bitki türlerine uygulanabilir.
Protokol
1. Bitkiler Yetiştiriciliği
- 6 hafta önce daldırma için, toprak ile 5 inç kaplarını doldurmak ve keten tohumlarını ekmeye ¼ (saksı başına 4 tohum) toprakta derin inç. Tohumlar üzerinde toprak firmaya emin olun. Düzenli bitkileri sulamak ve uzun gün ışığı (14 saat ışık ve 10 saat karanlık) onları korumak.
- Düzenli birincil çiçek salkımına (çiçekler 'organlarının kümeleri) için bitkiler edin. tomurcuklar görebilir ve sadece çiçeklenme (Şekil 1 ve 2) içinde oluşturulmuş olan, bitkiler dönüşüm için hazırdır. , Tomurcukları görmek gerekirse çevresinde yaprakları kesmek için.
NOT: En iyi çiçek sahne kullanmak çok önemlidir ve Tartışma ayrıntılı.- Yan kollara daha fazla çiçek üretir gibi deneysel tedavi için bitkinin ana dalı kullanın. Yan dallar ya kontroller olarak (daldırma değil) ya da diğer deneysel tedaviler için kullanın.
- Alternatif olarak, ana ve yan dalları kullanınAynı deneysel tedavi tesisi ve bir kontrol olarak ya da diğer deneysel tedavilerin bir bitki kullanımı. Bireysel şube ve tarih ve tedavi türü ile bireysel çiçek işaretlemek için etiketleri kullanın.
2. Klonlama ve Dönüşüm Escherichia coli (E.coli) Hücreler için
- T-DNA barındıran bir bitki ikili vektörünün çok sayıda klonlama yerine Söz konusu parçacık, / genini klonlamak.
- Bir aşamada ya da iki aşamada klonlama yapın.
- Doğrudan bitki ikili vektör içine bu protokol (~ 500 bp) küçük uçlar klon. Bu protokolde, bitki ikili vektörü (PRI909) kullanın. Aksi takdirde, benzer bir strateji başka bitki ikili vektörleri kullanırlar.
- Seçenek olarak ise, iki aşamada, büyük ekleri (≥6.5 kb), klon: ilk (spesifik bitki değildir), daha sonra bitki ikili vektöre alt-klonlamak genel ticari klonlama kiti kullanılarak.
- Bir aşamada ya da iki aşamada klonlama yapın.
- PCR REAC kurmaksiyon ilgili geni amplifiye etmek için. (Kullanılan bitki ikili vektörünün çoklu klonlama sitesi göre) 5 'ucunda bir sınırlama siteleri ile primerleri tasarlamak.
- Aşağıdaki döngü koşulları ile bir standart PCR genomik DNA kullanılarak, keten yapın: 24 ° C lik bir başlangıç tutma, daha sonra 5 saniye boyunca 98 ° C 30 döngü, ardından 94 ° C'de 2 dakika, 15 saniye için 60 ° C ve 2 dakika için 72 ° C. 4 ° C'de beklemeye belirsiz, ardından 5 dakika süreyle 72 ° C'de son uzatma adımı gerçekleştirir.
- % 1 Tris / borat / EDTA (TBE) agaroz jeli üzerinde, ayrı PCR ürünleri, 1 saat boyunca 100 V'ta jel üzerinde çalıştırıldı. Jelden ürünleri arındırın ve Nanodrop üzerinden ölçmek.
- Ticari klonlama vektörü PCR ürünü clone ligasyon karışımı ayarlayın. Üreticinin protokolünü takip ediniz.
- Kimyasal olarak, yetkili E. içine ligasyon karışımı Dönüşümü aşağıdaki gibi coli hücreleri.
- Ch bir şişe içine ligasyon karışımı 2 ul ekleemically yeterli E. E. coli hücreleri. 30 dakika boyunca buz üzerinde inkübe edin.
- Isıtma 42 ° C'de 30 saniye boyunca hücrelerin şok (ısı şoku zaman ve sıcaklık kullanılan hücre türüne göre değişir).
- Buz üzerinde inkübe ve katabolik baskı (SOC) orta RT süper optimum suyu 250 ul ekleyin.
- Tüp kap ve bir saat boyunca 37 ° C'de 200 rpm'de bir orbital çalkalayıcı içinde inkübe edilir.
- 10 yayılır - bir (37 ° C'de önceden ısıtılmış) önceden ısıtılmış LB plakası + uygun seçici antibiyotik her dönüşüm 50 ul (kullanılan ticari klonlama vektörü türüne göre seçici antibiyotiği belirlenmesi). 37 ° CO / N ile inkübe edin.
- Bir ticari kit kullanılarak, ~ Mini hazırlık plazmid saflaştırma için 10 koloni seçin. Miniprep plazmid arındırma genel olarak aşağıdaki gibi gerçekleştirilir.
NOT: Tampon isimleri kullanılan ticari kit özgüdür ama genel işlevler benzer.- 2 tek koloniler inoküle- (Kullanılan ticari vektör tipine göre belirlenen) uygun seçici antibiyotiği içeren 5 ml LB ortamı.
- Çalkalama (~ 300 rpm) ile 37 ° C 'de yaklaşık 8 saat boyunca inkübe edilir.
- 10 dakika boyunca 6000 x g'de santrifüj ile hücreler hasat edilir.
- 250 ul yeniden süspansiyon tamponunda pelletini. Mix ve vorteks tamamen pelet dağıtmak için.
- 6 kez - lizis tamponu 250 ul ekleyerek bakteriyel hücreler Lyse, boruları 4 tersini iyice karıştırın.
- Nötralizasyon tamponunda lizatını nötralize ve 4 ters - karıştırmak için 6 kez. Bir masa üstü mikrosantrifüj üzerinde ~ 17.900 xg'de 10 dakika santrifüj.
- Bir spin kolon önceki adımdan Süpernatantlar aktarın. Santrifüj tekrar 30 ~ 17.900 xg - 60 saniye.
- 60 saniye - 30 0.75 ml yıkama tampon ve santrifüj ekleyerek spin kolon yıkayın. Flow-through atın.
- Ilave 1 dakika boyunca santrifüj remoartık yıkama tamponu ettik. Temiz bir 1.5 ml mikrosantrifüj tüpü içinde spin kolon yerleştirin. DNA Zehir için, her sütunun merkezine 50 ul su ekleyin. 1 dakika bekletin ve 1 dakika santrifüj.
3. Ekle Varlığı için Saf Plazmidler Analiz
- Kısıtlama Digest:
- Ekleme klonlamak için kullanılan sınırlama enzimleri ile plazmidin sindirilmesi ile, ek maddenin varlığını belirlemek için bir kısıtlama sindirimi ayarlayın. Aşağıdaki gibi tipik bir çift sınırlama reaksiyonu özeti: Saflaştırılmış plazmid 1 ug, her bir sınır enzimleri 1 ul, 2 ul 10x kısıtlama (20 ul bir toplam) tampon + 2 ul BSA (eğer varsa), su ul, X sindirimi
- Yavaşça karıştırın ve önerilen sıcaklıkta (bir enzim diğerine değişir) inkübe.
- Kısıtlama 1 saat için 100 V çalışacak,% 1 TBE agaroz jel üzerinde reaksiyonu sindirmek ve uygun büyüklükte açılan dışarı bakmak analiz.
- PCR analizi:
- Insert veya vektör ve kartuş arasındaki kavşak içine yükseltmek için ticari vektör bölgesinden primerler kullanılarak, saflaştırılmış plazmid ile PCR ayarlayın. Ortak primerler M13 ileri ve geri ve T3 / T7 primerlerdir.
- Bu protokol, aşağıdaki PCR çevrim koşulları kullanacaktır: ve daha sonra 5 saniye, 15 saniye için 60 ° C 98 ° C 'de 18 döngü, ardından 94 ° C'de 2 dakika, ve 72 ° C, 24 ° C bir başlangıç tutma 2 dakika karıştırıldı. 4 ° C'de beklemeye belirsiz, ardından 5 dakika süreyle 72 ° C'de son uzatma adımı gerçekleştirir.
- 1 saat süre ile 120 V - bir% 1 TBE agaroz jeli üzerinde yük PCR ürünleri ve 100 çalıştırın.
- Ardışık:
- Analiz ve ekin varlığını doğrulamak için ticari bir sıralama tesisine arıtılmış plazmid gönder.
- Doğru yapı elde edildikten sonra, (bitki ikili vektör içine) klonlanması ikinci adım için kullanılır.
NOT: 2.3 Adımları - 3.3Klonlama bir aşamada tamamlanır elimine edilebilir.
Bitki, ikili vektör (PRI909) ve E. coli içine 4. Klon coli Dönüşüm
- Bitki ikili vektör doğrusallaştırmak tepkileri sindirmek bir çift kısıtlama kurmak ve primerler (2.2 adım) ilave edildi Aynı kısıtlama enzim sitelerini kullanarak önceden klonlanmış insert izole.
- 2 saat - 1 için 100 V çalıştırmak jel elektroforezi kullanılarak kısıtlama digests analiz. Insert ve jelden doğrusallaşmış bitki ikili vektör kesin.
- Jel ürünleri arındırmak için bir ticari kit kullanın. Üreticinin kılavuzuna başvurun.
- Bitki ikili vektöre ekleme bağlamak için, ligasyon reaksiyonu ayarlayın. vektör oranı geçen parçanın boyutu ve bitki ikili vektör bağlıdır. Bu protokolde LIS1 insert 6.5 kb ve bitki ikili vektör 9 kb oldu. Vektör oranı 2 eki: Bu nedenle, 1 kullanın. 3 -> tekrarlayın 2.4 adımları. Doğru yapı (insert + bitki ikili vektör) elde edildikten sonra, 5. adımda elektroporasyon geçin.
Agrobacterium 5. Elektroporasyon Elektrikli yetkili hücreler tumefaciens
- Agrobacterium bir şişe buz üzerinde elektriksel yetkili hücreleri tumefaciens çözülme.
- Buz üzerinde, yetkin hücre 20 ul ikili vektör plasmid DNA 1 ng ekleyin ve yavaşça karıştırın.
- Buz üzerinde 0.1 cm elektroporasyon küvetine soğutun.
- Elektroporasyon küvetler yetkili hücre / DNA karışımı aktarın ve alt karışımı toplamak için dokunun. Electroporator makine ve nabız küveti koyun (voltaj ve zaman koşulları küvetin büyüklüğüne ve kullanılan elektroporatörü bağlıdır).
- 15 ml'lik bir tüpe SOC ortam ve transfer hücre 1 ml ilave edilir.
- 28-30 'de 1 saat süreyle inkübe edin100 rpm'de sallayarak, C °. Levha 50 - LB agar + uygun seçici antibiyotiği hücre 100 ul (bitki ikili plazmid ve kullanılan Agrobacterium ırklarına dayanıyor 50 ug / ml kanamisin ve 100 ug / ml streptomisin, bu protokol kullanımında.).
- 30 ° C - 28 48 saat kadar inkübe edin.
- Koloni seçimi ve plazmid saflaştırma için yineleyin 2.5.
- 3. adımı yineleyin plazmid analiz etmek ve çiçek-daldırma için yapı kullanmadan önce insert ve T-DNA'nın bütünlüğünü kontrol etmek. Aşama 3.3'te olduğu gibi, tüm uç bölgede ve T-DNA bölgeleri boyunca ve dizileme ile birden çok PCR primerleri kullanılarak adımı tekrar 3.2.
NOT: Bu protokolde 4 farklı primerler, T-DNA ve insert genelinde 10 primerleri genelinde tasarlanmıştır. - Ben seçilmiş Agrobacterium kolonisi bitki ikili plazmid varlığı onaylandıktan sonra, yer hücreleri-80 ° C de, n,% 50 gliserol ve saklayın. Bunlar, bir hafta 7 içinde kullanılacak ise deposu 4 ° C plaka üzerinde koloniler kalmıştır.
6. Çiçekli-Daldırma
Not: 2 gün önce çiçek-daldırma için:
- Sıvı ortamda LB + uygun antibiyotikler - sabit faz (kabul edilebilir 1 600 0.5 arasındaki OD) Agrobacterium hücreleri büyür.
Not: Bu bitki ikili vektör ve kullanılan Agrobacterium soyu türüne göre, Aşama 5.6 ile aynı antibiyotik bulunmaktadır. - 1 ile başlangıç kültürü: doymuş (5 mi) O / N kültürün 100 seyreltiler ve 24 büyümek - 150 rpm ile çalkalanarak bir 28-30 ° C'de 48 saat süredir. Kültür midlogarithmic faz ulaşmış olmalıdır ve daha büyük olasılıkla yaklaşan veya sabit faz 1 olacak. Yaklaşık 0.8 OD (0.5 ila 1 arasında yine OD tüm kabul edilebilir) 8. 5.000 x santrifüj hücreleri toplayınoda sıcaklığında örn.
- Sızma orta hücrelerin tekrar (% 5.0 sakaroz + ,05-,003% Silwet L-77). Daldırma ilk turda için,% 0.05 Silwet-77 kullanın. İkinci ve üçüncü turlarda için, (Tartışma ayrıntılı)% 0.03 ile konsantrasyonunu azaltmak.
- Çiçek-daldırma adım ile devam edin. Yan bitki yatırın ve 1-2 dakika sızma ortamında yalnızca görünür tomurcukları batırın. Yan bitki bırakın ve kubbe (Şekil 3) yüksek nem korumak için plastik örtü ile örtün.
- Bir sonraki gün, dik bir konumda bitki yer ve normal olarak korur.
- Tomurcuk (genellikle yaklaşık 10 sonra - 14 gün) daha büyüdüğünde - 6.4, 6.1 tekrar adımları. 0.003% 60 sn ve Silwet-77 konsantrasyon - 30 daldırma süresini azaltın.
- Onların tohumları (Şekil 4) tahsil edilecek olgun ve hazır olana kadar normal bitkiler koruyun.
Pozitif Tra 7. SeçimiDoğrudan PCR ile nsformants
- Adım 1.1 gibi toprağa T1 tohumlarını ekmeye.
- Seçenek olarak ise, 500 ml su içinde, agar MS ortamı + 4 g, 2.2 g eklenmesi ile Murashige ve Skoog bazal tuz ortamı (MS ortamı) görünür. Otoklav ve küçük bitki tencere içine dökün. Kullanılana kadar 4 ° C'de muhafaza edin.
- Katılaşmış MS ortamı üzerinde yerleştirerek tohum Sow. Uzun gün ışığı (14 saat ışık ve karanlık 10 saat) altında tutun. 6 gün (Şekil 5) - Tohumlar yaklaşık 4 çimlenir.
- Bir başlangıç noktası olarak, her çiçekten bir tohum kullanın. Hiçbir olumlu Transformant elde edilirse, çiçek başka tohum seçerek bu adımı tekrarlayın.
NOT: Aynı çiçeklerden Testi farklı tohumlar, bazı durumlarda bir çiçek bütün tohumlar dönüştürülmüş olacak çünkü. Deneysel çiçek ek tohum seçilmesi bazen gereklidir.
- Düzenli fide kontrol edin. Yaklaşık 10 - çimlenme sonrası 14 gün, ne zaman doğrugeliştirmek direkt PCR ile bitkiler testi bırakır.
- 3 yaprak - 2 keserek yaprak ekstresi, DNA hazırlayın - Her fide (5 ağırlık 10 mg) ve bir mikrosantrifüj tüp koyun.
- Her bir tüpe 50 mM NaOH, 180 ul ekleyin ve 95 ° C'de 10 dakika inkübe edilir.
- 1 M Tris-HCl (pH 8.0) 20 ul eklenmesi ile özü nötralize.
- Pozitif dönüştürücüleri seçmek, T-DNA ya da parçası (Şekil 7) üzerinde tasarlanan primerler kullanılarak, doğrudan PCR reaksiyonunda ekstresi 1 ul kullanın.
- Bu protokol, 24 ° C lik bir başlangıç tutma doğrudan PCR kullanarak, daha sonra 10 saniye, 15 saniye, tavlama aşamasında, 68 ° C'de bir uzatma aşaması 98 ° C (40 döngü, ardından 98 ° C'de 2 dakika, C). 4 ° C'de beklemeye belirsiz, ardından 5 dakika boyunca 68 ° C'de son uzatma adımı gerçekleştirir. (Döngüleri için primer, tavlama sıcaklıkları ve uzatma süreleri ile ilgili ayrıntılar için Tablo 1'e bakınız).
- Pozitif dönüştürücüleri tanımak ve olgunluk onları büyümek. Tohumlar daha büyük bir kap içinde toprağa MS ortamına nakli çimlendirilmiştir durumunda (Şekil 5).
Sonuçlar
Şekil 1-4 protokol dahilinde bazı adımları göstermektedir. Şekil 1 ve 2, çiçeklenme tomurcukları etrafında yaprakları Agrobacterium hücreleri ve protokolü geliştirmek için kullanılan farklı tomurcuk aşamalarında bunları ortaya çıkarmak için kesilir. 3 keten çiçek daldırma işlemi göstermektedir. Şekil 4, gösteren bir takip ve tespit edilebilir nasıl ana ve yan dallar etiketli olabilir ve nasıl bireysel çiçekler örneği. Şekil 5 T1 yavrularıyla, MS bitki medyada çimlenmiş ve daha sonra vade için toprağa nakledilen nasıl gösterir. Şekil 6 nasıl vahşi göstermektedir tipi keten literatürde 6,9,14 önceki bulguları teyit kanamisin yüksek konsantrasyonlarda kaçabilir.
Şekil 7, pozitif T1 transformantlar arasında doğrudan PCR amplifikasyonunun bir örneğini göstermektedir. T1 çiçekler m toplandıTek bir T0 bitkinin ain ve yan sürgünler. Doğrudan PCR görülebileceği gibi, 12/08 T1 bitkiler PCR ile pozitif test edilmiş ve T-DNA üzerinde farklı bölgeleri amplifiye. Bizim primerleri Lis-1 ek ve çok sayıda klonlama konumu (Şekil 7B ve C) arasında tasarlanmıştır. Biz, sol sınır ve NOS terminatörü (veriler gösterilmemiştir) ya da sağ sınır ve çoklu bir klonlama bölgesi (Şekil 7D), T-DNA 'nın farklı segmentinin amplifiye edilmesi bitki ikili vektöründen ek primerler kullanıldı. LIS-1 ekleme özgü primerler de bu protokol kullanıldı (veriler gösterilmemiştir). Primerlerin listesi Tablo 1 'de verilmiştir. Bununla birlikte, bu primerlerin sekansları, T-DNA bitki ikili vektör sekansı ve çiçek daldırma için kullanılan ekleme bağlıdır. Biz de ana ve yan dallar toplanan çiçekler arasında dönüşüm oranı açısından anlamlı bir fark olmadığını kaydetti.

Birincil çiçeklenme tomurcukları etrafında yaprakları Kesme Şekil 1. Agrobacterim hücreleri bunları ortaya çıkarmak için. (A) tomurcukları yaprakları ile kaplıdır. (B) Yapraklar bunları ortaya çıkarmak için tomurcukları etrafında kesilmiştir. (C) bitkiden görüntü Büyütülmüş tomurcukları maruz kestikten sonra (A). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 2. çiçek dalış için kullanılacak en iyi evresini belirlemek için bu protokolü kullanılan farklı tomurcuk aşamaları. (A) erken evre tomurcuk approxima olduğunu tely 2 mm. (B) orta kademe tomurcuk yaklaşık 5 mm'dir. (C) Geç evre tomurcuk yaklaşık yaklaşık 1 cm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 3. keten çiçek-daldırma işlemi. (A), birinci salkımına daldırma bitkiler ertesi güne kadar düz belirtilen (C). (A) 'dan Büyütülmüş (B) gerçekleştirildi. Agrobacterium hücreleri ihtiva eden infiltrasyon ortam içinde daldırılır ve kısa kolları muhafaza etmek plastik ile kaplanmıştır Yüksek nem. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

. Şekil 4. T0 tedavi bitkilerden çiçek izleme ve tohum koleksiyonları süreci, (A) ana dal (merkezi uzun şube) ile tüm bitki örneği ve yan dallar (B - D). Bir . farklı branşlardan çiçek örneği (E) Bireysel çiçeklerden toplanan tohumların bir örnek (etiketli - k). ana dalından bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.

Şekil 5. T1 fidanları antibiyotik seçimi olmadan yetiştirilmektedir. (A) T1 tohumları vardırMS bitki medya çimlenmiş. (B) Olumlu transformanlar, direkt PCR tarafından belirlenen, toprağa nakledilen ve vadeye kadar büyütülür. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 6. Antibiyotik kaçış, T1 seçimi için bir sorun, doğrudan PCR taraması ile aşılır. Antibiyotik olmadan MS bitki medya çimlenmiş (A) Yabani tip keten tohumu. (B) Yabani tip keten tohumu, MS bitki medya + artan konsantrasyonları üzerinde çimlenmiş ve kanamisin (200 mg / ml, 600 ug / ml, 1 mg / ml). vahşi tip keten ve T1 ila 2 mg / ml kanamisin. (D), PCR MS bitki ortam üzerinde yeşertilmiş (c) vahşi-tür keten tohumu kanamisin primerler kullanılarak, fide tüm çoğaltılan, C DNA işaretleyici, FlaxS, vahşi tip flaxS: EZ1: kanamisin geni (efsaneleri ified olmayan daldırma dalı kontrol Ma: çiçekten T1 döl "bir" ana dal toplanan, Sc, Sd, Se, Sf: yan dal, W toplanan değişik çiçek "c, d, e, f" T1 yavrularıyla:. no-DNA) , bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
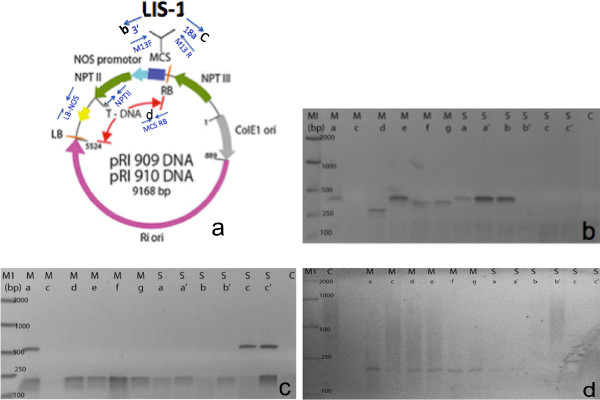
Şekil 7. direkt PCR yöntemi kullanılarak T1 progeny'lerinin başarılı PCR amplifikasyonlarının bir örnek. Bitki ikili vektör + klonlanmış LIS-1 ucun (A) şeması. Mavi oklar (Takara değiştirilmiş) doğrudan PCR taramasında kullanılan PCR primerleri konumunu göstermektedir. (B), PCR primerleri, M13F + ile 3 '(C), PCR ile primerler M13R + 18a primerler sağ sınırında (RB) ve çoklu klonlama sitesi (MCS) ile (D) PCR ** Her kulvar bireysel C toplanan çiçeklerden T1 temsil: Kontrol şube (non-daldırma), M: Ana dal çiçek ag, S: Yan dal çiçek bc '. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| İleri primer dizisi kaynağı | dizisi 5'-3 ' | Ters primer dizisi kaynağı | Sekans 5'-3 ' | Tavlama Sıcaklık (° C) | Uzatma Süresi (sn) | Beklenen boyutta (bp) |
| M13F (T-DNA) | CTGCAAGGCG ATTAAGTTGG | 3 '(LIS-1 ekleme) | GAGGATGGAA GATGAAGAAGG | 57 | 40 | 450 |
| 18a (LIS-1 ekleme) | TATTTTAACCC TATCTCCCAACAC | M13R (T-DNA) | ATTAGGCACC CCAGGCTTTA | 57 | 40 | 520 |
| MCS (T-DNA) | TGGTCATAGC TGTTTCCTGTG | RB (T-DNA) | TTTAAACTGA AGGCGGGAAA | 60 | 20 | 200 |
| LB (T-DNA) | TTTGATGGTG GTTCCGAAAT | NOS (T-DNA) | GAATCCTGTT GCCGGTCTT | 60 | 30 | 380 |
| NPTII (T-DNA) | GCGATACCGT AAAGCACGAG | NTPII (T-DNA) | GCTCGACGTT GTCACTGAAG | 65 | 45 | 502 |
Tablo 1. doğrudan PCR testi için kullanılan primerlerin bazı.
Tartışmalar
Böyle keten (Linum usitatissimum) gibi bazı bitki türlerinin,, başarılı bitki transformasyon sınırlı olmuştur. Daha önce, keten dönüşüm yaralama ve ortak ekimi, biyolistik parçacıkları uygulayarak ya da rejenerasyon ardından ultrason sonikasyon kullanarak bir Agrobacterium enfeksiyonu gerektiriyordu; Uzun ve eğilimli hem bir süreci birçok mutasyon olayları eşlik ediliyor. Ayrıca, bu teknikler arasında seçim süreci kanamisin gibi antibiyotik seçilebilir markerlerin kullanılmasını gerektirir. Bununla birlikte, keten antibiyotik 6,9,14 yüksek konsantrasyonlarda kaçış eğilimi seçimi bu yöntem, bir çok yanlış pozitif üreten literatürde not edilmiştir. Keten dönüşüm önceki tekniklerin bir diğer dezavantajı düşük dönüşüm oranları 2,6 olmuştur.
Burada anlatılan protokolde, çiçek-daldırma yoluyla Agrobacterium aracılı bitki transformasyon gösterildi(-% 60 50), keten için yüksek dönüşüm oranı yeterli olmaktadır. Transformantlar, ana ve yan dallarından daldırma ve toplanan çiçeklerden elde edilmiştir. Pozitif transformantların seçimi sadece by-pass antibiyotik seçimi kullanımı, toprak T1 büyüyen bitkiler ve çimlenmiş kısa bir süre sonra yapraklarını tarama tarafından yapıldı, bir adım önce diğer bitki türleri için çiçek daldırma bir norm olarak kullanmıştır. Yaprakların doğrudan PCR testi yapılarak ve uygun T-DNA primerleri kullanılarak, pozitif transformantlar hızlı bir şekilde seçilebilir. Bu teknik, bu yöntem 1,10,12 kullanılarak daha önce Arabidopsis ve diğer bitki türleri için rapor edilen çok daha yüksek bir dönüşüm oranı basit, ucuz ve kolay uygulanabilir olması, ancak sonuçlar. Ayrıca keten en yüksek bildirilen dönüşüm oranıdır.
Ancak, en iyi çiçek aşamasının seçimi ve iyi yüzey aktif madde konsantrasyonu gibi işlemlerde önemli adımlar, böylece oradaAgrobacterium çiçek organları öldürmeden bitki hücrelerine nüfuz edebilir. Erken sürgün aşamasında fazla% 0.05 yüksek Silwet-77 konsantrasyonu ile (Şekil 2A) kullanılırsa, çiçek geliştirme veya tohum vermeyecek. Dönüşüm çalışabilir, ancak son tomurcuk aşamasında (Şekil 2C) kullanılırsa, bu, çok daha düşük bir oranda gerçekleşir. Benzer sonuçlar Arabidopsis çiçek daldırma dönüşüm 1,4 ile elde edilmiştir. Bu protokol, tüm çiçek aşamaları ikinci daldırma ile, ardından farklı Silwet-77 konsantrasyonları ile test edilmiştir ve iyi aşama birinci daldırma için% 0.05 Silwet-77 orta tomurcuk aşama (Şekil 2C) olduğu belirlendi 0.03% biraz daha azalmış Silwet-77 konsantrasyonu ile geç tomurcuk sahne (Şekil 2C). Bu dönüşüm ayrıca, ardından% 0.003 düşük Silwet-77 konsantrasyonu ile erken tomurcuk aşama (Şekil 2A) ile çalıştı% 0.05 yüksek Silwet-77 konsantrasyonunda orta tomurcuk aşamasında (Şekil 2B) olan bir ikinci daldırma.
Bu protokolde, diğer bazı parametreler dönüşüm oranını optimize çalıştı, ancak nihai sonuç üzerinde hiçbir etkisi olduğu bulunmuştur. Örnekler bitkiler tarafında yatıyordu ve bir gün iki gün plastik kaplı olduğunu daldırma süre sonra uzanan içerir; Agrobacterium kültürü için birden fazla 1 OD kullanılarak yerine 0,5-1; 15 dakika yerine 1 - - 2 dakika 5 daldırma süresini arttırmak. Yine bu stratejileri kullanarak dönüşüm oranı üzerinde herhangi bir etkisi fark değil. En etkili faktör, bununla birlikte, doğru çiçek aşamalarında sağlıklı bitkiler kullanılarak, ve en iyi Silwet-77 konsantrasyonu kullanılarak bulunmuştur. Biz iki daldırma aralıkları, bir kez daldırma da çalışır halde, nedense daha iyi bir zaman çalıştığını fark ettim.
Bu protokole modifikasyonu reducin ile elde edilebilirg ikinci veya üçüncü daldırma olarak az 0.003 olarak% kadar Silwet-77 konsantrasyonu. Silwet-77 toksik olduğu için, çiçek çok yüksek bir konsantrasyon sonucu herhangi bir tohum verimi ile sonuçlanır kötü geliştirilmesi. bitkiler, sağlıklı görünümlü değil ve tomurcukları iyi gelişmekte değilse, ikinci veya üçüncü olaylar ortadan ile daldırma frekansı, birine azaltılabilir.
Bu tekniğin önemli bir sınırlama, keten, her bir çiçekten elde edilen tohum sınırlı sayıda ve keten uzun yaşam döngüsü tarafından üretilen çiçek düşük sayıdır. T1 nesil almak için 10 hafta sonrası daldırma - ilk daldırma için hazır birincil tomurcukları ve ek 8 için tohum ekimi 8 hafta 6 - alır. Toplamda, 5 bir dizi - 6 ay T1 nesil elde etmek gereklidir. Diğer bitki türlerinin aksine hangi çiçek yılın her zaman, yıllık belirli zamanlarda bazı keten çeşitleri çiçek daha iyi. Bu teknik için çok düşünceli planlama önemlidir.
, iki farklı keten çeşitleri ile çiçek dip bizim sonuçlarımız: keten, Stormont Cirrus (duyarlı ve plastik), ve yağ keten, (stabil olmayan duyarlı) Bethune, bu Agrobakteriyi gösteriyor - çiçek daldırma ile uyumlu bitki transformasyon keten transformasyonu için uygulanabilir ve etkili bir yöntem olup, keten transformasyonu için daha önce kullanılan tekniklerle yerine kullanılabilir. Bu protokolde çiçeksi-daldırma yöntemi tadilatları, diğer bitki türlerinden ile kullanım için uygulanan ve keten ile sınırlı olmayacaktır.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by the Ogelbay fund.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Flax seeds of the original Stormont Cirrus variety (PL) | |||
| 5" pots | |||
| Potting soil | |||
| Greenhouse with appropriate light setting | |||
| Thermocycler | |||
| Agarose gel electropheresis equipment | |||
| Digital imaging setup | |||
| Silwet-77 | LEHLE SEEDS | VIS-01 | Toxic, wear gloves |
| GoTaq Green Master Mix | Promega | Part# 9PIM712 | |
| Terra PCR Direct Polymerase Mix | Clontech | 639270 | |
| Binary vector PRI 909 | Takara | 3260 | |
| Agrobacterium tumefaciens LBA4404 E | Takara | 9115 | |
| TOPO TA cloning kit | Invitrogen | K4595-01 | |
| Sucrose | Fisher Scientific | ||
| Electroporator and cuvettes | Bio-Rad | 165-2092 | |
| Shaker | |||
| Spinner | |||
| Plastic wrap and aluminum foil wrap | |||
| speedSTAR DNA polymerase | Takara | RR070A/B | |
| QlAquick gel extraction kit | Qiagen | 28704 | |
| QIAGEN plasmid mini kit | Qiagen | 12123 | |
| SalI-HF enzyme | NEB | R3138S | |
| SacI-HF enzyme | NEB | R3156S | |
| T4 DNA ligation kit | NEB | M0202 | |
| Murashige Skoog | Sigma | M5524 | |
| Agar | Fisher Scientific | A360-500 |
Referanslar
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods Mol Biol. 343, 87-103 (2006).
- Beranova, M., Rakousky, S., Vavrova, Z., Skalicky, T. Sonication assisted Agrobacterium-mediated transformation enhances the transformation efficiency in flax (Linum usitatissimum L.). Plant Cell Tiss Organ Cult. 94, 253-259 (2008).
- Chen, Y., Schneeberger, R. G., Cullis, C. A. A site-specific insertion sequence in flax genotrophs induced by environment. New Phytol. 167, 171-180 (2005).
- Clough, S. J., Bent, A. F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Cullis, C. A. Mechanisms and Control of Rapid Genomic Changes in Flax. Ann Bot. 95, 201-206 (2005).
- Dong, J. Z., McHughen, A. An improved procedure for production of transgenic flax plants using Agrobacterium tumefaciens. Plant Sci. 88, 61-71 (1993).
- Logemann, E., Birkenbihl, R. P., Ulker, B., Somssich, I. S. An improved method for preparing Agrobacterium cells that simplifies the Arabidopsis transformation protocol. Plant Methods. 2 (16), (2006).
- Mara, C., Grigorova, B., Liu, Z. Floral-dip transformation of Arabidopsis thaliana to examine pTSO2::β-glucuronidase reporter gene expression. J Vis Exp. (40), (2010).
- Mlynarova, L., Bauer, M., Nap, J. -P., Pretova, A. High efficiency Agrobacterium-mediated gene transfer to flax. Plant Cell Rep. 13, 282-285 (1994).
- Mu, G., et al. Genetic transformation of maize female inflorescence following floral dip method mediated by agrobacterium. Biotechnology. 11 (3), 178-183 (2012).
- Trieu, A. T., et al. Transformation of Medicago truncatula via infiltration of seedlings or flowering plants with Agrobacterium. Plant J. 22 (6), 531-541 (2000).
- Yasmeen, A., et al. In Planta transformation of tomato. Plant Mol Biol Rep. 27, 20-28 (2009).
- Zale, J. M., Agarwal, S., Loar, S., Steber, C. M. Evidence for stable transformation of wheat by floral dip in Agrobacterium tumefaciens. Plant Cell Rep. 28, 903-913 (2009).
- Zhan, X. C., Jones, D. A., Kerr, A. Regeneration of flax plants transformed by Agrobacterium rhizogenes. Plant Mol Biol. 11, 551-559 (1988).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır