Method Article
Floral-Dip Transformation de lin (
Dans cet article
Résumé
Ici, nous présentons un protocole de transformer le lin en utilisant Agrobacterium transformation de plante médiée par l'intermédiaire floral creux. Ce protocole est simple à réaliser et peu coûteux, mais donne un taux de transformation plus élevé que les procédés actuellement disponibles pour la transformation de lin.
Résumé
Agrobacterium transformation de plante médiée par immersion florale est une technique largement utilisée dans le domaine de la transformation des plantes et a été rapporté comme étant efficace pour de nombreuses espèces végétales. Toutefois, le lin (Linum usitatissimum) par transformation floral creux n'a pas été signalée. L'objectif de ce protocole est d'établir que la méthode Agrobacterium et floral creux peut être utilisé pour générer le lin transgénique. Nous montrons que cette technique est simple, peu coûteux, efficace, et plus important encore, donne un taux de transformation plus élevé que les méthodes actuellement disponibles de la transformation de lin.
En résumé, les inflorescences de lin ont été plongées dans une solution d'Agrobacterium portant un plasmide vecteur binaire (fragment d'ADN-T en plus de la séquence d'insertion Linum, LIS-1) pour 1 à 2 min. Les plantes ont été posées à plat sur le côté pendant 24 heures. Ensuite, les plantes ont été maintenues dans des conditions de croissance normales jusqu'à ce que le traitement suivant. Les procèss d'immersion a été répétée 2-3 fois, avec environ 10 à 14 jours d'intervalle entre trempage. Les graines T1 ont été recueillies et mises à germer sur le sol. Après environ deux semaines, descendances traités ont été testés par PCR directe; 2-3 feuilles ont été utilisés par plante ainsi que les amorces d'ADN-T appropriées. Les transformants positifs ont été sélectionnés et cultivés jusqu'à maturité. Le taux de transformation est étonnamment élevé, avec 50 à 60% des semences de plantes traitées étant transformants positifs. Ce est un taux de transformation plus élevés que ceux rapportés pour Arabidopsis thaliana et d'autres espèces de plantes, en utilisant la transformation floral creux. Ce est aussi le plus élevé, qui a été rapporté à ce jour, pour la transformation de lin à l'aide d'autres méthodes de transformation.
Introduction
Lin (Linum usitatissimum) est une culture importante largement cultivé pour ses fibres et les huiles. La transformation du génome de lin est possible avec des techniques telles que la blessure, infection par Agrobacterium, et la co-culture dans une culture de tissu, à appliquer des particules biolistiques ou des ultrasons sonication suivie d'une régénération. Cependant, ces techniques présentent de nombreux inconvénients, notamment la propension à de nombreux événements de mutation et une période prolongée afin d'obtenir les lignées transgéniques. Certaines de ces méthodes peuvent également être coûteux et nécessitent une manipulation efficace du métier et des instruments, ce qui entraîne des plants de récupération faible. Plus important encore, ces techniques entraînent souvent des taux de transformation de faibles 2,6.
Agrobacterium transformation de plante médiée par l'intermédiaire floral creux est une approche simple et efficace pour générer des plantes transgéniques. Il a été utilisé avec succès et de façon routinière pour de nombreuses espèces de plantes telles que Arabidopsis Thalianun 1,4, Medicago truncatula 11, 12 tomate, le blé et le maïs 13 10. Cependant, il n'a pas été considéré comme une technique viable pour la transformation du lin en raison de plusieurs facteurs, tels que le faible nombre de fleurs produites par le lin, le nombre limité de graines obtenues à partir de chaque fleur, la grande taille des semences, et la couche épaisse, qui peut aussi être problématique pour un tel procédé de transformation génétique. En outre, le segment de sélection de la technique floral creux nécessite la germination des graines transformées sur un support végétal contenant un antibiotique, avec descendances transformées distingués en fonction de leur capacité à germer et rester vert, alors que les descendants non transformée, soit ne pas germer ou germer, mais l'eau de Javel rapidement et mourir. Dans la littérature actuelle, il a été noté que de type sauvage lin a tendance à échapper à forte concentration de sélections antibiotiques, produire de faux résultats positifs, et de faire la sélection des descendances T1 basesur la résistance aux antibiotiques plus difficile 6,14. En outre, quand une forte concentration d'antibiotique a été ajouté au milieu de sélection, le taux de transformation a chuté considérablement observée neuf.
Dans ce protocole, nous avons utilisé la méthode Agrobacterium et floral creux de transformer une ligne de lin textile, Stormont Cirrus (réactif et plastique), qui a été montré pour répondre aux contraintes de l'environnement en modifiant son génome 3,5. Pour surmonter le problème d'échappement antibiotique, nous avons choisi de faire des tests PCR directe de l'ADN à partir de feuilles de T1, au lieu de la sélection en ajoutant l'antibiotique aux médias de l'usine. Nous avons profité de simple anatomie de lin pour suivre fleurs spécifiques au moment du traitement. Ce système de suivi a permis la sélection des graines de fleurs et la germination spécifiques sur le sol sans ajouter antibiotique. Transformants positifs ont été tout simplement identifiés par des tests ADN obtenu à partir de feuilles en utilisant le rapide et efficace méthode of PCR directe. Nos résultats démontrent que la méthode floral creux fonctionnait très bien dans cette ligne de lin et étonnamment abouti à un taux de transformation très élevé (50-60%), le plus élevé que ceux précédemment observés pour Arabidopsis thaliana, qui a été signalé à être de 0,1 à 1 1%, et aussi élevés que d'autres espèces végétales 10,12. Nous avons également testé une autre variété de lin (lin oléagineux), Bethune (stable et non réactive), et nos données préliminaires indiquent que floral creux travaille également pour cette variété de lin.
L'objectif de ce protocole est de montrer que Agrobacterium et floral creux peuvent être utilisés pour générer le lin transgénique. On montre que cette technique est simple, peu coûteuse et plus rapide que d'autres méthodes de transformation de lin. Plus important encore, il en résulte un taux de transformation beaucoup plus élevé que les autres méthodes de lin 2,6 transformation. L'anatomie d'Arabidopsis thaliana, qui a beaucoup de branches et de fleurs, makes difficile de distinguer trempé et non trempé fleurs sur la même plante. Par conséquent, un grand nombre de graines, environ 20 000 graines par plante, doivent subir un dépistage pour identifier les transformants positifs 8. Lin, d'autre part, a moins de branches (une branche principale et quelques branches latérales) et moins de fleurs, produisant environ 100 graines par les plantes, ce qui permet de suivre les fleurs individuelles et pour sélectionner semences spécifiques pendant le processus de dépistage.
Nous proposons que floral creux est une méthode applicable à transformer des espèces apparentées de lin, un genre d'environ 200 espèces. Cette méthode donne des taux de transformation beaucoup plus élevés que d'autres méthodes de transformation de lin. Nous proposons également que le dépistage PCR directe de l'ADN T1 feuille est un moyen efficace de résoudre le problème de l'évasion de la résistance aux antibiotiques qui produit souvent de nombreux faux positifs. Criblage PCR directe peut être appliquée à toutes les autres espèces de plantes et ne est pas limitée to lin. La technique simple de suivi de semences employée dans ce protocole peut être appliqué à d'autres espèces de plantes avec ramification anatomie similaire à lin.
Protocole
1. la culture des plantes
- 6 semaines avant le trempage, remplissez pots de 5 pouces avec le sol et semer les graines de lin ¼ de pouce de profondeur dans le sol (4 graines par pot). Soyez sûr de tasser le sol sur les graines. Arrosez les plantes régulièrement et de les maintenir dans la longue lumière (la lumière de 14 h et 10 h foncé).
- Vérifiez plantes régulièrement pour inflorescences primaires (clusters des organes de fleurs). Les plantes sont prêtes pour la transformation lorsque les bourgeons sont visibles et ont seulement formé dans l'inflorescence (figure 1 et 2). Pour voir les bourgeons, couper les feuilles autour de lui si nécessaire.
NOTE: En utilisant le meilleur stade de la floraison est critique et est détaillée dans la discussion.- Utilisez la branche principale de l'usine pour le traitement expérimental car elle produit plus de fleurs que les Branches secondaires. Utilisez les branches latérales soit comme témoins (à ne pas croisement) ou pour d'autres traitements expérimentaux.
- Vous pouvez également utiliser les principales et secondaires branches de lamême usine pour le traitement expérimental et utiliser une autre usine comme un contrôle ou pour d'autres traitements expérimentaux. Utilisez des étiquettes pour marquer différentes branches et de fleurs individuelles avec la date et le type de traitement.
2. Clonage et à la transformation dans Escherichia coli (E. coli) Cellules
- Cloner le fragment / gène d'intérêt dans le site de clonage multiple d'un vecteur binaire de plante hébergeant l'ADN-T.
- Effectuer le clonage en une étape ou deux étapes.
- Cloner directement petits inserts dans ce protocole (~ 500 pb) dans le vecteur binaire de plante. Dans ce protocole, utiliser le vecteur binaire de plante (PRI909). Sinon, utiliser d'autres vecteurs binaires de plantes dans une stratégie similaire.
- Alternativement, cloner de grands inserts (≥6.5 ko) en deux étapes: d'abord en utilisant un kit de clonage commerciale générale (pas planter spécifique), puis sous-cloner dans le vecteur binaire de plante.
- Effectuer le clonage en une étape ou deux étapes.
- Mettre en place un réac PCRtion pour amplifier le gène d'intérêt. Conception des amorces avec des sites de restriction à l'extrémité 5 '(en fonction du site de clonage multiple du vecteur binaire de plante en cours d'utilisation).
- Effectuer une PCR standard utilisant de l'ADN de lin génomique avec les conditions de cyclage suivantes: une prise initiale de 24 ° C, puis 2 min à 94 ° C, suivie de 30 cycles de 98 ° C pendant 5 s, 60 ° C pendant 15 sec, et 72 ° C pendant 2 min. Effectuer une étape d'extension finale à 72 ° C pendant 5 minutes suivie d'une attente indéfinie à 4 ° C.
- Produits de PCR séparées sur 1% Tris / borate / EDTA (TBE) gel d'agarose, courent le gel à 100 V pendant 1 h. Purifier les produits du gel et de quantifier via Nanodrop.
- Mettre en place le mélange de ligature pour cloner le produit de PCR dans le vecteur de clonage commercial. Suivez le protocole du fabricant.
- Transformer le mélange de ligature dans E. chimiquement compétente cellules de E. coli comme suit.
- Ajouter 2 ul du mélange de ligature dans une fiole de chE. émiquement compétente cellules de E. coli. Incuber sur de la glace pendant 30 min.
- Choc thermique des cellules pendant 30 secondes à 42 ° C (chaleur heure de choc et de la température dépend du type de cellules utilisé).
- Incuber sur de la glace et ajouter 250 microlitres de RT super bouillon optimale avec la répression catabolique (SOC) moyen.
- Boucher le tube et incuber dans un agitateur orbital à 200 tpm à 37 ° C pendant une heure.
- Étaler 10-50 ul de chaque transformation sur une plaque préchauffée LB (préchauffé à 37 ° C) + antibiotique sélectif approprié (déterminer l'antibiotique sélectif basé sur le type de vecteur de clonage commercial utilisé). Incuber les plaques à 37 ° CO / N.
- Choisissez ~ 10 colonies pour mini-prep purification de plasmide, utilisant un kit commercial. Mini purification prep de plasmide est généralement effectuée de la manière suivante.
REMARQUE: Les noms tampons sont spécifiques à la trousse commerciale utilisée mais leurs fonctions générales sont semblables.- Inoculer les colonies isolées dans deux- 5 ml du milieu LB contenant l'antibiotique de sélection approprié (déterminé sur la base du type de vecteur utilisé commercial).
- Incuber pendant environ 8 heures à 37 ° C avec une agitation vigoureuse (~ 300 rpm).
- Récolter les cellules par centrifugation à 6000 xg pendant 10 min.
- Reprendre le culot dans le tampon de remise en suspension 250 ul. Mélanger et vortex pour disperser complètement la pastille.
- Les Lyse des cellules bactériennes en ajoutant 250 pi du tampon de lyse, mélanger soigneusement en inversant les tubes 4-6 fois.
- Neutraliser le lysat dans le tampon de neutralisation et inverser 4-6 fois pour mélanger. Centrifugeuse pendant 10 min à ~ 17 900 xg sur une microcentrifugeuse de table.
- Transférer les surnageants provenant de l'étape précédente à une colonne de centrifugation. Nouveau Centrifugeuse à ~ 17 900 g pendant 30 à 60 sec.
- Laver la colonne de centrifugation en ajoutant 0,75 ml de tampon de lavage et centrifuger pendant 30 - 60 secondes. Jeter le accréditives.
- Centrifugeuse pour un supplément de 1 min à Remove tampon de lavage résiduelle. Placer la colonne spin dans un tube de 1,5 ml microcentrifugeuse propre. Pour éluer l'ADN, ajouter de l'eau de 50 ul au centre de chaque colonne. Laisser reposer pendant 1 min et centrifuger pendant 1 min.
3. Analyser le purifiée plasmides pour la présence de l'insert
- Restriction Digest:
- Mettre en place une digestion de restriction pour déterminer la présence de l'insert par digestion du plasmide avec les enzymes de restriction utilisés pour cloner l'insert. Un double digest restriction typique réaction comme suit: 1 ug de plasmide purifié, 1 ul de chaque enzymes de restriction, 2 pi de tampon 10x digestion de restriction + 2 ul de BSA (le cas échéant), X pi d'eau (pour un total de 20 ul)
- Mélanger doucement et incuber à température recommandée (varie d'une enzyme à l'autre).
- Analyser le digestion de restriction réaction de 1% gel d'agarose TBE, fonctionner à 100 V pendant 1 heure et cherchez abandon de taille appropriée.
- L'analyse par PCR:
- Mettre en place une PCR avec le plasmide purifié, en utilisant des amorces à partir de la région du vecteur commercial pour amplifier l'intérieur de l'insert ou de la jonction entre le vecteur et l'insert. Amorces communes sont M13 avant et arrière et des amorces T3 / T7.
- Dans ce protocole, en utilisant les conditions de cycle de PCR suivantes: un maintien initial de 24 ° C, puis 2 min à 94 ° C, suivie de 18 cycles à 98 ° C pendant 5 s, 60 ° C pendant 15 sec, et 72 ° C pendant 2 min. Effectuer une étape d'extension finale à 72 ° C pendant 5 minutes suivie d'une attente indéfinie à 4 ° C.
- produits de PCR de charge sur un gel agarose à 1% TBE et exécutés pour 100 à 120 V pendant 1 h.
- Séquençage:
- Envoyer le plasmide purifié dans une installation de séquençage commercial à analyser et à confirmer la présence de l'insert.
- Une fois la construction correcte est obtenue, l'utiliser pour la deuxième étape du clonage (dans l'usine de vecteur binaire).
REMARQUE: Les étapes 02.03 à 03.03peut être éliminé si le clonage est réalisé en une seule étape.
4. Clonage dans l'usine vecteur binaire (PRI909) et E. coli Transformation
- Mettre en place une double digestion de restriction réactions de linéariser le vecteur binaire de plante et d'isoler l'insert préalablement clonée en utilisant les mêmes sites de restriction qui ont été ajoutés aux amorces (étape 2.2).
- Analyser les digestions de restriction par électrophorèse sur gel, de fonctionner à 100 V pour une à deux heures. Couper l'insert et l'usine vecteur binaire linéarisé du gel.
- Utilisez un kit commercial pour purifier les produits de gel. Consultez le manuel du fabricant.
- Mettre en place une réaction de ligature pour ligaturer l'insert dans le vecteur binaire de plante. L'insert de rapport de vecteur dépend de la taille de l'insert et le vecteur binaire de plante. Dans ce protocole, l'insert de 6,5 kb était LIS1 et la plante vecteur binaire était 9 kb. Par conséquent, utiliser un 1: 2 insert ratio de vecteur.
- Répétez les étapes de 2,4 à 3 pour la transformation bactérienne, la purification et l'analyse plasmidique. Une fois la construction correcte (+ insert usine vecteur binaire) est obtenu, passez à l'électroporation à l'étape 5.
5. L'électroporation dans des cellules d'Agrobacterium tumefaciens électrique compétentes
- Décongelez un flacon de Agrobacterium tumefaciens cellules compétentes électriquement sur la glace.
- Ajouter 1 ng d'ADN vecteur plasmidique binaire 20 ul de cellules compétentes, sur la glace, et mélanger doucement.
- Réfrigérer un 0,1 cm cuvette d'électroporation sur la glace.
- Transférer le mélange cellules / ADN compétent pour les cuvettes d'électroporation et touchez pour recueillir le mélange au fond. Placer la cuvette dans la machine d'impulsion d'électroporation et (conditions de tension et de temps dépendent de la taille de la cuve et électroporateur utilisé).
- Ajouter 1 ml de milieu SOC et les cellules de transfert à un tube de 15 ml.
- Incuber pendant 1 heure à 28-30° C, en agitant à 100 rpm. Planche 50 - 100 pi de cellules sur de la gélose LB + antibiotique sélectif approprié (dépendent du plasmide binaire végétal et la souche d'Agrobacterium utilisés dans ce protocole une utilisation 50 ug / ml de kanamycine et 100 ug / ml de streptomycine.).
- Incuber les plaques jusqu'à 48 heures à 28-30 ° C.
- Répétez l'étape 2.5 pour la sélection de la colonie et la purification du plasmide.
- Répétez l'étape 3 pour analyser le plasmide et de vérifier l'intégrité de l'insert et l'ADN-T avant d'utiliser la construction pour Fleuri-trempage. Répétez l'étape 3.2, en utilisant des amorces de PCR multiples à travers la région d'insertion et l'ensemble de toutes les régions d'ADN-T et par séquençage comme à l'étape 3.3.
NOTE: Dans ce protocole quatre amorces différentes ont été conçues dans l'ADN-T et 10 amorces à travers l'insert. - Une fois la présence de la plante plasmide binaire dans la colonie Agrobacterium sélectionnée est confirmée, place des cellules in 50% de glycérol et conserver à -80 ° C. Magasin restant colonies sur la plaque à 4 ° C si elles doivent être utilisées dans la semaine 7.
6. Floral-trempage
REMARQUE: deux jours avant Floral-trempage:
- Cultiver des cellules d'Agrobacterium pour la phase stationnaire (DO600 comprise entre 0,5 - 1 est acceptable) dans du LB + antibiotiques appropriés dans des milieux liquides.
NOTE: Ce sont le même antibiotique comme dans l'étape 5.6, basé sur le vecteur binaire de plante et le type de souche d'Agrobacterium utilisée. - Lancer la culture à 1: 100 dilutions d'un saturée (5 ml) O / N et la culture croître pendant 24-48 heures à 28-30 ° C tout en agitant à 150 tours par minute. La culture devrait avoir atteint la phase midlogarithmic et plus susceptibles sera approchant ou à une phase stationnaire. OD d'environ 0,8 (nouveau OD entre 0,5 à 1 sont tous acceptables) 8. Recueillir les cellules par centrifugation à 5000 xg à température ambiante.
- Remettre en suspension les cellules dans un milieu d'infiltration (5,0% de saccharose + de 0,05 à 0,003% Silwet L-77). Pour le premier tour de trempage, utiliser 0,05% Silwet-77. Pour les deuxième et troisième rondes, réduire la concentration à 0,03% (détaillées au Discussion).
- Passez à l'étape floral creux. Placez la plante sur le côté et tremper seulement les bourgeons visibles dans le milieu de l'infiltration pendant 1-2 min. Laissez la plante sur le côté et le couvrir d'une pellicule plastique pour maintenir une forte humidité dans le dôme (Figure 3).
- Le lendemain, placer la plante dans une position verticale et maintenir normalement.
- Lorsque le bourgeon grandit (généralement après environ 10-14 jours), répétez les étapes 6.1 à 6.4. Réduire le temps d'immersion de 30 à 60 sec et la concentration Silwet-77 à 0,003%.
- Maintenir les plantes normalement jusqu'à ce que leurs graines sont mûrs et prêts à être collectés (Figure 4).
7. Sélection de positif TraPCR directe avec nsformants
- Semez les graines de T1 sur le sol comme dans l'étape 1.1.
- Sinon, assurez-Murashige et Skoog de sel basale (milieu MS) en ajoutant 2,2 g de milieu MS + 4 g d'agar-agar dans 500 ml d'eau. Autoclave et verser dans des petits pots de plantes. Conserver à 4 ° C jusqu'à utilisation.
- Semez les graines en les plaçant sur le milieu MS solidifié. Conserver sous la lumière du jour à long (de lumière 14 h et 10 h d'obscurité). Les graines germent en environ 4-6 jours (figure 5).
- Utilisez une graine de chaque fleur comme un point de départ. Si aucun transformant positif est obtenu, répétez cette étape en choisissant une autre graine de la fleur.
Note: le test graines différentes des mêmes fleurs, car dans certains cas pas toutes les graines d'une fleur seront transformées. Sélection semences supplémentaires à partir de fleurs expérimentales est parfois nécessaire.
- Arrivée sur les plants régulièrement. Dans environ 10 à 14 jours après la germination, lorsqu'il est vrailaisse développer, tester les plantes avec la PCR directe.
- Préparer l'extrait d'ADN de feuilles en coupant 2-3 feuilles (5-10 mg en poids) de chaque plant et les placer dans un tube à centrifuger.
- Ajouter 180 ul de NaOH 50 mM à chaque tube, et incuber pendant 10 min à 95 ° C.
- Neutraliser l'extrait par addition de 20 pl de 1 M de Tris-HCl (pH 8,0).
- Utiliser une pi de l'extrait dans la réaction directe de PCR, utilisant des amorces conçues pour l'ADN-T ou l'insert (figure 7), pour sélectionner les transformants positifs.
- Dans ce protocole, utiliser PCR directe avec une prise initiale de 24 ° C, puis 2 min à 98 ° C, suivie de 40 cycles de (98 ° C pendant 10 sec, l'étape de recuit pendant 15 secondes, et une étape d'extension à 68 ° C). Effectuer une étape d'extension finale à 68 ° C pendant 5 minutes suivie d'une attente indéfinie à 4 ° C. (Voir le tableau 1 pour plus de détails sur les amorces, des températures de recuit et les temps de vulgarisation pour les cycles).
- Identifier les transformants positifs et les cultiver à l'échéance. Si les graines ont été mises à germer dans un milieu MS, greffe sur le sol dans un pot plus grand (Figure 5).
Résultats
Figure 1-4 illustrent quelques-unes des étapes dans le protocole. Dans les figures 1 et 2, les feuilles autour des bourgeons de l'inflorescence sont coupés de les exposer à des cellules d'Agrobacterium et les différentes étapes de bourgeons qui ont servi à élaborer le protocole. La figure 3 montre le processus de lin floral creux. Figure 4, montre un exemple de la façon dont les principales et secondaires branches peuvent être étiquetés et comment fleurs individuelles peuvent être suivis et identifiés. Figure 5 montre comment les descendances T1 peuvent être mises à germer sur les médias MS végétales puis transplantées dans le sol de la maturité. La figure 6 illustre comment sauvage Type de lin ne peut échapper à de fortes concentrations de kanamycine, confirmant les résultats antérieurs dans la littérature 6,9,14.
La figure 7 montre un exemple d'amplification par PCR directe de transformants positifs T1. Les fleurs T1 ont été recueillies à partir de la main et latéraux pousses d'une plante T0 unique. Comme on peut le voir à partir de la PCR directe, 8/12 plantes T1 ont été testés positifs par PCR et ont amplifié les différentes régions du T-ADN. Nos amorces ont également été conçus entre les LIS-1 insert et les sites de clonage multiples (figure 7b et C). Nous avons utilisé des amorces supplémentaires à partir du vecteur binaire de plante pour amplifier les différents segments de l'ADN-T, telles que la frontière gauche et le terminateur NOS (données non présentées) ou la bordure droite et le site de clonage multiple (figure 7D). Amorces spécifiques à la LIS-1 insert ont également été utilisés dans ce protocole (données non présentées). Une liste d'amorces est fourni dans le tableau 1. Cependant, les séquences de ces amorces dépend de la séquence du vecteur binaire usine d'ADN-T et l'insert utilisé pour le floral creux. Nous avons également constaté qu'il n'y avait pas de différence significative dans le taux de transformation entre les fleurs recueillies auprès des principales et secondaires branches.

Figure 1. Couper les feuilles autour des bourgeons de l'inflorescence primaires de les exposer aux cellules Agrobacterim. (A) Les bourgeons sont couverts par des feuilles. (B) Les feuilles ont été coupés autour des bourgeons de les exposer. (C) Image grossie de l'usine (A) après la coupe pour exposer bourgeons. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Les différents stades de bourgeons qui ont été utilisés dans ce protocole afin de déterminer la meilleure scène à utiliser pour la trempette floral. (A) Le bourgeon de stade précoce est approximation tement 2 mm (B) Le bourgeon de scène. moyenne est d'environ 5 mm. (C) Le bourgeon de stade avancé est d'environ 1 cm environ. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Le processus du lin floral-trempage. (A) Les inflorescences primaires sont plongés dans les médias d'infiltration contenant les cellules d'Agrobacterium. (B) agrandie de (A). (C) Les plantes croisement sont posés à plat jusqu'à ce que le lendemain, et les branches de croisement sont recouvertes de plastique pour maintenir une humidité élevée. Se il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

. Figure 4. Le processus de suivi de fleurs et de graines collections, des plantes T0 traité (A) Un exemple de la plante entière avec la branche principale (la branche la plus haute au centre) et le côté branches (B - D). Un . exemple des fleurs de différentes branches (E) Un exemple des graines récoltées à partir de fleurs individuelles (étiqueté - k). à partir de la branche principale Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5. Les plants sont cultivés T1 sans sélection antibiotique. (A) les graines T1 sontgermé sur le support MS des plantes. (B) Les transformants positifs, tel que déterminé par PCR directe, sont transplantées dans le sol et se est développée jusqu'à l'échéance. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 6. d'échappement aux antibiotiques, un problème pour la sélection T1, est surmontée par criblage direct PCR. (A) les graines de lin de type sauvage germées sur les médias MS végétal sans antibiotique. (B) graines de lin de type sauvage ont germé sur des supports de plantes MS + de concentrations croissantes de kanamycine (200 ug / ml, 600 pg / ml, 1 mg / ml). (C) de graines de lin de type sauvage germées sur des supports de plantes MS avec 2 mg / ml de kanamycine. (D) PCR à partir de type sauvage lin et T1 semis en utilisant des amorces à la kanamycine, tout amplified le gène de la kanamycine (légendes: EZ1: marqueurs d'ADN, FlaxS, flaxS de type sauvage, C: contrôler non trempé branche, Ma: T1 descendance de fleur "a" recueillies auprès de la branche principale, Sc, Sd, Se, Sf: descendances T1 de différentes fleurs "c, d, e, f" recueillies auprès de la branche latérale, W:. sans ADN) Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
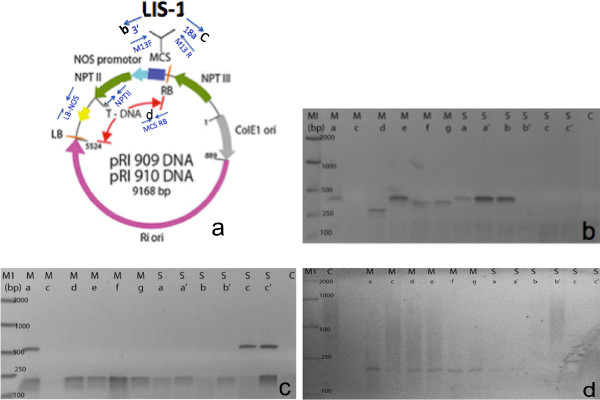
Figure 7. Un exemple d'amplifications PCR succès de descendances T1 en utilisant la méthode PCR directe. (A) Schéma du vecteur binaire usine + cloné LIS-1 insert. Les flèches bleues indiquent la position des amorces de PCR utilisés dans le criblage par PCR directe (modifié de Takara). (B) PCR avec des amorces M13F + 3 '(C) PCR avec des amorces M13R + 18a (D) PCR avec des amorces bordure droite (RB) et site de clonage multiple (MCS) ** Chaque voie représente T1 à partir de fleurs individuelles collectées à partir de C: branche de commande (non trempé), M: branche principale fleur ag, S: la branche latérale fleur bc '. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Source de séquence de l'amorce Forward | séquence 5'-3 ' | Source de séquence amorce inverse | Séquence 5'-3 ' | Recuit Temperature (° C) | Prorogation du délai (Sec) | La taille attendue (pb) |
| M13F (ADN-T) | CTGCAAGGCG ATTAAGTTGG | 3 '(LIS-1 insert) | GAGGATGGAA GATGAAGAAGG | 57 | 40 | 450 |
| 18a (LIS-1 insert) | TATTTTAACCC TATCTCCCAACAC | M13R (ADN-T) | ATTAGGCACC CCAGGCTTTA | 57 | 40 | 520 |
| MCS (ADN-T) | TGGTCATAGC TGTTTCCTGTG | RB (ADN-T) | TTTAAACTGA AGGCGGGAAA | 60 | 20 | 200 |
| LB (ADN-T) | TTTGATGGTG GTTCCGAAAT | NOS (ADN-T) | GAATCCTGTT GCCGGTCTT | 60 | 30 | 380 |
| NPTII (ADN-T) | GCGATACCGT AAAGCACGAG | NTPII (ADN-T) | GCTCGACGTT GTCACTGAAG | 65 | 45 | 502 |
Tableau 1. Certaines des amorces utilisées pour la PCR tests directs.
Discussion
Dans certaines espèces végétales, telles que le lin (Linum usitatissimum), la transformation de plantes avec succès a été limité. Auparavant, la transformation du lin a exigé une infection par Agrobacterium en blessant et co-culture, appliquer des particules biolistiques ou en utilisant des ultrasons sonication, suivie par la régénération; un processus qui est à la fois long et sujettes à être accompagné par de nombreux événements de mutation. En outre, le procédé de sélection de ces techniques nécessite l'utilisation de marqueurs de sélection d'antibiotiques tels que la kanamycine. Cependant, il a été noté dans la littérature que cette méthode de sélection produit un grand nombre de faux positifs, comme le lin a tendance à se échapper de fortes concentrations d'antibiotiques 6,9,14. Un autre inconvénient des techniques précédentes dans la transformation de lin a été le taux de transformation de faibles 2,6.
Dans le protocole décrit ici, Agrobacterium transformation végétale médiée par trempage floral a été montrépour aboutir à un taux de transformation élevé pour le lin (50 - 60%). Les transformants ont été obtenus à partir de fleurs de croisement et recueillies auprès des principales et secondaires branches. Sélection de transformants positifs a été fait simplement en cultivant des plantes T1 sur le sol et le dépistage leurs feuilles dès qu'elles ont germé, sans passer par l'utilisation de la sélection antibiotique, une étape précédemment utilisé comme norme dans floral creux pour d'autres espèces de plantes. En effectuant des essais de PCR directe de feuilles, et en utilisant les amorces d'ADN-T appropriées, des transformants positifs peuvent être rapidement sélectionnées. Cette technique est simple, peu coûteux et facile à réaliser, mais donne un taux de transformation beaucoup plus élevés que ceux précédemment rapportés pour Arabidopsis et d'autres espèces de plantes en utilisant cette méthode 1,10,12. Ce est aussi le taux de transformation la plus élevée signalée pour le lin.
Cependant, il ya des étapes critiques dans les procédures, y compris la sélection de la meilleure stade de la floraison et la meilleure concentration en tensioactif, de sorte queAgrobacterium peut pénétrer dans les cellules de plante sans tuer les organes floraux. Si un stade précoce des boutons est utilisé (figure 2A) avec une concentration élevée Silwet-77 de plus de 0,05%, la fleur ne se développera pas, ni mettre en graines. Si stade tardif des bourgeons est utilisé (figure 2C), bien que la transformation pourrait fonctionner, il va se produire à un rythme beaucoup plus faible. Des résultats similaires ont été obtenus avec Arabidopsis dip floral transformation 1,4. Pour ce protocole, toutes les étapes floraux ont été testés avec différents Silwet-77 concentrations et le meilleur stade était déterminé à être le stade du bouton du milieu (figure 2C) avec Silwet-77 à 0,05% pour la première immersion, suivie d'une seconde immersion au la fin du stade du bourgeon (figure 2C) avec une concentration Silwet-77 légèrement réduit de 0,03%. La transformation a également bien fonctionné en utilisant le stade du bouton (Figure 2A) avec une faible concentration Silwet-77 de 0,003%, suivie parun deuxième trempage avec stade du bouton du milieu (figure 2B) à une concentration plus élevée Silwet-77 de 0,05%.
Dans ce protocole, d'autres paramètres ont été tentées pour optimiser le taux de transformation, mais je ai trouvé ne avoir aucun effet sur le résultat final. Les exemples incluent proroge le délai après trempage que les plantes mettent sur leur côté et couverts en plastique d'une journée à deux jours; en utilisant une DO de plus de 1 pour la culture d'Agrobacterium, au lieu de 0,5 à 1; l'augmentation du temps d'immersion de 5 à 15 min au lieu de 1 à 2 min. Encore une fois nous ne avons pas remarqué aucun effet sur le taux de transformation à l'aide de ces stratégies. Les facteurs les plus efficaces, cependant, ont été trouvés à l'aide de plantes saines aux stades de fleurs correctes, et en utilisant la meilleure concentration Silwet-77. Nous avons remarqué que deux intervalles de trempage, fonctionne en quelque sorte mieux que une seule fois, même si une immersion de temps fonctionne aussi.
Modification de ce protocole peut être atteint par Reducing la concentration Silwet-77 à aussi peu que 0,003% dans le deuxième ou le troisième trempage. Depuis Silwet-77 est toxique, une trop forte concentration entraîne les fleurs développent mal, résultant en un rien de rendement en graines. La fréquence d'immersion peut être réduit à un, avec les deuxième ou troisième événements éliminés si les plantes ne sont pas à la recherche en santé et les bourgeons ne se développent pas bien.
Une limitation majeure de cette technique est le faible nombre de fleurs produites par le lin, le nombre limité de graines obtenues à partir de chaque fleur, et le cycle de lin longue durée de vie. Il prend 6-8 semaines à partir de semis d'avoir les bourgeons primaires prêts pour la première immersion et un 8 supplémentaires - 10 semaines post-trempage pour se rendre à la génération T1. Au total, une gamme de 5 - 6 mois est nécessaire pour obtenir la génération T1. Contrairement à d'autres espèces de plantes, qui fleurissent à tout moment de l'année, certaines variétés de lin fleur mieux à des moments précis de l'année. Donc, la planification réfléchie pour cette technique est important.
En résumé, nos résultats d'immersion florale avec deux variétés de lin différents: le lin textile, Stormont Cirrus (de plastique souple et), et le lin oléagineux, Bethune (stable et non réactive), montrent que Agrobacterium - transformation de plante médiée par immersion florale est une méthode applicable et efficace pour la transformation de lin et peut être utilisé pour remplacer les techniques précédemment utilisées pour la transformation du lin. Les modifications de la méthode floral creux dans ce protocole seront en vigueur pour une utilisation avec d'autres espèces végétales et non limité à lin.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by the Ogelbay fund.
matériels
| Name | Company | Catalog Number | Comments |
| Flax seeds of the original Stormont Cirrus variety (PL) | |||
| 5" pots | |||
| Potting soil | |||
| Greenhouse with appropriate light setting | |||
| Thermocycler | |||
| Agarose gel electropheresis equipment | |||
| Digital imaging setup | |||
| Silwet-77 | LEHLE SEEDS | VIS-01 | Toxic, wear gloves |
| GoTaq Green Master Mix | Promega | Part# 9PIM712 | |
| Terra PCR Direct Polymerase Mix | Clontech | 639270 | |
| Binary vector PRI 909 | Takara | 3260 | |
| Agrobacterium tumefaciens LBA4404 E | Takara | 9115 | |
| TOPO TA cloning kit | Invitrogen | K4595-01 | |
| Sucrose | Fisher Scientific | ||
| Electroporator and cuvettes | Bio-Rad | 165-2092 | |
| Shaker | |||
| Spinner | |||
| Plastic wrap and aluminum foil wrap | |||
| speedSTAR DNA polymerase | Takara | RR070A/B | |
| QlAquick gel extraction kit | Qiagen | 28704 | |
| QIAGEN plasmid mini kit | Qiagen | 12123 | |
| SalI-HF enzyme | NEB | R3138S | |
| SacI-HF enzyme | NEB | R3156S | |
| T4 DNA ligation kit | NEB | M0202 | |
| Murashige Skoog | Sigma | M5524 | |
| Agar | Fisher Scientific | A360-500 |
Références
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods Mol Biol. 343, 87-103 (2006).
- Beranova, M., Rakousky, S., Vavrova, Z., Skalicky, T. Sonication assisted Agrobacterium-mediated transformation enhances the transformation efficiency in flax (Linum usitatissimum L.). Plant Cell Tiss Organ Cult. 94, 253-259 (2008).
- Chen, Y., Schneeberger, R. G., Cullis, C. A. A site-specific insertion sequence in flax genotrophs induced by environment. New Phytol. 167, 171-180 (2005).
- Clough, S. J., Bent, A. F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Cullis, C. A. Mechanisms and Control of Rapid Genomic Changes in Flax. Ann Bot. 95, 201-206 (2005).
- Dong, J. Z., McHughen, A. An improved procedure for production of transgenic flax plants using Agrobacterium tumefaciens. Plant Sci. 88, 61-71 (1993).
- Logemann, E., Birkenbihl, R. P., Ulker, B., Somssich, I. S. An improved method for preparing Agrobacterium cells that simplifies the Arabidopsis transformation protocol. Plant Methods. 2 (16), (2006).
- Mara, C., Grigorova, B., Liu, Z. Floral-dip transformation of Arabidopsis thaliana to examine pTSO2::β-glucuronidase reporter gene expression. J Vis Exp. (40), (2010).
- Mlynarova, L., Bauer, M., Nap, J. -P., Pretova, A. High efficiency Agrobacterium-mediated gene transfer to flax. Plant Cell Rep. 13, 282-285 (1994).
- Mu, G., et al. Genetic transformation of maize female inflorescence following floral dip method mediated by agrobacterium. Biotechnology. 11 (3), 178-183 (2012).
- Trieu, A. T., et al. Transformation of Medicago truncatula via infiltration of seedlings or flowering plants with Agrobacterium. Plant J. 22 (6), 531-541 (2000).
- Yasmeen, A., et al. In Planta transformation of tomato. Plant Mol Biol Rep. 27, 20-28 (2009).
- Zale, J. M., Agarwal, S., Loar, S., Steber, C. M. Evidence for stable transformation of wheat by floral dip in Agrobacterium tumefaciens. Plant Cell Rep. 28, 903-913 (2009).
- Zhan, X. C., Jones, D. A., Kerr, A. Regeneration of flax plants transformed by Agrobacterium rhizogenes. Plant Mol Biol. 11, 551-559 (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon