Method Article
Цветочные DIP-трансформация льна (
В этой статье
Резюме
Здесь мы приводим протокол для преобразования лен с помощью Agrobacterium опосредованной трансформации растений с помощью цветочным погружения. Этот протокол является простым для выполнения и недорогой, но дает более высокую скорость, чем преобразование текущих доступных методов трансформации льна.
Аннотация
Agrobacterium опосредованной трансформации растений с помощью цветочные погружением является широко используемым методом в области трансформации растений и, как сообщалось, будет успешным для многих видов растений. Тем не менее, не было сообщено льна (Linum Usitatissimum) преобразование цветочными погружения. Целью этого протокола является установить, что Agrobacterium и способ цветочно-погружением может быть использован для создания трансгенного льна. Мы покажем, что этот метод является простым, недорогим, эффективным и, что более важно, дает более высокую скорость преобразования, чем имеющихся в настоящее время методов преобразования льна.
Таким образом, соцветия льна погружали в раствор Agrobacterium, несущей бинарный вектор плазмиды (фрагмент Т-ДНК в сочетании с введением последовательности Linum, LIS-1) в течение 1 - 2 мин. Растения в горизонтальном положении на боку в течение 24 ч. Затем растени выдерживают в нормальных условиях роста до следующего лечения. В процесх погружения был повторен 2 - 3 раза, с примерно 10 - 14-дневными интервалами между погружения. Семена T1 собирают и проращивают на почве. После приблизительно двух недель, обработанные потомства были испытаны путем прямого ПЦР; 2 - 3 листья были использованы на заводе вместе с соответствующими праймерами T-ДНК. Положительные трансформанты отбирали и выращивали до зрелости. Скорость превращения неожиданно высоким, с 50 - 60% семян от обработанных растений, находящихся положительные трансформантов. Это выше скорость превращения, чем показатели по Arabidopsis THALIANA и других видов растений, используя преобразование цветочно-погружением. Это также самый высокий, который, как сообщалось до сих пор, для преобразования льна с использованием других методов трансформации.
Введение
Лен (Linum Usitatissimum) является важной культурой выросла широко за ее волокон и масла. Преобразование льна генома можно с методами, такими как ранения, Agrobacterium-инфекции, и совместного культивирования в культуре ткани, применяя баллистической частицы или ультразвуковое ультразвуком с последующей регенерацией. Тем не менее, эти методы имеют много недостатков, в том числе склонность ко многим мутационных событий и длительного времени для получения трансгенных линий. Некоторые из этих методов также может быть дорогостоящим и требует квалифицированных и эффективное манипулирование инструментов, что приводит к низким рассады восстановления. Самое главное, это техника часто приводит к низкому уровню трансформации 2,6.
Agrobacterium опосредованной трансформации растений с помощью цветочно-провала простой и эффективный подход для создания трансгенных растений. Он был постоянно и успешно используется для многих видов растений, таких как Arabidopsis Thalian1,4, Medicago truncatula 11, помидоры 12, пшеница 13 и кукуруза 10. Тем не менее, он не был рассматривать как жизнеспособного техники для трансформации льна-за нескольких факторов, таких как низкий уровень числа цветках, произведенных льна, ограниченное количество семян, полученных от каждого цветка, большой размер семян, а толстый слой, который также может быть проблематичным для такого генетического процесса трансформации. Кроме того, выбор сегмента техники цветочно-погружением требуется прорастающих семян трансформированных растений на среде, содержащей антибиотик, с трансформированных потомства определяют на основе их способности к прорастанию и остается зеленым, в то время как нетрансформированных потомства либо не прорастают или прорастают, но отбеливателя быстро и умереть. В современной литературе, было отмечено, что дикого типа льна, как правило, чтобы избежать высокой концентрации антибиотика выборов, получения ложных положительных результатов, и сделать выбор на основе T1 потомстваоб устойчивости к антибиотикам сложнее 6,14. Кроме того, при высокой концентрации антибиотика добавляют к селекционной среде, скорость наблюдаемого трансформации резко упала 9.
В этом протоколе, мы использовали Agrobacterium и метод цветочно-погружением, чтобы преобразовать линию волокна льна, Стормонт перистых (гибкой и пластик), который, как было показано в ответ на напряжений в среде, изменяя его геном 3,5. Чтобы преодолеть антибиотик проблему выхода мы выбрали, чтобы сделать прямые ПЦР тестирование ДНК из T1 листьев, вместо выбора, добавив антибиотик растительного СМИ. Мы воспользовались простой анатомии льна отслеживать конкретные цветы на время лечения. Эта система слежения позволила выбор семян из конкретных цветов и прорастания на почве без добавления антибиотиков. Положительные трансформанты просто определить путем тестирования ДНК получают из листьев, используя быстрый и эффективный способ выводаF прямой ПЦР. Наши результаты показывают, что метод цветочно-погружением работал очень хорошо в этой линии льна и удивительно привело к очень высокой скоростью преобразования (50 - 60%) выше, чем тех, которые ранее наблюдались Arabidopsis THALIANA, который был представлен 0,1 - 1 % 1, а также выше, чем у других видов растений 10,12. Мы также протестировали еще одна разновидность льняного (льна масличного), Бетюн (стабильны и не реагируют), и нашим предварительным данным показывает, что цветочно-погружением также работает для этого сорта льна.
Целью этого протокола является показать, что Agrobacterium и цветочно-погружением может быть использован для создания трансгенного льна. Мы покажем, что этот метод является простым, недорогим и быстрее, чем другие методы преобразования льна. Что еще более важно это приводит к более высокой скорости превращения, чем у других методов льна трансформации 2,6. Анатомия Arabidopsis THALIANA, который имеет много ветвей и цветов, маКЭС трудно отличить ближнего и не опускают цветы на том же заводе. Таким образом, большое количество семян, примерно 20 000 семян с одного растения, нужно пройти обследование, чтобы определить положительные трансформантов 8. Лен, с другой стороны, имеет меньше филиалов (один основной ветви и несколько боковых ответвлений) и меньше цветов, производя около 100 семян на растениях, что делает возможным отслеживать отдельные цветы и выбрать конкретные семена во время процесса скрининга.
Мы полагаем, что цветочно-провал применимый метод для преобразования любых родственных видов льна, род около 200 видов. Этот метод дает гораздо более высокую скорость преобразования по сравнению с другими методами трансформации льна. Мы также предлагаем, что прямой ПЦР скрининг T1 листьев ДНК эффективный способ преодолеть проблему устойчивости к антибиотику побега, который часто производит много ложных срабатываний. Прямая скрининга ПЦР могут быть применены к любым другим видам растений и не ограничивается тО лен. Простой метод отслеживания семян используют в данном протоколе могут быть применены к любым другим видам растений с ветвлением анатомии, аналогичную льна.
протокол
1. выращивания растений
- 6 недель до погружения, заполните 5 дюймовые горшки с почвой и посеять семена льна ¼ дюйма глубиной в почву (4 семян на горшок). Будьте уверены, чтобы укрепить почву над семенами. Поливают растения регулярно и поддерживать их в долгосрочной дневного света (14 ч света и 10 ч темноты).
- Проверьте растения регулярно первичных соцветия (кластеров органов цветов ''). Растения готовы к трансформации, когда видны почки и только формируется в соцветия (рис 1 и 2). Чтобы увидеть бутоны, срезать листья вокруг него, если это необходимо.
ПРИМЕЧАНИЕ: Использование лучшие цветочные этап имеет решающее значение и подробно описана в дискуссии.- Используйте главное филиала завода для экспериментального лечения, как она производит больше цветов, чем боковых филиалах. Используйте боковые ветви либо в качестве контроля (не ближний свет) или для других экспериментальных процедур.
- Кроме того, использование основных и побочных ветвейже установка для экспериментальной обработки и использовать другое растение в качестве контроля или для других экспериментальных процедур. Используйте наклейки, чтобы отметить отдельных отраслей и отдельных цветов с указанием даты и вида лечения.
2. Клонирование и трансформация и Escherichia coli (кишечная палочка) клеток
- Клонирование фрагмента / интересующего гена в сайт множественного клонирования растений бинарного вектора, несущего Т-ДНК.
- Выполнение клонирования в одну стадию или две стадии.
- Непосредственно клонировать маленькие вставки в данном протоколе (~ 500 б.п.) на завод двоичного вектора. В этом протоколе, с помощью растений бинарный вектор (PRI909). В противном случае, использовать любые другие растительные бинарных векторов в подобной стратегии.
- Кроме того, клон большие вставки (≥6.5 Kb) в два этапа: сначала с использованием общего набора коммерческого клонирования (не конкретных станций), а затем субклонирования в бинарный вектор растений.
- Выполнение клонирования в одну стадию или две стадии.
- Настройка Reac ПЦРции, чтобы усилить интерес ген. Дизайн праймеров с сайтами рестрикции на 5 'конце (в соответствии с сайт множественного клонирования растений бинарного вектора в использовании).
- Выполнение стандартной ПЦР с использованием геномной ДНК льна при следующих условиях велосипедных: начальный захват 24 ° С, а затем 2 мин при 94 ° С, с последующими 30 циклами по 98 ° С в течение 5 сек, 60 ° С в течение 15 сек, и 72 ° С в течение 2 мин. Выполнение конечная стадия удлинения при 72 ° С в течение 5 мин с последующим на неопределенный срок при 4 ° С.
- Отдельные продукты ПЦР на 1% Трис / Борат / ЭДТА (КЭ) агарозном геле, запустить гель при 100 V в течение 1 часа. Очистить продукты от геля и количественно с помощью NanoDrop.
- Настройка лигирования смесь клонировать ПЦР-продукт в коммерческом клонирующий вектор. Следуйте протокол производителя.
- Преобразование перевязки смесь в химически компетентную E. палочки клетки следующим образом.
- Добавить 2 мкл сшитой смеси в одном флаконе Ч.emically компетентный E. палочки клетки. Инкубируют на льду в течение 30 мин.
- Теплового шока клетки в течение 30 сек при 42 ° С (тепловой шок времени и температуры зависит от типа клеток, используемых).
- Инкубировать на льду и добавить 250 мкл РТ супер оптимального бульоне с катаболитной репрессии (SOC) среде.
- Закрывают пробирку и инкубируют в орбитальном шейкере при 200 оборотах в минуту при 37 ° С в течение одного часа.
- Распространение 10 - 50 мкл из каждой трансформации на LB пластины нагретого (предварительно нагретой при 37 ° C) + соответствующего селективного антибиотика (определить селективное антибиотик в зависимости от типа коммерческой клонирующий вектор используется). Планшеты инкубируют при 37 ° CO / N.
- Pick ~ 10 колоний для очистки мини преп плазмиды, с помощью коммерческого набора. Мини очистка подготовительной плазмиды, как правило, осуществляется следующим образом.
ПРИМЕЧАНИЕ: Имена буфера являются специфическими для коммерческого набора используется, но их общие функции аналогичны.- Привить отдельные колонии в 2- 5 мл LB среды, содержащей соответствующий антибиотик (селективный определяется в зависимости от типа коммерческой вектора, используемого).
- Инкубируют в течение примерно 8 ч при 37 ° С при интенсивном встряхивании (~ 300 оборотов в минуту).
- Сбора клеток центрифугированием при 6000 х г в течение 10 мин.
- Ресуспендируют осадок в 250 мкл ресуспендирования буфера. Смешайте и вихрь полностью разогнать шарик.
- Лизировать бактериальные клетки путем добавления 250 мкл буфера для лизиса, тщательно перемешать путем обращения труб 4 - 6 раз.
- Нейтрализовать лизата в буфере нейтрализации и инвертировать 4 - 6 раз перемешать. Центрифуга в течение 10 мин при температуре ~ 17 900 мкг на настольной микроцентрифуге.
- Передача супернатанты из предыдущего шага в колонну спина. Центрифуга снова в ~ 17 900 мкг в течение 30 - 60 сек.
- Промыть колонку спина, добавив 0,75 мл моющего буфера и центрифуги для 30 - 60 сек. Откажитесь от проточных.
- Центрифуга в течение еще 1 мин до Ремове остаточного промывочного буфера. Поместите колонку отжима в чистом 1,5 мл микроцентрифужных трубки. Для элюирования ДНК, добавить 50 мкл воды к центру каждого столбца. Дайте постоять в течение 1 мин, а центрифуги в течение 1 мин.
3. Анализ очищенной плазмиды на присутствие вставки
- Ограничение Дайджест:
- Установка ограничения дайджест, чтобы определить присутствие вставки расщеплением плазмиды рестриктазами, используемых для клонирования вставки. Типичный двойной ограничение переварить реакцию следующим образом: 1 мкг плазмидной, 1 мкл каждого ферментов рестрикции, 2 мкл 10х ограничение переварить буфера + 2 мкл BSA (если применимо), X мкл воды (в общей сложности 20 мкл)
- Осторожно перемешать и инкубировать при рекомендуемой температуре (в зависимости от одного фермента к другому).
- Анализ ограничение переварить реакции на 1% агарозном геле КЭ, работать на 100 V в течение 1 часа и искать отсева соответствующего размера.
- ПЦР-анализ:
- Настройка ПЦР с очищенной плазмиды, используя праймеры от коммерческого векторной области для усиления внутри вставки или стыке между вектором и вставкой. Общие праймеры M13 вперед и назад и T3 / T7 праймеров.
- В этом протоколе, используют следующие условия ПЦР велосипедные: начальный захват 24 ° С, а затем 2 мин при 94 ° С с последующим 18 циклов при 98 ° С в течение 5 сек, 60 ° С в течение 15 сек и 72 ° C в течение 2 мин. Выполнение конечная стадия удлинения при 72 ° С в течение 5 мин с последующим на неопределенный срок при 4 ° С.
- ПЦР продукты нагрузки на 1% агарозном геле КЭ и работать в течение 100 - 120 V в течение 1 часа.
- Секвенирование:
- Отправить Очищенную плазмидную к коммерческой установки для секвенирования для анализа и подтвердить присутствие вставки.
- После того, как правильный конструкция получается, использовать его для второй стадии клонирования (в растение бинарного вектора).
ПРИМЕЧАНИЕ: Шаги 2,3 - 3,3могут быть устранены, если клонирование завершено в одну стадию.
4. Клонирование в завод бинарный вектор (PRI909) и Е. палочка Трансформация
- Установка двойной ограничение переварить реакции линеаризовать растений бинарный вектор и изолировать ранее клонированный вставку с использованием тех же сайты рестрикции, которые были добавлены к праймеров (этап 2,2).
- Анализ рестрикции дайджестов помощью гель-электрофореза, работать на 100 В в течение 1 - 2 часов. Сокращение вставку и линеаризованной растений бинарный вектор из геля.
- Использование коммерческого набора для очистки продуктов гель. Обратитесь к руководству производителя.
- Настройка реакции лигирования для лигирования вставки в растение бинарный вектор. Вкладыш соотношение вектора зависит от размера вставки и растительного бинарного вектора. В этом протоколе LIS1 вставка была 6,5 кб и завод бинарный вектор был 9 кб. Таким образом, использовать 1: 2 вставку соотношение вектора.
- Повторите шаги 2,4 - 3 для бактериальной трансформации, очистки плазмиды и анализа. После того, как правильно конструкция (вставка + завод бинарный вектор) получается, переходите к электропорации в шаге 5.
5. электропорации в Agrobacterium tumefaciens Электрические компетентных клеток
- Оттепель флакон Agrobacterium tumefaciens электрически компетентных клеток на льду.
- Добавить 1 нг бинарный вектор плазмиды ДНК с 20 мкл компетентных клеток, на льду и осторожно перемешать.
- Холод 0,1 см электропорации кюветы на льду.
- Передача компетентный смесь клеток / ДНК в электропорации кюветы, и нажмите, чтобы собрать смеси в нижней части. Поместите кювету в Электропоратор машины и импульса (напряжение и время условия зависят от размера кюветы и электропоратора используется).
- Добавить 1 мл SOC СМИ и передачи клеток в 15 мл пробирку.
- Выдержите в течение 1 ч при 28 - 30° С, встряхивая при 100 оборотах в минуту. Пластина 50 - 100 мкл клеток на LB-агар + соответствующего селективного антибиотика (в зависимости от растений бинарную плазмиду и штамм Agrobacterium, используемого в этом протоколе применения 50 мкг / мл канамицина и 100 мкг / мл стрептомицина.).
- Инкубируйте пластин до 48 ч при 28 - 30 ° C.
- Повторите шаг 2,5 для выбора колонии и очистки плазмид.
- Повторите шаг 3 для анализа плазмиды и проверить целостность вставки и Т-ДНК перед использованием конструкции для цветочно-погружением. Повторите шаг 3,2, используя несколько праймеров ПЦР на всей территории региона вставки и по регионам Т-ДНК и секвенирования, как в шаге 3.3.
Примечание: В этом протоколе 4 различных праймеры по Т-ДНК и 10 праймеров по всей вставки. - После того, как присутствие растений бинарную плазмиду в выбранной колонии Agrobacterium подтвердится, место клетки Iп 50% глицерина и хранят при -80 ° С. Магазин остальные колонии на пластине при 4 ° С, если они должны быть использованы в течение одной недели 7.
6. Цветочные окунания
ПРИМЕЧАНИЕ: 2 дней до цветочно-погружением:
- Выращивают клетки Agrobacterium к стационарной фазы (OD 600 от 0,5 - 1 приемлемо) в LB + соответствующими антибиотиками в жидких средах.
Примечание: Это то же самое, как антибиотик, на этапе 5,6, на основе растительного бинарного вектора и типа штамма Agrobacterium используется. - Начало культуры с 1: 100 разбавлении насыщенного (5 мл) O / N культуры и расти в течение 24 - 48 ч при 28-30 ° С при встряхивании при 150 оборотах в минуту. Культура должна достигли midlogarithmic фазу и, скорее всего будет приближаться или стационарной фазы 1. ОД примерно 0,8 OD (снова в пределах от 0,5 до 1, все приемлемо) 8. Сбор клетки центрифугированием при 5000 хг при комнатной температуре.
- Ресуспендируют клеток в среде инфильтрации (5,0% сахарозы + 0,05 - 0,003% Silwet L-77). Для первого раунда погружения, используйте 0,05% Silwet-77. Для второго и третьего раундов, уменьшить концентрацию до 0,03% (подробно в обсуждение).
- Перейдите с шагом цветочно-погружением. Положите растение на бок и опустите только видимые почки в инфильтрации среды в течение 1-2 мин. Оставьте растение на своей стороне и покрыть ее полиэтиленовой пленкой, чтобы поддерживать высокую влажность воздуха в куполе (рис 3).
- На следующий день, поместите растение в вертикальном положении и поддерживать в нормальном режиме.
- Когда бутон становится все больше (как правило, примерно через 10 - 14 дней), повторите шаги 6,1 - 6,4. Сокращение времени погружения до 30 - 60 сек и Silwet-77 концентрации до 0,003%.
- Поддерживать растения нормально, пока их семена не созрели и готовы быть собраны (Рисунок 4).
7. Выбор Положительный Траnsformants с прямым ПЦР
- Сейте семена Т1 на почву, как в шаге 1.1.
- В качестве альтернативы, чтобы Мурашига и Скуга базальной солевую среду (MS среде) с добавлением 2,2 г среде МС + 4 г агара в 500 мл воды. Автоклав и вылить в маленьких горшках растений. Хранить в 4 ° C до использования.
- Сейте семена, размещая их на затвердевает MS среды. Держите при длительном дневном свете (14 ч света и 10 часов темноты). Семена прорастают в течение 4 - 6 дней (рисунок 5).
- Используйте одно семя из каждого цветка в качестве отправной точки. Если ни одного положительного Трансформант не получается, повторите этот шаг, выбрав другое семя, из цветка.
ПРИМЕЧАНИЕ: Тестирование различных семян из тех же цветов, так как в некоторых случаях, не все семена из одного цветка будет преобразован. Выбор дополнительных семена из экспериментальных цветов иногда необходимо.
- Проверка на рассаду регулярно. Примерно 10 - 14 дней после появления всходов, когда правдаоставляет разработки, тестирования растения с прямым ПЦР.
- Подготовка экстракт листьев ДНК путем разрезания 2 - 3 листьев (5 - 10 мг в весе) от каждого саженца и поместить их в микроцентрифужных трубки.
- Добавить 180 мкл 50 мМ NaOH в каждую пробирку и инкубируют в течение 10 мин при 95 ° С.
- Нейтрализовать экстракта путем добавления 20 мкл 1 М Трис-HCl (рН 8,0).
- Использование 1 мкл экстракта в непосредственной реакции ПЦР, с использованием праймеров, сконструированных по Т-ДНК или вставки (фиг.7), чтобы выбрать для положительных трансформантов.
- В этом протоколе, используют прямой ПЦР с начальным отсеке 24 ° С, а затем 2 мин при 98 ° С, с последующими 40 циклами из (98 & deg; С в течение 10 сек, стадии отжига в течение 15 секунд, и стадией удлинения при 68 ° С). Выполнение конечная стадия удлинения при 68 ° С в течение 5 мин, после чего на неопределенный удержание при 4 ° С. (Обратитесь к Таблице 1 для получения подробной информации о праймеров, температуры отжига и времени для удлинения циклов).
- Определить положительные трансформантов и выращивать их до срока погашения. Если семена проращивают в среде МС, трансплантации в почву в крупный банк (Рисунок 5).
Результаты
Рисунок 1 - 4 иллюстрируют некоторые из этапов в протоколе. На рисунках 1 и 2, листья вокруг соцветия почки разрезают, чтобы выставить их на Agrobacterium клеток и на разных стадиях почки, которые были использованы для разработки протокола. Рисунок 3 показывает процесс льна цветочным погружения. Рисунок 4 показывает, пример того, как основные и боковые ветви могут быть помечены, и как отдельные цветы могут быть отслежены и определены. Рисунок 5 показывает, как потомства T1 может быть проращивают на MS средах растений, а затем пересаживают в почву для зрелости. 6 иллюстрирует, как дикого Тип льна можно избежать высоких концентраций канамицин, подтверждающие ранее сделанные выводы в литературе 6,9,14.
На фиг.7 показан пример прямого ПЦР-амплификации с положительными трансформантов T1. Цветки T1 собирали из мАйн и боковые побеги одного T0 завода. Как можно видеть из прямого ПЦР, 8/12 T1 растений дали положительный результат с помощью ПЦР и амплифицированный различные зоны через Т-ДНК. Наши праймеры также разработаны между LIS-1 вставки и нескольких сайтов клонирования (7В и С). Мы использовали дополнительные праймеры из растительного бинарного вектора для амплификации различные сегменты Т-ДНК, такие как левой границы и терминатора NOS (данные не показаны) или правой границы и множественный клонирующий сайт (фиг 7D). Праймеров, специфичных к ЛИС-1 вставки были также использованы в данном протоколе (данные не показаны). Список праймеров приведены в таблице 1. Тем не менее, в последовательности этих праймеров, зависит от последовательности растительной Т-ДНК бинарного вектора и вставки, используемой для цветочно-погружением. Мы также отметили, что не было никакого существенного различия в скорости трансформации между цветами, собранных из главных и боковых ветвей.

Рисунок 1. Резка листья вокруг первичных почек соцветия подвергать их клеток Agrobacterim. () Почки покрыты листьями. (B) Листья были вырезаны вокруг почек чтобы разоблачить их. (C) увеличенное изображение от завода в (А) после резки, чтобы разоблачить рецепторы. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 2. Различные этапы бутон, которые были использованы в данном протоколе, чтобы определить наилучший сцену, чтобы использовать для цветочного падения. () На ранней стадии почка approxima ДЕТАЛЬ 2 мм. (B) средняя стадия бутона примерно 5 мм. (C) Поздняя стадия бутона составляет примерно около 1 см. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 3. Процесс льна цветочно-погружением. (А) Первичная соцветия погружают в инфильтрации СМИ, содержащих Agrobacterium клетки. (B) Увеличенная из (А). (C) Ближний свет растения не прилегают до следующего дня, и ближний ветви покрыты пластиком для поддержания высокая влажность. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

. Рисунок 4. Процесс отслеживания цветок и коллекций семян, из T0 необработанными растениями () пример целого растения с основной ветвью (по высоте филиала в центре) и боковые ветви (B - D). An . Пример цветы из разных отраслей (E) пример семян, собранных из отдельных цветов (помечены - K). от главной ветви Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 5. растений Т1 выращивают без выбора антибиотиков. (A) семена T1 являютсяпроросшие на MS растений СМИ. (B) Положительные трансформанты, как определено путем непосредственного ПЦР, пересаживают в почву и выращивают до погашения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 6. Антибиотик побег, проблема выбора Т1, преодолевается путем прямого скрининга ПЦР. (A) дикого типа семян льна прорастают на MS растений СМИ без антибиотика. (B) дикого типа семян льна проращивают на MS растений СМИ + Повышение концентрации канамицина (200 мкг / мл, 600 мкг / мл, 1 мг / мл). (C) дикого типа проросшие семена льна на MS средах с завода 2 мг / мл канамицина. (D) PCR от дикого типа льна и T1 Рассада с помощью канамицину праймеров, все Amplманьяков генные канамицин (легенды: EZ1: ДНК-маркера, FlaxS, flaxS дикого типа, C: управлять прочими смоченной ветку, Ма: T1 потомство от цветка "" собирали из основной ветви, Sc, Sd, Se, Sf: T1-потомства разных цветов "C, D, E, F", собранных из боковой ветви, Вт:. Нет-ДНК) Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
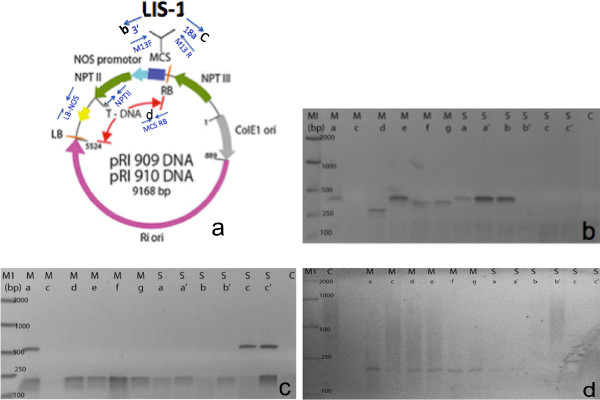
Рисунок 7. Пример успешных ПЦР амплификации Т1 потомства с использованием прямого метода ПЦР. () Схема двоичного вектора растений + клонированного LIS-1 вставки. Синие стрелки указывают положение ПЦР-праймеров, используемых в ПЦР прямого скрининга (модифицированной от Takara). (Б) ПЦР с праймерами M13F + 3 '(С) ПЦР с праймерами M13R + 18а (D) ПЦР с праймерами правой границы (RB) и сайт множественного клонирования (MCS) ** Каждая дорожка представляет T1 от отдельных цветов, собранных из C: управления филиала (не ближний), M: главная отрасль цветок AG, S: боковая ветвь цветок BC '. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
| Источник последовательность Прямой праймер | Последовательность 5'-3 ' | Обратный источник праймера | Последовательность 5'-3 ' | Отжиг Temprature (° C) | Расширение Время (сек) | Ожидаемый размер (BP) |
| M13F (Т-ДНК) | CTGCAAGGCG ATTAAGTTGG | 3 '(LIS-1 вставка) | GAGGATGGAA GATGAAGAAGG | 57 | 40 | 450 |
| 18а (LIS-1 вставка) | TATTTTAACCC TATCTCCCAACAC | M13R (Т-ДНК) | ATTAGGCACC CCAGGCTTTA | 57 | 40 | 520 |
| MCS (Т-ДНК) | TGGTCATAGC TGTTTCCTGTG | РБ (Т-ДНК) | TTTAAACTGA AGGCGGGAAA | 60 | 20 | 200 |
| LB (Т-ДНК) | TTTGATGGTG GTTCCGAAAT | NOS (Т-ДНК) | GAATCCTGTT GCCGGTCTT | 60 | 30 | 380 |
| NPTII (Т-ДНК) | GCGATACCGT AAAGCACGAG | NTPII (Т-ДНК) | GCTCGACGTT GTCACTGAAG | 65 | 45 | 502 |
Таблица 1. Некоторые из праймеров, используемых для прямого тестирования ПЦР.
Обсуждение
У некоторых видов растений, таких как лен (Linum Usitatissimum), успешная трансформация завод был ограничен. Ранее преобразования в льна потребовало Agrobacterium-инфекции путем ранение и Совместное культивирование с применением баллистической частиц или с помощью ультразвуковой обработки ультразвуком с последующей регенерацией; процесс, который является как длинные и склонны к сопровождается многих мутационных событий. Кроме того, процесс отбора из этих методов предполагает использование антибиотиков селективных маркеров, таких как канамицин. Тем не менее, было отмечено в литературе, что этот метод отбора производит много ложных срабатываний, как лен, как правило, чтобы избежать высоких концентраций антибиотиков 6,9,14. Другим недостатком предыдущих методов в трансформации льна был низкий уровень трансформации 2,6.
В методике, описанной здесь, Agrobacterium опосредованной трансформации растений с помощью цветочно-погружением было показаночтобы привести к высокой скорости преобразования для льна (50 - 60%). Трансформанты были получены из цветов ближнего и собранных из главных и боковых ветвей. Выбор положительных трансформантов просто сделать, растет T1 растения на почву и сеанс листья вскоре после того, пророщенные, минуя использование отбора антибиотиков, шаг ранее использовались в качестве нормы в цветочный погружения для других видов растений. При выполнении прямого ПЦР тестирование листьев, и с использованием соответствующих праймеров Т-ДНК, положительные трансформанты могут быть отобраны быстро. Этот метод является простой, недорогой и простой для выполнения, но результаты в гораздо более высокими темпами трансформации, чем ранее сообщалось Arabidopsis и других видов растений, используя этот метод 1,10,12. Это также Максимальные скорости превращения льна.
Тем не менее, существуют критические шаги в процедурах в том числе в выборе лучшего цветка стадии и лучшей концентрации поверхностно-активного вещества, так чтоAgrobacterium может проникнуть в клетки растений, не убивая цветочные органы. Если ранняя стадия бутон используется (рис 2а) с высоким Silwet-77 концентрации более 0,05%, цветок не будет развиваться ни установить семена. Если поздней стадии бутона используется (рис 2С), хотя преобразование может работать, это произойдет в гораздо меньшей степени. Аналогичные результаты были получены с Arabidopsis цветочный погружения трансформации 1,4. Для этого протокола, все цветочные этапы были протестированы с различными Silwet-77 концентрации и лучший этап был определен как стадия среднего бутона (фиг.2С) с Silwet-77 в количестве 0,05% для первого погружения, с последующим вторым погружением в поздней стадии почки (фиг.2С) со слегка пониженной концентрации Silwet-77 0,03%. Преобразование также хорошо работает с использованием ранней стадии бутонов (фиг.2А) с низкой Silwet-77 концентрации 0,003%, с последующимвторой этап погружения с среднего бутона (фиг.2В) при более высокой Silwet-77 концентрации 0,05%.
В этом протоколе, некоторые другие параметры, пытаясь оптимизировать скорость преобразования, но не нашел, не имеют никакого влияния на конечный результат. Примеры включают в себя увеличение времени после погружения, что растения лежали на их стороне, и покрыты пластиком от одного дня до двух дней; используя наружный диаметр больше, чем 1 для Agrobacterium культуры, а 0,5 - 1; увеличивая время погружения до 5 - 15 мин вместо 1 - 2 мин. Опять мы не заметили какого-либо влияния на скорость преобразования с использованием этих стратегий. Наиболее эффективные факторы, однако, были уличены в использовании здоровые растения на правильных этапах цветок, и с использованием лучших концентрацию Silwet-77. Мы заметили, что два погружных интервалы, работает как-то лучше, чем один раз, хотя одно время погружения тоже работает.
Модификация этого протокола может быть достигнуто путем reducinг концентрация Silwet-77 до всего лишь 0,003% во втором или третьем погружения. Поскольку Silwet-77 является токсичным, слишком высокая концентрация приводит цветов разработки слабо, что приводит к отсутствию урожая семян. Частота погружения могут быть сведены к одному, со второй или третьей события устраняется, если растения не здоровый вид и почки не развиваются хорошо.
Основным недостатком этого метода является низкое число цветках, произведенных льна, недостаточное количество семян, полученных из каждого цветка, и длительный срок службы льна. Она занимает 6 - 8 недель от посева семян иметь первичные почки готовы к первому погружения и дополнительный 8 - 10 недель после погружения, чтобы добраться до поколения T1. В целом, диапазон 5 - 6 месяцев необходимо получить генерацию T1. В отличие от других видов растений, которые цветок в любое время года, некоторые льна сорта цветов лучше в определенное время года. Так продуманное планирование для этой техники очень важно.
Таким образом, наши результаты цветочным падения с двух разных сортов льна: льна-долгунца, Stormont Cirrus (отзывчивы и пластик), и масло льна, Бетюн (стабильны и не реагируют), показывают, что Agrobacterium - опосредованной трансформации растений с помощью цветочно-провала применимо и эффективный способ трансформации льна и может быть использовано для замены ранее использовались методы трансформации льна. Модификации метода цветочно-погружением в настоящем Протоколе будет применяться для использования с любыми другими видами растений и не ограничивается льна.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by the Ogelbay fund.
Материалы
| Name | Company | Catalog Number | Comments |
| Flax seeds of the original Stormont Cirrus variety (PL) | |||
| 5" pots | |||
| Potting soil | |||
| Greenhouse with appropriate light setting | |||
| Thermocycler | |||
| Agarose gel electropheresis equipment | |||
| Digital imaging setup | |||
| Silwet-77 | LEHLE SEEDS | VIS-01 | Toxic, wear gloves |
| GoTaq Green Master Mix | Promega | Part# 9PIM712 | |
| Terra PCR Direct Polymerase Mix | Clontech | 639270 | |
| Binary vector PRI 909 | Takara | 3260 | |
| Agrobacterium tumefaciens LBA4404 E | Takara | 9115 | |
| TOPO TA cloning kit | Invitrogen | K4595-01 | |
| Sucrose | Fisher Scientific | ||
| Electroporator and cuvettes | Bio-Rad | 165-2092 | |
| Shaker | |||
| Spinner | |||
| Plastic wrap and aluminum foil wrap | |||
| speedSTAR DNA polymerase | Takara | RR070A/B | |
| QlAquick gel extraction kit | Qiagen | 28704 | |
| QIAGEN plasmid mini kit | Qiagen | 12123 | |
| SalI-HF enzyme | NEB | R3138S | |
| SacI-HF enzyme | NEB | R3156S | |
| T4 DNA ligation kit | NEB | M0202 | |
| Murashige Skoog | Sigma | M5524 | |
| Agar | Fisher Scientific | A360-500 |
Ссылки
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods Mol Biol. 343, 87-103 (2006).
- Beranova, M., Rakousky, S., Vavrova, Z., Skalicky, T. Sonication assisted Agrobacterium-mediated transformation enhances the transformation efficiency in flax (Linum usitatissimum L.). Plant Cell Tiss Organ Cult. 94, 253-259 (2008).
- Chen, Y., Schneeberger, R. G., Cullis, C. A. A site-specific insertion sequence in flax genotrophs induced by environment. New Phytol. 167, 171-180 (2005).
- Clough, S. J., Bent, A. F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Cullis, C. A. Mechanisms and Control of Rapid Genomic Changes in Flax. Ann Bot. 95, 201-206 (2005).
- Dong, J. Z., McHughen, A. An improved procedure for production of transgenic flax plants using Agrobacterium tumefaciens. Plant Sci. 88, 61-71 (1993).
- Logemann, E., Birkenbihl, R. P., Ulker, B., Somssich, I. S. An improved method for preparing Agrobacterium cells that simplifies the Arabidopsis transformation protocol. Plant Methods. 2 (16), (2006).
- Mara, C., Grigorova, B., Liu, Z. Floral-dip transformation of Arabidopsis thaliana to examine pTSO2::β-glucuronidase reporter gene expression. J Vis Exp. (40), (2010).
- Mlynarova, L., Bauer, M., Nap, J. -P., Pretova, A. High efficiency Agrobacterium-mediated gene transfer to flax. Plant Cell Rep. 13, 282-285 (1994).
- Mu, G., et al. Genetic transformation of maize female inflorescence following floral dip method mediated by agrobacterium. Biotechnology. 11 (3), 178-183 (2012).
- Trieu, A. T., et al. Transformation of Medicago truncatula via infiltration of seedlings or flowering plants with Agrobacterium. Plant J. 22 (6), 531-541 (2000).
- Yasmeen, A., et al. In Planta transformation of tomato. Plant Mol Biol Rep. 27, 20-28 (2009).
- Zale, J. M., Agarwal, S., Loar, S., Steber, C. M. Evidence for stable transformation of wheat by floral dip in Agrobacterium tumefaciens. Plant Cell Rep. 28, 903-913 (2009).
- Zhan, X. C., Jones, D. A., Kerr, A. Regeneration of flax plants transformed by Agrobacterium rhizogenes. Plant Mol Biol. 11, 551-559 (1988).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены