Method Article
Screenable
In This Article
Summary
A protocol is described for in vivo detection of effects of mitochondrial inhibitors in the model organism Caenorhabditis elegans and for identification of potential enhancing compounds. This protocol can be used to screen drug libraries for compounds modulating mitochondrial function.
Abstract
The multicellular model organism Caenorhabditis elegans is a small nematode of approximately 1 mm in size in adulthood that is genetically and experimentally tractable. It is economical and easy to culture and dispense in liquid medium which makes it well suited for medium-throughput screening. We have previously validated the use of transgenic luciferase expressing C. elegans strains to provide rapid in vivo assessment of the nematode’s ATP levels.1-3 Here we present the required materials and procedure to carry out bioassays with the bioluminescent C. elegans strains PE254 or PE255 (or any of their derivative strains). The protocol allows for in vivo detection of sublethal effects of drugs that may identify mitochondrial toxicity, as well as for in vivo detection of potential beneficial drug effects. Representative results are provided for the chemicals paraquat, rotenone, oxaloacetate and for four firefly luciferase inhibitory compounds. The methodology can be scaled up to provide a platform for screening drug libraries for compounds capable of modulating mitochondrial function. Pre-clinical evaluation of drug toxicity is often carried out on immortalized cancerous human cell lines which derive ATP mostly from glycolysis and are often tolerant of mitochondrial toxicants.4,5 In contrast, C. elegans depends on oxidative phosphorylation to sustain development into adulthood, drawing a parallel with humans and providing a unique opportunity for compound evaluation in the physiological context of a whole live multicellular organism.
Introduction
המטרה הכוללת של הליך זה היא הכימות המהיר של מצב האנרגיה של ג elegans in vivo עם נוף לשימוש זה כנקודת סיום בהקרנת מתחם. הרציונל מבוסס על הביטוי המהונדס של לוציפראז הגחלילית בג נמטודות elegans 1-3 באמצעות פלסמיד (1 pSLGCV https://www.addgene.org/49862). האנזים בלוציפראז הוא התמזגו לGFP חלבון פלואורסצנטי הירוק ובא לידי ביטוי בכל מקום וconstitutively בציטופלסמה (peroxisome לוציפראז מיקוד אות הוסר). זה מוביל לפליטת אור כאשר luciferin המצע מסופק אקסוגני. כתולעת היא שקופה, אור ניתן למדוד בluminometer כיחידות יחסי אור (RLU). דלקי ATP סלולריים תגובת פליטת אור וזמינותו קובעים את רמות האור מיוצרות. כתוצאה מכך, luminometry מציע convenienלא אומר להערכת רמות ה- ATP היחסית ועל ידי פונקציה של המיטוכונדריה הרחבה, מאז ייצור ATP מתרחש בעיקר במיטוכונדריה. קשר בין רמות תפקוד ופליטת האור של המיטוכונדריה כבר הוכיח בעבר באמצעות ההשתקה של גני המיטוכונדריה הובלת אלקטרונים שרשרת ונלווית תפוקת אור מופחתת. 1
זני פליטת אור שנוצרו היו מיועדים PE254 (feIs4) ו PE255 (feIs5) 1 (ראה רשימת חומרים) וניתן להשתמש בם לסירוגין. 3 מספר המחקרים מנוצל זני חיישן אלה לדווח על רמות ה- ATP הסלולריות in vivo לאחר חשיפה לכימיקלים xenobiotic שונים כגון אזיד הנתרן 1, 2 קדמיום, ביוב בוצת תמצית 3, 5'-fluoro-2-deoxyuridine 6, וnitrosamine טבק ספציפי 7. גם הזנים היו שימושיים כדי לפקח על השפעות של חשיפה לקרינת אולטרה סגולה C 8 ואת ההשפעות של שיבוש תפקוד שרשרת הנשימה במיטוכונדריה. 1.9 גרסה מוקדמת של חיישן הארה המבטא את הגן בלוציפראז ללא היתוך GFP (PE39) שימשו גם בחקירת השפעות של מתכות כבדות ושל דרכי הנשימה . Uncoupler 10 זני PE254 וPE255 לשאת לוציפראז: הקרינה היתוך וGFP GFP הוצגה להגדיל באופן יחסי עם מסת נמטודות, מציע אמצעי נוח לנורמליזציה של ערכי הארה 6,9 ההשפעות של סכום ההפרש של תולעים בכל טוב יכולות להיות גם. נלקח בחשבון על ידי כולל משכפל טכני מרובה בassay (מינימום של 5 בארות לכל מצב). 3
הפרוטוקול מציע את האפשרות של ניטור vivo של רמות אנרגיה (בניגוד ליותר מבחינה טכנית מייגע במבחנה קביעות ATP) מאפשר הקרנת מתחם ולמקם מחדש בהקשר הפיזיולוגי של כל muהאורגניזם lticellular. ההליך יכול להתארך למגוון של רקע גנטי על ידי חציית transgene המשולב chromosomally לזנים מוטנטים זמינים ו / או על ידי השתקת גנים על ידי התערבות RNA; כך, תוך ניצול מלא של ג elegans כאורגניזם מודל. השיטה אמורה לעזור להפחית כישלון בשלב מאוחר של מועמדי סמים בשל רעילות המיטוכונדריה ולתרום תרומה לצמצום ניסויים בבעלי חיים גבוהים יותר.
Protocol
הערה: בצע את כל השלבים בתנאים סטריליים (זרימת ממשלה למינרית) ועם חומרים מעוקרים מראש (על ידי מעוקר 126 ° C, 11 דקות). צלחת LB עם א המפוספס החוצה coli OP50 שמר על 4 מעלות צלזיוס נדרש, צלחות LB טריות פס החוצה אל וrestreak כל חודש.
1. בקטריאלי הכנת מזון (Escherichia coli OP50)
- יום 1. לחסן 2 x 5 מיליליטר LB בשני בקבוקים אוניברסליים עם מושבה אחת של א ' coli OP50 ומקום ברועד חממה ב 37 ° C (220 סל"ד) במשך 8 שעות.
- לאחר 8 שעות דגירה, להשתמש 2 מיליליטר של א ' coli OP50 LB תרבות לחסן כל 3 x 200 מיליליטר ליטראות צלוחיות מקום ברועדים חממת O (220 סל"ד) / N (17 שעות) על 37 מעלות צלזיוס.
- שוקל 20 x 50 מיליליטר צינורות צנטריפוגה ולכתוב משקל על הצינור.
- יום 2. בעזרת פיפטה סרולוגיות, aliquot 30 מיליליטר של O / N א תרבות coli OP50 לתוך מראש שקלה צינורות צנטריפוגה. צנטריפוגה ב 7741 xז, 10 מעלות צלזיוס, 8 דק '.
- למזוג בזהירות את supernatant, לשמור על הצינור הפוך עם המכסה ולהשאיר לעמוד במשך כמה דקות. בעזרת פיפטה להסיר כל supernatant עודף שייתכן שנאסף במכסה. לשקול את הצינור ולחשב את המשקל של גלולה.
- חשב את הנפח הדרוש כדי לספק השעיה של 30 גרם / ליטר ולסמן כרך זה בצינור. צינורות תאריך, תווית ומקום ב -20 ° C. לשימוש בתוך 1-3 חודשים, או ב-- 80 מעלות צלזיוס, אם אחסון למשך זמן ארוך יותר מ -3 חודשים.
- הכן השעיה חיידקים לגידול נמטודות; לאפשר גלולה חיידקים להפשיר ולהוסיף נפח הנדרש של S מלא בינוני 11,12 לכל צינור, מערבולת בעדינות כדי resuspend גלולה, תוכן בריכה של צינורות שונים כדי להשיג את הנפח הנדרש. לעבוד בתנאים סטריליים.
2. הכנת תרופות לתקינה בפורמט צלחת 96-היטב
הערה: אם משתמש בספריית סמים, צלחות תרופה ניתנות באחתריכוז של מתחם בDMSO. הקרנה ראשונית תבדוק תרכובות בריכוז אחד. הוראות מעקב להכנת צלחת תרופה לבדיקת מתחם מאשרות בטווח של ריכוזים בין 0-160 מיקרומטר, שנבחר לאחר מובהקות סטטיסטיות של 10 מיקרומטר. ניתן להתאים את השלבים הבאים כדי לבדוק את ריכוזים אחרים.
זהירות! עקוב אמצעי זהירות דרושה לטיפול בתרופות (בדרך כלל להתמודד עם מסכה, משקפי בטיחות, כפפות נדרשות).
- הכן צלחת תרופה עם עובד בסטנדרטים להקרנה מאשרות: לשקול את הכמות הנדרשת של מתחם לתוך צינור 1.7 מיליליטר microcentrifuge סטרילי ולהכין 16 מתחם מ"מ DMSO (כלומר, 100x מרוכז ביחס לריכוז העליון רצוי לחשיפה).
- סדרתי לדלל 16 מניות מ"מ 1: 2 בDMSO להשיג 8, 4, 2, 1, 0.5 ו -0.25 מ"מ סטנדרטים (תנאים סטריליים). אלה הם 100x מרוכז ויהיה מדוללים עד ריכוזים סופיים של 0 (רכב בלבד),2.5, 5, 10, 20, 40, 80 ו -160 מיקרומטר (ב 1% DMSO) במהלך חשיפה לסמים.
- בזרימה ממשלה למינרית, מקום 20-50 μl לכל גם סטנדרטים מתחם בתוך עמודה של צלחת 96-היטב, לA1 עמדת צלחת דוגמא: 16 מ"מ, B1: 8 מ"מ, C1: 4 מ"מ, D1: 2 מ"מ, E1: 1 מ"מ, F1: 0.5 מ"מ, G1: תרופת 0.25 מ"מ וH1: DMSO. השתמש בעמודות שונות סדרת דילול של תרופות שונות ל.
- רכב Aliquot לבארות של טור 12 בצלחת התרופה.
הערה: זה יקל בדיקת שליטה במורד רכב עמודות בנוסף לבדיקות לאורך השורה H, הבטחת הרכב שנבדק בנציג עמדות של כל הצלחת.
הערה: סדרת דילול למקסימום של 11 תרופות שונות כדי להיבדק בתוספת השליטה ברכב בכל צלחת תרופה להקרנה מאשרות מחזיקה. - תווית וצלחת חותם, מכסים בנייר כסף ומקום ב -20 ° C עד נדרשו.
3. ניסויים נמטודות
הערה: בצע את כל שלבי under תנאים סטריליים, סביבה נקיה מחיידקים ועם חומרים מראש מעוקרת וחומרים כימיים. לשמור על ג elegans זנים באופן שגרתי על צלחות NGM עם E. coli OP50. 12 תזמונים הציעו לצעדי פרוטוקול השונים ניתנים בטבלה 1.
- משימת יום 1: להגדיר תרבות הנוזלית של מתח biosensor לסנכרון הבא.
- קח את נמטודות מצלחת אחת 6 סנטימטר NGM (עם שפע של זחלים צעירים שבו מזון רק נגמר) ב 2 S מיליליטר שלם ולהעביר לבקבוק עם 30 גר '/ L א coli OP50 ב( נפח הכולל של 30 מיליליטר בבקבוק זכוכית 250 מיליליטר חרוטי קיבולת) S מלא. דגירה 3 ימים ב 20 ° C, 160 סל"ד.
- יום 4 משימה (כ 30-35 דקות לאפשר): תרבות אקונומיקה למסוק ביצים ולסנכרן אוכלוסיית תולעת. לבצע את כל צעדי צנטריפוגה דקות 1, 600 x גרם.
- הכן פתרון אקונומיקה רק לפני שימוש: לכל 16 מיליליטר של 0.156 M KOH / NaOH להוסיף 4 מיליליטר אקונומיקה.
- יוצקים 2 x 14 מיליליטרתרבות תולעת לתוך צינורות צנטריפוגה חרוטי 15 מיליליטר. לאפשר תולעים ליישב על ידי כוח הכבידה (3 דקות). להסיר ולסלק נמטודות התיישבה מעל הנוזל. הוסף 5 מיליליטר של תמיסת אקונומיקה על צינור אחד ולהתחיל טיימר. לשלב כרכים לתוך צינור אחד.
- היפוך צינור בעדינות במשך 2 דקות, לבדוק תחת stereoscope לשבירה של תולעים ושחרורו של ביצים להשעיה. כאשר רוב הביצים משתחררות או בזמן מרבי של 2 דקות בפתרון אקונומיקה, צנטריפוגות.
- הסר supernatant בזהירות. לשטוף 1x גלולה עם 14 מיליליטר S מלא ו צנטריפוגות.
- בטל supernatant, להוסיף פתרון אקונומיקה 10 מ"ל ולהתחיל טיימר (שלב אקונומיקה שני זה מבטיח שרוב פגרי התולעת להתפורר והם כבר לא ראו תחת stereoscope). לאחר זמן מרבי בפתרון אקונומיקה של 2 דקות, צנטריפוגה.
- גלולה 3x לשטוף בS מלא, בעדינות למזוג supernatant וגלול גלול ב -14 S מלא אחרי כל צנטריפוגה מיליליטר. לאחר שטיפה סופית, גלולה ביצה גלולה ב14 ג S מיליליטרomplete.
- העבר את הנפח בבקבוק זכוכית חרוטי. דגירה 18-24 שעות בטמפרטורה של 20 מעלות צלזיוס, 160 סל"ד.
הערה: הביצים שנקטפו יבקעו O / N ולעצור את הפיתוח בinstar הזחל הראשון (L1) בשל מחסור במזון, ומכאן הם יהיו כולם באותו השלב של צמיחה.
- משימת יום 5: להגדיר את תרבויות תולעת מסונכרנות למבחנים בסמים.
הערה: תולעים תלויים במדיום רעב נוטים לדבוק משטחי פלסטיק הידרופובי כגון טיפים פיפטה וצינורות. tween-20 0.01% הוא פעילי שטח המשמש כאן כדי להבהיר משטחי פלסטיק הידרופילי יותר ויאפשר דיוק רב יותר בספירה (גם 0.01% יכול לשמש Triton-X100). כאשר נמטודות נמצאות במדיום בתוספת החיידקים, הם לא נוטים לדבוק פלסטיק.- לקבוע מספרים של L1 של בקע בבקבוק, בקבוק לשמור על רועד פלטפורמה (160 סל"ד).
- קח 3x 100 דגימות μl מבקבוק (להשתמש קצה נקי בכל פעם) לmicrotubes מיליליטר הנפרד 1.7 עם 900 מ 'נוזל μledium 0.01% Tween-20.
הערה: Aspire 100 מדגם μl לתוך הקצה הנקי רק פעם אחת. ואז, כאשר מחלק, פיפטה למעלה ולמטה כמה פעמים לתוך מדיום tween תוספת לשחרר את כל תולעי הקפדה על הקצה. - רוזן נמטודות ב4x 10 טיפות μl מצינור אחד דילול שלושה עותקים. חישוב הערך ממוצע ולהעריך את מספר התולעים הנוכחיים בבקבוק זכוכית חרוטי.
- קח 3x 100 דגימות μl מבקבוק (להשתמש קצה נקי בכל פעם) לmicrotubes מיליליטר הנפרד 1.7 עם 900 מ 'נוזל μledium 0.01% Tween-20.
- חשב את הנפח של ההשעיה נמטודות בקעו נדרשה להגדיר תרבות מיליליטר 2 x 20 עם 10 נמטודות לכל 10 μl. הגדל את הנפח מחושב על ידי 10% לחשבון לאובדן חלק נמטודות לאחר מכן במהלך שלבי צנטריפוגה.
- נפח למזוג נדרש לתוך 2 x 15 צינורות צנטריפוגה מיליליטר (שקל מראש). לשקול צינורות להשיג נפח בפועל לוותר, מערבולת בעדינות ולהתאים למקד נפח על ידי הסרת נפח עודף עם טפטפת 5 מיליליטר (רק קצה סטרילי צריך להיכנס לצינור).
- איפור נפח 14 מיליליטר עם S הטרי השלם להיהנמטודות שעות. צנטריפוגה (1 דקות, 600 גר '). להסיר ולסלק supernatant בזהירות שלא להפריע את כדור נמטודות.
- הוסף 5 מיליליטר של S להשלים עם 30 גרם / L א coli OP50 לנמטודות pelleted. העבר 5 מיליליטר בצינור אחד לבקבוק זכוכית חרוטי המכיל 15 מיליליטר S מלא עם 30 גר '/ L א coli OP50. רשום נמטודות הזמן סופקה ראשונה עם אוכל.
- לנער בקבוק בעדינות (160 סל"ד), לקחת 9 x 10 טיפות μl על גבי שקופיות מיקרוסקופיות (להשתמש טיפים טריים בכל פעם) לספור נמטודות ולאשר ממוצע של כ 10 (± 2) לכל 10 μl.
- מניחים צלוחיות נמטודות ברועדות חממה ב 20 ° C, 160 סל"ד 42-44 שעות.
- לקבוע מספרים של L1 של בקע בבקבוק, בקבוק לשמור על רועד פלטפורמה (160 סל"ד).
- יום 7 משימה: נמטודות העברת 96 צלחות גם וליזום חשיפה לסמים.
- לשלב תרבויות נמטודות לתוך בקבוק אחד, לשמור מתערבל בקבוק בעדינות ומניח 3 x 4 מיליליטר של תרבות נמטודות בשוקת סטרילי 60 מיליליטר. הנח שוקת על פלטפורמה רועדת (160 סל"ד).
- השימוש 8 צ'אןפיפטה Nel לaliquot נמטודות המושעית 25 μl לכל גם של 96 צלחות microtiter גם שחורות עם תחתית שקופה שטוחה (ללקיחת שתי קריאות הארה וקרינה, או צלחות הלבנות להארה בלבד). מכסים במכסה צלחת ומניח בצד.
- לאחר שהוקם מכל 2 צלחות, מקום 2 x 2.5 מיליליטר נמטודות אחרת בשוקת להחליף נפח אבוד (לשמור "נפח מת" בשפל של כ -7 מיליליטר).
- הגדרה 13/14 צלחות עם נמטודות. 11 צלחות נמטודות תידרש לבחון שתי צלחות תרופה 96-היטב. צלחת נמטודות ה -12 תהיה טעונה באופן בלעדי עם רכב כביקורת. הצלחת ה -13 תשמש להקמת הקרינה רקע ביום 8 (ראה להלן). צלחת נוספת יכולה להיות מוכנה לשימוש צריכה טעויות להתרחש במהלך להגדיר.
- 74 μl Aliquot של S מלא לכל צלחת היטב ומקום בתא לח (ראה רשימת חומרים) בחממה רועדת (20 מעלות צלזיוס, 160 סל"ד) UNTil מוכן תרכובות בדיקת aliquot בזמן שנבחר מראש התפתחותיים (למשל, 30 דקות 45 שעות לאחר סיפק מזון). [כרך לכל גם הוא עכשיו 99 μl].
- להפשיר צלחת תרופה (ים) לבדיקה.
- להשתמש פיפטה רבה להקים צלחות נמטודות עם סמים, שינוי טיפים בכל פעם. לאפשר 5 דקות לצלחת 96 גם לaliquoting סמים.
- קח 1 μl מיום 1 בעמודת st של צלחת תרופה ולהוסיף לעמודים 1-5 בצלחת המכילה נמטודות; חוזר מטור 2 nd בצלחת התרופה לעמודות 8-12 של הצלחת המכילה נמטודות. הוסף 1 μl של רכב לעמודים 6 ו -7 של צלחת נמטודות.
הערה: הנפח הכולל לכל גם בצלחת נמטודות יהיה 100 μl וכתוצאה מכך 1: של מתחם / רכב 100 דילול. - חזור על תהליך על ידי הוספת 1 μl של הטור / 4 ה -3 של צלחת התרופה לעמודים 1-5 / 8-12 של צלחת נמטודות השנייה; להוסיף רכב לעמודים 6 ו -7 של צלחת נמטודות.
- תמשיך לבדוק עמודות צלחת תרופה שנותרו. הגדרה מינימאלית של צלחת נמטודות אחד עם רכב בכל הבארות באמצעות דגימה מהטור 12 של צלחת תרופה. צלחות מקום בחזרה בתאים לחים ברועדים חממה (20 מעלות צלזיוס, 160 סל"ד) ל20-22 שעות (ראה הערה ליום 8).
- קח 1 μl מיום 1 בעמודת st של צלחת תרופה ולהוסיף לעמודים 1-5 בצלחת המכילה נמטודות; חוזר מטור 2 nd בצלחת התרופה לעמודות 8-12 של הצלחת המכילה נמטודות. הוסף 1 μl של רכב לעמודים 6 ו -7 של צלחת נמטודות.
- חלק-להכין את חיץ הארה ליום הבא: להוסיף DMSO ו -10% Triton-X-100 להיקף הנדרש של S המלא כדי להשיג 1% DMSO ו0.15% Triton X-100. הרשה 5 מיליליטר לקריאת צלחת להארה, בתוספת 1 מ"ל ליחול מזרק luminometer.
- משימת יום 8: קרא נקודות קצה ניסיוניות - הקרינה ופליטת אור. (קריאות הקרינה GFP מומלצות כאמצעי ללנרמל את נתוני פליטת אור.)
הערה: מטרה לקרוא נקודות קצה על ידי 66-67 שעות לאחר אוכל הניתן לנמטודות כדי למנוע ייצור צאצאים משמעותי תחת תנאי הניסוי מתוארים.- צלחת להגדיר לשימוש כרקע לקריאת שליטת GFP. גombine גם תוכן מצלחת 13 ה לתוך צינור 15 מיליליטר. לאפשר נמטודות להתיישב (2-3 דקות). השתמש supernatant לטעון microplate (שחור עם תחתית שקופה) עם 100 השעיה חיידקי μl בכל טוב.
- שים לב צלחת שליטת רקע תחת מיקרוסקופ וציין את הבארות שבו ניתן לראות נמטודות. תכלול אלה מאומדן רקע שימוש בניתוח נתונים שלאחר מכן.
- קראו הקרינה של כל צלחת 96-היטב, כוללים שליטת הרקע. (הגדרות: אופטיקה מתחתית הצלחת; מסננים 485/20 עירור; 528/20 פליטה.)
- הכן חיץ לקריאת הארה: להוסיף luciferin (20 מ"מ) להיפרד הכנה חיץ (מהיום הקודם), כדי להשיג חיץ הארה עם 1% DMSO (1x), 0.15% Triton-X100 (3x) ו -0.3 מ"מ luciferin (3x ). 6x ראש luminometer מזרק עם 150 חיץ הארה μl.
- שלב קודם מניח DMSO 1% כרכב במהלך חשיפה לסמים. כאשר רכב הוא מים, להתאים את שיתוףncentration של DMSO במאגר הארה עד 3% (כלומר, פי 3).
- לעבוד עם צלחת אחת בכל פעם. לוותר 50 חיץ הארה μl בכל טוב. (150 נפח μl סופי וב; דילול 3x של חיץ הארה: ריכוזי 1% DMSO, 0.05% Triton-X100 ו0.1 מ"מ luciferin סופי.) מקום באופן מיידי על הפלטפורמה רועדת ולהתחיל טיימר.
- לאחר 3 דקות ברועדות פלטפורמה (160 סל"ד), לקרוא הארה (1 שניות למדידה).
- צלחת להגדיר לשימוש כרקע לקריאת שליטת GFP. גombine גם תוכן מצלחת 13 ה לתוך צינור 15 מיליליטר. לאפשר נמטודות להתיישב (2-3 דקות). השתמש supernatant לטעון microplate (שחור עם תחתית שקופה) עם 100 השעיה חיידקי μl בכל טוב.
ניתוח נתונים 4.
- לחסר רקע GFP ממוצע קריאה מתוצאות הקרינה. לחלק פליטת אור על ידי קריאת GFP בהתאמה.
- כאשר ערך ה- GFP גבוה מזוהה לנמטודות נחשפה למתחם, למדוד הקרינה של המתחם בכוחות עצמו כדי להסביר כל הקרינה מתחם. אם גבוה מממוצע, משתמש בזה כרקע במקום.
- פליטת אור Express, פליטת אור מנורמלת GFPND נתוני הקרינה GFP כאחוז מהערך הממוצע לשליטה ברכב בכל צלחת.
- העלילה ערכים ממוצע וברי שגיאה עבור כל ריכוז.
- מבחן למובהקות סטטיסטיות באמצעות 2-דרך ניתוח השונות (ANOVA) עם אפקטים של "ריכוז", "ניסוי" והאינטראקציה שלהם (כל הנתונים מתייחס לנקודה גם יחיד), ולהשתמש במבחן Dunnett כמבחן פוסט הוק (לעומת . שליטה ברכב).
הערה: אם "הניסוי" או המונחים "האינטראקציה" הם משמעותיים, ניסויים נוספים עשויים להידרש כדי לאשר תגובה. איפה אין השתנות בין הניסויים ניכר מתצפית של חלקות נתונים, ניתן לבצע ניתוח שונה כיוון אחד על נתונים נאספו מניסויים בלתי תלויים.- לניתוח הסטטיסטי של צלחת (ים) עם רכב בלבד, בחרו את כל הבארות בטורים 6 -7 וכל הבארות בH שורה כקבוצת ביקורת (אלה הם העמדות באופן שיגרתי שהוקצו לרכב במהלך בדיקת מתחם).
תוצאות
נציגי תוצאות כדי להמחיש את השיטה התקבלו לrotenone (איור 1), paraquat (איור 2), oxaloacetate (איור 3), ו 4 תרכובות שהרימו מעכבים כגחלילית בלוציפראז במהלך ההקרנה של ספריית תרופת 13 (איור 4). החשיפה לסמים החלה בשלב L4 בכל המקרים, אבל ניסויי חשיפת paraquat היו התחילו ב 41 שעות לאחר האוכל סיפק ראשון לנמטודות לעומת 45-46 שעות לתרכובות האחרות. הפרוטוקול מאפשר למידה של גמישות בבחירת הזמן לחניכה של החשיפה לסמים ואורך החשיפה. צריכים להיות דבקות פעמים עם זאת, למטרות הקרנה, מוגדרים נבחרו פעם אחת, לשחזור בין ניסויים. נקודות קצה יש למדוד על ידי זמן התפתחותי 66-67 שעות על מנת למנוע הטלת ביצים נרחבת ובקיעה של צאצאים בבארות. הנחיות לתזמונים מסופקות בTתוכל 1.
Rotenone, מורכב המיטוכונדריה אני מעכב, הופחת פליטת אור לאחר שני חשיפות קצרות יחסית (שעה 2) ועוד (24 שעות) לטווח של ריכוזים (איור 1). במקרה זה, אין מדידות GFP נלקחו, אך מספר החזרות טכניות בשימוש (n = 6) מספיק כדי לאזן את כל הבדלים במספרי תולעת בין בארות 3. חשיפת 24 שעות היא חלון של זמן שבו נמטודות לגדול, ופיתוח איטי יותר כתוצאה מעיכוב אני מורכב היה צפוי לתרום לירידה בפליטת אור. זו אושרה על ידי תצפית ויזואלית תחת stereoscope עם התפתחות מאוחרת ראתה, במיוחד בריכוזים של 20 מיקרומטר ומעלה; בנוסף כמה קטלני היה שם לב מ -40 מיקרומטר (תצפיות איכותיות לא לכמת). לא קטלני נצפה לאחר חשיפת 2 שעות אבל השפעות על תנועת תולעת נראו. ירידה חדה בפליטת אור ביחס להביא עלינו כיבוש בקרותrred בריכוז הנמוך ביותר של 2.5 מיקרומטר rotenone נבדק, שלתופעות לא מזוהות בקלות על ידי תצפית ויזואלית מהירה ב -2 חשיפת HR. ירידה בפליטת אור זה עולה בקנה אחד עם ATP הסלולרי מופחת. עיכוב מקסימאלי הושג עם הריכוז הנמוך ביותר של rotenone משמש (2.5 מיקרומטר) מצביע על כך שצריכים להתבצע בכל ניסויים הבאים במיוחד מיקוד rotenone בין 0 ל 5 מיקרומטר [טווח הריכוז 0-160 מיקרומטר נבחר כחלק מהשוואה עם תרופות אחרות תחילה זוהה כבעלי השפעה משמעותית על 10 מיקרומטר (שיפורסם במקום אחר)].
Paraquat קוטל העשבים משפיע על תפקוד המיטוכונדריה דרך גידול של מיני חמצן תגובתי. הנה, אנחנו מדגימים את השפעתה על פליטת אור של ג PE254 מתח elegans לאחר חשיפה למגוון רחב של ריכוזים למשך 24 שעות (איור 2). כזן נושא לוק :: היתוך GFP, הקרינה GFP הייתה also נמדד כאמצעי לנורמליזציה. 6,9 Paraquat ירד פליטת אור, הקרינה GFP ופליטת אור מנורמלת באופן משמעותי. מבחן פוסט הוק-Dunnet הצביע על כך שהריכוזים של paraquat עם הבדלים משמעותיים ביחס לשליטה ברכב היו 4 ו -8 מ"מ לפליטת אור ופליטת אור מנורמל, כמו גם 2 מ"מ לפליטת אור מנורמל. הריכוז רק הפחתת הקרינה GFP באופן משמעותי היה 8 מ"מ, ריכוז שבו השפעות הצמיחה והתולעת המתה מדי פעם נראו (תצפיות איכותיות). הירידה בפליטת אור (ופליטת אור מנורמלת) הייתה גדולה יותר מזה של הקרינה, עולה בקנה אחד עם הירידה בתפקוד והשפעות על ייצור ATP במיטוכונדריה.
Oxaloacetate ביניים מעגל חומצה הציטרית נבדק על ג PE254 מתח elegans בריכוז אחד של 8 מ"מ, הוביל לעלייה בפליטת אור (איור 3). לא לזרוח GFPמדידות NCE התקבלו או תצפית חזותית נוספת שביצעה; עם זאת, כגון תגובה לריכוז יחיד הייתה זוכה לחשיפה נוספת מאשרות לטווח של ריכוזים, ותצפיות מפורטות יותר של השפעות. שיפור של פליטת אור על ידי המתחם הזה הוא לא מפתיע כפי שהוא יכול להיות הניח להוביל לפעילות גדולה יותר של מעגל החומצה הציטרית, עם ייצור סופו של דבר גדול יותר של ה- ATP (בכל זאת זה יהיה רצוי כדי לשלוט על כל השפעות על רמות לוציפראז על ידי הערכת הקרינה GFP בניסויים הבאים). ערכות נתונים oxaloacetate מוצגות חושפים את מידת ההשתנות בתגובה ראתה בניסויים מבוססים לוציפראז. מניסיוננו שונות זו תכונה של מערכת הבדיקה במיוחד לתנאי חשיפה פחות מזיקים.
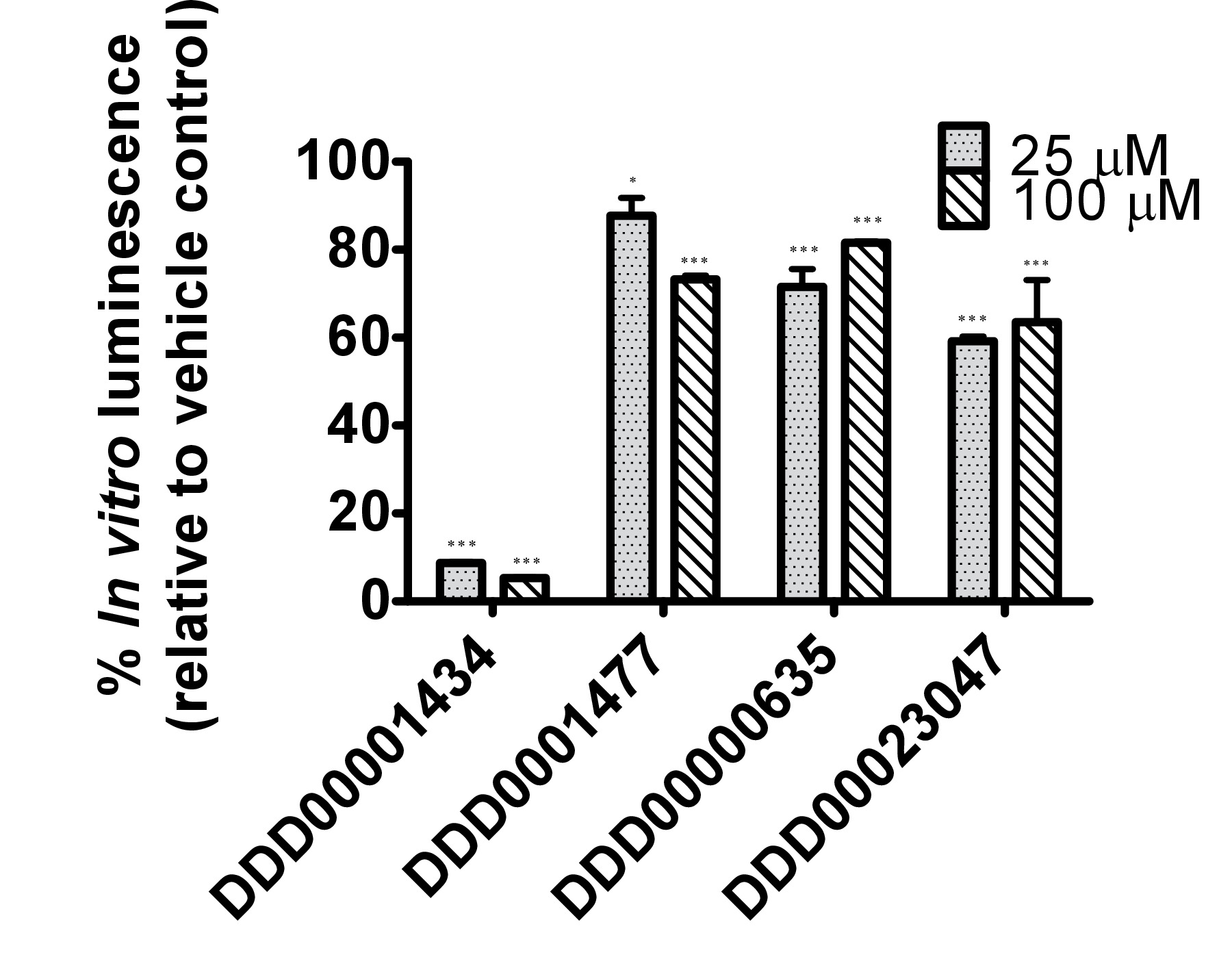
DDD00001434 התרכובות מעכבות גחלילית בלוציפראז, DDD0001477, DDD00000635 וDDD00023047 נבדקו הן במבחנה על ידי מסתכל על השפעות על puאנזים אחוז האימה וin vivo באמצעות ג לוק elegans: GFP להביע מתח. לא היו שום ראיות לכך שכל אחד מהתרכובות שנבדקו גרם למות נמטודות בתנאי החשיפה. כל 4 התרכובות השפיעו על הפעילות בלוציפראז במבחנה בריכוזים שנבדק 2 25 ו 100 מיקרומטר (איור 4 א). DDD00001434 נהרג הפעילות של לוציפראז המטוהר כמעט לחלוטין, אשר סיפק הצדקה אמינה לירידה הגדולה בin vivo פליטת אור (איור 4). אמנם, במבחנה ובמבחני vivo לא להשוואה ישירה, התגובה לDDD00023047 הייתה דומה בשני מבחני. DDD0001477 וDDD00000635 גרמו לירידה גדולה יותר בvivo מאשר במבחנה. תרכובות אלה נמסרו לתולעים חיים 22 שעות לפני מצע luciferin, ותוצאות עשויות לשקף שהם לא בקלות שנעקרו מהאתר הפעיל לוציפראז כאשר luciferin הפך available. לחלופין, DDD0001477 וDDD00000635 עלול להיות השפעה נוספת על רמות ה- ATP סלולריות. זה היה צריך להיות מוערך על ידי אמצעים שאינם כרוכים בלוציפראז גחלילית. של פתק היה השיפור החזק של אות ה- GFP בתולעים חיים החשופים למתחם DDD00000635. זה יידון בהמשך.
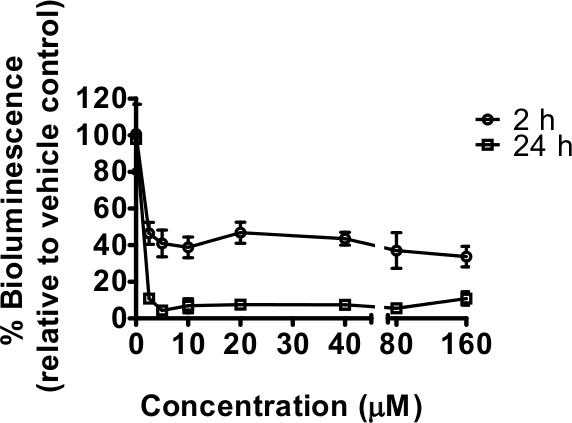
איור 1. מורכב המיטוכונדריה אני מעכב rotenone ירד מעמד האנרגיה של ג elegans כפי שנמדד על ידי פליטת אור של PE254 מתח. תולעי שלב מסונכרן L4 (45-46 שעות לאחר אוכל הניתן לזחלי L1) נחשף ל0, 2.5, 5, 10, 20, 40, 80 ו -160 מיקרומטר rotenone בDMSO 1% ל -2 שעה (קצרה) או 24 שעות (חשיפה ארוכה) קריאות קודמות של פליטת אור בהתאמה וב48 69 שעות של פיתוח תולעת לאחר סיפק מזון. פליטת אור (יחידות אור יחידה יחסית, RLU) באו לידי ביטוי כאחוז מהרכב (1% DMSערכי O). ברים שגיאה מתארים SEM של משכפל טכני בכל ריכוז rotenone (n = 6). כל הריכוזים שנבדקו הביאו הבדל מאוד משמעותי מבחינה סטטיסטית ביחס לשליטה ברכב (p <0.001).
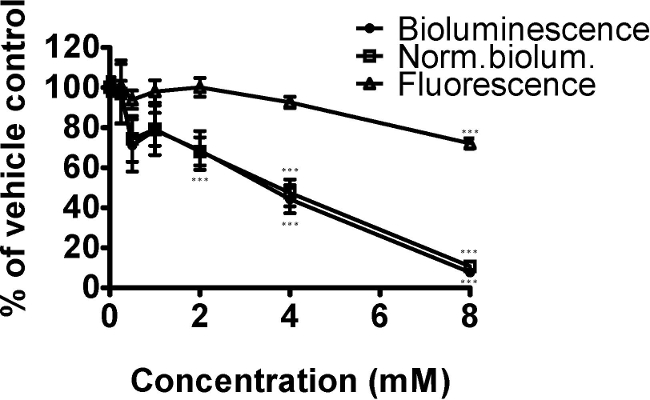
איור 2. paraquat לחץ חמצוני ירד מעמד האנרגיה של ג PE254 elegans המתח באופן תלוי ריכוז (שנמדד על ידי פליטת אור). תולעים מסונכרן L4 שלב (לנוחות במקרה זה ב 41 שעות לאחר אוכל הניתן לזחלי L1) נחשף ל0, 0.25, 0.5, 1, 2, 4 או 8 paraquat מ"מ עבור 24 שעות. הקרינה GFP (יחידות יחידה יחסית הקרינה, RFU) שימשה כדי לנרמל את נתוני פליטת אור (יחידת RLU), שני נקודות הקצה שהושגו בפיתוח משאבי אנוש 65. הנתונים באים לידי ביטוי כאחוז מפקדים (1% DMSO). ברים שגיאה מתארים SEM של משכפל טכני(N = 5 לריכוזים שונים; n = 18 עבור פקדים). כיוון אחד ANOVA: *** p <0.001 ביחס לשליטה ברכב.
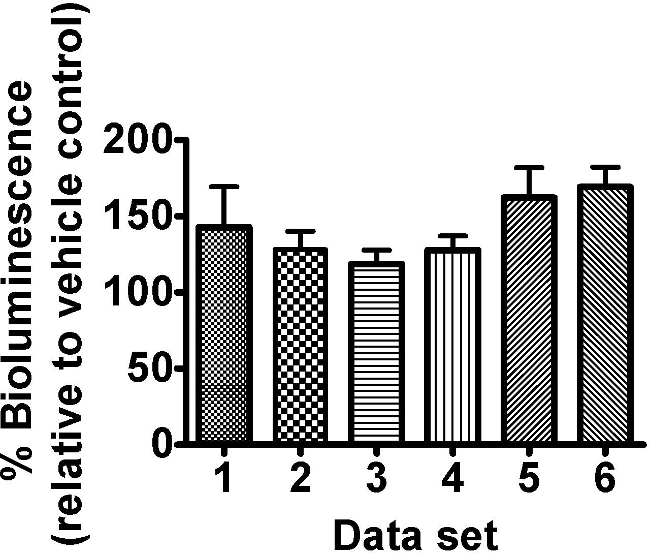
איור 3. oxaloacetate ביניים מעגל חומצה הציטרית (8 מ"מ) משופר פליטת אור של ג PE254 elegans מתח. תולעי שלב מסונכרן L4 (45-46 שעות לאחר אוכל הניתן לזחלי L1) נחשפו למוכנים טרי 8 oxaloacetate מ"מ במשך 18 שעות ± 30 דקות. פליטת אור (RLU יחידה) הייתה לקרוא בזמן ההתפתחותי של שעות 63.5 שעות ± 1 ובאה לידי ביטוי כאחוז מהשליטה ברכב (DDH 2 O). עמודות שונות מייצגות ערכות נתונים שונות של 8 חזרות טכניות הוקצו 96 צלחות גם שונות בתוך אותו הניסוי. ברים שגיאה מתארים SEM של משכפל טכני (n = 8). 2 דרך-ANOVA עם 'קבע' ו 'ריכוז' כגורמים: ̵6; 'p> 0.05,' סט עמ הריכוז '<0.001 וטווח האינטראקציה p> 0.05.
B 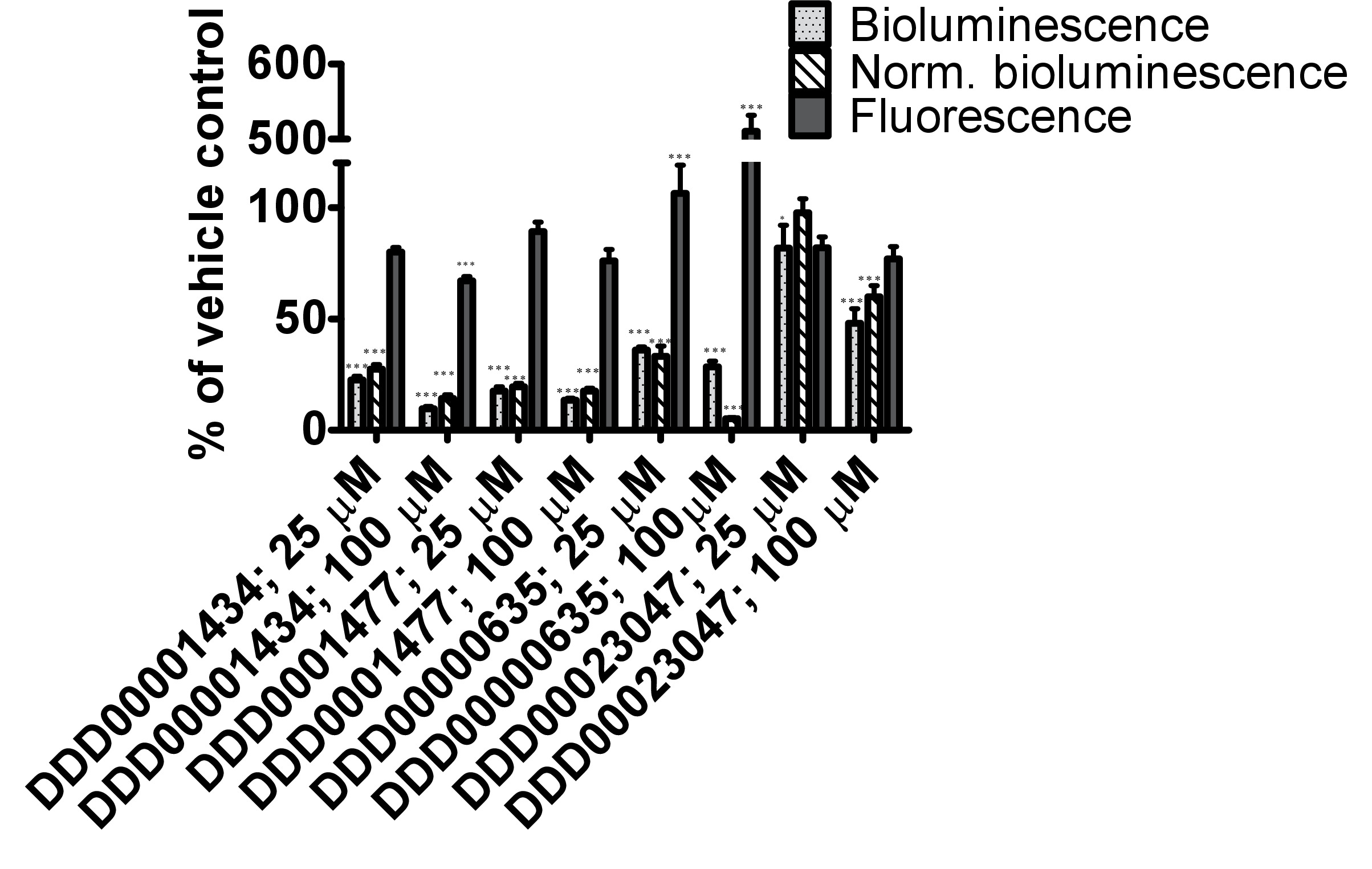
איור 4. בדיקה של תגובות ל4 תרכובות מספריית דנדי גילוי תרופות מתחם 13 (C1: DDD00001434, C2: DDD0001477, C3: DDD00000635 וC4: DDD00023047) עם פעילות מעכבת ידועה על הארה לוציפראז גחלילית. (א) השפעה של תרכובות בפעילות של לוציפראז גחלילית מטוהר (נמדד כיחידות אור, RLU), מבוטא באחוזים של שליטה ברכב. ערכת CLSII פליטת אור ATP (רוש, מנהיים, גרמניה) שימשה על פי הוראות עם אותה הכמות של אנזים בלוציפראז aliquoted לבארות (96-W לבןell צלחות microtiter). ATP סופק בריכוז סופי של 10 מיקרומטר ו1 μl של מתחם (ריכוז סופי הצביע) או DMSO (1%) נוספו. אות הארה שולבה במשך 10 שניות. ברים שגיאה מתארים SEM של משכפל טכני (n = 4). ניתוח: כיוון אחד ANOVA; * P <0.05 או *** p <0.001 ביחס לשליטה ברכב. הבדלים בין 25 ל 100 מיקרומטר משמעותיים ביותר עבור C1 (DDD00001434; p <0.001), ומשמעותי עבור C2 ו- C3 (בהתאמה DDD0001477 וDDD00000635; p <0.05). (ב) בvivo מדידות של פליטת אור, פליטת אור מנורמלת לקרינת GFP ו הקרינה GFP של ג PE254 elegans מתח בזמן התפתחותי 67 שעות לאחר חשיפה לתרכובות מבחן במשך 22 שעות. ברים שגיאה מתארים SEM של משכפל טכני (n = 8). ניתוח סטטיסטי (דרך-ANOVA אחת) בוצעה על הנתונים אספו מ3 ערכות נתונים (3 xn = 8). * P <0.05 או *** p <0.001 ביחס לשליטה ברכב בהתאמה. בידולCES בין 25 ל 100 מיקרומטר רק מובהק סטטיסטי (p <0.05) לפליטת אור מנורמלת בעקבות החשיפה לC4 (DDD00023047).
| שעה ביום | יום 1 | יום 2 | יום 3 | יום 4 | יום 5 | יום 6 | יום 7 | יום 8 |
| 9-10 | שלב 5 | |||||||
| 10-11 | שלב 5 | |||||||
| 11-12 | שלב 4 | שלב 5 | ||||||
| 12-13 | שלב 4 | |||||||
| 13-14 | ||||||||
| 14-15 | ||||||||
| 15-16 | ||||||||
| 16-17 | שלב 1 | שלב 3 | ||||||
| 17-18 | ||||||||
| 18-19 | שלב 2 |
סקירת טבלת 1. צעדי פרוטוקול להתבצע בכל יום של ניסויי נמטודות (סעיף 3) והציעה תזמונים.
Discussion
אורגניזם המודל C. elegans מספק מערכת ניסיונית חזקה. זה קל לתרבות ומייצר צאצאים זהים גנטי בשפע עם מחזור חיים 3.5 יום מביצה ללהתרבות מבוגר (דרך שלבי זחל לנוער L1 עד L4). בשל גודלו הקטן, זה יכול להיות מבוגר בנוחות ב96-גם צלחות, להקל הקרנת מתחם. אנו מציגים פרוטוקול הקרנה פנוטיפי המבוסס על זנים של ג elegans הפועלים כin vivo חיישנים של רמות אנרגיה. 14 הפרוטוקול ישים לכל מעבדה, אם כי נדרש luminometer צלחת 96-היטב וקבינט סטרילי. זה חשוב כדי למנוע זיהום במבחנים על ידי שימוש בטכניקת מעבדה טובה. אם עובד באופן ידני, את המספר המרבי של צלחות נמטודות השגה הוא 13 לכל ניסוי המאפשר בדיקה של 2x צלחות תרופת 96-היטב וכולל שתי צלחות רכב. נציגי תוצאות מוצגות למורכבת המיטוכונדריה אני מעכב rotenonדואר, גנרטור paraquat סופראוקסיד, oxaloacetate ביניים מחזור חומצת לימון וארבע תרכובות עם פעילות מעכבת גחלילית בלוציפראז ידועה. שתי התרכובות הראשונות הובילו לירידה בפליטת אור כפי שחזו ואילו oxaloacetate הוביל לשיפור, עשוי לנבוע מדור גדול יותר של ה- ATP. ערכות נתונים oxaloacetate גם להדגים את השונות המהותיות בניסויים מבוססים על לוציפראז גחלילית ככתב. מינימום של שלושה ניסויים בלתי תלויים הם מומלץ לוודא חוסן של תגובות לתרכובות בלתי ידועות.
העיכוב של פעילות לוציפראז גחלילית היה מזוהה עם assay במבחנה באמצעות ערכה מסחרית. 3 אחד המתחמים הביאו לעלייה משמעותית בקרינת GFP בקנה אחד עם מעכב הגדלת הרמות של גחלילית בלוציפראז באמצעות קשירת האנזים של לוציפראז פעיל מתויג GFP אתר, והופך אותו ליותר יציב. 15 במקרים מסוימים(לא במקרה הספציפי הזה) זה יכול להוביל לרמות גבוהות של פליטת אור כאשר המעכב שנעקר על ידי מצע עודף. 15 הוא, לכן, חשוב שלא לפרש את התוצאות בטעות מתרכובות שאינטראקציה עם אנזים הגחלילית כירידה או עליית רמות ה- ATP / פונקציה של המיטוכונדריה. שינויים באות הארה לעתים קרובות למדי לתאם עם מדידות נוספות של בריאות כגון תנועה, התפתחות וצמיחה. כדוגמא, מתחם הוא מעכב לוציפראז חשוד אם ירידה דרמטית באות פליטת אור מזוהה אך תולעים הם נבדלים מבקרות על ידי תצפית מיקרוסקופית. עלייה בקרינת GFP, לא מוסברת על ידי גידול או autofluorescence מתחם, יכולה גם להצביע על מעכב. מספר מעכבי לוציפראז 15 ידוע וכבר נכנס לPubChem. לכן במקרה הראשון, זה תרגול טוב להתייעץ מידע על מעכבי לוציפראז מוחזקים על ידי PubChem; אחרי testing של השפעות המתחם במבחני חוץ גופייה עם האנזים המטוהר 3 ו / או אישור של השפעות על תפקוד המיטוכונדריה ידי אמצעים נוספים. 16,17
מדידות הקרינה GFP מאפשרות זיהוי של רמות לוציפראז גחלילית (וזיהוי הפוטנציאל של כמה מעכבי אנזים בלוציפראז כפי שפורט לעיל) מה שהופך את מקרה חזק למדידת נקודת קצה זו לצד פליטת אור במידת האפשר. נורמליזציה של קריאות פליטת אור לGFP היא גם אמצעי לטיפול חשבונאי בשינויים במספרי תולעת בין בארות (אם כי זה יכול גם להיות מושגת על ידי הכללה של משכפל טכני מרובה). לרגישות רבה יותר, חשוב להפחית הקרינה רקע מקריאות. הפרוטוקול מעריך את התרומה של ההשעיה החיידקים לקרינת הרקע, לעומת זאת autofluorescence נמטודות לא היווה (הגבלה של assay הנוכחי, קריטית במיוחד לכל סטו הזדקנותבהתחשב בכך שמת עליות autofluorescence נמטודות עם גיל). גם autofluorescence של תרכובות מבחן צריך להיות מוערך במקביל. הנורמליזציה GFP הייתה נראית הכרחית שבו חוקרים מבקשים להתאים את הפרוטוקול כדי להשוות בריכות ATP סלולריות במוטציות גנטיות שונות או אחרי ההשתקה של גנים שונים, במטרה לשלוט על כל הבדלי מתח ברמת הביטוי של transgene פליטת אור.
פרמטרים קריטיים בפרוטוקול כוללים את השלב ההתפתחותי שבו חשיפה היא יזם, אורך החשיפה, וקבלת מספרים דומים של נמטודות בבארות שונות. חשיפה יכולה להתחיל בכל שלב של התפתחות של נמטודות, אולם שלב L3 ומעלה עדיפה. משלב זה והלאה, נמטודות תלויה בזרחון חמצוני לפיתוח לבגרות, כפי שמעיד גידול מאוד משמעותי בתוכן mtDNA, צריכת חמצן ורמות ה- ATP. 18,19,20 הפרוטוקול הנוכחי יוזם ירידייור בשלב L4. הסיבה לaliquoting נמטודות ל96-גם צלחות רק בשלב זה (ולא כאשר הם סיפקו ראשון עם מזון בשלב L1), היא שלמרות צלחות מונחות בתאים לחים כדי למזער אידוי, מידת האידוי עדיין מתרחשת ב החממה שלנו רועד, נראית כטיפין קטנות מאוד להרכיב על העפעפיים (זה לא יכול להיות בעיה עם חממות רועדות אחרות). על ידי aliquoting נמטודות לצלחות ממש לפני התוספת של תקני סמים, ריכוז התרופה בפועל אינו מושפע מכל וריאציה קטנה בנפח בשל התאדות. טעינת צלחת נמטודות עם רכב היחיד היא שימושית כדי לבדוק שנמטודות חולקו באופן שווה בין בארות. כל הבדלים מובהקים לרכב רק צלחת יהיו מעידים על טכניקה לקויה מחלק נמטודות לבארות.
אורך החשיפה הוא גורם חשוב לשקול. אם השפעות על מצב אנרגיה באופן עצמאי של צמיחה של עניין, פרוtocol יכול להיות שונה כדי להתאים חשיפות קצרות יותר (מתגובות כמעט מיידיות ל, למשל, 2 שעות). מצד השני, כניסה של תרכובות לג רקמות elegans עשויות לקחת קצת זמן. לדוגמא נדרשות 12-24 שעות כדי להשיג ריכוזים פנימיים מרביים של רזברטרול ו5-fluoro-2'-deoxyuridine (FUDR). 21 לכן, חשיפה ארוכה יותר (18 עד 24 שעות) עשויות להיות מוצדקות על מנת למקסם את רמות חשיפה. זמן החשיפה צריך להיות מוגבל לפעמים שאינם מאפשרים רמות משמעותיות של רבייה להתקיים בבאר. אנו ממליצים שהזמן התפתחותי הכולל של נמטודות נשמר תחת 66-67 שעות. למרות נוח, נמטודות הם מעוברת עד אז ויזמה egglaying. עם זאת מצאנו קריאות פליטת אור מהכנות ביצה להיות זניח (לא מוצג). ביטוי transgene מונע sur-5 האמרגן מזוהה ראשון רק 01:58 שעות וחצי לאחר הפריה בשלב 100 התא 22 וגקליפת הביצה hitinous עשויה להגביל כניסה של luciferin. אחרים מצאו כי ביצי embryonated לא תרמו באופן משמעותי לחילוף החומרים של מבוגרים הרה להולדת. 23 עם זאת, תנאים המאפשרים ייצור צאצאים משמעותי יש להימנע. אם העדיף, לוח הזמנים הניסיוניים יכול להיות מוזזים לאחור: יש לנו יזמנו בעבר חשיפה לרעלן סביבתי בשלב (36 שעות) הזחל מאוחר L3 וביצעו מדידות פליטת אור וGFP ב 55 שעות 2 רקעים לחלופין, גנטיים שתנאים סטריליים. יכול לשמש כדי למנוע ייצור צאצאים, כמו למשל FER-15 (B16) השני; FEM-1 מוטציה כפולה IV (hc17) אשר יכול להישמר על 15 מעלות צלזיוס, אך הוא סטרילי בC ° 25. 24 השימוש בFUDR לגרום לעקרות אינו מומלץ כמו זה יכול בעצמו משפיע על חילוף חומרים נמטודות. 25 assay יכול גם להתבצע בזנים עם העור הקרני חדיר יותר כגון פסד של funct החלקייון אוטובוס-8 מוטציות שהם multidrug רגיש בשל להגדיל חדירות של תרופות. 26 זה יקלו חשיפות וריכוזים נמוכים מתחם קצרים יותר. התנאים להוספת luciferin לנמטודות אלה עשויים גם צריכים התאמה כלומר, 1% DMSO ו0.05% Triton-X100 במאגר הארה לא ייתכן שיידרשו כדי לשפר את זמינות luciferin.
הפרוטוקול משתמש 1% DMSO כרכב למסירת מתחם. למרות שאינו קטלני, ריכוז זה של DMSO יש כמה תופעות ביולוגיות כפי שכבר דנו בפרסום קודם. 3 רבים של ספריות תרופה הזמינות ערוכים 100% DMSO, בריכוזים שיהיו מתאימים למבחנים מבוססי תאים לאחר הדילול של רכב 0.1%. ריכוזים גבוהים יותר מתחם נדרשים לעורר תגובות בג elegans בהשוואה לתאים אנושיים, כך שלעתים קרובות לא ניתן לערוך מבחני בנמוכים מ 1% DMSO. שוב, השימוש בזנים עםיותר העור הקרני חדיר עלול להוביל לבדיקה עם ריכוזים נמוכים של רכב. ריכוזים של% גבוהים יותר מאשר 1 DMSO אינם מומלצים.
זמן דגירה סט עם luciferin לקראת קריאה צריך להיות דבק. כפי שניתן לראות בעבר, הארה מגיעה לרמות המרביות שלה בתוך דקות השניה לאחר הוספת luciferin, שנותר יציב יחסית ל5 דקות הראשונות, ואחריו ירידה הדרגתית איטית בהארה על 30 דקות הבאות 1. יכולים להתבצע תגובות הקינטית לכימי מסוים בשלב ראשוני זה של 30 דקות אחרי מחלק ראשוני של luciferin.
הפרוטוקול כרוך צעד רעב הבא אוסף של ביצים כדי להשיג סנכרון של אוכלוסיית נמטודות. אנו ממליצים סנכרון של אוכלוסיות מבחן נמטודות מאז שלבי התפתחות שונים נבדלים ברמות ה- ATP סלולריות ועשויים להגיב באופן שונה לתרכובות הבדיקה. על ידי ביצוע הרעב במלא Sבינוני בניגוד לM9, נמטודות הבקיעה מסופקות עם מקור פחמן (אתנול), כך זחלים שלא לפתח אך לא מורעבות לחלוטין. 27,28 זה גם הוכח שנעצר L1 של דרוכים לתגובה מהירה למזון ו שיעור L1 נורמלי צמיחה מושגת בתוך 3 שעות לאחר אוכל הופך להיות זמין. 29 עם זאת, האפשרות שצעד הרעב עשוי לשנות את חילוף החומרים של ג לא ניתן לשלול elegans. 30 מסיבה זו באורך של רעב לא יעלה על 24 שעות (18 שעות מספיקות לסנכרון). ייתכן שיש לי מעבדות מסוימות את האפשרות של שימוש Biosorter קופאס לסנכרון גיל עוקף את צעד הרעב לגמרי. ייתכן שיש לי מעבדות אחרות העדפה להרחבת אוכלוסיית נמטודות על תקשורת מוצקה (צלחות NGM עם OP50) לפני ההלבנה (שלב 3.1) וזה יעבוד היטב גם. אנו משתמשים במדיום S במהלך חשיפת מתחם כמדיום סטנדרטי עבור culturing נמטודות, however תקשורת אחרת ניתן לבחור, למשל בינוני K או די מים קשים EPA משמש לעתים קרובות ללימודי ecotoxicological. 31,32
הפרוטוקול מספק אמצעי לסינון ולזהות מועמדים לבדיקות נוספות במונחים של ההשפעות על תפקוד המיטוכונדריה. בשלב הסינון ראשוני סביר להניח כי כמה תרכובות יהיו כבר החמיצו בשל נבדק רק אחד ריכוז, לכן מסכי תרופה לא צריכים להיחשב ממצה. יכולים להיות מאומתים על ידי להיטי השימוש בטכניקות להערכת היבטים שונים של תפקוד המיטוכונדריה לצריכת חמצן דוגמא, ג elegans זנים עם מיטוכונדריה GFP להביע, כתמים לפוטנציאל קרום המיטוכונדריה ו / או מדידות ROS. 16,33,34 המשמעות הגדולה ביותר של המתודולוגיה היא להיות אמצעי לסינון מספר רב של תרכובות ו / או תנאים ברמת האורגניזם רב-תאית, וחשוב מכך כדי להיות מסוגל לנצל את הנְהִילוּת הגנטית דואר של ג elegans לחקור מנגנוני פעולה. הטכניקה עשויה לעזור להאיץ ולמצוא נתיבים חדשים לגילוי של תרכובות ויעדים מעניינים. זה שחזה כי השילוב של החיישן עם רקע גנטי הקשורים למחלות בבני אדם להקרנה של ספריות מתחם בהקשר רלוונטי מחלה יש הרבה מה להציע.
Disclosures
יש המחברים אין לחשוף
Acknowledgements
The authors would like to thank David Gray from the Dundee Drug discovery unit for kindly donating firefly luciferase inhibitory compounds DDD00001434, DDD0001477, DDD00000635 and DDD00023047; Tibor Harkani (Medical University of Vienna) for the suggestion of oxaloacetate as a test compound; and Charlie Dear (University of Aberdeen) for illustrations. This work was funded by a BBSRC Pathfinder award (BB/FOF/PF/4/11) and the University of Aberdeen.
Materials
| Name | Company | Catalog Number | Comments |
| Orion II Microplate Luminometer | Berthold Detection Systems | with injector and the Simplicity 4.2 Software; transfer data to Excel at the end of plate measurement | |
| FLx800 fluorimeter | Biotek | with Gen5 Software; transfer data to Excel at the end of plate measurement | |
| Ks 130 basic shaking platform | Ika | #0002980000 | |
| Innova 4349 | New Brunswick Scientific | Refrigerated incubator shaker | |
| Eppendorf centrifuge 5804R | Eppendorf | with eppendorf rotor A-4-44 (for 50/15 ml tubes) | |
| Stripette, Costar | Corning | #4489 | Serological pipette |
| Cellstar 50 ml tubes | Greiner bio-one | #227661 | |
| Cellstar 15 ml tubes | Greiner bio-one | #188261 | |
| Cellstar 60 mm tissue culture plates | Greiner bio-one | #628160 | |
| Superfrost Microscope slides | VWR | #631-0909 | |
| Sterile spatula | Corning | #3007; #3004 | for weighing out chemicals |
| 0.22 mM Millex GP filters | Millipore | #SLGP033RS | |
| Axygen eppendorf tubes 1.5 ml | Fisher Scientific | #MCT-150-R | |
| Corning 96 well assay plate | VWR | #3603 | Black plate clear bottom with lid |
| Nunc 96 well assay plate | Fisher Scientific | #236105 | White plate with lid |
| Reservoir reagent 60 ml | Thermo Scientific Finnpipette | #9510027 | used as trough for nematodes in protocol section 4.4.1 |
| Storage box/damp chamber | Roche Diagnostics | #10 800 058 001 | 174 x 101 x 56.6 mm, used as a damp chamber with wet paper towels; 2x 96-well plates with lids can fit into one, the lower sitting on top of a microplate lid |
| Bleach: Sodium hypochlorite solution 4-4.99% Chlorine content | Sigma Aldrich | #239305 | Store in aliquots at 4 °C, seal with Parafilm to prevent loss of chlorine and cover in foil |
| D-Luciferin, potassium salt | Biotium Inc | # 10101-2 | Molecular Probes can also be used as supplier; prepare a 20 mM stock in ddH2O, keep at -20 °C in aliquots |
| [header] | |||
| Tween 20 | Sigma Aldrich | # P9416 | |
| DMSO | CalBiochem | #317275 | Purity 99.99% |
| Triton X100 | Alfa Aesar | #A16046 | Diltute to 10% in ddH2O |
| Nystatin | CalBiochem | #475914 | |
| C. elegans bioluminescent strains | Author's own laboratory | PE254, PE255 | contain integrated arrays feIs4 and feIs5 [Psur-5::luc+::gfp; rol-6(su1006)] respectively on chromossome V and X; select for homogeneous and strong expression of luc::GFP by fluorescence microscopy (e.g. pick 15 worms) every now and then. |
| E. coli OP50 | CGC | ||
| General chemicals | Sigma Aldrich/Fisher Scientific | ||
References
- Lagido, C., Pettitt, J., Flett, A., Glover, L. A. Bridging the phenotypic gap: real-time assessment of mitochondrial function and metabolism of the nematode Caenorhabditis elegans. BMC Physiol. 8, 7 (2008).
- Lagido, C., McLaggan, D., Flett, A., Pettitt, J., Glover, L. A. Rapid sublethal toxicity assessment using bioluminescent Caenorhabditis elegans, a novel whole-animal metabolic biosensor. Toxicol Sci. 109, 88-95 (2009).
- McLaggan, D., et al. Impact of sublethal levels of environmental pollutants found in sewage sludge on a novel Caenorhabditis elegans model biosensor. PloS one. 7, e46503 (2012).
- Rodriguez-Enriquez, S., Juarez, O., Rodriguez-Zavala, J. S., Moreno-Sanchez, R. Multisite control of the Crabtree effect in ascites hepatoma cells. Eur J Biochem. 268, 2512-2519 (2001).
- Marroquin, L. D., Hynes, J., Dykens, J. A., Jamieson, J. D., Will, Y. Circumventing the Crabtree effect: replacing media glucose with galactose increases susceptibility of HepG2 cells to mitochondrial toxicants. Toxicol Sci. 97, 539-547 (2007).
- Rooney, J. P., et al. Effects of 5'-fluoro-2-deoxyuridine on mitochondrial biology in Caenorhabditis elegans. Exp Gerontol. 56, 69-76 (2014).
- Bodhicharla, R., Ryde, I. T., Prasad, G. L., Meyer, J. N. The tobacco-specific nitrosamine 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone (NNK) induces mitochondrial and nuclear DNA damage in Caenorhabditis elegans. Environ Mol Mutagen. 55, 43-50 (2014).
- Leung, M. C., et al. Effects of early life exposure to ultraviolet C radiation on mitochondrial DNA content, transcription, ATP production, and oxygen consumption in developing Caenorhabditis elegans. BMC Pharmacol Toxicol. 14, 9 (2013).
- Kuang, J. J., Ebert, P. R. The failure to extend lifespan via disruption of complex II is linked to preservation of dynamic control of energy metabolism. Mitochondrion. 12, 280-287 (2012).
- Lagido, C., Pettitt, J., Porter, A. J., Paton, G. I., Glover, L. A. Development and application of bioluminescent Caenorhabditis elegans as multicellular eukaryotic biosensors. FEBS Lett. 493, 36-39 (2001).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Brenk, R., et al. Lessons learnt from assembling screening libraries for drug discovery for neglected diseases. ChemMedChem. 3, 435-444 (2008).
- Lagido, C., Wilson, M. J., Kakouli-Duarte, T. . Nematodes as environmental indicators. , 225-251 (2009).
- Thorne, N., et al. Firefly luciferase in chemical biology: a compendium of inhibitors, mechanistic evaluation of chemotypes, and suggested use as a reporter. Chem Biol. 19, 1060-1072 (2012).
- Houtkooper, R. H., et al. Mitonuclear protein imbalance as a conserved longevity mechanism. Nature. 497, 451-457 (2013).
- Andreux, P. A., Houtkooper, R. H., Auwerx, J. Pharmacological approaches to restore mitochondrial function. Nat Rev Drug Discov. 12, 465-483 (2013).
- Tsang, W. Y., Lemire, B. D. Mitochondrial genome content is regulated during nematode development. Biochem Bioph Res Co. 291, 8-16 (2002).
- Decuyper, C., Vanfleteren, J. R. Oxygen-Consumption during Development and Aging of the Nematode Caenorhabditis-Elegans. Comp Biochem Phys A. 73, 283-289 (1982).
- Dillin, A., et al. Rates of behavior and aging specified by mitochondrial function during development. Science. 298, 2398-2401 (2002).
- Zheng, S. Q., Ding, A. J., Li, G. P., Wu, G. S., Luo, H. R. Drug absorption efficiency in Caenorhbditis elegans delivered by different methods. PloS one. 8, e56877 (2013).
- Yochem, J., Gu, T., Han, M. A new marker for mosaic analysis in Caenorhabditis elegans indicates a fusion between hyp6 and hyp7, two major components of the hypodermis. Genetics. 149, 1323-1334 (1998).
- Vanfleteren, J. R., DeVreese, A. Rate of aerobic metabolism and superoxide production rate potential in the nematode Caenorhabditis elegans. J Exp Zool. 274, 93-100 (1996).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: a role for heat-shock factor and bacterial proliferation. Genetics. 161, 1101-1112 (2002).
- Davies, S. K., Leroi, A. M., Bundy, J. G. Fluorodeoxyuridine affects the identification of metabolic responses to daf-2 status in Caenorhabditis elegans. Mech Ageing Dev. 133, 46-49 (2012).
- Partridge, F. A., Tearle, A. W., Gravato-Nobre, M. J., Schafer, W. R., Hodgkin, J. The C. elegans glycosyltransferase BUS-8 has two distinct and essential roles in epidermal morphogenesis. Dev Biol. 317, 549-559 (2008).
- Castro, P. V., Khare, S., Young, B. D., Clarke, S. G. Caenorhabditis elegans Battling Starvation Stress: Low Levels of Ethanol Prolong Lifespan in L1 Larvae. PloS one. 7, (2012).
- Baugh, L. R. To Grow or Not to Grow: Nutritional Control of Development During Caenorhabditis elegans L1 Arrest. Genetics. 194, 539-555 (2013).
- Baugh, L. R., DeModena, J., Sternberg, P. W. RNA Pol II Accumulates at Promoters of Growth Genes During Developmental Arrest. Science. 324, 92-94 (2009).
- Maxwell, C. S., Antoshechkin, I., Kurhanewicz, N., Belsky, J. A., Baugh, L. R. Nutritional control of mRNA isoform expression during developmental arrest and recovery in C. elegans. Genome Res. 22, 1920-1929 (2012).
- Cressman, C. P., Williams, P. L. Reference toxicants for toxicity testing using Caenorhabditis elegans in aquatic media. Am Soc Test Mater. 131, 518-532 (1997).
- Khanna, N., Cressman, C. P., Tatara, C. P., Williams, P. L. Tolerance of the nematode Caenorhabditis elegans to pH, salinity, and hardness in aquatic media. Arch Environ Con Tox. 32, 110-114 (1997).
- Benedetti, C., Haynes, C. M., Yang, Y., Harding, H. P., Ron, D. Ubiquitin-like protein 5 positively regulates chaperone gene expression in the mitochondrial unfolded protein response. Genetics. 174, 229-239 (2006).
- Yang, W., Hekimi, S. A Mitochondrial Superoxide Signal Triggers Increased Longevity in Caenorhabditis elegans. Plos Biol. 8, (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved