A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Percutaneous כבדית זלוף (PHP) עם תרופה כטיפול גרורות נתיחות המרותק אל הכבד
In This Article
Summary
בכתב היד הזה, אנו מתארים זלוף כבד מבודד מלעורית עם chemofiltration סימולטני כטיפול בגרורות לכבד נתיחות. הליך זה מבוצע בהרדמה כללית angiosuite ידי צוות מנוסה, מורכבת הרדיולוג התערבותית, perfusionist קליני anaesthesiologist.
Abstract
גרורות בכבד נתיחות של סרטן המעי הגס ניתן לטפל עם כימותרפיה מערכתית, במטרה להפחית את המחלה, להאריך הישרדות או להפוך גרורות נתיחות למולקולות resectable. חלק מהחולים עם זאת, סובלים מתופעות לוואי או התקדמות תחת טיפול מערכתי. עבור חולים עם מלנומה הענביה גרורה אין אפשרויות טיפול סיסטמי סטנדרטיות. עבור חולים ללא מחלת extrahepatic, זלוף הכבד המבודד (IHP) עשוי לאפשר שליטה למחלה מקומית עם תופעות לוואי מערכתיות מוגבלות. בעבר, זה בוצע במהלך ניתוח פתוח עם תוצאה מספקת, אבל תחלואה ותמותה הקשורים ההליך הפתוח, אסור יישום נרחב. לכן, זלוף הכבד מלעורית (PHP) עם chemofiltration סימולטני פותח. מלבד הפחתת תחלואה ותמותה, הליך זה יכול להיות חוזר ונשנה, בתקווה וכתוצאה מכך שיעור תגובה גבוהה יותר והישרדות משופרת (על ידי שליטה המקומית של מחלה). במהלך PHP, חתולheters ממוקם עורק הכבד הראוי, להחדיר סוכן כימותרפיות, ובשנת וריד caval הנח לשאוב דם chemosaturated חוזר דרך הוורידים בכבדים. קטטר הווריד caval הוא צנתר בלון כפול אוסר הדליפה לתוך המחזור המערכתי. הדם חוזר מן הוורידים הכבדים הוא aspirated דרך קטטר fenestrations ואז perfused דרך מערכת סינון נוספת-גשמית. לאחר סינון, הדם מוחזר לחולה באמצעות קטטר שלישי וריד הצוואר הפנימי הנכון. במהלך PHP מינון גבוה של תרופה הוא החדיר לתוך הכבד, שהוא רעיל היה לגרום לסיבוכים מסכני חיים כאשר באופן מערכתי. בגלל חוסר היציבות המודינמי משמעותי הנובעות שילוב של חסימה בווריד caval ו chemofiltration, ניטור המודינמי ותמיכה המודינמי היא בעלת חשיבות עליונה במהלך הליך מורכב זה.
Introduction
כריתה של גידולים ממאירים בכבד היא הבחירה הראשונה של טיפול הוא ממאירויות בכבד ראשוניות ומשניים. עם זאת, חלק גדול מהחולים אינם מועמדים לניתוח בשל מחלה או מיקום המורחבת של גרורות. עבור חולים עם גרורות נתיחות מ קרצינומה המעי הגס, טיפול מערכתי הוא לעתים קרובות הטיפול המועדף. גרורות בכבד ממלנומה הענביה הם בדרך כלל קטנים להפיץ מתפזרים בתוך הכבד. אין טיפול מערכתי סטנדרטי הוא זמין עבור קבוצה זו של חולים. טיפול מקומי יכול להוות אלטרנטיבה טיפול מערכתי, למקרה הגרור מתוחמים הכבדים.
בגלל האנטומיה של כלי הדם הספציפית של הכבד, איבר זה יכול להיות מבודד מן המחזור המערכתי. זה מאפשר זלוף של הכבד עם כימותרפיה במינון גבוה (IHP, זלוף הכבד מבודדים). חוץ מזה, ממאירויות בכבד יש אספקת דם דומיננטית או בלעדי מן hepatiעורק ג, ואילו 70-80% מהאספקה של parenchyma הכבד הלא tumorous נגזרו וריד השער. 1, 2 טכניקה זו פותחה לפני למעלה מעשרים שנה, כדי לטפל בחולים עם גרורות נתיחות ממקורות ראשוניים שונים. 3, 4 במיוחד, חולים מלנומה עם גרורות הענביה בכבד עלולים להיות מועמדי IHP משום הגרורות הן בדרך כלל קטנות, התפשט ברחבי הכבד כולו, וכיום אין טיפול מערכתי סטנדרטי הוא זמין. 5, 6
עיקרון IHP הוא לבודד את הכבד זמני מהמחזור המערכתי perfuse האיבר עם מינון גבוה של כימותרפיה, שמוביל חשיפת סמים מקומית גבוהה עם תופעות לוואי מערכתיות מוגבלות. 7 זה מינון גבוה של כימותרפיה יהיה רעיל לגרום לסיבוכים כאשר באופן מערכתי. רוב המחקרים IHP בוצעו עם melphalan, ו חקרו לטיפול metastasi הכבד. ים של חולי סרטן המעי הגס, כמו גם חולים עם גרורות מלנומה הענביה 8,9 מספר מחקרים של IHP במהלך ניתוח פתוח מראים כי טיפול זה עשוי להיות יעיל: שיעורי התגובה של הגידול 50-59% (תגובה חלקית ומלאה) לטיפול סרטן מעי גס שיעור תגובת גידול 68% עבור חולים עם מלנומה גרורתית הענביה דווח. 8,10,11,12 למרות תוצאות הטיפול אלה, הליך זה לא צבר הסכמה רחבה, בגלל המורכבות של ההליך, משך חולים להישאר ואת התחלואה והתמותה הקשורות.
זלוף הכבד מלעורית (PHP) מציעה אלטרנטיבה פולשנית מינימלית IHP ו הוצגה לראשונה במודל חזירי בשנת 1993 באמצעות דוקסורוביצין 13 והראשון במשפטו האדם בוצע על ידי Ravikumar et al. בשנת 1994. 14 בשל חוסר הראיות של יעילות, הטכניקה ננטשה ברובו עד שנרשם בתחילת שנת 2000 כאשר הוא wכמו הערכה מחדש של המכון הלאומי לסרטן (NCI) בארצות הברית. 15 במהלך PHP, קטטר מושם מלעורית לעורק הכבד סדיר דרך עורק הירך להחדיר סוכן כימותרפיות. קטטר שני מושם בוריד caval הנח דרך וריד הירך כדי לשאוב את תזרים chemosaturated הכבד (ראה מעגל PHP באיור 1). קטטר שאיפת הבידוד להציב וריד caval הוא צנתר בלון כפול, האוסר הדליפה לתוך המחזור המערכתי. דם chemosaturated aspirated מסונן לפי מסנן פחם כפול וחזר לחולה באמצעות קטטר שלישי להציב וריד הצוואר הפנימי. החולה הוא הודה בבית החולים עם משך השהייה של ~ 3 ימים. ההליך PHP מתבצע בחדר אנגיוגרפיה בהרדמה כללית על ידי צוות רב תחומי מיומן המורכב anaesthesiologist, רדיולוג התערבותית ייעודי וכן perfusio extracorporealNIST. אונקולוג כירורגית אונקולוג גם חברי הצוות הרב-תחומי הזה, ובעיקר להתמקד ליידע את החולה, בחירת החולים וטיפול שלאחר הניתוח.
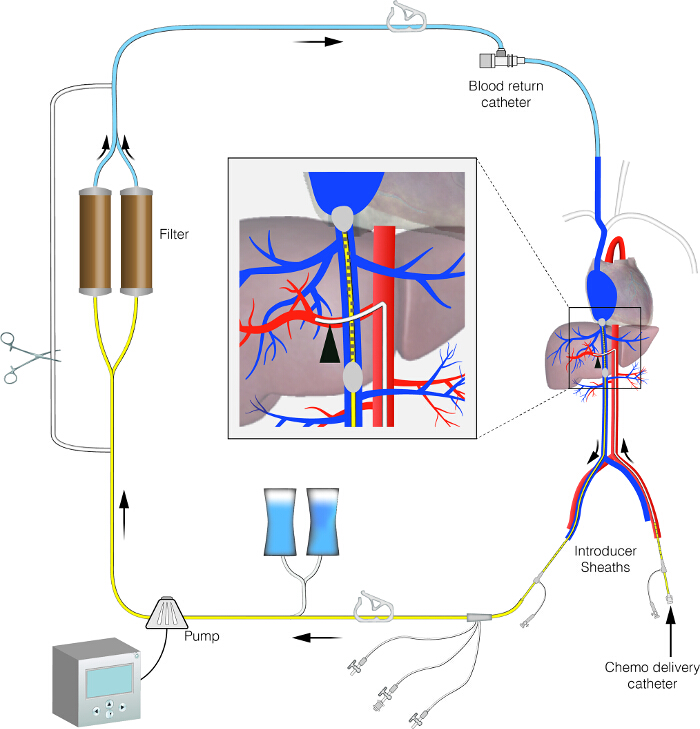
תמונת סכמטי באיור 1. של מעגל PHP. נתון זה מציג את ההגדרה של מעגל PHP. זה מראה מעגל זלוף כבד מבודד עם קו עוקף חוץ גשמי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
הליך פולשני מינימאלי זה קשור לתחלואה פעילה פחות וניתן לחזור מספר פעמים (לפחות עד 4 פעמים). חוץ מזה, זה לוקח רק כ 3 עד 4 שעות וההתאוששות חולה היא מהירה. היתרון של PHP הוא העובדה כי כל הגדלים של גרורות ניתן לטפל, וגרורות המייקר שמתבצעות treateד גם כן. גם המיקום של גרורות, קרוב מבנים כלי הדם ואת דרכי המרה, אינו קונטרה עבור PHP. מחקרים ראשוניים בוצעו עם מסנן דור 1 st, עם יעילות מיצוי מסנן 77% (ממוצע). 16 לאחרונה פורסמו תוצאות של ניסוי שלב III פורסמו על ידי יוז et al. מראה שיפור משמעותי של הישרדות ללא התקדמות המחלה בכבד ב הענביה חולי מלנומה עם גרורות בכבד שטופלו PHP לעומת טיפול החלופה הטובה ביותר. 17
מאז אפריל 2012 מסנן 2 nd הדור זמין. במחקרים פרה-קליניים המסנן 2 nd דור לחילוץ 98% של תרופה. מספר מחקרי מקרה הסדרה החוקרים PHP להתוויות מרובות פורסמו, אך מלבד משפט III שלב הפרסום האחרון, הישרדות לא נותחה בהרחבה. 16,18,19,20 בחקירה הנוכחית, אנו מתמקדים ra התערבותיתהליך diology, כמו גם בניהול ההרדמה ואת הזרימה גשמית הנוספת המשמשת במהלך הליך זה על מנת להקל על השימוש בטיפול זה במרכזים רפואיים אחרים.
Protocol
הערה: לאחר מטופל עמד בכל הקריטריונים להכללה הוערך בקפידה על ידי אונקולוג, כירורג anaesthesiologist רפואי, חולה נכללה במחקר. כל החולים בתנאי בכתב הסכמה מדעת. שני מחקרים קליניים אושרו על ידי ועדת האתיקה הרפואית המקומית של המרכז הרפואי של אוניברסיטת ליידן מבוצעות בהתאם לסטנדרטים האתיים של הצהרת הלסינקי.
1. אנגיוגרפיה טרום פרוצדורליים ידי התערבותית רדיולוג
- לקראת הליך PHP, לבצע אנגיוגרפיה מראש פרוצדורליים 20 כמה ימים לפני PHP למיפוי האנטומיה עורקים. במהלך הליך זה לבצע צנתור של עורק mesenteric המעולה (SMA), תא מטען צליאק ועורק בכבד. 21
- במהלך הצנתור, השתמש חומר ניגוד באמצעות מזרק משאבה לתוך העורקים העורקים אוֹנִי הכבדים הנפוצים באמצעות microcatheter 2.4F או 2.7F. (חומררשימה, פריט 7).
- להזריק 15 מ"ל של ניגוד בלתי מדולל (iopromide 300) (רשימת חומר, פריט 14) בשיעור של 5 מ"ל / sec עבור צנתור מעורק הכבד משותפים 12 מ"ל ב 3ml / sec עבור זריקות אוֹנִי. 21
- להתוות את האנטומיה של כלי הדם של הכבד ואי אספקת הגידול של כלי הדם באמצעות הזרקת בניגוד כמתואר בשלב 1.1.2. 21
- קבע את הסיכון של ריפלוקס של הסוכן כימותרפיות כדי hepatico-מעיים השקה (כגון gastroduodenal או עורק הקיבה מימין). 21 זהה גרסאות וסקולרית, כגון זכות סוטה או עורק הכבד עזב. 21
- במקרה של סיכון אפשרי של ריפלוקס, אם יש פחות מ ~ 1 ס"מ של דיסטלי העורק ראוי הכבד אל העורק gastroduodenal (GDA), embolize עורק זה עם microcoils להסרה או תקע וסקולרית (רשימת חומר, פריט 15 ו -16). כמו כן embolize gastro- אחרים ו / או anastomoses מעיים למנוע זרימת chemotheתרופות raputic למבנים אחרים. 21
- Embolize עורקי סניפים דיסטלי של האתר של אינפוזיה עם אספקת הדם אל הקיבה, הלבלב והמעיים של הסרעפת. 21
2. PHP נוהלו לי: הכנת יצירת מעגל זלוף
- היערכות Perfusionist הגשמי במיוחד (ECP)
- אסוף את chemosaturation tubingpack, chemofilters ואת משאבה צנטריפוגלית. (חומר רשימה, פריטי 1B ו -12) פריטים אלו נארזים בתיבה המתאימה ידי היצרן.
- שטוף את מעגל extracorporeal להשלים עם גז CO 2.
- ראש המעגל עם 0.9% ו הפרין NaCl (2,000 IU / L) כולל המסננים.
- שוטפים את המערכת extracorporeal עם 6 L של heparinized 0.9% NaCl, בתחילה באמצעות כוח הכבידה כמו primeline כבר קיימים במערכת. לאחר מסנני פחמן הם hydrated לגמרי, השתמש p צנטריפוגליUMP כדי להפעיל לחץ נוסף על מסננים, כדי להסיר את בועות הגז שנותרו.
הערה: פטיש קטן יכול לשמש כדי להסיר בועות גז על ידי רטט ותהודה.- בלון קטטר קו וקו מעקף כפול ממשלה.
- chemofilter שמאל הממשלה (עם 1 ליטר) ו-בועה דה, אז chemofilter תקין הממשלה (עם 1 ליטר) ו-בועה דה.
- chemofilters סודה (3 L לכל מחסנית) לאחר תחול ראשונית של המערכת לאט. זה יכול לקחת 10-20 דקות לכל chemofilter.
- מלכודת בועת ממשלה (מסנן עורק).
- שוטפים את המערכת extracorporeal עם 6 L של heparinized 0.9% NaCl, בתחילה באמצעות כוח הכבידה כמו primeline כבר קיימים במערכת. לאחר מסנני פחמן הם hydrated לגמרי, השתמש p צנטריפוגליUMP כדי להפעיל לחץ נוסף על מסננים, כדי להסיר את בועות הגז שנותרו.
- בדוק לכייל את המסכים חיישן לחץ זרימה, כמו מתוכנת בתפריט התוכנה משאבה צנטריפוגלית, על פי הוראות היצרן.
- הכנת חולה על חדר אנגיוגרפיה ידי anaesthesiologist
- הגדרת המעקב הנדרש לניהול הרדמה:
- מניח להקה לחץ דם לחץ דם לא פולשנית למדידת א.ק.ג.אלקטרודות על החזה של המטופל עבור ניטור אק"ג וכן ניטור סאו 2.
- מניח סולם אינדקס Bispectral (BIS) חיישן על מצחו של החולה כדי למדוד את העומק של מטופל הרדמה, במקרה זה הרופא המרדים הוא רגיל לעבוד עם זה.
- הגדרה מפלטות פי הוראות היצרן, כולל ET-CO 2 באמצעות מכשיר האוורור הטובוס. הנח את מכשיר האוורור בצד הנגדי של המטופל היכן IR עומד, כפי שהורה על ידי היצרן.
- מניחים את החולה על שולחן אנגיוגרפיה החדר ישירות לכסות את החולה עם שמיכה אוויר חם כדי mantain טמפרטורה נורמלית.
- מניח גישת ורידים היקפית בוריד זרוע ימני עבור ממשל של iv הרדמה iv נוזלים.
- להשרות הרדמה (עם הרדמה בבית ההעדפה של anaesthesiologist), לבצע אינטובציה endotracheal ולהתחיל intאוורור לחץ חיובי ermittent (IPPV).
- לשמור על הרדמה על BIS = 50, MAP = 65 מ"מ כספית, normuria של 0.5 מ"ל / ק"ג / שעה.
- מניח מדחום טמפרטורת גוף אף ולוע.
- מניח רכבת של ארבע (TOF) אלקטרודות לניטור מצור תוקף כמתואר הוראות היצרן (על ההעדפה המרדימה).
- ההגדרה ולהכין מערכת ניהול נוזל מהירה / או חמה נוזלת (רשימת חומר, פריט 2) כמתואר הוראות היצרן.
- הפעל את מסך הצג המתקדם (רשימת חומר, פסק 4) ולחבר את כל הכבלים.
- הכנס קו עורקי 22 G לתוך העורק הרדיאלי עזב לניטור לחץ הדם הממוצע (MAP). (רשימת חומר, פיסקה 3).
- מניח קו ורידי מרכזי למדידת לחץ מרכזי ורידי וריד הצוואר הפנימי השמאלי.
- הכנס קטטר לשלפוחית השתן.
- לשמור על טמפרטורה נורמלית בשמיכות y אוויר חמות עירוי נוזלים חמים.
- CVP לפקח לחץ דם תוך-עורקי שימוש במסך מתקדם (רשימת חומר, פיסקה 4) לאורך כל ההליך.
- לקבוע זמן קרישת מופעל בסיס (ACT) על ידי ציור דגימת דם, ומכניס אותה מד ACT.
- בנוסף, ב אינדוקציה לנהל גרם תוך ורידי Cefazolin 1, פנטופרזול 40 מ"ג ו -300 מ"ג הידרוקורטיזון.
- הגדרת המעקב הנדרש לניהול הרדמה:
- היערכות הרוקחת
- לשקם melphalan (3.0 מ"ג / ק"ג משקל גוף (מינון מקסימלי 220 מ"ג) (חומר רשימה, פריט 9)) על ידי הזרקת במהירות 10 מ"ל של diluent מסופק ישירות לתוך בקבוקון של אבקת lyophilized באמצעות מחט סטרילית (20 G או מחט גדולה יותר בקוטר ) ומזרק.
- מיד לנער בקבוקון במרץ עד פתרון ברור מתקבל. זה מספק פתרון 5 מ"ג / מיליליטר של תרופה.
- מיד לדלל את המינון להינתן בהזרקה NaCl 0.9%, USP, עלריכוז אינו גדול מ 0.45 מ"ג / מ"ל.
- ממשל מלא תוך 60 דקות של כינון מחדש.
- הכן על חדר אנגיוגרפיה ידי הרדיולוג התערבותית (IR)
- הנח את כלי ציוד הדרושים (סטרילי) ליד שולחן. (חומרי רשימה, פריטי 1a, 3,5,6,7,8,11).
- מכסים את המטופל עם סדינים סטריליים.
- המיקום של מעילי ידי IR
- השתמש הדרכה אולטרסאונד עבור המיקום של נדנים בורידי הצוואר הפנימיים (IJV) מהשמאל ומימין.
- מניח קטטר תוך ורידי 7.5F לומן המשולש, 20 סנטימטרים (רשימת חומר, פריט 5) ב שמאל IJV. נדן זה משמש את anaesthesiologist למדידת CVP עירוי של תרופות sympathomimetic.
- מניחים קטטר החזרה ורידית 10F (רשימת חומר, 1a פריט) בפינה הימנית IJV. נדן זה משמש להחזרת הוורידים של הדם המסונן לאחר chemofiltratio extracorporealn.
- מניחים נדן 5F לתוך עורק הירך משותף שמאל (CFA) (רשימת חומר, פריט 6).
הערה: נדן זה משמש עבור microcatheter להציב coaxially להחדיר סוכן כימותרפיות. - הוסף נדן 18F לווריד הירך משותף ימינה (CFV) (רשימת חומר, פריט 8) לאחר התרחבות סדרתי עם 8-10F ו 12-14F מרחיבים. השתמש מרחיב להתאים את פתיחת הכניסה בגודל הנכון בסופו של דבר למקום נדן 18F כראוי. הערה: נדן זה משמש להציג את הקטטר בלון הכפול (צנתר שאיפת בידוד).
- בידוד של וריד הכבד ויצירת מעגל מחוץ לגוף
- נהל הפרין אחרי הכל נדני הוצבו; במינון ההתחלתי של 300 IU / ק"ג (רשימת חומר, פריט 11).
- שמירה על זמן קרישת פעיל (ACT) מעל 50 שניות במהלך ההליך כולו עם מינונים בולוס הפרין נוספות כנדרש.
- Start נוראפינפרין (50 מ"ל 0.2mg / ml) 0.1-2 מיקרוגרם / ק"ג / דקה phenylephrine (50 מ"ל 0.1mg / ml) 0.1-2 מיקרוגרם / ק"ג / דקה ומינהל נוזל (500 מ"ל של crystalloids) כדי לשמור על פרמטרים המודינמי קרוב על לחץ הדם הממוצע (MAP) של 65 מ"מ כספית, ואת תפוקת שתן של 0.5 מ"ל / ק"ג / שעה.
- דרך נדן 5F בעורק הירך המשותף השמאל, להכניס את microcatheter 2.7F (רשימת חומר, פריט 7) שיתוף axially ומניח אותו בתוך העורקים עורקים או אוֹנִי הכבדים הנכונים באמצעות ניטור אנגיוגרפיה.
- דרך מעטה 18F ב וריד הירך זכות המשותפת, להציג 16 ו קטטר בלון כפול (צנתר שאיפה בידוד) ולמקם אותו עם קצה באטריום הנכון באמצעות ניטור אנגיוגרפיה.
- מיד לאחר ההנפקה של צנתרים, לצרף אלה למערכת extracorporeal באמצעות נקודות חיבור מיוחד; קו בתמורת ורידי אל הנדן ב IJV ואת קווי היצוא אל קטטר הבידוד.
- הפעל את גמשאבת entrifugal כפי שתואר על ידי היצרן:
הערה: כל הקווים פתוחים עכשיו ותזרים פועל מעל הקו עוקף. - לאחר עירוי תוך ורידי של תמיסת קולואיד 0.5 L (רשימת חומר, פריט 13), לנפח את הבלון גולגולתי עם מלח 50% תערובת חומר ניגוד 50%.
- עם נחרץ את בלון הזנב עדיין, לאט לחזור בו קטטר הבלון הכפול עד הבלון גולגולתי הוא בצומת של אטריום ימין וריד caval הנח (IVC), ממש מעל הווריד הכבד הימני (הבלון הוא עכשיו בצורת טריז, כמו באיור 2).
- לנפח את הבלון הזנב בתערובת של מלח 90% ו -10% חומר ניגוד עד הקצוות לרוחב של בלון מנופח מתחיל להיות מחוק ידי IVC.
הערה: בלונים מנופחים עם תערובות שונות של חומר ניגוד. בלון הזנב הוא מנופח להכשיל את הווריד הנבוב הנח מעל ורידי הכליות, כך יצוא ורידי כבד מבודד f rom מחזור ורידים מערכתי. נפח של 38 מיליליטר המקסימאלי ניתן להזריק לתוך כל בלון. - בדקו מיצוב של הבלונים לשלול דליפה עם venography
- בצע venography על ידי הזרקת 20 מ"ל של ניגוד (כלומר, iopromide 300) דרך יציאת אשנוב של הקטטר בלון דאבל דאבל בלון ורידי באמצעות הזרקת יד.
- אם דליפה בניגוד נתפסת, למקם את הבלונים או נוסף לנפח את הבלונים וחזרו על venography כמתואר בשלב 2.6.11.1 (ראה איור 2).
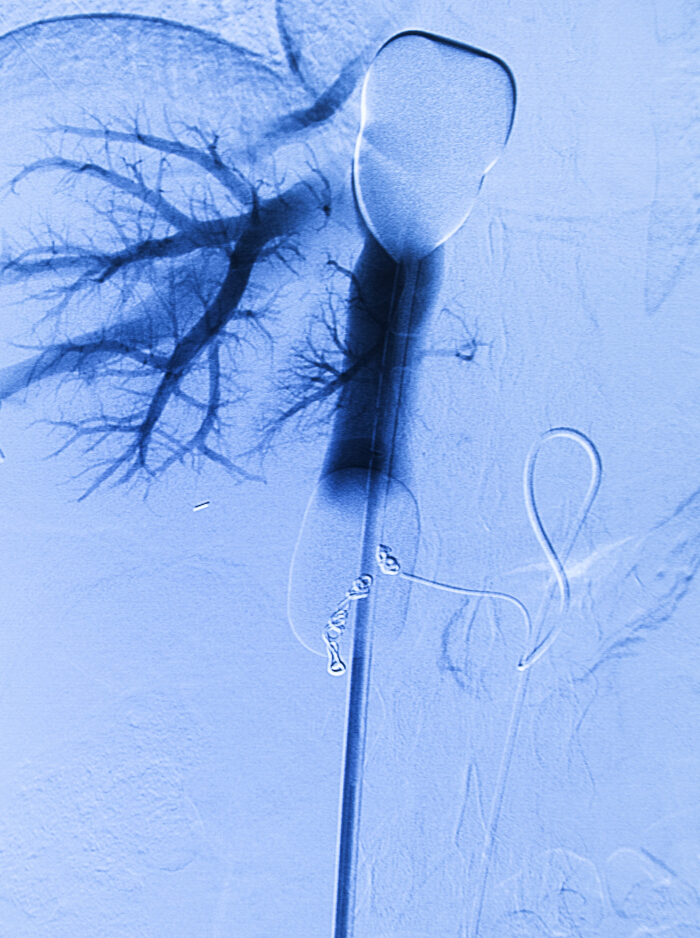
איור 2. Per-פרוצדורליים צנתור. קטטר בלון הכפול ורידי הקטטר העירוי לוריד עורק caval נח עורק הכבד הראוי. בניגוד מדרדר מוזרק דרך צנתר ורידי. סלילי מן אנגיוגרפיה מראש פרוצדורליות אמבוליזציה נמצאים במקום.ww.jove.com/files/ftp_upload/53795/53795fig2large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- סגירת המעגל
- להשרות -0.5 ליטר של פתרון קולואיד. ודא כי שני chemofilters סגורים ברגע זה בזמן, בעוד המעקף פתוח.
- נסו להשיג תזרים מספיק (Q = 400-500 מ"ל / דקה) עם הפרוקסימלי לחצים בטוח (בכלל <-70 מ"מ כספית) ו דיסטלי (<100 מ"מ כספית) של משאבה צנטריפוגלית (רשימת חומר, סעיף 12).
- לכיל נוראפינפרין 0.1-2 מיקרוגרם / ק"ג / דקה phenylephrine 0.1-2 מיקרוגרם / ק"ג / דקה ומינהל נוזל לשמור על לחץ דם סיסטולי של 160 מ"מ כספית, ואת תפוקת שתן של 0.5 מ"ל / ק"ג / שעה.
- כאשר תזרים ולחץ מספיק הם הגיעו, לפתוח את אחד מסנן על ידי אחד.
הערה: מעבר של דם על פי המסננים יהיו hemofiltrate הדם ולהסיר את רוב הסוכן כימותרפיות. Hemofiltration מתרחשת ברחבי proceduמחדש, כמו גם בתקופה 'כשלון' ישירות לאחר תקופת כימותרפיה-אינפוזיה. במהלך תקופת המתנה זו, סוכן כימותרפיות המחזירה מרקמת הכבד, הוא 'דהוי' מהמחזור. - כאשר לחץ דם סיסטולי בין 140-160 מ"מ כספי הושג, לסגור את הקו העוקף.
הערה: anaesthesiologist צריך להיות מוכן להיתקל ירידה בלחץ הדם כתוצאה מהפחתת ב preload עקב חסימה בווריד caval, התרחבות היקפי מפסוק דם באמצעות הסרת chemofilters של סוכני vasoactive (למשל, נוראפינפרין phenylephrine) על ידי chemofilters ו ככל הנראה בהשפעת vasodilative ייצור NO אנדוגני. התאם שיעורי עירוי של נוראפינפרין phenylephrine בהתאם שמירה על מפת 65 מ"מ כספית. - בדוק מיקום של קטטר הבלון הכפול על ידי ביצוע venography (כמתואר בשלב 2.6.11.1).
- בצע צנתר על ידי הזרקת הקונטראסt (iopromide 300) דרך microcatheter בעורק הכבד כדי לשלול התכווצות עורקת. אם התכווצות נתפסת, לנהל 100-200 מיקרוגרם של ניטרוגליצרין לעורק הכבד (כמו גם כמתואר בשלב 1.1 ותת-מדרגות).
3. PHP נוהלו שני: עירוי של כימותרפיה כישלון תקופה
- עירוי של תרופה
הערה: לאחר ההקצאה של מעגל מערכת מסירה, העירוי של תרופה לעורק הכבד הוא התחיל דרך microcatheter.- כאשר שיעור זרימה קבועה היא הוקמה, ואין דליפה הוא ההווה ואת לחץ הדם של החולה יציב, להזריק melphalan במינון של 3 מ"ג / ק"ג לעורק הכבד ראוי או ברצף לשני העורקים אוֹנִי.
- אל תתחיל עירוי כימותרפיה עד MAP הוא מעל 65 מ"מ כספית.
- להזריק את התרופה במינונים של 100 מ"ל באמצעות מזרק אוטומטי בשיעור של 0.4 סמ"ק / sec, כ -30 דק ', until המינון המלא מוזרק.
- במהלך אינפוזיה, במרווחי זמן קבועים, לבצע arteriogram לפקח על ההתרחשות של לווזוספזם ואת המיקום ולבדוק אינפלציה של הקטטר הבלון הכפול עם שטיפת ניגוד. (ראה שלב 2.6.11.1 (venography) ו -1.1 ו 2.7.9 (אנגיוגרפיה) לקבלת מידע על חומר ניגוד).
- במקרה של לווזוספזם, לנהל-גליצרין נטר (100-200 מיקרוגרם).
- לאחר 30 דקות של עירוי כימותרפיות, להמשיך hemofiltration עבור תקופת המתנה של כ -30 דקות (ראה באור בשלב 2.7.5).
- נהל 10 מ"ג מורפיום iv לשליטה בכאב לאחר הניתוח.
- לאחר תקופת המתנה של לאט להוציא את האוויר שני הבלונים בווריד caval.
- כאשר שיעור זרימה קבועה היא הוקמה, ואין דליפה הוא ההווה ואת לחץ הדם של החולה יציב, להזריק melphalan במינון של 3 מ"ג / ק"ג לעורק הכבד ראוי או ברצף לשני העורקים אוֹנִי.
- סוף אינפוזיה והסרה של קטטרים
- בסוף תקופת סחף, רוקן את מעגל extracorporeal ככל האפשר ולאחר מכן לעצור את זלוף extracorporeal.
- עצור את centrifuמשאבת gal וניתקה את הצינורות.
- הסר את הקטטר הבלון הכפול ואת microcatheter העירוי, אבל להשאיר את נדני גישה במקום עד הקרישה מנורמלת. מכשיר סגירת כלי דם יוטל בעורק הירך המשותף להשיג haemostasis.
- שמור את הקטטר השיבה זכות IJV במקום עד פרופיל קרישה מנורמל.
- שמור את 7.5F משולשת לומן קטטר תוך ורידי שמאל IJV במקום לכך ניתן להשתמש בו ביחידה לטיפול אלחוש הודעה (PACU).
- סוף האלחוש ו Heparinization
הערה: בצע את השלבים הבאים בסוף ההליך, כאשר הוא סיים-העירוי האוטומטי.- סגור ולהסיר את מעגל מעקפים.
- עצור את העירוי של נוראפינפרין phenylephrine מייד לאחר דפלציה בלון כפולה. זה אפשרי עקב חזרה של preload מספיק כדי הימני של הלב לבין סיומו של chemofiltration.
- לנרמל קרישה עם protamine (1: 1), פלזמה קפואה ו / או cryoprecipitate עם או בלי עירוי של טרומבוציטים. בדוק ACT לאחר מכן.
- לאחר ייצוב המודינמי והפסקת נוראפינפרין עירוי phenylephrine, להפסיק את תרופת תחזוקת ההרדמה.
- לאחר שהחולה חזרה אוורור ותודעה ספונטניים, extubate קנה הנשימה של החולה.
- מעבירים את החולה לבית PACU למשך 24 שעות של ניטור של תפקידים חיוניים (לחץ דם ופרמטרים קרישה).
- הסר את נדן וסקולרית פעם ספירת הטסיות> 50 x 10 9 / L, aptt <1.5 x נורמלי, ואת INR <1.5. החל דחיסה ידנית להשיג haemostasis ואת הרכב חבישה לוחצת על שני במפשעה.
- טיפול לאחר הניתוח
- צג חולים בבית PACU עבור 24 השעות הראשונות לאחר ההליך.
- בדקו באתר המוסטאסיס של קטטר insertiעל ודופק צג, לחץ דם, טמפרטורה, אוורור, מאזן נוזלים ועשרות כאב כמו גם קרישה.
- מעבירים את החולה למחלקה לאחר הניתוח במשך 1-2 ימים.
- פריקת החולה לאחר הניתוח יום 2 מתוך 3, לאחר בדיקת דם המטולוגיה וכימיה הסופי. בדוק hepatotoxicity וליצור קו התחלה מעקב על רעילות - זמן פרותרומבין (PT) בתוך 2 שניות של מהגבול העליון של הנורמה, הופעל זמן thromboplastin חלקיות (aptt) בטווח הנורמלי, טסיות> 75,000 / מ"מ 3 ללא עירוי טסיות או> 100,000 / mm 3 עם עירוי, המוגלובין> 10 גר '/ ד"ל (> 6.2 מילימול / ליטר) ו aspartate aminotransferase ו aminotransferase אלאנין (AST / ALT) חזר בתוך 10% של רמות הבסיס.
- נהל תמיכת גורם מושבה מגרה צמיחה (pegfilgastrim, 0.6 מזרק חד פעמי מיליליטר) עם שחרור או בתוך 48 שעות לאחר טיפול PHP.
תוצאות
ידע על PHP מבוסס על שלב קטן I ו- II בניסויים וסדרות מקרה ניסוי שלב גדול האחרון III; סקירה של תוצאות שפורסמו מוצגת בטבלת 1. נייר אחת דן הליך להרדמה, המודינמי והיבטים המטבולי של הטיפול. עם זאת, אין נתוני הישרדות דווחו. 22 שלושה ניסויים גדולים שדו...
Discussion
חולים עם גרורות בכבד נתיחות יכולים להיות מטופלים עם טיפול סיסטמי. עם זאת, עבור חולים עם מלנומה גרורתית הענביה, אין טיפול מערכתי סטנדרטי הוא זמין חיסוני או טיפול ממוקד טרם הצליח להראות שיפור בהישרדות. זלוף הכבד המבודד הוכח להיות טיפול יעיל עבור חולים עם גרורות מלנו...
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors have no acknowledgements.
The phase II study is financially supported by Delcath Systems.
Materials
| Name | Company | Catalog Number | Comments |
| Delcath 2nd Generation Hepatic CHEMOSAT Delivery System | Delcath Systems Inc., New York, New York, USA | 602001 and 602002 | Item no. 1 |
| Isofuse Isolation Aspiration Catheter (Double Balloon Catheter) | Delcath Systems Inc., New York, New York, USA | Item no. 1a | |
| 10F Venous Return Catheter | Delcath Systems Inc., New York, New York, USA | ||
| Hemofiltration Cartridges | Delcath Systems Inc., New York, New York, USA | Item no. 1b | |
| Circuit components | Delcath Systems Inc., New York, New York, USA | ||
| Level-1 rapid fluid management system | Smiths Medical | Item no. 2 | |
| 22 G arterial line | Arrow International Inc. / Teleflex Inc.,Dublin, Ireland | Item no. 3 | |
| Vigileo, Monitor | Edwards Lifesciences Corp, Irvine, California, USA | Item no. 4 | |
| 7.5F Triple lumen intravenous catheter, 20 cm | Vygon, Valkenswaard, Nederland | Item no. 5 | |
| 5F sheath | Item no. 6 | ||
| 2.7 Progreat microcatheter | Terumo, Tokyo, Japan | MC-PP27131 | Item no. 7 |
| 18F sheath | Item no. 8 | ||
| Auto-injector Medrad Mark V ProVis | Bayer, Indianola, Pennsylvania, USA | Not available anymore, replaced by Medrad Mark 7 Arterion Injection System | Item no. 9 |
| Melphalan | Alkeran, Aspen Pharmacare, Dublin, Ireland | Item no. 10 | |
| Heparin LEO, 5,000 IE/ml | LEO Pharma AB, Denmark | Item no. 11 | |
| Centrifugal pump | Medtronic, Minneapolis, Minnesota, VS | Item no. 12 | |
| Voluven colloid solution (6% hydroxyethyl starch 130/0.4 in 0.9% sodium chloride injection) | Item no. 13 | ||
| Iopromide 300, Ultravist | Bayer, Indianola, Pennsylvania, USA | Item no. 14 | |
| Detachable coil, Interlock | Boston Scientific, Marlborough, Massachusetts, USA | Item no. 15 | |
| Vascular plug, Amplatzer 4 | St. Jude Medical, St Paul,Minnesota, USA | Item no. 16 |
References
- Jovanovic, P., et al. Ocular melanoma: an overview of the current status. Int J Clin Exp Pathol. 6 (7), 1230-1244 (2013).
- Taylor, I., Bennett, R., Sherriff, S. The blood supply of colorectal liver metastases. Br J Cancer. 38 (6), 749-756 (1978).
- van de Velde, C. J., et al. A successful technique of in vivo isolated liver perfusion in pigs. J Surg Res. 41 (6), 593-599 (1986).
- Vahrmeijer, A. L., Der Eb, M. M. V. a. n., Van Dierendonck, J. H., Kuppen, P. J., Van De Velde, C. J. Delivery of anticancer drugs via isolated hepatic perfusion: a promising strategy in the treatment of irresectable liver metastases?. Semin Surg Oncol. 14 (3), 262-268 (1998).
- Vahrmeijer, A. L., van de Velde, C. J., Hartgrink, H. H., Tollenaar, R. A. Treatment of melanoma metastases confined to the liver and future perspectives. Dig Surg. 25 (6), 467-472 (2008).
- Ben-Shabat, I., et al. Isolated hepatic perfusion as a treatment for liver metastases of uveal melanoma. J Vis Exp. (95), e52490 (2015).
- Vahrmeijer, A. L., et al. Increased local cytostatic drug exposure by isolated hepatic perfusion: a phase I clinical and pharmacologic evaluation of treatment with high dose melphalan in patients with colorectal cancer confined to the liver. Br J Cancer. 82 (9), 1539-1546 (2000).
- Rothbarth, J., et al. Isolated hepatic perfusion with high-dose melphalan for the treatment of colorectal metastasis confined to the liver. Br J Surg. 90 (11), 1391-1397 (2003).
- van Iersel, L. B., et al. Isolated hepatic perfusion with 200 mg melphalan for advanced noncolorectal liver metastases. Ann Surg Oncol. 15 (7), 1891-1898 (2008).
- van Iersel, L. B., et al. Isolated hepatic melphalan perfusion of colorectal liver metastases: outcome and prognostic factors in 154 patients. Ann Oncol. 19 (6), 1127-1134 (2008).
- Alexander, H. R., et al. A phase I-II study of isolated hepatic perfusion using melphalan with or without tumor necrosis factor for patients with ocular melanoma metastatic to liver. Clin Cancer Res. 6 (8), 3062-3070 (2000).
- Olofsson, R., et al. Isolated hepatic perfusion for ocular melanoma metastasis: registry data suggests a survival benefit. Ann Surg Oncol. 21 (2), 466-472 (2014).
- Curley, S. A., et al. Increased doxorubicin levels in hepatic tumors with reduced systemic drug exposure achieved with complete hepatic venous isolation and extracorporeal chemofiltration. Cancer Chemother Pharmacol. 33 (3), 251-257 (1993).
- Ravikumar, T. S., et al. Percutaneous hepatic vein isolation and high-dose hepatic arterial infusion chemotherapy for unresectable liver tumors. J Clin Oncol. 12 (12), 2723-2736 (1994).
- Lillemoe, H. A., Alexander, H. R. Current Status of Percutaneous Hepatic Perfusion as Regional Treatment for Patients with Unresectable Hepatic Metastases: A Review. Am Oncology and Hematology Rev. (15-23), (2014).
- Pingpank, J. F., et al. Phase I study of hepatic arterial melphalan infusion and hepatic venous hemofiltration using percutaneously placed catheters in patients with unresectable hepatic malignancies. J Clin Oncol. 23 (15), 3465-3474 (2005).
- Fitzpatrick, M., et al. Use of partial venovenous cardiopulmonary bypass in percutaneous hepatic perfusion for patients with diffuse, isolated liver metastases: a case series. J Cardiothorac Vasc Anesth. 28 (3), 647-651 (2014).
- Forster, M. R., et al. Chemosaturation with percutaneous hepatic perfusion for unresectable metastatic melanoma or sarcoma to the liver: a single institution experience. J Surg Oncol. 109 (5), 434-439 (2014).
- Deneve, J. L., et al. Chemosaturation with percutaneous hepatic perfusion for unresectable isolated hepatic metastases from sarcoma. Cardiovasc Intervent Radiol. 35 (6), 1480-1487 (2012).
- Kandarpa, K., Machan, L. . Handbook of Interventional Radiologic Procedures. , 269-270 (2011).
- Hofmann, H., et al. Unresectable isolated hepatic metastases from solid pseudopapillary neoplasm of the pancreas: a case report of chemosaturation with high-dose melphalan. Pancreatology. 14 (6), 546-549 (2014).
- Miao, N., et al. Percutaneous hepatic perfusion in patients with metastatic liver cancer: anesthetic, hemodynamic, and metabolic considerations. Ann Surg Oncol. 15 (3), 815-823 (2008).
- Vogl, T. J., et al. Chemosaturation with percutaneous hepatic perfusions of melphalan for hepatic metastases: experience from two European centers. Rofo. 186 (10), 937-944 (2014).
- Pingpank, J. F., et al. A phase III random assignment trial comparing percutaneous hepatic perfusion with melphalan (PHP-mel) to standard of care for patients with hepatic metastases from metastatic ocular or cutaneous melanoma. J Clin Oncol. 28, 18s (2010).
- Rothbarth, J., Vahrmeijer, A. L., Mulder, G. J. Modulation of cytostatic efficacy of melphalan by glutathione: mechanisms and efficacy. Chem Biol Interact. 140 (2), 93-107 (2002).
- Bartlett, D. L., Libutti, S. K., Figg, W. D., Fraker, D. L., Alexander, H. R. Isolated hepatic perfusion for unresectable hepatic metastases from colorectal cancer. Surgery. 129 (2), 176-187 (2001).
- van Iersel, L. B., et al. Isolated hepatic perfusion with oxaliplatin combined with 100 mg melphalan in patients with metastases confined to the liver: A phase I study. Eur J Surg Oncol. , (2014).
- Rothbarth, J., Tollenaar, R. A., van de Velde, C. J. Recent trends and future perspectives in isolated hepatic perfusion in the treatment of liver tumors. Expert Rev Anticancer Ther. 6 (4), 553-565 (2006).
- van Etten, B., de Wilt, J. H., Brunstein, F., Eggermont, A. M., Verhoef, C. Isolated hypoxic hepatic perfusion with melphalan in patients with irresectable ocular melanoma metastases. Eur J Surg Oncol. 35 (5), 539-545 (2009).
- van Iersel, L. B., et al. Management of isolated nonresectable liver metastases in colorectal cancer patients: a case-control study of isolated hepatic perfusion with melphalan versus systemic chemotherapy. Ann Oncol. 21 (8), 1662-1667 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved