Method Article
תפוקה גבוהה בידוד Assisted רובוטית של מוטאנטים קטלניים רגישים-טמפרטורה
In This Article
Summary
Temperature-sensitive (ts) lethal mutants are valuable tools to identify and analyze essential functions. Here we describe methods to generate and classify ts lethal mutants in high throughput.
Abstract
Systematic identification and characterization of genetic perturbations have proven useful to decipher gene function and cellular pathways. However, the conventional approaches of permanent gene deletion cannot be applied to essential genes. We have pioneered a unique collection of ~70 temperature-sensitive (ts) lethal mutants for studying cell cycle regulation in the unicellular green algae Chlamydomonas reinhardtii1. These mutations identify essential genes, and the ts alleles can be conditionally inactivated by temperature shift, providing valuable tools to identify and analyze essential functions. Mutant collections are much more valuable if they are close to comprehensive, since scattershot collections can miss important components. However, this requires the efficient collection of a large number of mutants, especially in a wide-target screen. Here, we describe a robotics-based pipeline for generating ts lethal mutants and analyzing their phenotype in Chlamydomonas. This technique can be applied to any microorganism that grows on agar. We have collected over 3000 ts mutants, probably including mutations in most or all cell-essential pathways, including about 200 new candidate cell cycle mutations. Subsequent molecular and cellular characterization of these mutants should provide new insights in plant cell biology; a comprehensive mutant collection is an essential prerequisite to ensure coverage of a broad range of biological pathways. These methods are integrated with downstream genetics and bioinformatics procedures for efficient mapping and identification of the causative mutations that are beyond the scope of this manuscript.
Introduction
אפיון פנוטיפי של אוספי מוטציה שיטתיים של אורגניזמים מודל הוא גישה מוכחת לנתח מורכבות הסלולר. Reinhardtii Chlamydomonas אצות הירוק unicellular הפלואידים יש קבוצת גן דמוי צמח, אבל זה התפצל מצמחי קרקע לפני כפילויות הגנום מרובות במפעל קרקע השושלת 2. באופן עקרוני, חוסר שכפול גנטי וכן מחזור החיים הפלואידים בעיקר מקלה מאוד הפסד של פונקציה גישות גנטיות. עם זאת, הפרעה במיקוד של גנים של עניין היא כמעט בלתי אפשרית בשל חוסר האינטגרציה גנומי הומולוגית יעילה. ספריית שיבוש insertional אקראית נמצאת בבנייה, בשילוב עם זיהוי המקום שבש, עד כה מניב סט ערוך של 1,935 שיבושים ממופים המייצגים 1,562 גנים 3. עם זאת, גישה זו (צפויה בכלל לייצר מוטציות null) אינה חל על גנים חיוניים. טמפרטורה רגישה (TS) מוטציות ניתן recovereד בגנים חיוניים, ושיטות האחרונות לאפשר זיהוי יעיל של הגן הנבדק ואת הנגע סיבתי. ניתוח פנוטיפי בטמפרטורה גבוהה ולאחר מכן מספק מידע מיידי על הפונקציה של הגן הנבדק. דיווחנו על בידוד ואפיון של מוטציות קטלניות ts ב ~ 70 גנים חיוניים Chlamydomonas, המתמקדת בעיקר על גנים המעורבים התקדמות מחזור התא ולשלוט 1,4.
מסכי קטלני Ts להיות עמוד התווך של ניתוח גנטי מיקרואורגניזמים במשך עשרות שנים 5,6. באופן עקרוני, תכונה רצויה היא להתקרב "רוויה", כלומר כל הגנים המסוגלים מוטציה כדי TS קטלנית מזוהים לפחות מוטציה אחת, המאפשרים ניתוח מלא. עם זאת, בפועל, מספר גורמים להגביל את הגישה לרוויה. ראשית, בעוד שכמעט כל הגנים יכולים להיות מוטציה לאובדן פעילות בטמפרטורה גבוהה, את היעילות של התאוששות של מוטציות כאלה משתנית לאורך לפחותסדר גודל 7,8. לכן, מסך אקראי מתחיל להרים להיטים חוזרים ונשנים "מתניידים" הרבה לפני שמתקרבת רוויה. שנית, בעוד מוטציות TS בדרך כלל לגרום לירידה בתפקוד, יכולים להיות שהם לא nulls נכון בטמפרטורה מגבילה (ולהפך, הם לעתים קרובות לא מתפקדים במלואה בטמפרטורה מתירני). בעיה זו ניתן לטפל במידה מסוימת על ידי השוואת אללים מרובים; אם הם כולם חולקים פנוטיפ משותף, זה יותר עשוי לשקף את התוצאה של איון פשוט של הגן. אללים מרובים הם גם מאוד מועילים עבור זיהוי מולקולרי סופי של נגע סיבתי 1. עם זאת, הבעיה "הנוסע המתמיד" כלומר אללים מרובים בגנים פגעו רק לעתים נדירות יכולים להיות קשים להתאושש.
מסיבות אלה, שפתחנו צינור משופר לבודד phenotypically לאפיין מוטנטים ts. אספנו יותר מ -3,000 ts מוטציות עד כה, אניncluding כ -200 מוטציות מחזור חדשות תא המועמד. ניתוח מולקולרי פנוטיפי של האוסף הזה, שכבר כולל מוטציות סבירות ביותר או כל מסלולי התא חיוני, אמור לספק תובנה השערות חדשות בביולוגיה של תא צמח. חשוב לציין, צינור זה יכול להיות מיושם על כל מיקרואורגניזם שגדל על אגרת לבנות קולקציות ts מוטציה ביעילות.
הערה על ציוד: שני רובוטים חשובים מאוד עבור יעילות בהליך זה (בורר מושבה בורר שילוב העתק plater / דובדבן). קוטפים בדרך כלל יש סיכות מתכת. מושבות הרים מוחזקות אוויר בפינים אלה במשך תקופה מסוימת (שניות עד דקות, בהתאם לדגם). Chlamydomonas מת כ -20 שניות על סיכת מתכת באוויר. זה מגביל בחירת מודל עבור האורגניזם. בענייני דיוק. בורר המושבה שלנו הוא די מדויק; עם זאת, זה קצת אלים בפעולה שלו ויש לו כמה אפשרות צולבות זיהום מבוסס הספרים. הוא לא נעשה שימוש גבוהאה מצפיפות 384 (4.5 מ"מ ריווח מרכז-מרכז); בצפיפות זה, את הדיוק מקובל לחלוטין. ציפוי ההעתק / דובדבן הרובוט לקטוף (המצורף שונה המשמשים ליישומים אלה) הוא הרבה יותר איטי ב במסיק, אבל הוא מדויק מספיק עבור צפיפות 1,536 (6,144 הוא אתגר, אפילו עבור רובוט מדויק מאוד זה; הערכנו צפיפות זה, אך בחר שלא להשתמש בו בגלל הקשיים השונים). הרובוט לא יעבוד גם אם צלחות נטענות באופן לא אחיד, וכו. חשוב ספוט לבדוק כדי להיות בטוח את הדברים הנכונים קורים; כמובן, הרובוט יפעל ללא השגחה בכלל, כל ילך טוב אם כמה הצלחות הראשונות צדקו.
Protocol
1. mutagenesis UV
- כן יצווה של 100 - 200 צלחות אגרו מלבני עם טריס-תצטט-פוספט (TAP) 9,10 בינונית. כן צלחות אלה כמה ימים קדימה ולשמור אותם על הספסל להתייבש כדי להבטיח קליטה מהירה של התאים המושעים בשלבים הבאים.
- Chlamydomonas תרבות תאים עד 0.2 - 0.5 צפיפות אופטית (OD 750; ~ 2 ימים) ב 100 מ"ל של TAP נוזל תחת אור, של 25 מעלות צלזיוס ו רועד ב 100 סל"ד.
הערה: mutagenesis UV מתבצע באופן עצמאי בשני רקע גנטי: Mat- hygro r (מקנה עמידות hygromycin B) ו Mat + Paro r (מקנה עמידות Paromomycin). בחירה אנטיביוטיה היא שרירותית, בתנאים שיש שני סוגי הזדווגות התנגדויות תרופה משלימות. - בדוק מדגם של כל התרבויות תחת מיקרוסקופ על מנת להבטיח כי התאים הם קיימא, בריאה (שחייה ללא פגע), וללא זיהום.
הערה: תרבויות מגודל "התרסקות" ולאבד את יכולת הקיום, כפי שהן מופיעות "רוחות רפאים" במיקרוסקופ בניגוד שלב. אין להשאיר תרבויות שייקר הולך פעם שהם מגיעים לרוויה. תופעת "רפאים" ניתן לזהות בקלות בשלב 1.3. - לדלל את תרבות 0.003 OD 750. לעטוף את הבקבוק בנייר אלומיניום כדי להבטיח צפיפות הומוגנית, כמו המתח הוא ניע ושוחה כיוונית בתגובה לאור.
- התאם את הצפיפות של ההשעיה המבוססת על מנת UV המתוכננת, כך והיוו הרג תא, 200 - 600 מושבות ניצול תהווינה על הצלחות (איור 1). ראה טבלה מס '1 עבור מידע על זמני חשיפה UV.
- צרף קלטת קטן-צינור שמתאים מנפק נוזל ולבצע סדרה של שוטף עבור עיקור, על פי הוראות היצרן, על מנת למנוע זיהום.
- שימוש מנפק נוזל 8 x 12, לוותר 4 x 96 טיפות של 2 μl כל לצלחות מלבניות (איור 1 ). הקש במתינות על שולי הצלחת להבטיח את התמזגות של כל טיפות לתוך שכבה דקה של נוזל ומיד לכיסוי הלוחות כדי למנוע חשיפה לאור.
- כדי להבטיח אפילו מאוד פיזור תא בודד, להשתמש בצלחות יבש, כאמור לעיל, ומהר לכיסוי הלוחות כדי למנוע את התאים משחייה בתגובה לאור. שמור על רמת צלחות המכוסות בחושך עד שכל הנוזל נספג.
- מניחים את הצלחות תחת מנורת UV קוטל חידקים (30 ואט צינור UV קוטל חידקים) לפרקי זמן לקבוע באופן אמפירי לתת תשואה אופטימלית של מוטציות ts- בקרב הניצולים. הנה, השתמש פעמים של 0.5 - 1.5 דקות במרחק של 40 - 50 ס"מ כדי לגרום 90 - 99.9% הריגה. ניצולים מכילים 100 - 1,000 מוטציות נקודתיות נגרמות UV, מתוכם כ -10% רצפי קידוד שינוי.
- על מנת להבטיח עצמה המקסימלית של קרינת UV ללא חזרה בשל DNA אור תלוי לתקן 11,12, לעבוד בחושך בשלב זה ומייד לארוז אתצלחות בקופסה כהה לאחר ההקרנה.
- שמור על צלחות בחושך עבור 8 - 24 שעות בטמפרטורת החדר.
- מניחים את הצלחות באינקובטור ג '21 ° עם תאורה ליצור מושבות. היווצרות מושבה לוקחת ~ 10 ימים. הקפד לעטוף את הצלחות עם שקיות ניילון ולהוסיף נייר סופג בתוך למחוק את עיבוי נוזל. אידוי מחזורי התעבות אחר יכולים לספק נתיבי סרט נוזלים מזהם להיכנס הצלחות.
- טען את צלחות הערימות הרלוונטיות כמקורות לקטיף מושבה רובוטית (איור 2). פיק מושבות עבור 384 מערכים על צלחות מלבניות, ולגדל אותם ב 21 מעלות צלזיוס עם תאורה (~ 1 בשבוע).
- לתמצת את 384 מערכים לתוך 1,536-מערכים (4: 1) באמצעות רובוט ציפוי-העתק (איור 3), ולאפשר צלחות לגדול במשך ~ 3 ימים בחממה ג '21 °.
- לשכפל את 1,536-מערכים לשתי צלחות כל ומקום אחד בחממה 21 ° C (מתירניטמפרטורה) והשני בתוך 33 ° C חממה (טמפרטורה כובלת). בעקבות 24 שעות, לשכפל הצלחות ב -33 ° C עד סט חדש של צלחות מראש התחמם, ומניחים אותם בחממה C 33 °.
הערה: סיבת ציפוי משני זו היא כי TS מוטציות קטלניות יכולות במקרים מסוימים לצבור ביומסה משמעותי, גם אם התאים נעצרים במחזור התא הראשון לאחר הציפוי. העתק משני מבטל איתותים ואת המגדיל מאוד רגיש. - צלם את הצלחות עם מצלמה דיגיטלית הבאה 3 ימים של צמיחה ב 33 מעלות צלזיוס, 5 ימים של צמיחה ב 21 ° C. החזק את הצלחות בתוך מסגרת קבועה. השתמש אינדיקטורים יישור "רשת-צלחת" מסומנת עם תשעה אשר צולמו יחד עם צלחות התרבות (איור 4). צילום צלחות תרבות כמו לסירוגין לזווג 21 ° C ו- 33 ° C (21/33) תמונות.
הערה: פעמי דגירה שונות משמשות כדי להשוות צמיחה מאז סוג הבר גדל באופן משמעותימהר על 33 ° C מאשר ב 21 מעלות צלזיוס.
זיהוי 2. מועמדים Mutant ts: מסך ראשון
- לעבד את תמונות צלחת 21/33 זיווג עם תוכנת ניתוח תמונה מותאמת אישית Matlab לחסל את הרקע ואת לפלח את התמונות לתוך מערך 1,536. התכנית תקבע את ביומסה זוהתה (עוצמת פיקסל הכל) בכל עמדה (איור 5).
הערה: התוכנה (מסופקת SI יחד עם הוראות) תשתמש התמונה לרשת צלחת כדי לקבוע את מיקומם של תאים (רשומות בודד) בתוך מערך 1,536 על יישור הגדלת צלחת בשימוש ולחשב עוצמת פיקסל הכל בכל תא . ערכים אלה עבור כל מוטציה אז מושווים נגד פרמטרים מתכווננים לקבוע צמיחה הנדרשת ב 21 מעלות ביחס C אל ts + סטנדרטי מידת רגישות טמפרטורה, מוגדר כך: S (Mut 33) / S (33 WT) / S (Mut 21) / S (WT 21), כאשר ס 'היא אות (פיקסלדריכות לאחר חיסור רקע), Mut היא מוטצית פרט, "WT" הוא מושבה שנבחרה באקראים שאינם רגישה לטמפרטורה (זן mutagenized שיש ts + פנוטיפ). צמיחה ב 21 ° C מוגדר S (Mut 21) / S (WT 21). במסך הראשון, להחיל קריטריוני הבחירה רגוע (המאפשר צמיחה נמוכה יחסית, ועומדת על 21 מעלות צלזיוס ותואר נמוך יחסית של רגישות לטמפרטורה) כדי לשמור על שיעור נמוך שלילי כוזב. - טען את רשימת המושבות שנבחרו שנוצרו על ידי התוכנה כקובץ הוראה עבור-המושבה אחת לקטוף רובוטיקה (בדרך כלל למערך 384). הכן את צלחות המקור ושפת היעד בהתאם להוראות רובוטיקה לבחור מושבות למערך (איור 6).
הערה: מוסקים קונבנציונליים מחייבות קובץ הוראות בפורמט מסוים, כגון CSV, TXT, או xls. כל המוסקים יהיו את היכולת להיות מונחת קובץ; בפורמטים שונים ידרשו עריכה קלה של קוד MATLAB (קוד מקור סופק). - מניח את צלחות היעד בחממת C 21 מעלות במשך ~ 5 ימים לגדול צלחת מניות.
3. זיהוי מוטאנטים ts: מסך שני
- חזור על שלב 2.1 לבדיקה חוזרת מושבות תלושות. בדרך כלל 30 - 50% של מושבות יהיו בדוקים שוב כמו lethals ts הברור, תשואה של 2% - 5% ts lethals ביחס מושבות ראשוניות לשרוד mutagenesis UV.
- חזור על שלב 2.2 עבור לקטוף את lethals ts פעמים הוקרן, אך עם קובץ הוראות שונה שנועד מושבות מערך לגושים של 100 מושבות על צלחות מלבניות בכל בצפיפות 384. זהו לבדיקה מיקרוסקופית נוחה בשלב הבא. פורמט קובץ הוראות מצוין בזמן ריצה על ידי קוד MATLAB.
- הקפד לכלול מספר מושבות WT כביקורת ומניחי הצלחות ב 21 מעלות צלזיוס במשך ~ 5 ימים.
4. קביעת הפנוטיפ ראשונית
- לשכפל הצלחות 100-בלוק ערוכים בשלב 3.2 ולמקם אותם incu ג '21 °בטור עבור ~ 2 ימים כדי להשיג מושבות גדל טרי.
- לשכפל את העותק החדש של צלחות 100-הגוש (4.1) כדי שלושה עותקים. מניח עותק אחד בחממת ג '21 ° ואחד בחממת C 33 ° כקבוצת ביקורת.
- מניח את העותק השלישי ( 'סינון צלחות ") או בהתקנה רובוטית, ספוט המושבות עם סיכות ארוכות נגעו במים מעוקרים.
הערה: תאי Chlamydomonas המוצמדים אגר נוטים רובוט לנחות תחילה ככתם די צפוף של תאים, עם כמה תאים בודדים לעיון מיקרוסקופי. כדי לייעל את המושבות לבדיקה מיקרוסקופית, במקום תאים הועברו בתחילה עם טיפת המים (נפח המים המועברים על ידי סיכות רובוטית הארוכות הוא ~ 100 NL). התוצאה היא פיזור של התאים ברדיוס קטן (~ 1 מ"מ) על מרכז המצמיד הראשוני, עם תאים בודדים רבים מבודדים. - קח photomicrographs של אזור של כל נקודה ונקודה של צלחות הקרנה בזמן 0 (ועדיין יחיד, תא מחולק) (איור 7) ולמקם צלחות ב 33 מעלות צלזיוס במשך הדגירה. לקבוע מיקום תמונה על ידי השליטה בשלב הידנית של מיקרוסקופ לנתיחת הטטרדה שונה להגדיר לתת ועוצר את מרווח מרכז אל מרכז 4.5 מ"מ של מערך 384-צפיפות.
- הסר את הצלחות ההקרנה מן החממה C 33 ° ולקחת photomicrographs, כמו בשלב 4.4, בנקודות שונות בזמן (10 שעות, 20 שעות, 48 שעות). ודא הבמה, בעל הצלחת, ואת הבקר בשלב מכויל בדיוק כדי לקבל תמונות של אותם תאים בכל נקודת זמן. בצע רכישת photomicrograph מהירה (~ 10 דקות).
- השתמש העותק השני בחממה C 33 ° לאמת את הפנוטיפ ts וכדי לוודא כי תנודות הטמפרטורה במהלך רכישת התמונה אין השפעה גדולה על ts הפנוטיפ.
- ניתוח תמונות מיקרוסקופיות ולבחור עבור מוטציות בהתבסס על הקריטריונים הרצויים (איור 8). ספוט את הערכה שנבחרת הסופית בצלחת אגרה-ערוכה 96. ודא כי כלצלחת מכילה מוטציות מאותו סוג ההזדווגות העמידה לתרופות.
- עבור כל צלחת, לשלב את שתי העמודות האחרונות (מוטצית שאילתא) חיובית ושלילית (WT) שליטה עבור assay השלמה.
5. השלמה והצמדה בדיקה של ניו מוטאנטים כדי "מתניידים"
- העבר כמויות גדולות של מושבות הערוכות עד בינוני הגמטות אינדוקצית חנקן ללא 10 ב 96 גם microplates (צפיפות של כל מושבה צריכה להיות סביב 0.2 OD). דגירת הצלחות תחת אור (13 - 20 ואט נורה כספי) עבור ~ 5 שעות כדי לאפשר gametogenesis.
הערה: שלב זה יכול להתנהל גם עם התקנה רובוטית משכפלת או ידני באמצעות מכשיר ציפוי פשוט. - להשעות שאילתות עם סוגי ההזדווגות מול מחסה קלטות התנגדות האלטרנטיבה לתוך צינורות עם מדיום חנקן ללא הגמטות אינדוקצית 10 עבור gametogenesis.
- מערבבים את דגימות צלחת היעד זיווג mixtנפח יור של 20 μl (איור 9). בעקבות ~ 10 דקות מתחת לפנס, במקום 5 μl מכל טוב פעמיים: פעם אחת על צלחת TAP לבדיקה הצמדה ופעם מהחבית + 5 מיקרומטר Paro + 9 מיקרומטר hygro לבדיקה השלמה.
- דגירת צלחות ההצמדה בחממת ג '21 ° הלילה, ולאחר מכן לעטוף אותם בנייר כסף. שמור אותם בחושך במשך 5 ימים כדי לאפשר היווצרות zygospore.
- דגירת צלחות השלמות בדיקות עבור ~ 10 ימים לאור ב 21 מעלות צלזיוס.
הערה: סכומי התרופה מכוילים לאפשר הישרדות של diploids הטרוזיגוטיים כפליים, אבל הם עדיין מספיק כדי לחסל את haploids ההזדווגות. סכומים אלו כוילו עבור ואינטגרציות קלטת התנגדות סטנדרטיות המשמשות בפרויקט הספציפי הזה; עם אינטגרציה אישית חדשה, יש recalibrated מינונים. רוב ביומסה מאומתת להיות diploids ידי cytometry זרימה (איור 9), אם כי ברמה משתנה של haploids (כנראה המיוזה וצמיחה של עמיד כפלייםsegregants) בדרך כלל הוא ציין גם כן. - לשכפל הצלחות-בדיקות השלמות לשני עותקים לזיהוי פנוטיפ ts-. מניחים עותק אחד בכל 21 ° C והעתק אחד ב 33 מעלות צלזיוס במשך ~ 5 ימים.
- מושבות מבחן עבור הפנוטיפ ts-, כמפורט בסעיף 2.1 (איור 5). המושבות שאינם משלימים עם השאילתה צפויות לייצג אללים של אותו גן כמו השאילתה (diploids הטרו-אללים עבור מוטציות באותו גן).
- לבדיקה הצמדה, לאחר שלב 5.4, להעביר את הצלחות בחזרה אור לאפשר המיוזה ו תולדה של segregants הפלואידים עבור ~ 7 ימים.
- לשכפל צלחות בדיקות הצמדת TAP + 10 מיקרומטר Paro ו -10 מיקרומטר hygro לבחור עבור progenies הכפול עמיד (צפוי להיות 25% של הצאצאים הפלואידים, מאז הקלטות אינן צמודות) ו לדגור על 21 מעלות צלזיוס למשך שבוע.
הערה: להגדיל את מינון התרופה עבור haploids כפליים עמיד. - מושבות מבחן עבור הפנוטיפ ts-, כפי שאניn לשלב 2.1.
הערה: פנוטיפ ts- צפוי (וצופה) עבור מוטציות בקבוצה השלמה הזהה השאילתה. בנוסף, פנוטיפ ts- ב assay ההצמדה עבור מוטציה המשלימה את השאילתה, יכול לשקף הצמדה הדוקה בין השאילתה ואת המוטציה החדשה. מוטאנטים המשלימים שאילתות הנבדקות הם גנים חדשים סבירים אשר יכנסו הצינור לזיהוי bioinformatic של הנגע סיבתי, ובסופו של דבר לניתוח פנוטיפי נוסף.
תוצאות
אנו מציגים צינור מואץ לבידוד מוטציות ts ב Chlamydomonas. תאים הם ויתרו על צלחות אגרו, וזמן קצר לאחר אימות מהירה תחת מיקרוסקופ עבור צפיפות תא בודד, צלחות הם UV מוקרן (איור 1). מושבות מוקרנות אופייניות מזוהות והרים לתבנית ערוכה לאחר 10 ימים של צמיחה בטמפרטורה מתירנית (איור 2). הצלחות כתוצאה במתכונת 384 ימוזגו על 1,536-מערך (איור 3). בצעדיו הראשונים האלה של איסוף מושבות מוקרנות, יש לנו ערוכים ~ 200,000 מושבות עד כה. הצפיפות של ההשעיה מותאמת מבוסס על מנת UV מתוכנן כך, והיווה מוות, 200 - 600 מושבות ניצול תהווינה על הצלחות. שלוש פעמים חשיפה UV (1.5 דק ', 1 דק', ו -0.5 דקות) שלוש צפיפויות נבדקו בהתאם (טבלה 1). באופן אמפירי, את זמן החשיפה 1.5 דקות הניבו רוב tsמוטציות (~ 50%) -; עם זאת, ללא ספק, 1 דק 'הניב רוב מועמדי מחזור התא. לכן, סיבובי mutagenesis UV בעתיד נעשו עם 1 דקות בלבד. נושא חשוב הוא מתיז במהלך קטיף ראשוני ואת הזיהום הצולב (במיוחד פורמטים בצפיפות גבוהה). הדבר עלול לגרום שכפול phenotyping נוספת של אותה מוטציה פעמיים. כדי למזער את ההסתברות לתרחיש כזה, לטפל לאסוף מושבות בגודל האופטימלי, ולוודא כי מושבות סמוכות אינן נקלטות ב assay הראשוני.
לאחר מכן, שני מבחני פנוטיפ ts- רציפים (איור 5) בוצעו, ועל כ -3,000 ts- מוטציות בודדו ואופיינו phenotypically ידי מיקרוסקופיה זמן לשגות (איור 8). בשל ההתמקדות הביולוגית בלימוד מחזור התא של עניין פנוטיפים שעומדים בקריטריונים מסוימים, אנחנו לא מעוניינים באיסוף יותר משני אללים בכל יעד genדואר. לכן, בצענו השלמה ובדיקת הצמדה עם גנים מאופיינים כבר עם יותר משני אללים (שאילתא) נגד מועמדים שנאספו לאחרונה להסיר גנים חוזרים מאוד מהצנרת במורד הזרם (איור 9).

איור 1: אחיד פריסת תאים Unmutagenized ו- UV mutagenesis. (א) 384 x 2 טיפות μl הם ויתרו על צלחת אגר באמצעות מתקן מגיב. (ב) צלחות אקראיות נבדקות תחת מיקרוסקופ כדי לוודא צפיפות תא בודד והם UV מוקרן עם חשיפה 1-דקה. בר סולם = 50 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

מושבות איור 2.-mutagenized UV שנבחרו עבור 384 המערכים. (א) תאים בודדים מוקרן UV גדלים במשך ~ 10 ימים לתוך מושבות גלויות. סרגל קנה מידה = 2 ס"מ. (ב) תכנית ניתוח תמונה מזהה מושבות להפרדה על פי פרמטרים מסוימים ומערכים אותם רובוטים לתוך 384 צלחות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. איחוד אל-מערך 1,536. ארבע צלחות 384 בפורמט מתמזגות אחד 1,536-צלחת; פעם גדל, הם משוכפלים שוב כדי לבדוק את הפנוטיפ ts-. אנא לחץ כאן כדי להציגגרסה גדולה יותר של דמות זו.
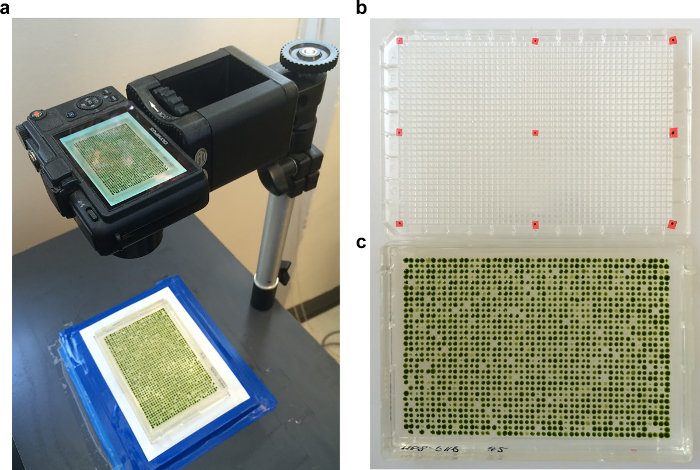
איור 4. הדמיה עבור כימות. צלחות (א) מתקיימות בתוך מסגרת תחת דוכן צילום מסמכים, כך שכל הצלחות בסדרה מצולמות בהגדלה ומיצוב זהים. (ב) התמונה הראשונה היא של צלחת microtiter 1536-היטב עם נקודות אדומות להציב בפינות אמצע. זה "רשת-צלחת" תמונה מגדירה את המיקום של המערך. (ג) דוגמה של 1,536-מערך אחרי הדגירה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

זיהוי איור 5. הפנוטיפ ts- ידי חציניתוח תמונה -automated. תמונות פלייט מנותחות על ידי תוכנה מותאמת אישית MATLAB (מסופקת SI). התמונה מפולחת באופן אוטומטי למערכי תא (96, 384, או 1,536), ואת האות בכל תא היא לכימות. צמיחה ב 21 ° C מסומן בכחול, וצמיחה על 33 ° C מסומן בצהוב. מושבות מפגינות צמיחה גבוהה באופן משמעותי ב -21 מעלות צלזיוס לעומת 33 ° C (טופלה כדי ts +) נבחרו ויסומן ריבועים שחורים עם נקודה ירוקה. אפשרויות אלה ניתן לערוך באופן ידני. בחירות סופיות מועברות קבצים בשימוש על ידי רובוט קטיף המושבה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

קטיף איור 6. רובוטית של המועמדים הקטלנים TS-הסיבוב הראשון. הדובדבן-picking רובוט מציית להוראות מקובץ שנוצר כמתואר בשלב 2.1 לאסוף מועמדים מערך חדש. הפנל העליון מראה את הטעינה של סיכה מעוקרת. הפנל התחתון מראה לקטיף המדויק ממושבה מסוימת בצלחת המקור. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

הקרנת זמן לשגות איור 7. למיון ראשוני של פנוטיפים קטלני ts. משובטים שעברו שני סבבים של פרוטוקול ההקרנה באיור 5 משוכפלי צלחות בצפיפות תא כזה תאים בודדים ניתן לפתור מיקרוסקופי. מיקרוסקופ לנתיחה הטטרדה שונה משמש לזיהוי תפקידים אשר photomicrographs נלקחים לאחר 0 hr, 10 שעות, ו -20 incubations hr t 33 ° C. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
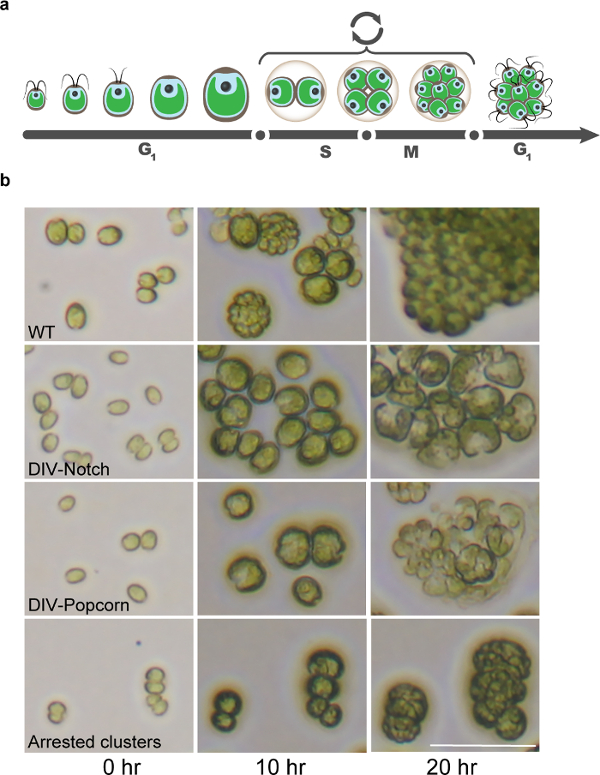
איור 8: מוטציות מחזור התא Chlamydomonas שזוהו על ידי זמן לשגות מיקרוסקופ. (א) האיור של מחזור התא הייחודי Chlamydomonas מתאר את שלב G1 הארוך מאופיין בצמיחה הסלולר, ואחריו מחזורי SM ביקוע, אשר בסופו של דבר עם הבקיעה של לתאי בת שזה עתה נולד. (ב) תמונות מיקרוסקופיות להפגין תאי WT במהלך מחזור התא ואת זיהוי של מוטציות מחזור התא טיפוסיות שאינו מצליחות להשלים מיטוזה. בר סולם = 50 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 9: השלמה והצמדה מבחן. (א) עמיד לאנטיביוטיקה (למשל, hygro) שאילתא עם מוטציה גנטית חוזר נחצתה בצלחת 96-היטב עם סט של מוטציות של סוג ההזדווגות מול מטפחי קלטת עמידות לאנטיביוטיקה שנייה (למשל, Paro). צלחות שלמות להניב שיעור גבוה של diploids כפי שמוצג על ידי מכתים חומצות גרעין וניתוח cytometry זרימה (פנל שמאלי תחתון א). (ב) תערובת ההזדווגות נבחנת הן שלם ב diploids ועבור הצמדת צאצאי meiotic כפולים עמידים. הביקורת החיובית היא השאילתה עצמה בסוג הזדווגות ההפוך, כצפוי, מראה את הפנוטיפ ts- על 33 ° C, ואילו הביקורת השלילית היא WT ומראה את הפנוטיפ TS +. המושבות הקיפו מראים שלמים עם השאילתה ולכן nאללים ts- EW עבור גן השאילתה. אלו אינם נכללים בדרך כלל אפיון נוסף, שכן רק "מתניידים" נמצא בערכת הבדיקה השלמה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| זְמַן | OD | מושבות הרים (#) | פנוטיפ Ts- | מועמדי מחזור התא |
| 1.5 " | 0.012 | 6000 (ממוצע = ~ 200) | 200 (3.3%) | 7 (3.5%) |
| 1 ' | 0.003 | 11,000 | 131 (1.19%) | 15 (11.4%) |
| (ממוצע = ~ 360) | ||||
| 0.5 ' | 6E-04 | 9000 | 40 (0.45%) | 1 (2.5%) |
| (ממוצע = ~ 300) |
טבלה 1: כיול טיימס הקרנה כדי למקסם את התשואה של מועמדים Mutant מחזור התא. שלוש פעמי הקרנה נבדקו (30 צלחות כל אחת) עם מקביל מכנסי הש"כ כדי להבטיח מספרי מושבה לשרוד (200 - 600).
Discussion
הצינור המתואר כאן לבידוד תשואה גבוהה של מוטציות קטלניות ts מבטיח כי ככל הנראה כל המסלולים הסלולר חיוניים של הגנום Chlamydomonas מיוצגים. שני השלבים הקריטיים ביותר עבור גבייה יעילה של גני מחזור התא פוטנציאליים לשם מניעת חוזרות "נוסע המתמיד" אללים הם: 1) ההגדרה קוהרנטית של מאפייני פנוטיפ מעצר מחזורי תא שלמים 2) assay השלמה במקביל נגד שכבר זיהה שאילתא גנים כדי להגדיל את האוסף עם אלה שזה עתה מבודד.
כאשר מסונכרן על ידי מחזורי אור כהה, Chlamydomonas גדל photosynthetically בשעות היום ועלייה גודל התא> 10x ללא כל חלוקה DNA שכפול או תא 13. כ חופף עם תחילת הלילה, תאים ואז עוברים מחזורים רבים של לסירוגין שכפול הדנ"א, מיטוזה, ואת חלוקת תא (איור 8). שכם תקין זהדואר מספק הבחנה טבעית בין הגנים הדרושים בעיקר עבור צמיחת תאי יושרת גנים הדרושים במיוחד עבור מחזור חלוקת תא. מצאנו כי 10-hr ונקודות הזמן של 20 שעות הם מאוד אינפורמטיבי עבור פנוטיפי מחוספס ראשוני לחתוך 1. השיעורים הרחבים של מוטציות קטלניות ts שנכיר כיום, בהתבסס על התמונות האלה (ראו SI ב Tulin וקרוס, 2014) 1, הם: Notch, פופקורן, עגול, קטן, בינוני, תמוגה מוקדם, מחזור מרובה (איור 8 ).
שלוש הקטגוריות הרלוונטיות ביותר אנו מתמקדים הם Notch, פופקורן, ועגול. פנוטיפים "Notch" ו- "פופקורן" הוצגו בעבר להיות מאפיין של התא ביותר במחזור ספציפי הנגעים (למשל, קינאז cyclin התלוי mitotic, מכונות שכפול הדנ"א, topoisomerase II) 1. הופעתו של אחד (Notch) או מרובה (פופקורן) מטוסים לכאורה של חלוקת תא מתחלה אבל לא מוצלחת היא morphol נוחמחוון ogical חניכת מחזור התא. מוטציות אלה מפגינים בדרך כלל מעט או ללא פגמי צמיחה, עם גידול בנפח תא דומה WT ב סימן 10 שעות. פנוטיפים Notch ופופקורן ניכרים ב -10 שעות ו מפותחים לגמרי (קשור לעתים קרובות עם תמוגה תא) ב -20 שעות. "עגולים" תאים לגדול בדומה WT אבל עם ייצור הרבה מופחת של מטוסי חטיבה מתחלים לכאורה, ובכך מניב גדול, עגול תאים נעצרו. מוטציות קודמות בקטגוריה זו נפלו למרכיבים של קידום anaphase המורכב 14 או הגנים הדרושים לתפקוד microtubule (קו-פקטורים מתקפל-טובולין, מורכבי טבעת טובולין גמא) 1. לפעמים מאוחר יותר, תאים אלה לעתים קרובות מפגינים תמוגה תא מובהק.
"קטן" ו "בינוניים" תאים לגדול או negligibly (קטן) או משמעותי פחות מ WT (בינוני). רבי המוטציות אלה שזוהו עד כה יש נגעים בגנים אשר הסברים מציעים תפקידי cellula הבסיסיתהליכי גדילה r (תרגום או biogenesis ממברנה). האפליה המיקרוסקופית העיקרית בין בינוני ועגול נשענת על כמות צמיחה ב 10 שעות (עגול: כמו WT; בינוני: מופחת). מאחר הקטגוריות הקטנות והבינוניות הן גדולות למדי וכנראה משקפות נגעים ב מגוון גדול של מסלולים סלולריים, אנחנו לא מנסים להרוות בקטגוריות אלה; עם זאת, אנחנו רוצים מולקולריים לזהות נציגי המעמד להבין פנוטיפים של אובדן במסלולים מגוונים. שתי קטגוריות נחקרה הם: 1) בתחילת שנות ה-lysing מוטציות שמאבדים שלמות (הפסד של צבע ירוק, אובדן refractility) על-פי ציון 10-hr, עם מעט עדויות של צמיחת תאים לפני ו -2) המחזורים מרובים. תאים מתרבים בדומה WT ב -10 ו -20 שעות, אם כי הם מפגינים חוסר יכולת להשלים לבצע ריבוי לטווח ארוך.
אנחנו בעיקר הם מאפיינים "חריץ", "פופקורן", ו "עגול" לכלול תאים עגולים קטנים ובינוניים, כמו גםכמו מוטציות דולפות כי חלוקות תא שלמות כמה. זהו בעיקר על מנת להבטיח כי תכונות בסיסיות של הסלולר, כגון צמיחת שלמות הממברנה, הם פונקציונליות ולהעשיר את ההסתברות עבור גנים הקשורים חלוקים. גישה זו נמצאת להיות יעיל באופן אמפירי; עם זאת, ייתכן שגן מחזור התא הוא pleiotropic ויש לו תפקידים נוספים קודם לכן ב- G1, לפני החלוקה בפועל. במקרים כאלה, אשר אנו מצפים להיות נדירים, הם החמיצו. באופן כללי יותר, אנו שואפים מעצר הומוגנית, אשר בהסתברות גבוהה הוא עקב מוטציה סיבתי אחד כי הוא חלבון מתפקד לחלוטין. עם זאת, מאותה הסיבה כמו שתוארו לעיל, ייתכנו נקודות מעצר כמה ולכן, גמישות מסוימת רצויה בבחירת מועמדים.
על מנת להעשיר את האוסף עם גנים שזוהו זה עתה, המועמדים שנבחרו assayed עבור השלמה. אנו דורשים ts- בבקרה חיובית (שאילתה מול מוטציה שאילתה) ו- TS + בבקרה שלילית (query נגד WT). מוטציות חדשות באותה קבוצת ההשלמה כמו השאילתה הן ts-. חברות באותה הקבוצה שלמה כמעט תמיד משקפות נגע מולקולרי באותו הגן (זה היה המקרה עבור כל גן כזה בדקנו). לכן, עבור "מתניידים," אמת מידה זו היא פסילה לאפיון נוסף. מוטאנטים שלא היו באותו קבוצות שלמות כמו השאילתות הנבדקות מועמדי גנים חדשים ומאופיינים עוד יותר על ידי ביואינפורמטיקה כלים ניסיוניים. מאוד התאוששות משתנה של ts- אללים לקבוצות השלמות שונות היא תופעה כי ידועה היא, ההשתנות גדולה במידה ניכרת מאשר רעש פואסון, בשל ההשתנות הפנימית הגדולה של ניוון כדי ts- בין גנים שונים. גורם יכול לכלול הבדלי thermolability מהותיים; בגדלי חלבון שונים; הנוכחות של חלבון כמו מונומר לעומת כמו גדול, התייצב מורכב; ו חמים מוטגנים. זה כמעט nuisa טהורNCE. עם זאת, תוצאה חיובית וכתוצאה מכך אחד היא כי הרשימה "הנוסע המתמיד" אינה ארוכה (עם רק כמה מטרות הכובשות ביותר של הרשימה), ולכן הבדיקות השלמות עתירת העבודה אינה משימה עצומה עד לשלבים המאוחרים של הפרויקט.
כגישה משלימה, ביצענו assay הצמדה. ב assay זה, progenies כפול עמיד נבחרים וכפופים לבחינת הפנוטיפ ts-. פנוטיפ ts- צפוי (וצפה) עבור מוטציות באותה קבוצת ההשלמה כמו השאילתה או מוטציות קשורות קשר הדוק. עבור כל הגנים שנבדקו, פרי בטן WT צפוי להופיע (TS + פנוטיפ) ב סבירות מסוימת תלויה המרחק הגנטי. אנו מעריכים כי ישנם כ -100 zygospores לכל הזדווגות במקומות אלה. בהנחת 100% יעילים meiotic, זה יביא כ -100 צאצאי פעמים עמידים לתרופות מן הקלטות העמידות לתרופות הצמודות (25% של צאצאי meiotic, ארבעה לכל המיוזה, בשל Mירושת endelian). זה יהיה גם במקרה של מוטציות ts-, שבו 25% של progenies יהיו כפולה-מוטציה, ו -25% יהיו WT אם מוטציות השאילתה ולבדוק אינן צמודות. לכן, מתוך הצאצאים פעמים עמידות לתרופות, 25% יהיו WT (סביב 25 תאים). זהו המקרה עבור מוטציות לא צמודות לחלוטין; עם זאת, הצמדה מתונה (בתוך ~ 20 סנטימטרים, כ -2 מגה, או 2% מהגנום 115) יפחית במידה רבה או במידה לחסל את אות TS +. במקרה של הצמדה של המוטציה נבדקה לקסטה האנטיביוטיה, TS + haploids כי הם פעמים עמידות לתרופות הן נוכח כמויות נמוכות מאוד. זה בא לידי ככישלון לכאורה להשתלב מחדש עם כל המוטציות הנבדקות, למרות משלים כל המוטציות נבדקות, תוצאה סוטה כי הוא בקלות ציין; במקרים כאלה, backcrossing יפתור את הבעיה.
הן ידעו קודם מניתוח רצף, אנו מצפים גני מחזור תא Chlamydomonas להיות סביב 500 גנים 2, אם כי מוst, אבל כנראה לא כולם, הם חיוניים. אנחנו יהיו להעריך את צורך סיבובי mutagenesis נוספים כמו מוטציות יותר נאספות ורמת העולה רוויה.
הליך זה נועד ייחודי לחקר תהליכים ביולוגיים חיוניים ואת הגנים והחלבונים לבצען. מתודולוגיות אחרות כדי לייצר הפרעות בגנים חיוניים קיימות (למשל, שינוי של אללים mutagenized באקראי 16, אללים עבדו תנאים 17, או אללים hypomorphic 18). עם זאת, כולם דורשים הומולוגי, אשר נדחקו בתוקף וגטטיבי Chlamydomonas. התקבצו, חזור palindromic קצר interspaced בקביעות (CRISPR) / מערכת Cas9 הוקם ככלי רב עוצמה עבור שינוי גנטי 19; עם זאת, היא עדיין לעבוד ביעילות Chlamydomonas 20. אנושות, כל השיטות האלה דורשים ידע מוקדם של היעד. זוהי מגבלה חמורהאם רוצים לקבל את האפשרות ללמוד משהו חדש! הגישה שלנו תניב מוטציות זיהוי גנים חיוניים, עצמאיים של כל ידע מוקדם. לכן, ברמה הנוכחית של הטכנולוגיה, בידוד של מוטציות אקראיות ts ואחריו זיהוי גנים על ידי רצף עמוק עשוי להיות שיטה יעילה ביותר של צובר כניסה מהירה לתוך ביולוגיה של התא של חיידקים בתוך superkingdom צמח.
זיהוי של מוטציות סיבתי (מקרב ~ 100 מקודדי רצף-שינוי מוטציות בכל שיבוט) הוא מעבר להיקף של מאמר זה. רצף עמוק של ברכות segregant bulked 1 הוא יעיל אך עתיר עבודה. אסטרטגית ברכת קומבינטורית לקביעה כל המוטציות מספר רב של זנים, לאחר רצף מספר קטן של ברכות, הוא מאוד עלות ועבודה אפקטיבית. אסטרטגיה חדשה עבור סידור segregant קומבינטורית bulked הוא בפיתוח, אשר יאפשר זיהוי של מוטציות סיבתי בעשרות מוטציות simultaneously בריצת רצף יחיד (בהכנה). שיפורים אלה חשובים מאוד על מנת לאפשר את הצעד זיהוי גנים קריטי לשמור על הקצב עם הצטברות מהירה מאוד של מוטציות כי מתאפשרת על ידי בהתאם לנוהל המתואר.
Disclosures
המחברים מצהירים שום אינטרסים כלכליים משמעותיים.
Acknowledgements
אנו מודים לחברי מעבדת הצלב עבור ייעוץ ודיון שימושי. עבודה זו נתמכה על ידי PHS 5RO1-GM078153 ועל ידי פרס עמית ג'וניור מן סימונס קרן למיכל Breker.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment: | |||
| Hudson RapidPick colony picker | Hudson Robotics | ||
| MultiDrop Combi Reagent Dispenser | Thermo Scientific | 5840300 | |
| Small tube metal tip cassette | Thermo Scientific | 24073295 | |
| Singer RotoR replica-plating robot | Singer Instruments | Very essential for the process. For lower scale screenings you can use an in-house manual tool | |
| Singer single-colony picking attachment (‘Stinger’) | Singer Instruments | Can be picked manually, however for large scales it is nearly impossible | |
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| SYTOX Green Nucleic Acid Stain | ThermoFisher Scientific | S7020 |
References
- Tulin, F., Cross, F. R. A microbial avenue to cell cycle control in the plant superkingdom. Plant Cell. 26, 4019-4038 (2014).
- Cross, F. R., Umen, J. G. The Chlamydomonas cell cycle. Plant J. 82, 370-392 (2015).
- Li, X., et al. An Indexed, Mapped Mutant Library Enables Reverse Genetics Studies of Biological Processes in Chlamydomonas reinhardtii. Plant Cell. 28, 367-387 (2016).
- Tulin, F., Cross, F. R. Cyclin-Dependent Kinase Regulation of Diurnal Transcription in Chlamydomonas. Plant Cell. 27, 2727-2742 (2015).
- Simchen, G. Cell cycle mutants. Annu. Rev. Genet. 12, 161-191 (1978).
- Hartwell, L. H., Culotti, J., Reid, B. Genetic control of the cell-division cycle in yeast. I. Detection of mutants. Proc. Natl. Acad. Sci. U. S. A. 66, 352-359 (1970).
- Li, Z., et al. Systematic exploration of essential yeast gene function with temperature-sensitive mutants. Nat. Biotechnol. 29, 361-367 (2011).
- Ben-Aroya, S., et al. Toward a comprehensive temperature-sensitive mutant repository of the essential genes of Saccharomyces cerevisiae. Mol Cell. 30, 248-258 (2008).
- Harris, E. The Chlamydomonas Sourcebook: Introduction into Chlamydomonas and Its Laboratory Use. , Elsevier Academic Press. (2008).
- Dutcher, S. K. Mating and tetrad analysis in Chlamydomonas reinhardtii. Methods Cell Biol. 47, 531-540 (1995).
- Gill, S. S., Anjum, N. A., Gill, R., Jha, M., Tuteja, N. DNA damage and repair in plants under ultraviolet and ionizing radiations. Sci World J. 2015, 250158(2015).
- Liu, Z., Wang, L., Zhong, D. Dynamics and mechanisms of DNA repair by photolyase. Phys. Chem. Chem. Phys. 17, 11933-11949 (2015).
- Francis, D. Cell cycle control and plant development. Annual Plant Reviews, Volume 32. Ann. Bot. 101, 1049-1050 (2008).
- Zachariae, W., Nasmyth, K. Whose end is destruction: cell division and the anaphase-promoting complex. Genes Dev. 13, 2039-2058 (1999).
- Merchant, S. S., et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions. Science. 318, 245-250 (2007).
- Ben-Aroya, S., et al. Toward a comprehensive temperature-sensitive mutant repository of the essential genes of Saccharomyces cerevisiae. Mol. Cell. 30, 248-258 (2008).
- Mnaimneh, S., et al. Exploration of essential gene functions via titratable promoter alleles. Cell. 118, 31-44 (2004).
- Schuldiner, M., et al. Exploration of the function and organization of the yeast early secretory pathway through an epistatic miniarray profile. Cell. 123, 507-519 (2005).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31, 827-832 (2013).
- Jiang, W., Brueggeman, A. J., Horken, K. M., Plucinak, T. M., Weeks, D. P. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryot. Cell. 13, 1465-1469 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved