Method Article
Sıcaklık duyarlı Öldürücü Mutants Yüksek Verim robotik Destekli İzolasyonu içinde
Bu Makalede
Özet
Temperature-sensitive (ts) lethal mutants are valuable tools to identify and analyze essential functions. Here we describe methods to generate and classify ts lethal mutants in high throughput.
Özet
Systematic identification and characterization of genetic perturbations have proven useful to decipher gene function and cellular pathways. However, the conventional approaches of permanent gene deletion cannot be applied to essential genes. We have pioneered a unique collection of ~70 temperature-sensitive (ts) lethal mutants for studying cell cycle regulation in the unicellular green algae Chlamydomonas reinhardtii1. These mutations identify essential genes, and the ts alleles can be conditionally inactivated by temperature shift, providing valuable tools to identify and analyze essential functions. Mutant collections are much more valuable if they are close to comprehensive, since scattershot collections can miss important components. However, this requires the efficient collection of a large number of mutants, especially in a wide-target screen. Here, we describe a robotics-based pipeline for generating ts lethal mutants and analyzing their phenotype in Chlamydomonas. This technique can be applied to any microorganism that grows on agar. We have collected over 3000 ts mutants, probably including mutations in most or all cell-essential pathways, including about 200 new candidate cell cycle mutations. Subsequent molecular and cellular characterization of these mutants should provide new insights in plant cell biology; a comprehensive mutant collection is an essential prerequisite to ensure coverage of a broad range of biological pathways. These methods are integrated with downstream genetics and bioinformatics procedures for efficient mapping and identification of the causative mutations that are beyond the scope of this manuscript.
Giriş
model organizmaların sistematik mutant koleksiyonları Fenotipik karakterizasyonu hücresel karmaşıklığı diseksiyon için kanıtlanmış bir yaklaşımdır. Haploid tek hücreli yeşil algler chlamydomonas reinhardtii bir bitki gibi gen kümesi vardır, ancak arazi bitki soyu 2 çoklu genom duplications önce kara bitkileri uzaklaşmıştır. Prensip olarak, gen çoğaltılması ve özellikle haploid yaşam döngüsü eksikliği büyük ölçüde zarar fonksiyon-genetik yaklaşımlar kolaylaştırır. Bununla birlikte, ilgi konusu gen, hedeflenen bozulma nedeniyle verimli homolog genomik entegrasyon eksikliği neredeyse imkansızdır. Bir rastgele sokma bozulması kütüphane bugüne kadar 1.562 genleri 3 temsil 1,935 eşlenen kesintileri bir dizilmiş bir dizi verimli kesintiye sitenin tanımlama ile birlikte yapım aşamasındadır. Bununla birlikte, (sıfır mutasyon üretmek için, genel olarak beklenen) bu yaklaşım elzem genlerine için geçerli değildir. Sıcaklığa duyarlı (ts) mutasyonlar recovere edilebilirtemel genlerdeki d ve son yöntemler mutasyona uğramış gen ve nedensel lezyonun etkin kimlik izin verir. yüksek sıcaklıkta Fenotipik analizi, daha sonra mutasyona uğramış genin fonksiyonu hakkında derhal bilgi verir. Biz hücre döngüsü ilerlemesinde rol oynayan genlerin özellikle odaklanarak, Chlamydomonas ~ 70 temel genlerdeki ts ölümcül mutasyonlar izolasyonu ve karakterizasyonu üzerine rapor ve 1,4 kontrol eder.
Ts öldürücü ekranlar yıllardır 5,6 mikroorganizmaların genetik analizlerin bir dayanak olmuştur. Prensip olarak, arzu edilen bir özellik, ölümcül TS mutasyona yeteneğine sahip tüm genlerin tam bir analiz sağlayan en az bir mutant tarafından tanımlanan olduğu anlamına gelen "doygunluğu," yaklaşım sağlamaktır. Bununla birlikte, uygulamada, çeşitli faktörler doygunluk yaklaşım sınırlar. Hemen hemen tüm genlerin yüksek sıcaklıkta aktivite kaybına uğramış olabilir İlk olarak, bu tür mutant geri kazanım veriminin en az göre değişirbüyüklüğü 7,8 bir düzen. Bu nedenle, rastgele bir ekran doygunluk yaklaştı uzun zaman önce "sık sık el ilanları" tekrarlayan hit almak için başlar. ts mutasyonlar genellikle fonksiyonunun azalmasına neden olurken İkincisi, onlar gerçek bir kısıtlayıcı sıcaklıkta nulls olmayabilir (ve tersi, sık sık bir keyfi sıcaklıkta tamamen işlevsel değildir). Bu sorun, birden allelleri karşılaştırarak bir ölçüde ele alınabilir; hepsi ortak bir fenotip paylaşan, bu genin basit inaktivasyonu sonucu yansıtmak için daha olasıdır. Çoklu alleller da etken lezyon 1 kesin moleküler tanımlanması için çok faydalıdır. Ancak, "sık uçan" sorunu nadiren vurmak genlerdeki birden alleller kurtarmak için zor olabilir anlamına gelir.
Bu nedenlerden dolayı, izole etmek ve fenotipik TS mutantlar karakterize için geliştirilmiş boru hattı geliştirilmektedir. Biz i bugüne kadar 3.000'in üzerinde ts mutantlar topladık200, yeni bir aday hücre döngüsü mutasyonlar ncluding. Zaten muhtemelen çoğu veya tüm hücre gerekli yollar mutasyonlar içeren bu koleksiyonda, Moleküler ve fenotipik analizi, bitki hücre biyolojisinde yeni anlayışlar ve hipotezleri sağlamalıdır. Önemli olarak, bu boru hattının verimli, Ts mutantı koleksiyonları oluşturmak için agarı üzerinde yetişen herhangi bir mikroorganizma uygulanabilir.
ekipman ile ilgili bir not: İki robot bu prosedür (bir koloni toplayıcı ve bir arada kopya plater / kiraz seçici) verimlilik açısından çok önemlidir. Toplayıcıları tipik olarak metal işaretçilerine var. Çekilen koloniler (modele bağlı olarak, saniyeler dakika) belli bir süre için bu iğneler üzerinde havada yapılır. Chlamydomonas havada metal pim üzerinde yaklaşık 20 saniye içinde ölür. Bu organizma modeli seçimi kısıtlar. Doğruluk önemlidir. Bizim koloni seçici makul doğru; Ancak, onun eylem biraz şiddet ve sprey bazlı çapraz kontaminasyon için bazı olasılığı vardır. Yüksek de kullanılmazer daha 384 yoğunluğu (4.5 mm merkez merkez boşluk); Bu yoğunlukta, doğruluk tamamen kabul edilebilir. çoğaltma kaplama / kiraz toplama robotu (bu uygulamalar için kullanılan farklı ekleri) toplama çok daha yavaştır, ancak (6144 bile bu çok doğru robot için bir meydan okumadır 1536 yoğunluğu için yeterli doğrudur, biz bu yoğunluk değerlendirildi ancak seçtiler ) nedeniyle çeşitli zorluklar kullanmak için. Levha vb, dengesiz yüklenen ise robot iyi çalışmaz. Doğru şeyler oluyor emin olmak için nokta-kontrol etmek önemlidir; Elbette, robot gözetimsiz çalışacak ve genel olarak tüm ilk birkaç tabak doğruydu de eğer gidecek.
Protokol
1. UV Mutajenez
- 9,10 orta Tris-Asetat-Fosfat (TAP) ile 200 dikdörtgen agar plaklarına - 100 toplu hazırlayın. Bir kaç gün kala bu tabak hazırlayın ve sonraki adımlarda asılı hücrelerin hızlı emilimini sağlamak için kuru bankta saklayın.
- 25 ° C'de ışık altında sıvı TAP, 100 ml ve 100 rpm'de çalkalanarak, - kültür Chlamydomonas hücreleri kadar 0.2 ila 0.5 optik yoğunluk (~ 2 gün OD 750).
Not: Mat- Hygro R (Higromisin B direnç veren) Mat + Paro R (paromomisin direnç kazandıran) UV mutagenez, iki genetik geçmişlerde, bağımsız olarak gerçekleştirilir. Antibiyotik seçimi iki çiftleşme tipleri tamamlayıcı ilaç dirençleri olması koşuluyla, keyfidir. - Hücreler uygun bir sağlıklı (yüzme ve bozulmamış) ve kirlenme olmadan sağlamak için mikroskop altında kültürlerin her birinin bir numunesi kontrol edin.
NOT: Büyümüş kültürler "çarpışma" veFaz kontrast mikroskopi "hayaletler" olarak görünen, canlılığını kaybettiği. Onlar doygunluk ulaştıktan sonra giderek çalkalama kültürleri tutmayın. "Hayalet" fenomen adım 1.3 kolaylıkla saptanabilir. - 0.003 OD 750 kültür sulandırmak. suşu hareketli ve ışığa karşılık olarak yönlü olarak yüzer şekilde, homojen yoğunluk sağlamak için alüminyum folyo ile bir şişe sarın.
- 600 kurtulan koloniler plakalar (Şekil 1) oluşturacak - hücre öldürme için muhasebe, 200 böylece, planlı UV dozu dayalı süspansiyonun yoğunluğunu ayarlayın. UV ışınlarına maruz kalma süreleri ile ilgili bilgi için Tablo 1'e bakınız.
- bulaşmasını önlemek için, üreticinin talimatlarına uygun olarak, bir sıvı dozaj uygun bir küçük tüp kaseti takın ve sterilizasyon için bir dizi yıkama yapar.
- Bir 8 x 12, sıvı dağıtıcı kullanarak, dikdörtgen plaka (Şekil 1 üzerine 2 ul, her 4 x 96 damla akıtın ). sıvı ince bir tabaka halinde tüm damlaların birleşmesini sağlamak ve hemen ışığa maruz kalmasını önlemek için plakaları kapsayacak şekilde plakanın kenarında hafif dokunun.
- Çok daha tek bir hücre yayılmasını sağlamak için, yukarıda belirtildiği gibi, kuru bir tabak kullanın ve hızlı bir şekilde ışığa karşılık olarak yüzme hücreleri bilmek plakaları kaplamak için. Tüm sıvı çekene kadar kapalı plakalar düzeyi ve karanlıkta saklayın.
- Hayatta kalanlar arasında TS-mutantların optimal verim elde deneysel olarak tespit zaman dönemleri için mikrop öldürücü, UV lambası (30 watt mikrop öldürücü UV tüp) altında tabak koyun. % 99.9 öldürme - 90 ile sonuçlandığı 50 cm - 40 arasında bir mesafede 1.5 dakika - Al, 0.5 kez kullanmak. 1000 UV kaynaklı nokta mutasyonları, bir ~% 10 değişmesi kodlama dizileri - Dul 100 içerir.
- Paketi hemen 11,12 bu aşamada karanlıkta çalışma tamir nedeniyle ışığa bağımlı DNA için bir çevirim UV ışıması maksimum etkisini temin etmek amacı ile,ışınlama sonrası bir siyah kutu içinde levha.
- Oda sıcaklığında 24 saat - 8 karanlıkta plakaları tutun.
- koloniler oluşturmak için aydınlatma ile 21 ° C inkübatör tabak koyun. Koloni oluşumu 10 gün ~ alır. Sıvı yoğunlaşmasını kadar örtecek plastik torba ile plakaları sarın ve iç emici kağıt eklemek emin olun. kirleticilerin plakaları girmek için buharlaşma ve yoğuşma döngüleri aksi sıvı film yolları sağlayabilir.
- Robotik koloni toplama (Şekil 2) için kaynaklar gibi ilgili yığınlar halinde tabak yerleştirin. dikdörtgen plakalar üzerinde 384 dizileri için koloniler seçin ve aydınlatma (~ 1 hafta) ile 21 ° C'de onları büyümek.
- Bir 1.536-dizileri (4: 1) yoluyla 384 diziler yoğunlaşır çoğaltma kaplama robot kullanılarak (Şekil 3) ve plakalar, 21 ° C kuluçka makinesi içinde ~ 3 gün boyunca büyümeye izin verir.
- Her iki plakalara 1536-diziler çoğaltmak ve (21 ° C inkübatör keyfi bir yersıcaklığı) ve 33 ° C inkübatör (kısıtlayıcı ısısında). 24 saat sonra, önceden ısıtılmış plakaları yeni bir dizi için 33 ° C plakaları çoğaltmak ve 33 ° C inkübatör koyun.
NOT: Bu ikincil kaplama nedeni hücreleri kaplama sonrası ilk hücre döngüsünün tutuklandı olsa bile, o ölümcül mutantlar bazı durumlarda önemli biyokütle birikir içinde can ts olduğunu. İkincil çoğaltma bu sinyali ortadan kaldırır ve büyük ölçüde duyarlılığı artırır. - 33 ° C'de büyüme 3 gün 21 ° C'de büyüme 5 gün sonra, bir dijital kamera ile plakalar fotoğrafı. Sabit bir çerçeveye plakaları tutun. Kültür plakaları (Şekil 4) ile birlikte fotoğraflandı dokuz hizalama göstergeleri ile işaretlenmiş bir "grid plaka" kullanın. alternatif olarak fotoğraf kültür plakaları 21 ° C ve 33 ° C (21/33) görüntüleri eşleştirilmiş.
NOT: vahşi tip önemli ölçüde büyür beri farklı inkübasyon süreleri büyümeyi dengelemek için kullanılırhızlı 33 ° C'de 21 ° C de daha.
ts Mutant Adayların 2. Kimlik: İlk Ekran
- Bir 1536-diziye arka plan ve segmente görüntüleri ortadan kaldırmak için özel bir Matlab görüntü analiz yazılımı ile eşleştirilmiş 21/33 plakalı görüntüleri işlemek. Program her pozisyon (Şekil 5) tespit biyokütle (toplam piksel yoğunluğu) belirleyecektir.
NOT: (yönergelerle birlikte SI sağlanan) yazılımı kullanılan büyütme ve plaka şeklinde yayılıyor bir 1536-dizideki hücrelerin yerleri (bireysel girişleri) tespit etmek ve her hücrede toplam piksel yoğunluğunu hesaplamak için ızgara plakası resim kullanacağız . Mut (S (Mut 33) / S (WT 33) / S: Her mutant için bu değerler daha sonra ts + standart ve sıcaklık duyarlılık derecesi 21 ° C nispetle gerekli büyümeyi belirlemek için ayarlanabilir parametreleri ile karşılaştırılarak, olarak tanımlanır 21) / S (WT 21), S sinyali (piksel olduğuArka plan çıkarma sonra tensit), Mut bireysel mutant olduğunu ve "WT" rasgele seçilen olmayan ısıya duyarlı koloni ts + fenotip vardı (mutagenized suş) 'dir. 21 ° C de büyüme S (Mut 21) / S (WT 21) olarak tanımlanır. bu ilk ekranda, yalancı negatiflik oranı düşük tutmak için (21 ° C'de nispeten düşük büyüme ve sıcaklık hassasiyeti nispeten düşük düzeyde izin) rahat seçim kriterlerini uygulamak. - (Tipik bir 384-diziye) robotik toplama tek koloni için bir talimat dosyası olarak yazılım tarafından oluşturulan seçilen kolonilerin listesini yükleyin. Robotik talimatlara göre kaynak ve hedef tabak hazırlayın ve diziye koloniler (Şekil 6) seçin.
NOT: Geleneksel toplayıcılar gibi .csv, .txt veya .xls gibi bazı biçimde bir talimat dosyası gerektirir. Tüm toplayıcıları dosya odaklı olmak kapasitesine sahip olacak; farklı biçimleri MATLAB kodu (sağlanan kaynak kodu) küçük düzenleme gerektirir. - ~ 5 gün stok plaka büyümek için 21 ° C inkübatör hedef tabak yerleştirin.
3. ts Mutants belirlenmesi: İkinci Ekran
- Adımı yineleyin 2.1 picked koloniler yeniden test etmek. Genellikle 30 - UV mutagenezi kalan ilk koloniler göre% 5 ts öldürücü - kolonilerin% 50% 2'lik bir verim için, net ts öldürücü tekrar test edecektir.
- Tekrarlayın iki ekranlı ts öldürücü toplamak için adım 2.2, ancak 384 yoğunlukta dikdörtgen plakalar üzerinde 100 koloni bloklar halinde dizi koloniler için tasarlanmış bir modifiye talimat dosyası ile. Bu, sonraki aşamada uygun bir mikroskopik inceleme için. talimat dosya biçimi MATLAB kodu ile zamanında belirlenir.
- Bir kontrol olarak birkaç WT koloniler dahil ve ~ 5 gün süreyle 21 ° C'de plakaları yerleştirmek için emin olun.
4. İlk Fenotip belirlenmesi
- Aşama 3.2 dizilmiş 100 Plakaları, çoğaltma ve 21 ° C incu koyunbatör 2 ~ için gün taze büyüyen koloniler elde etmek.
- üç nüsha 100-blok plakaları (4.1) yeni bir kopyasını çoğaltırlar. kontrol grubu olarak 33 ° C inkübatör bir 21 ° C inkübatör kopya ve bir koyun.
- Bir robot kurulum üçüncü kopya ( "plakaları tarama") koyun ve uzun iğneler steril su ile dokundu ile koloniler nokta.
NOT: agar tutturulmuş Chlamydomonas hücreleri robot mikroskobik muayene için kullanılabilir birkaç tek hücreler ile hücre oldukça yoğun nokta olarak başlangıçta karaya eğilimindedir. Mikroskobik muayene için koloniler optimize bir damla su ile başlangıçta transfer hücreleri nokta (robotik uzun pimleri tarafından aktarılan suyun hacmi ~ 100 nl). Bu, pek çok izole edilmiş tek hücreler ile ilk sabitleme merkezi etrafında küçük bir yarıçap (~ 1 mm) hücre dispersiyon ile sonuçlanır. - 0 zamanda eleme plakalarının her nokta bir bölgenin fotomikrografları al (tek ise hala, bölünmemiş hücre) (Şekil 7) ve kuluçka 33 ° C'de plakalar yerleştirin. 384 yoğunluklu dizinin 4.5 mm merkez-merkez aralığında durur vermek için ayarlanır değiştirilmiş dörtlü diseksiyon mikroskobu manuel kademe kontrol görüntü konumunu belirler.
- 33 ° C inkübatör eleme tabakalarını çıkarın ve çeşitli zaman noktalarında, Aşama 4.4 gibi, (10 saat, 20 saat, 48 saat) fotomikrograflarıdır alır. sahne, plaka tutucu ve sahne denetleyicisi emin olun tam her zaman noktasında aynı hücrelerin görüntüleri almak için kalibre edilir. Hızlı fotomikrograf satın alma (~ 10 dk) gerçekleştirin.
- ts fenotip doğrulamak ve görüntü alımı sırasında sıcaklık dalgalanmaları ts fenotip üzerinde önemli bir etkiye sahip olduğundan emin olmak için 33 ° C inkübatör ikinci bir kopyasını kullanın.
- Mikroskobik görüntüleri analiz ve istenilen kriterlere göre mutantlar (Şekil 8) için seçin. 96-dizilmiş agar plaka final seçilen set nokta. Emin olun herplaka, aynı çiftleşme tipi ve ilaç direnci mutantlar içerir.
- Her plaka için, son iki sütunu pozitif (sorgu mutasyon) ve tamamlama testi için negatif (WT) kontrol dahil edilmiştir.
Yeni Mutants 5. tamamlama ve Bağlantı Testi için "Sık Flyers"
- Azot içermeyen gamet indüksiyon ortamı 10 dizilmiş kolonilerin büyük miktarlarda 96 oyuklu (her koloninin yoğunluğu yaklaşık 0.2 OD olmalıdır) mikro. Gametogenezis izin ~ 5 saat - (20 W cıva ampul 13) ışık altında inkübe edin.
Not: Bu adım, basit bir kaplama cihazı ile bir kopyalayan robot kurulum veya manuel ile ya yapılabilir. - Gametogenez için azot içermeyen gamet-indüksiyon ortamı 10 ile tüplere alternatif direnç kasetleri barındıran ters çiftleşme tipleri ile sorguları Askıya.
- Bir eşleşme mikst bir hedef levha örnekleri karıştırın20 ul (Şekil 9) ve ure hacmi. Aşağıdaki ~ ışığı altında 10 dakika, her bir kuyunun iki spot 5 ul: Bir kez bağlantı testi için TAP plaka üzerinde ve bir kez tamamlama testi için TAP + 5 mcM Paro + 9 uM Higro üzerinde.
- bir gecede 21 ° C inkübatör bağlantı plakaları inkübe ve ardından folyo ile sarın. zygospore oluşumuna izin vermek için 5 gün süreyle karanlıkta tutun.
- 21 ° C de bir ışık 10 gün ~ için tamamlama testi inkübe edin.
NOT: ilaç miktarları çifte heterozigot diploidlerin hayatta izin kalibre, ama onlar hala çiftleşme haploidler ortadan kaldırmak için yeterli olan. Bu miktarlar, bu özel projede kullanılan standart direnç kaset entegrasyonları için kalibre edildi; yeni entegrasyonlar ile, dozları tekrar kalibre edilmelidir. Çoğu biyokütle, akış sitometri (Şekil 9) tarafından diploitler olarak doğrulanmış olmasına rağmen muhtemelen mayoz ve iki kat dayanıklı büyümesinden haploidlerden (değişken düzeyiayırımlarındaki), genellikle de görülmektedir. - TS-fenotip tanımlaması için iki nüsha halinde tamamlama-test plakaları çoğaltırlar. ~ 5 gün boyunca 33 ° C'de 21 ° C de bir kopya ve bir kopyasını koyun.
- TS-fenotip için test koloniler, bu bölümde 2.1 (Şekil 5) tarif edilmiştir. sorgusu ile tamamlayan olmayan koloniler muhtemel sorgu (aynı gen mutasyonları için hetero-alelik diploidlerin) aynı genin allel temsil etmektedir.
- bağlantı testi için adım 5.4 aşağıdaki ~ 7 gün boyunca mayoz ve haploid ayırımlarındaki ve büyümesine izin ışığa geri plakaları kaydırır.
- (Kasetler bağlantısız olduğundan, haploid döl% 25'i olarak tahmin) çift dayanıklı yavrularıyla için seçin ve bir hafta boyunca 21 ° C'de inkübe TAP + 10 uM Paro ve 10 uM Higro için bağlantı test plakaları çoğaltırlar.
NOT: iki kat dayanıklı haploidlerden ilaç dozunu artırın. - Deney koloniler TS-fenotip, in 2.1 adım.
NOT: TS-fenotip sorgusu ile aynı tamamlama grubu mutantlar için beklenen (ve gözlemlenen gibi). Buna ek olarak, bağlantı deneyinde bir TS-fenotip, sorgu tamamlayan bir mutant için, sorgu ve yeni mutasyon arasındaki sıkı bağlantıyı yansıtabilir. Test sorguları tamamlayan mutantlar daha fenotipik analiz için sonuçta etken lezyonun biyoinformatik tanımlama için boru hattı girin ve olasıdır yeni genler bulunmaktadır.
Sonuçlar
Biz Chlamydomonas ts mutantlar izole etmek için hızlandırılmış bir boru hattı göstermektedir. Hücreler, agar plakaları üzerinde dağıtılır ve kısa bir süre tek hücre yoğunluğu mikroskop altında pratik doğrulama sonra plakalar, UV radyasyona tabi (Şekil 1). Tipik ışınlanmış koloniler tespit ve bir keyfi sıcaklıkta (Şekil 2) büyüme 10 gün sonra bir dizilmiş biçime toplanır. 384 biçiminde bileşke plakalar 1536 dizi (Şekil 3) ile birleştirilir. ışınlanmış koloniler toplama bu ilk adımlarından itibaren, şimdiye kadar ~ 200.000 koloniler dizilmiş var. 600 kurtulan koloniler plakalar üzerinde oluşturacak - süspansiyon yoğunluğu, ölümü için muhasebe, 200 böylece planlanan UV dozu dayalı ayarlanır. Üç UV ışınlarına maruz kalma süresi (1.5 dakika, 1 dakika ve 0.5 dakika) ve üç yoğunlukları buna uygun olarak (Tablo 1) test edilmiştir. Ampirik, 1.5 dakika maruz kalma süresi ts en vermiştir- Mutantlar (~% 50); Ancak, bugüne kadar, 1 dak hücre döngüsü adayların çoğu vermiştir. Bu nedenle, gelecek UV mutagenez mermi sadece 1 dakika ile yapıldı. Önemli bir sorun, ilk toplama ve (özellikle yüksek yoğunluklu formatlarda) çapraz kontaminasyon sırasında sıçraması olduğunu. Bu iki çoğaltma ve aynı mutantının daha fenotipleme neden olabilir. Böyle bir senaryo için olasılığını en aza indirmek için, en uygun boyutta koloniler toplamak için özen ve komşu koloniler ilk deneyde aldı olmadığından emin olun.
Sonra, iki sıralı TS-fenotip deneyleri (Şekil 5) yapıldı ve yaklaşık 3.000 TS-mutantları izole edilmiştir ve fenotipik zaman atlamalı mikroskobu (Şekil 8) tarafından karakterize edilir. Nedeniyle belirli ölçütlere uyan fenotipleri ilgi hücre döngüsünü okuyan biyolojik odak, biz gen her hedef ikiden fazla alleli toplama ilgilenmiyore. Bu nedenle, biz aşağı boru hattı (Şekil 9) dan son derece tekrarlayan genleri kaldırmak için yeni toplanan adaylara karşı ikiden fazla allel (Sorgu) zaten karakterize genlerle tamamlanmasını ve bağlantı testi uygulandı.

Şekil 1: Düzgün mutajenize Hücreleri ve UV Mutajenesisin Yayılma. (a) 384 x 2 ul damla Reaktif dağıtıcı kullanarak bir agar plaka üzerine dağıtılır. (b) Rastgele plakaları tek hücreli yoğunluğu doğrulamak için mikroskop altında test edilmiş ve 1 dk maruziyet ile ışınlanmış UV vardır vardır. Ölçek çubuğu 50 mikron =. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 2. UV mutagenized Koloniler 384 diziler için aldı. (a), UV-ışınlanmış tek hücre görünür koloniler halinde 10 gün ~ için yetiştirilir. Ölçek çubuğu = 2 cm. (b) Görüntü analiz programı belli parametrelere göre ayrılabilir kolonilerini tanır ve robot 384 tabak içine diziler. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

1536-dizi 3. birleştirme Şekil. Dört 384 format plakaları tek 1.536-plakaya birleştirilir; bir kez yetiştirilen, onlar TS-fenotip test etmek için tekrar çoğaltılır. Bir görmek için buraya tıklayınızBu rakamın daha büyük bir versiyonu.
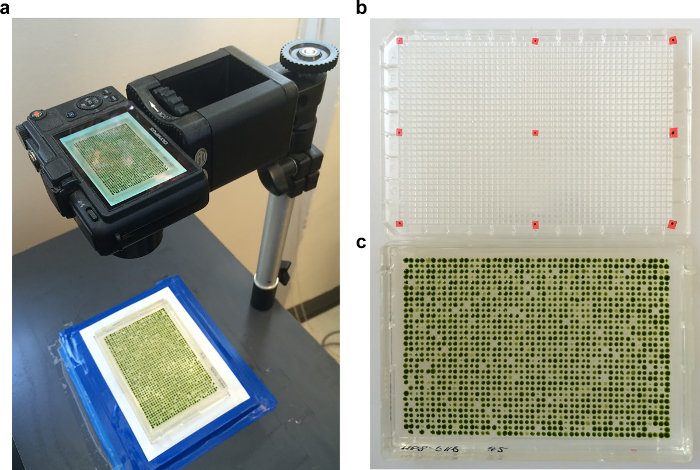
Niceleme 4. Görüntüleme Şekil. Bir serideki tüm plakaları aynı büyütme ve konumlandırma fotoğraflanan böylece (a) Levhalar belge fotoğraf standı altında bir çerçeve içinde tutulur. (b) birinci köşe görüntü ve orta noktaları yerleştirilmiş kırmızı noktalar ile 1536 oyuklu mikrotitre plakasının taşımaktadır. Bu "ızgara plakalı" görüntü dizinin konumunu tanımlar. (c) inkübasyonun ardından 1.536-dizi Örnek. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Yarı tarafından TS-fenotip Şekil 5. Kimlik-Otomatik görüntü analizi. Plaka görüntüleri (SI sağlanan) özel MATLAB yazılımı tarafından analiz edilir. görüntüsü otomatik hücre dizileri (96, 384, ya da 1536) içine bölümlere ve her hücrede sinyali ölçülür. 21 ° C'de büyüme mavi işaretlenir ve 33 ° C'de büyüme sarı işaretlenir. 33 ° C ile karşılaştırıldığında 21 ° C'de önemli ölçüde daha yüksek bir büyüme sergileyen koloniler seçilir ve yeşil bir nokta ile siyah kareler işaretlenmiştir (ts + standardize). Bu seçimler elle düzenlenebilir. Nihai seçimleri koloni toplama robotu tarafından kullanılan bir dosyaya aktarılır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

İlk yuvarlaklık ts Lethal Adayları Şekil 6. Robotik Toplama. kiraz-picking robotu yeni bir dizi için adayların almak için adım 2.1 açıklandığı gibi oluşturulan bir dosyadan talimatları izler. Üst panelde steril pim yüklenmesini gösterir. alt panel kaynak plakası belli bir koloniden kesin toplama gösterir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Ts Ölümcül fenotipleri İlk Sıralama için Şekil 7. Time-lapse Taraması. Şekil 5'te gösterilen tarama protokolü iki tur geçirilir klonlar tek tek hücreler mikroskobik olarak çözülebilir şekilde bir hücre yoğunluğunda plakalara çoğaltılır. Değiştirilmiş bir tetrad mikroskopu fotomikrograflarıdır 0 saat, 10 saat ve 20 saat inkubasyon bir süre sonra alındığı pozisyonları tanımlamak için kullanılır t 33 ° C. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
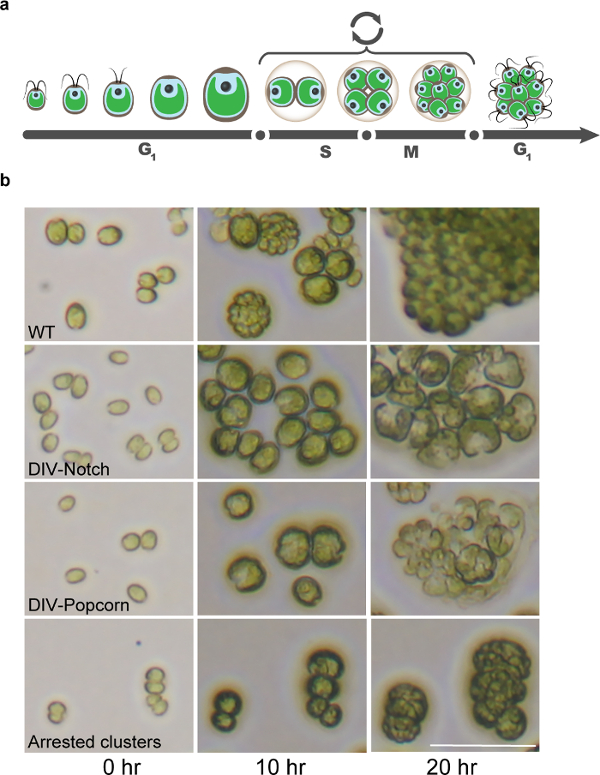
Şekil 8: Time-Lapse Mikroskopi tarafından Belirlenen Chlamydomonas Hücre Döngüsü Mutantlar. (a) Chlamydomonas benzersiz hücre döngüsünün İllüstrasyon yenidoğan kızı hücrelerinin kuluçka ile sona fisyon SM döngüleri, ardından hücresel büyüme ile karakterize uzun G1 fazı, açıklanır. (b) Mikroskobik görüntüler hücre döngüsü ve mitoz tamamlamak için başarısız tipik hücre döngüsü mutantlar belirlenmesi sırasında WT hücreleri göstermektedir. Ölçek çubuğu 50 mikron =. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 9: tamamlama ve Bağlantı Testi. (a) sık sık tekrarlanan mutasyona uğramış gen ile bir antibiyotik dirençli (örneğin, Hygro) sorgu (örneğin, Puro) ikinci bir antibiyotik direnç kasetini liman karşı eşleşme Çeşidi mutantlarının bir dizi 96 oyuklu bir plaka içerisinde çaprazlanır. (A sol alt panel) nükleik asit boyama ve analiz flow sitometri de gösterildiği gibi tümleme plakaları diploidlerin yüksek kısmını verir. (b) çiftleşme karışımı diploidlerin içinde tamamlama ve çift dayanıklı mayotik döl içinde bağlantı için hem test edilir. Pozitif kontrol zıt eşleşme türü sorgu kendisi ve negatif kontrol WT ve ts + fenotipini gösterir ise, beklendiği gibi, 33 ° C'de TS-fenotipi gösterir. daire koloniler sorgu ile hiçbir tamamlanmasını göstermek ve bu nedenle nSorgu geni için ew TS-alleller. Sadece "sık sık el ilanları" tamamlama testi seti olduğundan Bunlar genellikle, daha fazla karakterizasyon dışındadır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Zaman | OD | Koloniler aldı (#) | TS-fenotip | Hücre döngüsü adayları |
| 1.5 ' | 0.012 | 6000 (Ort = ~ 200) | 200 (% 3.3) | 7 (% 3.5) |
| 1 ' | 0.003 | 11.000 | 131 (1.19%) | 15 (% 11.4) |
| (Ort = ~ 360) | ||||
| 0.5 ' | 6E-04 | 9000 | 40 (% 0.45) | 1 (% 2.5) |
| (Ort = ~ 300) |
Tablo 1: Işınlama Times Kalibrasyon Hücre Döngüsü Mutant Adayları Verim maksimize etmek. Üç ışınlama süreleri kalan koloni sayıları (- 600 200) sağlamak için ODS tekabül eden (30 plakaları her biri) test edildi.
Tartışmalar
ts öldürücü mutantların yüksek verim izolasyonu için burada açıklanan boru hattı Chlamydomonas genomunun muhtemelen tüm hücresel-temel yollar temsil edilmesini sağlar. Potansiyel hücre döngüsü genlerinin verimli bir şekilde toplanması ve tekrarlayan "sık uçan" allellerin ortadan kaldırılması için iki en kritik adımlar şunlardır: eksik hücre döngüsü ve 2) zaten tanımlanan karşı paralel tamamlama testi için tutuklama fenotip özelliklerinin 1) tutarlı tanım yeni izole olanlarla koleksiyonu büyütmek için genleri sorgular.
Işık-karanlık döngüleri ile senkronize olduğunda, Chlamydomonas herhangi bir DNA replikasyonu veya hücre bölünmesi 13 olmadan gündüz saatleri ve hücre boyutu> 10x artışlar sırasında fotosentetik büyür. Gece başlangıcından yaklaşık tesadüf hücreler daha sonra DNA replikasyonu, mitoz ve hücre bölünmesi (Şekil 8) alternatif defalarca tekrarlayabilir. Bu düzenleyici şematiktirE, öncelikle hücre büyümesi ve bütünlük ve hücre bölünmesi döngüsü için özel olarak gerekli olan genler için gerekli genler arasında doğal bir ayrım sağlar. Biz 10 saat ve 20 saatlik zaman noktaları bir başlangıç kaba fenotipik 1 kesmek için çok bilgilendirici bulundu. Bu görüntülere dayanan şu anda tanımak ts öldürücü mutantlar, geniş sınıfları 1 (Tulin ve Cross, 2014 SI bakınız) şunlardır: Notch, Popcorn, Yuvarlak, Küçük, Orta, erken lizis ve çoklu-çevrim (Şekil 8 ).
Biz odaklanmak üç en alakalı kategoriler Notch, Patlamış mısır ve Yuvarlak vardır. "Çentik" ve "patlamış mısır" fenotipleri çoğu hücre döngüsü spesifik lezyonları için daha önce gösterilen (örn, mitotik sikline bağlı kinaz, DNA replikasyon makine ve topoizomeraz II); 1. biri (Notch) ya da çoklu görünüm (Popcorn) başlangıç ama başarısız hücre bölünmesinin belirgin uçakları uygun bir morfolin olduğunuHücre döngüsü inisiyasyon ogical göstergesi. Bu mutantlar, genel olarak 10 saat gösterirken WT benzer hücre hacmindeki artışlar, çok az veya hiç bir büyüme kusurlar sergilerler. Notch ve Popcorn fenotipleri 10 saatte belirgindir ve tam 20 saat ile (sıklıkla hücre parçalama ile ilişkili) geliştirilmiştir. "Yuvarlak" hücreler, böylece büyük, yuvarlak tutuklandı hücreleri verimli, WT ama belirgin başlangıç bölümü uçaklarının çok azaltılmış üretimi ile benzer büyür. Bu kategoride önceki mutantlar mikrotübül fonksiyonu (tübülin-katlama kofaktör, gama-tubulin halka kompleks) 1 için gerekli anafaz-teşvik 14 karmaşık ya da genlerin bileşenlerine düşmüş. Daha sonra zaman zaman, bu hücreler sıklıkla belirgin hücre parçalama sergilerler.
"Küçük" ve "Orta" hücreleri WT (Orta) daha ihmal edilebilir (Küçük) ya da daha az ya da büyür. Bugüne kadar belirlenen bu mutantların birçok ek açıklamalar temel cellula rol önermek genlerdeki lezyonları varr büyüme süreçleri (çeviri veya zar biyogenezi). (:;: Azaltılmış Orta WT gibi Yuvarlak) Orta ve Yuvarlak arasındaki ana mikroskobik ayrımcılık 10 saatte büyüme miktarına dayanmaktadır. Küçük ve Orta Ölçekli kategoriler oldukça büyük ve muhtemelen hücresel yolların büyük bir aralıkta lezyonları yansıtan, çünkü biz bu kategorileri doyurmak için çalışırken değildir; Ancak, farklı yollardaki kaybı fenotipleri anlamak için sınıfın temsilcilerini belirlemek moleküler yönden istiyoruz. İki çalışılmamış kategoriler şunlardır: 1) Erken parçalama önce hücre büyümesinin çok az kanıt ve 2) çoklu döngüleri ile, 10 saat işareti ile yeşil renk (kaybı, refraktilitesi kaybı) bütünlüğünü kaybeder mutantlar. Hücreler, daha uzun vadeli bir proliferasyonunu gerçekleştirmek için tam bir yetersizlik sergiler ama, 10 ve 20 saat sonra ağırlıkla benzer çoğalır.
Biz çoğunlukla, hem de küçük ve orta yuvarlak hücreler "çentik", "patlamış mısır" ve "yuvarlak" karakterize ve dışarıda olanolarak sızdıran mutantlar bu tam kaç hücre bölünmeleri. Bu, büyüme ve membran bütünlüğünün, gibi temel hücresel özellikleri, fonksiyonel olmasını sağlamak ve bölünme ile ilgili genler için olasılığını zenginleştirmek için esas olduğunu. Bu yaklaşım, deneysel olarak etkili olduğu bulunmuştur; Ancak, bir hücre döngüsü gen gerçek bölünmeden önce, pleiotropik ve önceki G1 ek rolleri vardır olabilir. biz nadir olmasını bekliyoruz Bu gibi durumlarda, cevapsız. Daha genel olarak, biz yüksek olasılık tamamen işlevsiz proteindir nedeniyle bir etken mutasyon homojen tutuklama, hedefliyoruz. Bununla birlikte, aşağıda açıklanan aynı nedenden dolayı, çok sayıda tutuklama noktalar ve bu nedenle, bazı esnekliğin adayları seçmek tavsiye edilir.
yeni tanımlanan genlerle koleksiyonunu zenginleştirmek amacıyla, seçilen adaylar tamamlama için deneye tabi tutulur. Biz pozitif kontrol negatif kontrol (sorgu mutasyon karşı sorgu) ve ts + TS-gerektirir (querWT karşı Y). sorguda aynı tamamlama grubu yeni mutantlar TS- vardır. Aynı tamamlama grubuna üyelik neredeyse kaçınılmaz aynı genin moleküler lezyon (bu test ettik her tür gen için böyle olmuştur) yansıtır. Bu nedenle, için "sık sık el ilanları," Bu kriter daha karakterizasyon için dışlayıcı olduğunu. Test sorgular aynı tamamlama grupları değildi mutantlar yeni genlerin için aday olan ve daha fazla biyoinformatik ve deneysel araçları ile karakterizedir. Farklı tamamlama gruplarına TS-allellerinin yüksek değişkenliğe sahip kurtarma iyi bilinen bir olgudur-olan değişkenlik nedeniyle, farklı genler arasındaki TS- için mutability büyük içsel değişkenlik, Poisson gürültü belirgin derecede daha yüksektir olmasıdır. içsel thermolability farklılıkları içerebilir Nedenler; farklı protein boyutları; Büyük bir şekilde, karmaşık bir stabilize karşı bir monomer gibi bir proteinin varlığı; ve mutajenik sıcak noktalar. Bu neredeyse saf nuisa olduğununce. Ancak, bir ortaya çıkan olumlu sonuç "sık uçan" listesi (listenin en işgal yalnızca birkaç hedeflerle) uzun değil, bu yüzden emek-yoğun tamamlama testi projenin ileriki aşamalarında kadar büyük bir girişim değil olmasıdır.
tamamlayıcı bir yaklaşım olarak, biz bir bağlantı testi uygulandı. Bu deneyde, iki dayanıklı yavrularıyla seçilir ve TS- fenotipi için test edilir. Bir TS-fenotip beklenen (ve gözlenen) sorgusu ya da sıkıca bağlı mutasyonlar için aynı tamamlama grubu mutantlar için bir. Test edilen genlerin her biri için, bir WT döl genetik mesafeye bağlı olarak belli bir olasılık (ts + fenotip) çıkması bekleniyor. Biz bu noktalar her çiftleşme için yaklaşık 100 zygospores olduğunu tahmin ediyoruz. % 100 öz değişmesine ait başarı ile, bu durum, M bağlantısız ilaç direnci kasetleri yaklaşık 100 çift ilaca dirençli soyun (öz değişmesine ait döl% 25, mayoz başına dört sonuçlanacaktırendelian miras). Bu aynı zamanda döllerinde% 25'i çift mutant olacak TS- mutasyonlar için durumda olacağını ve sorgu ve test mutasyonları bağlantısız ise% 25 WT olacaktır. Bu nedenle, çift-ilaca dirençli döl üzerinden, ağırlıkça% 25 (yaklaşık 25 hücre) olacaktır. Bu tamamen bağlantısız mutasyonlar için de geçerlidir; Ancak, orta bağlantı (~ 20 cm, yaklaşık 2 Mb, ya da genom 115% 2 içinde) şiddetle azaltmak veya ts + sinyali ortadan kaldıracaktır. Antibiyotik kaseti test mutasyonun bağlanması durumunda, çift ilaca dirençli + haploids TS çok düşük miktarlarda mevcut bulunmaktadır. Bu, tüm mutantlar kaydetti kolayca bir anormal bir sonuç test tamamlayan rağmen, test edilen tüm mutantlar ile recombine açıkça başarısızlık olarak ortaya çıkar; Bu gibi durumlarda, geriye melezleme sorunu çözecektir.
Önceki bilgileri ve dizi analizi, her ikisi de mo birlikte, Chlamydomonas hücre döngüsü genlerinin 500 genler 2 olmasını bekliyoruzst, ama muhtemelen hepsi değil, esastır. Biz başka bir mutasyon tur için gerekliliğini daha fazla mutantlar toplanır olarak ve doygunluk yükselir düzeyini değerlendirecek.
Bu prosedür benzersiz temel biyolojik süreçleri ve bunları yürütmek genleri ve proteinleri çalışmak için tasarlanmıştır. Diğer yöntemler temel genlerdeki tedirginlikler var oluşturmak için (örneğin, rastgele mutagenized alellerin 16, koşullu transkripsiyonu alellerin 17 veya hypomorphic allellerin 18 dönüşüm). Bununla birlikte, tüm kuvvetli bitkisel Chlamydomonas bastırılır homolog rekombinasyonu gerektirir. Kümelenmiş düzenli interspaced kısa palindromic tekrar (CRISPR) / Cas9 sistem gen modifikasyonu 19 için güçlü bir araç olarak kurulmuştur; Ancak, Chlamydomonas 20 verimli çalışmasını henüz. Kritik, bu yöntemlerin hepsi hedefin ön bilgi gerektirir. Bu ciddi bir kısıtlama olduğunuyeni bir şeyler öğrenmek olanağına sahip olmak isterse! Bizim yaklaşım herhangi bir ön bilgi bağımsız temel genleri tanımlama mutasyonları verecektir. Bu nedenle, teknolojinin bugünkü düzeyinde, derin sıralama ile gen tanımlama ardından rastgele ts mutasyonların izolasyon bitki superkingdom mikrobiyal hücre biyolojisi içine hızlı bir giriş kazanmanın en etkili yöntem olabilir.
neden olan mutasyonların tanımlanması bu yazının kapsamı dışındadır (kodlama-dizi-değişen her klon mutasyonlar 100 ~ arasından). Hacimli segregant havuzlar 1 derin sıralama etkili ama emek-yoğundur. suşu çok sayıda Tüm mutasyonlar belirlenmesi için bir birleştirici havuzu strateji, havuzları az sayıda sekanslanması sonra çok maliyet ve emek etkilidir. kombinatoryal bulked segregant dizileme için yeni bir strateji sim mutantlar onlarca yol açan mutasyonların belirlenmesi sağlayacak geliştirme aşamasındadır(Hazırlık aşamasında) tek bir sıralama vadede ultaneously. Bu verimlilik kritik gen tanımlama adımı burada anlatılan prosedürler ile mümkün olmaktadır mutantlar çok hızlı birikimi ayak uydurmak için izin için çok önemlidir.
Açıklamalar
Yazarlar önemli mali çıkarlarının beyan ederim.
Teşekkürler
Biz tavsiye ve yararlı bir tartışma için Çapraz laboratuvar üyelerine teşekkür ederim. Bu çalışma PHS 5RO1-GM078153 tarafından ve tarafından desteklenen Michal Breker için Simons Vakfı Junior Fellow ödülü.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment: | |||
| Hudson RapidPick colony picker | Hudson Robotics | ||
| MultiDrop Combi Reagent Dispenser | Thermo Scientific | 5840300 | |
| Small tube metal tip cassette | Thermo Scientific | 24073295 | |
| Singer RotoR replica-plating robot | Singer Instruments | Very essential for the process. For lower scale screenings you can use an in-house manual tool | |
| Singer single-colony picking attachment (‘Stinger’) | Singer Instruments | Can be picked manually, however for large scales it is nearly impossible | |
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| SYTOX Green Nucleic Acid Stain | ThermoFisher Scientific | S7020 |
Referanslar
- Tulin, F., Cross, F. R. A microbial avenue to cell cycle control in the plant superkingdom. Plant Cell. 26, 4019-4038 (2014).
- Cross, F. R., Umen, J. G. The Chlamydomonas cell cycle. Plant J. 82, 370-392 (2015).
- Li, X., et al. An Indexed, Mapped Mutant Library Enables Reverse Genetics Studies of Biological Processes in Chlamydomonas reinhardtii. Plant Cell. 28, 367-387 (2016).
- Tulin, F., Cross, F. R. Cyclin-Dependent Kinase Regulation of Diurnal Transcription in Chlamydomonas. Plant Cell. 27, 2727-2742 (2015).
- Simchen, G. Cell cycle mutants. Annu. Rev. Genet. 12, 161-191 (1978).
- Hartwell, L. H., Culotti, J., Reid, B. Genetic control of the cell-division cycle in yeast. I. Detection of mutants. Proc. Natl. Acad. Sci. U. S. A. 66, 352-359 (1970).
- Li, Z., et al. Systematic exploration of essential yeast gene function with temperature-sensitive mutants. Nat. Biotechnol. 29, 361-367 (2011).
- Ben-Aroya, S., et al. Toward a comprehensive temperature-sensitive mutant repository of the essential genes of Saccharomyces cerevisiae. Mol Cell. 30, 248-258 (2008).
- Harris, E. . The Chlamydomonas Sourcebook: Introduction into Chlamydomonas and Its Laboratory Use. , (2008).
- Dutcher, S. K. Mating and tetrad analysis in Chlamydomonas reinhardtii. Methods Cell Biol. 47, 531-540 (1995).
- Gill, S. S., Anjum, N. A., Gill, R., Jha, M., Tuteja, N. DNA damage and repair in plants under ultraviolet and ionizing radiations. Sci World J. 2015, 250158 (2015).
- Liu, Z., Wang, L., Zhong, D. Dynamics and mechanisms of DNA repair by photolyase. Phys. Chem. Chem. Phys. 17, 11933-11949 (2015).
- Francis, D. Cell cycle control and plant development. Annual Plant Reviews, Volume 32. Ann. Bot. 101, 1049-1050 (2008).
- Zachariae, W., Nasmyth, K. Whose end is destruction: cell division and the anaphase-promoting complex. Genes Dev. 13, 2039-2058 (1999).
- Merchant, S. S., et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions. Science. 318, 245-250 (2007).
- Ben-Aroya, S., et al. Toward a comprehensive temperature-sensitive mutant repository of the essential genes of Saccharomyces cerevisiae. Mol. Cell. 30, 248-258 (2008).
- Mnaimneh, S., et al. Exploration of essential gene functions via titratable promoter alleles. Cell. 118, 31-44 (2004).
- Schuldiner, M., et al. Exploration of the function and organization of the yeast early secretory pathway through an epistatic miniarray profile. Cell. 123, 507-519 (2005).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31, 827-832 (2013).
- Jiang, W., Brueggeman, A. J., Horken, K. M., Plucinak, T. M., Weeks, D. P. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryot. Cell. 13, 1465-1469 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır