Method Article
Alto Throughput Robotically Isolamento Assistida da temperatura sensível Lethal Mutantes em
Neste Artigo
Resumo
Temperature-sensitive (ts) lethal mutants are valuable tools to identify and analyze essential functions. Here we describe methods to generate and classify ts lethal mutants in high throughput.
Resumo
Systematic identification and characterization of genetic perturbations have proven useful to decipher gene function and cellular pathways. However, the conventional approaches of permanent gene deletion cannot be applied to essential genes. We have pioneered a unique collection of ~70 temperature-sensitive (ts) lethal mutants for studying cell cycle regulation in the unicellular green algae Chlamydomonas reinhardtii1. These mutations identify essential genes, and the ts alleles can be conditionally inactivated by temperature shift, providing valuable tools to identify and analyze essential functions. Mutant collections are much more valuable if they are close to comprehensive, since scattershot collections can miss important components. However, this requires the efficient collection of a large number of mutants, especially in a wide-target screen. Here, we describe a robotics-based pipeline for generating ts lethal mutants and analyzing their phenotype in Chlamydomonas. This technique can be applied to any microorganism that grows on agar. We have collected over 3000 ts mutants, probably including mutations in most or all cell-essential pathways, including about 200 new candidate cell cycle mutations. Subsequent molecular and cellular characterization of these mutants should provide new insights in plant cell biology; a comprehensive mutant collection is an essential prerequisite to ensure coverage of a broad range of biological pathways. These methods are integrated with downstream genetics and bioinformatics procedures for efficient mapping and identification of the causative mutations that are beyond the scope of this manuscript.
Introdução
Caracterização fenotípica de coleções mutantes sistemáticas de organismos-modelo é uma abordagem comprovada para dissecar complexidade celular. O unicelular Chlamydomonas reinhardtii algas verde haplóides tem um conjunto de genes de plantas-like, mas divergiram de plantas terrestres antes de uma duplicação do genoma da linhagem plantas terrestres 2. Em princípio, a falta de duplicação de gene e um ciclo de vida essencialmente haplóide facilita grandemente a perda de função abordagens genéticas. No entanto, ruptura direccionada de genes de interesse é praticamente impossível devido à falta de integração genómico homóloga eficiente. Uma biblioteca interrupção de inserção aleatória está em construção, combinado com identificação do local interrompido, até agora produzindo um conjunto de vestidos de 1.935 interrupções mapeadas representando 1.562 genes 3. No entanto, esta abordagem (esperado, em geral, para produzir mutações nulas) não é aplicável a genes essenciais. sensível à temperatura (TS) mutações podem ser recovered em genes essenciais, e métodos recentes permitem a identificação eficiente do gene mutado e a lesão causal. A análise fenotípica em alta temperatura, em seguida, fornece informação imediata sobre a função do gene mutado. Nós relatado no isolamento e caracterização de mutações letais ts em ~ 70 genes essenciais em Chlamydomonas, focando especialmente em genes envolvidos na progressão do ciclo celular e controlar 1,4.
Ts telas letais têm sido um pilar da análise genética de microrganismos durante décadas 5,6. Em princípio, uma característica desejável é a abordagem de "saturação", o que significa que todos os genes capazes de sofrer mutação ts letalidade são identificados por, pelo menos, um mutante, que permite uma análise completa. No entanto, na prática, vários factores limitam a abordagem à saturação. Em primeiro lugar, enquanto que quase todos os genes podem ser mutados para a perda de actividade a uma temperatura elevada, a eficiência de recuperação de tais mutantes varia ao longo de pelo menosuma ordem de magnitude 7,8. Portanto, uma tela aleatória começa a pegar visitas recorrentes em "passageiros frequentes" muito antes de saturação é abordado. Em segundo lugar, enquanto as mutações ts geralmente resultam em redução da função, eles podem não ser verdadeiros valores nulos a uma temperatura restritiva (e por outro lado, não são muitas vezes completamente funcional a uma temperatura permissiva). Este problema pode ser tratado com, em certa medida através da comparação múltiplos alelos; Se todos eles partilham um fenótipo comum, este é o mais provável para reflectir o resultado de simples inactivação do gene. Alelos múltiplos também são muito úteis para a identificação molecular definitivo da lesão causal 1. No entanto, o problema "passageiro frequente" significa que vários alelos em genes raramente atingidas pode ser difícil de recuperar.
Por estas razões, temos vindo a desenvolver um gasoduto reforçada para isolar e caracterizar fenotipicamente mutantes ts. Reunimos mais de 3.000 mutantes ts até agora, including cerca de 200 novas mutações do ciclo celular candidato. A análise molecular e fenotípica desta coleção, que já provavelmente inclui mutações na maioria ou em todos os caminhos de células-essencial, deverá proporcionar novos conhecimentos e hipóteses em biologia celular das plantas. Mais importante, esta conduta pode ser aplicado a qualquer microorganismo que cresce em agar para a construção de colecções de forma eficiente ts mutantes.
Uma nota sobre equipamentos: dois robôs são muito importantes para a eficiência deste procedimento (um seletor de colónia e uma combinação réplica chapeador / elevatória). Catadores têm tipicamente pinos de metal. colónias escolhidas são realizadas no ar sobre estes pinos para algum período (segundos a minutos, dependendo do modelo). Chlamydomonas morre em cerca de 20 segundos em um pino de metal no ar. Isto restringe a escolha do modelo para o organismo. assuntos precisão. O nosso selecionador colónia é razoavelmente precisa; no entanto, é um pouco violento na sua acção e possui alguma possibilidade de contaminação cruzada à base de pulverização. Não é usada a altaer do que o 384 densidade (4,5 milímetros espaçamento de centro centro); neste densidade, a precisão é completamente aceitável. O robô escolhendo chapeamento réplica / cereja (acessórios diferentes utilizados para estas aplicações) é muito mais lento na colheita, mas é preciso o suficiente para a densidade 1.536 (6.144 é um desafio, mesmo para este robô muito precisos; nós avaliamos esta densidade, mas não eleitos para usá-lo por causa de suas várias dificuldades). O robô não vai funcionar bem se as placas são carregados de forma desigual, etc. É importante ponto-verifique se as coisas certas estão acontecendo; é claro, o robô será executado sem supervisão e, em geral, tudo vai correr bem se as primeiras placas estavam corretas.
Protocolo
1. UV mutagênese
- Preparar um lote de 100 - 200 placas de agar rectangulares com Tris-Acetato-Fosfato (TAP) médias 9,10. Preparar estas placas a poucos dias e mantê-los no banco para secar a assegurar uma rápida absorção de as células em suspensão nos passos seguintes.
- Cultura Chlamydomonas células até 0,2-,5 densidade óptica (OD 750; ~ 2 dias) em 100 ml de TAP líquido sob luz, a 25 ° C e agitação a 100 rpm.
NOTA: mutagénese UV é realizada de forma independente em duas origens genéticas: Mat- Hygro r (confere resistência à higromicina B) e Mat + Paro r (confere resistência a Paromomycin). escolha do antibiótico é arbitrário, desde que os dois tipos de acasalamento têm resistências aos medicamentos complementares. - Verificar uma amostra de cada uma das culturas sob o microscópio para assegurar que as células são viáveis, saudável (natação e intacta), e sem contaminação.
NOTA: culturas Overgrown "crash" eperder viabilidade, aparecendo como "fantasmas" em microscopia de contraste de fase. Não manter culturas shaker indo uma vez que atingem a saturação. O fenômeno "fantasma" é facilmente detectável no passo 1.3. - Dilui-se a cultura a 0.003 OD 750. Enrole a garrafa com folha de alumínio para garantir a densidade homogênea, como a estirpe é móvel e nada direcionalmente em resposta à luz.
- Ajustar a densidade da suspensão com base na dose de UV prevista, de modo que representando a morte celular, a 200 - 600 colónias sobreviventes vai formar-se nas placas (Figura 1). Ver Tabela 1 para obter informações sobre os tempos de exposição UV.
- Anexar uma cassete de pequeno-tubo que se encaixa um dispensador de líquido e realizar uma série de lavagens para a esterilização, de acordo com as instruções do fabricante, para prevenir a contaminação.
- Utilizando um distribuidor de líquido de 8 x 12, 4 x 96 distribuir gotas de 2 ul de cada uma em placas rectangulares (Figura 1 ). Toque levemente na borda da placa para assegurar a fusão de todas as gotas para formar uma folha fina de líquido imediatamente e cobrir as placas para evitar a exposição à luz.
- Para assegurar uma dispersão célula muito uniforme único, utilizar placas secas, como mencionado acima, e rapidamente cobrir as placas para impedir que as células de natação em resposta à luz. Manter o nível de placas cobertas e no escuro até que todo o líquido é absorvido.
- Colocar as placas sob uma lâmpada de UV germicida (30 watt lâmpada UV germicida) por períodos de tempo determinados empiricamente para se obter um rendimento óptimo de mutantes ts- entre os sobreviventes. Aqui, usar tempos de 0,5-1,5 minutos, a uma distância de 40 - 50 cm a resultar em 90 - 99,9% de morte. Sobreviventes contêm 100 - 1.000 mutações pontuais induzidos por UV, de que ~ sequências codificantes de 10% de mudança.
- A fim de assegurar a máxima potência de irradiação UV sem reversão devido ao DNA dependente da luz reparar 11,12, trabalho no escuro a este passo e imediatamente a embalarplacas em uma caixa escura após a irradiação.
- Manter as placas no escuro durante 8-24 h à temperatura ambiente.
- Colocar as placas em uma incubadora a 21 ° C com iluminação, para formar colónias. A formação de colónias leva ~ 10 dias. Certifique-se de envolver as placas com sacos de plástico e adicionar papel absorvente dentro para apagar-se a condensação de líquido. ciclos de evaporação e condensação de outra forma pode fornecer rotas filme líquido para os contaminantes para entrar nas placas.
- Carregar as placas nas pilhas relevantes como fontes para picking colónia robótica (Figura 2). Escolha colónias para 384 matrizes em placas rectangulares, e crescê-las a 21 ° C com iluminação (~ 1 semana).
- Condensar a 384 matrizes em uma 1.536-matrizes (4: 1) usando um robô-plaqueamento de réplicas (Figura 3), e permitir que as placas se crescer durante ~ 3 dias a 21 ° C incubadora.
- Replicar os 1.536-matrizes para duas placas de cada um e colocar um na C incubadora de 21 ° (permissivatemperatura) e o outro numa incubadora de 33 ° C (temperatura restritiva). Na sequência de 24 horas, replicar as placas de 33 ° C a um novo conjunto de placas pré-aquecido, e colocá-los no 33 ° C incubadora.
Observação: A razão para isto é que o chapeamento secundário mutantes ts letal pode, em alguns casos acumular biomassa substancial, mesmo que as células são presos no primeiro ciclo celular após o plaqueamento. A réplica secundária elimina este sinal e aumenta grandemente a sensibilidade. - Fotografar as placas com uma câmera digital após 3 dias de crescimento a 33 ° C e 5 dias de crescimento a 21 ° C. Segure as placas em um quadro fixo. Usar uma "grelha de placa" marcado com nove indicadores de alinhamento que é fotografada em conjunto com as placas de cultura (Figura 4). placas de cultura de fotografia como alternada emparelhado 21 ° (21/33) as imagens 33 ° C C e.
NOTA: os tempos de incubação diferentes são usados para equalizar crescimento desde o tipo selvagem cresce significativamentemais rápido a 33 ° C do que a 21 ° C.
2. Identificação dos candidatos mutantes ts: Primeira Tela
- Processar os pares 21/33 imagens das chapas com um costume Matlab software de análise de imagem para eliminar o fundo e para o segmento as imagens em um 1.536-matriz. O programa irá determinar a biomassa detectado (intensidade total de pixels) em cada posição (Figura 5).
NOTA: O software (fornecida no SI juntamente com instruções) vai usar a imagem da grade de placa para determinar as localizações de células (entradas individuais) em uma 1536-matriz no alinhamento ampliação e placa utilizada e calcular a intensidade total de pixels em cada célula . Estes valores para cada mutante são então comparados com os parâmetros ajustáveis para determinar o crescimento requerida a 21 ° C em relação a um TS + padrão e o grau de temperatura-sensibilidade, definida como: S (Mut 33) / S (WT 33) / S (Mut 21) / S (WT 21), em que S é o sinal (pixeltensity após a subtracção de fundo), Mut é um mutante individual, e "WT" é um escolhido aleatoriamente colónia não-sensível à temperatura (estirpe mutagenizada que tinha ts + fenótipo). Crescimento a 21 ° C é definido como S (Mut 21) / S (WT 21). Nesta primeira tela, aplicar critérios de selecção relaxado (permitindo relativamente baixo crescimento a 21 ° C e um grau relativamente baixo de sensibilidade à temperatura) para manter a falsa baixa taxa negativa. - Coloque a lista de colónias seleccionadas gerados pelo software como um arquivo de instrução para a colheita robótica (tipicamente em um 384-array) single-colônia. Preparar as placas de origem e de destino de acordo com as instruções de robótica e escolher colónias a matriz (Figura 6).
NOTA: catadores convencionais exigem um arquivo de instruções em algum formato, como .csv, .txt ou .xls. Todos os catadores terá a capacidade de ser orientada para o arquivo; diferentes formatos exigirá edição menor do código MATLAB (código-fonte fornecido). - Coloque as placas-alvo na C incubadora de 21 ° para ~ 5 dias para crescer uma placa de estoque.
3. Identificar mutantes TS: Segunda Tela
- Repita o passo 2.1 para testar novamente colónias escolhidas. Tipicamente 30 - 50% das colónias irão testar novamente ts como claras letais, para um rendimento de 2% - 5% em relação ao ts letais colónias sobreviventes iniciais mutagénese UV.
- Repita o passo 2.2 para escolher os letais ts duas vezes-selecionados, mas com um arquivo de instrução modificado projetado para colônias de matriz em blocos de 100 colônias em placas retangulares em um 384-densidade. Isto é conveniente para o exame microscópico no passo seguinte. O formato de arquivo de instrução é especificado em tempo de execução pelo código MATLAB.
- Certifique-se incluir várias colónias WT como um controle e colocar as placas a 21 ° C durante ~ 5 dias.
4. Determinação Fenótipo inicial
- Replicar as placas de 100 blocos dispostos na etapa 3.2 e colocá-los no C incu 21 °bator para ~ 2 dias para obter colónias recém-crescimento.
- Replicar a nova cópia das placas 100-bloco (4.1) para três cópias. Coloque uma cópia na incubadora a 21 ° C e um C na incubadora de 33 °, como controles.
- Coloque a terceira cópia ( "screening placas") em uma configuração robótico, e identificar as colónias com pinos tempo tocou com água esterilizada.
NOTA: células Chlamydomonas fixadas ao agar roboticamente tendem a terra inicialmente como um local bastante densa de células, com poucas células individuais disponíveis para inspeção microscópica. Para otimizar as colônias para a inspecção microscópica, detectar as células inicialmente transferidos com uma gota de água (o volume de água transferido pelas longas pinos robóticos é ~ 100 nl). Isto resulta na dispersão das células num raio pequeno (~ 1 mm) sobre o centro de fixação inicial, com muitas células individuais isoladas. - Tome fotomicrografias de uma região de cada ponto das placas de triagem no momento 0 (enquanto ainda único, células não divididas) (A Figura 7) e colocar as placas a 33 ° C durante a incubação. Determinar a localização de imagem, através do controlo manual do estágio de um microscópio de dissecação tétrade modificada ajustado para dar paradas no espaçamento de 4,5 mm de centro a centro de uma matriz de 384 densidade.
- Remova as placas de rastreio do C incubadora de 33 ° e tomar microfotografias, como na etapa 4.4, em diferentes pontos de tempo (10 h, 20 h, 48 h). Certifique-se a fase, o suporte da placa, e o controlador de fase são precisamente calibrado para obter imagens das mesmas células em cada ponto de tempo. Execute aquisição photomicrograph rápido (~ 10 min).
- Use a segunda cópia no 33 ° C incubadora para verificar o fenótipo ts e para se certificar de que as flutuações de temperatura durante a aquisição de imagens não têm grande efeito sobre ts fenótipo.
- Analisar imagens microscópicas e seleccionar para os mutantes com base nos critérios desejados (Figura 8). Manchar o conjunto selecionado final em uma placa de ágar de 96 vestidos. Certifique-se de que cadaplaca contém mutantes do mesmo tipo de acasalamento e resistência aos medicamentos.
- Para cada placa, incorporar as duas últimas colunas um (mutação consulta) positivo e um controlo negativo (WT) para o ensaio de complementação.
5. Complementação e Linkage ensaio de novos mutantes para "Frequent Flyers"
- Transferir grandes quantidades de colónias dispostas de forma gameta-indução livre de azoto 10 em microplacas de 96 poços (densidade de cada colónia deve ser cerca de 0,2 OD). Incubar as placas sob a luz (13-20 W mercúrio lâmpadas) durante ~ 5 horas para permitir que a gametogênese.
NOTA: Este passo pode ser realizado, quer com uma configuração robótico replicar manualmente ou com um dispositivo de metalização simples. - Suspender consultas com os tipos de acasalamento opostos que abrigam as cassetes de resistência alternativos em tubos com meio de gametas por indução livre de azoto 10 para gametogênese.
- Misturar as amostras em uma placa-alvo em um MIXT acasalamentovolume de Ure de 20 ul (Figura 9). Seguindo ~ 10 min sob a luz, spot 5 mL de cada poço duas vezes: uma em uma placa TAP para testes de ligação e uma vez na TAP + 5? M Paro + 9 mM Hygro para testes de complementação.
- Incubar as placas de ligação no 21 ° C incubadora durante a noite e, em seguida, envolvê-los em papel alumínio. Mantê-los no escuro durante 5 dias para permitir a formação zygospore.
- Incubar as placas de teste de complementação para ~ 10 dias à luz a 21 ° C.
NOTA: Os valores de drogas são calibrados para permitir a sobrevivência de diplóides duplamente heterozigotos, mas eles ainda são suficientes para eliminar os haplóides de acasalamento. Esses valores foram calibrados para integrações cassete de resistência padrão utilizadas neste projeto específico; com novas integrações, as doses devem ser recalibrado. A maior parte da biomassa é verificado para ser diplóides por citometria de fluxo (Figura 9), embora a um nível variável de haplóides (provavelmente da meiose e crescimento de resistente duplamentesegregantes) é geralmente observado como bem. - Replicar as placas de teste de complementação em duas cópias para a identificação fenótipo ts-. Coloque uma cópia a 21 ° C e uma cópia a 33 ° C durante ~ 5 dias.
- Colónias de ensaio para o fenótipo ts-, como descrito na secção 2.1 (Figura 5). As colónias que não estão complementando com a consulta provavelmente representam alelos do mesmo gene que a consulta (diplóides hetero-alélicas para mutações no mesmo gene).
- Para os testes de ligação, seguindo o passo 5.4, mudar as placas de volta à luz para permitir a meiose e crescimento de segregantes haplóides para ~ 7 dias.
- Replicar placas de ensaio de ligação a TAP + 10 uM e 10 uM Paro Hygro para seleccionar para os descendentes de duplos-resistente (prevê-se ser de 25% da progenia haplóide, uma vez que as cassetes são não ligados) e incubar a 21 ° C durante uma semana.
NOTA: Aumentar a dosagem da droga para haplóides resistentes duplamente. - colónias de teste para o fenótipo ts-, como eun passo 2.1.
NOTA: Um fenótipo ts- é esperado (e observada) para os mutantes no mesmo grupo de complementação como a consulta. Além disso, um fenótipo ts- no ensaio de ligação, para um mutante que complementa a consulta, pode reflectir ligação apertada entre a consulta e a nova mutação. Mutantes que complementam as consultas testados são novos genes prováveis que entrarão no gasoduto para a identificação de bioinformática da lesão causal, e, finalmente, para posterior análise fenotípica.
Resultados
Mostramos um gasoduto acelerado para isolar mutantes ts em Chlamydomonas. As células são dispensadas em placas de agar, e logo após a validação rápida sob o microscópio para a densidade de célula única, as placas são irradiadas UV (Figura 1). Irradiados colónias típicas são identificados e colhidos em um formato vestida depois de 10 dias de crescimento a uma temperatura permissiva (Figura 2). As placas resultantes no formato de 384 são fundidas a uma matriz-1536 (Figura 3). A partir desses primeiros passos da coleta de colônias irradiados, temos vestiu ~ 200.000 colônias até agora. A densidade da suspensão é ajustada com base na dose de UV planeado de modo a que, representando a morte, a 200 - 600 colónias sobreviventes vai formar-se nas placas. Três tempos de exposição UV (1,5 min, 1 min e 0,5 min) e três densidades foram testados em conformidade (Tabela 1). Empiricamente, o tempo de exposição de 1,5 min produziu a maior parte dos TS- mutantes (~ 50%); No entanto, de longe, 1 min produziu a maior parte dos candidatos do ciclo celular. Portanto, futuras rodadas de mutagênese UV foram feitos com apenas 1 min. Uma preocupação importante é a salpicos durante a colheita inicial e a contaminação cruzada (especialmente nos formatos de alta densidade). Isso pode resultar em duplicação e ainda fenotipagem do mesmo mutante duas vezes. Para minimizar a probabilidade de tal cenário, ter o cuidado de recolher colónias com o tamanho ideal, e certifique-se que as colônias adjacentes não são apanhados no ensaio inicial.
Em seguida, dois ensaios sequenciais fenótipo TS- (Figura 5) foram realizadas, e cerca de 3.000 ts- mutantes foram isolados e caracterizados fenotipicamente por microscopia de lapso de tempo (Figura 8). Devido ao enfoque biológico no estudo do ciclo celular de interesse em fenótipos que atendam a determinados critérios, não estamos interessados em recolher mais de dois alelos em cada alvo gene. Por conseguinte, foram realizados testes de complementação e ligação com genes já caracterizados com mais de dois alelos (query) contra candidatos recentemente recolhidos para remover genes altamente recorrentes do gasoduto a jusante (Figura 9).

Figura 1: Uniforme disseminação de células Unmutagenized e UV mutagênese. (um) 384 x 2 gotas ul são dispensados numa placa de ágar usando um distribuidor de reagente. (b) placas de distribuição aleatória são testados ao microscópio para verificar a densidade de uma única célula e são irradiadas com UV de uma exposição de 1 min. Barra de escala = 50 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. As colónias mutagenizadas-UV escolhido para o 384-matrizes. (A) As células irradiadas com UV individuais são cultivadas durante ~ 10 dias em colónias visíveis. Barra de escala = 2 cm. (b) Programa de Análise de imagem reconhece colônias separáveis de acordo com certos parâmetros e roboticamente matrizes los em 384 placas. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Fusão ao 1536-matriz. Quatro placas de 384 formato são mesclados a um 1.536-placa; uma vez crescidas, elas são replicados para testar de novo para o fenótipo ts-. Por favor clique aqui para ver umaversão maior desta figura.
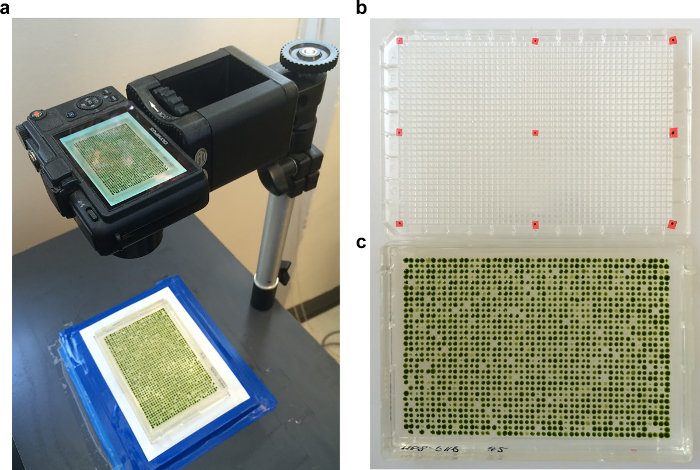
Figura 4. Imaging para quantificação. (a) As placas são mantidos em um quadro sob um stand fotografia documento de forma que todas as placas em uma série são fotografados com uma ampliação idêntica e posicionamento. (b) A primeira imagem é de uma microplaca 1536 bem com pontos vermelhos colocados em cantos e pontos médios. Este "grid-plate" imagem define a posição da matriz. (C) Exemplo de uma matriz-1536 após a incubação. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5. Identificação do fenótipo ts- por SemiAnálise de Imagem -automated. imagens placa são analisados por software Matlab personalizado (fornecida no SI). A imagem é automaticamente segmentado em células de matrizes (96, 384, ou 1.536), e o sinal em cada uma das células é quantificado. Crescimento a 21 ° C é marcada a azul, e crescimento a 33 ° C é marcado em amarelo. Colónias que apresentam crescimento significativamente maior a 21 ° C em comparação a 33 ° C (padronizado para ts +) são selecionadas e marcadas em quadrados pretos com um ponto verde. Estas escolhas podem ser editadas manualmente. seleções finais são transferidos para um arquivo usado pelo robô-picking colônia. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6. Picking Robotic de Candidatos letais ts primeira rodada. A cereja-picking robô segue instruções a partir de um ficheiro gerado como descrito no passo 2.1 para escolher candidatos para uma nova matriz. O painel superior mostra o carregamento de um pino esterilizado. O painel inferior mostra a separação precisa de uma determinada colónia na placa de fonte. Por favor clique aqui para ver uma versão maior desta figura.

Figura Screening 7. Time-lapse para classificação inicial dos ts fenótipos letais. Os clones que passaram duas rondas do protocolo de rastreio ilustrada na Figura 5 são replicadas para placas com uma densidade celular de tal modo que as células individuais podem ser resolvidos microscopicamente. Um microscópio de dissecção tetrad modificado é usado para identificar posições em que microfotografias são tomadas após 0 h, 10 h e 20 h incubações um t 33 ° C. Por favor clique aqui para ver uma versão maior desta figura.
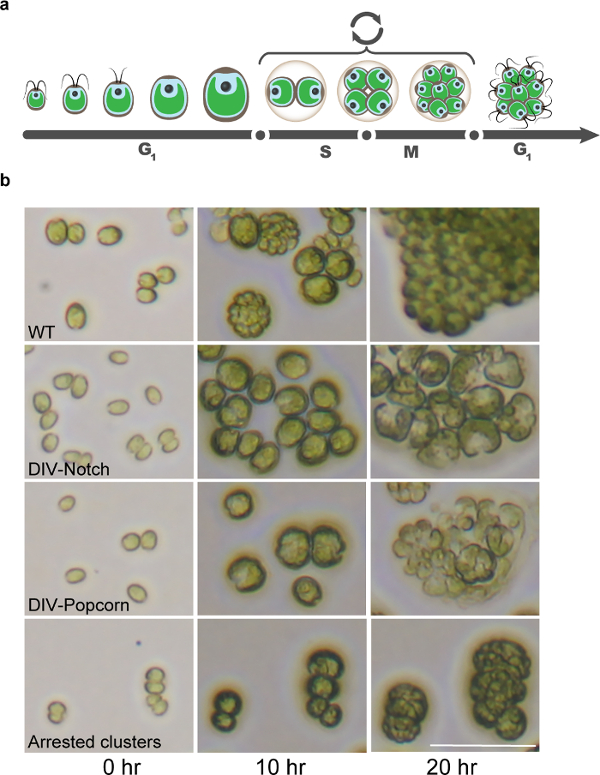
Figura 8: Os Mutantes ciclo celular Chlamydomonas identificados pela Time-Lapse Microscopia. (a) Ilustração do ciclo celular única Chlamydomonas descreve a fase G1 longa caracterizada pelo crescimento celular, seguido por ciclos de SM de fissão, que acabam com a eclosão de células filhas recém-nascidas. (b) As imagens microscópicas demonstrar células WT durante o ciclo celular e a identificação de mutantes típicos do ciclo celular que não conseguem completar a mitose. Barra de escala = 50 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 9: Complementação e Teste Linkage. (a) Uma consulta resistente aos antibióticos (por exemplo, Hygro) com um gene mutado frequentemente repetido é atravessada em uma placa de 96 poços com um conjunto de mutantes do tipo de cruzamento oposto que abrigam uma segunda cassete de resistência a antibióticos (por exemplo, Paro). placas de complementação produzir fracção elevada de diplóides como mostrado por coloração do ácido nucleico e análise de citometria de fluxo (painel inferior esquerdo em um). (b) A mistura de acasalamento é testado tanto para complementação em diplóides e de ligação em progênie meiótica double-resistente. O controlo positivo é a própria consulta no tipo de cruzamento oposto, e, como esperado, mostra o fenótipo ts- a 33 ° C, enquanto que o controlo negativo é WT e mostra o fenótipo TS +. As colônias circundadas não mostram nenhuma complementação com a consulta e são, portanto, nalelos TS- ew para o gene da consulta. Estes são geralmente excluídos da caracterização adicional, uma vez que apenas "passageiros frequentes" são no conjunto de teste de complementação. Por favor clique aqui para ver uma versão maior desta figura.
| Tempo | OD | Colónias escolhido (#) | fenótipo Ts | Candidatos do ciclo celular |
| 1,5 ' | 0,012 | 6000 (médio = ~ 200) | 200 (3,3%) | 7 (3,5%) |
| 1 ' | 0,003 | 11.000 | 131 (1,19%) | 15 (11,4%) |
| (Média = ~ 360) | ||||
| 0,5 " | 6E-04 | 9000 | 40 (0,45%) | 1 (2,5%) |
| (Média = ~ 300) |
Tabela 1: Calibração de irradiação Times maximizar o rendimento do ciclo celular candidatos mutantes. Três tempos de irradiação foram testadas (30 placas de cada) com ODs correspondente para garantir número de colónias sobreviventes (200 - 600).
Discussão
O gasoduto descrito aqui para isolamento de alto rendimento de mutantes letais ts garante que, presumivelmente, todos os caminhos celulares essencial do genoma Chlamydomonas são representados. Os dois passos mais críticos para recolha eficiente dos potenciais genes do ciclo celular e para a eliminação do repetitivas alelos "passageiro frequente" são: 1) a definição coerente de características fenotípicas de prisão para ciclos celulares incompletas e 2) o ensaio de complementação paralelo contra a já identificados consultar genes para ampliar a coleção com os recém-isoladas.
Quando sincronizado por ciclos de luz-escuro, Chlamydomonas cresce fotossíntese durante o dia e aumenta de tamanho de célula> 10x sem qualquer replicação do DNA ou célula divisão 13. Aproximadamente coincidente com o início da noite, as células, em seguida, submetidos a vários ciclos alternados de replicação do ADN, mitose e divisão celular (Figura 8). Este schem regulamentare fornece uma distinção natural entre genes necessários principalmente para o crescimento celular e integridade e genes necessários especificamente para o ciclo de divisão celular. Descobrimos que as 10 hr e 20 hr pontos de tempo são muito informativos para uma fenotípica bruto inicial cortar 1. As grandes classes de mutantes letais ts que reconhecemos atualmente, com base nessas imagens (ver SI em Tulin e Cruz, 2014) 1, são: Notch, pipoca, Round, pequeno, médio, lise cedo, e de ciclos múltiplos (Figura 8 ).
As três categorias mais relevantes nós focar são Notch, pipoca, e Round. O "nível" e fenótipos "pipoca" foram mostrados anteriormente para ser característica da maioria das lesões específicas do ciclo celular (por exemplo, quinase dependente da ciclina mitótica, maquinaria de replicação de DNA, e topoisomerase II) 1. O aparecimento de um (Notch) ou múltipla (pipoca) aparentes planos de divisão celular incipiente, mas vencida é uma morfol convenienteIndicador ogical da iniciação do ciclo celular. Estes mutantes geralmente apresentam defeitos de crescimento pouco ou nenhum, com o aumento do volume celular semelhante ao WT na marca de 10-hr. O entalhe e pipoca fenótipos são evidentes às 10 horas e estão totalmente desenvolvidos (frequentemente associado a lise celular) por 20 horas. células "round" crescer de forma semelhante ao WT, mas com produção muito reduzida de aviões divisão incipientes aparentes, produzindo, assim, células grandes, rodada presos. Mutantes anteriores nessa categoria caíram em componentes do complexo 14 ou em genes que promovem a anáfase necessários para a função dos microtúbulos (co-fatores de dobra de tubulina, complexo anel gama-tubulina) 1. Em tempos mais recentes, essas células apresentam frequentemente lise celular pronunciado.
"Pequeno" e células "médio" crescer tanto insignificante (Small) ou significativamente menos do que WT (Medium). Muitos destes mutantes identificados até à data têm lesões nos genes cujas anotações sugerem papéis em cellula básicaprocessos de crescimento r (tradução ou biogênese membrana). A principal discriminação microscópica entre Medium and Round repousa sobre a quantidade de crescimento em 10 hr (Round: como WT; Medium: reduzida). Como as categorias pequenas e médias são bastante grandes e provavelmente refletem lesões em uma grande variedade de caminhos celulares, não estamos tentando saturar essas categorias; no entanto, nós queremos molecularmente identificar representantes da classe para entender fenótipos de perda de diversos caminhos. Duas categorias não estudadas são as seguintes: 1) o início de lise mutantes que perdem integridade (perda de cor verde, perda de refractility) pela marca 10-h, com pouca evidência de crescimento celular antes e 2) os múltiplos ciclos. As células proliferam de forma semelhante ao WT, às 10 e 20 horas, embora eles apresentam uma completa incapacidade de realizar a proliferação de mais longo prazo.
Estamos na maior parte caracterizando "notch", "pipoca" e "round" e excluir as células pequenas e médias redondas, bemcomo mutantes com vazamentos que poucas divisões celulares completos. Isto é principalmente para assegurar que as características celulares básicas, tais como o crescimento e a integridade da membrana, são funcionais e enriquecer a probabilidade de genes relacionados com a divisão. Esta abordagem é encontrada para ser empiricamente eficiente; No entanto, pode ser que um gene do ciclo celular é pleiotrópica e tem funções adicionais no início G1, antes da divisão real. Nesses casos, que esperamos ser raro, são perdidas. De modo mais geral, o nosso objectivo de prisão homogênea, que a grande probabilidade é devido a uma mutação causal que é uma proteína completamente disfuncional. No entanto, pela mesma razão, como acabado de descrever, pode haver vários pontos de captura e, por conseguinte, é aconselhável uma certa flexibilidade na escolha dos candidatos.
A fim de enriquecer a coleção com genes recém-identificados, os candidatos seleccionados serão analisadas para complementação. Exigimos ts- no controle positivo (consulta contra mutação query) e ts + no controle negativo (Query contra WT). Novos mutantes no mesmo grupo de complementação como a consulta são ts-. A associação ao mesmo grupo de complementação reflete quase invariavelmente uma lesão molecular no mesmo gene (este tem sido o caso para cada tal gene nós testamos). Portanto, para "passageiros frequentes", este critério é excludente para posterior caracterização. Os mutantes que não estavam nos mesmos grupos de complementação como as consultas são candidatos testados de novos genes e são ainda caracterizados por bioinformática e ferramentas experimentais. recuperação altamente variável de TS- alelos em diferentes grupos de complementação é um fenómeno de que o bem-conhecido é, a variabilidade é significativamente maior do que o ruído Poisson, devido à grande variabilidade intrínseca de mutabilidade para TS- entre os diferentes genes. Causas podem incluir diferenças termolabilidade intrínsecas; tamanhos diferentes de proteínas; a presença de uma proteína como um monómero contra um grande como, complexo estabilizado; e hot spots mutagénicos. Isso é quase um nuisa purance. No entanto, um resultado favorável resultante é que a lista de "passageiro frequente" não é longo (com apenas alguns alvos que ocupam a maior parte da lista), de modo que o teste de complementação de trabalho intensivo não é uma grande empresa, até as fases posteriores do projeto.
Como uma abordagem complementar, foi realizado um ensaio de ligação. Neste ensaio, progenies duplos resistentes são seleccionadas e são testados para o fenótipo ts-. Um fenótipo ts- é esperado (e observada) para os mutantes no mesmo grupo de complementação como a consulta ou para mutações firmemente ligadas. Para cada um dos genes testados, uma descendência WT é esperado para aparecer (TS + fenótipo) em uma certa probabilidade dependendo da distância genética. Nós estimamos que existam cerca de 100 zigosporos para cada acasalamento nesses locais. Assumindo 100% de eficiência meiose, isso resultará em progênie resistentes-double-droga cerca de 100 das cassetes de resistência a drogas não ligados (25% da progênie meiose, quatro por meiose, devido à Mherança endelian). Este também seria o caso para TS- mutações, onde 25% das progênies serão duplo mutante, e 25% será WT se as mutações de consulta e de teste são desvinculados. Portanto, fora da progênie-double-resistente, 25% será WT (cerca de 25 células). Este é o caso de mutações completamente não ligados; no entanto, a ligação moderada (dentro de ~ 20 cm, cerca de 2 Mb, ou 2% do genoma 115) irá reduzir fortemente ou eliminar o ts + sinal. No caso da ligação da mutação testados para a cassete de antibiótico, TS + haplóides que são duplo-resistentes a fármacos estão presentes em quantidades muito baixas. Este manifesta-se como falha aparente para recombinar-se com todos os mutantes testados, apesar complementar todos os mutantes testados, um resultado aberrante que é facilmente observado; Em tais casos, o retrocruzamento vai resolver o problema.
Tanto a partir do conhecimento prévio e da análise da sequência, esperamos genes do ciclo celular na Chlamydomonas em cerca de 500 genes 2, embora most, mas provavelmente não todos, são essenciais. Vamos avaliar a necessidade de rodadas adicionais de mutagénese como mais mutantes são recolhidos e o nível dos aumentos de saturação.
Este procedimento destina-se exclusivamente para o estudo de processos biológicos essenciais e os genes e proteínas que as realizam. Outras metodologias para gerar existem perturbações nos genes essenciais (por exemplo, a transformação de alelos mutagenizados aleatoriamente 16, alelos condicionalmente transcritas 17, ou alelos hipomórfico 18). No entanto, todos eles necessitam de recombinação homóloga, que é fortemente suprimida em Chlamydomonas vegetativo. O cluster, regularmente espaçadas curta repetição palíndromo (CRISPR) / sistema de Cas9 foi estabelecida como uma poderosa ferramenta para a modificação do gene 19; no entanto, ainda está para trabalhar de forma eficiente em Chlamydomonas 20. Fundamentalmente, todos estes métodos requerem conhecimento prévio do alvo. Esta é uma restrição severase se deseja ter a possibilidade de aprender algo novo! A nossa abordagem irá produzir mutações que identificam genes essenciais, independentes de qualquer conhecimento prévio. Portanto, no atual nível de tecnologia, isolamento de ts mutações aleatórias seguidas de identificação gênica por sequenciamento de profundidade pode ser o método mais eficiente de ganhar rápida entrada em biologia celular microbiana no superkingdom planta.
Identificação de mutações causais (de entre ~ 100 de codificação-sequência mudando mutações em cada clone) está além do escopo deste artigo. Sequenciamento de profundidade de piscinas de segregantes agrupados 1 é eficaz, mas exige muito trabalho. Uma estratégia piscina combinatória para a determinação de todas as mutações em um grande número de estirpes, após sequenciação de um pequeno número de piscinas, é muito eficaz em termos de custos e de mão-de-. Uma nova estratégia para combinatória sequenciamento de segregantes agrupados está em desenvolvimento que permitirá a identificação de mutações causais em dezenas de mutantes SIMultaneously em uma única corrida de seqüenciamento (em preparação). Essas eficiências são muito importantes para permitir o passo de identificação de genes críticos para manter o ritmo com o rápido acúmulo de mutantes que é possível através dos procedimentos descritos aqui.
Divulgações
Os autores declaram não haver interesses financeiros significativos.
Agradecimentos
Agradecemos aos membros do laboratório Cruz para aconselhamento e discussão útil. Este trabalho foi apoiado pelo PHS 5RO1-GM078153 e por um prêmio Júnior Fellow do Simons Fundação para Michal Breker.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment: | |||
| Hudson RapidPick colony picker | Hudson Robotics | ||
| MultiDrop Combi Reagent Dispenser | Thermo Scientific | 5840300 | |
| Small tube metal tip cassette | Thermo Scientific | 24073295 | |
| Singer RotoR replica-plating robot | Singer Instruments | Very essential for the process. For lower scale screenings you can use an in-house manual tool | |
| Singer single-colony picking attachment (‘Stinger’) | Singer Instruments | Can be picked manually, however for large scales it is nearly impossible | |
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| SYTOX Green Nucleic Acid Stain | ThermoFisher Scientific | S7020 |
Referências
- Tulin, F., Cross, F. R. A microbial avenue to cell cycle control in the plant superkingdom. Plant Cell. 26, 4019-4038 (2014).
- Cross, F. R., Umen, J. G. The Chlamydomonas cell cycle. Plant J. 82, 370-392 (2015).
- Li, X., et al. An Indexed, Mapped Mutant Library Enables Reverse Genetics Studies of Biological Processes in Chlamydomonas reinhardtii. Plant Cell. 28, 367-387 (2016).
- Tulin, F., Cross, F. R. Cyclin-Dependent Kinase Regulation of Diurnal Transcription in Chlamydomonas. Plant Cell. 27, 2727-2742 (2015).
- Simchen, G. Cell cycle mutants. Annu. Rev. Genet. 12, 161-191 (1978).
- Hartwell, L. H., Culotti, J., Reid, B. Genetic control of the cell-division cycle in yeast. I. Detection of mutants. Proc. Natl. Acad. Sci. U. S. A. 66, 352-359 (1970).
- Li, Z., et al. Systematic exploration of essential yeast gene function with temperature-sensitive mutants. Nat. Biotechnol. 29, 361-367 (2011).
- Ben-Aroya, S., et al. Toward a comprehensive temperature-sensitive mutant repository of the essential genes of Saccharomyces cerevisiae. Mol Cell. 30, 248-258 (2008).
- Harris, E. The Chlamydomonas Sourcebook: Introduction into Chlamydomonas and Its Laboratory Use. , Elsevier Academic Press. (2008).
- Dutcher, S. K. Mating and tetrad analysis in Chlamydomonas reinhardtii. Methods Cell Biol. 47, 531-540 (1995).
- Gill, S. S., Anjum, N. A., Gill, R., Jha, M., Tuteja, N. DNA damage and repair in plants under ultraviolet and ionizing radiations. Sci World J. 2015, 250158(2015).
- Liu, Z., Wang, L., Zhong, D. Dynamics and mechanisms of DNA repair by photolyase. Phys. Chem. Chem. Phys. 17, 11933-11949 (2015).
- Francis, D. Cell cycle control and plant development. Annual Plant Reviews, Volume 32. Ann. Bot. 101, 1049-1050 (2008).
- Zachariae, W., Nasmyth, K. Whose end is destruction: cell division and the anaphase-promoting complex. Genes Dev. 13, 2039-2058 (1999).
- Merchant, S. S., et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions. Science. 318, 245-250 (2007).
- Ben-Aroya, S., et al. Toward a comprehensive temperature-sensitive mutant repository of the essential genes of Saccharomyces cerevisiae. Mol. Cell. 30, 248-258 (2008).
- Mnaimneh, S., et al. Exploration of essential gene functions via titratable promoter alleles. Cell. 118, 31-44 (2004).
- Schuldiner, M., et al. Exploration of the function and organization of the yeast early secretory pathway through an epistatic miniarray profile. Cell. 123, 507-519 (2005).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31, 827-832 (2013).
- Jiang, W., Brueggeman, A. J., Horken, K. M., Plucinak, T. M., Weeks, D. P. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryot. Cell. 13, 1465-1469 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados