Method Article
פרוטוקול אופטימיזציה כדי לנתח הגליקוליזה מיטוכונדריאלי הנשימה לימפוציטים
* These authors contributed equally
In This Article
Summary
The study of metabolism is becoming increasingly relevant to immunological research. Here, we present an optimized method for measuring glycolysis and mitochondrial respiration in mouse splenocytes, and T and B lymphocytes.
Abstract
לימפוציטים להגיב למגוון של גירויים באמצעות הפעלת מסלולי איתות תאיים, אשר בתורו מוביל לשגשוג הסלולר המהירה, הגירה והבחנה, וייצור ציטוקינים. כל האירועים הללו הם קשורים באופן הדוק את מצב האנרגיה של התא, ולכן לומד את המסלולים מייצרי אנרגיה עשוי לתת רמזים לגבי הפונקציונליות הכללית של תאים אלה. מנתח השטף התאי הוא מכשיר נפוץ להערכת הביצועים של הגליקוליזה ונשימה המיטוכונדריה סוגי תאים רבים. מערכת זו נעשה שימוש כדי ללמוד תאים חיסוניים כמה דיווחים שפורסמו, עדיין פרוטוקול מקיף מותאם במיוחד עבור לימפוציטים חסר. לימפוציטים הם תאים שברירי ששורדים גרועים בתנאי vivo לשעבר. לעתים קרובות תת הלימפוציטים הם נדירים, ועבודה עם מספרים סלולריים נמוכים היא בלתי נמנעת. לפיכך, אסטרטגיית הניסוי הנותן מענה לקשיים אלה נדרש. כאן, אנו מספקים פרוטוקולהמאפשר בידוד מהיר של לימפוציטים קיימא מרקמות הלימפה, ועל הניתוח של המדינות המטבולית שלהם מנתח השטף התאי. יתר על כן, אנו מספקים תוצאות ניסויים שבהם הפעילויות המטבולית של תת הלימפוציטים כמה בצפיפויות תאים שונים הושוו. מקרים אלה מצביעים כי הפרוטוקול שלנו יכול לשמש כדי להשיג תוצאות עקביות היטב סטנדרטיות גם בריכוזי תא נמוכים, וכך יכולה להיות שהיא כוללת יישומים רחבים במחקרים עתידיים התמקדות באפיון אירועים מטבוליים בתאי מערכת חיסוניים.
Introduction
התגובה החיסונית נגד אנטיגנים איזון הדוק מוסדר בין ההפעלה החיסונית דיכוי המערכת החיסונית. הפעלה חיסונית כונני התפשטות נדידת תאים מהירים, כמו גם ייצור ציטוקינים, הפרשת נוגדנים phagocytosis גדל ו בתגובה את החומר מהגוף, ואילו דיכוי מערכת חיסוני פשוט מעכב את האירועים הללו, ולכן הוא חשוב במניעת 1-6 תגובות חיסוניות מיותרות. מחקרים שנעשו לאחרונה הראו כי קיים קשר ישיר בין מצב ההפעלה של תאי מערכת החיסון ופעילות מסלולים מטבוליים שונים 7. תאי חיסון יכולים לעבור בין המדינות ההמנוחות והופעל על ידי מעבר מסלולים להפקת אנרגיה לסירוגין. יתר על כן, היא נצפתה כי סוגי תאים חיסוניים שונים עשויים להשתמש באסטרטגיות מטבוליים שונות כדי לתדלק צרכי האנרגיה המוגברות שלהם במהלך הפעלה. לדוגמא, בעוד הפעלה של לימפוציטים מסוג T מפנה תאים למצב glycolytic כמעט לחלוטין 8 , לימפוציטים מסוג B מופעל להשתמש איזון של זירחון הגליקוליזה חמצוני 9,10. מחקרים אלה מצביעים על החשיבות של שבדק את ההשפעה של הפעלת תא חיסון על חילוף חומרים תאיים.
בזמן אמת, מדידות סימולטני של שיעור צריכת החמצן (OCR) וקצב החמצה תאיים (ECAR), כאינדיקטורים של זרחון חמצוני הגליקוליזה, היא אסטרטגיה נפוצה להתייחס מצבי מסלולים להפקת אנרגיה 11-13. על מנת להשיג זאת, נתח שטף תאי, כגון סוסון הים XF 96, משמש באופן שגרתי. מכשיר כזה יכול להשוות שינויים במהירות OCR ו ECAR פני סוגי תאים או בתנאי גירוי שונים. עד כה, סוגי תאים שונים, כולל תאי חיסון, נחקרו באמצעות התקנים אלה. עם זאת, פרוטוקול אופטימיזציה תוכנן במיוחד עבור תאי מערכת החיסון אינו זמין.
תאי מערכת החיסון, במיוחד לימפוציטים, נבדלים otסוגי התאים אותה בכמה דרכים קריטיות. לימפוציטים הם תאי שברירי כי אינם שורדים למשך זמן ארוך בתנאים vivo לשעבר 14-16. זוהי סוגיה גדולה עוד יותר כאשר הם בתרבית תקשורת צמיחה לא טובה חסרת חומרים מזינים חיוניים, כגון אלו המשמשים בניתוח שטף תאי. בניגוד מקרופאגים שורות תאים רבים, לימפוציטים אינם דבקים משטחי פלסטיק; ולכן זה קריטי לצרף אותם לצלחת הניתוח מבלי ליצור מתח. לבסוף, כמה תת-אוכלוסיות לימפוציטים עשויים להיות נדירות מאוד וקציר אותם נדרש, הכמות האופטימלית עשויה להיות מאתגר 17-19.
כאן, אנו מספקים פרוטוקול אופטימיזציה כי היא פותחה במיוחד עבור לימפוציטים. שימוש splenocytes, לימפוציטים מסוג B ו לימפוציטים מסוג CD4 + T נאיבי מבודד מן הטחול הלימפה העכבר צמתים 20, אנו מציגים את המאפיינים של זירחון הגליקוליזה חמצוני במצב מנוחה שלהם בידולצפיפות תא t. נתונים היו מנורמלים להסביר את הבדלי המספרים הסלולריים הראשוניים עבור כל טוב על ידי מדידת ריכוזי חלבון lysate תא assay סוף, שהיו ביחס ישר המספרים הסלולריים. הפרוטוקול שלנו לא רק מספק הנחיות הבידוד המהיר של לימפוציטים מעשי עבור מבחני שטף תאיים, אבל זה גם מאפשר לעבודה בריכוזי תא הכי מוצלחים מבלי להתפשר על איכות הנתונים.
Protocol
כל הניסויים בבעלי החיים בוצעו בהתאם לפרוטוקול חית LIG-4, אשר אושר על ידי ועדת הטיפול בבעלי חי NIAID ושימוש.
1. הכנת ריאגנטים
- הכן הפרדה מגנטי (MS) חיץ: PBS (pH 7.2) בתוספת 0.5% BSA ו -2 מ"מ EDTA או פתרון ההפרדה אוטומטית בתוספת 0.5% BSA. סינון סטרילי (0.22 מיקרומטר) ולאחסן ב 2-8 מעלות צלזיוס.
- כן בינוני RF10: RPMI בינוני 1640 בתוספת 10% בסרום שור עובר חום מומת, 50 פניצילין U / ml, 50 מיקרומטר סטרפטומיצין, פירובט סודיום 1 מ"מ, 2 מ"מ L- גלוטמין, 0.1 מ"מ חומצות אמינו לא חיוניות, 50 מיקרומטר 2 -mercaptoethanol, 10 HEPES מ"מ. השתמש ריאגנטים סטרילית. מסנן ולאחסן סטרילי ב 2-8 מעלות צלזיוס.
- כן בינוני מבחן לחץ המיטוכונדריה: בינוני בסיס XF בתוספת פירובט סודיום 1 מ"מ, 2 מ"מ L- גלוטמין ו -25 גלוקוז מ"מ.
- כן בינוני מבחן לחץ הגליקוליזה: supplemen הבינוני בסיס XFטד עם 2 L- גלוטמין מ"מ.
- התאם את ה- pH של שתי תקשורת מבחן המיטוכונדריה הגליקוליזה מתח ל -7.4, מסנן ולאחסן סטרילי ב 2-8 מעלות צלזיוס. תקשורת חמה 37 ° C מחדש ולהתאים את ה- pH לפני שימוש (לבצע מדידות pH על 37 מעלות צלזיוס).
הערה: שימוש בינוני XF, אשר חסרה ביקרבונט, הוא קריטי. מאז אווירת מנתח השטף התאי מכילה ושות סביבה רק 2, כל ביקרבונט במדיום, על קשירת הפרוטונים שוחררו כתוצר לוואי של גליקוליזה, יהיה לנתק להקים CO 2 ומים. CO 2 תהיה דגה במהלך הניסוי, גרימה ונסחפה pH כי הייתה לטשטש את אות החמצת glycolytic. - הכן oligomycin: הכן 10 מ"מ מניות פתרון ב DMSO; לאחסן ב -20 ° C.
- כן 2,4-DNP: כן 1 M פתרון מניות ב DMSO; לאחסן ב -20 ° C.
- להכין antimycin: הכן 10 מ"מ מניות פתרון ב DMSO; לאחסן ב -20 ° C.
- כן rotenone: כן 10 מ"מימ שלפתרון טוק ב DMSO; לאחסן ב -20 ° C.
- הכן גלוקוז: ממיסים סוכר במדיום מבחן הלחץ הגליקוליזה לגבש פתרון 250 מ"מ; להכין טרי לפני כל ניסוי ואינו להקפיא.
- כן 2-DG: ממסים מוצקים 2-DG במדיום מבחן לחץ הגליקוליזה לגבש פתרון 500 מ"מ; להכין טרי לפני כל ניסוי ואינו להקפיא.
2. טחול קציר ובלוטות לימפה מעכברים
- להרדים את העכבר על ידי מחנק 2 CO ואחריו נקע בצוואר הרחם.
- תרסיס העכבר עם אתנול 70%.
- עבור בידוד תא עוקב T, לקצור את הטחול, צוואר רחם שטחי, שטחי / עמוקה השחי, mandibular, מפשעתי, ובלוטות לימפה mesenteric.
- עבור בידוד B תא עוקב קציר רק הטחול.
הערה: השתמש ארון בטיחות ביולוגית ולשמור האיברים נקצרים ב PBS או מדיה RF10 על הקרח עד עיבוד. השתמש מעבדתי סטרילי טכניקה סטרילית לכל עיבוד Isolצעדי ation. שמור את כל המאגרים ומדיה על קרח כדי להגביר את יעילות בידוד כדי להפחית מוות של תאים.
עיבוד רקמות 3.
- מניחים מסננת 70 מיקרומטר התא מעל צינור חרוטי 50 מ"ל ולהעביר את האיברים על מסננת. עבור בידוד תא T, לשלב את כל האיברים להעברת בידוד תא B רק הטחול.
- באמצעות הבוכנה של מזרק 3 מ"ל סטרילי, ומועכים את רקמת דרך מסננת. במהלך רסוק, לוודא כי המסנן ואת האיברים הם לחים בכל עת להרטיב אותם כנדרש על ידי הוספת חיץ MS. זה הן ישמור כדאיות התא גבוהה למנוע סתימת מסנן.
- אחרי שלחץ, להחיל 5-10 מ"ל MS חיץ לפילטר להגדיל התאוששות התא. צנטריפוגה ההשעיה ב 400 XG במשך 5 דקות ב 4 ° C.. (ביצוע כל centrifugations הנוספת בתנאים אלה, אלא אם כן צוין).
- למזוג את הנוזל ו resuspend גלולה במאגר תמוגה תא דם אדום ACK 5 מ"ל. Incuבייט במשך 5 דקות על קרח כדי lyse תאי דם אדומים (כדוריות דם אדום הצורך להסירו משום שהם מפריעים הפרדה המגנטית). להוסיף 10-20 מ"ל MS חיץ צנטריפוגות.
- מקום מסנן תא 30 מיקרומטר מעל צינור חרוטי 15 מיליליטר ו ממשלה זה עם 1 מיליליטר חיץ MS (סינון זה יהיה להסיר שאריות מן תמוגה הכדורית האדומה). למזוג נוזל מהצינור centrifuged, resuspend גלולה ב 5 מ"ל MS חיץ ולהעביר אותו דרך מסנן. לשטוף את הצינור הראשוני עם חיץ 4 מ"ל MS להגדיל התאוששות התא, והשתמש בו כדי לשטוף את המסנן.
- באמצעות hemocytometer או נגד תא אוטומטי, לקבוע את המספר הכולל של תאים. מספר תא זה ישמש כדי לקבוע את כמות ריאגנטים פרדה מגנטיות כנדרש בסעיף 4. אם splenocytes הוא לשמש ב assay השטף התאי עוקב להפריש את המספר המתאים של תאים בשלב זה.
- צנטריפוגה ההשעיה והמשך פרדה מגנטית. splenocytes Resuspend לא בשימושבידוד תא B ב RF10 5 מיליליטר ולשמור על קרח עד assay השטף התאי.
4. הפרדה מגנטית של תאי B ותאי T מסוג CD4 + הנאיבי
- קבע את הכרכים הדרושים של קוקטייל ביוטין-נוגדן, microbeads אנטי ביוטין, חיץ MS. השתמש הכרכים הבאים במשך 10 8 תאים כמדריך ולהרחיב למעלה או למטה לפי הצורך.
הערה: דגירה דגימות במקרר ולא על הקרח מאז דוגרים על הקרח עשוי להפחית את יעילות הנוגדנים מחייב פעמים הדגירה כבר עשוי להידרש.
| ריאגנטים עבור הפרדת תא נאיבית CD4 + T | נפח עבור 10 8 תאים |
| (סולם כראוי) | |
| קוקטייל ביוטין-נוגדן | 100 μl |
| חיץ MS לאינקובטורים הראשון | 400 μl |
| microbeads אנטי ביוטין | 200 μl |
| microbeads CD44 | 100 μl |
| חיץ MS לאינקובטורים השני | 200 μl |
| דגירת הקוקטייל ותאי הנוגדן ביוטין ב 4 מעלות צלזיוס למשך 5 דקות. להוסיף microbeads אנטי ביוטין, microbeads CD44, MS חיץ דגירה על 4 מעלות צלזיוס למשך 15 דקות. | |
טבלה 1: כרכים בידוד T תא והוראות.
| ריאגנטים להפרדת תאי B | נפח עבור 10 8 תאים |
| (סולם כראוי) | |
| קוקטייל ביוטין-נוגדן | 100 μl |
| חיץ MS לאינקובטורים הראשון | 400 μl |
| microbeads אנטי ביוטין | 200 μl |
| חיץ MS לאינקובטורים השני | 300 μl |
| דגירת הקוקטייל ותאי הנוגדן ביוטין ב 4 מעלות צלזיוס במשך 15 דקות. להוסיף הנפח המתאים של קוקטייל ביוטין-נוגדן חיץ MS, דגירה את התערובת על 4 מעלות צלזיוס למשך 15 דקות. להוסיף נפח מתאים של microbeads אנטי ביוטין ו- MS חיץ דגירה את התערובת על 4 מעלות צלזיוס למשך 15 דקות. לאחר הדגירה השנייה, למלא את הצינור עם חיץ צנטריפוגות MS. | |
טבלה 2: B לצינוק כרכים והוראות.
- Resuspend גלולה במאגר MS: 500 μl להפרדה ידני, 3-4 מ"ל עבור הפרדה אוטומטית.
- המשך עם הפרדות ידניות או אוטומטיים אוכְּדִלקַמָן:
- הפרדה ידנית:
- הכנס טור LS לתוך המגנט ההפרדה, להציב צינור חרוטי 15 מ"ל סטרילי למטה כדי לאסוף את הזרימה דרך, וראש הטור ידי שטיפה עם חיץ 3 מ"ל MS. מחק את הזרימה דרך.
- מעביר את השעית התא לעמודת LS הדרוכה ולאפשר לו לעבור; לשטוף את צינור המשמש במהלך הדגירה עם 3 מ"ל MS חיץ ולהעביר זו דרך עמוד גם כן. Eluate יכיל את התאים מטוהרים. עבור בידוד תא B, להעביר את התאים המטוהרים באמצעות העמודה בשנית לתוך צינור 15 מיליליטר חדש, וחזור על שלב הכביסה. זה יגביר טוהר תשואה.
- הפרדה אוטומטית:
- הפעל את המפריד האוטומטי ולבדוק את הרמות של הפעלת מאגר, שטיפת פתרון ואתנול 70%. ודא כי הפסולת ריקה לפני תחילת ההפרדה.
- בחר מתלה מצונן המתאים בהתאם לגודל הצינור של tהוא מדגם unpurified (למשל, 15 מ"ל). על מנת לשמור על תאי קיימא לאורך כל תהליך ההפרדה, השתמש מתל כי כבר מקורר בעבר ב 2-8 מעלות צלזיוס במשך 3-4 שעות, או עד הקירור הופך מוצק.
- הר מתלה מקורר על הבמה מדגם של מפריד אוטומטית.
- מניח את הצינור מדגם בחריץ A1, צינור עבור החלק השלילי חריץ B1, ושפופרת לשבריר החיובי C1. אם איסוף יותר מדגם אחד, למקם צינורות נוספים במדורים הבאים (A2, B2, C2, וכו ').
- בחר בכרטיסיית ההפרדה על מסך המגע, ומצביע על הסדר של צינורות על המדף. מתפריט ההפרדה, בחר את התכנית "מהכלה" ולהשלים את מחזור התכנית בהתאם לסוג הכביסה המתאים (ראה הערה להלן).
הערה: "מהכלה" התכנית מבצעת דלדול השימוש במצב הרגיש ביותר של המכונה, המעניק קדימות טוהרות. בנוסף, יש שלוש אפשרויות לשטוף שונות: quic k לשטוף, לשטוף, ולישון. אם הדגימות הן מאותו המקור והם כדי להיות משולבים, בחרו שטיפה מהירה. אם הדגימות הן להיות כל זמן נפרד, בחר שטיפה. בחר באפשרות השינה אם לא בידודים נוספים יבוצעו באותו יום ואם המכונה ייסגר באי בידוד - הפעל את הבידוד על ידי לחיצה על "הפעלה", ולאשר את רמות חיץ כאשר תתבקש לעשות זאת. לאחר התכנית הסתיימה, השבר השלילי יכיל תאים מטוהרים.
- מלאו את צינור חרוטי עד 15 מ"ל עם MS חיץ צנטריפוגות.
- למזוג MS חיץ ותאי resuspend ב 5 מ"ל מדיה RF10. שמור את התאים על קרח עד assay השטף התאי.
הערה: באופן אידיאלי, assay השטף התאי צריכה להתבצע באופן מיידי לאחר בידוד. עם זאת, בניסויים ראשוניים אין הבדלים משמעותיים בתוצאות assay נצפו תאים המשמשים בתוך 3 שעות של בידוד לעומת אלה טריים-מבודדים.
- הפרדה ידנית:
ss = "jove_title"> 5. תאי שטף Assay
הערה: הפרוטוקול המתואר כאן הוא עבור תבנית 96-היטב של המכשיר. כרכים יהיו צריכים להיות מותאמים אם בתבנית אחרת משמשת.
- הידרציה של חיישן Cartridge
- הרם את מחסנית חיישן, למלא היטב בכל צלחת השירות עם 200 μl של פתרון calibrant ולהפחית את מחסנית חיישן לצלחת השירות, השריית חיישנים בפתרון calibrant.
הערה: ודא כי רמת פתרון calibrant גבוהה מספיק כדי לשמור על החיישנים שקועים. מחסנית מטפח fluorophores הקשורים O 2 ו- H + עבור כל טוב; אלה צריכים להיות התייבשות, כדי שתוכל לעבוד כמו שצריך. - הנח את המחסנית בתוך 37 ° C חממה לא השלימה עם CO 2 או חמצן / חנקן. לבצע את כל incubations נוספת בתנאים אלה, אלא אם כן צוין. דגירת מחסנית הלילה מהימה.
- הרם את מחסנית חיישן, למלא היטב בכל צלחת השירות עם 200 μl של פתרון calibrant ולהפחית את מחסנית חיישן לצלחת השירות, השריית חיישנים בפתרון calibrant.
- הכנהation של צלחות מצופות הדבקה
- הכן 2.5 מ"ל של פתרון דבק 22.4 מיקרוגרם / מ"ל ב 0.1 M סודיום ביקרבונט, 8.0 pH (ביקרבונט מספק את רמת החומציות האופטימלית ספיחה דבק).
- החל 25 μl של הפתרון היטב כל צלחת assay, דגירה על הספסל בטמפרטורת החדר למשך 20 דקות.
- לשאוב דבק ולשטוף היטב כל פעמיים באמצעות 200 μl של מים סטריליים. חכה עד בארות יבשות לפני זריעת התאים.
- זריעת תאי צלחות דבקות מצופות
- תאי צנטריפוגה בטמפרטורת חדר בבית XG 200 במשך 5 דקות. תאים Resuspend ב 5 מ"ל של מדיום assay המתאים (ראה לעיל עבור גיבוש מתח המיטוכונדריה ומדיה מתח גלוקוז). צנטריפוגה תאים שוב resuspend בריכוז הרצוי בינוני assay (נפח resuspension ישתנו בהתאם ריכוז; כל טוב יכילו 180 μl של השעית תא).
הערה: כל עוד התקשורת במתחם assay המתאימההים משמש, נתח השטף התאי יכול בו זמנית להפעיל את לחץ המיטוכונדריה הגליקוליזה בדיקות על אותה הצלחת. - פלייט 180 μl של ההשעיה תא היטב כל אחד. להשתמש בבארות A1, A12, H1, ו H12 עבור תיקון טמפרטורת הרקע: להוסיף 180 μl של מדיום assay בבארות אלה (לא התאים).
- דגירת צלחות עבור 25 דקות ב 37 מעלות צלזיוס.
- צנטריפוגה את הצלחת ב XG 200 במשך 5 דקות ללא בלם על מנת להבטיח כי כל התאים יש מצורפים לחלוטין. ראייה לאשר כי התאים הם דבקו ביציבות אל פני שטח התרבות, ויצרו בשכבה, על ידי הצגה תחת המיקרוסקופ. מעביר את הצלחות בחזרה אל האינקובטור עבור 30 דקות נוספות.
- תאי צנטריפוגה בטמפרטורת חדר בבית XG 200 במשך 5 דקות. תאים Resuspend ב 5 מ"ל של מדיום assay המתאים (ראה לעיל עבור גיבוש מתח המיטוכונדריה ומדיה מתח גלוקוז). צנטריפוגה תאים שוב resuspend בריכוז הרצוי בינוני assay (נפח resuspension ישתנו בהתאם ריכוז; כל טוב יכילו 180 μl של השעית תא).
- הכנת 10x ריכוזים של תרכובות, וטעינה של נמלי Injector
- עבור מבחן הקיצון המיטוכונדריה, להכין 2.5 מ"ל כל אחד 10 oligomycin מיקרומטר, 1 מ"מ DNP, ואת תערובת של 10 מיקרומטר rotenone ו 10 A antimycin מיקרומטר, והכל mediu assay מתח המיטוכונדריהM.
הערה: ריכוז 2,4-DNP מבוססת על מחקרים שפורסמו בעבר; 21 זהו קו מנחה כללי, אלא ריכוז uncoupler לכל סוג תא בשימוש צריך להיקבע על ידי החוקר. - עבור מבחן הקיצון הגליקוליזה, להכין 2.5 מ"ל כל אחת גלוקוז 250 מ"מ, 10 מיקרומטר oligomycin, ו -500 מ"מ 2-deoxyglucose (2-DG) במדיום assay מתח הגליקוליזה.
- 10x פתרונות חמים 37 ° C, כדי להתאים את pH 7.4.
- טען את התרכובות ליציאות המזרק המתאימות של המחסנית באמצעות micropipettor רב וכי מכווני הטעינה, כדלקמן:
טבלה 3: כרכים במגרש.נָמָל Assay מתח מיטוכונדריאלי Assay מתח הגליקוליזה א 20 μl oligomycin 20 גלוקוז μl B 22 μl 2,4-DNP 22 μl oligomycin C 25 μl antimycin A / rotenone 25 μl 2-DG
הערה: כל סדרת היציאות (למשל, כל היציאות א) חייבות לכלול את אותו הנפח. זה קריטי, כי כל הבארות בסדרת נתונה נטענות, אפילו אלה שלא השתמשו בניסוי, אחרת התרכובות לא להיות מוזרקים (יציאות בבארות בשימוש ניתן לטעון עם אותו הנפח בינוני assay). - דגירת המחסנית תוך הגדרת התכנית.
- עבור מבחן הקיצון המיטוכונדריה, להכין 2.5 מ"ל כל אחד 10 oligomycin מיקרומטר, 1 מ"מ DNP, ואת תערובת של 10 מיקרומטר rotenone ו 10 A antimycin מיקרומטר, והכל mediu assay מתח המיטוכונדריהM.
- הגדרת פרוטוקולי Assay שטף תאי
- הגדר את התכנית הבאה (לוח 4).
לוח 4: פריסת תוכנית.שלב לוּלָאָה כִּיוּל - אִזוּן - קריאות Baseline 3 פעמים: מערבבים 3 דקות, לחכות 0 דקות, מדד 3 דקות לולאת הסוף - להזריק פורט A - מידות 3 פעמים: מערבבים 3 דקות, לחכות 0 דקות, מדד 3 דקות לולאת הסוף - להזריק נמל B - מידות 3 פעמים: מערבבים 3 דקות, לחכות 0 דקות, מדד 3 דקות לולאת הסוף - להזריק נמל C - מידות 3 פעמים: מערבבים 3 דקות, לחכות 0 דקות, measurדואר 3 דקות לולאת הסוף - תוכנית סיום -
הערה: בתנאים מסוימים, למשל, כאשר באמצעות תאים מופעלים, ההחמצה עשויה להימשך זמן רב יותר מאשר בתאים נאיביים. מסיבה זו, זה עשוי להיות נחוץ כדי להאריך את המועדים "לחכות" בתכנית הנ"ל או לחזור על כל מחזור מדידה יותר פעמים. - בגין התוכנית. לאחר שלב הכיול, להחליף את צלחת calibrant לצלחת assay (כאשר יתבקשו לעשות זאת).
הערה: השימוש בתוכנה, אפשר להצביע על קבוצות של בארות עם תנאים דומים. בנוסף, חשוב לציין איזה בארות הן בארות השליטה (בפרוטוקול זה, הם הארבעה בפינות המשטחות) וכדי לציין איזה בארות ריקות. במשך מפורט יותר, צעד אחר צעד, פרוטוקול להקמת מכונית וזההתוכנה של, אתר האינטרנט של היצרן יש להיוועץ.
- הגדר את התכנית הבאה (לוח 4).
- מדידת תכולת חלבון
- הסר את מדיום assay הנותר מכל טוב מבלי להפריע את התאים.
הערה: אם זה לא נוח להמשיך עם assay חלבון הריכוז, אפשר להקפיא את הצלחת השלמה ב -20 ° C עד ניתוח. אם קפוא, להפשיר לפני שתמשיך. - כן פתרון 1x של מעכבי פרוטאז (100x לני"ע) במדיום תמוגה ריפה (מספיק עבור 50 μl / טוב).
- הוסף 50 μl בינוני ריפה תמוגה השלימו עם מעכבי פרוטאז היטב כל אחד. להתסיס הצלחת על שייקר במשך 5 דקות, ולאחר מכן דגירה צלחת על קרח למשך 30 דקות לתאי lyse לחלוטין.
- ספין את הצלחת ב XG 200 במשך 5 דקות בטמפרטורת החדר כדי להביא שומנים ומולקולות אחרות לתחתית הצלחת, כך שהם לא להפריע חומצה bicinchoninic assay (BCA).
- מדוד ריכוז חלבון על ידי assay BCA פי יצרן &# 39; s המלצות.
- הסר את מדיום assay הנותר מכל טוב מבלי להפריע את התאים.
תוצאות
תאים איקריוטיים להשתמש רשת משולבת של הגליקוליזה, החומצה tricarboxylic (TCA) מחזור, ו זרחון חמצוני לפגוש את רוב דרישות האנרגיה שלהם לספק ביניים הדרושים להתפתחות התא ושגשוגם. מסלולים אלה להתחיל עם ההשמנה התאית של גלוקוז חינם בצורה של גלוקוז-6-פוספט, אשר לאחר מכן מקבל מעובד לתוך פירובט. פירובט הוא גם מופחתת לקטט או מועבר לתוך המיטוכונדריה, שם הוא יוצר אנזים אצטיל (CoA). אצטיל COA ואז נכנס לתוך מחזור TCA. ביניים-אנרגיה גבוהה של מחזור TCA להניע את תנועת האלקטרונים בשרשרת העברת אלקטרונים (ETC), אשר בתורו מגרשת H + מהמטריצה המיטוכונדריה לייצר H + שיפוע פני קרום המיטוכונדריה הפנימית. חמצן משמש acceptor האלקטרון האחרון, ו- H + לחזור חזרה מטריקס המיטוכונדריה דרך F O / F 1 מורכב, שבו האנרגיה הפוטנציאלית שלהם משמשת להפקת ATP (איור 1 א).
עיקרון העבודה של assay השטף התאי תלוי מפריעת הגליקוליזה זרחון חמצונים בנקודות ספציפיות, והערכת ההשפעות הנובעות מכך. לשם כך, השתמשנו גלוקוז להפיץ הגליקוליזה בתאי מורעבים, ו -2-deoxyglucose (2-DG), אשר מומר 2-deoxyglucose-6-פוספט, מעכב תחרותי של phosphoglucoisomerase 23, על ידי hexokinase, כדי לחסום הגליקוליזה. Rotenone (מעכב מורכב ספציפי שאני של ETC), antimycin A (קומפלקס מעכב III הספציפי של ETC), oligomycin (מעכב של ה- ATP synthase 24), ואת 2,4-dinotrophenol הסוכן שחרר (DNP) 25 היו נהג להתערב אירועים ספציפיים הקשורים אלקטרון תחבורה, שיפוע פרוטון וסינתזה ATP (איור 1 א). במקום 2,4-DNP, cya קרבונילnide-4- (trifluoromethoxy) phenylhydrazone (FCCP) יכול לשמש גם, אבל אופטימיזציה נוספת ייתכן שתידרש. בכל מקרה, uncouplers צריך להיות טיטרציה תמיד לסוג תא מסוים לפני השימוש כדי לקבוע את הריכוז האופטימלי צורך.
מבחן לחץ הגליקוליזה (האיור 1B) מתחיל עם מדידת בסיס של שיעור ההחמצה התאי (ECAR) בתאים המורעבים בעבר. מאז תאים אלה הם לכל הפחות הבסיס שלהם, ולכן יכול להיחשב כמעט כבלתי glycolytic, את ECAR נמדד בנקודה זו המכונה החמצה הלא glycolytic. החמצה זו תואמת עשויה הנשימה CO 2 שנוצר במחזור TCA להיות מומר HCO 3 - ו- H +. זה ואחריו ההזרקה של גלוקוז כדי להפעיל הגליקוליזה, המציגה כגידול ההחמצה התאית עקב ההיווצרות של לקטט.גידול זה מייצג את הקצב הנורמלי של הגליקוליזה. התאים אז מאותגרים עם הזרקה של oligomycin, החוסם את הדור של ATP באמצעות זירחון חמצוני. תאים להגיב ירידה דרמטית זו בייצור ATP על ידי הפעלת הגליקוליזה לרמה המקסימלית שלה, וכי התוצאה היא עלייה משנית ברמת ECAR (מילואים glycolytic). המבחן הוא הופסק על ידי עיכוב סך של הגליקוליזה באמצעות גלוקוז אנלוגי 2-DG, שמחזירה את ECAR לרמתו הלא glycolytic. מעניין, הוצע כי בניגוד להמלצות היצרן, הגליקוליזה מקסימלי אינה מושגת בהכרח על ידי הזרקה של oligomycin 26. בתאים עם קיבולת glycolytic גבוהה, אם אין עלייה משמעותית בביקוש ATP, הגליקוליזה תוכל לחלוטין להתמודד עם האובדן של ATP במיטוכונדריה בלעדיו צורך להיות למעלה מוסדר. שיעור glycolytic עם oligomycin יכול להיות מעל ומעבר על ידי הוספת מעכבי נשימה, כגון rotenone ו myxothiazol, המספקים כמה יתרונות על פני oligomycin: 1) הם מגבירים את צריכת ATP, כפי שהם גורמים להיפוך synthase ATP, עם הידרוליזה ATP, לשאוב פרוטונים בניסיון לשחזר את קרום המיטוכונדריה פוטנציאל 26; 2) הם מונעים החמצת נשימה של המדיום, אשר יכול לבלבל את תוצאות ECAR (ראה להלן). דרכים אחרות להגדיל את ביקוש ATP כוללות תוספת של תרכובות המעודדות את הידרוליזה של ATP על ידי ATPases קרום הפלזמה 26. כל זה יש לשקול בזהירות על ידי החוקרים בעת תכנון מבחן מאמץ הגליקוליזה.
מבחן הלחץ המיטוכונדריה (איור 1 ג) מתחיל עם מדידת בסיס של שיעור צריכת חמצן (OCR) בתאים שאינם מורעב. זה ואחריו ההזרקה של oligomycin, אשר מעכבת את החזרת הפרוטונים דרך מורכב F O / F 1 ובכך במהירות hyperpolariz es קרום המיטוכונדריה. Hyperpolarization מונע פרוטון שאיבת יתר באמצעות מתחמי נשימה, ואת ירידות קצב נשימה. נשימתו הנותרים נקראת דליפת פרוטון, המייצגת את זרימת הפרוטונים דרך שומנים או ערוצים אחרים. מדינת hyperpolarized זה מתהפכת במהירות על ידי התוספת של הסוכן שחרר 2,4-DNP, אשר משמש ionophore פרוטון. בתגובה, תאים לנסות ולשחזר את הפוטנציאל הממברנה בניסיון כושל על ידי גברת קצב העברת האלקטרונים כדי המקסימלית שלה, וזה בתורו מגביר את OCR. לבסוף, עם תוספת של שני מעכבי ETC (א antimycin ו rotenone), הנשימה המיטוכונדריאלי נעצרת לגמרי OCR פוחתת לרמתו הנמוכה ביותר. ברמה זו, צריכת החמצן אינה עקב פעילות המיטוכונדריה (לא המיטוכונדריה). הבדל OCR שנוצר על ידי המעכבים הללו נקרא הנשימה מקסימלית המיטוכונדריה, שהוא הסכום של נשימת הבסיס ואת לקיבולת.
class = "jove_content" FO: keep-together.within-page = "1"> B ו- isolations תא T להניב מאוד אוכלוסיות לימפוציטים טהורות קיימא.
תאי B ותאי T מסוג CD4 + נאיבי בודדו כמפורט בסעיף 4 לפרוטוקול, ו splenocytes התקבלו פשוט על ידי lysing בתאי הדם האדומים כמפורט בסעיף 3.3.
הרגישות של מבחני מטבולית סוג תא ספציפי תלויה הכדאי ועל הטוהר של אוכלוסיית התא מתחילה. לכן, על מנת לוודא הכדאיות של תאי T העכבר מבודדים, splenocytes, ותאי B, ועל טוהר של תאי T ו- B, aliquots קטן של תאים היו מוכתמים עבור ניתוח תזרים cytometric (איור 2). בשנות ה פיזור-באיזור הקדמי לעומת הצד פיזור-שטח (FSC-A לעומת SSC-A) העלילה, לימפוציטים היו מגודרת, ובתוך השער הזה, האוכלוסייה לאורך אלכסוני פיזור-הי קדימהt (FSC-H) לעומת FSC-A עלילה נקבע כמו singlets. בתוך אוכלוסיית הגופייה, כדאיות נמדדה על ידי gating התאים שהכתימו שלילי על הסמן החי / המת (איור 2 א); T כדאיות התא היה 97.9%, הכדאיות splenocyte היה 92%, ואת כדאיות התא B היה 94%. B טוהר התא, כפי שהיא נמדדת על ידי B220 + CD19 + האוכלוסייה 26, היה 99%, בעוד טוהר תא CD4 + T, כפי שהיא נמדדת על ידי CD44 - CD4 + האוכלוסייה 27, היה 98.3% (תרשים 2B).
ריכוז חלבון של lysate התא יכול לשמש כאינדיקטור ישיר של מספר תאים המצופה.
לימפוציטים splenocytes המבודדים היו מצופים ב צלחת assay דבקה מצופה 96-גם ב 5 x 10 5 תאים / טוב, 2.5 x 10 5 תאים / טוב, 1.25 x 10 5 תאים / היטב, 0.625 x 10 5 תאים / היטב. המפגש בכל צפיפות ציפוי של שלושת סוגי התאים היה דמיינו תחת מיקרוסקופ אור (איור 3 א). כצפוי, מפגש בקורלציה עם צפיפויות ציפוי הראשוניות. עם השלמת assay השטף התאי, תאים מצופים היו lysed וריכוזי החלבון שלהם היו לכמת באמצעות assay BCA. עבור כל סוגי התאים, ריכוזי חלבון lysate הוצגו להיות מתואמים באופן ליניארי עם צפיפויות הציפוי הראשוניות (האיור 3B), אשר מאשר כי ריכוזי חלבון lysate יכולים לשמש מדד מדויק לנורמליזציה של מספרים סלולריים כאשר מפרשים את נתוני שטף התאיים. צפיפויות הציפוי השתמשו בניסוי זה ממוטבים עבור לימפוציטים נאיבי, unstimulated. אם תאי מגורה או מתורבתים בעבר הם לשמש, ייתכן שיידרשו אופטימיזציה נוספת.
מיטוכונדריאלי ו stres glycolyticמבחני ים תלויים מספר הסלולרי מצופה.
OCR נמדדה עבור כל סוג תא וצפיפות ציפוי ב נתח השטף התאי. כצפוי, מספרים גבוהים יותר תא יש OCR נמדד גבוה, כמו גם תגובות דרמטיות יותר oligomycin, 2,4-DNP, ואת antimycin A / rotenone (איור 4 א). סטנדרטיזציה מדידות OCR על כל ריכוז חלבון מדגם של מגלה כי ככלל, מספרים גדולים יותר של תאים להוביל יותר מדויק מדידות OCR. ציפוי בשעת 5 ו -2.5 x 10 5 תאים / גם הביאו מדידות OCR מנורמלות דומות בתאי splenocytes T, ו -5 1.25 x 10 5 תאים / גם הביא מדידות OCR מנורמלות דומות בתאי B (איור 4 ב). ההבדלים הקלים בתא B המנורמל מדידות OCR יכולות להיות אינדיקציה עקיפה כי תאי B ביצועים טובים יותר ב 2.5 x 10 5 תאים / טוב בהשוואה לצפיפות תאים אחרות. על ידי כל האמצעים, 0.625 x 10 5 תאים / גם נתנו תוצאות לא טובות, הוכחה כי צפיפות ציפוי זו אינה מספיקה. נשימת Baseline, דליפת פרוטון, נשימת המיטוכונדריאלי מקסימלית, הלא המיטוכונדריה נשימה, ייצור ATP בקורלציה ליניארית עם צפיפות ציפוי לכל סוגי התאים (איור 4C). בנוסף, רוב נשימת הבסיס משמש לקראת סינתזת ATP, כפי שצוין על ידי דליפת הפרוטון הנמוכה סוגי התאים השלושה. למרות ההתמקדות העיקרית של ניסוי המתח המיטוכונדריה היא למדוד שינויי OCR, את ECAR הוא עדיין שימושי להקליט על מנת להבטיח כי assay בוצע בהצלחה. בדומה OCR, שתי צפיפויות הציפוי הגבוהות הביאו ECAR הגבוה ותגובות דרמטיות יותר oligomycin, 2,4-DNP, ואת antimycin A / rotenone (איור 4D). השינויים הדרמטיים ECAR על תוספת של 2,4-DNP, ואת rotenone antimycin A / יכול להיות בגלל שינויים בנשימה בנוסף לשינויים glycolysis, מאז CO 2 שנוצר במחזור TCA מומר HCO 3 - ו- H +. בעיה זו טופלה לאחרונה, ואם קיימת שיטה פשוטה לתיקון אות ההחמצה תאית הכולל שימוש נתוני צריכת חמצן, כדי להשיג שיעור glycolytic האמיתי 12,29.
את assay מתח הגליקוליזה היה מוצלח ביותר בצפיפות הציפוי הגבוהה ביותר (איור 5 א ', ב'). בכל סוגי התאים, דגימות 5 x 10 5 תאים / גם היו את השינויים הגדולים ביותר ECAR לאחר התוספת של גלוקוז, oligomycin, ו -2 DG (איור 5). בנוסף, הנורמליזציה של ריכוז חלבון הוכיחה כי עבור כל סוגי התאים, 5 x 10 5 התאים / גם דגימות ניב תוצאות אופטימליות, תוך ריכוזי-במיוחד נמוך 0.625 x 10 5 תאים / היטב לא להציג יכולת מילואי glycolytic חזקה. ללא glycolytiהחמצת ג, הגליקוליזה, וקיבולת glycolytic לכאורה בקורלציה ליניארית עם צפיפות ציפוי לכל סוגי התאים (איור 5 ג). לצורך ניסוי המתח הגליקוליזה, גרף OCR מראה כי גלוקוז מעט מגרת נשימה המיטוכונדריאלי, אשר מעכבת מכן על ידי טיפול oligomycin; התוספת של 2-DG לא השפיעה על OCR (איור 5D). גרף OCR יכול לשמש אינדיקטור נוסף כי ניסוי מתח הגליקוליזה בוצע בהצלחה. כמו כן, בגרף OCR ניתן להשתמש כדי לתקן את הגרף ECAR, במידת הצורך, כפי שהוסבר לעיל במקרה של מבחן הלחץ המיטוכונדריה 12,29.
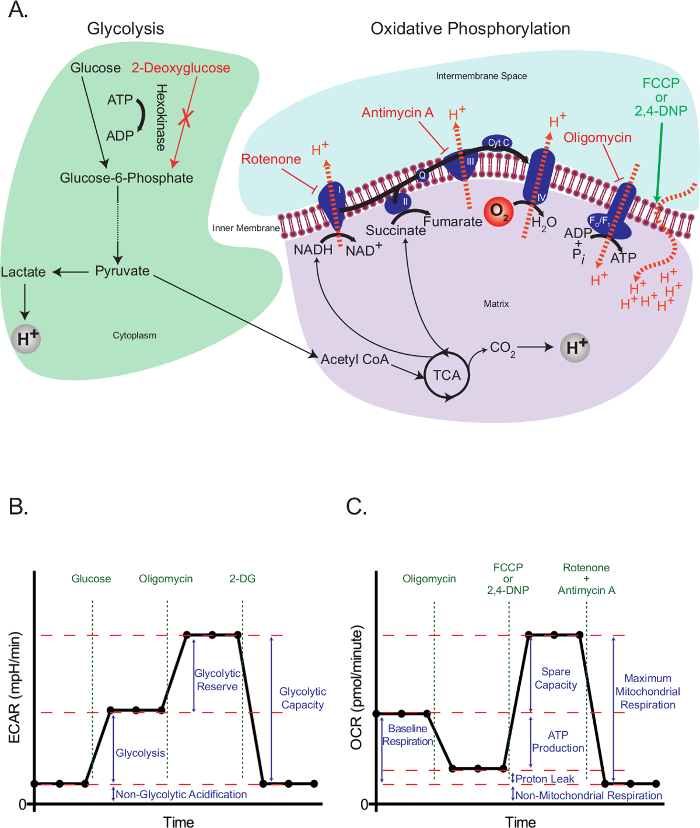
איור 1:. תמציתי של מבחני השטף תאיים (א) איור של הגליקוליזה (משמאל) זרחון חמצוני (מימין) מראה את הפעולה שלתרופות מטבוליים המשמשות מבחני השטף התאיים. (ב) סכמטי של גרף החמצת שיעור (ECAR) תאיים; סכמטי של שיעור צריכת החמצן (OCR) גרף (C). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
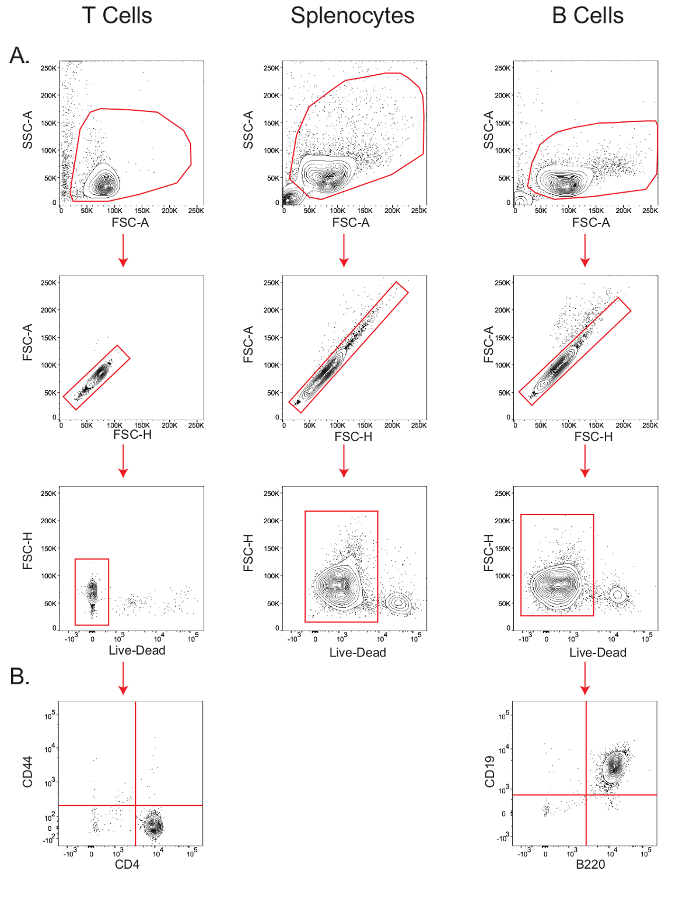
. איור 2: gating צעדיים של תאי T, תאי B, ו splenocytes לקבוע כדאיות וטוהר Cytometry זרימה מגרשים מראה את הכדאיות של תאי T, splenocytes, ותאי B (A); והטוהר של T ותאי B (B). תוצאות מייצגות לפחות שלושה ניסויים בלתי תלויים. אנא לחצו כאן כדי להציג גרסה גדולה יותר של ההוא דמות.
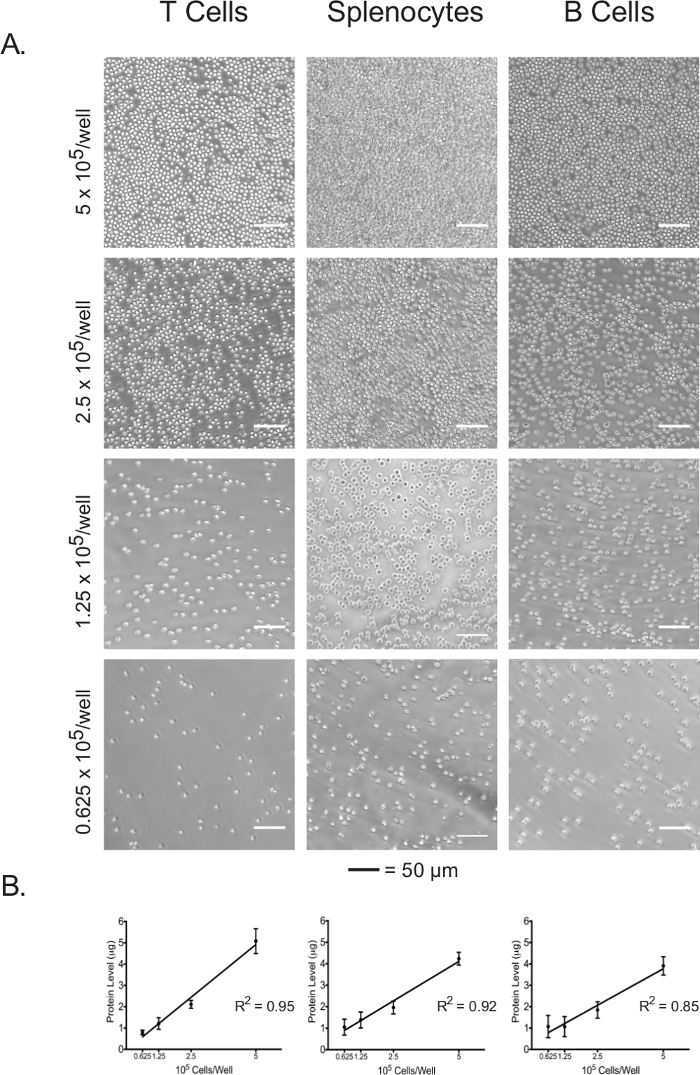
איור 3:. מפגש תא בקורלציה עם ריכוזי חלבון lysate של כל סוג תא בצפיפויות ציפוי שונים (א) micrographs אור של תאי בארות צלחת assay בצפיפויות ציפוי הנעה בין 5 x 10 5 תאים / היטב 0.625 x 10 5 תאים / טוֹב. ברי סולם מציינים 50 מיקרומטר. (ב) Lysate ריכוז חלבון בצפיפויות ציפוי שונים, כפי שהיא נמדדת על ידי assay BCA. תוצאות מייצגות לפחות שלושה ניסויים בלתי תלויים. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
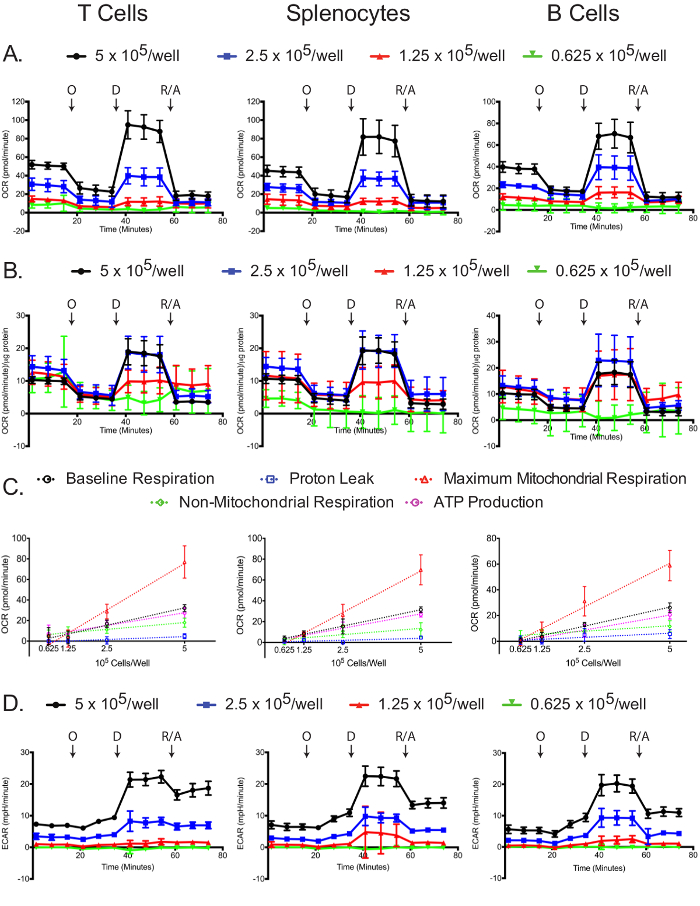
איור 4: Assay מתח מיטוכונדריאלי. הגלם (א) ו סטנדרטי (B) OCR עבור כל סוג תא וצפיפות ציפוי מוצג. (ג) שינויים במספר תלוי Cell ברמות בסיס, המיטוכונדריה מקסימלית ונשימה הלא המיטוכונדריה, כמו גם את consumptions החמצן צמוד דליפת פרוטון או ייצור ATP, מוצגים עבור כל סוגי תאים. (ד) הערכים ECAR גלם המתקבלים מבחני קיצון המיטוכונדריה מוצגים. כל נקודת נתונים מייצגת את הממוצע של 7-8 בארות עם סטיית תקן. החצים שכותרתו לציין זריקות של oligomycin (O), 2,4-DNP (D), ו rotenone / antimycin A (R / A). תוצאות מייצגות לפחות שלושה ניסויים בלתי תלויים. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
_upload / 54,918 / 54918fig5.jpg "/>
איור 5:. Assay מתח glycolytic גלם (א) ו סטנדרטי (B) ECAR לכל סוג תא וצפיפות ציפוי מוצג. (ג) שינויים במספר תלוי תאי ECAR עבור החמצה הלא glycolytic, הגליקוליזה הנגרמת גלוקוז וקיבולת glycolytic הכולל מוצגים. (ד) ערכי OCR הגלם המתקבלים מבחני קיצון glycolytic מוצגים. כל נקודת נתונים מייצגת את הממוצע של 7-8 בארות עם סטיית תקן. החצים שכותרתו לציין זריקות של גלוקוז (G), oligomycin (O), ו -2-deoxyglucose (2-DG). תוצאות מייצגות לפחות שלושה ניסויים בלתי תלויים. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
הפרוטוקול שפתחנו מותר בידוד יעיל של תת הלימפוציטים טהורים קיימא, אשר לאחר מכן שמשו בניתוח תאיים שטף בריכוזים שונים כדי להעריך את ההבדלים הגליקוליזה וביצועי נשימה המיטוכונדריאלי. פרוטוקול זה הוא תוכנן במיוחד עבור לימפוציטים ומספקים מענה שיקולים המיוחדים הקשורים סוגי תאים אלה, כגון פעילות חילוף חומרים בסיסית נמוכה, שבריריות, בתדירות נמוכה, וחוסר היכולת שלהם לדבוק צלחות assay. לכן, לעומת פרוטוקולים שפורסמו בעבר 11,12, השיטה שלנו מציע מדריך נוח יותר אופטימיזציה טובה יותר עבור חוקרים העובדים בתחום האימונולוגיה. ישנם מספר שלבים קריטיים בפרוטוקול זה, כולל פעולת כניסת אוכלוסיות תאים טהורות קיימא, ציפוי התאים בנקודת מפגש אופטימלי, סטנדרטיזציה של מדידות assay שטף תאי על ריכוז החלבון בכל טוב.
האנימספר nitial התאים המצופים הן יכל להיות דמיינו ידי מיקרוסקופ אור וגם לכמת באמצעות מדידות ריכוז חלבון. המתאם הליניארי בין מספר תא ריכוז חלבון אשר כי ריכוז החלבון אכן יכול לשמש כדרך לתקנן את השפעת השינויים מספרים סלולריים בין בארות שונות.
על ידי סטנדרטיזציה את תוצאות ECAR ו- OCR אל ריכוזי החלבון, הראינו כי, למרות מפגש תא תחתון, מספר המצומצם ככל 2.5 x 10 5 תאים / גם יכולים לשמש ברוב המבחנים מבלי להתפשר על איכות הנתונים. עם זאת, הגבול התחתון של תאים שיכולים לשמש נעים בין סוגי תאי מבחנים. לדוגמה, בעוד כמה כמו 1.25 x 10 5 תאים יכול לשמש למדידות B תא OCR, אפילו 2.5 x 10 5 תאים / גם לא היו מספיק כדי להעריך את הביצועים glycolytic מאותו סוג תא. לכן, כל עוד מספר הסלולרי אינו גורם מגביל, ציפוי ביותר מ90% מפגש, מתוכם כ מקביל 5 x 10 5 לימפוציטים / היטב, עדיף. אופטימיזציה נוספת ייתכן שתידרש כאשר תאים בגדלים-כגון שונים כמו מופעל בעבר-הם לימפוציטים בשימוש הבדיל באופן חלקי. בנוסף, בעת שימוש לימפוציטים עיקרי תרבותי בעבר, שאולי יש וריאצית כדאי תא בין תנאי טיפול שונים, אשר תקטין את האמינות של ריכוז חלבון כמדד את המספר הסלולרי מאז מת או תאים מתים יכולים גם לתרום רמות החלבון הנמדדות . במקרים כאלה, זה עשוי להיות מועיל כדי למיין תאי חיים על ידי זרימת cytometry לפני ביצוע מבחני שטף התאי.
המבחנים שלנו באמצעות אוכלוסיות לימפוציטים מבודדות טרי מאוד קיימא, השגנו נתונים תפקודיים אמינים עבור שתי מדידות OCR ו ECAR. בעוד כל סוגי התאים התנהגו באופן דומה במבחן הלחץ המיטוכונדריה, הבדלים בולטים בין סוגי התאים היושנצפה מבחן הקיצון הגליקוליזה. למשל, את ביצועי glycolytic של תאי T הנאיביים היו נמוכים בהשוואה splenocytes או תאי B, וזה לא השתנה עם התוספת של oligomycin. תצפית זו עולה בקנה אחד עם מחקרים שפורסמו בעבר 7,30, המאשר את תוקפו של הפרוטוקול שלנו.
לסיכום, השיטה שלנו מציעה דרך יעילה ונוחה של בדיקת הפעילות המטבולית של לימפוציטים באמצעות מנתח שטף תאי, וזה יכול להיות שימושי במגוון רחב של מחקרים אימונולוגית לחקור שינויי מטבוליים בתאי מערכת חיסוניים באקטיבציה, התמיינות תאים או בשל פנוטיפים המחלה כגון ממאירות זיהום, אוטואימוניות המטולוגיות.
Disclosures
The authors declare that they have no competing financial interests. Open Access fees for this article were provided by Agilent Technologies.
Acknowledgements
The authors thank Dr. Michael N. Sack (National Heart, Lung, and Blood Institute) for support and discussion, Ms. Ann Kim for optimizing the B cell isolation protocol, Dr. Joseph Brzostowski for his help with microscopy, and Ms. Mirna Peña for maintaining the animals used. This study was supported by the Intramural Research Programs of the National Institutes of Health, National Institute of Allergy and Infectious Diseases, and National Heart, Lung, and Blood Institute.
Materials
| Name | Company | Catalog Number | Comments |
| PBS (pH 7.2) | Gibco-ThermoFisher | 20012-050 | To make MACS buffer |
| Bovine Serum Albumin BSA | Sigma-Aldrich | A3803 | To make MACS buffer |
| 0.5 M EDTA, pH 8 | Quality Biological | 10128-446 | To make MACS buffer |
| autoMACS rinsing solution | Miltenyi Biotec | 130-091-222 | Instead of PBS + EDTA to make MS buffer. Also used in autoMACS Pro Separator. |
| RPMI-1640 | Gibco-ThermoFisher | 11875-093 | Contains phenol red and L-glutamine |
| Fetal Bovine Serum | Gibco-ThermoFisher | 10437-028 | For heat-inactivation, thaw frozen stock bottle in a 37 °C water bath and then inactivate at 56 °C for 30 min. Aliquot heat-inactivated serum for storage (e.g., in 50 ml conical tubes) and freeze at -20 °C until needed. |
| Penicillin-Streptomycin (Pen Strep) | Gibco-ThermoFisher | 15140-122 | Combine Pen Strep with L-Glut 1:1 (if making 500 ml media, make a total of 12 ml Pen Strep/L-Glut); keep aliquots at -20 °C until ready to make media. |
| L-Glutamine 200 mM (L-Glut) | Gibco-ThermoFisher | 25030-081 | Component of RF10 and stress test media |
| Sodium pyruvate 100 mM | Gibco-ThermoFisher | 11360-070 | Component of RF10 and stress test media |
| HEPES 1 M | Gibco-ThermoFisher | 15630-080 | Component of RF10 |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco-ThermoFisher | 11140-050 | Component of RF10 |
| 2-Mercaptoethanol (55 mM) | Gibco-ThermoFisher | 21985-023 | Component of RF10 |
| Falcon 70 μm cell strainer | Falcon-Fischer Scientific | 87712 | Used in cell isolation |
| Monoject 3 ml Syringe, Luer-Lock Tip | Covidien | 8881513934 | Used in cell isolation |
| Falcon 15 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-959-53A | Used in cell isolation |
| Falcon 50 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-432-22 | Used in cell isolation |
| ACK Lysing Buffer | Lonza | 10-548E | Used in cell isolation |
| CellTrics 30 μm cell filter, sterile, single-packed | Partec CellTrics | 04-004-2326 | Used in cell isolation |
| B Cell Isolation Kit, mouse | Miltenyi Biotec | 130-090-862 | Used in cell isolation |
| Naïve CD4+ T cell isolation kit, mouse | Miltenyi Biotec | 130-104-453 | Used in cell isolation |
| LS Column | Miltenyi Biotec | 130-042-401 | Used in cell isolation |
| MidiMACS separator | Miltenyi Biotec | 130-042-302 | Magnet for separation |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | Holder for magnets |
| autoMACS Rinsing Solution | 130-091-222 | Rinsing solution for autoMACS Pro Separator | |
| autoMACS Pro Separator Instrument | Miltenyi Biotec | N/A | |
| 2-Deoxy-D-glucose (2-DG) | Sigma-Aldrich | D8375-5G | |
| Cell-Tak | Corning | 354240 | Cell adhesive. Take care to note concentration, as each lot is different (package is 1 mg). |
| Oligomycin | Sigma-Aldrich | 75351 | |
| 2,4-Dinotrophenol (2,4-DNP) | Sigma-Aldrich | D198501 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Halt Protease Inhibitor Cocktail | ThermoFisher Scientific | 78429 | Supplied as 100x cocktail, combine with RIPA to form 1x solution for lysis. |
| RIPA Buffer | Boston BioProducts | BP-115 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | Follow manufacturer's instructions |
| Seahorse XFe96 FluxPak | Seahorse Bioscience | 101085-004 | Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
| Seahorse XF Base Medium | Seahorse Bioscience | 102353-100 | Used to prepare stress test media |
| Seahorse XFe96 Extracellular Flux Analyzer | Seahorse Bioscience | ||
| Stericup Sterile Vacuum Filter Units, 0.22 μm | EMD Millipore-Fisher Scientific | SCGPU10RE | Used to sterile filter media. |
| Sodium bicarbonate | Sigma-Aldrich | 487031 | Dissolved to 0.1 M and used to dilute Cell-Tak. |
References
- Motz, G. T., Coukos, G. Deciphering and reversing tumor immune suppression. Immunity. 39 (1), 61-73 (2013).
- Akkaya, M., Barclay, A. N. How do pathogens drive the evolution of paired receptors?. Eur J Immunol. 43 (2), 303-313 (2013).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu Rev Immunol. 27, 591-619 (2009).
- Dinarello, C. A. Proinflammatory cytokines. Chest. 118 (2), 503-508 (2000).
- Kurosaki, T., Kometani, K., Ise, W. Memory B cells. Nat Rev Immunol. 15 (3), 149-159 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Gerriets, V. A., Rathmell, J. C. Metabolic pathways in T cell fate and function. Trends Immunol. 33 (4), 168-173 (2012).
- Doughty, C. A., et al. Antigen receptor-mediated changes in glucose metabolism in B lymphocytes: role of phosphatidylinositol 3-kinase signaling in the glycolytic control of growth. Blood. 107 (11), 4458-4465 (2006).
- Caro-Maldonado, A., et al. Metabolic reprogramming is required for antibody production that is suppressed in anergic but exaggerated in chronically BAFF-exposed B cells. J Immunol. 192 (8), 3626-3636 (2014).
- Pelletier, M., Billingham, L. K., Ramaswamy, M., Siegel, R. M. Extracellular flux analysis to monitor glycolytic rates and mitochondrial oxygen consumption. Methods Enzymol. 542, 125-149 (2014).
- Mookerjee, S. A., Brand, M. D. Measurement and Analysis of Extracellular Acid Production to Determine Glycolytic Rate. J Vis Exp. (106), e53464 (2015).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Klein, A. B., et al. Impact of different cell isolation techniques on lymphocyte viability and function. J Immunoassay Immunochem. 27 (1), 61-76 (2006).
- Hsueh, R. C., et al. Purification and Characterization of Mouse Splenic B Lymphocytes. AfCS Research Reports. 1 (1), 1-11 (2012).
- Zambrano, K., et al. Prolonged ex vivo expansion and differentiation of naive murine CD43 B splenocytes. Biotechnol Prog. , (2016).
- Costa, G. L., et al. Targeting rare populations of murine antigen-specific T lymphocytes by retroviral transduction for potential application in gene therapy for autoimmune disease. J Immunol. 164 (7), 3581-3590 (2000).
- Franz, B., May, K. F., Dranoff, G., Wucherpfennig, K. Ex vivo characterization and isolation of rare memory B cells with antigen tetramers. Blood. 118 (2), 348-357 (2011).
- Schneider, D. F., Glenn, C. H., Faunce, D. E. Innate lymphocyte subsets and their immunoregulatory roles in burn injury and sepsis. J Burn Care Res. 28 (3), 365-379 (2007).
- Reeves, J. P., Reeves, P. A. Removal of lymphoid organs. Curr Protoc Immunol. Chapter 1, Unit 1 9 (2001).
- Akkaya, B., et al. A Simple, Versatile Antibody-Based Barcoding Method for Flow Cytometry. J Immunol. 197 (5), 2027-2038 (2016).
- Traba, J., et al. Fasting and refeeding differentially regulate NLRP3 inflammasome activation in human subjects. J. Clin. Invest. 125 (12), 4592-4600 (2015).
- Wick, A. N., et al. Localization of the Primary Metabolic Block Produced by 2-Deoxyglucose. J. Biol. Chem. 224 (2), 963-969 (1957).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthetase system. Methods Enzymol. 55, 472-518 (1979).
- Terada, H. Uncouplers of oxidative phosphorylation. Environmental Health Perspectives. 87, 213-218 (1990).
- Mookerjee, S. A., Nicholls, D. G., Brand, M. D. Determining Maximum Glycolytic Capacity Using Extracellular Flux Measurements. PLOS ONE. 11 (3), e0152016 (2016).
- Lai, L., Alaverdi, N., Maltais, L., Morse, H. C. Mouse cell surface antigens: nomenclature and immunophenotyping. J Immunol. 160 (8), 3861-3868 (1998).
- Gerberick, G. F., Cruse, L. W., Miller, C. M., Sikorski, E. E., Ridder, G. M. Selective modulation of T cell memory markers CD62L and CD44 on murine draining lymph node cells following allergen and irritant treatment. Toxicol Appl Pharmacol. 146 (1), 1-10 (1997).
- Mookerjee, S. A., Goncalves, R. L. S., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochim. Biophys. Acta - Bioenergetics. 1847 (2), 171-181 (2015).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. J Exp Med. 212 (9), 1345-1360 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved