Method Article
Um protocolo otimizado para analisar glicólise e respiração mitocondrial nos linfócitos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
The study of metabolism is becoming increasingly relevant to immunological research. Here, we present an optimized method for measuring glycolysis and mitochondrial respiration in mouse splenocytes, and T and B lymphocytes.
Resumo
Os linfócitos respondem a uma variedade de estímulos, activando vias de sinalização intracelular, o que por sua vez leva a uma rápida proliferação celular, migração e diferenciação, e a produção de citocinas. Todos estes eventos são firmemente ligados ao estado de energia da célula, e, por conseguinte, o estudo das vias de produção de energia pode dar pistas sobre a funcionalidade global destas células. O analisador de fluxo extracelular é um dispositivo comumente utilizado para avaliar o desempenho da glicólise e respiração mitocondrial em muitos tipos de células. Este sistema tem sido usado para estudar as células imunes em alguns relatórios publicados, ainda um protocolo global optimizado particularmente para os linfócitos que falta. Os linfócitos são frágeis células que sobrevivem mal em condições ex vivo. Muitas vezes, os subconjuntos de linfócitos são raros, e trabalhar com números celulares de baixo é inevitável. Assim, uma estratégia experimental que aborda estas dificuldades é necessário. Aqui, nós fornecemos um protocoloque permite a rápida isolamento de linfócitos viáveis a partir de tecidos linfóides, e para a análise dos seus estados metabólicos no analisador de fluxo extracelular. Além disso, nós fornecemos resultados de experiências nas quais as actividades metabólicas dos vários subtipos de linfócitos com diferentes densidades celulares foram comparados. Estas observações sugerem que o protocolo pode ser utilizado para alcançar resultados consistentes, bem padronizados, mesmo em concentrações celulares baixas, e, portanto, pode ter amplas aplicações em estudos futuros incidindo sobre a caracterização de eventos metabólicos nas células do sistema imunológico.
Introdução
A resposta imunitária contra antigénios é um equilíbrio estritamente regulada entre a activação imunitária e supressão imunitária. Activação imunitária conduz a rápida proliferação e migração celular, bem como a produção de citoquinas, a secreção de anticorpos e a fagocitose aumentada em resposta ao estímulo, ao passo que a supressão imune simplesmente inibe estes eventos e, por conseguinte, é importante na prevenção de respostas imunes desnecessários 1-6. Estudos recentes têm demonstrado que existe uma relação directa entre o estado de activação das células imunes ea atividade de várias vias metabólicas 7. células do sistema imunológico pode alternar entre repouso e activados estados trocando vias produtoras de energia e desligar. Além disso, tem-se observado que os diferentes tipos de células imunitárias pode utilizar diferentes estratégias metabólicas para abastecer as suas maiores necessidades de energia durante a activação. Por exemplo, enquanto que a activação dos linfócitos T dirige as células para um estado quase completamente glicolítica 8 , os linfócitos B activados utilizar um balanço da glicólise e fosforilação oxidativa 9,10. Estes estudos apontam para a importância de se investigar os efeitos da ativação de células imunes no metabolismo celular.
Em tempo real, medições simultâneas de taxa de consumo de oxigênio (OCR) e taxa de acidificação extracelular (ECAR), como indicadores de fosforilação oxidativa e glicólise, é uma estratégia comum para lidar com os estados de vias de produção de energia 11-13. A fim de alcançar este objectivo, um analisador de fluxo extracelular, tais como a XF cavalo marinho 96, é usado rotineiramente. Tal instrumento pode comparar rapidamente mudanças em OCR e ECAR em todos os tipos de células ou a diferentes condições de estimulação. Até agora, vários tipos de células, incluindo células do sistema imunológico, têm sido estudados utilizando estes dispositivos. No entanto, um protocolo optimizado especificamente para as células do sistema imunológico não está disponível.
células do sistema imunológico, sobretudo linfócitos, diferem de otos tipos de células em várias formas críticos. Os linfócitos são células frágeis que não sobrevivem por longos períodos em condições ex vivo 14-16. Este é um problema ainda maior quando elas são cultivadas em meio de crescimento sub-óptima falta de nutrientes essenciais, tais como aqueles usados na análise de fluxo extracelular. Ao contrário de macrófagos e muitas linhas de células, os linfócitos não aderem às superfícies de plástico; Por conseguinte, é crítico para fixá-los à placa de análise sem a geração de stress. Finalmente, algumas subpopulações de linfócitos podem ser extremamente raro e colhê-los no limite, quantidades ideais exigidas pode ser um desafio 17-19.
Aqui, nós fornecemos um protocolo otimizado que é especificamente desenvolvido para linfócitos. Usando esplenócitos, linfócitos B e linfócitos T CD4 + naive isolados de baço de ratinho e linfonodos 20, que mostram as características de sua glicólise e fosforilação oxidativa estado de repouso em differendensidades celulares t. Os dados foram normalizados para ter em conta as diferenças no número de células iniciais para cada poço através da medição das concentrações de proteína de lisado de células de ensaio, os quais estão directamente proporcional ao número de células. Nosso protocolo não só fornece diretrizes para o rápido isolamento de linfócitos viáveis para ensaios de fluxo extracelular, mas também permite que para trabalhar em concentrações de células sub-óptimos sem comprometer a qualidade dos dados.
Protocolo
Todos os experimentos com animais foram realizados de acordo com o protocolo animais LIG-4, que foi aprovado pela Comissão Cuidado e Uso do NIAID Animal.
1. Preparação dos Reagentes
- Preparar tampão de separação magnética (MS): PBS (pH 7,2) suplementado com 0,5% de BSA e EDTA a 2 mM ou solução de separação automática suplementado com 0,5% de BSA. filtro estéril (0,22 mM) e armazenar a 2-8 ° C.
- Prepare forma RF10: RPMI 1640 suplementado com 10% de soro fetal de bovino inactivado pelo calor, 50 U / ml de penicilina, 50 | iM de estreptomicina, piruvato de sódio 1 mM, 2 mM de L-glutamina, MM aminoácidos não essenciais 0,1, 50? M 2 -mercaptoetanol, HEPES 10 mM. Use reagentes estéreis. filtro estéril e armazenar a 2-8 ° C.
- Prepare meio de teste de stress mitocondrial: XF meio base suplementado com piruvato de sódio 1 mM, 2 mM de L-glutamina e 25 mM de glicose.
- Prepare meio de teste de estresse glicólise: suple meio base XFTed com mM de L-glutamina 2.
- Ajustar o pH de ambos os meios de teste mitocondrial e estresse glicólise para 7,4, filtro estéril e armazenar a 2-8 ° C. media quente para 37 ° C e re-ajustar o pH antes do uso (realização de medições de pH a 37 ° C).
NOTA: Usando o meio XF, que carece de bicarbonato, é crítica. Uma vez que a atmosfera no analisador de fluxo extracelular contém apenas o CO 2 ambiente, qualquer de bicarbonato no meio, após ligação a protões como um subproduto da glicólise, irá dissociar para formar CO2 e água. CO 2 vai degas Durante o experimento, causando desvios no pH que obscurecem o sinal acidificação glycolytic. - Prepare oligomicina: preparar 10 mM solução estoque em DMSO; Armazenar a -20 ° C.
- Prepare 2,4-DNP: Preparar a solução 1 M em DMSO; Armazenar a -20 ° C.
- Prepare antimicina A: preparar 10 mM solução estoque em DMSO; Armazenar a -20 ° C.
- Prepare rotenona: preparar 10 mM ssolução tock em DMSO; Armazenar a -20 ° C.
- Prepare glicose: Dissolve-se a glicose no meio de ensaio glicólise tensão para formar uma solução de 250 mM; preparar, de fresco antes de cada experiência e não congelar.
- Prepare 2-DG: Dissolver sólida 2-DG no meio de ensaio glicólise esforço para formar uma solução 500 mM; preparar, de fresco antes de cada experiência e não congelar.
2. A colheita baço e linfonodos de camundongos
- Euthanize o mouse por asfixia com CO2, seguido por deslocamento cervical.
- Pulverizar o rato com 70% de etanol.
- Por subsequente isolamento de células T, recolher o baço, cervical superficial, superficial axilar / profunda, mandibular, inguinal, e linfonodos mesentéricos.
- Por subsequente isolamento de células B, ceifa apenas no baço.
NOTA: Use uma cabine de segurança biológica e manter os órgãos colhidos em PBS ou mídia RF10 em gelo até o processamento. Use material de laboratório estéril e técnica estéril para todo o processamento e isoladorpassos ation. Mantenha todos os tampões e meios de comunicação no gelo para aumentar a eficiência de isolamento e reduzir a morte celular.
Processamento 3. Tissue
- Coloque uma peneira de 70 uM de células ao longo de um tubo cónico de 50 ml e transferir os órgãos para o filtro. Para o isolamento de células T, combinar todos os órgãos como para o isolamento de células B transferência só o baço.
- Usando o êmbolo estéril de uma seringa de 3 ml, triturar o tecido através do filtro. Durante triturar, certifique-se de que o filtro e os órgãos são úmido em todos os momentos e molhá-los como exigido pela adição de tampão MS. Isto irá manter tanto a viabilidade celular elevada e impedir o entupimento do filtro.
- Depois de triturar, aplicam-se 5-10 ml de tampão SM para o filtro para aumentar a recuperação das células. Centrifugar a suspensão a 400 xg durante 5 min a 4 ° C. (Realizar todas as outras centrifugações sob essas condições, a menos que especificado).
- Decanta-se o líquido e ressuspender o sedimento em 5 ml de tampão de lise ACK células vermelhas do sangue. incuBATE durante 5 min em gelo para lisar as células vermelhas do sangue (glóbulos vermelhos devem ser removidos porque eles interferem com a separação magnética). Adicionar 10-20 mL de tampão e centrifuga-MS.
- Colocar um filtro de células 30 mm ao longo de um tubo de 15 ml e prime-lo com 1 ml de tampão de MS (esta filtração irá remover detritos da lise de eritrócitos). Decanta-se o líquido a partir do tubo de centrifugado, ressuspender o sedimento em 5 ml de tampão SM e passá-lo através do filtro. Lavar o tubo inicial com 4 ml de tampão SM para aumentar a recuperação das células, e utilizar este para enxaguar o filtro.
- Usando um hemocitómetro ou um contador de células automatizado, determinar o número total de células. Este número de células vai ser utilizado para determinar a quantidade de reagentes de separação magnética necessários na Secção 4. Se os esplenócitos são para ser utilizado no ensaio de fluxo extracelular subsequente, anular o número apropriado de células no momento.
- Centrifugar a suspensão e proceder à separação magnética. Ressuspender esplenócitos não utilizadapara o isolamento de células B, em 5 ml RF10 e manter em gelo até que o ensaio de fluxo extracelular.
4. separação magnética de células B e células T CD4 + Naive
- Determinar os volumes necessários de cocktail de anticorpo-biotina, microcontas anti-biotina, e tampão de MS. Utilize os seguintes volumes de 10 8 células como um guia e escalar para cima ou para baixo, conforme necessário.
NOTA: Incubar as amostras no frigorífico, em vez de gelo uma vez que a incubação em gelo pode reduzir a eficiência de ligação do anticorpo e os tempos de incubação mais longos possam ser necessários.
| Os reagentes para a separação de células CD4 + T naive | Volume de 10 8 células |
| (dimensionar adequadamente) | |
| coquetel de biotina-anticorpo | 100 ul |
| tampão MS para a primeira incubação | 400 ul |
| microesferas anti-biotina | 200 ul |
| micropérolas CD44 | 100 ul |
| tampão MS para segunda incubação | 200 ul |
| Incubar o cocktail e células biotina-anticorpo, a 4 ° C durante 5 min. Adicionar microesferas anti-CD44, microesferas de biotina, tampão SM e incubar a 4 ° C durante 15 min. | |
Tabela 1: volumes de isolamento de células T e instruções.
| Os reagentes para a separação de células B | Volume de 10 8 células |
| (dimensionar adequadamente) | |
| coquetel de biotina-anticorpo | 100 ul |
| tampão MS para a primeira incubação | 400 ul |
| microesferas anti-biotina | 200 ul |
| tampão MS para segunda incubação | 300 ul |
| Incubar o cocktail e células biotina-anticorpo, a 4 ° C durante 15 min. Adicionar o volume adequado de mistura de biotina-anticorpo e tampão SM, e incubar a mistura a 4 ° C durante 15 min. Adicionar o volume apropriado de microesferas anti-biotina e tampão SM e incubar a mistura a 4 ° C durante 15 min. Após a segunda incubação, encher o tubo com tampão SM e centrifugar. | |
Tabela 2: volumes de isolamento de células B e instruções.
- Ressuspender o sedimento em tampão MS: 500 ul de separação manual, 3-4 ml para a separação automática.
- Continue com qualquer separações manuais ou automatizadosdo seguinte modo:
- Separação manual:
- Insira uma coluna LS no ímã separação, coloque um estéreis 15 ml tubo cônico abaixo para recolher o fluxo através de e privilegiada da coluna por lavagem com 3 ml de tampão de MS. Elimine o escoamento.
- Transferir a suspensão de células para a coluna LS preparado e permitir que ela passe através de; lavar o tubo utilizado durante a incubação com 3 ml de tampão SM e passar esta através da coluna, bem. O eluato conterá as células purificadas. Para o isolamento de células B, as células purificadas passar através da coluna uma segunda vez para um novo tubo de 15 ml, e repetir o passo de lavagem. Isto irá aumentar a pureza e rendimento.
- Separação Automatizada:
- Ligue o separador automático e verificar os níveis de tampão de corrida, solução a 70% de etanol enxaguar. Garantir que os resíduos está vazio antes de iniciar a separação.
- Selecione o rack refrigerados apropriado, dependendo do tamanho do tubo de tele amostra não purificada (por exemplo, 15 ml). Para manter as células viáveis ao longo do processo de separação, utilizar suportes que tenham sido previamente arrefecida a 2-8 ° C durante 3-4 horas, ou até que o refrigerante torna-se sólida.
- Montar a cremalheira refrigerada na fase de amostra do separador automático.
- Colocar o tubo de amostra na ranhura de A1, um tubo para a fracção negativa na ranhura de B1, e um tubo para a fracção positiva em C1. Se recolher mais de uma amostra, coloque tubos adicionais nas próximas colunas (A2, B2, C2, etc.).
- Selecione a guia de separação na tela sensível ao toque, e indicar a disposição dos tubos no rack. A partir do menu de separação, selecione o programa "esgota" e completar o ciclo de programa com o tipo apropriado de lavagem (ver nota abaixo).
NOTA: O programa "esgota" realiza o esgotamento usando o modo mais sensível da máquina, que prioriza a pureza. Além disso, há três opções de lavagem diferentes: quick lavar, lavar e dormir. Se as amostras são da mesma fonte e são para ser combinados, seleccionar lavagem rápida. Se as amostras devem ser mantidas separadas, selecione lavagem. Selecione a opção de suspensão se não mais isolamentos será realizada naquele dia e se a máquina será encerrado após isolamento - Comece o isolamento pressionando "Run", e confirmar os níveis de buffer quando solicitado. Após o fim do programa, a fração negativa irá conter células purificadas.
- Encha o tubo cônico de até 15 ml com o MS tampão e centrifugação.
- Decantar tamponar o MS e Ressuspender as células em 5 ml de mídia RF10. Manter as células em gelo até ao ensaio de fluxo extracelular.
NOTA: Idealmente, o ensaio de fluxo extracelular deve ser realizado imediatamente depois do isolamento. No entanto, em experiências preliminares não foram observadas diferenças significativas nos resultados do ensaio em células utilizadas dentro de 3 horas de isolamento contra os recém-isoladas.
- Separação manual:
5. Extracelular Flux Assay
NOTA: O protocolo delineado aqui é para o formato de 96 poços do instrumento. Volumes terá de ser ajustada, se um outro formato é usado.
- Hidratação do cartucho do sensor
- Levanta o cartucho do sensor, encher cada poço da placa de serviço com 200 ul de solução de calibração e diminuir o cartucho do sensor sobre a placa de utilidade, submergindo os sensores na solução de calibração.
NOTA: Verifique se o nível de solução de calibração é alta o suficiente para manter os sensores submersos. O cartucho abriga fluoróforos associados ao O 2 e H + para cada poço; estes precisam ser hidratados para que eles funcionem corretamente. - Colocar o cartucho numa incubadora a 37 ° C não suplementado com CO 2 ou de oxigénio / azoto. Levar a cabo todas as incubações mais sob estas condições, a menos que especificado. Incubar o cartucho durante a noite para hidratar.
- Levanta o cartucho do sensor, encher cada poço da placa de serviço com 200 ul de solução de calibração e diminuir o cartucho do sensor sobre a placa de utilidade, submergindo os sensores na solução de calibração.
- preparção de placas revestidas com adesivo
- Preparar 2,5 ml de uma solução / ml adesiva 22,4 ug em bicarbonato de sódio 0,1 M, pH 8,0 (bicarbonato proporciona o pH óptimo para a adsorção de adesivo).
- Aplicar 25 ul da solução a cada poço da placa de ensaio, e incuba-se no banco à temperatura ambiente durante 20 min.
- Aspirar adesiva e lavar cada poço duas vezes com 200 ul de água estéril. Espere até que os poços estão secos antes da semeadura das células.
- Semeando as células em placas revestidas com adesivo
- células Centrifugar a temperatura ambiente a 200 xg durante 5 min. Ressuspender as células em 5 ml de meio de ensaio adequado (ver acima para a formulação de estresse mitocondrial e media tensão glicose). Centrifugar novamente as células e ressuspender na concentração desejada em meio de ensaio (o volume de ressuspensão irá variar com base na concentração; cada poço contém 180 ul de suspensão de células).
NOTA: Enquanto os meios de comunicação de ensaio adequados e compostos são utilizados, o analisador de fluxo extracelular podem ser executados simultaneamente os testes de estresse a glicólise mitocondriais e sobre a mesma placa. - Placa de 180 ul de suspensão de células em cada poço. Use poços A1, A12, H1, e H12 para o fundo temperatura correção: adicionar 180 mL de meio de ensaio nesses poços (sem células).
- Incubar as placas durante 25 min a 37 ° C.
- Centrifugar a placa a 200 xg durante 5 minutos sem travão para assegurar que todas as células foram completamente ligado. Visualmente confirmar que as células estão estavelmente aderida à superfície da cultura, a formação de uma monocamada, através da visualização sob o microscópio. Transferir as placas de novo na incubadora durante mais 30 min.
- células Centrifugar a temperatura ambiente a 200 xg durante 5 min. Ressuspender as células em 5 ml de meio de ensaio adequado (ver acima para a formulação de estresse mitocondrial e media tensão glicose). Centrifugar novamente as células e ressuspender na concentração desejada em meio de ensaio (o volume de ressuspensão irá variar com base na concentração; cada poço contém 180 ul de suspensão de células).
- Preparação de 10x concentrações de compostos, e carregando de portas de injecção
- Para o teste de stress mitocondrial, preparar 2,5 mL de cada um de 10 uM oligomicina, DNP 1 mM, e uma mistura de 10 uM e 10 uM rotenona antimicina A, em todos mitocondrial mediu ensaio de tensãom.
NOTA: A concentração de 2,4-DNP é baseada em estudos anteriormente publicados; 21 esta é uma orientação geral mas a concentração do desacoplador para cada tipo de célula utilizado deve ser determinado pelo investigador. - Para o teste de estresse glicólise, prepare 2,5 ml cada um de glucose 250 mM, 10 mM oligomicina e mM 2-deoxiglicose 500 (2-DG) no meio de ensaio estresse glicólise.
- Aqueça 10x soluções a 37 ° C, e ajustar o pH para 7,4.
- Carregar os compostos para as portas de injecção apropriadas do cartucho utilizando uma micropipeta multicanal e as guias de carga, como se segue:
Tabela 3: volumes compostos.Porta Ensaio de estresse mitocondrial Glicólise Ensaio estresse UMA 20 ul oligomicina 20 ul de glucose B 22 ul de 2,4-DNP 22 ul oligomicina C 25 ul antimicina A / rotenona 25 ul de 2-DG
NOTA: Cada série de portas (por exemplo, todas as portas A) deve conter o mesmo volume. É essencial que todos os poços de uma mesma série estão carregado, mesmo que não tenham usado na experiência, caso contrário, os compostos não vão ser injectadas (portas em poços não utilizadas pode ser carregado com o mesmo volume de meio de ensaio). - Incubar o cartucho durante a configuração do programa.
- Para o teste de stress mitocondrial, preparar 2,5 mL de cada um de 10 uM oligomicina, DNP 1 mM, e uma mistura de 10 uM e 10 uM rotenona antimicina A, em todos mitocondrial mediu ensaio de tensãom.
- Configurando Extracelular Flux Ensaio de Protocolos
- Configure o seguinte programa (Tabela 4).
Tabela 4: Disposição do Programa.Passo laço calibragem - Equilíbrio - leituras de linha de base 3 vezes: Misture 3 min, espera 0 min, medida 3 min laço da extremidade - Injectar Port A - medições 3 vezes: Misture 3 min, espera 0 min, medida 3 min laço da extremidade - Injectar Porto B - medições 3 vezes: Misture 3 min, espera 0 min, medida 3 min laço da extremidade - Injectar Porto C - medições 3 vezes: Misture 3 min, espera 0 min, MEASURe 3 min laço da extremidade - Programa End -
NOTA: Em certas condições, por exemplo, quando se utiliza células ativadas, a acidificação pode continuar por mais tempo do que em células naive. Por esta razão, pode ser necessário alargar as "esperar" vezes no programa acima ou repetir cada ciclo de medição mais vezes. - Iniciar o programa. Após o passo de calibração, substituir a placa de calibração para a placa de ensaio (quando solicitada).
NOTA: Usando o software, é possível indicar grupos de poços que têm condições semelhantes. Além disso, é crucial para indicar que os poços são os poços de controlo (neste protocolo, eles são os quatro cantos da placa) e para indicar que os poços estão vazias. Para uma mais detalhada, passo-a-passo, protocolo para configurar a máquina es software, o site do fabricante deve ser consultado.
- Configure o seguinte programa (Tabela 4).
- Medição do conteúdo de Proteína
- Remover o meio de ensaio remanescente de cada cavidade sem perturbar as células.
NOTA: Se não é conveniente para prosseguir com o ensaio de concentração de proteína, é possível congelar toda a placa à temperatura de -20 ° C até à análise. Se congelado, descongelar antes de continuar. - Prepara-se uma solução de 1x de inibidores de protease (100x estoque) em meio de lise RIPA (50 suficiente para ul / poço).
- Adicionar 50 ul de meio de lise RIPA suplementado com inibidores da protease a cada poço. Agitar placa num agitador durante 5 min, e em seguida, Incubar a placa em gelo durante 30 min para lisar as células completamente.
- Girar a placa a 200 xg durante 5 min à temperatura ambiente para trazer os lípidos e outras moléculas para o fundo da placa de modo a que eles não interfiram com o ensaio de ácido bicinconínico (BCA).
- Medir a concentração de proteína por ensaio BCA de acordo com o fabricante# 39; s recomendações.
- Remover o meio de ensaio remanescente de cada cavidade sem perturbar as células.
Resultados
As células eucarióticas utilizam uma rede integrada de glicólise, o ácido tricarboxílico ciclo (TCA), e fosforilação oxidativa para satisfazer a maior parte das suas exigências de energia e proporcionar intermediários necessários para o crescimento e proliferação celular. Estas vias de começar com a retenção intracelular de glicose livre sob a forma de glicose-6-fosfato, o que, subsequentemente, é processado em piruvato. O piruvato é ou reduzido a lactato ou transportado para as mitocôndrias, onde forma acetil-coenzima A (CoA). Acetil-CoA, em seguida, entra no ciclo do TCA. Intermediários de alta energia do ciclo de TCA a impulsionar o movimento de electrões da cadeia de transporte de electrões (ETC), que por sua vez expulsa H + da matriz mitocondrial para gerar um gradiente de H + através da membrana mitocondrial interna. Oxigênio age como receptor de elétrons final, e H + voltar para a matriz mitocondrial através do F O / F um complexo, em que a energia potencial é usado para gerar ATP (Figura 1A).
O princípio de funcionamento do ensaio de fluxo extracelular depende de interferir com a glicólise e fosforilação oxidativa em pontos específicos, e avaliar os efeitos resultantes. Para este fim, utilizou-se glucose para propagar a glicólise em células em jejum, e 2-desoxiglucose (2-DG), que é convertido em 2-desoxiglucose-6-fosfato, um inibidor competitivo de fosfoglucoisomerase 23, por hexoquinase, a fim de bloquear glicolise. Rotenona (um inibidor complexo específico-I do ETC), antimicina A (um complexo inibidor específico-III da ETC), oligomicina (inibidor da ATP sintase 24), e o agente de desacoplamento 2,4-dinotrophenol (DNP) 25 eram utilizados para intervir eventos específicos relacionados com elétrons de transporte, gradiente de prótons e síntese de ATP (Figura 1A). Em vez de 2,4-DNP, de cya carbonilnide-4- (trifluorometoxi) fenil-hidrazona (FCCP) também pode ser utilizada, mas uma maior optimização pode ser necessária. Em ambos os casos, desacopladores deve sempre ser titulada para um tipo específico de célula antes de usar para determinar a concentração óptima necessária.
O teste de stress a glicólise (Figura 1B) inicia-se com uma medição da linha de base da taxa de acidificação extracelular (ECAR) em células previamente em jejum. Uma vez que estas células estão no seu mínimo basal, e pode, portanto, ser considerada como praticamente não-glicolítico, o ECAR medido neste ponto é referido como o acidificação não glicolítica. Esta acidificação provável corresponde a CO 2 gerado respiratória no ciclo de TCA a ser convertido em HCO 3 - e H +. Isto é seguido pela injecção de glicose para activar a glicólise, que se apresenta como um aumento na acidificação extracelular devido à formação de lactato.Este aumento representa a taxa normal de glicólise. As células são, então, provocados com a injecção de oligomicina, que bloqueia a produção de ATP através da fosforilação oxidativa. As células respondem a esta diminuição dramática na produção de ATP por activação glicólise ao seu nível máximo, e que resulta em um aumento secundário na ECAR nível (reserva glicolítica). O teste é terminada por inibição total da glicólise usando o analógico glucose 2-DG, que retorna a ECAR ao seu nível não-glicolítica. Curiosamente, tem sido proposto que, contrariamente ao que as recomendações do fabricante, a glicólise máxima não é necessariamente conseguido através da injecção de 26 oligomicina. Em células com uma elevada capacidade glicolítica, se não houver um aumento significativo na procura de ATP, a glicólise poderá ser perfeitamente capaz de lidar com a perda de ATP mitocondrial, sem necessidade de ser regulada para cima. A taxa glicolítica com oligomicina pode ser superada pela adição de inibidores respiratórios, Tais como rotenona e mixotiazol, que proporcionam algumas vantagens sobre oligomicina: 1) Eles aumentam o consumo de ATP, em que provocam a reversão da ATP sintase, com a hidrólise de ATP, para bombear protões, numa tentativa para recuperar o potencial de membrana mitocondrial 26; 2) Eles impedem a acidificação respiratória do meio, o que pode confundir os resultados eCar (veja abaixo). Outras maneiras de aumentar a procura de ATP incluir a adição de compostos que estimulam a hidrólise de ATP nas ATPases de membrana de plasma 26. Tudo isso deve ser considerado com cuidado pelos pesquisadores ao planejar um teste de glicólise stress.
O teste de estresse mitocondrial (Figura 1C) começa com uma medida de referência da taxa de consumo de oxigênio (OCR) em células não morriam de fome. Isto é seguido pela injecção de oligomicina, que inibe o regresso dos protões através do complexo F O / F 1 e, assim, rapidamente hyperpolarizes da membrana mitocondrial. Hiperpolarização impede ainda mais prótons bombeamento através complexos respiratórios, e diminui a taxa respiratória. A respiração restante é chamado vazamento de protões, que representa o fluxo de protões através de lípidos ou de outros canais. Este estado hiperpolarizado é rapidamente revertida pela adição do agente de desacoplamento 2,4-DNP, o qual actua como um ionóforo de protões. Em resposta, as células tentam recuperar o potencial de membrana em uma tentativa fútil, aumentando a taxa de transporte de elétrons ao seu máximo, e este, por sua vez aumenta o OCR. Finalmente, com a adição de dois inibidores da ETC (antimicina A e rotenona), respiração mitocondrial completamente paradas e OCR diminui para seu nível mais baixo. A este nível, o consumo de oxigénio não é devida à actividade mitocondrial (não-mitocondrial). A diferença no OCR gerado por estes inibidores é chamado de respiração mitocondrial máxima, que é a soma da respiração da linha de base e a capacidade de reposição.
B e isolamentos de células T produzir populações de linfócitos puros altamente viáveis.Células B e células T CD4 + naive foram isolados como descrito na Seção 4 do protocolo, e baço foram simplesmente obtidas por lise das células vermelhas do sangue, como descrito na Seção 3.3.
A sensibilidade dos ensaios metabólicas específicas do tipo de células depende da viabilidade e a pureza da população de células de partida. Por conseguinte, a fim de verificar a viabilidade das células isoladas, os esplenócitos de rato, T e células B, e a pureza das células T e B, pequenas alíquotas de células foram coradas para a análise de citometria de fluxo (Figura 2). Na dispersão da área de frente vs. dispersão-área lateral (FSC-A vs. SSC-A) enredo, linfócitos foram fechado, e dentro deste portão, a população ao longo da diagonal na dispersão-heigh frentet (FSC-H) vs. FSC-A trama foram determinados como as camisolas interiores. Dentro da população singuleto, a viabilidade foi medida por gating as células que coraram para o marcador negativo ao vivo / morto (Figura 2A); a viabilidade das células T foi de 97,9%, a viabilidade dos esplenócitos foi de 92%, e a viabilidade das células B foi de 94%. Pureza de células B, como medido pela B220 + CD19 + da população de 26, foi de 99%, enquanto que a pureza das células CD4 + T, como medido pela presença de células CD44 - CD4 + população 27, foi de 98,3% (Figura 2B).
A concentração de proteínas do ligado celular pode ser utilizada como um indicador directo do número de células plaqueadas.
Isolado linfócitos e os esplenócitos foram plaqueadas numa placa de 96 poços de ensaio revestida com adesivo a 5 x 10 5 células / poço, 2,5 x 10 5 células / poço, 1,25 x 10 5 células / poço, e 0,625 x 10 5 células / poço. A confluência em cada densidade de revestimento dos três tipos de células foi visualizada sob a luz do microscópio (Figura 3A). Como esperado, confluência correlacionada com as densidades de plaqueamento inicial. Após a conclusão do ensaio de fluxo extracelular, células plaqueadas foram lisadas e as suas concentrações de proteína foram quantificados usando o ensaio BCA. Para todos os tipos de células, as concentrações de proteína de lisado foram mostrados para serem linearmente correlacionada com as densidades de plaqueamento inicial (Figura 3B), o que confirma que as concentrações de proteína de lisado pode ser usado como uma medida exacta para a normalização do número de células na interpretação dos dados de fluxo extracelulares. As densidades de revestimento utilizadas neste experimento foram otimizados para linfócitos naïve, não estimuladas. Se as células estimuladas ou previamente cultivadas são para ser utilizado, uma maior optimização pode ser necessária.
Mitocondrial e stres glicolíticass ensaios são dependentes do número de células banhado.
O OCR foi medido para cada tipo celular e densidade do revestimento no analisador de fluxo extracelular. Como esperado, os números de células mais elevadas têm uma maior OCR medido, bem como respostas mais dramático a oligomicina, 2,4-DNP, e antimicina A / rotenona (Figura 4A). A padronização medições OCR para concentração de proteína de cada amostra revela que, em geral, maiores números de células conduzir medições OCR para mais precisos. Plaqueamento a 5 e 2,5 x 10 5 células / poço resultou em medições OCR normalizados semelhantes nas células T e esplenócitos, e 5 e 1,25 x 10 5 células / poço resultou medições OCR normalizados semelhantes em células B (Figura 4B). As ligeiras diferenças na célula B normalizada medições OCR pode ser uma indicação indirecta que as células B têm melhor desempenho a 2,5 x 10 5 células / poço em comparação com outras densidades celulares. Por todas as medidas, 0,625 x 10 5 células / poço deu resultados sub-óptimos, demonstrando que esta densidade de revestimento é insuficiente. Respiração da linha de base, vazamento de protões, a respiração mitocondrial máxima, a respiração de não-mitocondrial, e a produção de ATP linearmente correlacionada com densidades de revestimento para todos os tipos de células (Figura 4C). Além disso, a maior parte da respiração da linha de base é utilizado no sentido de sintetizar ATP, tal como indicado pelo vazamento baixo de protões nos três tipos de células. Embora o foco principal da experiência estresse mitocondrial é medir alterações no OCR, o ECAR ainda é útil para gravar para assegurar que o ensaio foi realizado com sucesso. Semelhante ao OCR, as duas densidades de revestimento mais elevados resultou em maior ECAR e respostas mais dramáticas para oligomicina, 2,4-DNP, e antimicina A / rotenona (Figura 4D). As mudanças dramáticas na ECAR com a adição de 2,4-DNP, e antimicina A / rotenona pode ser devido a mudanças na respiração, além de mudanças no glycolysis, visto que o CO 2 gerado no ciclo do TCA é convertido para HCO 3 - e H +. Esta questão foi recentemente abordada, e existe um método simples para corrigir o sinal total acidificação extracelular utilizando os dados de consumo de oxigênio, para obter a taxa glicolítica verdadeira 12,29.
O ensaio de glicólise estresse foi mais bem sucedida na maior densidade de plaqueamento (Figura 5A, B). Em todos os tipos de células, as amostras de 5 x 10 5 células / poço tinha as maiores alterações em ECAR após a adição de glucose, oligomicina, e 2-DG (Figura 5B). Além disso, normalizando a concentração de proteína demonstraram que, para todos os tipos de células, os 5 x 10 5 células / poço amostras produziram os melhores resultados, enquanto que as concentrações-especialmente inferiores 0,625 x 10 5 células / bem-não exibir uma capacidade de reserva glycolytic robusto. Não glycolytic acidificação, glicólise, e capacidade glicolítica aparente linearmente correlacionados com densidades de revestimento para todos os tipos de células (Figura 5C). Para a experiência a glicólise o stress, o gráfico mostra que a glucose OCR ligeiramente estimula a respiração mitocondrial, o qual é então inibida pelo tratamento com oligomicina; a adição de 2-DG não afectou o OCR (Figura 5D). O gráfico OCR pode ser usado como mais um indicador de que o experimento glicólise estresse foi realizado com sucesso. Além disso, o gráfico OCR pode ser utilizado para corrigir o gráfico ECAR, se necessário, como explicado acima, no caso do teste de stress mitocondrial 12,29.
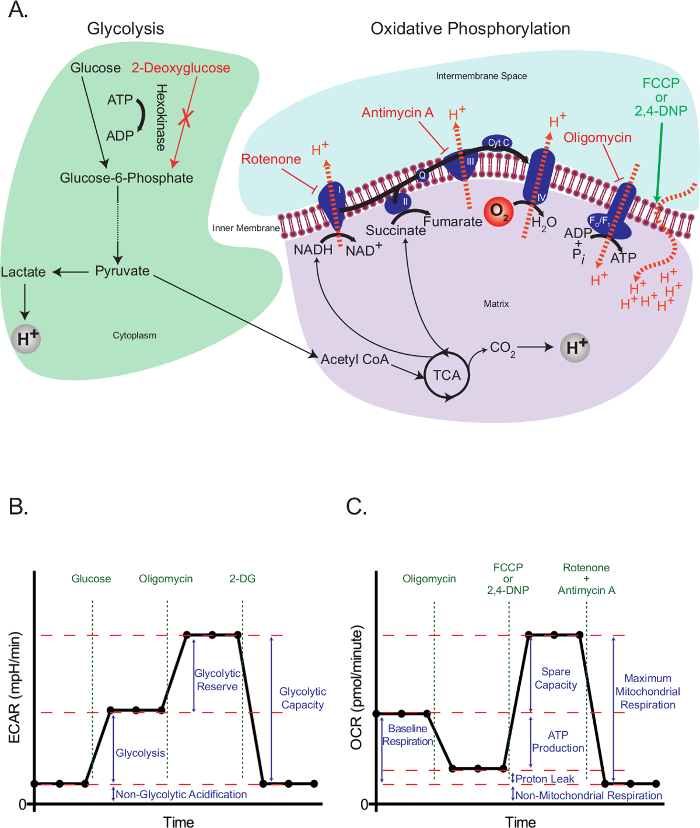
Figura 1:. Esboço de ensaios de fluxo extracelular (A) Ilustração da glicólise (esquerda) e fosforilação oxidativa (direita), mostrando a acção dofármacos metabólicos utilizados nos ensaios de fluxo extracelular. (B) Esquema de a taxa de acidificação extracelular (ECAR) gráfico; esquemática do gráfico do ritmo de consumo de oxigênio (OCR) (C). Por favor clique aqui para ver uma versão maior desta figura.
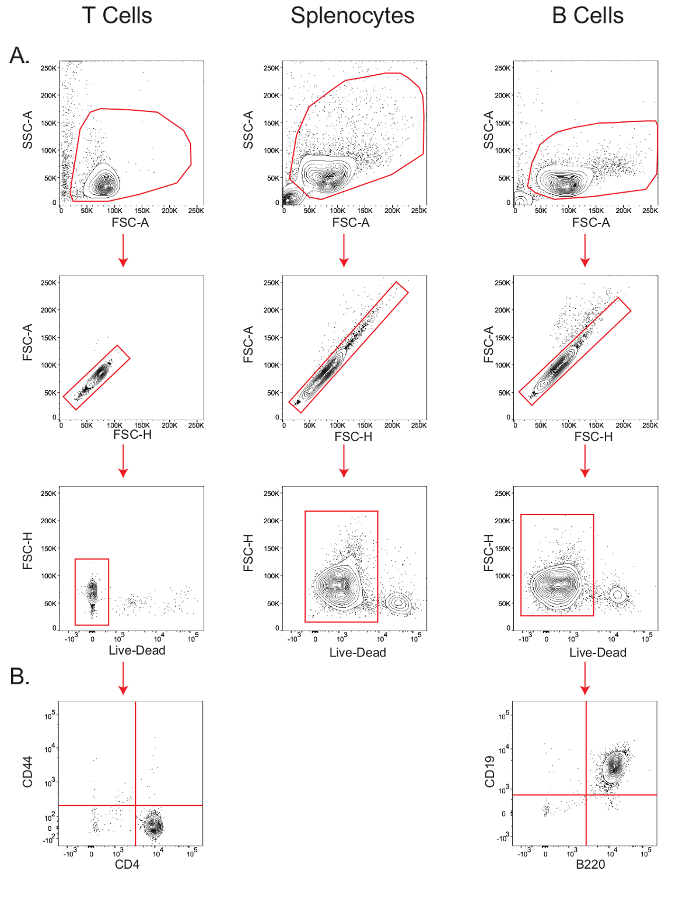
. Figura 2: gating gradual de células T, células B, e esplenócitos para determinar a viabilidade e a pureza de citometria de fluxo que mostram a viabilidade parcelas de células T, os esplenócitos e as células B (A); e a pureza das células B (B) e t. Os resultados são representativos de pelo menos três experiências independentes. Por favor clique aqui para ver uma versão maior do thé figura.
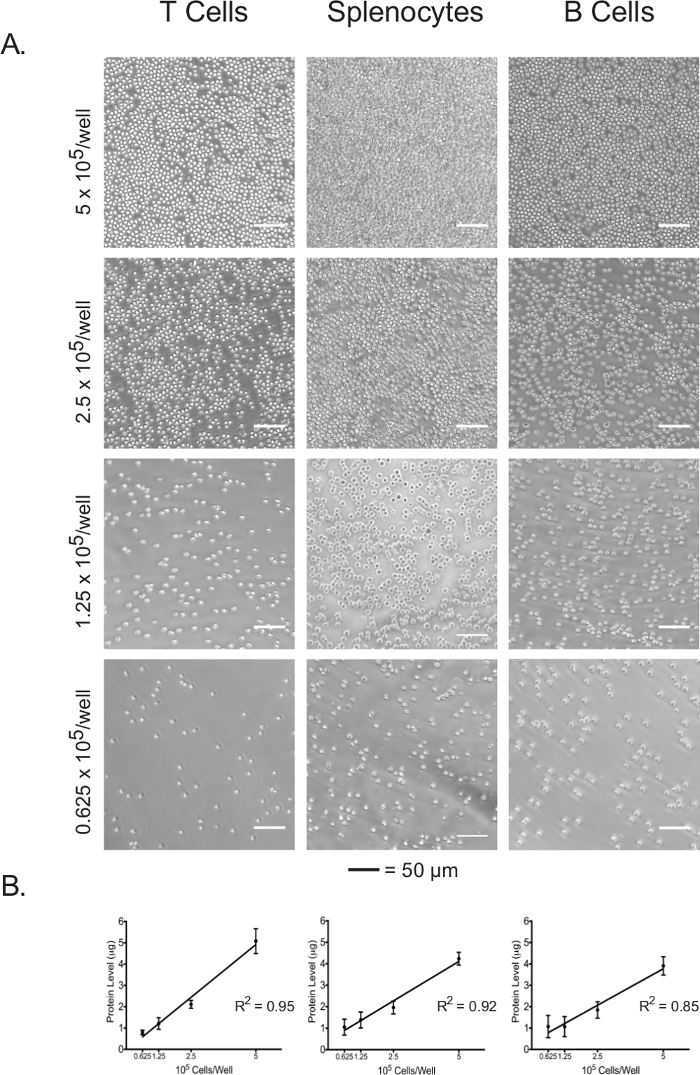
Figura 3:. Confluência celular correlaciona-se com as concentrações de proteína de lisado de cada tipo de célula em diferentes densidades de revestimento (A) micrografias ópticas de células nos poços da placa de ensaio a densidades de revestimento variando de 5 x 10 5 células / poço e 0,625 x 10 5 células / bem. As barras de escala representam 50 mm. As concentrações de proteína (B) Lisado com diferentes densidades de plaqueamento, tal como medido pelo ensaio de BCA. Os resultados são representativos de pelo menos três experiências independentes. Por favor clique aqui para ver uma versão maior desta figura.
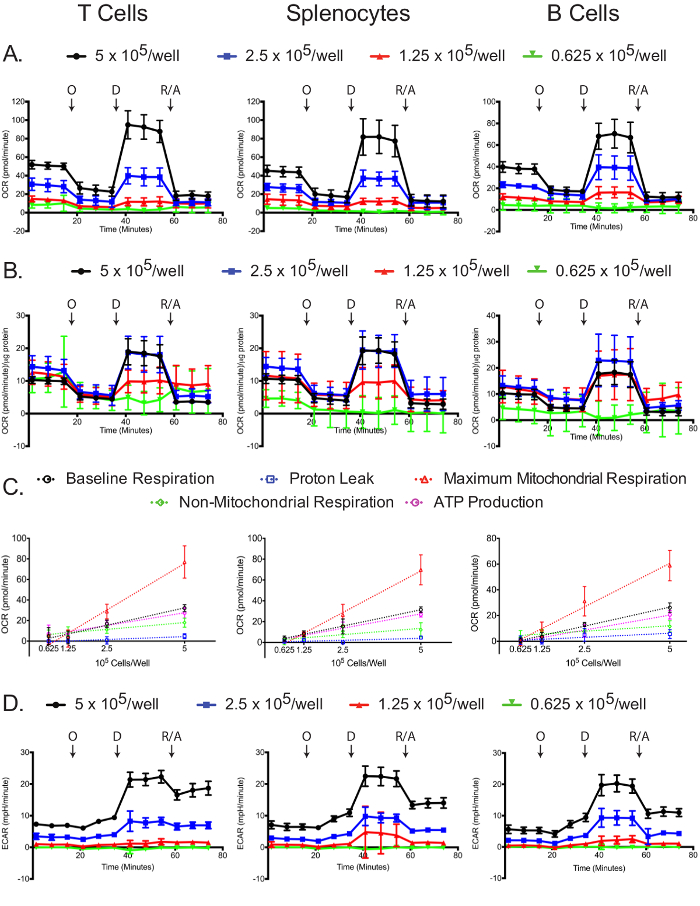
Figura 4: Ensaio mitocondrial stress. Bruto (A) e (B) OCR normalizado para cada tipo de célula e densidade de revestimento são mostradas. (C) de células alterações dependentes do número nos níveis de linha de base, e a respiração mitocondrial máxima não-mitocondrial, bem como os consumos de oxigénio ligados ao vazamento de protão ou a produção de ATP, são mostrados para cada tipo de célula. Valores (D) Raw eCar obtidos a partir dos testes de estresse mitocondriais são mostrados. Cada ponto de dados representa a média de 7-8 poços com desvio padrão. setas marcadas denotar injecções de oligomicina (S), 2,4-DNP (D), e rotenona / antimicina A (R / D). Os resultados são representativos de pelo menos três experiências independentes. Por favor clique aqui para ver uma versão maior desta figura.
_upload / 54918 / 54918fig5.jpg "/>
Figura 5:. Ensaio de tensão Glicosidases bruto (A) e (B) ECAR normalizado para cada tipo de célula e densidade de revestimento são mostradas. (C) Celulares alterações dependentes do número de ECAR de acidificação não glycolytic, glicólise induzida por glicose e capacidade glicolítica são os apresentados. Valores (D) OCR bruto obtidos a partir dos testes de stress glicolíticas são mostrados. Cada ponto de dados representa a média de 7-8 poços com desvio padrão. setas marcadas denotar injecções de glicose (G), oligomicina (O), e 2-desoxiglucose (2-DG). Os resultados são representativos de pelo menos três experiências independentes. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo que nós desenvolvemos permitiu o isolamento eficiente de subconjuntos de linfócitos viáveis e puro, que foram subsequentemente usadas na análise de fluxo extracelular em diferentes concentrações para avaliar as diferenças na glicólise e desempenho respiração mitocondrial. Este protocolo é projetado especificamente para linfócitos e aborda as considerações especiais relacionadas com estes tipos de células, como a baixa atividade metabólica basal, fragilidade, baixa frequência, e sua incapacidade de aderir às placas de ensaio. Portanto, em comparação com os protocolos previamente publicados 11,12, o nosso método oferece um guia mais conveniente e melhor optimizados para os investigadores que trabalham no campo da imunologia. Há vários passos críticos neste protocolo, incluindo a obtenção de populações celulares puras e viáveis, plaqueamento das células em confluência ideal, e padronizar as medições extracelulares ensaio de fluxo para a concentração de proteína em cada poço.
o initial número de células plaqueadas ambos podem ser visualizados por microscopia de luz e também ser quantificada usando medições da concentração de proteína. A correlação linear entre o número de células e concentração de proteína confirmou que a concentração de proteína pode realmente ser usado como uma maneira de padronizar os efeitos das mudanças no número de células entre diferentes poços.
Ao padronizar os resultados ECAR e OCR para as concentrações de proteína, que mostraram que, apesar de inferior a confluência celular, tão poucos como 2,5 x 10 5 células / poço pode ser usado na maioria dos ensaios, sem comprometer a qualidade dos dados. No entanto, o limite inferior de células que podem ser utilizadas variaram entre tipos de células e ensaios. Por exemplo, enquanto que somente 1,25 x 10 5 células poderia ser usado para as medições de OCR células B, até 2,5 x 10 5 células / poço não foram suficientes para avaliar o desempenho glicolítica do mesmo tipo celular. Por conseguinte, enquanto o número de células não é um factor limitativo, plaqueamento em mais90% de confluência, o que corresponde aproximadamente a 5 x 10 5 linfócitos / cavidade, é preferível. Otimização pode ser necessária quando as células de diferentes tamanhos, tais como previamente activado e são linfócitos-utilizado parcialmente diferenciadas. Além disso, quando se utiliza linfócitos primários previamente cultivadas, pode haver uma variação na viabilidade celular entre os diferentes condições de tratamento, o que diminuiria a fiabilidade da concentração de proteína, como uma medida do número de células desde mortos ou células que morrem também podem contribuir para os níveis de proteína medidos . Em tais casos, pode ser útil para classificar células vivas por citometria de fluxo antes da realização de ensaios de fluxo extracelulares.
Em nossos ensaios utilizando populações recém-isoladas e altamente viáveis de linfócitos, foram obtidos dados funcionais confiáveis para ambos os OCR e eCar medições. Embora todos os tipos de células se comportavam de forma semelhante no teste de estresse mitocondrial, marcantes diferenças entre os tipos de células foramobservada no teste de stress a glicólise. Por exemplo, o desempenho glicolítica de células T naive foi baixa em comparação com os esplenócitos ou células B, e não se alterou com a adição de oligomicina. Esta observação está de acordo com estudos previamente publicados 7,30, confirmando a validade do nosso protocolo.
Em conclusão, o método oferece uma maneira eficiente e conveniente de testar a actividade metabólica de linfócitos utilizando um analisador de fluxo extracelular, e que podem ser úteis em uma ampla gama de estudos imunológicos explorar as alterações metabólicas em células imunitárias mediante a activação, a diferenciação das células ou devido a fenótipos da doença, tais como infecção, autoimunidade e hematológicas malignas.
Divulgações
The authors declare that they have no competing financial interests. Open Access fees for this article were provided by Agilent Technologies.
Agradecimentos
The authors thank Dr. Michael N. Sack (National Heart, Lung, and Blood Institute) for support and discussion, Ms. Ann Kim for optimizing the B cell isolation protocol, Dr. Joseph Brzostowski for his help with microscopy, and Ms. Mirna Peña for maintaining the animals used. This study was supported by the Intramural Research Programs of the National Institutes of Health, National Institute of Allergy and Infectious Diseases, and National Heart, Lung, and Blood Institute.
Materiais
| Name | Company | Catalog Number | Comments |
| PBS (pH 7.2) | Gibco-ThermoFisher | 20012-050 | To make MACS buffer |
| Bovine Serum Albumin BSA | Sigma-Aldrich | A3803 | To make MACS buffer |
| 0.5 M EDTA, pH 8 | Quality Biological | 10128-446 | To make MACS buffer |
| autoMACS rinsing solution | Miltenyi Biotec | 130-091-222 | Instead of PBS + EDTA to make MS buffer. Also used in autoMACS Pro Separator. |
| RPMI-1640 | Gibco-ThermoFisher | 11875-093 | Contains phenol red and L-glutamine |
| Fetal Bovine Serum | Gibco-ThermoFisher | 10437-028 | For heat-inactivation, thaw frozen stock bottle in a 37 °C water bath and then inactivate at 56 °C for 30 min. Aliquot heat-inactivated serum for storage (e.g., in 50 ml conical tubes) and freeze at -20 °C until needed. |
| Penicillin-Streptomycin (Pen Strep) | Gibco-ThermoFisher | 15140-122 | Combine Pen Strep with L-Glut 1:1 (if making 500 ml media, make a total of 12 ml Pen Strep/L-Glut); keep aliquots at -20 °C until ready to make media. |
| L-Glutamine 200 mM (L-Glut) | Gibco-ThermoFisher | 25030-081 | Component of RF10 and stress test media |
| Sodium pyruvate 100 mM | Gibco-ThermoFisher | 11360-070 | Component of RF10 and stress test media |
| HEPES 1 M | Gibco-ThermoFisher | 15630-080 | Component of RF10 |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco-ThermoFisher | 11140-050 | Component of RF10 |
| 2-Mercaptoethanol (55 mM) | Gibco-ThermoFisher | 21985-023 | Component of RF10 |
| Falcon 70 μm cell strainer | Falcon-Fischer Scientific | 87712 | Used in cell isolation |
| Monoject 3 ml Syringe, Luer-Lock Tip | Covidien | 8881513934 | Used in cell isolation |
| Falcon 15 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-959-53A | Used in cell isolation |
| Falcon 50 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-432-22 | Used in cell isolation |
| ACK Lysing Buffer | Lonza | 10-548E | Used in cell isolation |
| CellTrics 30 μm cell filter, sterile, single-packed | Partec CellTrics | 04-004-2326 | Used in cell isolation |
| B Cell Isolation Kit, mouse | Miltenyi Biotec | 130-090-862 | Used in cell isolation |
| Naïve CD4+ T cell isolation kit, mouse | Miltenyi Biotec | 130-104-453 | Used in cell isolation |
| LS Column | Miltenyi Biotec | 130-042-401 | Used in cell isolation |
| MidiMACS separator | Miltenyi Biotec | 130-042-302 | Magnet for separation |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | Holder for magnets |
| autoMACS Rinsing Solution | 130-091-222 | Rinsing solution for autoMACS Pro Separator | |
| autoMACS Pro Separator Instrument | Miltenyi Biotec | N/A | |
| 2-Deoxy-D-glucose (2-DG) | Sigma-Aldrich | D8375-5G | |
| Cell-Tak | Corning | 354240 | Cell adhesive. Take care to note concentration, as each lot is different (package is 1 mg). |
| Oligomycin | Sigma-Aldrich | 75351 | |
| 2,4-Dinotrophenol (2,4-DNP) | Sigma-Aldrich | D198501 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Halt Protease Inhibitor Cocktail | ThermoFisher Scientific | 78429 | Supplied as 100x cocktail, combine with RIPA to form 1x solution for lysis. |
| RIPA Buffer | Boston BioProducts | BP-115 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | Follow manufacturer's instructions |
| Seahorse XFe96 FluxPak | Seahorse Bioscience | 101085-004 | Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
| Seahorse XF Base Medium | Seahorse Bioscience | 102353-100 | Used to prepare stress test media |
| Seahorse XFe96 Extracellular Flux Analyzer | Seahorse Bioscience | ||
| Stericup Sterile Vacuum Filter Units, 0.22 μm | EMD Millipore-Fisher Scientific | SCGPU10RE | Used to sterile filter media. |
| Sodium bicarbonate | Sigma-Aldrich | 487031 | Dissolved to 0.1 M and used to dilute Cell-Tak. |
Referências
- Motz, G. T., Coukos, G. Deciphering and reversing tumor immune suppression. Immunity. 39 (1), 61-73 (2013).
- Akkaya, M., Barclay, A. N. How do pathogens drive the evolution of paired receptors?. Eur J Immunol. 43 (2), 303-313 (2013).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu Rev Immunol. 27, 591-619 (2009).
- Dinarello, C. A. Proinflammatory cytokines. Chest. 118 (2), 503-508 (2000).
- Kurosaki, T., Kometani, K., Ise, W. Memory B cells. Nat Rev Immunol. 15 (3), 149-159 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Gerriets, V. A., Rathmell, J. C. Metabolic pathways in T cell fate and function. Trends Immunol. 33 (4), 168-173 (2012).
- Doughty, C. A., et al. Antigen receptor-mediated changes in glucose metabolism in B lymphocytes: role of phosphatidylinositol 3-kinase signaling in the glycolytic control of growth. Blood. 107 (11), 4458-4465 (2006).
- Caro-Maldonado, A., et al. Metabolic reprogramming is required for antibody production that is suppressed in anergic but exaggerated in chronically BAFF-exposed B cells. J Immunol. 192 (8), 3626-3636 (2014).
- Pelletier, M., Billingham, L. K., Ramaswamy, M., Siegel, R. M. Extracellular flux analysis to monitor glycolytic rates and mitochondrial oxygen consumption. Methods Enzymol. 542, 125-149 (2014).
- Mookerjee, S. A., Brand, M. D. Measurement and Analysis of Extracellular Acid Production to Determine Glycolytic Rate. J Vis Exp. (106), e53464 (2015).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Klein, A. B., et al. Impact of different cell isolation techniques on lymphocyte viability and function. J Immunoassay Immunochem. 27 (1), 61-76 (2006).
- Hsueh, R. C., et al. Purification and Characterization of Mouse Splenic B Lymphocytes. AfCS Research Reports. 1 (1), 1-11 (2012).
- Zambrano, K., et al. Prolonged ex vivo expansion and differentiation of naive murine CD43 B splenocytes. Biotechnol Prog. , (2016).
- Costa, G. L., et al. Targeting rare populations of murine antigen-specific T lymphocytes by retroviral transduction for potential application in gene therapy for autoimmune disease. J Immunol. 164 (7), 3581-3590 (2000).
- Franz, B., May, K. F., Dranoff, G., Wucherpfennig, K. Ex vivo characterization and isolation of rare memory B cells with antigen tetramers. Blood. 118 (2), 348-357 (2011).
- Schneider, D. F., Glenn, C. H., Faunce, D. E. Innate lymphocyte subsets and their immunoregulatory roles in burn injury and sepsis. J Burn Care Res. 28 (3), 365-379 (2007).
- Reeves, J. P., Reeves, P. A. Removal of lymphoid organs. Curr Protoc Immunol. Chapter 1, Unit 1 9 (2001).
- Akkaya, B., et al. A Simple, Versatile Antibody-Based Barcoding Method for Flow Cytometry. J Immunol. 197 (5), 2027-2038 (2016).
- Traba, J., et al. Fasting and refeeding differentially regulate NLRP3 inflammasome activation in human subjects. J. Clin. Invest. 125 (12), 4592-4600 (2015).
- Wick, A. N., et al. Localization of the Primary Metabolic Block Produced by 2-Deoxyglucose. J. Biol. Chem. 224 (2), 963-969 (1957).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthetase system. Methods Enzymol. 55, 472-518 (1979).
- Terada, H. Uncouplers of oxidative phosphorylation. Environmental Health Perspectives. 87, 213-218 (1990).
- Mookerjee, S. A., Nicholls, D. G., Brand, M. D. Determining Maximum Glycolytic Capacity Using Extracellular Flux Measurements. PLOS ONE. 11 (3), e0152016 (2016).
- Lai, L., Alaverdi, N., Maltais, L., Morse, H. C. Mouse cell surface antigens: nomenclature and immunophenotyping. J Immunol. 160 (8), 3861-3868 (1998).
- Gerberick, G. F., Cruse, L. W., Miller, C. M., Sikorski, E. E., Ridder, G. M. Selective modulation of T cell memory markers CD62L and CD44 on murine draining lymph node cells following allergen and irritant treatment. Toxicol Appl Pharmacol. 146 (1), 1-10 (1997).
- Mookerjee, S. A., Goncalves, R. L. S., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochim. Biophys. Acta - Bioenergetics. 1847 (2), 171-181 (2015).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. J Exp Med. 212 (9), 1345-1360 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados