Method Article
Un protocollo ottimizzato per analizzare glicolisi e mitocondriale respirazione nei linfociti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
The study of metabolism is becoming increasingly relevant to immunological research. Here, we present an optimized method for measuring glycolysis and mitochondrial respiration in mouse splenocytes, and T and B lymphocytes.
Abstract
Linfociti rispondono ad una varietà di stimoli attivando vie di segnalazione intracellulare, che a sua volta porta ad una rapida cellulare proliferazione, migrazione e differenziazione e la produzione di citochine. Tutti questi eventi sono strettamente legate allo stato di energia della cellula, e quindi studiare i percorsi che producono energia può fornire indizi circa la funzionalità complessiva di queste cellule. L'analizzatore di flusso extracellulare è un dispositivo comunemente utilizzato per valutare le prestazioni di glicolisi e la respirazione mitocondriale in molti tipi cellulari. Questo sistema è stato utilizzato per studiare le cellule immunitarie in alcuni rapporti pubblicati, ancora un protocollo completo ottimizzata, particolarmente per i linfociti è carente. I linfociti sono cellule fragili che sopravvivono male in ex vivo condizioni. Sovente sottopopolazioni linfocitarie sono rari, e lavorare con il numero di cellule bassi è inevitabile. Pertanto, è necessaria una strategia sperimentale che affronta queste difficoltà. Qui, forniamo un protocolloche consente un rapido isolamento dei linfociti vitali da tessuti linfoidi, e per l'analisi dei loro stati metabolici nell'analizzatore flusso extracellulare. Inoltre, forniamo risultati degli esperimenti in cui sono stati confrontati le attività metaboliche dei vari sottotipi di linfociti a diverse densità cellulari. Queste osservazioni suggeriscono che il nostro protocollo può essere utilizzato per ottenere risultati coerenti e ben standardizzate anche a concentrazioni basse di cellule, e quindi può avere ampie applicazioni in studi futuri concentrandosi sulla caratterizzazione degli eventi metabolici nelle cellule immunitarie.
Introduzione
La risposta immunitaria contro gli antigeni è un equilibrio strettamente regolata tra l'attivazione immunitaria e la soppressione immunitaria. L'attivazione immunitaria guida la proliferazione rapida e migrazione cellulare, così come la produzione di citochine, la secrezione di anticorpi e aumento della fagocitosi in risposta stimolante, che soppressione immunitaria inibisce semplicemente questi eventi e quindi è importante nel prevenire risposte immunitarie inutili 1-6. Recenti studi hanno dimostrato che esiste un legame diretto tra lo stato di attivazione delle cellule immunitarie e l'attività delle varie vie metaboliche 7. Le cellule immunitarie possono spostare tra riposo e attivati gli stati passando percorsi di produzione di energia e si spegne. Inoltre, è stato osservato che i diversi tipi di cellule immunitarie possono utilizzare diverse strategie metaboliche per alimentare le loro aumentati fabbisogni energetici durante l'attivazione. Ad esempio, mentre l'attivazione dei linfociti T dirige cellule in uno stato quasi completamente glicolitico 8 , i linfociti B attivati utilizzare un equilibrio di glicolisi e fosforilazione ossidativa 9,10. Questi studi sottolineano l'importanza di indagare gli effetti di attivazione delle cellule immunitarie sul metabolismo cellulare.
In tempo reale, misure simultanee del tasso di consumo di ossigeno (OCR) e tasso di acidificazione extracellulare (ECAR), come indicatori di fosforilazione ossidativa e glicolisi, è una strategia comune per affrontare gli stati di percorsi di produzione di energia 11-13. Per realizzare ciò, un analizzatore di flusso extracellulare, come la Seahorse XF 96, viene utilizzato di routine. Tale strumento può confrontare rapidamente cambiamenti di OCR e ECAR attraverso tipi di cellule o su diverse condizioni di stimolazione. Finora, vari tipi di cellule, comprese le cellule immunitarie, sono stati studiati utilizzando questi dispositivi. Tuttavia, un protocollo ottimizzato specificamente progettato per cellule immunitarie non è disponibile.
Le cellule immunitarie, in particolare i linfociti, differiscono da oti suoi tipi di cellule in diversi modi critici. I linfociti sono cellule fragili che non sopravvivono per lunghi periodi in condizioni ex vivo 14-16. Questo è un problema ancora maggiore quando sono coltivate in terreni di crescita subottimale manca nutrienti essenziali, come quelli utilizzati nell'analisi flusso extracellulare. A differenza di macrofagi e molte linee di cellule, linfociti non aderiscono a superfici plastiche; pertanto è fondamentale per il fissaggio della piastra di analisi senza generare stress. Infine, alcune sottopopolazioni di linfociti possono essere estremamente rari e la raccolta presso le richieste, quantità ottimali potrebbero essere impegnativo 17-19.
Qui, forniamo un protocollo ottimizzato che è specificamente sviluppato per i linfociti. Utilizzando splenociti, linfociti B e ingenuo linfociti T CD4 + isolate da milza e linfonodi del mouse 20, mostriamo le caratteristiche del loro stato di riposo glicolisi e fosforilazione ossidativa a differenle densità di cellule t. I dati sono stati normalizzati per spiegare le differenze nel numero di cellule iniziali per ciascun pozzetto misurando le concentrazioni proteiche lisato cellulare saggio finale, che erano direttamente proporzionali ai numeri cellulari. Il nostro protocollo non solo fornisce le linee guida per il rapido isolamento dei linfociti vitali per saggi di flusso extracellulari, ma permette anche di lavorare a concentrazioni di cellule non ottimali senza compromettere la qualità dei dati.
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con il protocollo animali LIG-4, che è stato approvato dal Comitato di cura e l'uso degli animali NIAID.
1. Preparazione dei reagenti
- Preparare tampone di separazione magnetica (MS): PBS (pH 7,2) supplementato con 0,5% BSA e 2 mM EDTA o soluzione separazione automatica supplementato con 0,5% BSA. filtro sterile (0,22 micron) e conservare a 2-8 ° C.
- Preparare media RF10: terreno RPMI 1640 supplementato con 10% di siero fetale bovino inattivato al calore, 50 U / ml di penicillina, 50 pM streptomicina, 1 mM di sodio piruvato, 2 mM L-glutammina, 0,1 mM aminoacidi non essenziali, 50 pM 2 -mercaptoetanolo, 10 mM HEPES. Utilizzare i reagenti sterili. filtro sterile e conservare a 2-8 ° C.
- Preparare mitocondriale mezzo di stress test: terreno di base XF supplementato con piruvato di sodio 1 mm, 2 mm L-glutammina e 25 mm di glucosio.
- Preparare la glicolisi mezzo di stress test: medio supplemen di base XFTed con 2 mM L-glutammina.
- Regolare il pH di entrambi i mezzi di prova mitocondriale e lo stress glicolisi a 7.4, filtro sterile e conservare a 2-8 ° C. mezzi Riscaldare a 37 ° C e ri-regolare il pH prima dell'uso (la misurazione del pH a 37 ° C).
NOTA: L'utilizzo medio XF, che manca il bicarbonato, è critica. Poiché l'atmosfera nell'analizzatore flusso extracellulare contiene solo CO ambiente 2, qualsiasi bicarbonato nel mezzo, in seguito al legame di protoni rilasciati come sottoprodotto della glicolisi, lo dissocia per formare CO 2 ed acqua. CO 2 sarà Degas durante l'esperimento, causando derive di pH che oscurare il segnale acidificazione glicolitico. - Preparare oligomicina: Preparare 10 mM soluzione madre in DMSO; conservare a -20 ° C.
- Preparare 2,4-DNP: Preparare 1 M soluzione madre in DMSO; conservare a -20 ° C.
- Preparare antimicina A: Preparare 10 mM soluzione madre in DMSO; conservare a -20 ° C.
- Preparare rotenone: Preparare 10 mM ssoluzione tock in DMSO; conservare a -20 ° C.
- Preparare glucosio: Sciogliere glucosio nel mezzo di prova di stress glicolisi per formare una soluzione 250 mM; preparare fresco prima di ogni esperimento e non congelare.
- Preparare 2-DG: Sciogliere solido 2-DG nel mezzo di prova di stress glicolisi per formare una soluzione di 500 mm; preparare fresco prima di ogni esperimento e non congelare.
2. La raccolta della milza e nei linfonodi di topi
- Eutanasia il mouse da CO 2 asfissia seguita da dislocazione cervicale.
- Spruzzare il mouse con il 70% di etanolo.
- Per la successiva isolamento delle cellule T, raccogliere la milza, cervicale superficiale, superficiali ascellare / profonda, mandibolare, inguinali, e linfonodi mesenterici.
- Per la successiva isolamento delle cellule B, raccolto solo la milza.
NOTA: Utilizzare un armadio biosicurezza e mantenere gli organi raccolti in PBS o supporto RF10 in ghiaccio fino al trattamento. Utilizzare da laboratorio sterile e tecnica sterile per tutti i trattamenti e ISOLpassi inflazione. Tenere tutti i buffer e dei media sul ghiaccio per aumentare l'efficienza di isolamento e di ridurre la morte cellulare.
Processing 3. Tissue
- Mettere un filtro 70 micron cellulare su un tubo conico da 50 ml e trasferire gli organi sul filtro. Per l'isolamento delle cellule T, unire tutti gli organi e B trasferimento isolamento delle cellule solo la milza.
- Utilizzando lo stantuffo di una siringa sterile da 3 ml, schiacciare il tessuto attraverso il filtro. Durante schiacciare, assicurarsi che il filtro e gli organi sono umidi in ogni momento e bagnare come richiesto con l'aggiunta di buffer di MS. Ciò sia mantenere la vitalità cellulare alta e prevenire l'intasamento del filtro.
- Dopo mashing, applicare 5-10 ml MS buffer per il filtro per aumentare il recupero delle cellule. Centrifugare la sospensione a 400 xg per 5 minuti a 4 ° C. (Effettuare tutte le ulteriori centrifugazioni in queste condizioni, se non specificato).
- Decantare il liquido e risospendere il pellet in 5 ml ACK tampone di lisi dei globuli rossi. Incubate per 5 minuti in ghiaccio per lisare i globuli rossi (globuli rossi devono essere rimossi perché interferiscono con la separazione magnetica). Aggiungere 10-20 ml MS tampone e centrifugare.
- Mettere un filtro cella di 30 micron in un tubo da 15 ml e il primo con 1 ml di MS tampone (questa filtrazione sarà rimuovere i detriti dalla lisi degli eritrociti). Decantare il liquido dal tubo centrifugato, risospendere il pellet in 5 ml MS tampone e farlo passare attraverso il filtro. Lavare il tubo iniziale con 4 ml di MS buffer per aumentare il recupero delle cellule, e utilizzare questo per sciacquare il filtro.
- Utilizzando un emocitometro o un contatore automatico di cellule, determinare il numero totale di cellule. Questo numero cellulare sarà utilizzata per determinare la quantità di reagenti separazione magnetici richiesti al punto 4. Se splenociti devono essere utilizzati nella successiva analisi flusso extracellulare, annullare il numero appropriato di cellule in questo momento.
- Centrifugare la sospensione e procedere alla separazione magnetica. splenociti Risospendere non utilizzatiper l'isolamento delle cellule B in 5 ml RF10 e tenere in ghiaccio fino a quando il test del flusso extracellulare.
4. Separazione magnetica di cellule B e cellule T CD4 Naïve
- Determinare i volumi necessari di cocktail di biotina-anticorpo, microsfere anti-biotina, e buffer di MS. Utilizzare i seguenti volumi per 10 a 8 celle da guida e scalare verso l'alto o verso il basso, se necessario.
NOTA: incubare i campioni in frigorifero piuttosto che sul ghiaccio da incubazione su ghiaccio può ridurre l'efficienza degli anticorpi di legame e potrebbero essere necessari tempi di incubazione più lunghi.
| Reagenti per ingenuo separazione delle cellule T CD4 + | Volume per 10 a 8 celle |
| (scala in modo appropriato) | |
| cocktail biotina-anticorpo | 100 pl |
| buffer di MS per prima incubazione | 400 ml |
| microsfere anti-biotina | 200 ml |
| microsfere CD44 | 100 pl |
| buffer di MS per seconda incubazione | 200 ml |
| Incubare il cocktail e le cellule biotina-anticorpo a 4 ° C per 5 min. Aggiungere microsfere anti-biotina, microsfere CD44, MS tampone e incubare a 4 ° C per 15 min. | |
Tabella 1: volumi e le istruzioni di isolamento delle cellule T.
| Reagenti per la separazione delle cellule B | Volume per 10 a 8 celle |
| (scala in modo appropriato) | |
| cocktail biotina-anticorpo | 100 pl |
| buffer di MS per prima incubazione | 400 ml |
| microsfere anti-biotina | 200 ml |
| buffer di MS per seconda incubazione | 300 microlitri |
| Incubare il cocktail e le cellule biotina-anticorpo a 4 ° C per 15 min. Aggiungere il volume appropriato di cocktail biotina-anticorpo e il buffer MS, ed incubare la miscela a 4 ° C per 15 min. Aggiungere il volume appropriato di microsfere anti-biotina e MS tampone ed incubare la miscela a 4 ° C per 15 min. Dopo la seconda incubazione, riempire il tubo con tampone MS e centrifugare. | |
Tabella 2: volumi e le istruzioni di isolamento delle cellule B.
- Risospendere il pellet in tampone MS: 500 microlitri per la separazione manuale, 3-4 ml per la separazione automatica.
- Continuare sia con separazioni manuali o automaticiCome segue:
- Separazione manuale:
- Inserire una colonna LS nel magnete di separazione, inserire un tubo conico sterili 15 ml di sotto per raccogliere il flusso attraverso, e il primo la colonna mediante lavaggio con 3 ml di tampone di MS. Gettare il flusso attraverso.
- Trasferire la sospensione cellulare alla colonna LS innescato e farlo passare attraverso; lavare il tubo utilizzato durante l'incubazione con 3 ml di MS tampone e passare questo attraverso la colonna pure. L'eluato conterrà le cellule purificate. Per l'isolamento delle cellule B, passare le cellule purificate attraverso la colonna una seconda volta in un nuovo tubo 15 ml, e ripetere la fase di lavaggio. Ciò aumenterà purezza e resa.
- Separazione automatizzato:
- Accendere il separatore automatico e controllare i livelli di gestione del buffer, soluzione di risciacquo e il 70% di etanolo. Assicurarsi che il rifiuto è vuoto prima di iniziare la separazione.
- Selezionare il rack refrigerate appropriata a seconda della dimensione del tubo di tegli campione non depurate (ad esempio, 15 ml). Al fine di mantenere le cellule vitali durante il processo di separazione, utilizzare rastrelliere che sono stati precedentemente raffreddati a 2-8 ° C per 3-4 ore, o fino a quando il refrigerante diventa solido.
- Montare il rack raffreddato sul palco del campione del separatore automatico.
- Posizionare il tubo campione nello slot A1, un tubo per la frazione negativo nello slot B1, e un tubo per la frazione positiva in C1. Se la raccolta di più di un campione, posizionare provette in colonne successive (A2, B2, C2, etc.).
- Selezionare la scheda di separazione sul touchscreen, e indicano la disposizione dei tubi sul rack. Dal menu di separazione, selezionare il programma "esaurisce" e completare il ciclo del programma con il tipo appropriato di lavaggio (vedi nota sotto).
NOTA: il programma "esaurisce" svolge esaurimento utilizzando la modalità più sensibile della macchina, che privilegia la purezza. Inoltre, ci sono tre diverse opzioni di lavaggio: quick lavare, risciacquare, e dormire. Se i campioni sono dalla stessa fonte e devono essere combinati, seleziona risciacquo rapido. Se i campioni devono essere tenuti separati, selezionare risciacquo. Selezionare l'opzione di sonno se non ulteriori isolamenti saranno effettuate quel giorno e se la macchina si chiuderà dopo l'isolamento - Avviare l'isolamento premendo il tasto "Esegui" e confermare i livelli di buffer quando richiesto. Dopo che il programma è terminato, la frazione negativo conterrà cellule purificate.
- Riempire il tubo conico fino a 15 ml con MS tampone e centrifugare.
- Decantare il MS tampone e risospendere le cellule in 5 ml supporto RF10. Mantenere le cellule in ghiaccio fino a quando il test del flusso extracellulare.
NOTA: Idealmente, il saggio flusso extracellulare deve essere effettuata immediatamente dopo l'isolamento. Tuttavia, in esperimenti preliminari non sono state osservate differenze significative nei risultati del test in cellule utilizzate nel raggio di 3 ore di isolamento rispetto a quelli appena isolati.
- Separazione manuale:
5. Extracellulare Flux Assay
NOTA: Il protocollo descritto qui è per il formato a 96 pozzetti dello strumento. I volumi dovranno essere adeguati se si utilizza un altro formato.
- L'idratazione della cartuccia sensore
- Sollevare la cartuccia della sonda, riempire ciascun pozzetto della piastra di servizio con 200 ml di soluzione calibrante e abbassare la cartuccia del sensore sulla piastra di utilità, immergendo i sensori nella soluzione calibrante.
NOTA: verificare che il livello della soluzione calibrante è abbastanza alto per mantenere i sensori sommerse. La cartuccia porti fluorofori associati a O 2 e H + per ogni bene; questi devono essere idratati in modo per loro di lavorare correttamente. - Posizionare la cartuccia in un 37 ° C incubatore non integrato con CO 2 o ossigeno / azoto. Effettuare tutte le ulteriori fasi di incubazione in queste condizioni, se non diversamente specificato. Incubare la cartuccia durante la notte per idratare.
- Sollevare la cartuccia della sonda, riempire ciascun pozzetto della piastra di servizio con 200 ml di soluzione calibrante e abbassare la cartuccia del sensore sulla piastra di utilità, immergendo i sensori nella soluzione calibrante.
- preparzione di Piastre adesivizzato
- Preparare 2,5 ml di una / ml soluzione adesiva 22,4 mg in 0,1 M di bicarbonato di sodio, pH 8,0 (bicarbonato fornisce il pH ottimale per l'adsorbimento adesivo).
- Applicare 25 microlitri della soluzione a ciascun pozzetto della piastra dosaggio e incubare sul banco a temperatura ambiente per 20 min.
- Aspirare adesivo e lavare ogni pozzetto due volte con 200 ml di acqua sterile. Attendere fino a quando i pozzi sono asciutti prima della semina le cellule.
- Semina cellule in piastre adesive rivestite
- Centrifugare le cellule a temperatura ambiente a 200 xg per 5 min. Risospendere le cellule in 5 ml di terreno di coltura appropriato (vedi sopra per la formulazione di stress mitocondriale e mezzi di sollecitazione glucosio). cellule centrifuga di nuovo e risospendere alla concentrazione desiderata nel terreno di coltura (volume risospensione variano in funzione della concentrazione; ogni pozzetto conterrà 180 ml di sospensione cellulare).
NOTA: Fino a quando i mezzi di comunicazione di analisi appropriati e compounds vengono utilizzati, l'analizzatore di flusso extracellulare in grado di eseguire simultaneamente i test mitocondriale e lo stress glicolisi sulla stessa lastra. - Piastra 180 ml di sospensione cellulare in ciascun pozzetto. Utilizzare pozzi A1, A12, H1, e H12 per lo sfondo correzione della temperatura: aggiungere 180 ml di terreno di coltura in questi pozzi (senza celle).
- Incubare le piastre per 25 minuti a 37 ° C.
- Centrifugare la piastra a 200 xg per 5 min senza freno per garantire che tutte le cellule hanno completamente attaccato. Visivamente confermano che le cellule sono stabilmente aderenti alla superficie coltura, formando un monostrato, visualizzando al microscopio. Trasferire le piastre indietro al incubatore per altri 30 min.
- Centrifugare le cellule a temperatura ambiente a 200 xg per 5 min. Risospendere le cellule in 5 ml di terreno di coltura appropriato (vedi sopra per la formulazione di stress mitocondriale e mezzi di sollecitazione glucosio). cellule centrifuga di nuovo e risospendere alla concentrazione desiderata nel terreno di coltura (volume risospensione variano in funzione della concentrazione; ogni pozzetto conterrà 180 ml di sospensione cellulare).
- Preparazione di 10x concentrazioni di composti, e caricamento dei porti iniettori
- Per il test di stress mitocondriale, preparare 2,5 ml ciascuna di 10 oligomicina mM, 1 mM DNP, ed una miscela di 10 pM rotenone e 10 pM antimicina A, tutti in mitocondriale mediu test di stressm.
NOTA: La concentrazione di 2,4-DNP si basa su studi precedentemente pubblicati, 21 questa è una linea guida generale, ma la concentrazione di sganciamento per ogni tipo di cellula utilizzato dovrebbe essere determinato dal ricercatore. - Per lo stress test glicolisi, preparare 2,5 ml ciascuna di 250 mm di glucosio, 10 micron oligomicina, e 500 mm 2-desossiglucosio (2-DG) in terreno di coltura di stress glicolisi.
- Caldo 10x soluzioni a 37 ° C, e aggiustare il pH a 7,4.
- Caricare i composti nelle porte iniettori adatti della cartuccia utilizzando una micropipetta multicanale e le guide di carico, come segue:
Tabella 3: i volumi composti.porto Mitocondriale Assay stress Glicolisi stress test UN 20 l oligomicina 20 ml di glucosio B 22 ml 2,4-DNP 22 ml oligomicina C 25 ml antimicina A / rotenone 25 ml 2-DG
NOTA: Ogni serie di porte (ad esempio, tutte le porte A) devono contenere lo stesso volume. È fondamentale che tutti i pozzetti di una stessa serie sono caricati, anche quelli non utilizzati nell'esperimento, altrimenti non verranno iniettati composti (porti pozzetti non possono essere caricati con lo stesso volume di terreno di coltura). - Incubare la cartuccia durante l'impostazione del programma.
- Per il test di stress mitocondriale, preparare 2,5 ml ciascuna di 10 oligomicina mM, 1 mM DNP, ed una miscela di 10 pM rotenone e 10 pM antimicina A, tutti in mitocondriale mediu test di stressm.
- Impostazione extracellulare Flux Assay Protocolli
- Impostare il seguente programma (Tabella 4).
Tabella 4: il layout del programma.Passo Ciclo continuo Calibrazione - Equilibration - letture di base 3 volte: MIX 3 min, attendere 0 min, misura 3 min Loop End - Iniettare Port A - misure 3 volte: MIX 3 min, attendere 0 min, misura 3 min Loop End - Iniettare Port B - misure 3 volte: MIX 3 min, attendere 0 min, misura 3 min Loop End - Iniettare Port C - misure 3 volte: MIX 3 min, attendere 0 min, measure 3 min Loop End - Programma fine -
NOTA: in determinate condizioni, ad esempio, quando si utilizza cellule attivate, l'acidificazione può continuare più a lungo rispetto alle cellule naive. Per questo motivo, può essere necessario estendere le "wait" tempi nel programma precedente o ripetere ciascun ciclo di misura più volte. - Iniziare il programma. Dopo la fase di calibrazione, sostituire la piastra calibrante per la piastra di test (quando richiesto).
NOTA: Utilizzando il software, è possibile indicare gruppi di pozzi che hanno condizioni simili. Inoltre, è fondamentale indicare quali pozzetti sono i pozzetti di controllo (in questo protocollo, sono i quattro angoli della piastra) e per indicare quali pozzi sono vuoti. Per una più dettagliata, step-by-step, il protocollo per l'impostazione della macchina esoftware s, sito Web del produttore dovrebbe essere consultato.
- Impostare il seguente programma (Tabella 4).
- Misurare contenuto proteico
- Rimuovere il terreno di coltura residuo da ogni pozzetto senza disturbare le cellule.
NOTA: Se non è conveniente procedere con il test concentrazione di proteine, è possibile bloccare l'intera piastra a -20 ° C fino all'analisi. Se congelato, scongelare prima di continuare. - Preparare una soluzione 1x di inibitori della proteasi (100x magazzino) in media lisi RIPA (sufficiente per 50 ml / pozzetto).
- Aggiungere 50 ml di media RIPA lisi integrato con inibitori della proteasi in ciascun pozzetto. Agitare piastra su un agitatore per 5 minuti e quindi incubare piastra su ghiaccio per 30 minuti per lisare cellule completamente.
- Spin la piastra a 200 xg per 5 min a temperatura ambiente per portare lipidi e altre molecole per il fondo della piastra in modo che non interferiscano con il test dell'acido bicinconinico (BCA).
- Misurare la concentrazione di proteine mediante saggio BCA secondo il fornitore &# 39; s raccomandazioni.
- Rimuovere il terreno di coltura residuo da ogni pozzetto senza disturbare le cellule.
Risultati
Le cellule eucariotiche utilizzano una rete integrata di glicolisi, il ciclo degli acidi tricarbossilici (TCA), e la fosforilazione ossidativa per soddisfare la maggior parte delle loro richieste energetiche e fornire intermedi necessari per la crescita e la proliferazione cellulare. Questi percorsi iniziano con la cattura intracellulare di glucosio libero sotto forma di glucosio-6-fosfato, che successivamente viene trasformato in piruvato. Il piruvato è sia ridotto a lattato o trasportati nei mitocondri, dove forma acetil coenzima A (CoA). Acetil-CoA entra quindi nel ciclo TCA. Intermedi ad alta energia del ciclo TCA sospingere il movimento degli elettroni nella catena di trasporto degli elettroni (ETC), che a sua volta espelle H + dalla matrice mitocondriale per generare un H + gradiente attraverso la membrana mitocondriale interna. Ossigeno agisce come accettore finale di elettroni e H + ritorno indietro alla matrice mitocondriale attraverso la F O / F 1 complessa, dove la loro energia potenziale è utilizzato per generare ATP (Figura 1A).
Il principio di funzionamento del dosaggio flusso extracellulare dipende interferire con glicolisi e fosforilazione ossidativa in punti specifici, e valutare gli effetti derivanti. A questo scopo, abbiamo usato il glucosio per propagare glicolisi in cellule affamate, e 2-deossiglucosio (2-DG), che viene convertito in 2-deossiglucosio-6-fosfato, un inibitore competitivo di phosphoglucoisomerase 23, dall'esochinasi, al fine di bloccare glicolisi. Rotenone (complesso inibitore specifico-I della ETC), antimicina A (un complesso inibitore III-specifico della ETC), oligomicina (inibitore della ATP sintasi 24), e l'agente disaccoppiamento 2,4-dinotrophenol (DNP) 25 erano utilizzati per intervenire eventi specifici relativi al trasporto degli elettroni, gradiente protonico e la sintesi di ATP (Figura 1A). Invece di 2,4-DNP, cya carboniliconide-4- (trifluorometossi) fenilidrazone (FCCP) può anche essere utilizzato, ma un'ulteriore ottimizzazione può essere richiesto. In entrambi i casi, uncouplers dovrebbero sempre essere titolati per uno specifico tipo cellulare prima dell'uso per determinare la concentrazione ottimale necessaria.
Lo stress test glicolisi (Figura 1B) inizia con una misura di base del tasso di acidificazione extracellulare (ECAR) nelle cellule in precedenza affamate. Poiché queste cellule sono al loro minima basale, e possono quindi essere praticamente considerate non glicolitico, il ECAR misurata a questo punto è indicato come l'acidificazione non glicolitico. Questo acidificazione probabilmente corrisponde a CO 2 respiratoria generato nel ciclo TCA essere convertito in HCO 3 - e H +. Segue l'iniezione di glucosio per attivare glicolisi, che presenta come un aumento acidificazione extracellulare causa della formazione di lattato.Questo aumento rappresenta il normale tasso di glicolisi. Le cellule sono poi sfidati con l'iniezione di oligomicina, che blocca la generazione di ATP attraverso la fosforilazione ossidativa. Le cellule rispondono a questa drammatica diminuzione della produzione di ATP, attivando la glicolisi al suo livello massimo, e che si traduce in un aumento secondario del livello ECAR (riserva glicolitico). La prova viene terminata totale inibizione della glicolisi usando l'analogico glucosio 2-DG, che restituisce il ECAR al suo livello non glicolitico. È interessante notare, è stato proposto che, contrariamente alle raccomandazioni del fabbricante, la glicolisi massima non è necessariamente raggiunto con l'iniezione di oligomicina 26. In cellule con una elevata capacità glicolitica, se non vi è un aumento significativo della domanda ATP, glicolisi può essere perfettamente in grado di far fronte alla perdita di ATP mitocondriale senza dover essere up-regolata. Il tasso di glicolisi con oligomicina potrebbe essere superato con l'aggiunta di inibitori delle vie respiratorie, Quali rotenone e myxothiazol, che forniscono alcuni vantaggi rispetto oligomicina: 1) Aumentano la domanda ATP, in cui possono causare l'inversione di ATP sintasi, con idrolisi, per pompare protoni nel tentativo di recuperare il potenziale di membrana mitocondriale 26; 2) Impediscono acidificazione respiratoria del mezzo, che può confondere i risultati ECAR (vedere sotto). Altri modi per aumentare la domanda ATP includono l'aggiunta di composti che stimolano l'idrolisi di ATP dai ATPasi della membrana plasmatica 26. Tutto questo dovrebbe essere considerato con attenzione da parte dei ricercatori quando si pianifica un test di stress glicolisi.
Lo stress test mitocondriale (Figura 1C) inizia con una misura di base del tasso di consumo di ossigeno (OCR) in cellule non-fame. Segue l'iniezione di oligomicina, che inibisce il ritorno di protoni attraverso il complesso F O / F 1 e quindi hyperpolariz rapidamentees la membrana mitocondriale. Iperpolarizzazione impedisce l'ulteriore protone pompaggio attraverso complessi respiratori, e il tasso diminuisce respiratorie. La respirazione rimanente viene chiamato perdita protonica, che rappresenta il flusso di protoni attraverso lipidi o altri canali. Questo stato iperpolarizzato viene rapidamente invertita mediante aggiunta dell'agente disaccoppiamento 2,4-DNP, che funge da ionoforo protonico. In risposta, le cellule cercano di recuperare il potenziale di membrana in un tentativo futile aumentando la velocità di trasporto di elettroni al massimo, e questo a sua volta aumenta il OCR. Infine, con l'aggiunta di due inibitori ETC (antimicina A e rotenone), respirazione mitocondriale completamente ferma e OCR diminuisce al livello più basso. A questo livello, il consumo di ossigeno non è dovuta ad attività mitocondriale (non mitocondriale). La differenza nella OCR generato da questi inibitori è chiamato respirazione mitocondriale massima, che è la somma della respirazione basale e la capacità inutilizzata.
B e isolamenti delle cellule T resa altamente vitali popolazioni di linfociti puri.Le cellule B e le cellule T CD4 + naive sono stati isolati come indicato nella Sezione 4 del protocollo, e splenociti sono stati semplicemente ottenuti lisi dei globuli rossi, come descritto nella Sezione 3.3.
La sensibilità di tipo-specifiche cellule saggi metabolici dipende la vitalità e la purezza della popolazione cellulare di partenza. Pertanto, al fine di verificare la vitalità delle cellule isolate topo T, splenociti e le cellule B, e la purezza delle cellule T e B, piccole aliquote di cellule sono state colorate per l'analisi citofluorimetrica (Figura 2). Nel forward scatter-zona VS lato scatter-zona (FSC-A vs SSC-A) la trama, i linfociti sono stati gated, e all'interno di questa porta, la popolazione lungo la diagonale in avanti scatter-altezzat (FSC-H) vs. FSC Una trama sono stati determinati come le canottiere. All'interno della popolazione singoletto, la vitalità è stata misurata mediante gating le cellule che macchiati negativo per il / marcatore morti vivo (Figura 2A); la vitalità delle cellule T è stata 97,9%, splenocyte viabilità è stata del 92%, e la vitalità delle cellule B è stata del 94%. B purezza delle cellule, come misurato dalla B220 + CD19 + popolazione 26, era del 99%, mentre CD4 + T purezza delle cellule, come misurato dal CD44 - CD4 + popolazione 27, era 98,3% (Figura 2B).
La concentrazione proteica del lisato cellulare può essere utilizzato come indicatore diretta del numero di cellule placcato.
Linfociti isolati e splenociti sono state piastrate in una piastra da 96 pozzetti test adesivizzato a 5 x 10 5 cellule / pozzetto, 2,5 x 10 5 cellule / pozzetto, 1,25 x 10 5 cellule / pozzetto, e 0,625 x 10 5 cellule / pozzetto. La confluenza in ciascuna densità di placcatura dei tre tipi di cellule è stato visualizzato sotto il microscopio ottico (Figura 3A). Come previsto, confluenza correlata con le densità di placcatura iniziali. Al termine del test flusso extracellulare, le cellule sono state lisate placcato e loro concentrazioni proteiche sono state quantificate usando il saggio BCA. Per tutti i tipi di cellule, concentrazioni di proteine lisato hanno dimostrato di essere linearmente correlata con la densità di placcatura iniziali (Figura 3B), il che conferma che le concentrazioni di proteine lisato possono essere usate come una misura accurata per la normalizzazione dei numeri di cellulare quando si interpretano i dati di flusso extracellulari. Le densità di placcatura utilizzati in questo esperimento sono stati ottimizzati per ingenui, i linfociti non stimolati. Se cellule stimolate o precedentemente coltivate devono essere utilizzati, può essere necessaria un'ulteriore ottimizzazione.
Mitocondriale e stres glycolyticsaggi s dipendono dal numero di cellulare placcato.
L'OCR è stata misurata per ciascun tipo di cellula e densità di placcatura in analizzatore di flusso extracellulare. Come previsto, il numero di cellule superiori hanno un OCR più alto misurato, così come risposte più drammatici oligomicina, 2,4-DNP, e antimicina A / rotenone (Figura 4A). La standardizzazione misurazioni OCR di concentrazione di proteine di ogni campione rivela che, in generale, un maggior numero di cellule portano misurazioni OCR a più accurate. Placcatura a 5 e 2,5 x 10 5 cellule / pozzetto provocato simili misurazioni normalizzate OCR nelle cellule T e splenociti e 5 e 1,25 x 10 5 cellule / pozzetto portato simili misurazioni normalizzate OCR in cellule B (Figura 4B). Le leggere differenze nella cellula B normalizzato misurazioni OCR potrebbe essere un'indicazione indiretta che le cellule B eseguono meglio a 2,5 x 10 5 cellule / pozzetto rispetto ad altre densità cellulari. Con tutte le misure, 0,625 x 10 5 cellule / pozzetto ha dato risultati non ottimali, dimostrando che questa densità placcatura è insufficiente. La respirazione basale, perdita di protoni, massima respirazione mitocondriale, la respirazione non mitocondriale e la produzione di ATP linearmente correlati con densità di placcatura per tutti i tipi di cellule (Figura 4C). Inoltre, la maggior parte della respirazione basale è usato verso sintetizzare ATP, come indicato dalla bassa perdita protonica nelle tre tipi di cellule. Mentre l'obiettivo primario dell'esperimento lo stress mitocondriale è quello di misurare le variazioni OCR l'ECAR è ancora utile per registrare assicurare che il saggio è stato eseguito con successo. Simile al OCR, i due densità di placcatura più elevati per effetto di accrescere ECAR e risposte più drammatici a oligomicina, 2,4-DNP, e antimicina A / rotenone (Figura 4D). I cambiamenti drammatici ECAR dopo l'aggiunta di 2,4-DNP, e antimicina A / rotenone possono essere dovute a cambiamenti nella respirazione, oltre ai cambiamenti di glycolysis, poiché CO 2 generato nel ciclo TCA viene convertito HCO 3 - e H +. Questo problema è stato recentemente affrontato, e non esiste un metodo semplice per correggere il segnale totale extracellulare acidificazione utilizzando dati sul consumo di ossigeno, per ottenere il tasso reale glicolisi 12,29.
Il test di stress glicolisi era di maggior successo al più alto densità di placcatura (Figura 5A, B). In tutti i tipi cellulari, i campioni 5 x 10 5 cellule / pozzetto avevano le maggiori variazioni ECAR dopo l'aggiunta di glucosio, oligomicina, e 2-DG (Figura 5B). Inoltre, normalizzando di concentrazione di proteina ha dimostrato che per tutti i tipi di cellule, i 5 x 10 5 cellule / pozzetto di campioni ha dato risultati ottimali, mentre minori concentrazioni, soprattutto 0,625 x 10 5 cellule / benessere non hanno mostrano una robusta capacità di riserva glicolitico. Non-glycolytic acidificazione, la glicolisi, e la capacità glicolitico apparente linearmente correlati con densità di placcatura per tutti i tipi di cellule (Figura 5C). Per l'esperimento sollecitazioni glicolisi, il grafico mostra che OCR glucosio stimola leggermente respirazione mitocondriale, che viene quindi inibita mediante trattamento oligomicina; l'aggiunta di 2-DG non ha influenzato il OCR (Figura 5D). Il grafico OCR può essere utilizzato come un ulteriore indicatore che l'esperimento sollecitazioni glicolisi stata effettuata con successo. Inoltre, il grafico OCR può essere utilizzato per correggere il grafico ECAR, se necessario, come spiegato in precedenza nel caso di stress test mitocondriale 12,29.
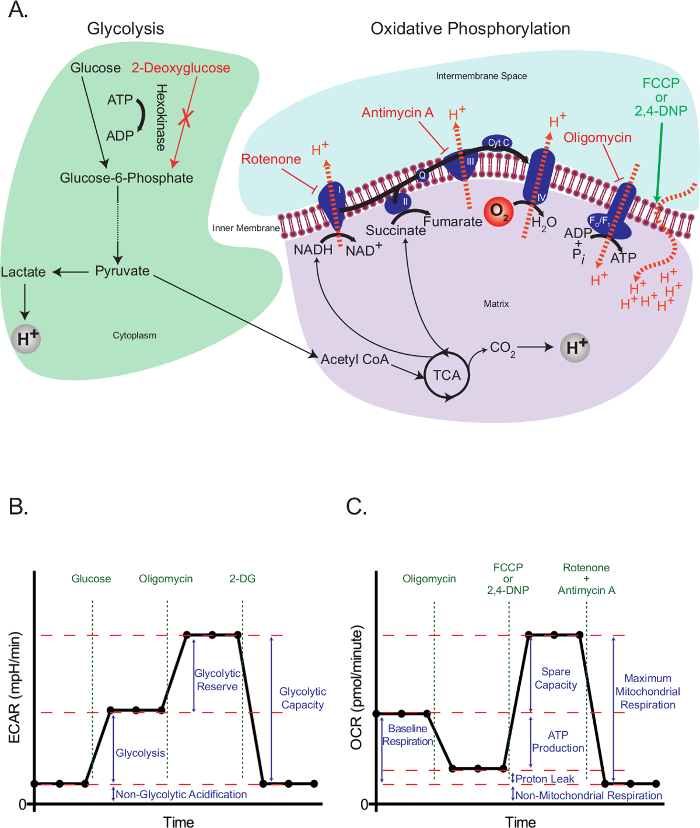
Figura 1:. Schema di saggi flusso extracellulari (A) Illustrazione della glicolisi (sinistra) e la fosforilazione ossidativa (destra) che mostra l'azione delfarmaci metabolici utilizzati nei saggi flusso extracellulari. (B) Schema del grafico tasso di acidificazione extracellulare (ECAR); schematica del grafico tasso di consumo di ossigeno (OCR) (C). Fai clic qui per vedere una versione più grande di questa figura.
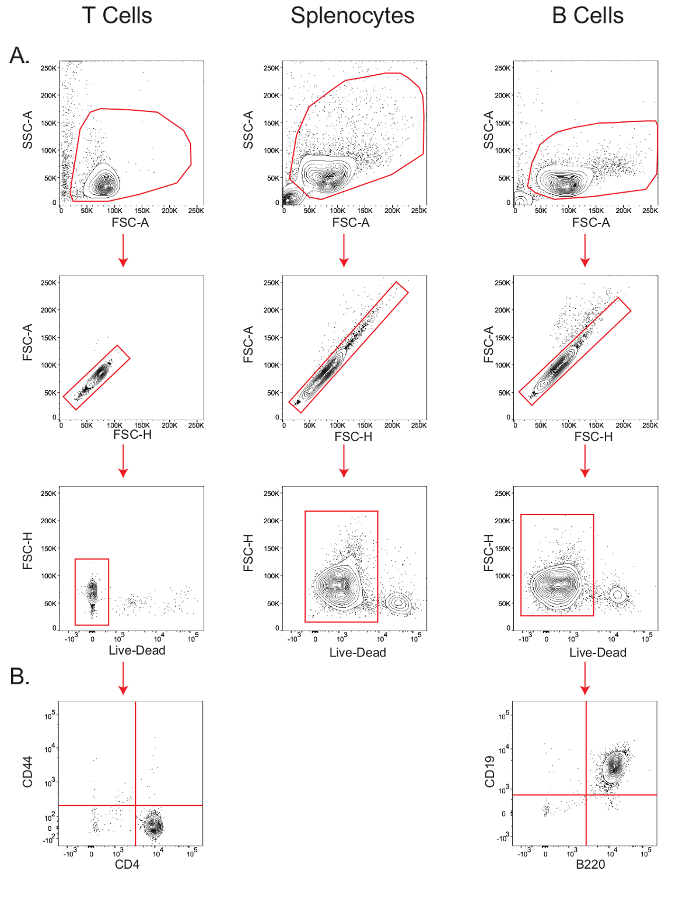
. Figura 2: gating graduale delle cellule T, cellule B, e splenociti per determinare la vitalità e purezza citometria a flusso trame che mostrano la vitalità delle cellule T, splenociti e le cellule B (A); e la purezza di T e cellule B (B). I risultati sono rappresentativi di almeno tre esperimenti indipendenti. Clicca qui per vedere una versione più grande di Thè figura.
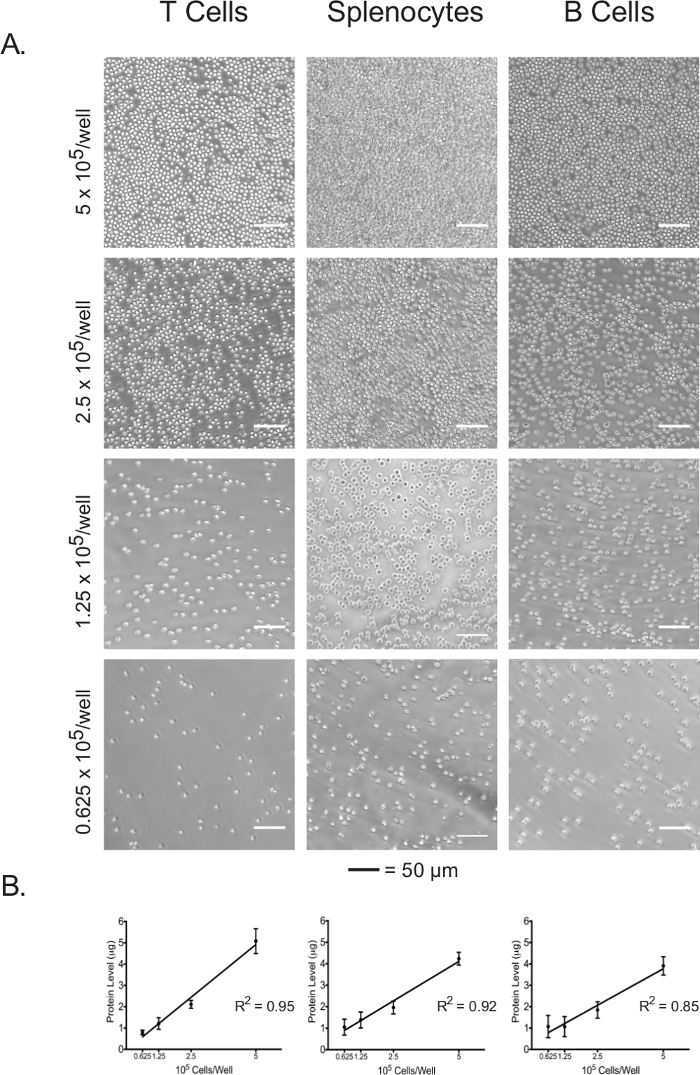
Figura 3: Cell. Confluenza correla con le concentrazioni di proteine lisato di ciascun tipo cellulare a differenti densità di placcatura (A) micrografie luce di cellule in pozzetti della piastra dosaggio a densità placcatura vanno da 5 x 10 5 cellule / pozzetto a 0,625 x 10 5 cellule / bene. Barre di scala denotano 50 micron. Concentrazioni di proteine (B) Lysate a diverse densità di placcatura, come misurate con il test BCA. I risultati sono rappresentativi di almeno tre esperimenti indipendenti. Clicca qui per vedere una versione più grande di questa figura.
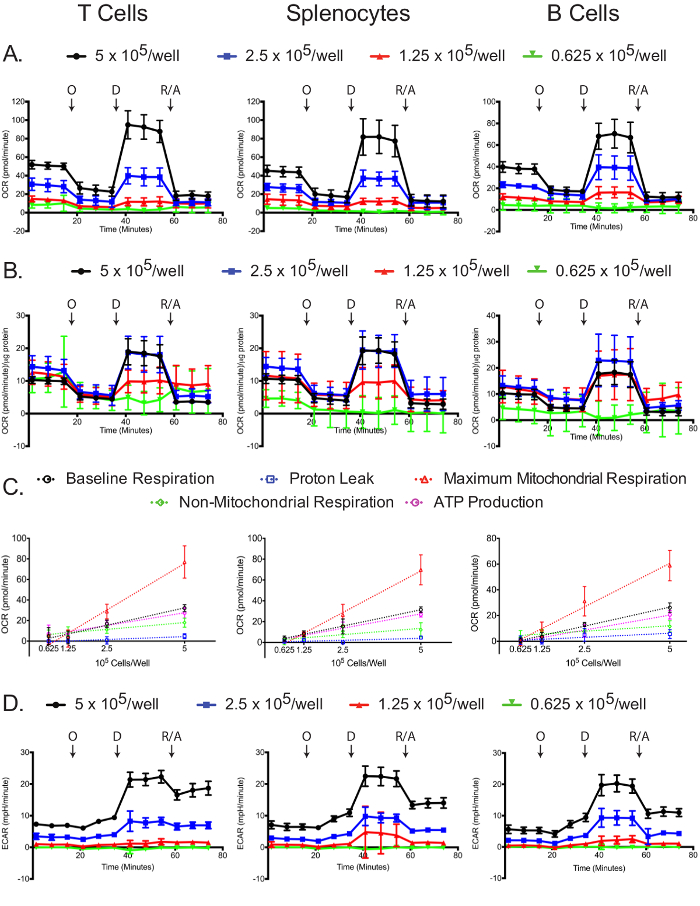
Figura 4: Sono mostrati dosaggio mitocondriale stress. Grezzo (A) e standardizzato OCR (B) per ogni tipo di cellula e densità di placcatura. (C) numero-dipendente cellulare cambiamenti nei livelli di base, massima mitocondriale e la respirazione non mitocondriale, nonché i consumi di ossigeno legati alla perdita di protone o produzione di ATP, sono presenti per ogni tipi di cellule. Sono mostrati valori (D) grezza ECAR ottenuti dalle prove di stress mitocondriale. Ciascun punto di dati rappresenta la media di 7-8 pozzetti con deviazione standard. frecce indicano etichettati iniezioni di oligomicina (O), 2,4-DNP (D), e rotenone / antimicina A (R / A). I risultati sono rappresentativi di almeno tre esperimenti indipendenti. Clicca qui per vedere una versione più grande di questa figura.
_upload / 54918 / 54918fig5.jpg "/>
Figura 5:. Test di stress glicolitica crudo (A) e standardizzato (B) ECAR per ciascun tipo di cellula e densità di rivestimento sono mostrati. (C) sono mostrati numero-dipendente delle cellule cambiamenti nella ECAR per l'acidificazione non glicolitico, glicolisi glucosio-indotta e la capacità glicolitico totale. Vengono visualizzati i valori (D) Raw OCR ottenuti dalle prove di stress glicolitico. Ciascun punto di dati rappresenta la media di 7-8 pozzetti con deviazione standard. frecce indicano etichettati iniezioni di glucosio (G), oligomicina (O), e 2-desossiglucosio (2-DG). I risultati sono rappresentativi di almeno tre esperimenti indipendenti. Clicca qui per vedere una versione più grande di questa figura.
Discussione
Il protocollo abbiamo sviluppato consentito per l'isolamento efficiente delle sottopopolazioni linfocitarie pura e vitale, che sono stati successivamente utilizzati nell'analisi flusso extracellulare a diverse concentrazioni per valutare le differenze nella glicolisi e prestazioni respirazione mitocondriale. Questo protocollo è progettato specificamente per i linfociti e affronta le considerazioni particolari relativi a questi tipi di cellule, come la bassa attività metabolica basale, fragilità, a bassa frequenza, e la loro incapacità di aderire alle piastre test. Pertanto, rispetto a protocolli precedentemente pubblicati 11,12, il nostro metodo offre una guida più conveniente e meglio ottimizzata per i ricercatori che lavorano nel campo della immunologia. Ci sono diversi passaggi critici in questo protocollo, tra cui ottenere popolazioni di cellule pure e vitali, placcatura le cellule a confluenza ottimale, e la standardizzazione delle misure di analisi di flusso extracellulari per la concentrazione di proteine in ogni pozzetto.
l'iil numero di cellule nitial placcato entrambi potrebbero essere visualizzati al microscopio ottico ed anche essere quantificato utilizzando le misure di concentrazione di proteine. La correlazione lineare tra numero di cellule e la concentrazione proteica confermato che la concentrazione proteica può effettivamente essere usato come un modo per standardizzare gli effetti delle variazioni di numero di cellule tra diversi pozzetti.
Standardizzando i ECAR e OCR risultati alle concentrazioni di proteine, abbiamo dimostrato che, nonostante inferiori confluenza delle cellule, il minor numero di 2,5 x 10 5 cellule / pozzetto possono essere usati nella maggior parte dei saggi senza compromettere la qualità dei dati. Tuttavia, il limite inferiore di cellule che possono essere utilizzati variato tra i tipi di cellule e saggi. Ad esempio, mentre il minor numero di 1,25 x 10 5 cellule potrebbero essere usate per misurazioni OCR cellule B, anche 2,5 x 10 5 cellule / pozzetto non erano sufficienti per valutare le prestazioni glicolitico dello stesso tipo cellulare. Perciò, fintanto che il numero di cellule non è un fattore limitante, placcatura a più90% di confluenza, che corrisponde approssimativamente a 5 x 10 5 linfociti / pozzetto, è preferibile. Ulteriore ottimizzazione potrebbe essere necessaria quando le cellule di differenti dimensioni, ad esempio in precedenza attivati e sono i linfociti-utilizzati parzialmente differenziate. Inoltre, quando si utilizza linfociti primari precedentemente coltivate, potrebbe verificarsi una variazione di vitalità cellulare tra diverse condizioni di trattamento, che ridurrebbe l'affidabilità della concentrazione proteica come una misura del numero di cellule dal vivo o cellule morenti può anche contribuire ai livelli di proteina misurati . In questi casi, potrebbe essere utile per ordinare le cellule vive di citometria di flusso prima di effettuare le analisi di flusso extracellulari.
Nei nostri test utilizzando popolazioni di linfociti appena isolate e altamente vitali, abbiamo ottenuto dati funzionali affidabili per entrambe le misure OCR e ECAR. Mentre tutti i tipi di cellule si comportavano allo stesso modo nello stress test mitocondriale, notevoli differenze tra i tipi di cellule sono statiosservata nel test di stress glicolisi. Per esempio, le prestazioni glicolitico di cellule T naive era basso rispetto al splenociti o cellule B, e non ha cambiato con l'aggiunta di oligomicina. Questa osservazione è in linea con gli studi precedentemente pubblicati 7,30, confermando la validità del nostro protocollo.
In conclusione, il metodo offre un modo efficiente e conveniente per testare l'attività metabolica dei linfociti utilizzando un analizzatore di flusso extracellulare, e può essere utile in una vasta gamma di studi immunologici esplorare i cambiamenti metabolici nelle cellule immunitarie upon attivazione, differenziazione cellulare oa causa a fenotipi di malattie come l'infezione, autoimmunità e ematologiche maligne.
Divulgazioni
The authors declare that they have no competing financial interests. Open Access fees for this article were provided by Agilent Technologies.
Riconoscimenti
The authors thank Dr. Michael N. Sack (National Heart, Lung, and Blood Institute) for support and discussion, Ms. Ann Kim for optimizing the B cell isolation protocol, Dr. Joseph Brzostowski for his help with microscopy, and Ms. Mirna Peña for maintaining the animals used. This study was supported by the Intramural Research Programs of the National Institutes of Health, National Institute of Allergy and Infectious Diseases, and National Heart, Lung, and Blood Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| PBS (pH 7.2) | Gibco-ThermoFisher | 20012-050 | To make MACS buffer |
| Bovine Serum Albumin BSA | Sigma-Aldrich | A3803 | To make MACS buffer |
| 0.5 M EDTA, pH 8 | Quality Biological | 10128-446 | To make MACS buffer |
| autoMACS rinsing solution | Miltenyi Biotec | 130-091-222 | Instead of PBS + EDTA to make MS buffer. Also used in autoMACS Pro Separator. |
| RPMI-1640 | Gibco-ThermoFisher | 11875-093 | Contains phenol red and L-glutamine |
| Fetal Bovine Serum | Gibco-ThermoFisher | 10437-028 | For heat-inactivation, thaw frozen stock bottle in a 37 °C water bath and then inactivate at 56 °C for 30 min. Aliquot heat-inactivated serum for storage (e.g., in 50 ml conical tubes) and freeze at -20 °C until needed. |
| Penicillin-Streptomycin (Pen Strep) | Gibco-ThermoFisher | 15140-122 | Combine Pen Strep with L-Glut 1:1 (if making 500 ml media, make a total of 12 ml Pen Strep/L-Glut); keep aliquots at -20 °C until ready to make media. |
| L-Glutamine 200 mM (L-Glut) | Gibco-ThermoFisher | 25030-081 | Component of RF10 and stress test media |
| Sodium pyruvate 100 mM | Gibco-ThermoFisher | 11360-070 | Component of RF10 and stress test media |
| HEPES 1 M | Gibco-ThermoFisher | 15630-080 | Component of RF10 |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco-ThermoFisher | 11140-050 | Component of RF10 |
| 2-Mercaptoethanol (55 mM) | Gibco-ThermoFisher | 21985-023 | Component of RF10 |
| Falcon 70 μm cell strainer | Falcon-Fischer Scientific | 87712 | Used in cell isolation |
| Monoject 3 ml Syringe, Luer-Lock Tip | Covidien | 8881513934 | Used in cell isolation |
| Falcon 15 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-959-53A | Used in cell isolation |
| Falcon 50 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-432-22 | Used in cell isolation |
| ACK Lysing Buffer | Lonza | 10-548E | Used in cell isolation |
| CellTrics 30 μm cell filter, sterile, single-packed | Partec CellTrics | 04-004-2326 | Used in cell isolation |
| B Cell Isolation Kit, mouse | Miltenyi Biotec | 130-090-862 | Used in cell isolation |
| Naïve CD4+ T cell isolation kit, mouse | Miltenyi Biotec | 130-104-453 | Used in cell isolation |
| LS Column | Miltenyi Biotec | 130-042-401 | Used in cell isolation |
| MidiMACS separator | Miltenyi Biotec | 130-042-302 | Magnet for separation |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | Holder for magnets |
| autoMACS Rinsing Solution | 130-091-222 | Rinsing solution for autoMACS Pro Separator | |
| autoMACS Pro Separator Instrument | Miltenyi Biotec | N/A | |
| 2-Deoxy-D-glucose (2-DG) | Sigma-Aldrich | D8375-5G | |
| Cell-Tak | Corning | 354240 | Cell adhesive. Take care to note concentration, as each lot is different (package is 1 mg). |
| Oligomycin | Sigma-Aldrich | 75351 | |
| 2,4-Dinotrophenol (2,4-DNP) | Sigma-Aldrich | D198501 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Halt Protease Inhibitor Cocktail | ThermoFisher Scientific | 78429 | Supplied as 100x cocktail, combine with RIPA to form 1x solution for lysis. |
| RIPA Buffer | Boston BioProducts | BP-115 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | Follow manufacturer's instructions |
| Seahorse XFe96 FluxPak | Seahorse Bioscience | 101085-004 | Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
| Seahorse XF Base Medium | Seahorse Bioscience | 102353-100 | Used to prepare stress test media |
| Seahorse XFe96 Extracellular Flux Analyzer | Seahorse Bioscience | ||
| Stericup Sterile Vacuum Filter Units, 0.22 μm | EMD Millipore-Fisher Scientific | SCGPU10RE | Used to sterile filter media. |
| Sodium bicarbonate | Sigma-Aldrich | 487031 | Dissolved to 0.1 M and used to dilute Cell-Tak. |
Riferimenti
- Motz, G. T., Coukos, G. Deciphering and reversing tumor immune suppression. Immunity. 39 (1), 61-73 (2013).
- Akkaya, M., Barclay, A. N. How do pathogens drive the evolution of paired receptors?. Eur J Immunol. 43 (2), 303-313 (2013).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu Rev Immunol. 27, 591-619 (2009).
- Dinarello, C. A. Proinflammatory cytokines. Chest. 118 (2), 503-508 (2000).
- Kurosaki, T., Kometani, K., Ise, W. Memory B cells. Nat Rev Immunol. 15 (3), 149-159 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Gerriets, V. A., Rathmell, J. C. Metabolic pathways in T cell fate and function. Trends Immunol. 33 (4), 168-173 (2012).
- Doughty, C. A., et al. Antigen receptor-mediated changes in glucose metabolism in B lymphocytes: role of phosphatidylinositol 3-kinase signaling in the glycolytic control of growth. Blood. 107 (11), 4458-4465 (2006).
- Caro-Maldonado, A., et al. Metabolic reprogramming is required for antibody production that is suppressed in anergic but exaggerated in chronically BAFF-exposed B cells. J Immunol. 192 (8), 3626-3636 (2014).
- Pelletier, M., Billingham, L. K., Ramaswamy, M., Siegel, R. M. Extracellular flux analysis to monitor glycolytic rates and mitochondrial oxygen consumption. Methods Enzymol. 542, 125-149 (2014).
- Mookerjee, S. A., Brand, M. D. Measurement and Analysis of Extracellular Acid Production to Determine Glycolytic Rate. J Vis Exp. (106), e53464 (2015).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Klein, A. B., et al. Impact of different cell isolation techniques on lymphocyte viability and function. J Immunoassay Immunochem. 27 (1), 61-76 (2006).
- Hsueh, R. C., et al. Purification and Characterization of Mouse Splenic B Lymphocytes. AfCS Research Reports. 1 (1), 1-11 (2012).
- Zambrano, K., et al. Prolonged ex vivo expansion and differentiation of naive murine CD43 B splenocytes. Biotechnol Prog. , (2016).
- Costa, G. L., et al. Targeting rare populations of murine antigen-specific T lymphocytes by retroviral transduction for potential application in gene therapy for autoimmune disease. J Immunol. 164 (7), 3581-3590 (2000).
- Franz, B., May, K. F., Dranoff, G., Wucherpfennig, K. Ex vivo characterization and isolation of rare memory B cells with antigen tetramers. Blood. 118 (2), 348-357 (2011).
- Schneider, D. F., Glenn, C. H., Faunce, D. E. Innate lymphocyte subsets and their immunoregulatory roles in burn injury and sepsis. J Burn Care Res. 28 (3), 365-379 (2007).
- Reeves, J. P., Reeves, P. A. Removal of lymphoid organs. Curr Protoc Immunol. Chapter 1, Unit 1 9 (2001).
- Akkaya, B., et al. A Simple, Versatile Antibody-Based Barcoding Method for Flow Cytometry. J Immunol. 197 (5), 2027-2038 (2016).
- Traba, J., et al. Fasting and refeeding differentially regulate NLRP3 inflammasome activation in human subjects. J. Clin. Invest. 125 (12), 4592-4600 (2015).
- Wick, A. N., et al. Localization of the Primary Metabolic Block Produced by 2-Deoxyglucose. J. Biol. Chem. 224 (2), 963-969 (1957).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthetase system. Methods Enzymol. 55, 472-518 (1979).
- Terada, H. Uncouplers of oxidative phosphorylation. Environmental Health Perspectives. 87, 213-218 (1990).
- Mookerjee, S. A., Nicholls, D. G., Brand, M. D. Determining Maximum Glycolytic Capacity Using Extracellular Flux Measurements. PLOS ONE. 11 (3), e0152016 (2016).
- Lai, L., Alaverdi, N., Maltais, L., Morse, H. C. Mouse cell surface antigens: nomenclature and immunophenotyping. J Immunol. 160 (8), 3861-3868 (1998).
- Gerberick, G. F., Cruse, L. W., Miller, C. M., Sikorski, E. E., Ridder, G. M. Selective modulation of T cell memory markers CD62L and CD44 on murine draining lymph node cells following allergen and irritant treatment. Toxicol Appl Pharmacol. 146 (1), 1-10 (1997).
- Mookerjee, S. A., Goncalves, R. L. S., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochim. Biophys. Acta - Bioenergetics. 1847 (2), 171-181 (2015).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. J Exp Med. 212 (9), 1345-1360 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon