Method Article
リンパ球における解糖およびミトコンドリア呼吸を分析するために最適化されたプロトコル
* これらの著者は同等に貢献しました
要約
The study of metabolism is becoming increasingly relevant to immunological research. Here, we present an optimized method for measuring glycolysis and mitochondrial respiration in mouse splenocytes, and T and B lymphocytes.
要約
リンパ球は、順番に急速な細胞増殖、遊走及び分化、およびサイトカイン産生をもたらす細胞内シグナル伝達経路を活性化することにより、種々の刺激に応答します。これらの事象の全てをしっかり細胞のエネルギー状態にリンクされ、したがって、エネルギー産生経路を研究することは、これらの細胞の全体的な機能に関する手がかりを与えることができます。細胞外フラックス分析器は、多くの細胞型における解糖およびミトコンドリア呼吸の性能を評価するために一般的に使用される装置です。このシステムは、いくつか公表された報告で免疫細胞を研究するために使用されてきた、まだ特にリンパ球用に最適化された包括的なプロトコルが欠けています。リンパ球は、ex vivoでの条件に乏しい生き残る脆弱な細胞です。しばしばリンパ球サブセットはまれであり、かつ低細胞数での作業は避けられません。したがって、これらの困難に対処する実験戦略が必要とされます。ここでは、プロトコルを提供しますそれは、リンパ組織から生存可能なリンパ球の迅速な単離を可能にし、細胞外フラックスアナライザーでそれらの代謝状態の分析のため。さらに、我々は、異なる細胞密度で、いくつかのリンパ球サブタイプの代謝活性を比較した実験の結果を提供します。これらの観察は、我々のプロトコルも低い細胞濃度で一貫性のある、よく標準化された結果を達成するために使用することができ、したがって、それは、免疫細胞における代謝イベントの特性に着目し、将来の研究において広範な用途を有し得ることを示唆しています。
概要
抗原に対する免疫応答は、免疫活性化と免疫抑制との間にしっかりと規制のバランスです。免疫抑制は、単にこれらのイベントを阻害し、したがって、不要な免疫応答1-6を防止するのに重要であるのに対し、免疫活性化は、刺激に応答して急速な細胞増殖および遊走、ならびにサイトカイン産生、抗体分泌の増加食作用を駆動します。最近の研究は、直接リンクは、免疫細胞の活性化状態及び様々な代謝経路7の活性の間に存在することを示しています。免疫細胞は、オンとオフのエネルギー産生経路を切り替えることにより、休止および活性化状態の間でシフトすることができます。また、別の免疫細胞タイプの活性化の間に、それらの増加したエネルギー需要を燃料に異なる代謝戦略を使用し得ることが観察されています。例えば、Tリンパ球の活性化はほぼ完全解糖状態8に細胞を指示しながら pは、活性化Bリンパ球は、解糖および酸化的リン酸化9,10のバランスを使用します。これらの研究は、細胞の代謝に対する免疫細胞活性化の影響を調査することの重要性を指摘します。
リアルタイムでは、酸素消費速度(OCR)および細胞外酸性化率(ECAR)の同時測定は、酸化的リン酸化及び解糖の指標として、経路11から13を製造するエネルギーの状態に対処するための一般的な戦略です。これを達成するために、そのようなシーホースXF 96のような細胞外フラックス分析器は、日常的に使用されます。このような機器は急速に細胞タイプで、または異なる刺激条件にOCRとECARの変化を比較することができます。これまでに、免疫細胞を含む様々な細胞型は、これらのデバイスを使用して研究されています。しかし、特に免疫細胞のために設計され最適化されたプロトコルは使用できません。
免疫細胞、特にリンパ球は、OTとは異なりますいくつかの重要な方法で彼女の細胞型。リンパ球は、ex vivoでの条件14-16で長期間生存していない脆弱な細胞です。これは、例えば、細胞外フラックス解析において使用されるような必須栄養素を欠く次善の増殖培地中で培養しても大きな問題です。マクロファージおよび多くの細胞株とは異なり、リンパ球は、プラスチック表面に付着しません。したがって、ストレスを発生させることなく、分析プレートに添付することが重要です。最後に、いくつかのリンパ球亜集団は非常にまれであってもよく、必要に応じ、最適な量でそれらを収穫することは17-19挑戦的であるかもしれません。
ここでは、具体的には、リンパ球のために開発された最適化されたプロトコルを提供します。 、我々はdifferenにその休止状態の解糖および酸化的リン酸化の特性を示す20ノードマウスの脾臓およびリンパ節から単離した脾臓細胞、Bリンパ球およびナイーブCD4 + Tリンパ球を使用してT細胞密度。データは、細胞数に直接比例した端アッセイ細胞溶解物のタンパク質濃度を測定することにより、各ウェルについての最初の細胞数の違いを説明するために正規化しました。私たちのプロトコルは、細胞外フラックスアッセイのための実行可能なリンパ球の迅速な単離のためのガイドラインを提供するだけでなく、それはまた、データの品質を損なうことなく、次善の細胞濃度での作業を可能にします。
プロトコル
全ての動物実験は、NIAID動物管理使用委員会によって承認されたLIG-4動物プロトコールに従って行いました。
試薬の調製
- 磁気分離(MS)は、バッファを準備し、0.5%BSAおよび2mMのEDTA又は0.5%BSAを補充した自動分離液を補充したPBS(pHは7.2)。滅菌フィルター(0.22μm)で、2〜8℃で保存。
- RF10培地を準備し、10%の熱不活性化ウシ胎児血清、50 U / mlペニシリン、50μMストレプトマイシン、1mMピルビン酸ナトリウム、2mM L-グルタミン、0.1mMの非必須アミノ酸、50μM2を補充したRPMI 1640培地メルカプトエタノール、10mMのHEPES。無菌の試薬を使用してください。 2〜8℃で滅菌フィルターとストア。
- 1mMピルビン酸ナトリウム、2mMのL-グルタミン及び25mMのグルコースを補充したXF基本培地:ミトコンドリアストレステスト媒体を準備します。
- XFベースの媒体supplemen:解糖負荷試験媒体を準備します2 mMのL-グルタミンとテッド。
- 2〜8℃で7.4、滅菌フィルターとストアにミトコンドリアと解糖ストレステスト媒体の両方のpHを調整します。 37℃、使用前に再調整のpH(37℃でのpH測定を行う)の温かい媒体。
注:XF媒体を使用して、重炭酸塩を欠いているが重要です。細胞外フラックスアナライザー内の雰囲気だけ周囲のCO 2が含まれているので、培地中の任意の重炭酸塩は、解糖の副産物として放出されたプロトンに結合すると、CO 2と水を形成するために解離します。 CO 2は、実験中の脱ガスは、解糖の酸性化信号を不明瞭になり、pHのドリフトを引き起こすでしょう。 - オリゴマイシン準備:DMSO中の10mMストック溶液を調製します。 -20℃で保存します。
- 2,4-DNPの準備:DMSO中の1Mストック溶液を準備します。 -20℃で保存します。
- アンチマイシンAを準備:DMSO中の10mMストック溶液を調製します。 -20℃で保存します。
- ロテノンを準備:10mMの秒を準備DMSO中のタック溶液; -20℃で保存します。
- グルコースを準備:250mMの溶液を形成する糖ストレス試験培地中のグルコースを溶解します。各実験の前に新鮮な準備をし、凍結しないでください。
- 2-DGを準備:500 mM溶液を形成するために、解糖ストレステスト媒体中に固体2-DGを溶かします。各実験の前に新鮮な準備をし、凍結しないでください。
2.マウスから収穫脾臓およびリンパ節
- 頸椎脱臼に続いてCO 2窒息によりマウスを安楽死させます。
- 70%エタノールでマウスをスプレーします。
- その後のT細胞の単離のために、脾臓、浅子宮頸部、表面的な/深い腋窩、下顎、鼠径、および腸間膜リンパ節を収穫。
- 後続のB細胞の単離のために、収穫のみ脾臓。
注:バイオセーフティキャビネットを使用して処理するまで氷上でPBSまたはRF10メディアで収穫された臓器を保ちます。すべての処理とISOL用滅菌実験器具や滅菌技術を使用してくださいエーションの手順を実行します。分離効率を高め、細胞死を減らすために氷の上ですべてのバッファとメディアを保管してください。
3.組織処理
- 50ミリリットルコニカルチューブの上に70μmのセルストレーナーを配置し、ストレーナに臓器を転送します。 T細胞の単離のために、全ての器官を結合のみ脾臓B細胞の単離の転送のため。
- 無菌の3ミリリットルシリンジからプランジャーを使用して、ストレーナを介して組織をすりつぶします。マッシングの間に、フィルタや臓器が常に湿っていると、MSのバッファを追加することにより、必要に応じてそれらを濡らしていることを確認してください。これは、両方の高い細胞生存率を維持し、フィルターの目詰まりを防ぐことができます。
- マッシングの後、5月10日を適用ミリリットルMSは、細胞の回復を高めるために、フィルタにバッファ。 4℃で5分間、400×gで懸濁液を遠心。 (指定がない限り、これらの条件の下で、すべてのさらなる遠心分離を行って)。
- 液体をデカントし、5mlのACK赤血球溶解緩衝液を、ペレットを再懸濁します。 Incu氷上で5分間譲りは(それらは磁気分離を妨害するので、赤血球を除去する必要がある)赤血球を溶解します。 10〜20ミリリットルMSバッファと遠心を追加します。
- 1ミリリットルMSバッファ(赤血球溶解から破片を除去します。この濾過)でそれを15ミリリットルコニカルチューブの上に30μmのセルのフィルターを置き、プライム。遠心分離管から液体をデカントし、5ミリリットルMSバッファにペレットを再懸濁し、フィルターを通してそれを渡します。細胞の回復を増加させ、フィルターを洗浄するためにこれを使用するために4ミリリットルMS緩衝液で最初のチューブを洗浄します。
- 血球計又は自動化細胞カウンターを使用して、細胞の総数を決定します。この細胞数は、脾臓細胞は、その後、細胞外フラックスアッセイで使用される場合、セクション4で必要な磁気分離試薬の量を決定するために使用され、この時点で適切な数の細胞を取っておきます。
- サスペンションを遠心し、磁気分離に進みます。再懸濁脾細胞が使用されていません5ミリリットルRF10中のB細胞の単離のための細胞外フラックスアッセイまで氷上に保ちます。
B細胞およびナイーブCD4 + T細胞の4磁気分離
- ビオチン抗体カクテル、抗ビオチンマイクロビーズ、およびMSバッファの必要なボリュームを決定します。ガイドとして10 8個の細胞については、次のボリュームを使用して、スケールアップまたは必要に応じてダウン。
注:氷上でインキュベート以来、冷蔵庫ではなく、氷上でインキュベートしたサンプルは、抗体結合効率を低下させることができるし、より長いインキュベーション時間が必要になることがあります。
| ナイーブCD4 + T細胞の分離のための試薬 | 10 8個の細胞のボリューム |
| (適切にスケーリング) | |
| ビオチン - 抗体カクテル | 100μlの |
| 最初のインキュベーションのためのMSバッファ | 400μlの |
| 抗ビオチンマイクロビーズ | 200μlの |
| CD44マイクロビーズ | 100μlの |
| 第二のインキュベーションのためのMSバッファ | 200μlの |
| 5分間4℃でビオチン抗体カクテルと細胞をインキュベートします。抗ビオチンマイクロビーズ、CD44マイクロビーズを追加し、MSはバッファ、15分間4℃でインキュベートします。 | |
表1:T細胞の単離量と指示。
| B細胞の分離のための試薬 | 10 8個の細胞のボリューム |
| (適切にスケーリング) | |
| ビオチン - 抗体カクテル | 100μlの |
| 最初のインキュベーションのためのMSバッファ | 400μlの |
| 抗ビオチンマイクロビーズ | 200μlの |
| 第二のインキュベーションのためのMSバッファ | 300μlの |
| 15分間、4℃でビオチン抗体カクテルと細胞をインキュベートします。ビオチン抗体カクテルとMSバッファの適切な量を追加し、15分間、4℃で混合物をインキュベートします。抗ビオチンマイクロビーズとMSバッファの適切な量を追加し、15分間、4℃で混合物をインキュベートします。第二のインキュベーションの後、MSバッファと遠心でチューブを埋めます。 | |
表2:B細胞単離ボリュームと指示。
- MSバッファにペレットを再懸濁:手動分離のために500μlの、自動分離3-4ミリリットル。
- 手動または自動分離のいずれかに進みます次のように:
- 手動分離:
- 3ミリリットルMS緩衝液で洗浄することにより、フロースルー、および素数列を収集するために、以下の滅菌15ミリリットルコニカルチューブを配置し、分離磁石にLSカラムを挿入します。フロースルーを捨てます。
- 下塗りしたLSカラムに細胞懸濁液を移し、それを通過することを可能にします。 3ミリリットルMSバッファーとのインキュベーションの間に使用されるチューブを洗浄し、同様に列を介してこれを通過します。溶出液は、精製された細胞が含まれています。 B細胞の単離のために、新しい15ミリリットルチューブにカラムを介して第2の時間を精製細胞を渡し、洗浄工程を繰り返します。これは純度と収量を増加します。
- 自動分離:
- 自動セパレータ上に切り替え、ランニング緩衝液のレベルをチェックし、溶液および70%のエタノールをすすぎます。廃棄物の分離を開始する前に空であることを確認してください。
- Tの管径に応じて適切な冷却されたラックを選択します彼未精製試料( 例えば 、15ミリリットル)。分離プロセスを通して生存細胞を維持するために、以前に3-4時間、2〜8℃に冷却、または冷却剤が固体になるまでされているラックを使用しています。
- 自動セパレータの試料ステージで冷却ラックをマウントします。
- スロットA1、スロットB1で陰性画分、およびC1で陽性分画のための管用チューブにサンプルチューブを置きます。複数のサンプルを収集する場合は、次の列(A2、B2、C2、 など )で追加のチューブを配置します。
- タッチスクリーン上での分離]タブを選択し、ラックのチューブの配置を示しています。分離メニューから、「枯渇する」プログラムを選択し、洗浄の適切なタイプのプログラムサイクルを完了する(下記の注を参照)。
注:「枯渇させる」プログラムは純度の優先順位を付け、マシンの最も敏感なモードを使用して、枯渇を行います。また、三つの異なる洗浄オプションがあります。QUICすすぎK、すすぎ、および睡眠。サンプルは、同じソースからのものであり、組み合わせることになっている場合は、迅速なリンスを選択します。サンプルは別々に保持する場合には、リンスを選択します。それ以上の単離は、その日に行われません場合は、マシンが単離後にシャットダウンする場合は、スリープオプションを選択します - 「ファイル名を指定して実行」を押すことにより、アイソレーションを起動し、プロンプトが表示されたら、バッファレベルを確認します。プログラムが終了した後、陰性画分は、精製された細胞を含有します。
- MSバッファと遠心で15ミリリットルまでのコニカルチューブを埋めます。
- 5ミリリットルRF10メディアにMSバッファおよび再懸濁細胞をデカントします。細胞外フラックスアッセイするまで氷上で細胞を保管してください。
注:理想的には、細胞外フラックスアッセイは、単離直後に行われるべきです。しかし、予備実験では、アッセイの結果に有意な差は、新たに単離したもの対分離の3時間以内に使用した細胞では観察されませんでした。
- 手動分離:
5。細胞外フラックスアッセイ
注:ここで説明したプロトコルは、機器の96ウェルフォーマットのためです。他のフォーマットが使用される場合、ボリュームを調整する必要があります。
- センサーカートリッジの水和
- センサカートリッジを持ち上げ、較正溶液200μlとユーティリティプレートの各ウェルを満たし、ユーティリティ板上にセンサカートリッジを下げ、較正溶液にセンサーを沈めます。
注:較正液レベルが水没センサーを維持するのに十分に高いことを確認します。カートリッジは、各ウェルについて、O 2とH +に関連するフルオロフォアを保有します。これらは、それらが正しく動作するためには水和する必要があります。 - CO 2または酸素/窒素を補充していない37℃のインキュベーターにカートリッジを置きます。指定がない限り、これらの条件の下で、すべてのさらなるインキュベーションを行います。水和物に一晩カートリッジをインキュベートします。
- センサカートリッジを持ち上げ、較正溶液200μlとユーティリティプレートの各ウェルを満たし、ユーティリティ板上にセンサカートリッジを下げ、較正溶液にセンサーを沈めます。
- Prepar接着剤でコーティングされたプレートのエーション
- 0.1 M重炭酸ナトリウムで22.4 / mlの接着剤溶液の2.5ミリリットルを準備し、pHが8.0(重炭酸塩は、接着剤の吸着のための最適pHを提供します)。
- アッセイプレートの各ウェルに溶液25μlを適用し、そして20分間室温でベンチにインキュベートします。
- 吸引し、接着剤や滅菌水200μlを使用して二回各ウェルを洗浄します。ウェルが細胞を播種する前に乾燥しているまで待ってください。
- 接着剤でコーティングされたプレートに細胞を播種
- 5分間、200×gで室温で遠心分離した細胞。適切なアッセイ培地5mlで再懸濁細胞(ミトコンドリアのストレスとグルコースストレスメディアの製剤については上記を参照)。アッセイ培地で所望の濃度で遠心分離し、再び細胞を再懸濁(再懸濁量は濃度によって異なります。各ウェルの細胞懸濁液の180μlのを含んでいます)。
注:適切なアッセイ培地と化合物である限りsが細胞外フラックスアナライザーが同時に同じプレート上のミトコンドリアと解糖ストレステストを実行することができ、使用されています。 - 各ウェルに細胞懸濁液180μLをプレート。背景温度補正のために井戸A1、A12、H1、およびH12を使用します。これらのウェル(細胞なし)でのアッセイ培地180μlを添加します。
- 37℃で25分間プレートをインキュベートします。
- すべての細胞が完全に取り付けられていることを確認するために、ブレーキなしで5分間、200×gでプレートを遠心。視覚細胞が安定的に顕微鏡下で見ることにより、単分子膜を形成し、培養表面に付着していることを確認します。さらに30分間バックインキュベーターにプレートを転送します。
- 5分間、200×gで室温で遠心分離した細胞。適切なアッセイ培地5mlで再懸濁細胞(ミトコンドリアのストレスとグルコースストレスメディアの製剤については上記を参照)。アッセイ培地で所望の濃度で遠心分離し、再び細胞を再懸濁(再懸濁量は濃度によって異なります。各ウェルの細胞懸濁液の180μlのを含んでいます)。
- 化合物の10倍の濃度の調製、及びインジェクタポートの読み込み中
- ミトコンドリアのストレステストのために、10μMのオリゴマイシン、1 mMのDNP、および10μMロテノンおよび10μMアンチマイシンAの混合物の2.5ミリリットルそれぞれ、ミトコンドリアストレスアッセイmediu内のすべての準備メートル。
注:2,4-DNPの濃度は、以前に公表された研究に基づいています; 21これは一般的なガイドラインですが、使用される各細胞型のための脱共役剤の濃度は、研究者によって決定されるべきです。 - 解糖のストレステストについては、2.5ミリリットル250 mMグルコース、10μMのオリゴマイシン、および解糖ストレスアッセイ培地中の500 mMの2-デオキシグルコース(2-DG)のそれぞれを準備します。
- ウォーム10倍〜37℃のソリューション、およびpHを7.4に調整します。
- 次のように、マルチチャンネルピペットを用いて、カートリッジの適切なインジェクタポートとローディングガイドに化合物をロードします。
表3:化合物のボリューム。ポート ミトコンドリアストレスアッセイ 解糖ストレスアッセイ A 20μlのオリゴ 20μlのグルコース B 22μlの2,4-DNP 22μlのオリゴ C言語 25μlのアンチマイシンA /ロテノン 25μlの2-DG
注:ポートの各シリーズ( 例えば 、すべてのポートA)が同じボリュームを含む必要があります。それ以外の場合の化合物は、(未使用のウェル内のポートは、アッセイ媒体の同じボリュームをロードすることができます)に注入されることはありません、でも、実験に使用されていないものを、与えられたシリーズの全てのウェルがロードされていることが重要です。 - プログラムの設定中にカートリッジをインキュベートします。
- ミトコンドリアのストレステストのために、10μMのオリゴマイシン、1 mMのDNP、および10μMロテノンおよび10μMアンチマイシンAの混合物の2.5ミリリットルそれぞれ、ミトコンドリアストレスアッセイmediu内のすべての準備メートル。
- 細胞外フラックスアッセイプロトコルの設定
- 次のプログラム( 表4)を設定します。
表4:プログラムのレイアウト。ステップ ループ 較正 - 平衡 - ベースラインの読み 3回:3分を混ぜ、0分を待って、メジャー3分 エンドループ - ポートAを注入 - 測定結果 3回:3分を混ぜ、0分を待って、メジャー3分 エンドループ - ポートBを注入 - 測定結果 3回:3分を混ぜ、0分を待って、メジャー3分 エンドループ - ポートCを注入 - 測定結果 3回:3分を混ぜ、0分を待って、measurE 3分 エンドループ - 終了プログラム -
注:活性化された細胞を使用した場合、一定の条件では、 例えば 、酸性化は、ナイーブ細胞よりも長く継続することができます。このため、各測定サイクル以上の時間を上記のプログラムに「待機」時間を延長するか繰り返す必要があるかもしれません。 - プログラムを開始します。較正ステップの後、アッセイプレート(プロンプトが表示)のための較正プレートを交換してください。
注:ソフトウェアを使用して、同様の条件を有するウェルのグループを指示することが可能です。加えて、ウェルは対照ウェルであるかを示すために(このプロトコルでは、彼らはプレートの四隅あり)、空である井戸を示すために重要です。マシンを設定するための、より詳細な、ステップバイステップ、プロトコルのために、それsのソフトウェア、メーカーのウェブサイトでは、相談する必要があります。
- 次のプログラム( 表4)を設定します。
- タンパク質含有量を測定します
- 細胞を乱すことなく、各ウェルからの残りのアッセイ培地を除去します。
注:これは、タンパク質濃度アッセイを続行することができない場合、それは分析まで-20℃で全プレートを凍結することが可能です。凍結した場合は、続行する前に解凍。 - (50μl/ウェルのための十分な)RIPA溶解媒体中のプロテアーゼ阻害剤(100×ストック)の1×溶液を調製します。
- 各ウェルに、プロテアーゼ阻害剤を補充した50μlのRIPA溶解媒体を追加します。 5分間シェーカー上でプレートを攪拌してから、完全に細胞を溶解し、30分間氷上で静置します。
- 彼らはビシンコニン酸(BCA)アッセイを妨害しないように、プレートの底に脂質および他の分子をもたらすために、室温で5分間、200×gでプレートをスピン。
- 製造業者によれば、BCAアッセイによりタンパク質濃度を測定' sの提言。
- 細胞を乱すことなく、各ウェルからの残りのアッセイ培地を除去します。
結果
真核細胞は、解糖の統合ネットワークを使用し、トリカルボン酸(TCA)サイクル、および酸化的リン酸化は、それらのエネルギー需要の大部分を満たすために、細胞の成長および増殖に必要な中間体を提供します。これらの経路は、その後ピルビン酸に加工されますグルコース-6-リン酸の形で遊離グルコースの細胞内トラッピングで始まります。ピルビン酸は、いずれかの減少乳酸またはそれがアセチルコエンザイムAを形成し、ミトコンドリア、(COA)に輸送することです。アセチルCoAが、その後TCAサイクルに入ります。 TCAサイクルの高エネルギー中間体は、次に、ミトコンドリア内膜を横切るH +勾配を生成するために、ミトコンドリアのマトリックスからのH +を放出する電子伝達系(ETC)で電子の移動を推進します。酸素は、最終電子受容体として作用し、そしてHは、+ F O / F <介してミトコンドリアマトリックスに戻りそのポテンシャルエネルギーをATP( 図1A)を生成するために使用されるサブ> 1複合体。
細胞外フラックスアッセイの動作原理は、特定のポイントで解糖および酸化的リン酸化に干渉し、得られた効果を評価するに依存します。この目的のために、我々は、ブロックするために、飢餓細胞における解糖、及びヘキソキナーゼによって、2-デオキシグルコース-6-リン酸、ホスホグルコ23の競合的阻害剤に変換される2-デオキシグルコース(2-DG)を伝播するためにグルコースを使用しました解糖。ロテノン(複合体I-特定のETCの阻害剤)、アンチマイシンA(ETCの阻害剤III-特異的複合体)(ATP合成酵素24の阻害剤)、オリゴマイシン、および脱共役剤2,4- dinotrophenol(DNP)25ました電子輸送、プロトン勾配やATP合成( 図1A)に関連する特定のイベントに介入するために使用されます。代わりに2,4-DNPの、カルボニルCYAnide -4-(トリフルオロメトキシ)フェニルヒドラゾン(FCCP)を用いることもできるが、さらなる最適化が必要とされ得ます。いずれの場合も、脱共役剤は必ずしも必要で最適な濃度を決定するために使用する前に特定の細胞型のために滴定する必要があります。
解糖負荷試験( 図1B)は 、以前に飢餓細胞における細胞外酸性化率(ECAR)のベースライン測定から始まります。これらの細胞は、その基底最低限であり、したがって、実質的に非解糖とみなすことができるので、この点で測定ECAR非解糖酸性化と呼ばれています。 Hの+ -この酸性化はおそらくHCO 3に変換されるTCAサイクルで生成された呼吸のCO 2に相当します。これは、乳酸の形成による細胞外酸性化の増加として提示解糖を活性化するためにグルコースの注入が続いています。この増加は、解糖の通常の速度を表します。次いで、細胞を酸化的リン酸化を介してATPのをブロックする世代、オリゴマイシンの注射でチャレンジしています。細胞は、その最大レベルに解糖を活性化することにより、ATP産生におけるこの劇的な減少に対応し、それはECARレベル(解糖リザーブ)における二次増加をもたらします。テストは、その非解糖レベルにECARを返すグルコースアナログ2-DGを使用して、解糖の合計阻害により終了されます。興味深いことに、製造業者の推奨に反して、最大の解糖は必ずしも26オリゴマイシンの注射によって達成されていない、ということが提案されています。 ATP需要の大幅な増加がない場合、高い解糖能力を有する細胞では、糖は、それがアップレギュレートされる必要なしに、ミトコンドリアATPの損失に対処する完全に可能であり得ます。オリゴマイシンと解糖速度は、呼吸阻害剤を添加することにより、突破することができました、そのようなオリゴマイシンを超えるいくつかの利点を提供するロテノンとmyxothiazol、など:彼らはATP合成酵素の逆転を引き起こすとして1)彼らは潜在的な26ミトコンドリア膜を回復する試みでプロトンをポンプするために、ATP加水分解して、ATPの需要を増加させます。 2)彼らは(下記参照)ECAR結果を混乱させる可能なメディアの呼吸酸性化を防止します。 ATPの需要を増加させる他の方法は、原形質膜ATPアーゼ26によってATPの加水分解を刺激する化合物の添加を含みます。解糖のストレステストを計画する際にこのすべてが研究者によって慎重に検討する必要があります。
ミトコンドリアのストレステスト( 図1C)は、非飢餓細胞における酸素消費速度(OCR)のベースライン測定から始まります。これは、急速にこのようhyperpolariz F O / F 1複合体を介してプロトンの戻りを阻害し、オリゴマイシンの注射、続いてミトコンドリア膜をエス。過分極は、呼吸複合体を介してポンピングさらにプロトン、および呼吸数の減少を防ぐことができます。残りの呼吸は、脂質または他のチャネルを介してプロトンの流れを表し、プロトンリーク、と呼ばれています。この過分極状態は急速にプロトンイオノフォアとして作用する脱共役剤2,4-DNPの添加により逆転されます。応答では、細胞は最大限に電子輸送速度を増加させることにより、無駄な試みで膜電位を回復しようとすると、これは順番にOCRを増加させます。最後に、2 ETCの阻害剤(アンチマイシンAおよびロテノン)を加えて、ミトコンドリア呼吸は完全に停止し、OCRは、その最低レベルまで低下します。このレベルでは、酸素消費量は、ミトコンドリア活性(非ミトコンドリア)によるものではありません。これらの阻害剤によって生成されたOCRの差はベースライン呼吸と空き容量の合計である最大ミトコンドリア呼吸と呼ばれています。
B及びT細胞の単離は、高度に生存可能な純粋なリンパ球集団を生じます。プロトコルの第4節で概説したようにB細胞およびナイーブCD4 + T細胞を単離し、そして脾細胞を単にセクション3.3で説明したように赤血球を溶解することによって得ました。
細胞型特異的代謝アッセイの感度は、生存率および出発細胞集団の純度に依存します。したがって、単離されたマウスのT細胞、脾臓細胞、およびB細胞、ならびにTおよびB細胞の純度の生存度を確認するために、細胞の小アリコートをフローサイトメトリー分析( 図2)のために染色しました。側方散乱領域(SSC-A対FSC-A)プロット対前方散乱領域では、リンパ球をゲートしており、このゲート内に、対角線に沿った人口前方散乱-おいでFSC-プロット対トン(FSC-H)は、一重のように決定しました。一重の集団内で、生存率は、生/死マーカー( 図2A)のために、負の染色された細胞をゲートすることによって測定しました。 T細胞の生存率は、脾細胞の生存率は92%であり、B細胞の生存率は94%であった97.9%でした。 CD44によって測定されるB細胞の純度は、B220 + CD19 +集団 26によって測定されるように、CD4 + T細胞の純度が、99%であった- CD4 +集団 27 98.3%( 図2B)でした。
細胞溶解物のタンパク質濃度は、めっきセルの数の直接的な指標として用いることができます。
単離したリンパ球および脾細胞を5×10 5細胞/ウェル、2.5×10 5細胞/ウェル、1.25×10 5細胞/ウェル、および0.625×10で接着剤を塗布した96ウェルアッセイプレートに播種しました 5細胞/ウェル。 3つの細胞タイプのそれぞれプレーティング密度での合流を光学顕微鏡( 図3A)の下で可視化しました。予想されるように、合流は、最初のプレーティング密度と相関していました。細胞外フラックスアッセイの完了時に、播種した細胞を溶解し、それらのタンパク質濃度は、BCAアッセイを用いて定量しました。全ての細胞型については、溶解物のタンパク質濃度を直線的に外磁束データを解釈する際の溶解物のタンパク質濃度は、細胞数の正常化のための正確な尺度として使用できることを確認し、最初のプレーティング密度( 図3B)と相関することが示されました。この実験で用いたメッキ密度はナイーブ、非刺激リンパ球のために最適化されています。刺激または以前に培養された細胞が使用される場合、さらなる最適化が必要とされ得ます。
ミトコンドリアと解糖stressのアッセイは、メッキ細胞数に依存しています。
OCRは、細胞外フラックス分析器の各細胞型およびプレーティング密度を測定しました。予想されたように、高い細胞数が高く測定されたOCRだけでなく、オリゴマイシンために、より劇的な応答、2,4-DNP、およびアンチマイシンA /ロテノン( 図4A)を有しています。各サンプルのタンパク質濃度にOCR測定値を標準化することは、一般に、細胞の多数は、より正確なOCRの測定につながることが明らかになりました。 5でプレーティングし、よくT細胞および脾臓細胞、および5及び1.25×10 5細胞/ウェルで同様の正規化されたOCRの測定をもたらした2.5×10 5細胞/は、B細胞( 図4B)における同様の正規化されたOCR測定をもたらしました。正規化されたB細胞のわずかな違いは、OCRの測定は、B細胞/ウェル他の細胞密度に比べて2.5×10 5細胞でのパフォーマンスが向上していることを間接的指標であるかもしれません。すべての手段によって、0.625×10 5細胞/ウェルこの播種密度が不十分であることを実証し、次善の結果を与えました。ベースライン呼吸、プロトンリーク、最大ミトコンドリア呼吸、非ミトコンドリア呼吸、およびATP生産を直線すべての細胞型( 図4C)めっき密度と相関していました。 3つの細胞型における低プロトンリークによって示されるように加えて、ベースライン呼吸のほとんどは、ATPの合成に向けて使用されます。ミトコンドリアのストレス実験の主な焦点は、OCRの変化を測定することであるが、ECARはまだアッセイが正常に行われたことを確認するために記録することが有用です。 OCRと同様に、2より高いメッキ密度が高くECAR、より劇的なオリゴマイシンへの応答、2,4-DNP、およびアンチマイシンA /ロテノン( 図4D)をもたらしました。劇的な2,4-DNPを添加した際ECARの変化、およびアンチマイシンA /ロテノンはグラムの変化に加えて、呼吸の変化に起因する可能性がありますHの+ - lycolysis、CO TCAサイクルで生成された2はHCO 3に変換されます。この問題は、最近解決されており、実際の解糖速度12,29を得るために、酸素消費量データを用いて、全細胞外酸性化信号を補正するための簡単な方法が存在します。
解糖ストレスアッセイは、最高のプレーティング密度( 図5A、B)で最も成功しました。全ての細胞型では、5×10 5細胞/ウェルのサンプルをオリゴマイシン、グルコースの添加後ECARにおける最大の変化を有し、そして2-DG( 図5B)。さらに、タンパク質濃度を正常化することは、より低い濃度は、特に0.625×10 5細胞/はよくなかった頑強な解糖予備容量を表示していないが、すべての細胞型のために、5×10 5細胞/ウェルのサンプルは、最適な結果を得られることが証明されました。非glycolytiCの酸性化、解糖、および見かけの解糖容量が直線的にすべての細胞タイプ( 図5C)めっき密度と相関していました。解糖ストレス実験では、OCRのグラフは、グルコースが若干その後オリゴマイシン治療によって阻害されたミトコンドリア呼吸を刺激することを示しています。 2-DGの添加は、OCR( 図5D)には影響しませんでした。 OCRグラフは解糖ストレス実験を首尾よく行ったさらなる指標として使用することができます。また、OCRのグラフは、ミトコンドリアストレステスト12,29の場合に上述したように、必要に応じて、ECARグラフを修正するために使用することができます。
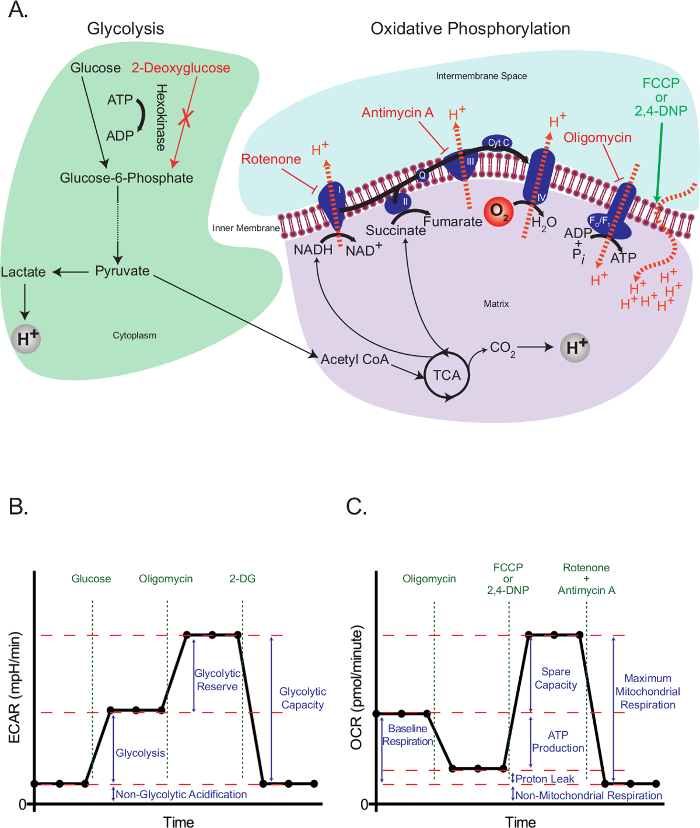
図1:(左)解糖の細胞外フラックスアッセイの概要 (A)イラストレーションと酸化的リン酸化(右)の作用を示します細胞外フラックスアッセイで使用される代謝薬。 (B)は、細胞外酸性化率(ECAR)グラフの概略。酸素消費速度(OCR)グラフ(C)の概略。 この図の拡大版をご覧になるにはこちらをクリックしてください。
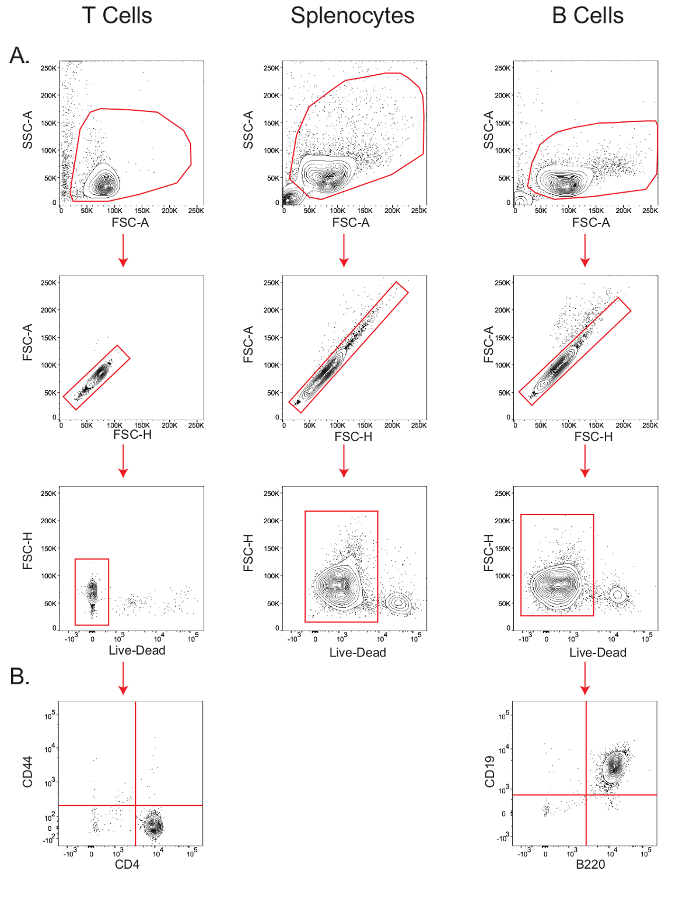
。 図2:T 細胞、B細胞、および生存率および純度を決定するための脾細胞の段階的なゲーサイトメトリーT細胞、脾臓細胞、およびB細胞の生存率(A)を示すプロットを流れ、そして、TおよびB細胞(B)の純度。結果は、少なくとも3つの独立した実験の代表である。 番目の拡大版をご覧になるにはこちらをクリックしてください。図です。
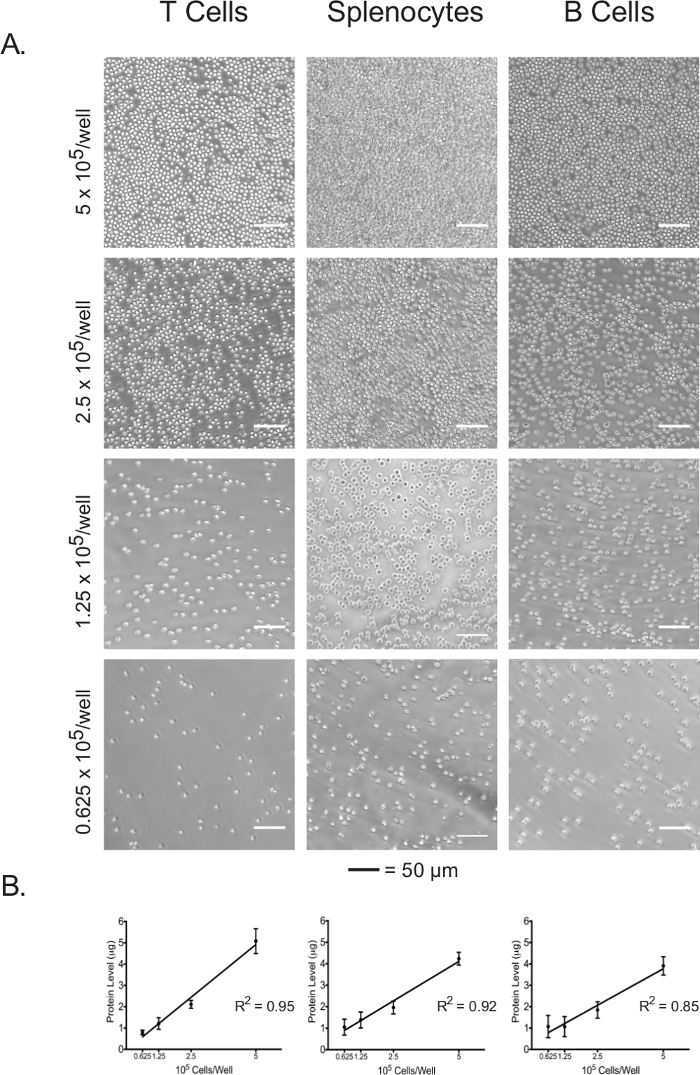
図3: 細胞コンフルエンスが異なるめっき密度で各細胞タイプの溶解物のタンパク質濃度と相関メッキ密度でアッセイプレートのウェル中の細胞の(A)の光顕微鏡写真0.625×10 5個の細胞を5×10 5細胞/ウェルの範囲の/。よく。スケールバーは50μmで表します。 BCAアッセイによって測定されるように、異なるめっき密度における(B)溶解物のタンパク質濃度を、。結果は、少なくとも3つの独立した実験の代表例である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
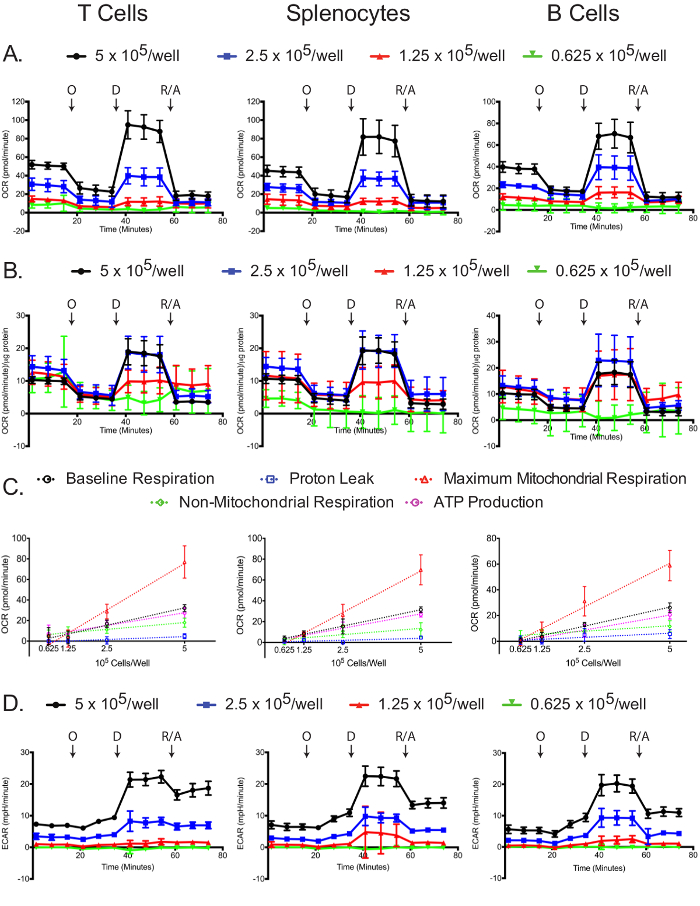
図4:各細胞型とメッキ密度ミトコンドリアストレスアッセイ生(A)及び標準化された(B)OCRが示されています。 (C)細胞ベースラインのレベルの数に依存した変化、最大ミトコンドリア非ミトコンドリア呼吸、並びにプロトンリークまたはATP産生に連結された酸素消費量は、各細胞型のために示されています。ミトコンドリアのストレステストから得られた(D)生ECARの値が示されています。各データ点は標準偏差7~8ウェルの平均を表します。標識された矢印は、オリゴマイシン(O)の注射を、2,4-DNP(D)、およびロテノン/アンチマイシンA(R / A)を示します。結果は、少なくとも3つの独立した実験の代表例である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
_upload / 54918 / 54918fig5.jpg "/>
図5:各細胞型とメッキ密度解糖ストレスアッセイ生(A)及び標準化された(B)ECARが示されています。 (C)非解糖の酸性化、グルコース誘導性解糖および総解糖能力のためECARにおける細胞数依存性の変化が示されています。解糖ストレステストから得られた(D)生OCRの値が示されています。各データ点は標準偏差7~8ウェルの平均を表します。標識された矢印は、グルコース(G)、オリゴ(O)、および2-デオキシグルコース(2-DG)の注射を意味します。結果は、少なくとも3つの独立した実験の代表例である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
我々が開発したプロトコルは、その後、解糖およびミトコンドリア呼吸性能の違いを評価するために種々の濃度で細胞外フラックス分析に使用した純粋な、生存リンパ球サブセットの効率的な分離を可能にしました。このプロトコルは、リンパ球のために特別に設計されており、このような低い基礎代謝活性、脆弱性、低周波数とこれらの細胞型に関連する特別な考慮事項に対処して、できないことは、アッセイプレートに付着されます。そのため、以前に公開されたプロトコル11,12に比べて、私たちの方法は、免疫学の分野で働く研究者のためのより便利で、より良い最適化されたガイドを提供しています。純粋な、生存細胞集団を得る最適なコンフルエンスで細胞をプレーティングし、各ウェル中のタンパク質濃度に外フラックスアッセイ測定を標準化するなど、このプロトコルにはいくつかの重要なステップがあります。
私播種した細胞のnitial数は両方の光学顕微鏡により可視化することができ、また、タンパク質濃度の測定を用いて定量します。細胞数及びタンパク質濃度の間の線形相関は、タンパク質濃度が実際に異なるウェル間の細胞数の変化の影響を標準化する方法として使用することができることを確認しました。
タンパク質濃度にECARとOCR結果を標準化することにより、我々は示された、より低い細胞コンフルエンスにもかかわらず、いくつかの5×10 2.5個の細胞/ウェルのデータの品質を損なうことなく、ほとんどのアッセイで使用することができるように。しかし、細胞タイプおよびアッセイ間で変動し使用することができる細胞の下限。例えば、わずか5×10 1.25ような細胞は、B細胞OCR測定のために使用することができるが、さらに2.5×10 5細胞/ウェルを、同じ細胞型の解糖系の性能を評価するのに十分ではなかったです。したがって、限り、細胞数は、制限要因ではないとしてオーバーでメッキ約5×10 5リンパ球に相当する90%のコンフルエンスで、/ウェル、好ましいです。異なるサイズ-、先に活性化され、部分的に分化などの細胞に使用リンパ球を-されたときにさらなる最適化が必要になることがあります。以前に初代培養リンパ球を使用した場合に加え、死亡または瀕死の細胞はまた、測定されたタンパク質レベルに寄与することができるので、細胞数の指標としてのタンパク質濃度の信頼性を減少させる別の処理条件との間の細胞生存率の変化、があるかもしれません。このような場合には、細胞外フラックスアッセイを行う前に、フローサイトメトリーにより生細胞を選別するために役に立つかもしれません。
新たに単離された、高度に実行可能なリンパ球集団を使用して、我々のアッセイでは、我々は両方のOCRとECAR測定のための信頼性の高い機能的なデータを得ました。全ての細胞型は、ミトコンドリアストレス試験において同様に挙動しながら、細胞型間の著しい差がありました解糖負荷試験で観察されました。例えば、ナイーブT細胞の解糖系の性能は、脾細胞またはB細胞と比較して低く、それは、オリゴマイシンの添加によって変化しませんでした。この観察は、我々のプロトコルの有効性を確認し、以前に発表された研究7,30に沿ったものです。
結論として、私たちの方法は、細胞外フラックスアナライザーを用いてリンパ球の代謝活性を試験する効率的かつ便利な方法を提供し、それは代謝活性化の際に、免疫細胞の変化、細胞の分化や原因を探求する免疫学的研究の広い範囲で有用であることができますこのような感染症、自己免疫および血液学的悪性腫瘍などの疾患の表現型に。
開示事項
The authors declare that they have no competing financial interests. Open Access fees for this article were provided by Agilent Technologies.
謝辞
The authors thank Dr. Michael N. Sack (National Heart, Lung, and Blood Institute) for support and discussion, Ms. Ann Kim for optimizing the B cell isolation protocol, Dr. Joseph Brzostowski for his help with microscopy, and Ms. Mirna Peña for maintaining the animals used. This study was supported by the Intramural Research Programs of the National Institutes of Health, National Institute of Allergy and Infectious Diseases, and National Heart, Lung, and Blood Institute.
資料
| Name | Company | Catalog Number | Comments |
| PBS (pH 7.2) | Gibco-ThermoFisher | 20012-050 | To make MACS buffer |
| Bovine Serum Albumin BSA | Sigma-Aldrich | A3803 | To make MACS buffer |
| 0.5 M EDTA, pH 8 | Quality Biological | 10128-446 | To make MACS buffer |
| autoMACS rinsing solution | Miltenyi Biotec | 130-091-222 | Instead of PBS + EDTA to make MS buffer. Also used in autoMACS Pro Separator. |
| RPMI-1640 | Gibco-ThermoFisher | 11875-093 | Contains phenol red and L-glutamine |
| Fetal Bovine Serum | Gibco-ThermoFisher | 10437-028 | For heat-inactivation, thaw frozen stock bottle in a 37 °C water bath and then inactivate at 56 °C for 30 min. Aliquot heat-inactivated serum for storage (e.g., in 50 ml conical tubes) and freeze at -20 °C until needed. |
| Penicillin-Streptomycin (Pen Strep) | Gibco-ThermoFisher | 15140-122 | Combine Pen Strep with L-Glut 1:1 (if making 500 ml media, make a total of 12 ml Pen Strep/L-Glut); keep aliquots at -20 °C until ready to make media. |
| L-Glutamine 200 mM (L-Glut) | Gibco-ThermoFisher | 25030-081 | Component of RF10 and stress test media |
| Sodium pyruvate 100 mM | Gibco-ThermoFisher | 11360-070 | Component of RF10 and stress test media |
| HEPES 1 M | Gibco-ThermoFisher | 15630-080 | Component of RF10 |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco-ThermoFisher | 11140-050 | Component of RF10 |
| 2-Mercaptoethanol (55 mM) | Gibco-ThermoFisher | 21985-023 | Component of RF10 |
| Falcon 70 μm cell strainer | Falcon-Fischer Scientific | 87712 | Used in cell isolation |
| Monoject 3 ml Syringe, Luer-Lock Tip | Covidien | 8881513934 | Used in cell isolation |
| Falcon 15 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-959-53A | Used in cell isolation |
| Falcon 50 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-432-22 | Used in cell isolation |
| ACK Lysing Buffer | Lonza | 10-548E | Used in cell isolation |
| CellTrics 30 μm cell filter, sterile, single-packed | Partec CellTrics | 04-004-2326 | Used in cell isolation |
| B Cell Isolation Kit, mouse | Miltenyi Biotec | 130-090-862 | Used in cell isolation |
| Naïve CD4+ T cell isolation kit, mouse | Miltenyi Biotec | 130-104-453 | Used in cell isolation |
| LS Column | Miltenyi Biotec | 130-042-401 | Used in cell isolation |
| MidiMACS separator | Miltenyi Biotec | 130-042-302 | Magnet for separation |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | Holder for magnets |
| autoMACS Rinsing Solution | 130-091-222 | Rinsing solution for autoMACS Pro Separator | |
| autoMACS Pro Separator Instrument | Miltenyi Biotec | N/A | |
| 2-Deoxy-D-glucose (2-DG) | Sigma-Aldrich | D8375-5G | |
| Cell-Tak | Corning | 354240 | Cell adhesive. Take care to note concentration, as each lot is different (package is 1 mg). |
| Oligomycin | Sigma-Aldrich | 75351 | |
| 2,4-Dinotrophenol (2,4-DNP) | Sigma-Aldrich | D198501 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Halt Protease Inhibitor Cocktail | ThermoFisher Scientific | 78429 | Supplied as 100x cocktail, combine with RIPA to form 1x solution for lysis. |
| RIPA Buffer | Boston BioProducts | BP-115 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | Follow manufacturer's instructions |
| Seahorse XFe96 FluxPak | Seahorse Bioscience | 101085-004 | Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
| Seahorse XF Base Medium | Seahorse Bioscience | 102353-100 | Used to prepare stress test media |
| Seahorse XFe96 Extracellular Flux Analyzer | Seahorse Bioscience | ||
| Stericup Sterile Vacuum Filter Units, 0.22 μm | EMD Millipore-Fisher Scientific | SCGPU10RE | Used to sterile filter media. |
| Sodium bicarbonate | Sigma-Aldrich | 487031 | Dissolved to 0.1 M and used to dilute Cell-Tak. |
参考文献
- Motz, G. T., Coukos, G. Deciphering and reversing tumor immune suppression. Immunity. 39 (1), 61-73 (2013).
- Akkaya, M., Barclay, A. N. How do pathogens drive the evolution of paired receptors?. Eur J Immunol. 43 (2), 303-313 (2013).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu Rev Immunol. 27, 591-619 (2009).
- Dinarello, C. A. Proinflammatory cytokines. Chest. 118 (2), 503-508 (2000).
- Kurosaki, T., Kometani, K., Ise, W. Memory B cells. Nat Rev Immunol. 15 (3), 149-159 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Gerriets, V. A., Rathmell, J. C. Metabolic pathways in T cell fate and function. Trends Immunol. 33 (4), 168-173 (2012).
- Doughty, C. A., et al. Antigen receptor-mediated changes in glucose metabolism in B lymphocytes: role of phosphatidylinositol 3-kinase signaling in the glycolytic control of growth. Blood. 107 (11), 4458-4465 (2006).
- Caro-Maldonado, A., et al. Metabolic reprogramming is required for antibody production that is suppressed in anergic but exaggerated in chronically BAFF-exposed B cells. J Immunol. 192 (8), 3626-3636 (2014).
- Pelletier, M., Billingham, L. K., Ramaswamy, M., Siegel, R. M. Extracellular flux analysis to monitor glycolytic rates and mitochondrial oxygen consumption. Methods Enzymol. 542, 125-149 (2014).
- Mookerjee, S. A., Brand, M. D. Measurement and Analysis of Extracellular Acid Production to Determine Glycolytic Rate. J Vis Exp. (106), e53464 (2015).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Klein, A. B., et al. Impact of different cell isolation techniques on lymphocyte viability and function. J Immunoassay Immunochem. 27 (1), 61-76 (2006).
- Hsueh, R. C., et al. Purification and Characterization of Mouse Splenic B Lymphocytes. AfCS Research Reports. 1 (1), 1-11 (2012).
- Zambrano, K., et al. Prolonged ex vivo expansion and differentiation of naive murine CD43 B splenocytes. Biotechnol Prog. , (2016).
- Costa, G. L., et al. Targeting rare populations of murine antigen-specific T lymphocytes by retroviral transduction for potential application in gene therapy for autoimmune disease. J Immunol. 164 (7), 3581-3590 (2000).
- Franz, B., May, K. F., Dranoff, G., Wucherpfennig, K. Ex vivo characterization and isolation of rare memory B cells with antigen tetramers. Blood. 118 (2), 348-357 (2011).
- Schneider, D. F., Glenn, C. H., Faunce, D. E. Innate lymphocyte subsets and their immunoregulatory roles in burn injury and sepsis. J Burn Care Res. 28 (3), 365-379 (2007).
- Reeves, J. P., Reeves, P. A. Removal of lymphoid organs. Curr Protoc Immunol. Chapter 1, Unit 1 9 (2001).
- Akkaya, B., et al. A Simple, Versatile Antibody-Based Barcoding Method for Flow Cytometry. J Immunol. 197 (5), 2027-2038 (2016).
- Traba, J., et al. Fasting and refeeding differentially regulate NLRP3 inflammasome activation in human subjects. J. Clin. Invest. 125 (12), 4592-4600 (2015).
- Wick, A. N., et al. Localization of the Primary Metabolic Block Produced by 2-Deoxyglucose. J. Biol. Chem. 224 (2), 963-969 (1957).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthetase system. Methods Enzymol. 55, 472-518 (1979).
- Terada, H. Uncouplers of oxidative phosphorylation. Environmental Health Perspectives. 87, 213-218 (1990).
- Mookerjee, S. A., Nicholls, D. G., Brand, M. D. Determining Maximum Glycolytic Capacity Using Extracellular Flux Measurements. PLOS ONE. 11 (3), e0152016 (2016).
- Lai, L., Alaverdi, N., Maltais, L., Morse, H. C. Mouse cell surface antigens: nomenclature and immunophenotyping. J Immunol. 160 (8), 3861-3868 (1998).
- Gerberick, G. F., Cruse, L. W., Miller, C. M., Sikorski, E. E., Ridder, G. M. Selective modulation of T cell memory markers CD62L and CD44 on murine draining lymph node cells following allergen and irritant treatment. Toxicol Appl Pharmacol. 146 (1), 1-10 (1997).
- Mookerjee, S. A., Goncalves, R. L. S., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochim. Biophys. Acta - Bioenergetics. 1847 (2), 171-181 (2015).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. J Exp Med. 212 (9), 1345-1360 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved