Method Article
Ein optimiertes Protokoll Glykolyse und die mitochondriale Atmung in Lymphozyten zu analysieren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
The study of metabolism is becoming increasingly relevant to immunological research. Here, we present an optimized method for measuring glycolysis and mitochondrial respiration in mouse splenocytes, and T and B lymphocytes.
Zusammenfassung
Lymphocyten reagieren auf eine Vielzahl von Stimuli durch intrazelluläre Signalwege zu aktivieren, was zur schnellen Zellproliferation, Migration und Differenzierung wiederum führt und Zytokinproduktion. Alle diese Ereignisse sind eng mit dem Energiestatus der Zelle verbunden sind, und daher Hinweise auf die gesamte Funktionalität dieser Zellen geben kann, die Energie erzeugenden Wege zu studieren. Die extrazelluläre Flußmittel Analysator ist eine häufig verwendete Vorrichtung die Leistung der Glykolyse und der mitochondrialen Atmung in vielen Zelltypen zur Auswertung. Dieses System verwendet worden ist Immunzellen in einigen veröffentlichten Berichten zu studieren, noch ein umfassendes Protokoll optimiert besonders für Lymphozyten fehlt. Lymphozyten sind fragile Zellen , die schlecht in ex - vivo - Bedingungen zu überleben. Oft Lymphozytensubpopulationen sind selten, und die Arbeit mit niedrigen Zellzahlen ist unvermeidlich. Somit wird eine experimentelle Strategie, die diese Schwierigkeiten Adressen erforderlich. Hier bieten wir ein Protokolldass ermöglicht eine schnelle Isolation von lebensfähigen Lymphozyten aus lymphoiden Geweben und für die Analyse ihrer Stoffwechselzustände in den extrazellulären Flußmittel Analysators. Darüber hinaus stellen wir die Ergebnisse von Experimenten, in denen die Stoffwechselaktivitäten von mehreren Lymphozyten-Subtypen bei verschiedenen Zelldichten verglichen. Diese Beobachtungen legen nahe, dass unser Protokoll verwendet werden kann, konsistente und gut standardisierten Ergebnisse auch bei niedrigen Zellkonzentrationen zu erreichen, und somit kann sie haben breite Anwendungen in zukünftigen Studien zur Charakterisierung der metabolischen Ereignissen in Immunzellen konzentriert.
Einleitung
Die Immunantwort gegen Antigene ist ein streng reguliert Gleichgewicht zwischen Immunaktivierung und Immununterdrückung. Immunaktivierung treibt schnelle Zellproliferation und Migration sowie Produktion von Zytokinen, Antikörper Sekretion und erhöhte Phagocytose in Reaktion auf das Stimulans, während Immunsuppression einfach diese Ereignisse hemmt und daher ist wichtig in 1-6 unnötige Immunreaktionen zu verhindern. Jüngste Studien haben gezeigt , dass eine direkte Verbindung zwischen dem Aktivierungsstatus von Immunzellen und die Aktivität verschiedener Stoffwechselwege 7 existiert. Immunzellen können durch Umschalten Energie erzeugenden Wege ein- und ausgeschaltet zwischen ruhenden und aktivierten Zustände verschieben. Weiterhin wurde beobachtet, dass verschiedene Immunzelltypen verschiedene Stoffwechselstrategien verwenden kann ihre erhöhte Energiebedarf während der Aktivierung Kraftstoff. Während zum Beispiel die Aktivierung von T - Lymphozyten richtet Zellen in einem fast vollständig glykolytischen Zustand 8 , aktivierte B - Lymphozyten verwenden , um ein Gleichgewicht der Glykolyse und oxidative Phosphorylierung 9,10. Diese Studien weisen darauf hin, wie wichtig die Auswirkungen der Immunzellaktivierung auf den Zellstoffwechsel zu untersuchen.
Echtzeit, gleichzeitige Messungen der Sauerstoffverbrauchsrate (OCR) und der extrazellulären Ansäuerungsrate (ECAR), als Indikatoren für oxidativen Phosphorylierung und der Glycolyse, ist eine gemeinsame Strategie , um die Zustände der Energieerzeugungspfade 11-13 zu adressieren. Um diese 96, eine extrazelluläre Fluss-Analysator, wie beispielsweise die Seahorse XF zu erreichen, wird routinemäßig eingesetzt. Ein solches Instrument kann Veränderungen in der OCR und ECAR über Zelltypen oder auf verschiedenen Stimulationsbedingungen schnell zu vergleichen. Bisher sind verschiedene Zelltypen, einschließlich Immunzellen wurden unter Verwendung dieser Vorrichtungen untersucht. Jedoch speziell ein optimiertes Protokoll für Immunzellen ausgelegt ist nicht verfügbar.
Immunzellen, insbesondere von Lymphozyten, unterscheiden sich von otihre Zelltypen in mehrere kritische Weise. Lymphozyten sind fragile Zellen , die 14 bis 16 für längere Zeit in ex vivo Bedingungen nicht überleben. Dies ist ein noch größeres Problem, wenn sie kultiviert werden in suboptimalen Wachstumsmedien essentielle Nährstoffe fehlen, wie sie in der extrazellulären Flussanalyse verwendet. Im Gegensatz zu vielen Makrophagen und Zelllinien, Lymphozyten haften nicht an Kunststoffoberflächen; Daher ist es wichtig, sie auf die Analyseplatte zu befestigen, ohne Stress zu erzeugen. Schließlich können einige Lymphozytensubpopulationen extrem selten sein und sie bei den erforderlichen, optimalen Mengen Ernte könnte eine Herausforderung sein 17-19.
Hier stellen wir ein optimiertes Protokoll, das speziell für Lymphozyten entwickelt wird. Mit Splenozyten, B - Lymphozyten und naive CD4 + T - Lymphozyten isoliert aus Maus - Milz und Lymphknoten 20 zeigen wir die Eigenschaften ihrer Ruhezustand Glykolyse und oxidative Phosphorylierung an different Zelldichten. Daten wurden normalisiert für die Unterschiede in der anfänglichen Zellzahlen zu berücksichtigen und für jeden durch das Ende Assay Zellysat-Protein-Konzentrationen, die zu den Zellzahlen direkt proportional waren. Unser Protokoll bietet nicht nur Richtlinien für die schnelle Isolierung von lebensfähigen Lymphozyten für extrazellulären Fluss-Assays, sondern erlaubt es auch für bei suboptimalen Zellkonzentrationen arbeiten, ohne dass die Datenqualität zu beeinträchtigen.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit dem LIG-4 Tier-Protokoll durchgeführt, das von der NIAID Animal Care und Use Committee genehmigt wurde.
1. Vorbereitung der Reagenzien
- Bereiten magnetische Trennung (MS) Puffer: PBS (pH 7,2), ergänzt mit 0,5% BSA und 2 mM EDTA oder automatische Trennlösung mit 0,5% BSA ergänzt war. Sterilfilter (0,22 & mgr; m) und bei 2-8 ° C.
- Bereiten RF10 Medium: RPMI 1640 Medium mit 10% hitzeinaktiviertem fötalem Rinderserum, 50 U / ml Penicillin, 50 uM Streptomycin, 1 mM Natriumpyruvat, 2 mM L-Glutamin, 0,1 mM nicht-essentielle Aminosäuren, 50 & mgr; M 2 beta; -Mercaptoethanol, 10 mM HEPES. Verwenden Sie sterile Reagenzien. Sterilfilter und bei 2-8 ° C.
- Bereiten Sie mitochondrialen Stresstest Medium: XF Basismedium mit 1 mM Natriumpyruvat ergänzt, 2 mM L-Glutamin und 25 mM Glucose.
- Bereiten Sie Glykolyse Stresstest Medium: XF Basismedium supplemented mit 2 mM L-Glutamin.
- Der pH-Wert sowohl der mitochondrialen und Glykolyse Stresstest Medien bis 7,4, Sterilfilter und bei 2-8 ° C. Warme Medium auf 37 ° C und erneut der pH-Wert vor der Verwendung (Durchführung pH-Messungen bei 37 ° C).
HINWEIS: Die Verwendung XF Medium, das Bikarbonat fehlt, ist kritisch. Da die Atmosphäre in der extrazellulären Flux Analyzer nur Umgebungs CO 2 enthält, jede Bicarbonat in dem Medium, bei der Bindung an Protonen als Nebenprodukt der Glykolyse freigesetzt wird distanziere CO 2 und Wasser zu bilden. CO 2 wird entgasen während des Experiments, was Drifts in pH, die die glykolytischen Ansäuerung Signal verschleiern würden. - Bereiten Sie Oligomycin: Bereiten 10 mM Stammlösung in DMSO; Lagerung bei -20 ° C.
- Bereiten 2,4-DNP: Bereiten Sie 1 M Stammlösung in DMSO; Lagerung bei -20 ° C.
- Bereiten Sie Antimycin A: Bereiten 10 mM Stammlösung in DMSO; Lagerung bei -20 ° C.
- Bereiten Sie Rotenon: Bereiten Sie 10 mM stock Lösung in DMSO; Lagerung bei -20 ° C.
- Bereiten Glucose: Man löst Glucose in Glykolyse Belastungstestmedium mit einer 250 mM Lösung zu bilden; Vorbereitung frisch vor jedem Experiment und nicht einfrieren.
- Bereiten Sie 2-DG: Man löst feste 2-DG in der Glykolyse Stresstest Medium mit einer 500 mM Lösung zu bilden; Vorbereitung frisch vor jedem Experiment und nicht einfrieren.
2. Ernte Milz und Lymphknoten von Mäusen
- Euthanize die Maus durch CO 2 Ersticken durch Genickbruch folgte.
- Sprühen Sie die Maus mit 70% Ethanol.
- Für die anschließende Zellisolierung T, ernten die Milz, oberflächliche Hals-, oberflächlichen / tiefen axillären, Kiefer, Leisten- und mesenterialen Lymphknoten.
- Für die anschließende B-Zell-Isolierung, Ernte nur die Milz.
HINWEIS: ein Bio-Sicherheitsschrank verwenden und die entnommenen Organe in PBS oder RF10 Medien auf Eis, bis die Verarbeitung halten. Verwenden Sie sterile Laborgeräte und sterile Technik für die gesamte Verarbeitung und isolation Schritte. Halten Sie alle Puffer und Medien auf Eis Isolationseffizienz zu erhöhen und den Zelltod zu reduzieren.
3. Gewebeverarbeitung
- Legen Sie eine 70 um Zelle Sieb über eine 50 ml konischen Röhrchen und übertragen die Organe auf das Sieb. Für T-Zell-Isolierung, vereinen alle Organe und für B-Zell-Isolierung Übertragung nur die Milz.
- Mit dem Kolben aus einer sterilen 3 ml Spritze, Maische, das Gewebe durch das Sieb. Beim Maischen stellen Sie sicher, dass der Filter und die Organe zu jeder Zeit feucht sind und nass sie durch Zugabe von MS-Puffer erforderlich, da. Dies wird sowohl die Lebensfähigkeit der Zellen hoch zu halten und ein Verstopfen des Filters zu verhindern.
- Nach dem Maischen gelten 5-10 ml MS zu dem Filter Puffer Zellgewinnung zu erhöhen. Zentrifugieren Sie die Suspension bei 400 xg für 5 min bei 4 ° C. (Führen Sie alle weiteren Zentrifugationen unter diesen Bedingungen, sofern nicht anders angegeben).
- Dekantiert die Flüssigkeit und das Pellet in 5 ml ACK roten Blutkörperchen Lysepuffer. IncuBeize für 5 min auf Eis roten Blutkörperchen (Erythrozyten müssen entfernt werden, weil sie mit der magnetischen Trennung stören) zu lysieren. In 10 bis 20 ml MS-Puffer und Zentrifuge.
- Legen Sie eine 30 um Zellenfilter über einen 15 ml konischen Röhrchen und ihn zunächst mit 1 ml MS-Puffer (diese Filtration wird Schmutz von der Erythrozytenlysepuffer entfernen). Die Flüssigkeit aus dem zentrifugierten Röhrchen, das Pellet in 5 ml MS-Puffer und es durch den Filter passieren. Waschen Sie die Anfangs Röhrchen mit 4 ml MS-Puffer Zellgewinnung zu erhöhen, und verwenden Sie diese um den Filter zu spülen.
- Verwendung eines Hämozytometers oder eines automatisierten Zellzähler, bestimmen die Gesamtzahl der Zellen. Diese Zellzahl wird verwendet, um die Menge der magnetischen Trennung Reagenzien in Abschnitt erforderlich, um zu bestimmen 4. Wenn Splenozyten sind in der nachfolgenden extrazellulären Flux-Test verwendet werden, die entsprechende Anzahl von Zellen zu diesem Zeitpunkt aufgehoben.
- Zentrifugieren Sie die Suspension und fahren Sie magnetische Trennung. Resuspendieren Splenozyten nicht verwendetfür B-Zell-Isolierung in 5 ml RF10 und auf Eis halten, bis der extrazellulären Fluss-Test.
4. Magnetische Trennung von B - Zellen und naiven CD4 + T - Zellen
- Bestimmen Sie die erforderlichen Mengen an Biotin-Antikörper-Cocktail, Anti-Biotin-Mikrokugeln und MS-Puffer. Verwenden Sie die folgenden Mengen für 10 8 Zellen als Leitfaden und vergrößern oder verkleinern, falls erforderlich.
HINWEIS: Inkubieren Proben in einem Kühlschrank nicht auf Eis, da Eis auf Inkubation können Antikörper-Bindungseffizienz und längere Inkubationszeiten erforderlich sein könnten reduzieren.
| Reagenzien für naive CD4 + T - Zell - Trennungs | Volume 10 8 Zellen |
| (Skalierung entsprechend) | |
| Biotin-Antikörper-Cocktail | 100 ul |
| MS-Puffer für die erste Inkubation | 400 ul |
| Anti-Biotin-Mikrokugeln | 200 ul |
| CD44 Microbeads | 100 ul |
| MS-Puffer für die zweite Inkubation | 200 ul |
| Inkubieren des Biotin-Antikörper-Cocktail und die Zellen bei 4 ° C für 5 min. Hinzufügen anti-Biotin-Microbeads, CD44 Microbeads, MS-Puffer und Inkubation bei 4 ° C für 15 min. | |
Tabelle 1: T - Zell - Isolation Volumen und Anweisungen.
| Reagenzien für die B - Zell - Trennung | Volume 10 8 Zellen |
| (Skalierung entsprechend) | |
| Biotin-Antikörper-Cocktail | 100 ul |
| MS-Puffer für die erste Inkubation | 400 ul |
| Anti-Biotin-Mikrokugeln | 200 ul |
| MS-Puffer für die zweite Inkubation | 300 ul |
| Inkubieren des Biotin-Antikörper-Cocktail und die Zellen bei 4 ° C für 15 min. Fügen Sie die entsprechenden Volumen von Biotin-Antikörper-Cocktail und MS-Puffer, und Inkubieren der Mischung bei 4 ° C für 15 min. Fügen Sie die entsprechenden Volumen von anti-Biotin-Mikrobeads und MS-Puffer und die Mischung bei 4 ° C für 15 min inkubieren. Nach der zweiten Inkubation die Röhrchen mit MS-Puffer und Zentrifuge füllen. | |
Tabelle 2: B - Zell - Isolation Volumen und Anweisungen.
- Das Pellet in MS-Puffer: 500 & mgr; l für die manuelle Trennung, 3-4 ml für die automatische Trennung.
- Fahren Sie mit entweder manuell oder automatisiert Trennungenwie folgt:
- Manuelle Trennung:
- Legen Sie eine LS-Säule in den Trennmagneten, legen Sie einen sterilen 15 ml konischen Röhrchen unter den Durchfluss durch und prime die Säule durch Waschen mit 3 ml MS-Puffer zu sammeln. Entsorgen Sie die Strömung durch.
- Übertragen Sie die Zellsuspension auf die grundierte LS Säule gegeben und es durchlaufen; Waschen Sie die Röhrchen während der Inkubation mit 3 ml MS-Puffer und übergeben diese durch die Säule zum Einsatz. Das Eluat wird die gereinigten Zellen enthalten. Für B-Zell-Isolierung, passieren die gereinigten Zellen durch die Säule ein zweites Mal in eine neue 15-ml-Röhrchen, und wiederholen Sie den Waschschritt. Dies wird Reinheit und die Ausbeute zu erhöhen.
- Automatische Trennung:
- Schalten Sie den automatischen Separator und überprüfen Sie die Ebenen der Laufpuffer, Spüllösung und 70% Ethanol. Stellen Sie sicher, dass der Abfall vor dem Start der Trennung ist leer.
- Wählen Sie die entsprechende gekühlt Rack je nach Rohrgröße von ter ungereinigte Probe (zB 15 ml). Um die Zellen lebensfähig während des Trennungsprozesses zu halten, verwenden Sie Racks, die 2-8 ° C für 3-4 Stunden bei zuvor gekühlt worden sind, oder bis das Kühlmittel wird fest.
- Montieren Sie die gekühlte Racks auf dem Probentisch des automatischen Separator.
- Platzieren Sie die Probenröhrchen in Steckplatz A1, ein Rohr für die negative Fraktion in Steckplatz B1 und ein Rohr für die positive Fraktion in C1. Wenn mehr als eine Probe zu sammeln, setzen zusätzliche Rohre in den nächsten Spalten (A2, B2, C2, etc.).
- Wählen Sie die Registerkarte Trennung auf dem Touchscreen, und zeigen die Anordnung von Rohren auf dem Rack. Von der Trennung Wählen Sie im Menü "Verbraucht" Programm und die Programmzyklus mit der entsprechenden Art von Wäsche vervollständigen (siehe Hinweis unten).
HINWEIS: Die "Verbraucht" Programm führt Erschöpfung der Maschine am empfindlichsten Modus, was Reinheit priorisiert. Darüber hinaus gibt es drei verschiedene Waschmöglichkeiten: quick spülen, spülen, und schlafen. Wenn die Proben aus der gleichen Quelle sind und miteinander kombiniert werden sollen, wählen Sie schnelles Spülen. Wenn die Proben werden getrennt gehalten sind, wählen Sie spülen. Wählen Sie den Schlaf-Option, wenn keine weiteren Isolationen an diesem Tag durchgeführt und wird, wenn die Maschine wird abgeschaltet Isolation folgende - Starten Sie die Isolation von "Run" drücken und bestätigen Sie die Pufferstufen, wenn Sie dazu aufgefordert. Nachdem das Programm beendet ist, wird die negative Fraktion gereinigter Zellen enthalten.
- Füllen Sie das konische Röhrchen bis zu 15 ml mit MS-Puffer und Zentrifuge.
- Dekantiert die MS-Puffer und resuspendieren Zellen in 5 ml RF10 Medien. Halten Sie Zellen auf Eis, bis der extrazellulären Fluss-Test.
HINWEIS: Im Idealfall, den extrazellulären Fluss Test sollte sofort nach der Isolierung durchgeführt werden. in Vorversuchen jedoch keine signifikanten Unterschiede in Assay-Ergebnisse wurden in Zellen beobachtet wurde innerhalb von 3 h der Isolation gegenüber frisch isoliert diejenigen verwendet.
- Manuelle Trennung:
5. Extracellular Flux Assay
HINWEIS: Das Protokoll ist hier skizzierte für das 96-Well-Format des Instruments. Volumes müssen angepasst werden, wenn ein anderes Format verwendet wird.
- Hydratisierung von Sensorkartusche
- Heben Sie die Sensorkassette nach oben, füllen jede Vertiefung der Utility-Platte mit 200 ul Kalibrierlösung und senken Sie die Sensorkartusche auf die Utility-Platte, Eintauchen der Sensoren in der Kalibrierlösung.
HINWEIS: Stellen Sie sicher, dass die Kalibrierlösung hoch genug ist, um die Sensoren unter Wasser zu halten. Die Patrone beherbergt Fluorophore zu O 2 zugeordnet ist und H + für jede Vertiefung; diese müssen mit Feuchtigkeit versorgt werden, um für sie richtig zu arbeiten. - Legen Sie die Patrone in einem 37 ° C Inkubator nicht mit CO 2 ergänzt oder Sauerstoff / Stickstoff. Führen Sie alle weiteren Inkubationen unter diesen Bedingungen, sofern nicht anders angegeben. Inkubieren Sie die Patrone über Nacht Hydrat.
- Heben Sie die Sensorkassette nach oben, füllen jede Vertiefung der Utility-Platte mit 200 ul Kalibrierlösung und senken Sie die Sensorkartusche auf die Utility-Platte, Eintauchen der Sensoren in der Kalibrierlösung.
- preparation von klebstoffbeschichteten Platten
- Bereiten 2,5 ml einer 22,4 & mgr; g / ml Klebstofflösung in 0,1 M Natriumbicarbonat, pH 8,0 (Bicarbonat liefert den optimalen pH-Wert für die Klebstoff-Adsorption).
- Anwenden 25 ul der Lösung zu jeder Vertiefung der Testplatte, und Inkubieren auf der Bank bei Raumtemperatur für 20 min.
- Absaugen Klebstoff und waschen Sie jedes Well zweimal mit 200 & mgr; l sterilem Wasser. Warten Sie, bis Brunnen trocken sind, bevor die Zellen Aussaat.
- Seeding Zellen in klebstoffbeschichteten Platten
- Zentrifugen Zellen bei Raumtemperatur bei 200 × g für 5 min. Die Zellen in 5 ml des entsprechenden Testmedium (siehe oben für die Formulierung der mitochondrialen Belastung und Glukose Stress Medien). Zentrifugen Zellen wieder und resuspendieren in der gewünschten Konzentration in Testmedium (Resuspensionsvolumen auf Konzentration variieren; jede Vertiefung enthält 180 & mgr; l der Zellsuspension).
HINWEIS: Solange die entsprechenden Testmedien und Verbindungs verwendet werden, die extrazelluläre Fluss Analysator gleichzeitig die mitochondriale und Glykolyse Stresstests auf der gleichen Platte ausgeführt werden kann. - Platte 180 & mgr; l der Zellsuspension in jede Vertiefung geben. Verwenden Brunnen A1, A12, H1 und H12 für die Hintergrundtemperaturkorrektur: in 180 & mgr; l Assay-Medium in diesen Brunnen (keine Zellen).
- Inkubieren Platten für 25 min bei 37 ° C.
- Zentrifugieren Sie die Platte bei 200 g für 5 min ohne Bremse, um sicherzustellen, dass alle Zellen vollständig angeschlossen haben. Optisch bestätigen, dass die Zellen, die stabil auf der Kulturoberfläche anhaften, um eine Monoschicht bilden, durch unter dem Mikroskop betrachtet. Übertragen Sie die Platten zurück in den Inkubator für weitere 30 min.
- Zentrifugen Zellen bei Raumtemperatur bei 200 × g für 5 min. Die Zellen in 5 ml des entsprechenden Testmedium (siehe oben für die Formulierung der mitochondrialen Belastung und Glukose Stress Medien). Zentrifugen Zellen wieder und resuspendieren in der gewünschten Konzentration in Testmedium (Resuspensionsvolumen auf Konzentration variieren; jede Vertiefung enthält 180 & mgr; l der Zellsuspension).
- Herstellung von 10-fach Konzentrationen von Verbindungen, und Laden von Injector Ports
- Für die mitochondrialen Stresstest vorbereiten jeweils 2,5 ml von 10 & mgr; M Oligomycin, 1 mM DNP und einer Mischung aus 10 & mgr; M Rotenon und 10 & mgr; M Antimycin A, die alle in der mitochondrialen Stress-Test mediuMeter
HINWEIS: Die Konzentration von 2,4-DNP basiert auf zuvor veröffentlichten Studien; 21 Dieses ist eine allgemeine Richtlinie , aber die Konzentration der Entkoppler für jede Zelle verwendet werden , sollten vom Forscher bestimmt werden. - Für die Glykolyse Stresstest vorbereiten jeweils 2,5 ml von 250 mM Glucose, 10 & mgr; M Oligomycin und 500 mM 2-Desoxyglucose (2-DG) in der Glykolyse Stresstestmedium.
- Warm 10x Lösungen auf 37 ° C und pH-Einstellung auf 7,4.
- Legen Sie die Verbindungen in die entsprechenden Injektors Ports der Patrone einer mehrkanaligen Mikropipetter und die Ladeführungen wie folgt mit:
Tabelle 3: Verbindung Bände.Hafen Mitochondriale Stress - Test Glykolyse Stress - Test EIN 20 ul Oligomycin 20 & mgr; l Glucose B 22 & mgr; l 2,4-DNP 22 & mgr; l Oligomycin C 25 ul Antimycin A / Rotenon 25 & mgr; l 2-DG
HINWEIS: Jede Reihe von Ports (zB alle Ports A) müssen das gleiche Volumen enthalten. Es ist wichtig, dass alle Vertiefungen in einer gegebenen Reihe geladen werden, auch wenn diese nicht in dem Experiment verwendet, da sonst die Verbindungen nicht injiziert werden (Ports in ungenutzten Vertiefungen können mit dem gleichen Volumen an Assaymedium geladen werden). - Inkubieren Sie die Patrone, während das Programm einrichten.
- Für die mitochondrialen Stresstest vorbereiten jeweils 2,5 ml von 10 & mgr; M Oligomycin, 1 mM DNP und einer Mischung aus 10 & mgr; M Rotenon und 10 & mgr; M Antimycin A, die alle in der mitochondrialen Stress-Test mediuMeter
- Einrichten extrazellulärer Flux Assay-Protokolle
- Stellen Sie das folgende Programm auf (Tabelle 4).
Tabelle 4: Programm - Layout.Schritt Schleife Kalibrierung - Equilibrierung - Baseline-Lesungen 3 mal: Mix 3 min, warten 0 min, messen 3 min End-Schleife - Injizieren Port A - Messungen 3 mal: Mix 3 min, warten 0 min, messen 3 min End-Schleife - Injizieren Anschluss B - Messungen 3 mal: Mix 3 min, warten 0 min, messen 3 min End-Schleife - Injizieren Anschluss C - Messungen 3 mal: Mix 3 min, warten 0 min, measure 3 min End-Schleife - Programm beenden -
HINWEIS: Unter bestimmten Bedingungen, zB bei der aktivierten Zellen verwendet, kann die Versauerung für mehr weiter als in naiven Zellen. Aus diesem Grund kann es notwendig sein, die "wait" -Zeiten in dem obigen Programm zu verlängern oder jeder Zyklus Messung mehrmals wiederholen. - Beginnen Sie mit dem Programm. Nach dem Kalibrierungsschritt, ersetzen Sie die Kalibrant Platte für die Assayplatte (bei Aufforderung).
HINWEIS: Mit der Software ist es möglich, Gruppen von Brunnen, um anzuzeigen, die ähnliche Bedingungen haben. Zusätzlich ist es entscheidend, die Vertiefungen sind die Kontrollvertiefungen geben (in diesem Protokoll sind sie die vier Ecken der Platte) und um anzuzeigen, welche Vertiefungen leer sind. Für eine detaillierte Schritt-für-Schritt, Protokoll zum Einrichten der Maschine und ess-Software, sollte die Website des Herstellers zu Rate gezogen werden.
- Stellen Sie das folgende Programm auf (Tabelle 4).
- Messproteingehalt
- Entfernen Sie den verbleibenden Testmedium aus jeder Vertiefung, ohne die Zellen zu stören.
HINWEIS: Wenn es nicht praktisch ist mit der Proteinkonzentration Test ablaufen, ist es möglich, die gesamte Platte bei -20 ° C bis zur Analyse einzufrieren. Wenn gefroren, aufgetaut, bevor Sie fortfahren. - Bereiten Sie eine 1x-Lösung von Protease-Inhibitoren (100x Lager) in RIPA Lysemedium (ausreichend für 50 & mgr; l / Well).
- In 50 ul RIPA Lysemedium mit Protease-Inhibitoren ergänzt jede Vertiefung. Rühre Platte auf einem Schüttler für 5 Minuten, und dann Platte für 30 Minuten vollständig zu lysieren Zellen auf Eis inkubiert.
- Drehen die Platte bei 200 xg für 5 min bei Raumtemperatur Lipiden und anderen Molekülen an die Unterseite der Platte zu bringen, so dass sie nicht mit dem Bicinchoninsäure (BCA) Assay stören.
- Messen Proteinkonzentration von BCA-Test nach Hersteller &# 39; s Empfehlungen.
- Entfernen Sie den verbleibenden Testmedium aus jeder Vertiefung, ohne die Zellen zu stören.
Ergebnisse
Eukaryotische Zellen verwenden, um ein integriertes Netzwerk von Glykolyse, die Tricarbonsäure (TCA) -Zyklus, und die oxidative Phosphorylierung zu treffen, um die Mehrheit ihrer Energiebedarf und Zwischenprodukte für das Zellwachstum und die Proliferation erforderlich ist. Diese Wege beginnen mit dem intrazellulären Einfangen von freier Glucose in Form von Glucose-6-phosphat, die anschließend in Pyruvat verarbeitet wird. Pyruvat wird entweder reduziert zu Lactat oder in die Mitochondrien transportiert, wo es Acetyl-Coenzym A (CoA) bildet. Acetyl-CoA tritt dann in den TCA-Zyklus. Hochenergetische Zwischenprodukte des Citratzyklus die Bewegung von Elektronen in der Elektronentransportkette (ETC) antreiben, die wiederum H + aus der mitochondrialen Matrix ausstößt einen H + -Gradienten über die innere Mitochondrienmembran zu erzeugen. Sauerstoff wirkt als die endgültige Elektronenakzeptor und H + wieder zurück in die mitochondriale Matrix durch die F O / F 1 - Komplex, wo ihre potentielle Energie verwendet wird ATP (1A) zu erzeugen.
Das Arbeitsprinzip der extrazellulären Fluss Assay hängt mit der Glykolyse und oxidative Phosphorylierung an spezifischen Punkten auf störende und Bewertung der daraus resultierenden Effekte. Zu diesem Zweck verwendeten wir Glucose Glykolyse in ausgehungert Zellen zu vermehren, und 2-Desoxyglucose (2-DG), die auf 2-Desoxyglucose-6-phosphat, einem kompetitiven Inhibitor von Phosphoglucoisomerase umgewandelt 23, Hexokinase, um zu blockieren , Glykolyse. Rotenon (komplexe I-spezifischer Inhibitor des ETC), Antimycin A (komplexe III-spezifischen Inhibitor des ETC), Oligomycin (Inhibitor der ATP - Synthase 24) und die Entkopplungsmittel 2,4-dinotrophenol (DNP) 25 waren In den elektronen~~POS=TRUNC, Protonengradienten und ATP - Synthese (1A) im Zusammenhang verwendet , um spezifische Ereignisse zu intervenieren. Anstelle von 2,4-DNP, Carbonyl cyanid-4- (trifluormethoxy) phenylhydrazon (FCCP) kann auch verwendet werden, aber eine weitere Optimierung erforderlich. In jedem Fall ist die optimale Konzentration erforderlich, um zu bestimmen Entkuppler sollte immer vor der Verwendung für einen bestimmten Zelltyp titriert werden.
Die Glykolyse Stresstest (Abbildung 1B) beginnt mit einer Baseline - Messung der extrazellulären Ansäuerung Rate (ECAR) in den zuvor ausgehungert Zellen. Da diese Zellen in ihrem basalen minimal sind, und kann daher praktisch als nicht glykolytischen betrachtet werden, die ECAR an dieser Stelle gemessen wird, als nicht-glykolytischen Ansäuerung bezeichnet. Diese Ansäuerung entspricht wahrscheinlich die Atmungs CO 2 in dem TCA - Zyklus erzeugt HCO umgewandelt wird 3 - und H +. Dies wird durch die Injektion von Glucose, gefolgt Glykolyse zu aktivieren, die als eine Zunahme in der extrazellulären Ansäuerung stellt aufgrund der Bildung von Lactat.Dieser Anstieg stellt die normale Rate der Glykolyse. blockier die Erzeugung von ATP durch oxidative Phosphorylierung Die Zellen werden dann mit der Injektion von Oligomycin, in Frage gestellt. Zellen reagieren auf diese dramatische Abnahme der ATP-Produktion durch Glykolyse auf seinen maximalen Pegel zu aktivieren, und das führt zu einer sekundären Erhöhung der ECAR Ebene (Glykolyse-Reserve). Der Test wird durch vollständige Hemmung der Glykolyse mit dem Glukose analogen 2-DG, beendet die die ECAR in seinen nicht glycolytic Niveau zurückkehrt. Interessanterweise ist vorgeschlagen worden , dass im Gegensatz zu den Empfehlungen des Herstellers wird maximal Glycolyse nicht notwendigerweise durch die Injektion von Oligomycin 26 erreicht. In Zellen mit einer hohen glykolytischen Kapazität, wenn kein signifikanter Anstieg in ATP Nachfrage ist, kann Glykolyse durchaus in der Lage sein, mit dem Verlust des mitochondrialen ATP zu bewältigen, ohne sie benötigen hochreguliert zu sein. Die Glykolyse-Rate mit Oligomycin konnte durch Zugabe von Atmungshemmer übertroffen werdenWie Rotenon und Myxothiazol, die einige Vorteile gegenüber Oligomycin bieten: 1) Sie erhöhen die ATP Nachfrage, da sie die Umkehrung der ATP - Synthase, mit der ATP - Hydrolyse verursachen, Protonen in einem Versuch zu pumpen das mitochondriale Membranpotential 26 zu erholen; 2) Sie verhindern, dass Atem Ansäuerung des Mediums, das die ECAR Ergebnisse durcheinander bringen können (siehe unten). Andere Wege ATP Nachfrage zu erhöhen , umfassen die Zugabe von Verbindungen, die die Hydrolyse von ATP durch die Plasmamembran ATPasen 26 stimulieren. All dies sollte sorgfältig von den Forschern in Betracht gezogen werden, wenn ein Glykolyse Stresstest zu planen.
Die mitochondrialen Stresstest (1C) beginnt mit einer Baseline - Messung des Sauerstoffverbrauchsrate (OCR) in nicht ausgehungert Zellen. Dies wird durch die Injektion von Oligomycin gefolgt, die die Rückkehr der Protonen durch die F O / F 1 - Komplex hemmt und somit schnell hyperpolarizes die Membran der Mitochondrien. Hyperpolarisation verhindert ein weiteres Proton durch Atmungskomplexe Pumpen, und die Atemfrequenz nimmt ab. Die verbleibende Atmung Protonenleck bezeichnet, die den Fluss der Protonen durch Lipide oder andere Kanäle darstellt. Diese hyperpolarisierten Zustand wird durch die Zugabe des Entkopplungsmittel 2,4-DNP, die als Protonen Ionophor wirkt schnell umgekehrt. Als Reaktion darauf versuchen Zellen das Membranpotential in einem vergeblichen Versuch, sich zu erholen, indem die Elektronentransportrate zu seiner maximalen Erhöhung und dies wiederum erhöht die OCR. Schließlich mit dem Zusatz von zwei ETC-Inhibitoren (Antimycin A und Rotenon) vollständig mitochondriale Atmung stoppt und OCR sinkt auf sein niedrigstes Niveau. Auf dieser Ebene ist der Sauerstoffverbrauch aufgrund mitochondriale Aktivität (nicht-mitochondriale). Der Unterschied in der durch diese Inhibitoren erzeugten OCR wird die maximale mitochondrialen Atmung, genannt, die die Summe der Basislinie der Atmung und der Reservekapazität.
B und T - Zell - Isolationen Ausbeute sehr tragfähige reine Lymphozyten - Populationen.B - Zellen und naiven CD4 + T - Zellen wurden wie in Abschnitt 4 des Protokolls skizziert isoliert und Splenozyten wurden einfach durch Lysieren der roten Blutkörperchen erhalten , wie in Abschnitt 3.3 beschrieben.
Die Empfindlichkeit der Zelltyp-spezifischen metabolischen Assays hängt von der Lebensfähigkeit und der Reinheit der Ausgangszellpopulation. Daher ist , um die Lebensfähigkeit der isolierten Maus - T - Zellen zu überprüfen, Splenozyten und B - Zellen, und die Reinheit von T- und B - Zellen, kleine Aliquots der Zellen wurden für die durchflusszytometrische Analyse (Abbildung 2) gefärbt. In der Vorwärtsstreuung-Bereich vs. Seitenstreubereich (FSC-A vs. SSC-A) Plot wurden Lymphozyten gated, und innerhalb dieses Tor, die Bevölkerung entlang der Diagonale in der Vorwärtsstreuung-height (FSC-H) gegen FSC-A-Grundstück wurden als Singuletts bestimmt. Innerhalb der Singulettpopulation wurde Lebensfähigkeit gemessen , indem die Zellen Gating, die für die Live / Dead - Marker (2A) negativ gefärbt; T-Zell-Lebensfähigkeit betrug 97,9%, Splenozyten- Lebensfähigkeit betrug 92%, und B die Lebensfähigkeit der Zellen betrug 94%. B - Zell - Reinheit, gemessen durch den B220 + CD19 + -Population 26, betrug 99%, während die CD4 + T - Zell - Reinheit, wie durch das CD44 gemessen - CD4 + -Population 27, betrug 98,3% (2B).
Die Proteinkonzentration des Zelllysats kann als direkter Indikator für plattierte Zellzahl verwendet werden.
Isolierte Lymphozyten und Splenozyten wurden bei 5 x 10 5 Zellen / Vertiefung in einem Klebstoff beschichteten 96-Well - Assayplatte plattiert, 2,5 x 10 5 Zellen / Vertiefung, 1,25 x 10 5 Zellen / Vertiefung und 0,625 x 10 5 Zellen / Vertiefung. Der Zusammenfluss an jeder Plattierungsdichte der drei Zelltypen wurde unter dem Lichtmikroskop (3A) sichtbar gemacht . Wie erwartet, Einmündung in den anfänglichen Plattierung Dichten korreliert. Nach Abschluss der extrazellulären Fluss Assay wurden plattierten Zellen lysiert und deren Proteinkonzentrationen wurden mit dem BCA Assay quantifiziert. Für alle Zelltypen wurden Lysat Proteinkonzentrationen gezeigt linear mit der anfänglichen Beschichtungsdichten (3B) korreliert werden, die die Konzentrationen Lysat - Protein bestätigt , kann als ein genaues Maß für die Normalisierung der Zellzahlen verwendet werden , wenn die extrazellulären Flussdaten zu interpretieren. Die Beschichtungsdichten in diesem Experiment verwendet wurden naive, unstimulierte Lymphozyten optimiert. Wenn stimuliert oder zuvor kultivierten Zellen verwendet werden sollen, kann eine weitere Optimierung erforderlich.
Mitochondriale und glycolytic stress-Assays sind abhängig von plattierten Zellzahl.
Die OCR wurde für jeden Zelltyp und Plattierungsdichte in der extrazellulären Flußmittel gemessen. Wie erwartet, haben höhere Zellzahlen eine höhere Mess OCR sowie dramatischer Reaktionen auf Oligomycin, 2,4-DNP und Antimycin A / Rotenon (4A). OCR Standardisieren Messungen an einzelnen Proteinkonzentration der Probe zeigt, dass in der Regel eine größere Anzahl von Zellen führen zu genaueren OCR-Messungen. Plattierung bei 5 und 2,5 x 10 5 Zellen / resultierte auch in ähnlicher normalisierten OCR Messungen in den T - Zellen und Milzzellen und 5 und 1,25 x 10 5 Zellen / resultierte auch ähnliche normalisierten OCR Messungen in B - Zellen (4B). Die geringen Unterschiede in der normalisierten B - Zell - OCR Messungen könnte ein indirektes Anzeichen dafür sein , dass B - Zellen mit 2,5 × 10 5 Zellen bessere Leistung / well im Vergleich zu anderen Zelldichten. Mit allen Maßnahmen, 0,625 x 10 5 Zellen / Vertiefung gab suboptimalen Ergebnissen, die zeigen , dass diese Plattierungsdichte unzureichend ist. Baseline - Atmungs, Protonenleck, maximale mitochondrialen Atmung, nicht-mitochondrialen Atmung und ATP Produktion linear mit der Beschichtungsdichten für alle Zelltypen (4C) korreliert. Zusätzlich wird der größte Teil der Basislinie Atmung verwendet ATP zur Synthese, wie durch die geringe Protonenleck in den drei Zelltypen angegeben. Während der primäre Fokus des Experiments mitochondrialen Stress Veränderungen in OCR zu messen, ist die ECAR nützlich noch aufzuzeichnen, daß der Test, um sicherzustellen, wurde erfolgreich durchgeführt. Ähnlich wie bei der OCR, die beiden höheren Plattierung Dichten führte zu höheren ECAR und dramatischer Reaktionen auf Oligomycin, 2,4-DNP und Antimycin A / Rotenon (4D). Die dramatischen Veränderungen in ECAR bei der Zugabe von 2,4-DNP und Antimycin A / Rotenon kann bei der Atmung zusätzlich zu den Änderungen in g aufgrund von Änderungen seinlycolysis, da CO 2 in dem TCA - Zyklus erzeugt wird, HCO 3 umgewandelt - und H +. Dieses Problem wurde vor kurzem angesprochen, und es gibt eine einfache Methode für die gesamte extrazelluläre Ansäuerung Signal unter Verwendung von Sauerstoffverbrauchsdaten zu korrigieren, die reale glykolytischen Rate 12,29 zu erhalten.
Die Glykolyse Stress - Test war am erfolgreichsten bei der höchsten Plattierungsdichte (5A, B). In allen Zelltypen, die 5 x 10 5 Zellen / well Proben hatten die größten Veränderungen in ECAR nach der Zugabe von Glucose, Oligomycin und 2-DG (5B). Darüber hinaus zeigte die Proteinkonzentration zu normalisieren , dass für alle Zelltypen, die 5 x 10 5 Zellen / Well Proben optimale Ergebnisse erzielt, während niedrigere Konzentrationen-insbesondere 0,625 x 10 5 Zellen / gut nicht eine robuste glycolytic Reservekapazität anzuzeigen. Nicht glycolytic Versauerung, Glykolyse, und die scheinbare glycolytic Kapazität linear mit Überzug Dichten für alle Zelltypen (5C) korreliert. Für die Glykolyse Stress Experiment zeigt die OCR Diagramm, das Glucose stimuliert leicht mitochondrialen Atmung, die dann durch Oligomycin Behandlung inhibiert wird; die Zugabe von 2-DG hatte keinen Einfluss auf die OCR (5D). Die OCR-Grafik kann als weiterer Indikator verwendet werden, dass die Glykolyse Stress Experiment erfolgreich durchgeführt wurde. Auch kann die OCR Graph verwendet werden , um die ECAR Graph zu korrigieren, falls erforderlich, wie oben im Falle des mitochondrialen Belastungstest 12,29 erläutert.
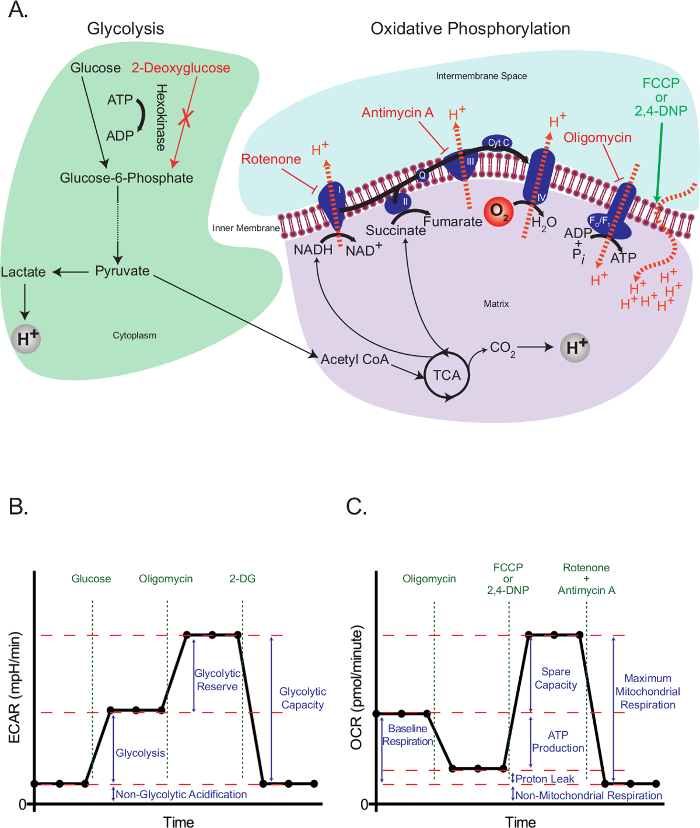
Abb . 1: Übersicht über die extrazellulären Fluss - Assays (A) Abbildung der Glykolyse (links) und die oxidative Phosphorylierung (rechts) zeigt die Wirkung desmetabolische Medikamente in den extrazellulären Flussassays verwendet. (B) Schematische Darstellung der extrazellulären Ansäuerung Rate (ECAR) Graph; Schema des Sauerstoffverbrauchsrate (OCR) Diagramm (C). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
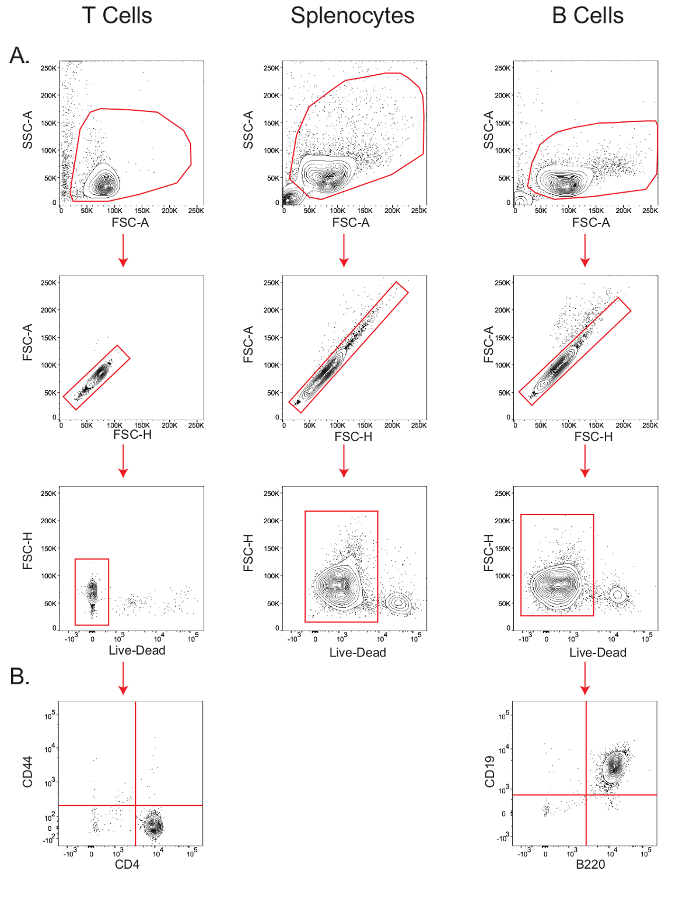
. Abbildung 2: Stepwise Gating von T - Zellen, B - Zellen und Splenozyten Lebensfähigkeit und Reinheit zu bestimmen Durchflusszytometrie Plots der Lebensfähigkeit von T - Zellen, Splenozyten und B - Zellen (A) zeigt; und Reinheit von T- und B - Zellen (B). Die Ergebnisse sind von mindestens drei unabhängigen Experimenten repräsentativ. Bitte klicken Sie hier , um eine größere Version zu sehen thFigur.
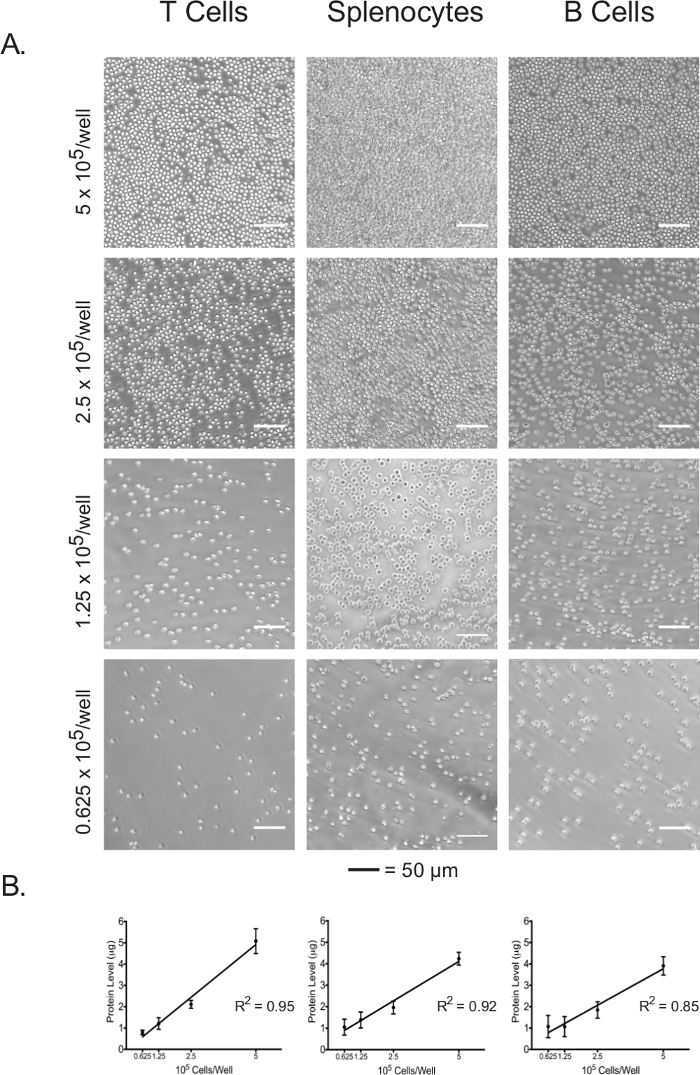
Fig . 3: Die Zellkonfluenz korreliert mit dem Lysat Proteinkonzentrationen einer jeden Zelltyps bei verschiedenen plating Dichten (A) Lichtmikroskopische Aufnahmen von Zellen in Assayplatte Vertiefungen bei plating Dichten im Bereich von 5 x 10 5 Zellen / well bis 0,625 x 10 5 Zellen / Gut. Maßstabsbalken bezeichnen 50 & mgr; m. (B) Lysate Proteinkonzentrationen bei verschiedenen Beschichtungsdichten, wie durch den BCA - Assay gemessen. Die Ergebnisse sind von mindestens drei unabhängigen Experimenten repräsentativ. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
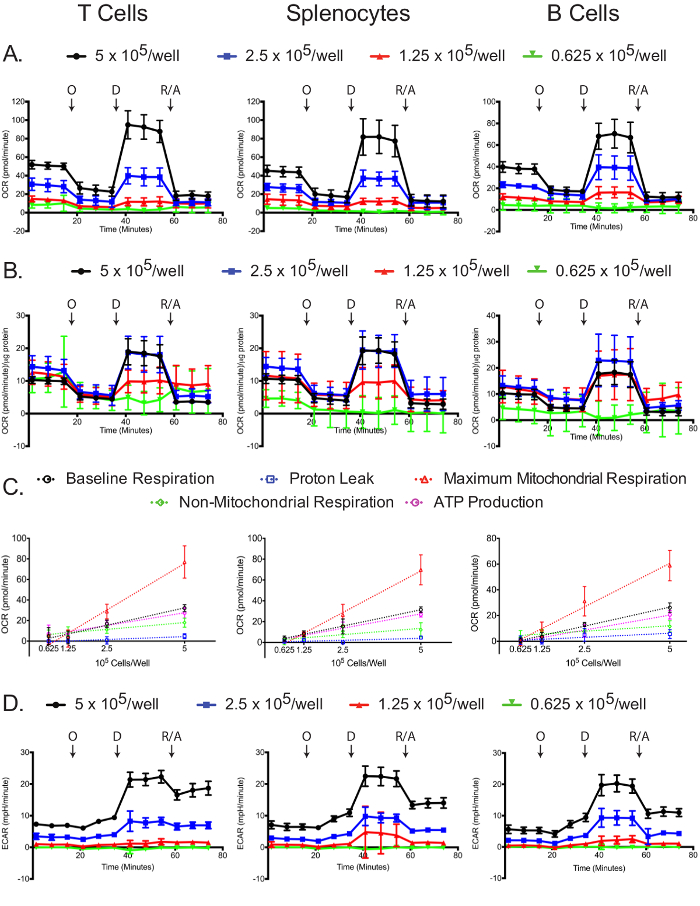
Abbildung 4: Mitochondriale Stress - Test. Raw (A) und standardisiert (B) OCR für jeden Zelltyp und Plattierungsdichte gezeigt. (C) Zellzahl abhängige Änderungen in der Höhe der Grundlinie, die maximale mitochondrialen und nicht-mitochondrialen Atmung, sowie die Sauerstoffverbräuche verbunden Protonenleck oder ATP - Produktion, werden für jede Zelltypen gezeigt. (D) Raw ECAR Werte aus den mitochondrialen Stresstests erhalten werden gezeigt. Jeder Datenpunkt stellt den Mittelwert von 7-8 Vertiefungen mit Standardabweichung. Markierten Pfeile bezeichnen Injektionen von Oligomycin (O), 2,4-DNP (D) und Rotenon / Antimycin A (R / A). Die Ergebnisse sind von mindestens drei unabhängigen Experimenten repräsentativ. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
_upload / 54918 / 54918fig5.jpg "/>
Abbildung 5:. Glykolytische Stress - Test Raw (A) und standardisiert (B) ECAR für jeden Zelltyp und Plattierungsdichte gezeigt. (C) Zellzahl abhängige Änderungen in ECAR für nicht glykolytischen Ansäuerung, Glucose-induzierte Glykolyse und die Gesamtkapazität glykolytischen gezeigt. (D) Raw OCR - Werte aus den Glykolyse - Stresstests erhalten werden gezeigt. Jeder Datenpunkt stellt den Mittelwert von 7-8 Vertiefungen mit Standardabweichung. Markierten Pfeile bezeichnen Injektionen von Glucose (G), Oligomycin (O) und 2-Desoxyglucose (2-DG). Die Ergebnisse sind von mindestens drei unabhängigen Experimenten repräsentativ. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Das Protokoll, entwickelten wir für die effiziente Isolierung von reinem und tragfähige Lymphozytensubpopulationen erlaubt, die anschließend bei verschiedenen Konzentrationen in extrazellulären Flussanalyse wurden verwendet, um die Unterschiede in der Glykolyse und der mitochondrialen Atmungsleistung zu bewerten. Dieses Protokoll ist speziell für Lymphozyten und adressiert die spezielle Überlegungen zu dieser Zelltypen im Zusammenhang, wie niedrige basale metabolische Aktivität, Zerbrechlichkeit, niedrige Frequenz, und ihre Unfähigkeit zu Testplatten haften. Daher kann im Vergleich zu bisher veröffentlichten Protokolle 11,12 unsere Methode bietet eine bequemere und besser optimierte Führung für Forscher auf dem Gebiet der Immunologie arbeiten. Es gibt mehrere wichtige Schritte in diesem Protokoll, einschließlich der immer rein und lebensfähige Zellpopulationen, die Plattierung der Zellen bei optimalen Zusammen und Standardisierung der extrazellulären Flusstestmessungen an die Proteinkonzentration in jeder Vertiefung.
Das initial Anzahl von Zellen plattiert konnte sowohl durch Lichtmikroskopie sichtbar gemacht werden und auch Proteinkonzentration Messungen quantifiziert werden. Die lineare Korrelation zwischen der Zellzahl und die Proteinkonzentration bestätigt, dass die Proteinkonzentration in der Tat als ein Weg verwendet werden kann, um die Auswirkungen von Veränderungen in der Zellzahlen zwischen verschiedenen Vertiefungen zu standardisieren.
Durch die Standardisierung der ECAR und OCR - Ergebnisse zu den Proteinkonzentrationen, haben wir gezeigt , dass trotz geringerer Zellkonfluenz, so wenig wie 2,5 x 10 5 Zellen / Vertiefung in den meisten Assays verwendet werden, um die Qualität der Daten , ohne Kompromisse. Jedoch ist die untere Grenze von Zellen, die zwischen den Zelltypen und Assays verwendet werden, können variiert werden. Zum Beispiel, während so wenig wie 1,25 x 10 5 Zellen für die B - Zell - OCR - Messungen verwendet werden könnten, auch 2,5 x 10 5 Zellen / waren nicht gut genug , um die glykolytischen Leistung des gleichen Zelltyps zu bewerten. Daher, solange die Zellzahl ist kein begrenzender Faktor, Plattieren bei über90% Konfluenz, was etwa 5 entspricht x 10 5 Lymphozyten / Napf, bevorzugt. Eine weitere Optimierung kann erforderlich werden, wenn die Zellen in verschiedenen Größen-wie zuvor aktivierte und teilweise differenzierten Lymphozyten-Einsatz. Zusätzlich kann, wenn zuvor kultivierten primären Lymphozyten verwendet, könnte es eine Variation in der Zelllebensfähigkeit zwischen den verschiedenen Behandlungsbedingungen sein, was die Zuverlässigkeit der Proteinkonzentration als Maß für die Zellzahl seit toten oder sterbenden Zellen auf die gemessenen Proteinspiegel kann auch dazu beitragen, verringern würde . In solchen Fällen kann es hilfreich sein, lebende Zellen durch die Strömung zu sortieren Zytometrie, bevor die extrazellulären Fluss-Assays durchgeführt wird.
In unseren Tests frisch isolierten und stark tragfähige Lymphozyten-Populationen verwenden, erhalten wir eine zuverlässige Funktionsdaten für beide OCR und ECAR Messungen. Während alle Zelltypen in ähnlicher Weise in der mitochondrialen Stresstest verhalten haben, ergaben sich deutliche Unterschiede zwischen Zelltypenin der Glykolyse Stresstest beobachtet. Zum Beispiel war die Glykolyse-Leistung von naiven T-Zellen gering im Vergleich zu Splenozyten oder B-Zellen, und es hat nicht mit dem Zusatz von Oligomycin ändern. Diese Beobachtung steht im Einklang mit den zuvor veröffentlichten Studien 7,30, die Gültigkeit unseres Protokolls bestätigt.
Abschließend unser Verfahren bietet eine effiziente und bequeme Weise die Stoffwechselaktivität der Lymphozyten von Testen eines extrazellulären Fluss Analysator verwenden, und es kann in einem breiten Spektrum von immunologischen Studien Erforschung der metabolischen Veränderungen in Immunzellen bei Aktivierung, Zelldifferenzierung oder durch nützlich sein, zu Krankheitsphänotypen wie Infektionen, Autoimmun- und malignen hämatologischen Erkrankungen.
Offenlegungen
The authors declare that they have no competing financial interests. Open Access fees for this article were provided by Agilent Technologies.
Danksagungen
The authors thank Dr. Michael N. Sack (National Heart, Lung, and Blood Institute) for support and discussion, Ms. Ann Kim for optimizing the B cell isolation protocol, Dr. Joseph Brzostowski for his help with microscopy, and Ms. Mirna Peña for maintaining the animals used. This study was supported by the Intramural Research Programs of the National Institutes of Health, National Institute of Allergy and Infectious Diseases, and National Heart, Lung, and Blood Institute.
Materialien
| Name | Company | Catalog Number | Comments |
| PBS (pH 7.2) | Gibco-ThermoFisher | 20012-050 | To make MACS buffer |
| Bovine Serum Albumin BSA | Sigma-Aldrich | A3803 | To make MACS buffer |
| 0.5 M EDTA, pH 8 | Quality Biological | 10128-446 | To make MACS buffer |
| autoMACS rinsing solution | Miltenyi Biotec | 130-091-222 | Instead of PBS + EDTA to make MS buffer. Also used in autoMACS Pro Separator. |
| RPMI-1640 | Gibco-ThermoFisher | 11875-093 | Contains phenol red and L-glutamine |
| Fetal Bovine Serum | Gibco-ThermoFisher | 10437-028 | For heat-inactivation, thaw frozen stock bottle in a 37 °C water bath and then inactivate at 56 °C for 30 min. Aliquot heat-inactivated serum for storage (e.g., in 50 ml conical tubes) and freeze at -20 °C until needed. |
| Penicillin-Streptomycin (Pen Strep) | Gibco-ThermoFisher | 15140-122 | Combine Pen Strep with L-Glut 1:1 (if making 500 ml media, make a total of 12 ml Pen Strep/L-Glut); keep aliquots at -20 °C until ready to make media. |
| L-Glutamine 200 mM (L-Glut) | Gibco-ThermoFisher | 25030-081 | Component of RF10 and stress test media |
| Sodium pyruvate 100 mM | Gibco-ThermoFisher | 11360-070 | Component of RF10 and stress test media |
| HEPES 1 M | Gibco-ThermoFisher | 15630-080 | Component of RF10 |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco-ThermoFisher | 11140-050 | Component of RF10 |
| 2-Mercaptoethanol (55 mM) | Gibco-ThermoFisher | 21985-023 | Component of RF10 |
| Falcon 70 μm cell strainer | Falcon-Fischer Scientific | 87712 | Used in cell isolation |
| Monoject 3 ml Syringe, Luer-Lock Tip | Covidien | 8881513934 | Used in cell isolation |
| Falcon 15 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-959-53A | Used in cell isolation |
| Falcon 50 ml Conical Centrifuge Tubes | Falcon-Fischer Scientific | 14-432-22 | Used in cell isolation |
| ACK Lysing Buffer | Lonza | 10-548E | Used in cell isolation |
| CellTrics 30 μm cell filter, sterile, single-packed | Partec CellTrics | 04-004-2326 | Used in cell isolation |
| B Cell Isolation Kit, mouse | Miltenyi Biotec | 130-090-862 | Used in cell isolation |
| Naïve CD4+ T cell isolation kit, mouse | Miltenyi Biotec | 130-104-453 | Used in cell isolation |
| LS Column | Miltenyi Biotec | 130-042-401 | Used in cell isolation |
| MidiMACS separator | Miltenyi Biotec | 130-042-302 | Magnet for separation |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | Holder for magnets |
| autoMACS Rinsing Solution | 130-091-222 | Rinsing solution for autoMACS Pro Separator | |
| autoMACS Pro Separator Instrument | Miltenyi Biotec | N/A | |
| 2-Deoxy-D-glucose (2-DG) | Sigma-Aldrich | D8375-5G | |
| Cell-Tak | Corning | 354240 | Cell adhesive. Take care to note concentration, as each lot is different (package is 1 mg). |
| Oligomycin | Sigma-Aldrich | 75351 | |
| 2,4-Dinotrophenol (2,4-DNP) | Sigma-Aldrich | D198501 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Halt Protease Inhibitor Cocktail | ThermoFisher Scientific | 78429 | Supplied as 100x cocktail, combine with RIPA to form 1x solution for lysis. |
| RIPA Buffer | Boston BioProducts | BP-115 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | Follow manufacturer's instructions |
| Seahorse XFe96 FluxPak | Seahorse Bioscience | 101085-004 | Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
| Seahorse XF Base Medium | Seahorse Bioscience | 102353-100 | Used to prepare stress test media |
| Seahorse XFe96 Extracellular Flux Analyzer | Seahorse Bioscience | ||
| Stericup Sterile Vacuum Filter Units, 0.22 μm | EMD Millipore-Fisher Scientific | SCGPU10RE | Used to sterile filter media. |
| Sodium bicarbonate | Sigma-Aldrich | 487031 | Dissolved to 0.1 M and used to dilute Cell-Tak. |
Referenzen
- Motz, G. T., Coukos, G. Deciphering and reversing tumor immune suppression. Immunity. 39 (1), 61-73 (2013).
- Akkaya, M., Barclay, A. N. How do pathogens drive the evolution of paired receptors?. Eur J Immunol. 43 (2), 303-313 (2013).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu Rev Immunol. 27, 591-619 (2009).
- Dinarello, C. A. Proinflammatory cytokines. Chest. 118 (2), 503-508 (2000).
- Kurosaki, T., Kometani, K., Ise, W. Memory B cells. Nat Rev Immunol. 15 (3), 149-159 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Gerriets, V. A., Rathmell, J. C. Metabolic pathways in T cell fate and function. Trends Immunol. 33 (4), 168-173 (2012).
- Doughty, C. A., et al. Antigen receptor-mediated changes in glucose metabolism in B lymphocytes: role of phosphatidylinositol 3-kinase signaling in the glycolytic control of growth. Blood. 107 (11), 4458-4465 (2006).
- Caro-Maldonado, A., et al. Metabolic reprogramming is required for antibody production that is suppressed in anergic but exaggerated in chronically BAFF-exposed B cells. J Immunol. 192 (8), 3626-3636 (2014).
- Pelletier, M., Billingham, L. K., Ramaswamy, M., Siegel, R. M. Extracellular flux analysis to monitor glycolytic rates and mitochondrial oxygen consumption. Methods Enzymol. 542, 125-149 (2014).
- Mookerjee, S. A., Brand, M. D. Measurement and Analysis of Extracellular Acid Production to Determine Glycolytic Rate. J Vis Exp. (106), e53464 (2015).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Klein, A. B., et al. Impact of different cell isolation techniques on lymphocyte viability and function. J Immunoassay Immunochem. 27 (1), 61-76 (2006).
- Hsueh, R. C., et al. Purification and Characterization of Mouse Splenic B Lymphocytes. AfCS Research Reports. 1 (1), 1-11 (2012).
- Zambrano, K., et al. Prolonged ex vivo expansion and differentiation of naive murine CD43 B splenocytes. Biotechnol Prog. , (2016).
- Costa, G. L., et al. Targeting rare populations of murine antigen-specific T lymphocytes by retroviral transduction for potential application in gene therapy for autoimmune disease. J Immunol. 164 (7), 3581-3590 (2000).
- Franz, B., May, K. F., Dranoff, G., Wucherpfennig, K. Ex vivo characterization and isolation of rare memory B cells with antigen tetramers. Blood. 118 (2), 348-357 (2011).
- Schneider, D. F., Glenn, C. H., Faunce, D. E. Innate lymphocyte subsets and their immunoregulatory roles in burn injury and sepsis. J Burn Care Res. 28 (3), 365-379 (2007).
- Reeves, J. P., Reeves, P. A. Removal of lymphoid organs. Curr Protoc Immunol. Chapter 1, Unit 1 9 (2001).
- Akkaya, B., et al. A Simple, Versatile Antibody-Based Barcoding Method for Flow Cytometry. J Immunol. 197 (5), 2027-2038 (2016).
- Traba, J., et al. Fasting and refeeding differentially regulate NLRP3 inflammasome activation in human subjects. J. Clin. Invest. 125 (12), 4592-4600 (2015).
- Wick, A. N., et al. Localization of the Primary Metabolic Block Produced by 2-Deoxyglucose. J. Biol. Chem. 224 (2), 963-969 (1957).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthetase system. Methods Enzymol. 55, 472-518 (1979).
- Terada, H. Uncouplers of oxidative phosphorylation. Environmental Health Perspectives. 87, 213-218 (1990).
- Mookerjee, S. A., Nicholls, D. G., Brand, M. D. Determining Maximum Glycolytic Capacity Using Extracellular Flux Measurements. PLOS ONE. 11 (3), e0152016 (2016).
- Lai, L., Alaverdi, N., Maltais, L., Morse, H. C. Mouse cell surface antigens: nomenclature and immunophenotyping. J Immunol. 160 (8), 3861-3868 (1998).
- Gerberick, G. F., Cruse, L. W., Miller, C. M., Sikorski, E. E., Ridder, G. M. Selective modulation of T cell memory markers CD62L and CD44 on murine draining lymph node cells following allergen and irritant treatment. Toxicol Appl Pharmacol. 146 (1), 1-10 (1997).
- Mookerjee, S. A., Goncalves, R. L. S., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochim. Biophys. Acta - Bioenergetics. 1847 (2), 171-181 (2015).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. J Exp Med. 212 (9), 1345-1360 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten