Method Article
שיפה Sap דגימה של כרוב napus עבור תלת-ממד-דף של חלבונים, קומפלקסים Ribonucleoprotein
In This Article
Summary
כאן אנו מציגים פרוטוקול כדי לנתח את הרכב החלבון גדול מקורי: חלבון וחלבון: חומצות גרעין מתחמי מהאונס שמן (נולד ב- napus) תפליט שיפה בגישה של תלת-ממד לזיהוי ג'ל אלקטרופורזה (עמוד) שילוב של כחול מקורי (בסון) עם שני עמודים denaturing ואחריו זיהוי המוני spectrometric.
Abstract
דגימה של שיפה של צמחים גבוהים לעתים קרובות מפרך ותלוי באופן משמעותי מיני צמחים. עם זאת, מחקרים פרוטאום תחת denaturing תנאים ניתן להשיג במינים שונים. מקורית: חלבון וחלבון: חומצות גרעין מתחמי מדגימות שיפה יש עדיין בקושי נותחו, למרות שהם אולי משחק תפקידים חשובים תחזוקת את התא מיוחדים או איתות למרחקים ארוכים. מכלולים גדולים מולקולרית ניתן לבודד באמצעות של כחול מקורי בג'ל (בסון-עמוד). ניתן להפריד בין מרכיבי חלבון שלהם על ידי סולפט נתרן עוקבות dodecyl (דף מרחביות-). עם זאת, חלבונים עם משקולות מולקולרי דומה משותפת נודדים, מה יכול לעכב זיהוי חלבונים באמצעות ספקטרומטר מסה. שילוב בסון-דף עם שני שונים denaturing ג'ל אלקטרופורזה צעדים, כלומר טריס-Tricine-אוריאה ומרחביות-דף, מאפשר ההפרדה נוספים של חלבונים על פי hydrophilicity/hydrophobicity שלהם ושל ובכך מגדיל את הרזולוציה ואת ההצלחה שיטות זיהוי חלבונים. זה גם מאפשר הבחנה חלבונים אשר נבדלים רק שינויים posttranslational שלהם. בנוסף, כחול מקורי הצפוני סופג ניתן להחיל כדי לזהות את רכיבי ה-RNA קומפלקסים macromolecular. אנו מראים כי הפרוטוקול שלנו מתאימה לפענח חלבונים ו- RNA מרכיבי מקורית: חלבון ו- ribonucleoprotein (RNP) מתחמי התרחשות בדגימות שיפה. שילוב של כחול מקורי דף עם שני צעדים דף שונה denaturing יכול לעזור כדי להפריד בין סוגים שונים של חלבון גדולה מתחמי ומאפשר גם שיעור זיהוי מוגברת של הרכיבים שלהם באמצעות ספקטרומטר מסה. יתר על כן, הפרוטוקול היא יציבה מספיק כדי לזהות בו זמנית חומצות גרעין שעשויות להיות מאוגדים בתוך מתחמי חלבון יחיד.
Introduction
התעלות הבינעירוניים של שיפה הם חיוניים עבור ההקצאה של חומרים מזינים אורגניים צמחים גבוהים יותר, אבל הם גם מעורבים בוויסות תהליכים שונים רבים חשוב צמיחה, פיתוח, ההגנה הפתוגן של ההסתגלות כדי לוואי תנאים סביבתיים. חוץ effectors קטן כמו יונים, phytohormones או מטבוליטים עצמם, מקרומולקולות כמו חלבונים ו RNAs שהתגלו לאחרונה כמו אותות פוטנציאליים.
מחקרים הראו כי שיפה הטעינה של חלבונים הוא גודל התלוי ומבוקר על ידי ממגבלת הגודל של הדרה (SEL) של יחידות נקבובית-plasmodesmal התחברות תאים לוויה (CC), ניפוי אלמנטים (SE) כי הם בדרך כלל בטווח של 10 > 67 kDa1 , 2 , 3. עם זאת, למרות אלה מגבלות גודל חלבונים גדולים יותר של חלבון מתחמי נמצאו בתוך מערכת שיפה מאתגר את הרעיון של אי-הכללה של גודל4, אפילו לא ספציפית אובדן מהחלבונים CC ל SE כבר הציע5 .
Ribonucleoprotein multiprotein, כמו גם גדול מתחמי ממלאים תפקידים מרכזי ביוסינטזה, שמירה על שלמות המבנה של תא6. יש ראיות כי מכלולי חלבון ו- ribonucleoprotein שיפה-mobile קיימים4,7, אך נכון להיום ידוע מעט על תפקידם. ברכיבי מסננת שיפה היו מעורבים: חלבון ו- RNP מתחמי בתחבורה הבינעירונית ו / או8,איתות9. כדי לפענח את הפונקציות של מתחמי translocated, לומד שלהם קומפוזיציה אצל משתנה סביבתי או להדגיש תנאי נדרש. כדי להשיג זאת, מתחמי מקורי צריך להיות מבודד, הרכיבים שלהם יש להפריד עם רזולוציה מספיק.
כדי לבודד מתחמי גבוהה משקל מולקולרי של שיפה, זה הכרחי הראשונה כדי לקבל דוגמאות sap מספקת איכות וכמות. הטכניקה יכולה לשמש עבור הדגימה שיפה תלוי מיני צמחים מעניינים. שלוש שיטות עיקריות להשגת מהצינורות קיים 10: חרקים stylectomy11exudation הקלו EDTA12, ספונטנית exudation13.
שיפה דגימות תודרנית לבנה (ע' לבנה), המפעל הגדולות מודל במעבדות ברחבי העולם, יכולה להיות מושגת רק על ידי הקלו EDTA exudation או כנימות עלה stylectomy14,15. שתי השיטות להוביל מהצינורות מדולל מאוד או כמויות מדגם נמוך מאוד. Exudation EDTA הקלו גם מועדים לזיהום, שאולי לא מייצג את הרכב שיפה אמיתי16. שיפה ספונטנית exudation מוגבל לשתול זנים כמו cucurbits, תורמוס או יוקה, לאן לחתוך חלקי הצמח מוביל פליטה ספונטנית של מהצינורות שניתן בקלות שנאספו13,17,18, 19. לאחרונה הקמנו שמן אונס (כרוב napus) כמערכת מודל מתאים לניתוח שיפה, שכן הוא קרוב משפחה של לבנה א , מספר microliters של מהצינורות ניתן להשיג חתכים קטנים זה הוכח להיות של טוהר גבוהה-4,-8,-20. יתר על כן, רצף הגנום napus דרב יצא בשנת 201421.
חוץ stylectomy כנימות עלה, שיפה כל אוסף השיטות המתוארות כוללים פגיעה של הרקמה באתר של הדגימה שמסביב, ההרכב של מהצינורות עשויים להשתנות בתגובה לפציעה. לכן זה חיוני כדי לבדוק את טיב דגימות שיפה, מבלי להתחשב בשיטה דגימה חלה. ישנן שיטות שונות עבור בקרת איכות של שנאספו מהצינורות, למשל על-ידי קביעת RNase פעילות22,23, RT-PCR עם primers נגד8,Rubisco24, או הניתוח של הסוכר הרכב8.
שיטות שונות כדי לבודד ולהפריד בין מתחמי חלבון יכול להיות מיושם, כולל גודל אי-הכללה של כרומטוגרפיה, ultracentrifugation צפיפות סוכרוז או מדגם הסינון דרך ריריות עם משקל מולקולרי ייחודי החתך offs. עם זאת, גישות אלה אינם מאפשרים ברזולוציה גבוהה. טכניקה שנקראת כחול מקורי (דף בסון-), תואר לראשונה על ידי Schägger et al. 25, עדיפה מבחינת רזולוציה. הוא שימש בהצלחה כדי לקבוע את המשקולות מולקולרית של מתחמי חלבון מקורית גדולה organelles שונים או lysates הסלולר ו26,שלהם יחסית abundances27.
להבהיר עוד יותר את הרכב מורכב של חלבונים מתחמי, זה הכרחי להפריד בין הרכיבים השונים תחת denaturing תנאים, שמוביל פירוק מוחלט של הרכיבים המורכבים. זו יכולה להיות מושגת על ידי מימד השני של 28,מרחביות-דף29 או, כדי להשיג רזולוציה גבוהה יותר, על ידי מימד השני של התמקדות לגירויי כאב (הציבורית) ואחריו third dimension של מרחביות-דף30 וזיהוי עוקבות של החלבונים באמצעות ספקטרומטר מסה.
ב פרוטוקול זה, אנו מתארים את הדגימה של מהצינורות טהור מצמחים napus דרב וניתוח של חלבון מתחמי מדגימות שיפה כזה באמצעות גישה electrophoretic 3D של שילוב בסון-דף עם טריס-Tricine-שתנן-עמוד ועמוד מרחביות. החלבון מופרדים רכיבים מורכבים לאחר מכן מזוהות באמצעות ספקטרומטר מסה. בנוסף, אנחנו מציגים כחול מקורי הצפוני סופג כשיטה המאפשר הזיהוי של RNAs קומפלקסים גדולים RNP4, הרחבת הישימות של הגישה.
Protocol
1. דגימה וצמחים הכנת מהצינורות של napus נולד ב- 4,8,20
- לשימוש מהצינורות דגימה, להבינם 8 בת napus דרב צמחים הפריחה הראשונית רק את הצג כדי למנוע אבקה מציג.
- השתמש מחט תת-עורית (Ø מ מ 0.8) punctate התפרחת שאלה מספר פעמים. חזור על מספר גבעולים תפרחת אחרים ועל צמחים אחרים כדי להשיג מספיק מהצינורות (איור 2 א).
הערה: עבור ניתוח מורכב, מומלץ להתחיל עם פחות 600 µL של מהצינורות. 4-5 צמחים תניב בין 200 ל 700 µL של מהצינורות. - . תנגב את הטיפה הראשונה מן האתרים פצוע עם נייר סינון טיפות אלה בעיקר מכילים חומר מזוהם מאוד מן הפצועים הרקמה שמסביב, צריך להיות מושלך.
- לאסוף את הטיפות הבאות על ידי pipetting ולאחסן את תפליט שנאספו בשפופרת תגובה צוננת מראש mL 1.5 חרוט ב-20 ° C באמצעות מערכת קירור שהנהר.
- המשך איסוף עד אין צורה ירידה נוספת היא הנצפה, אך לא יותר מ- 1 h. הליך זה יכול לחזור אחרי יומיים ללא אובדן משמעותי של מהצינורות שנאספו.
הערה: מהצינורות שנאספו יכול להשתמש בו מיד או המאוחסנים ב- 80 ° C לצורך ניתוח עתידי. לאחסון-80 ° C, הלם-להקפיא הצינור התגובה בחנקן נוזלי. - לרכז את הדגימה שיפה כ 1/6th של אמצעי האחסון הראשונית באמצעות רכזים צנטריפוגלי עם משקל מולקולרי חתך (MWCO) של 10,000 Daltons (Da). Centrifuge המדגם מרוכזת בשעה 4 ° C ו- g x 20,000 לפחות 15 דקות להסיר חלקיקי אבק.
הערה: ריכוז sap שיפה לא להוביל לאובדן משמעותי של חלבונים. - לניתוח מורכב עוקבות, להמשיך עם שלב 3.1.
2. שיפה sap טוהר שליטה באמצעות רוורס טרנסקריפטאז PCR (RT-PCR) 4,8,20
- לבודד RNA הכולל מ מהצינורות באמצעות שיטת החילוץ RNA סטנדרטי עבור חומר נוזלי (למשל TRIzol או פנול-כלורופורם החילוץ ואחריו אלכוהול איזופרופיל משקעים פאזה מימית, אתנול שטיפה צעדים על פי הפרוטוקול של היצרן).
התראה: פנול-כלורופורם הוא רעיל. לעבוד תחת ברדס עם ציוד למיגון אישי המתאים. ניתן לאחסן את הרנ א שחולצו אתנול ב-80 מעלות צלזיוס עד שישה חודשים. - להסיר זיהום של ה-DNA על ידי עיכול עם DNase אני (u 1/µg) למשך 45 דקות ב 37 מעלות צלזיוס, בטל את האנזים על-ידי הוספת EDTA ריכוז הסופי של 5 מ מ, דגירה המדגם ב 75 מעלות צלזיוס למשך 10 דקות.
- כדי לקבל את ה-RNA טהור, לטהר ולרכז את הדגימה מאת צעד טיהור נוסף (למשל באמצעות ערכות ניקוי RNA, לפי הוראות היצרן).
- ביצוע של רוורס טרנסקריפטאז PCR (RT-PCR) של סינתזה של cDNA עם ערכת סינתזה cDNA באמצעות 150 ng של RNA טהור כפי שתואר על ידי היצרן של פרוטוקול.
הערה: cDNA שניתן לאחסן ב-20 ° C עד שימוש נוסף. - להשתמש µL 5 של cDNA כתבנית עבור ריאקציה PCR רגיל כפי שצוין על-ידי היצרן, להגביר את התמלילים תא ספציפי ולבדוק על-ידי agarose בג'ל. לאשר את הטוהר של דגימות שיפה באמצעות למשל תחל יחידת משנה קטנים rubisco, thioredoxin h של החלבון מעיל אבקה (איור 1b, טבלה 1).
3. כחול מקורי דף 4,25,26,31
- להשתמש או ג'לים מעבר צבע מקורי יציקת עצמית כמפורט במקומות אחרים27 או מסחרי Bis-טריס צבע ג'לים.
- עומס µg 20-30 של המדגם ופרוטאין מרוכז לכל טוב על גבי הג'ל לפחות triplicates.
- להפעיל את הג'ל 4 ° C ו 150 V באמצעות מאגר קטודית כחול כהה B ומאגר אנודת (טבלה 2) עד המדגם 1/3rd של הג'ל (ca. 20-30 דקות, איור 3a).
הערה: עבור סופג בצפון, נתיב יחיד ג'ל מספיקה, בעוד לניתוח של חלבון הרכב על-ידי דף תלת-ממד וספקטרומטר מסה שמומלץ לשלב אותה להקה של עד עשרה מסלולים ג'ל להתרכז שופע פחות חלבונים. - להשהות ההפעלה, מאגר קטודית כחול כהה exchange B עם קטודה כחול בהיר מאגר B/10 (טבלה 2) ולהמשיך לרוץ. לסיים את הג'ל כאשר החזית הכחולה יתחיל elute החוצה הג'ל (ca. 120-180 דקות, איור 3a).
הערה: הג'ל מקורי כחול המוגמר ניתן לאחסן ב 4 מעלות צלזיוס למשך לפחות שבוע. אחסון ממושך יכול להוביל לפזר להקות, יש להימנע. מאגר כחול כהה B הניתנים לשימוש חוזר.
4. אופציונלי: זיהוי של RNA באמצעות כחול מקורי הצפוני סופג 4
- לגזור רצועות נפרדות או להשתמש את ליין ג'ל כל הג'ל מקורי כחול, להעביר אותם לתוך קרום ניילון על ידי חצי יבש סופג-3.5 mA/cm2 עבור 60 דקות ולסמן את הגבול העליון והתחתון ג'ל עם עיפרון על הקרום (איור 4a).
- לאחר סופג, לשטוף את הקרום במים שטופלו DEPC ויבש בין שני ניירות סינון.
- לבצע UV-crosslinking של קרום blotted עם µJ/cm 120,0002 (85 ש' אם שימוש Crosslinker את הטבלה שלחומרים).
- מראש hybridize הקרום עם 6 מ של מאגר הכלאה (מסחרי או מתוצרת עצמית) עבור 60 דקות ב 68 מעלות צלזיוס בתנור הכלאה (איור 4a).
- להוסיף 1 אוטם שריר נוספים של הכלאה מאגר המכיל 4 µL של הגששים 3'-biotinylated (100 ננומטר).
- דגירה הקרום עם החללית בן לילה, תוך כדי קירור התנור מ 68 ° C ל- 37 מעלות צלזיוס.
- לשטוף את הקרום עם מאגר המכיל 2 מרחביות x SSC ו- 0.1%, עבור 5 דקות בטמפרטורת החדר, כדי להסיר את הגששים מאוגדים unspecifically.
התראה: מרחביות יכול לגרום גירויים. ללבוש כפפות, חלוק המעבדה בעת עבודה עם מרחביות מרחביות המכיל פתרונות. - מבצע זיהוי הגששים 3'-biotinylated קרום למשל עם Streptavidin-HRP-המספר המשלים, הלומינול כמו מצע peroxidase (HRP) חזרת, וכתוצאה מכך לתגובה chemiluminescent רגיש (איור 4a).
5. שני ממד: טריס-Tricine-אוריאה דף 4,28
- בלו להקות יחיד של הג'ל מקורי כחול. לשלב להקות מדגימות להפעיל מסלולים מקבילים להשגת ריכוז נוסף של חלבונים מורכבים (איור 5).
הערה: להקות נכרת יכול להיות מאוחסן התגובה יחיד צינורות עד שימוש נוסף ב 4 º C. - לשפוך ג'ל טריס-Tricine-אוריאה ב- 12% (עובי של 1 מ מ, 6.8 ס"מ 8.6 ס"מ (רוחב x אורך)). להתכונן 10 מ ל ג'ל פתרון A הג'ל הפרדת (טבלה 2), לשפוך בין שתי צלחות זכוכית כיסוי עם אלכוהול איזופרופיל. להסיר את אלכוהול איזופרופיל בסיום הפילמור ולהעביר 4 מ ל ג'ל פתרון B (טבלה 2) עבור הערימה בג'ל ג'ל ועל הוספה ש-10 לסרק היטב.
התראה: אקרילאמיד Unpolymerized יכול להיות העצבים, TEMED הוא מזיק אם נשאף. תמיד ללבוש ציוד למיגון אישי ועבודה תחת מכסה המנוע. - העברת הלהקות ג'ל נכרת לתוך צינור התגובה 1.5 mL ולהוסיף 1 מ"ל של 2 x מרחביות למאגר מדגם equilibration של החלקים ג'ל (איור 5, בטבלה 2).
- דגירה בדגימות 10 דקות בטמפרטורת החדר, לפני רותחים בתוך גוש חימום (95 ° C) או במיקרוגל, דגירה בדגימות שוב בטמפרטורת החדר במשך 15 דקות נוספות.
- מחסנית כמה חתיכות ג'ל equilibrated המייצג אותו מורכבים לכיס ג'ל בודד אחד.
- לבצע את אלקטרופורזה באמצעות אנודת קטודית הפעלת מאגרי ב-150 V 45 עד 60 דקות, לסלק את ליין ג'ל שלם.
- דגירה השביל לחתוך כעשרים דקות במאגר חומצי (100 מ מ טריס, חומצה אצטית 100 מ מ), equilibrate ב 125 מ"מ טריס-HCl, pH 6.8 עוד כעשרים דקות (איור 5).
6. הממד השלישי: 4,מרחביות-דף32
- יוצקים על מרחביות 15% הפרדת ג'ל על פי Laemmli32 (עובי: 1.5 מ מ, 6.8 ס"מ 8.6 ס"מ (רוחב x אורך)) (טבלה 2) ומוסיפים שכבה דקה של a 4% לערום ג'ל לעיל.
התראה: מרחביות, אקרילאמיד ו- TEMED הם רעילים ואינם מזיקים. לעבוד תחת ברדס וללבוש ציוד למיגון אישי. - להעביר את ליין ג'ל equilibrated על גבי הג'ל מרחביות ולכסות את הג'ל עם 0.5% (w/w) agarose ב 1 x מרחביות הפעלת מאגר בתוספת עקבות של bromophenol כחול (איור 5).
- מרתיחים זמנים תוססים הפעלת מאגר עם agarose במיקרוגל מוקדמת על הג'ל.
- להפעלת סימן הפרוטאין. כדי להעריך את המשקולות מולקולרית של רכיבי יחיד, הכנס את פיסת נייר סינון בקצה אחד של הג'ל עד agarose פני השטח למוצק או להשתמש מסרק מיוחד משמש בדרך כלל עבור IPG ג'לים.
- להפעיל את הג'ל ב-150 V עבור 60 דקות וכתם הג'ל עם colloidal Coomassie, הכתם כסף או כל אחד אחר מכתים שיטה מתאימה לניתוח spectrometric המוני הבאים.
- לנתח את הנקודות חלבון גלוי שימוש בגישות spectrometric המוני כמו לייזר בסיוע מטריקס desorption/יינון זמן-של-טיסה (MALDI-TOF) או LC-MS/MS ספקטרומטר מסה.
הערה: מומלץ להשתמש את Coomassie colloidal מכתים כמו כבר מתואר33... בידיים שלנו, שופע אפילו פחות חלבונים יכולים להיות מספיק צבעונית ומאפשר ניתוח המוני spectrometric עם איכות נתונים סבירים.
תוצאות
כאן אנו מציגים פרוטוקול המאפשר הניתוח של חלבון: חלבון כמו גם חלבון: RNA מתחמי שיפה דגימות כרוב napus. זרימת העבודה מודגם באיור1. אחד היתרונות העיקריים של napus נולד ב- על אורגניזמים אחרים מודל היא האפשרות של שיפה קל יחסית אוסף דגימה מן דקירות קטנות בגזע תפרחת. זה מאפשר להשיג דגימות שיפה הטהור בכמויות גדולות וזהובה. כאשר הדגימה שיפה, זה תמיד רצוי לבדוק עבור מציג, לדוגמה על-ידי ה-RT-PCR8. תוצאה נציג המתקבל מדגם שיפה טהור מתוארת באיור2. דגימות שיפה שזוהמו שאינו צריך להראות להקה לעין עבור thioredoxin h, ואילו אין אות rubisco, החלבון מעיל אבקה אמור להופיע. יחידת משנה קטנה rubisco יכול לשמש פקד דגימות עלים, גבעולים תפרחת או אבקה. Thioredoxin h צריך להיות לזיהוי כל הדגימות, מאז mRNA שלו נמצאה על שיפה ממינים שונים, בעוד בתמליל חלבון מעיל אבקה רק צריך להיות גלוי בדגימות וניצן. מציג יכולות להתרחש בעת שיפה הדגימה מבוצעת באופן מלא צמחים בעלי פרחים (חלבון מעיל אבקה) או כאשר טיפות הראשון של שיפה הדגימה דקירות לא יימחקו כראוי (rubisco).
לפני בסון-דף זה חובה לרכז את מהצינורות. שימוש µg 20-30 של חלבון לכל. ובכן, לפחות ארבעה חלבונים גדולים מורכבים להקות לנראה אחרי בסון-דף napus דרב מהצינורות, נמוך מדי או ריכוז גבוה מדי אינם מאפשרים הפרדה ברורה של מתחמי (איור 3). מומלץ כדי לטעון מספר להקות ג'ל המייצג אותו מורכבים לכיס בודד אחד של הג'ל שנייה-מימד נוסף בריכוז החלבונים ממתחם כל יחיד עבור עיבוד במורד הזרם וזיהוי המוני spectrometric הבאים.
כדי לזהות רכיבים בודדים של מתחמי macromolecular שיפה, אנו בשילוב בסון-העמוד הראשוני המימד השני טריס-Tricine-אוריאה, שליש ממד מרחביות-דף כדי להשיג הפרדה של חלבונים יחיד. . הנה, פרידה עם רזולוציה גבוהה יכול להיות שנצפו עקב ההתנהגויות ההעברה חלבונים שונים של אוריאה ו מרחביות-דף ג'לים. בדרך כלל, חלבונים השייכים קומפלקס יחיד יהיה גלוי כמו קו אלכסוני לרוחב הג'ל. חלבונים מעל קו זה יש של hydrophobicity מוגברת, ואילו חלבונים מתחת לקו מייצגים אלה הידרופילית עוד28 (איור 5, איור 6).
עבור אפיון מתחמי RNP, השתמשנו חלק ג'ל בסון-דף לבצע סופג הצפוני בסון. לאחר סופג של נתיב שלם על גבי הממברנה ניילון עם crosslinking על ידי קרינת UV, הרנ א יכול להיות visualized באמצעות RNA ספציפיים הגששים כמופיע באיור4. הנה היא מופיעה tRNA ספציפי זה, רק נוכח מתחם מסוים אחד. מרכיבי מתחם זה מחייב סינתזת חלבון יכול בהמשך ייחקרו באמצעות גישה ג'ל 3D שתוארו לעיל. ניתוחים spectrometric המוני הראו כי מתחם זה מכיל בעיקר tRNA-ligases מה מאשרת את פעילות איגוד tRNA שנמצאו על ידי סופג הצפוני בסון.
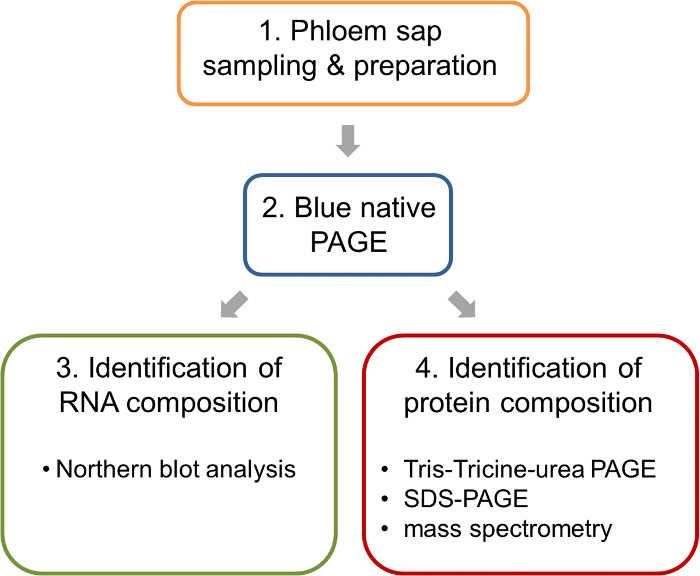
איור 1: עובד זרימה הניתוח קומפלקסי ribonucleoprotein של מהצינורות של שמן אונס. לאחר דגימה, הכנת דוגמאות שיפה, בסון-דף מתבצע כדי להפריד בין מתחמי מקורית. ג'לים בסון-דף כזה מאפשר ניתוח מקביל של חומצות גרעין על ידי סופג הצפוני בסון וזיהוי מרכיבי החלבון מתחמי באמצעות ספקטרומטר מסה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: דגימה וטוהר השליטה מהצינורות של napus ב. לאחר ניקב את הגבעול תפרחת של 8-10 שבוע שמן צמחים אונס עם מחט תת-עורית סטרילי, תפליט עם פיפטה ונשתמש הועבר של התגובה כקרח צינור (א) כדי לאשר את הטוהר של הדגימות שיפה ש-RT-PCR מבוצע, מגביר את ההעתקים של thioredoxin h, יחידת משנה קטנים rubisco וחלבון המעיל אבקה דגימות רקמות ספציפיות (b) RT-PCR בלי רוורס טרנסקריפטאז בוצעה כפקד (-). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
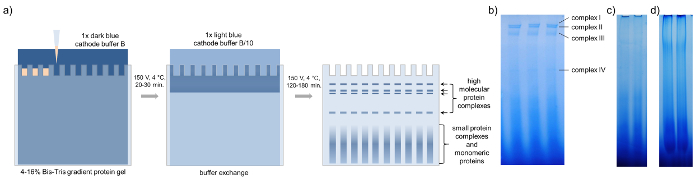
איור 3: בסון-דף. ייצוג סכמטי של דף מקורי כחול עם שיפה מרוכז דוגמיות של napus ב. (א) לאחר טעינת הג'ל חלבון מעבר צבע עם 15-20 µL של מהצינורות מרוכז, בסון-דף מתבצע באמצעות מאגר קטודית כחול כהה 1 x B ב-150 V למשך 20-30 דקות בחדר קר. לאחר מכן למאגר חילופי נגד x 1 קטודית כחול בהיר מאגר B/10, הדף הוא סיים ב-150 V 120-180 דקות עד כחול כהה פועל קבלה יאזל הג'ל. ג'לים בסון-דף הצג ארבע להקות שונות המייצגות ארבעה מתחמי גבוהה משקל מולקולרי שונה. (ב) טעינה מעט מדי (c) או יותר מדי חלבונים שיפה (ד) מפחית את הנראות של מתחמי בודדים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: בסון סופג הצפוני. ייצוג סכמטי בסון הצפוני סופג בשיטה. (א) מסלול של בסון-הדף מועבר על גבי קרום ניילון על ידי חצי יבש סופג. לאחר UV-crosslinking הכלאה קדם, הקרום מודגרת עם RNA ספציפיים רגשים (כאן מתיונין tRNA-ספציפי העצמית), אשר biotinylated בקצה 3'-בתנור הכלאה בין לילה. הגששים חינם יוסרו על ידי שטיפת מדרגות, זיהוי RNA מתבצעת על-ידי המספר המשלים streptavidin-HRP הלומינול. באמצעות גישה זו, הבחנו כי מורכבות הרביעי מתוך בסון-הדף מכיל מתיונין tRNA. (b ג'ל Coomassie צבעונית), את האבן החשופה tRNA דומים שני מסלולים שונים ג'ל לפעול במקביל כדי למנוע הגירה הבדלים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
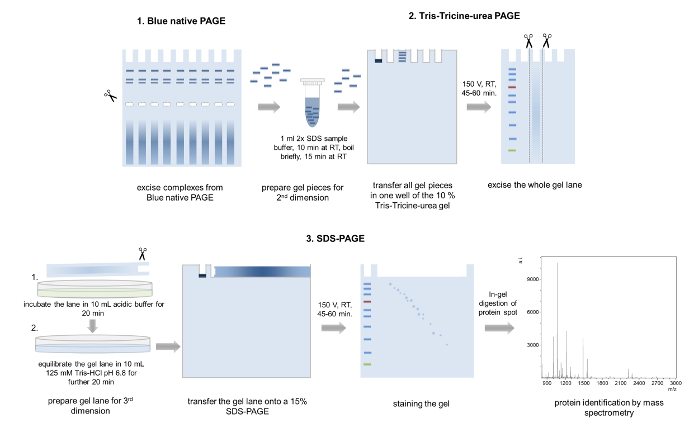
איור 5: 3D-דף. ייצוג סכמטי של הגישה 3D-דף. מספר להקות מ באותו המתחם טוחנות של ג'ל בסון-דף, מודגרות בטעינת מאגר, הועבר לתוך באר אחת של הממד השני טריס-Tricine-שתנן-דף. לאחר אלקטרופורזה, ג'ל כל הנתיבים לגזור, במאגר חומצה חומצי, equilibrated, שטופים להציב על גבי ג'ל מרחביות-דף 15%. הממד השלישי דף, החלבונים מופרדים האורחים Coomassie צבעונית וניתח באמצעות ספקטרומטר מסה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
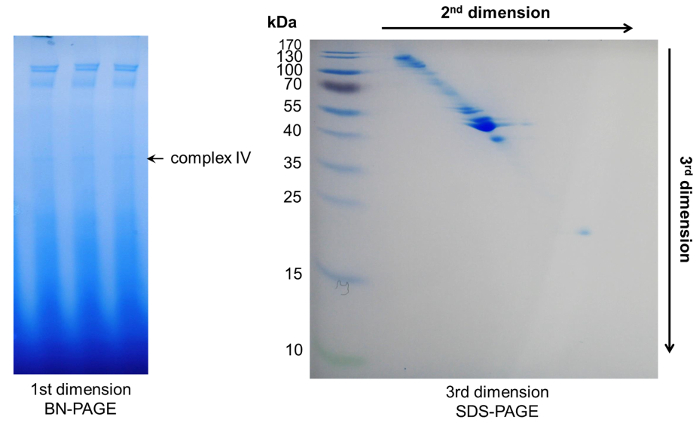
איור 6: נציג תוצאות לאחר 3D-דף. בתוך המימד הראשון בסון-דף מספר מתחמי הופיע. מרכיבי חלבון שלהם יכול להיות מופרדים עוד יותר על ידי שני עמודים עוקבים denaturing, וכתוצאה מכך דפוס ספוט אלכסוני. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| בדיקה | רצף |
| Thioredoxin h |
קדימה: CTCAAGGCAGCCAAAGAATC הפוך: ATGGCCTGAACATCGAACTC |
| רשת קטנה Rubisco |
קדימה: TTCACCGGCTTGAAGTCATC הפוך: CCGGGTACTCCTTCTTGCAT |
| חלבון מעיל אבקה BRU77666 |
קדימה: TCAGAACTGGAGCTTCAACG הפוך: TTCCTTAATGGCCTCAGTGG |
טבלה 1: תחל המשמש לבקרת טוהר מדגם שיפה. כדי לאשר שיפה מדגם טוהר תחל ספציפיות עבור רשת קטנה rubisco thioredoxin h, אבקה המעיל חלבון יכול לשמש cDNA הגברה.
| מאגרי ופתרונות | תוכן | תגובה | |
| מאגר קטודית כחול כהה B | 15 מ מ Bis-טריס pH 7.0 50 מ מ Tricine 0.02% (w/v) G250 Coomassie כחול | מתכון מקורי Fiala et al. 17 צריך להיות מותאם pH 7.0 מאגר שניתן להכינו מניה 10 x | |
| מאגר קטודית כחול בהיר B/10 | 15 מ מ Bis-טריס pH 7.0 50 מ מ Tricine 0.002% (w/v) G250 Coomassie כחול | מאגר ניתן להכין על ידי דילול קטודית מאגר B עם קטודה מאגר ללא Coomassie | |
| אנודת מאגר |
50 מ מ Bis-טריס pH 7.0 | ניתן להכין מאגר כמו 10 x פתרון מניות | |
| 2 x מרחביות דוגמת המאגר |
125 מ מ טריס-HCl pH 6.8 4% מרחביות 20% גליצרול 0.2 DTT מ' 0.02% (w/v) bromophenol כחול | ||
| העברת מאגר 1 x TBE מאגר |
89 מ מ טריס pH 7.6 חומצה בורית 89 מ מ 2 מ מ EDTA | מאגר TBE יכול להיות עשוי ומאוחסנים מניות של 5 x או 10 x. חשוב להשתמש ללא RNase יונים למים. | |
| 2 x מאגר האס |
300 מ"מ NaCl 30 מ מ נה3ציטראט pH 7.0 | ||
| 3 x מאגר ג'ל |
טריס 3 מ' HCl 1 מ' 0.3% מרחביות pH 8.45 | מתכון מקורי Schägger 19 | |
| טריס-Tricine ג'ל פתרון A |
עבור 10 מ: 30% אקרילאמיד-bisacrylamide (29:1) 3.34 mL אוריאה 6 מ' 3 x ג'ל מאגר 3.34 mL גליצרול 70% מ ל 1.4 ddH2O להוסיף 10 מ 10% APS 40 ΜL ΜL TEMED 4 | משקל 6 מ' אוריאה ולהוסיף 3 x מאגר ג'ל, פתרון אקרילאמיד-bisacrylamide 70% gycerol. מחממים עד 60 ° צלזיוס באמבט מים כדי solubilize של האוריאה. להוסיף 10 מ ל, 10% ddH2O APS, ולבסוף TEMED עבור הפילמור. | |
| טריס-Tricine ג'ל פתרון B |
עבור 6 מ: 30% אקרילאמיד-bisacrylamide (29:1) 0.8 מ ל אוריאה 6 מ' 3 x ג'ל מאגר 1.5 mL להוסיף ddH2O 6 מ 10% APS 45 ΜL TEMED 4.5 ΜL | משקל 6 מ' אוריאה ולהוסיף 3 x מאגר ג'ל פתרון אקרילאמיד-bisacrylamide. מחממים עד 60 ° צלזיוס באמבט מים כדי solubilize של האוריאה. להוסיף 10 מ ל, 10% ddH2O APS, ולבסוף TEMED עבור הפילמור. | |
| 1 x טריס-Tricine פועל מאגר (אנודת) |
100 מ מ טריס 22.5 מ מ HCl pH 8.9 | מתכון מקורי Schägger 19 | |
| 1 x טריס-Tricine פועל מאגר (קטודה) |
100 מ מ טריס 100 מ מ Tricine 1% מרחביות pH 8.25 | מתכון מקורי Schägger 19 | |
| מאגר חומצי |
100 מ מ טריס 100 מ מ חומצה אצטית | ||
| 4% ג'ל הערימה למען חברה דמוקרטית |
עבור 2 מ: ddH2O 1.4 mL 30% אקרילאמיד-bisacrylamide (37.5:1) 0.33 mL 1 מ"ל pH 6.8 0.25 M טריס 10% מרחביות 20 ΜL 10% APS 20 ΜL ΜL TEMED 2 | ||
| 15% מרחביות מפריד ג'ל |
עבור 10 מ: ddH2O 2.3 mL 30% אקרילאמיד-bisacrylamide (37.5:1) מ ל מ 1 ל pH 8.8 2.5 טריס.5 M ΜL מרחביות 100 10% ΜL APS 100 10% ΜL TEMED 4 | ||
| 1 x מאגר פועל למען חברה דמוקרטית |
25 מ מ טריס גליצין 192 מ מ 0.1% מרחביות | ||
| Coomassie מכתים פתרון |
5% (w/v) אלומיניום סולפט-(14-18)-הידרייט... 10% (v/v) אתנול (96%) 2% (v/v) חומצה זרחתית (85%) 0.02% (w/v) G-250 Coomassie כחול מבריק | ||
| מאגר הכלאה העדינה ULTRAhyb | Ambion, חיים טכנולוגיות | ||
בטבלה 2: פתרונות, מאגר מתכונים. רשימה של כל מאגרי ופתרונות הדרושים לניתוח 3D-דף.
| . לא במקום. | MW תשיג [kDa] | זיהוי | אורגניזם | ההצטרפות לא. | MW [kDa] | הקמע את הציון | |
| CIV_1 | 130 | מחלה בשם ההתנגדות חלבון At4g19050 | נולד ב- napus | CDX78917 | 131.1 | 110 | |
| CIV_2 | 130 | מחלה בשם ההתנגדות חלבון At4g19050 | נולד ב- napus | CDX78917 | 131.1 | 89 | |
| CIV_3 | 100 | חום לחשמל kDa 70 חלבון כמו 14 | נולד ב- napus | XP_013748865 | 89.9 | 113 | |
| CIV_4 | 90 | התארכות האיקריוטים פקטור 2 חלוקת התא לשלוט חלבון homolog 48 א' | נולד ב- napus נולד ב- napus | CDX90241 CDY41316.1 | 89.5 89.5 | 111 197 | |
| CIV_5 | 85 | חום הלם חלבון 90 2-כמו | ראפא דרב | XP_009132342 | 79.8 | 172 | |
| CIV_6 | 80 | טראונין - tRNA ליגאז גליצין - tRNA ליגאז | נולד ב- הבר נולד ב- napus | XP_013599115 CDY43195 | 81.5 80.8 | 110 88 | |
| CIV_7 | 70 | חום הלם חלבון 70 kDa ליזין - tRNA ליגאז דמוי | נולד ב- הבר נולד ב- napus | XP_013685267 XP_013747530 | 67.8 69.9 | 230 150 | |
| CIV_8 | 65 | Myrosinase אספרטט - tRNA ליגאז 2 אספרגין - tRNA ליגאז 1 | נולד ב- napus נולד ב- napus נולד ב- napus | ABQ42337 XP_013670803 XP_013729126 | 60.6 61.6 63.5 | 183 141 153 | |
| CIV_9 | 60 | Myrosinase | נולד ב- napus | ABQ42337 | 60.6 | 164 | |
| CIV_10 | 55 | Adenosylhomocysteinase כמו 2 | ראפא דרב | XP_009135865 | 53.1 | 139 | |
| CIV_11 | 55 | התארכות מקדם 1-אלפא 1 דמוי | נולד ב- הבר | XP_013586115 | 51.9 | 161 | |
| CIV_12 | 50 | ציסטין lyase כמו CORI3 | נולד ב- napus | XP_013653143 | 48.1 | 237 | |
| CIV_13 | 44 | ציסטין lyase כמו CORI3 | ראפא דרב | XP_009108611 | 48.3 | 213 | |
| CIV_14 | 38 | אלדולאז | ראפא דרב | XP_009115993 | 38.4 | 226 | |
| CIV_15 | 45 | ציסטין lyase כמו CORI3 | ראפא דרב | XP_009108611 | 48.3 | 219 | |
| CIV_16 | 45 | ציסטין lyase CORI3 | ראפא דרב | CDY69765 | 46.9 | 209 | |
| CIV_17 | 38 | אלדולאז | ראפא דרב | XP_009115993 | 38.4 | 124 | |
| CIV_18 | 18 | Peptidyl-prolyl ציס-טרנס איזומראז דמויי 3 CYP18 | נולד ב- napus | XP_009101932 | 18.3 | 128 | |
| CIV_19 | 45 | ציסטין lyase כמו CORI3 | ראפא דרב | XP_009108611 | 48.3 | 177 | |
טבלה 3: זיהו חלבון רכיבים מורכבים IV. מספר tRNA ligases וחלבונים נוספים נמצאו בתוך המתחם איגוד tRNA משתמש MALDI-TOF המונית, ניתוח spectrometric אחרי 3D-עמוד.
Discussion
שיפה הוא תא של ריבית גבוהה, כיוון שהוא מהווה תוואי תחבורה ראשי עבור photoassimilates, היא חיונית עבור מערכת אזעקה למרחקים ארוכים בין צמחים שונים חלקים9,20,34, 35. בנוסף, מולקולות קטנות מקרומולקולות כמו חלבונים ו RNAs היו מעורבים עם תחזוקה שיפה, איתות4,7,8. הניתוח של הרכב שיפה מוגבלת על ידי נגישות מוגבלת שיפה דגימות של רוב מיני צמחים. הטכניקה stylet חרקים החלים נרחב, אך תובענית השפעול ותוצאות בכמויות קטנות מאוד של שיפה דגימות11. טכניקה קלה אחת המשמש עבור הדגימה שיפה זה הקלו EDTA exudation12. EDTA chelates יונים כלט כמו סידן, וכך מונע סגירה של מסננת צלחות על ידי P-חלבונים ו callose. זה קל לשימוש, אך נוטה זיהום על ידי תאים פגומים, דוגמאות הן מדולל. Depleting יונים כלט מאת EDTA יכול גם להוביל התמוטטות של מתחמי הקיים. עם זאת, הוא מאפשר דגימה מתוך מגוון רחב של מינים, כולל צמח מודל לבנה א15. Exudation ספונטנית של מהצינורות מתרחשת רק במספר קטן של מיני צמחים. זה שיטה פולשני הכרוך נזק משמעותי של רקמות הצמח10. לאחרונה הקמנו napus דרב כמין מודל לימוד בתחבורה הבינעירונית4,8,20. כאן, מהצינורות ניתן לטעום מן חתכים קטנים, אשר מפחית ופצעו אפקטים של מקורות זיהום.
באמצעות טכניקות דגימה שונים, פרוטאום שיפה דוגמאות של מינים שונים של נחקר, בשנים האחרונות7,8,17,36,37, 38,39. ללימודים אלה פרוטאום ', היו חלבונים חילוץ, זירז תחת denaturing תנאים, ולכן אינם מאפשרים מסקנות לגבי חלבון: חלבון וחלבון: חומצות גרעין אינטראקציות להציג בתנאים מקורית. Co-immunoprecipitation (CoIP), שכבת-על מבחני המצוין ribonucleoprotein הגדולות מורכבות אולי קיימים מהצינורות של דלעת40, אך לא הוכח כי כל מכלולי macromolecular להתקיים בתנאים מקורי בתוך מערכת שיפה.
דף מקורי כחול, שהוצגו על ידי. Schägger et al. 26, בשילוב עם ג'ל ברזולוציה גבוהה עוקבות אלקטרופורזה צעדים מאפשרות ההפרדה של רכיבים בודדים של מתחמי חלבון גדולה. באמצעות 3D-דף ניתוחים של יליד napus דרב שיפה תפליט, אנו יכול לאחרונה להדגים כי מספר גבוה משקל מולקולרי: חלבון, מתחמי RNP קיים בדגימות שיפה, פעיל enzymatically4. שיטות אלטרנטיביות כדי לבודד חלבון מתחמי, כמו גם RNPs כמו גודל אי-הכללה של כרומטוגרפיה שאולי קיימים, אבל נכשל מבחינת רזולוציה בהשוואה בסון-דף. יתר על כן, איכות סבירה של הפרדה מורכבים, גודל אי-הכללה של עמודות מטריצות חייב להיות מותאם על פי העובי מולקולרית בסך הכל מורכבת נחקר. ניתוח מתחמי גודל שונים ולכן ידרוש סוגים שונים של עמודות אשר הוא עולה אינטנסיבית, אינו מאפשר ככוח התמקדות גבוהה כדף בסון.
שלבים קריטיים כדי לנתח מתחמי מ napus דרב כוללים את הסכום הכולל של מהצינורות משמש החל חומר. µL לפחות 600 שיפה מדגם הכרחי, ניתן להשיג 5 מפעלים להבינם. 3D-דף ו בסון סופג בצפון זה הכרחי להפעיל את הג'ל בסון הראשונית עם כמות מספקת של שיפה דגימות. כדי להשיג זאת, שיפה דגימות מרוכזים עד ניתן לטעון לתוך כל 20-30 µg של חלבון לפחות היטב triplicates של המדגם אותו מופעלים במקביל. ריכוז נמוך מדי או גבוה מדי להפחית את הגילוי של מכלולים (איור 3). דוגמאות שיפה צריך להיות שנאספו לתוך צינורות התגובה על קרח ויש לאחסנו קפוא לשימוש במועד מאוחר יותר למנוע השפלה חלבון והמסירה. מעכבי פרוטאז נמצאו proteomes שיפה כל מנותח, אך גם פרוטאוזום פעיל מלא שתואר בעלון שיפה napus נולד ב-4. יתר על כן, נפח והרכב של דגימות שיפה תלויות זמן-נקודת הדגימה של תנאים סביבתיים10. לכן חייבים להקפיד לאסוף בו זמנית של היום בתנאים דומים. מתח טיפולים (למשל הבצורת) יכולים להפחית את כמות שיפה הניתנים לאיסוף. כדי לזהות חלבונים יחיד באמצעות ספקטרומטר מסה, זה חובה להגביל מציג קרטין אפשרי על ידי בכפפות כל הזמן. קרטין מוביל לאותות נוספים במהלך ניתוח המוני spec, הסלים זיהוי חלבונים. הפעלת בסון-הדף במתח גבוה או בטמפרטורת החדר יכול להוביל חימום של הג'ל עשוי לגרום פירוק של מתחמי שביר.
פרוטוקול המובאת כאן מתאימה לניתוח של קומפלקסים: חלבון. אנו גם מראים כי זה יכול לשמש כדי לזהות RNAs מסוים הכלול את מתחמי במקביל. כדי להשיג זאת, לאחרונה הצגנו פרוטוקול עבור בסון הצפוני סופג4. RNAs נוטים השפלה מאת RNAse מציג. כדי להגביל את השפלה כזאת שטופלו DEPC, מים אמור לשמש.
המגבלות העיקריות של השיטה הציג כוללים את אומדן משקל מולקולרי של מתחמי חלבון המופרדות על-ידי בסון-דף, מאז העברת התנהגות תלוי בגודל, צורה אפילו שינויים posttranslational של מתחמי31, 41. הערכת גודל של מתחמי RNP זה עוד יותר קשה בגלל ההשפעה של חומצות גרעין על התנהגות ההעברה. זה גם לא ניתן למנוע את מתחמי בגודל זהה שיתוף להעביר בלהקה בודד אחד. זה יכול להוביל חיזוי שגוי של קומפוזיציות מורכבות. ולכן אימות את האינטראקציות נצפתה עם שיטות משלימות, למשל על ידי מבחני תפקודית4, ייתכן שיהיה צורך. גם חלבונים בלבד בחולשה או transiently קשור קומפלקס macromolecular עלול ללכת לאיבוד בתוך שהמאגר בסון. כדי למנוע זאת, דגימות יכול להיות תפור, מה יכול גם לגרום לחפצים או יכול למנוע זיהוי חלבונים, או התנאים מאגר ניתן למטב.
בניגוד קלאסי 2D-דף, השילוב של אוריאה-מרחביות-דף מאפשר ההפרדה על פי hydrophobicity, משקל מולקולרי במקום נקודה איזואלקטרית (pI) ו משקל מולקולרי 28, וכן אינו מגביל את ההפרדה חלבונים של טווח ספציפי pI. חלבונים הדומה קלאסי 2D-דף, מופרדים גלויים נקודות יחיד, אבל על אלכסון קו 4,28 (איור 5, איור 6). יותר חלבונים הידרופובי מופיעים כתמים מעל זה באלכסון, ואילו יותר הידרופילית חלבונים נמצאים מתחת לקו28. הריכוזים לזיהוי בשימוש פרוטוקול זה להפריד חלבונים בין 25 ל-80 kDa. טוב. כדי לאפשר הפרדה של חלבונים קטן או גדול יותר לזיהוי של ריכוז יכולים להיות מגוונים או ג'לים מעבר צבע יכול לשמש בממד השלישי. הרכיבים של מורכבות הרביעי (איור 3) המופרדות באמצעות 3D-דף (איור 6) נחתכו החוצה, טריפסין, מתעכל נותחו על ידי ספקטרומטר מסה. כתוצאה מכך הזיהוי של מספר ligases tRNA. מרכיבי מתחמי אחרים היו שפורסם לאחרונה 4. 3D-עמוד שלנו זמין ההפרדה של ligases שונים, כלומר אספרטט, אספרגין, תראונין, ליזין, גליצין ligases, עם משקולות מולקולרי דומה (טבלה 3). באמצעות בדיקה tRNA ספציפי מתיונין, אנחנו הצליחו לזהות tRNA שעשויות להיות מאוגדים בתוך מתחם הרביעי, אבל אם tRNA באורך מלא או שברי tRNA במתחם לא שיפלו עם הגששים בשימוש. כדי לבדוק אם חומצות גרעין ממש בתוך המתחם וקשורות לא שותפה נודדים, פרוטאז מתעכל מהצינורות דגימות עשוי לשמש בפקדי העברה מתאים.
זה כבר העריכו קודם לכן כי תרגום החלבון יכול להתרחש בתוך צינורות מסננת שיפה, מאז כמעט רוב מרכיבי ריבוזום כולו, כמו גם גורמים התארכות נמצאו שיפה דגימות4,7. שלנו ממצא של tRNA, tRNA ligases נראה כדי לתמוך את הרעיון הזה. אולם, שברי tRNA בדגימות שיפה מתנת דלעת הוכחו להיות מעכבי חזק של תרגום42 , ריבוזומים פונקציונלי שנראה שהוא נעדר4, רומז כי התרגום לא יכולים להתקיים.
פרוטוקול המובאת כאן יחדיו, מאפשר ההפרדה של: חלבון מקורי, אפילו RNP קומפלקסים של שיפה ודוגמאות הפרדה וזיהוי של רכיבים בודדים שלהם עם רזולוציה גבוהה. היישום של שיטה זו מאפשרת הגילוי של חלבון הרומן ושל RNP מתחמי בדגימות שיפה, ולכן יכול להבהיר את פונקציות חדשות בתא הזה צמח מאוד מיוחדים.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים ג'ניפר דיק, אורסולה Zarzenska על תמיכתם מדעי. עבודה זו מבחינה כלכלית נתמך על ידי הקריירה אינטגרציה מענק (CIG, PCIG14-GA-2013-63 0734) על ידי הנציבות האירופית בתוך תוכנית המסגרת השביעית המענק LFF-GK06 'DELIGRAH' (Landesforschungsförderung המבורג), המענק DFG (DFG KE 856_6-1) מוענק JK.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL reaction tubes | Eppendorf | 30120086 | |
| 10 well comb for SDS PAGE, thickness 1 mm | BioRad | 1653359 | |
| 2-Propanol | AppliChem | 131090 | |
| 30 % Acrylamide-bisacrylamide solution (29:1) solution | BioRad | 1610156 | |
| 30 % Acrylamide-bisacrylamide solution (37.5:1) solution | BioRad | 1610158 | |
| 96 % Ethanol | Carl Roth | P075 | |
| Acetic acid | Carl Roth | 6755 | |
| Agarose | Lonza | 50004 | |
| Aluminum sulfate-(14-18)-hydrate | AppliChem | 141101 | |
| Ammonium peroxodisulfate (APS) | Carl Roth | 9592.3 | |
| Bis-Tris | AppliChem | A3992 | |
| Boric acid | AppliChem | A2940 | |
| Bromophenol blue | AppliChem | A2331 | |
| Centrifugal concentrators e.g. Vivaspin 500 (Mwco 10 kDa) | Sartorius | VS0102 | |
| Chemiluminescent Nucleic Acid Detection Module Kit | Thermo Fisher Scientific | 89880 | |
| Chromatography papers e.g. 3 mm CHR | Whatman | 3030-153 | |
| CoolBox M30 System | Biocision | BCS-133 | |
| Coomassie brilliant Blue G-250 | AppliChem | A3480 | |
| Diethyl pyrocarbonate (DEPC) | AppliChem | A0881 | |
| Dithiothreitol (DTT) | AppliChem | A1101 | |
| DNase I | AppliChem | A3778 | |
| Ethanol abs. | AppliChem | A3693 | |
| Ethylenediaminetetraacetic acid (EDTA) | AppliChem | A1103 | |
| Gel Imaging system e.g. Chemidoc Touch | BioRad | 1708370 | |
| GeneRuler 1kb plus | Thermo Fisher Scientific | SM1331 | |
| Glycerol | AppliChem | 141339 | |
| Glycine | AppliChem | 131340 | |
| Heating block TS1 | Biometra | 846-051-500 | |
| Hybridization oven e.g. GFL Hybridization Incubator 7601 | GFL | 7601 | |
| Hypodermic needle (0.8 mm) | B Braun | 4658309 | |
| IPG gel comb, thickness 1 mm | BioRad | 1653367 | |
| Labeling of RNA e.g.Biotin 3'end DNA Labeling Kit | Thermo Fisher Scientific | 89818 | |
| Native gradient gel e.g. Novex NativePAGE 4–16% Bis-Tris protein gel | Invitrogen | BN1002BOX | |
| Nylon membrane e.g. Hybond-N+ | Amersham Pharmacia | RPN203B | |
| Ortho-phosphoric acid | Carl Roth | 6366.1 | |
| PageRuler prestained protein ladder | Thermo Fisher Scientific | 26616 | |
| Power supply for Gel electrophoresis EPS | Amersham Pharmacia | 18-1130-01 | available from GE Healthcare |
| RNA Cleanup Kit | Qiagen | 74204 | |
| Semi dry blot e.g. Fastblot 43B semi dry Blot | Biometra | 846-015-100 | |
| Sodium chloride (NaCl) | AppliChem | A1149 | |
| Sodium dodecyl sulfate (SDS) | AppliChem | 142363 | |
| Synthesis of cDNA e.g. RevertAid First Strand cDNA Synthesis Kit | Thermo Fisher Scientific | K1621 | |
| Tetramethylethylenediamine (TEMED) | AppliChem | A1148 | |
| Tricine | AppliChem | A3954 | |
| Tris | AppliChem | A1086 | |
| Tri-sodium citrate dihydrate | AppliChem | A3901 | |
| TRIzol Reagent | Thermo Fisher Scientific | 15596026 | |
| ULTRAhyb Ultrasensitive Hybridization Buffer | Thermo Fisher Scientific | AM8670 | |
| Urea | AppliChem | A1360 | |
| UV Crosslinker e.g. Stratalinker 2400 | Agilent | NC0477671 | from Fisher Scientific |
| Vertical electrophoresis apparatus e.g.The XCell SureLock Mini-Cell or Mini-Protean III System | Thermo Fisher Scientific or BioRad | EI0001 or 1658004 | |
| Wipers e.g. KIMWIPES Delicate Task Wipers | Kimberly-Clark | 34120 |
References
- Kempers, R., van Bel, A. J. E. Symplasmic connections between sieve element and companion cell in the stem phloem ofVicia faba L. have a molecular exclusion limit of at least 10 kDa. Planta. 201 (2), 195-201 (1997).
- Stadler, R., et al. Expression of GFP-fusions in Arabidopsis companion cells reveals non-specific protein trafficking into sieve elements and identifies a novel post-phloem domain in roots. Plant J. 41 (2), 319-331 (2005).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11 (3), 309-322 (1999).
- Ostendorp, A., et al. Functional analysis of Brassica napus phloem protein and ribonucleoprotein complexes. New Phytol. 214 (3), 1188-1197 (2017).
- Paultre, D. S. G., Gustin, M. -. P., Molnar, A., Oparka, K. J. Lost in Transit: Long-Distance Trafficking and Phloem Unloading of Protein Signals in Arabidopsis Homografts. Plant Cell. 28 (9), 2016-2025 (2016).
- Sali, A., Glaeser, R., Earnest, T., Baumeister, W. From words to literature in structural proteomics. Nature. 422 (6928), 216-225 (2003).
- Lin, M. -. K., Lee, Y. -. J., Lough, T. J., Phinney, B. S., Lucas, W. J. Analysis of the Pumpkin Phloem Proteome Provides Insights into Angiosperm Sieve Tube Function. Mol. Cell. Proteomics. 8 (2), 343-356 (2008).
- Giavalisco, P., Kapitza, K., Kolasa, A., Buhtz, A., Kehr, J. Towards the proteome of Brassica napus phloem sap. Proteomics. 6 (3), 896-909 (2006).
- Lucas, W. J., Yoo, B. C., Kragler, F. RNA as a long-distance information macromolecule in plants. Nat. Rev. Mol. Cell. Bio. 2 (11), 849-857 (2001).
- Dinant, S., Kehr, J. Sampling and Analysis of Phloem Sap. Plant Mineral Nutrients. 953, 185-194 (2013).
- Kennedy, J. S., Mittler, T. E. A Method of obtaining Phloem Sap via the Mouth-parts of Aphids. Nature. 171 (4351), 528 (1953).
- King, R. W., Zeevaart, J. A. Enhancement of Phloem exudation from cut petioles by chelating agents. Plant Physiol. 53 (1), 96-103 (1974).
- Alosi, M. C., Melroy, D. L., Park, R. B. The regulation of gelation of Phloem exudate from cucurbita fruit by dilution, glutathione, and glutathione reductase. Plant Physiol. 86 (4), 1089-1094 (1988).
- Dinant, S., Bonnemain, J. -. L., Girousse, C., Kehr, J. Phloem sap intricacy and interplay with aphid feeding. Comptes rendus biologies. 333 (6-7), 504-515 (2010).
- Tetyuk, O., Benning, U. F., Hoffmann-Benning, S. Collection and analysis of Arabidopsis phloem exudates using the EDTA-facilitated Method. J Vis Exp. (80), e51111 (2013).
- Kovalskaya, N., Owens, R., Baker, C. J., Deahl, K., Hammond, R. W. Application of a modified EDTA-mediated exudation technique and guttation fluid analysis for Potato spindle tuber viroid RNA detection in tomato plants (Solanum lycopersicum). J. Virol. Methods. 198, 75-81 (2014).
- Rodriguez-Medina, C., Atkins, C. A., Mann, A. J., Jordan, M. E., Smith, P. M. Macromolecular composition of phloem exudate from white lupin (Lupinus albus L). BMC Plant Biol. 11 (1), 36 (2011).
- Taylor, J. S., Thompson, B., Pate, J. S., Atkins, C. A., Pharis, R. P. Cytokinins in the Phloem Sap of White Lupin (Lupinus albus L.). Plant Physiol. 94 (4), 1714-1720 (1990).
- Yoo, B., et al. A Systemic Small RNA Signaling System in Plants. Plant Cell. 16 (8), 1979-2000 (2004).
- Buhtz, A., Springer, F., Chappell, L., Baulcombe, D. C., Kehr, J. Identification and characterization of small RNAs from the phloem of Brassica napus. Plant J. 53 (5), 739-749 (2008).
- Chalhoub, B., et al. Plant genetics. Early allopolyploid evolution in the post-Neolithic Brassica napus oilseed genome. Science. 345 (6199), 950-953 (2014).
- Sasaki, T., Chino, M., Hayashi, H., Fujiwara, T. Detection of several mRNA species in rice phloem sap. Plant Cell Phys. 39 (8), 895-897 (1998).
- Doering-Saad, C., Newbury, H. J., Bale, J. S., Pritchard, J. Use of aphid stylectomy and RT-PCR for the detection of transporter mRNAs in sieve elements. J Exp. Bot. 53 (369), 631-637 (2002).
- Ruiz-Medrano, R., Xoconostle-Cázares, B., Lucas, W. J. Phloem long-distance transport of CmNACP mRNA: implications for supracellular regulation in plants. Dev. 126 (20), 4405-4419 (1999).
- Schägger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Fiala, G. J., Schamel, W. W. A., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. (48), e2164 (2011).
- Rais, I., Karas, M., Schägger, H. Two-dimensional electrophoresis for the isolation of integral membrane proteins and mass spectrometric identification. Proteomics. 4 (9), 2567-2571 (2004).
- Schägger, H. Tricine-SDS-PAGE. Nature protocols. 1 (1), 16-22 (2006).
- Wittig, I., Braun, H. -. P., Schägger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Eubel, H., Braun, H. -. P., Millar, A. H. Blue-native PAGE in plants: a tool in analysis of protein-protein interactions. Plant Methods. 1 (1), 11 (2005).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Turnbull, C. G. N., Lopez-Cobollo, R. M. Heavy traffic in the fast lane: long-distance signalling by macromolecules. New Phytol. 198 (1), 33-51 (2013).
- Hall, S. M., Baker, D. A. The chemical composition of Ricinus phloem exudate. Planta. 106 (2), 131-140 (1972).
- Barnes, A., Bale, J., Constantinidou, C., Ashton, P., Jones, A., Pritchard, J. Determining protein identity from sieve element sap in Ricinus communis L. by quadrupole time of flight (Q-TOF) mass spectrometry. J. Exp. Bot. 55 (402), 1473-1481 (2004).
- Walz, C., Giavalisco, P., Schad, M., Juenger, M., Klose, J., Kehr, J. Proteomics of curcurbit phloem exudate reveals a network of defence proteins. Phytochemistry. 65 (12), 1795-1804 (2004).
- Walz, C., Juenger, M., Schad, M., Kehr, J. Evidence for the presence and activity of a complete antioxidant defence system in mature sieve tubes. Plant J. 31 (2), 189-197 (2002).
- Kehr, J. Phloem sap proteins: their identities and potential roles in the interaction between plants and phloem-feeding insects. J Exp. Bot. 57 (4), 767-774 (2006).
- Ham, B. -. K., Brandom, J. L., Xoconostle-Cázares, B., Ringgold, V., Lough, T. J., Lucas, W. J. A polypyrimidine tract binding protein, pumpkin RBP50, forms the basis of a phloem-mobile ribonucleoprotein complex. Plant Cell. 21 (1), 197-215 (2009).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J. Immunol. Methods. 252 (1-2), 171-174 (2001).
- Zhang, S., Sun, L., Kragler, F. The phloem-delivered RNA pool contains small noncoding RNAs and interferes with translation. Plant Physiol. 150 (1), 378-387 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved