Method Article
Amostragem de seiva de floema de Brassica napus para 3D-PAGE de complexos de proteínas e ribonucleoproteínas
Neste Artigo
Resumo
Aqui nós apresentamos um protocolo para analisar a composição da proteína da proteína: proteína nativa grande e proteína: complexos de ácidos nucleicos de colza (b. napus) exsudato floema usando uma abordagem de eletroforese (página) do gel de polyacrylamide 3D combinando azul nativo (BN) com duas páginas de desnaturação, seguido pela identificação de espectrometria de massa.
Resumo
O floema de plantas superiores de amostragem é muitas vezes trabalhoso e significativamente dependente das espécies vegetais. No entanto, estudos de proteoma sob condições de desnaturação poderiam ser alcançados em diferentes espécies de plantas. Proteína: proteína nativa e proteína: complexos de ácidos nucleicos de amostras de floema ainda mal foram analisados, embora eles podem desempenhar um papel importante na manutenção deste compartimento especializado ou na sinalização de longa distância. Grandes conjuntos moleculares podem ser isolados usando uma eletroforese em gel azul de nativo (BN-PAGE). Seus componentes de proteínas podem ser separadas por um sulfato dodecyl de sódio subsequentes página (SDS-PAGE). No entanto, as proteínas com peso moleculares similares co migram, o que pode dificultar a identificação de proteínas por espectrometria de massa. Combinando a BN-página com dois diferentes desnaturação gel de electroforese passos, ou seja, Tris-Tricine-ureia e SDS-PAGE, permite a separação adicional de proteínas de acordo com sua Hidrofilia/hidrofobicidade e, portanto, aumenta a resolução e o sucesso da identificação de proteínas. Ele ainda permite distinguir as proteínas que só diferem em suas modificações posttranslational. Além disso, a mancha do Norte nativo azul pode ser aplicado para identificar os componentes do RNA em complexos macromoleculares. Nós mostramos que nosso protocolo destina-se a desvendar a proteína e os componentes do RNA de proteína: proteína nativa e complexos ribonucleoprotein (RNP) ocorrem nas amostras de floema. Combinando um azul nativa página com duas diferentes etapas de página desnaturação pode ajudar a separar os diferentes tipos de grandes complexos de proteínas e também permite uma taxa de aumento da identificação de seus componentes por espectrometria de massa. Além disso, o protocolo é robusto o suficiente para detectar simultaneamente potencialmente vinculados ácidos nucleicos dentro de complexos de proteínas simples.
Introdução
Os conduítes de longa distância do floema são essenciais para a atribuição de nutrientes orgânicos em plantas superiores, mas também estão envolvidos na regulação de muitos processos diferentes importantes para o crescimento e desenvolvimento, defesa do patógeno e a adaptação ao adversos condições ambientais. Além de pequenos efetores como íons, fitohormônios ou metabolitos próprios, macromoléculas como proteínas e RNAs surgiram recentemente como potenciais sinais.
Estudos têm mostrado que o carregamento do floema de proteínas é tamanho dependente e controlado pelo limite de exclusão de tamanho (SEL) das unidades do pore-plasmodesmal conectando células companheiro (CC) e peneira elementos (SE) que são tipicamente na faixa de 10 a > 67 kDa1 , 2 , 3. no entanto, apesar destes tamanho limitações maiores proteínas e proteínas complexos foram encontrados dentro do sistema de floema, desafiando a ideia de exclusão de tamanho4, e nem inespecífica perda de proteínas do CC para SE tem sido sugeridas5 .
Complexos Multiproteicos, bem como grandes ribonucleoprotein desempenham um papel crucial na biossíntese e mantendo a integridade estrutural da célula6. Há evidências de que o floema-mobile da proteína-proteína e ribonucleoprotein complexos existem4,7, mas até agora pouco sobre a sua função é conhecido. Em elementos crivados de floema proteína: proteína e RNP complexos têm sido implicados com o transporte de longa distância e / ou sinalização de8,9. Para desvendar as funções dos complexos translocados, estudando sua composição sob diferentes ambiental ou condições de estresse é necessárias. Para conseguir isso, complexos nativos precisam ser isolado e seus componentes têm de ser separados com resolução suficiente.
Para isolar complexos de alto peso molecular do floema, é primeiro necessário para obter amostras de seiva em qualidade e quantidade suficientes. A técnica que pode ser usada para amostragem de floema depende da espécie de planta de interesse. Três métodos principais para obter seiva do floema existem 10: inseto stylectomy11, exsudação de EDTA-facilitou12e exsudação espontânea13.
Amostras de floema de Arabidopsis thaliana (a. thaliana), a planta modelo grande em laboratórios em todo o mundo, só podem ser obtidas por EDTA-facilitado exsudação ou pulgão stylectomy14,15. Ambos os métodos conduzem a seiva do floema altamente diluídas ou quantidades de amostra muito baixa. Exsudação de EDTA-facilitou também é propensa a contaminação e não pode representar o floema real composição16. Exsudação de floema espontânea é limitada para plantar espécies como abóboras, tremoço ou yucca, onde cortar as partes da planta leva a uma emissão espontânea de seiva do floema que pode ser facilmente coletadas13,17,18, 19. Recentemente estabelecemos colza (Brassica napus) como um sistema de modelo apropriado para a análise do floema, uma vez que é um parente próximo da . thaliana e vários microlitros de seiva do floema podem ser obtidos de pequenas incisões que tem sido mostrado para ser de alta pureza4,8,20. Além disso, a sequência do genoma de b. napus foi lançada em 201421.
Exceto para pulgão stylectomy, todos os métodos de coleção de floema descritos incluem danos do tecido no local da amostragem, e a composição da seiva do floema pode mudar em resposta a lesões. Portanto, é essencial verificar a qualidade das amostras de floema, independentemente do método de amostragem aplicada. Existem diferentes métodos para o controle de qualidade de seiva do floema coletados, por exemplo, por determinação do RNase atividade22,23, RT-PCR com primers contra Rubisco8,24ou a análise do açúcar composição8.
Diferentes métodos para isolar e separar os complexos da proteína podem ser aplicados, incluindo cromatografia de exclusão, ultracentrifugação de densidade de sacarose ou filtração da amostra através de membranas com distintas de peso molecular de corte offs. No entanto, essas abordagens não permitem alta resolução. A técnica chamada azul nativa página (BN-), primeiramente descrita por Schägger et al. 25, é superior em termos de resolução. Foi usado com sucesso para determinar os pesos moleculares dos complexos proteína nativa grande de várias organelas ou de lisados celulares e suas abundâncias relativas de26,27.
Para elucidar ainda mais a composição complexa de complexos de proteínas, é necessário separar os componentes individuais sob condições, levando a desmontagem completa dos componentes do complexos de desnaturação. Isto pode ser conseguido por uma segunda dimensão de SDS-PAGE 28,29 , ou, para obter maior resolução, por uma segunda dimensão de focalização isoelétrica (IEF) seguida por um third dimension de SDS-PAGE30 e posterior identificação de as proteínas usando espectrometria de massa.
Neste protocolo, descrevemos a amostragem de seiva pura do floema de plantas b. napus e a análise de complexos de proteínas de tais amostras de floema usando uma abordagem eletroforética 3D combinando BN-página com Tris-Tricine-ureia-página e SDS-PAGE. Os componentes de complexos de proteínas separadas são posteriormente identificados usando espectrometria de massa. Além disso, nós introduzimos azul nativo northern blot que serve como um método que permite a detecção de RNAs em grandes complexos RNP4, estendendo-se a aplicabilidade da abordagem.
Protocolo
1. amostragem e preparação de seiva do floema de b. napus plantas 4,8,20
- De seiva do floema de amostragem, usar bem regada de 8 semanas de idade b. napus essa floração inicial apenas mostrar para evitar contaminações de pólen de plantas.
- Use uma agulha hipodérmica (Ø 0,8 mm) e a inflorescência punctate-tronco várias vezes. Repita em várias outras hastes de inflorescência e em outras plantas para obter suficiente seiva do floema (Figura 2a).
Nota: Para análise complexa, é recomendável começar com pelo menos 600 µ l de seiva do floema. 4 a 5 plantas produzirá entre 700 e 200 µ l de seiva do floema. - Limpe a primeira gota do lesionado sites com papel de filtro. Estas gotas principalmente contenham material altamente contaminado do lesionado tecido circundante e precisam ser descartados.
- Recolher as gotas seguintes pipetando e armazenar o exsudato coletado em um tubo de reação de pre-refrigerados cónico 1,5 mL a-20 ° C, usando um sistema de refrigeração livre de gelo.
- Continue coletando até sem mais formação de gota é observável, mas não mais de 1 h. Este procedimento pode ser repetido após dois dias sem perda significativa de seiva do floema coletados.
Nota: A seiva do floema coletados pode ser usada imediatamente ou armazenada a-80 ° C para análise futura. Para o armazenamento de-80 ° C, choque-congelar no tubo de reação em nitrogênio líquido. - Concentre a amostra de floema para aproximadamente 1/6th do volume inicial usando concentradores centrífugos com um peso molecular corte (MWCO) de 10.000 Daltons (Da). Centrifugar a amostra concentrada a 4 ° C e 20.000 x g, durante pelo menos 15 min remover partículas de poeira.
Nota: Concentração de seiva do floema não conduz a uma perda significativa de proteínas. - Para posterior análise complexa, proceda com o passo 3.1.
2. controle de pureza de seiva floema usando transcriptase reversa PCR (RT-PCR) 4,8,20
- Isolar o RNA total de seiva do floema usando um método padrão para a extração de RNA para material líquido (por exemplo, extração de TRIzol ou fenol-clorofórmio seguido de precipitação do isopropanol da fase aquosa e etanol lavagem etapas de acordo com o protocolo do fabricante).
Atenção: O fenol-clorofórmio é tóxico. Trabalhar sob uma capa com equipamento de proteção pessoal apropriado. O RNA extraído pode ser armazenado em etanol a-80 ° C por até seis meses. - Remover a contaminação de DNA por digestão com DNase I (1 u / µ g) por 45 min a 37 ° C e inativar a enzima adicionando EDTA para uma concentração final de 5 mM e incubar a amostra a 75 ° C por 10 min.
- Para obter RNA puro, purificar e concentrar a amostra por outra etapa de purificação (por exemplo, usando Kits de limpeza de RNA, de acordo com as instruções do fabricante).
- Executar um transcriptase reversa PCR (RT-PCR) para a síntese de cDNA com um kit de síntese do cDNA usando 150 ng do RNA puro conforme descrito pelo fabricante do protocolo.
Nota: O cDNA pode ser armazenado a-20 ° C até utilização posterior. - Use 5 µ l de cDNA como um modelo para uma reação de PCR padrão conforme especificado pelo fabricante, para amplificar o compartimento específico transcrições e verificar por eletroforese em gel de agarose. Confirme a pureza das amostras de floema usando, por exemplo, as primeiras demão para pequena subunidade rubisco, tioredoxina h e a proteína do revestimento de pólen (Figura 1b, tabela 1).
3. azul nativo página 4,de25,de26,31
- Use ou géis de gradientes nativos auto derramados como descrito em outro lugar27 ou géis de gradiente comerciais Bis-Tris.
- Carga de 20 a 30 µ g de amostra concentrada de proteína por alvéolo até o gel pelo menos triplica.
- Funcione o gel a 4 ° C e 150 V usando buffers de catodo azul escuro B e ânodo (tabela 2) até que a amostra passado 1/3rd do gel (ca. 20 a 30 min, Figura 3a).
Nota: Para a mancha do Norte, uma pista única gel é suficiente, enquanto para a análise da composição de proteína por página 3D e espectrometria de massa é aconselhável combinar a mesma banda de até dez pistas de gel para concentrar proteínas menos abundantes. - Pausar a execução e buffer de catodo azul escuro de troca B com luz azul cátodo buffer B/10 (tabela 2) e continuar a executar. Termine o gel executar quando a fachada azul começa a eluir fora o gel (ca. 120 a 180 min, Figura 3a).
Nota: O gel nativo azul acabado pode ser armazenado a 4 ° C durante pelo menos uma semana. Armazenamento prolongado pode levar a difundir bandas e deve ser evitado. Buffer de azul escuro B pode ser reutilizado.
4. opcional: Detecção de RNA usando azul nativo mancha norte 4
- Cortar bandas distintas ou usar o gel de todo do gel azul nativo e transferi-los para uma membrana de nylon por semi seco mancha a 3,5 mA/cm2 para 60 min e marcar a fronteira de gel de superior e inferior com um lápis na membrana (figura 4a).
- Depois da mancha, lave a membrana com água tratada DEPC e secar entre dois papéis de filtro.
- Executar UV-reticulação da membrana borrada com 120.000 µ j/cm2 (85 s se usando o Crosslinker na Tabela de materiais).
- Pre-cruzar a membrana com 6 mL de tampão de hibridização (comercial ou self-made) para 60 min a 68 ° C em um forno de hibridização (figura 4a).
- Adicionar um adicional 1 mL de tampão de hibridização contendo 4 µ l de sondas de 3'-biotinilado (100 nM).
- Incube a membrana com a sonda durante a noite, arrefecendo o forno de 68 ° C a 37 ° C.
- Lave a membrana com tampão contendo 2 x SSC e 0,1% SDS, por 5 min à temperatura ambiente para remover sondas vinculadas unspecifically.
Cuidado: SDS pode causar irritações. Use luvas e avental quando estiver trabalhando com SDS e SDS contendo soluções. - Execute a detecção das sondas 3'-biotinilado sobre a membrana , por exemplo, com um conjugado-Streptavidin-HRP e luminol como substrato horseradish peroxidase (HRP), resultando em uma sensível reação quimioluminescente (figura 4a).
5. segunda dimensão: Tris-Tricine-ureia página 4,28
- Impostos especiais de consumo única bandas do gel azul nativo. Combine faixas de amostras correr em pistas paralelas para alcançar uma maior concentração de proteínas complexas (Figura 5).
Nota: Bandas extirpadas podem ser armazenadas em tubos de reação simples até o uso mais a 4 ° C. - Despeje um gel Tris-Tricine-ureia de 12% (espessura de 1mm, 6,8 x 8,6 cm (largura x comprimento)). Prepare-se para o gel de separação (tabela 2), 10 mL de solução de gel A derramar entre duas placas de vidro e sobreposição com isopropanol. Remover o isopropanol após a polimerização é terminada e transferir 4 mL de solução de gel B (tabela 2) para o gel de empilhamento para o gel e inserir que um 10 bem pentear.
Atenção: Não polimerizada acrilamida pode ser neurotóxica e TEMED é prejudicial se inalado. Sempre use equipamentos de proteção pessoal e trabalhar sob um capuz. - Transferir as bandas excisado do gel em um tubo de reação de 1,5 mL e adicionar 1 mL de tampão de amostra SDS para o equilíbrio das peças gel (Figura 5, tabela 2) de 2x.
- Incubar as amostras durante 10 minutos à temperatura ambiente, antes da ebulição em um bloco de aquecimento (95 ° C) ou no microondas e incubar as amostras novamente à temperatura ambiente para um mais 15 min.
- Empilhe vários pedaços de gel equilibrado que representa o mesmo complexo em um gel único bolso.
- Realizar a eletroforese usando o ânodo e o cátodo executando buffers de 150 V por 45 a 60 min e excisar a gel de toda pista.
- Incubar a corte lane por 20 min em tampão ácido (100 mM Tris, 100 mM de ácido acético) e equilibrar em 125 mM Tris-HCl, pH 6,8 por mais 20 minutos (Figura 5).
6. terceira dimensão: 4,de SDS-PAGE32
- Despeje um SDS de 15%, separando o gel de acordo com Laemmli32 (espessura: 1.5 mm, 6,8 x 8,6 cm (largura x comprimento)) (tabela 2) e adicionar uma camada fina de um 4% acima do gel de empilhamento.
Cuidado: SDS, acrilamida e TEMED são tóxicos e prejudiciais. Trabalhar sob um capuz e use equipamento de proteção pessoal. - Transferir a faixa de gel equilibrada sobre o gel de SDS e cobrir o gel com 0,5% (w/w) agarose em 1x SDS executando o tampão completado com um traço de azul de bromofenol (Figura 5).
- Ferva o SDS com buffer de agarose no microondas prévia de carregamento para o gel.
- Para a execução de um marcador de proteína para estimar os pesos moleculares dos componentes simples, coloque um pedaço de papel de filtro em uma extremidade do gel até que solidificou a agarose ou usar um pente especial geralmente usado para géis IPG.
- Funcione o gel a 150 V por 60 min e mancha o gel com Coomassie coloidal, mancha prateada ou qualquer outro método de coloração adequado para posterior análise de espectrometria de massa.
- Analisar os pontos visíveis da proteína usando espectrometria de massa abordagens como a laser assistida por matriz dessorção/ionização tempo-de-voo (MALDI-TOF) ou espectrometria de massa de LC-MS/MS.
Nota: Recomendamos a utilização do Coomassie coloidal coloração como já descrito,33. Em nossas mãos, ainda menos abundantes proteínas podem ser suficientemente manchados e permite uma análise de espectrometria de massa com qualidade razoável dos dados.
Resultados
Aqui nós apresentamos um protocolo que permite a análise de proteína: proteína bem como complexos de proteína: RNA em amostras de floema de Brassica napus. O fluxo de trabalho é ilustrado na Figura 1. Uma das principais vantagens do b. napus sobre outros organismos modelo é a possibilidade de coleta de amostra relativamente fácil floema de pequenos furos no tronco da inflorescência. Isto permite a obtenção de amostras de floema puro em comparativamente grandes quantidades. Quando o floema de amostragem, é sempre aconselhável verificar contaminações, por exemplo por RT-PCR8. Um resultado representativo obtido de uma amostra pura de floema é retratado na Figura 2. Amostras não-contaminada floema devem mostrar uma banda visível para tioredoxina h, Considerando que nenhum sinal para a rubisco e a proteína do revestimento de pólen deve aparecer. A subunidade pequena rubisco pode servir como um controle em amostras de folhas, caules de inflorescência ou pólen. Tioredoxina h deve ser detectável em todas as amostras, desde que seu mRNA foi encontrado no floema de espécies diferentes, enquanto a transcrição de proteínas do pólen casaco só deve ser visível em amostras de flor em botão. Contaminações podem ocorrer quando a amostragem do floema é realizada em plantas de floração totalmente (proteína de casaco de pólen) ou quando as primeiras gotículas de floema punções de amostragem não são descartadas corretamente (rubisco).
Antes da página BN é obrigatório para concentrar a seiva do floema. Com 20 a 30 µ g de proteína por bem, pelo menos quatro bandas de complexos de proteína principal se tornam visíveis após BN-página de seiva do floema b. napus , demasiado baixa ou demasiado altas concentrações não permitem uma clara separação dos complexos (Figura 3). Recomenda-se carregar várias bandas de gel que representam o mesmo complexo em um único bolso do gel segunda dimensão se concentrar ainda mais as proteínas de cada único complexo para processamento a jusante e a posterior identificação de espectrometria de massa.
Para identificar os componentes individuais de complexos macromoleculares de floema, estamos combinados a BN-página inicial com uma segunda dimensão Tris-Tricine-ureia e uma terceira dimensão de SDS-PAGE para conseguir uma separação de proteínas simples. Aqui, uma separação com alta resolução pode ser observada devido os comportamentos de migração diferentes proteínas em ureia e geles de SDS-PAGE. Normalmente, as proteínas pertencentes a um complexo único será visíveis como uma linha diagonal através do gel. Proteínas acima desta linha têm uma maior hidrofobicidade, enquanto proteínas abaixo da linha representam mais hidrófilas28 (Figura 5, Figura 6).
Para a caracterização de complexos de RNP, usamos uma parte de um gel de BN-página para executar BN mancha do Norte. Após a mancha de uma faixa inteira sobre uma membrana de nylon e reticulação pela radiação UV, o RNA pode ser visualizado usando sondas de RNA específico, conforme ilustrado na Figura 4. Aqui é mostrado que um tRNA específico só está presente em um complexo específico. Os componentes de proteína deste complexo de tRNA-vinculação podem ser mais investigados usando a aproximação de gel 3D descrita acima. Espectrometria de massa análises mostrou que este complexo contém principalmente tRNA-ligases que confirma a actividade de ligação do tRNA encontrada por BN mancha do Norte.
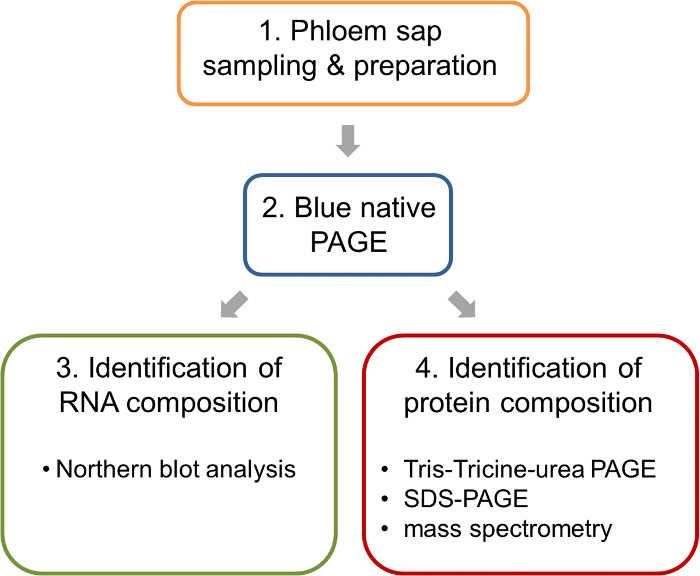
Figura 1: trabalhar o fluxo da análise de complexos ribonucleoprotein na seiva do floema de colza. Após a amostragem e preparação de amostras de floema, BN-página é realizada para separar complexos nativos. Esses géis BN-página permitem a análise paralela de ácidos nucleicos por BN mancha do Norte e a identificação dos componentes da proteína dos complexos por espectrometria de massa. Clique aqui para ver uma versão maior desta figura.

Figura 2: controle de amostragem e pureza de seiva do floema de b. napus. Depois de perfurar a haste da inflorescência de plantas de estupro de oleaginosas de 8-10 semanas com uma agulha hipodérmica estéril, exsudato é coletado com uma pipeta e transferido para um tubo de reação gelada (um) para confirmar a pureza das amostras de floema, QUE RT-PCR é realizado, amplificar as transcrições da tioredoxina h, rubisco pequena subunidade e proteína de casaco de pólen em amostras de tecido-específica (b) RT-PCR sem transcriptase reversa foi executada como controle (-). Clique aqui para ver uma versão maior desta figura.
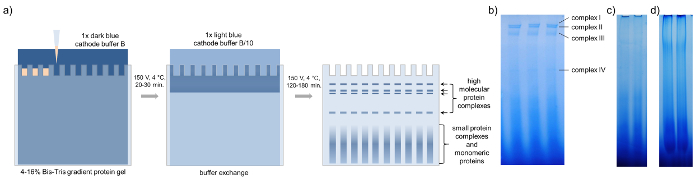
Figura 3: BN-página. Representação esquemática da página nativa azul com amostras de floema concentrada de b. napus. (a) depois de carregar o gel de proteína gradiente com 15-20 µ l de seiva do floema concentrada, BN-página é executada com buffer de catodo azul escuro 1 x B a 150 V para 20-30 min em uma sala fria. Então o buffer é trocado contra 1 buffer de luz catodo azul x B/10 e a página é terminada em 150 V para 120-180 min até o azul escuro, executando a front executa fora do gel. Os géis de BN-página mostram quatro bandas distintas que representam quatro diferentes complexos de alto peso molecular. (b) carregamento (c) muito pouco ou demais proteínas do floema (d) reduz a visibilidade de complexos individuais. Clique aqui para ver uma versão maior desta figura.

Figura 4: a mancha do Norte BN. Representação esquemática do Norte mancha método o BN. b a pista da BN-página é transferida para uma membrana de nylon semi-seca borrando. Após a reticulação de UV e pré-hibridização, a membrana é incubada com sondas de RNA específicas (sonda aqui um tRNA metionina-específico), que são biotinilado na 3'-extremidade em um forno de hibridização durante a noite. Enciclopédia sondas são removidas por etapas de lavagem e a detecção de RNA é realizada por um conjugado HRP-streptavidin e luminol. Usando essa abordagem, observamos que o complexo IV da BN-página contém metionina tRNA. (b) o gel de Coomassie manchado e o borrão de tRNA assemelham-se a duas pistas de gel diferentes executadas em paralelo para evitar diferenças de migração. Clique aqui para ver uma versão maior desta figura.
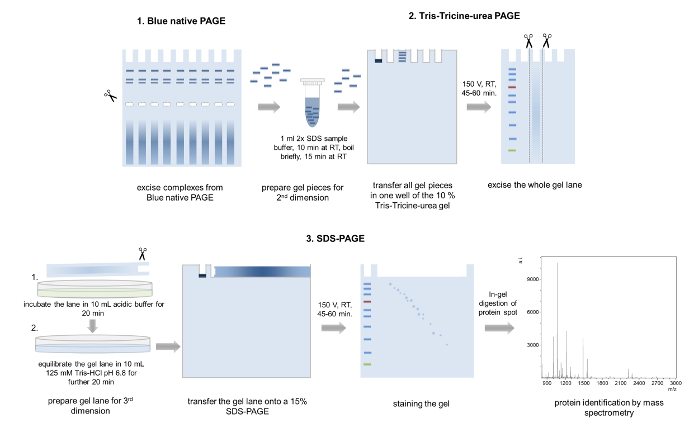
Figura 5: 3D-página. Representação esquemática da abordagem 3D-página. Várias bandas do mesmo complexo são extirpadas de um gel de BN-PAGE, incubadas em tampão de carregamento e transferidas para um poço de segunda dimensão Tris-Tricine-ureia-página. Após eletroforese, gel de todo pistas são cortar, lavadas em tampão ácido ácido, equilibradas e colocadas em um gel de SDS-PAGE 15%. Após a terceira dimensão de página, as proteínas separadas são Coomassie manchado e analisados por espectrometria de massa. Clique aqui para ver uma versão maior desta figura.
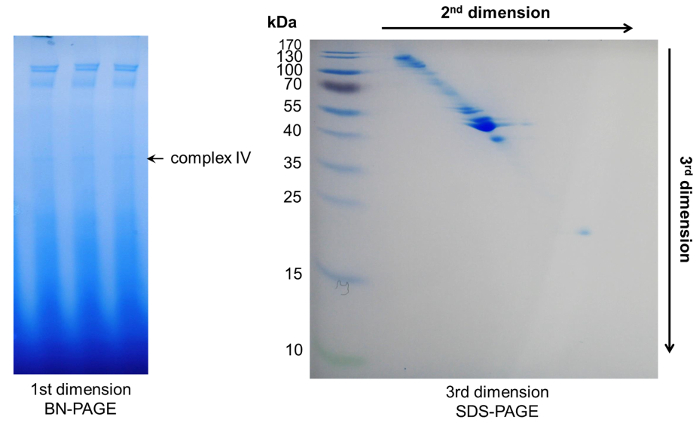
Figura 6: representante os resultados depois de 3D-página. Dentro da primeira dimensão BN-página vários complexos apareceram. Seus componentes de proteína poderiam ser ainda mais separados por duas páginas subsequentes de desnaturação, resultando em um padrão diagonal do ponto. Clique aqui para ver uma versão maior desta figura.
| Sonda | Sequência de |
| Tioredoxina h |
para a frente: CTCAAGGCAGCCAAAGAATC reverso: ATGGCCTGAACATCGAACTC |
| RuBisCO pequena cadeia |
para a frente: TTCACCGGCTTGAAGTCATC reverso: CCGGGTACTCCTTCTTGCAT |
| Proteína de casaco de pólen BRU77666 |
para a frente: TCAGAACTGGAGCTTCAACG reverso: TTCCTTAATGGCCTCAGTGG |
Tabela 1: Primers utilizados para controle de pureza do floema sample. Para confirmar a pureza de amostra de floema primers específicos para a pequena cadeia rubisco, tioredoxina h e proteína de casaco de pólen podem ser usados para a amplificação do cDNA.
| Buffers e soluções | Conteúdo | Comentário | |
| buffer de catodo azul escuro B | pH de 15 mM Tris Bis 7.0 50mm Tricine 0,02% (p/v), azul de Coomassie G250 | receita é adaptada de Fiala et al. 17 pH deve ser ajustado para 7,0 Tampão pode ser feito como um estoque de 10 x | |
| buffer de luz catodo azul B/10 | pH de 15 mM Tris Bis 7.0 50mm Tricine 0,002% (p/v), azul de Coomassie G250 | Tampão pode ser preparado diluindo o buffer de cátodo B com buffer de cátodo sem Coomassie | |
| buffer de ânodo |
pH 50 mM Tris-Bis 7.0 | Tampão pode ser preparado como uma solução-mãe de 10x | |
| 2 x de tampão de amostra SDS |
pH de 125 mM Tris-HCl 6,8 4% SDS 20% glicerol 0.2 TDT DE M bromofenol 0,02% (p/v) | ||
| 1 x TBE buffer de buffer de transferência |
pH de 89 mM Tris 7,6 ácido bórico 89 mM 2 mM EDTA | Amortecedor de TBE pode ser feito e armazenado como existências de 5x ou 10x. É importante para o uso livre de RNase deionizada água. | |
| 2 x tampão SSC |
300 mM NaCl pH de citrato de 30 mM Na37.0 | ||
| 3 x amortecedor gel |
3 M Tris HCl 1m 0,3% SDS pH as 8h45 | receita adaptada de Schägger 19 | |
| A de solução de gel Tris-Tricine |
Para 10ml: 30% do acrilamido-bisacrylamide (29:1) 3,34 mL Ureia de 6m 3 x gel de buffer 3,34 mL 70% de glicerol 1,4 mL Adicionar O ddH2a 10 mL 10% APS 40 Μ l TEMED 4 Μ l | Peso de 6 M de ureia e adicionar 3 x amortecedor gel, a solução de acrilamida-bisacrylamide e gycerol de 70%. Aquecer a 60 ° C em banho-maria para solubilizar a ureia. Adicionar 10 mL, 10% DDQ2O APS e finalmente TEMED para polimerização. | |
| Solução de gel Tris-Tricine B |
Para 6 mL: 30% do acrilamido-bisacrylamide (29:1) 0,8 mL Ureia de 6m 3 x 1,5 mL de buffer de gel Adicionar O ddH2a 6 mL 10% APS 45 Μ l Μ L DE TEMED 4.5 | Peso de 6 M de ureia e adicionar 3 x solução tampão e acrilamida-bisacrylamide de gel. Aquecer a 60 ° C em banho-maria para solubilizar a ureia. Adicionar 10 mL, 10% DDQ2O APS e finalmente TEMED para polimerização. | |
| 1x Tris-Tricine buffer de execução (ânodo) |
100 mM Tris HCl de 22,5 mM pH 8,9 | receita adaptada de Schägger 19 | |
| 1x Tris-Tricine buffer de execução (cátodo) |
100 mM Tris 100mm Tricine 1% SDS pH 8,25 | receita adaptada de Schägger 19 | |
| Tampão ácido |
100 mM Tris 100 mM de ácido acético | ||
| 4% gel de empilhamento de SDS |
Para 2 mL: ddH2O 1,4 mL 30% do acrilamido-bisacrylamide (37.5:1) 0,33 mL 1 M Tris pH 6,8 0,25 mL 10% SDS 20 Μ l 10% APS 20 Μ l TEMED 2 Μ l | ||
| 15% SDS, separando o gel |
Para 10ml: ddH22.3 O mL 30% do acrilamido-bisacrylamide (37.5:1) 5 mL 1,5 M Tris pH 8,8 2.5 mL 10% SDS 100 Μ l 10% APS 100 Μ l TEMED 4 Μ l | ||
| tampão de execução SDS 1x |
25 mM Tris glicina 192mm 0,1% SDS | ||
| Solução de coloração de Coomassie |
-(14-18)-hidrato de sulfato de alumínio de 5% (p/v) 10% (v/v) de etanol (96%) ácido ortofosfórico a 2% (v/v) (85%) 0,02% (p/v), azul de Coomassie brilhante G-250 | ||
| Tampão de hibridização ultra-sensível de ULTRAhyb | Ambion, tecnologias da vida | ||
Tabela 2: soluções e receitas do amortecedor. Lista de todos os buffers e soluções necessárias para a análise de página 3D.
| Não mancha. | Obs. MW [kDa] | Identificação | Organismo | Não de adesão. | MW [kDa] | Pontuação de mascote | |
| CIV_1 | 130 | Proteína de resistência putativo doença At4g19050 | B. napus | CDX78917 | 131,1 | 110 | |
| CIV_2 | 130 | Proteína de resistência putativo doença At4g19050 | B. napus | CDX78917 | 131,1 | 89 | |
| CIV_3 | 100 | 70 kDa proteína 14-como de choque do calor | B. napus | XP_013748865 | 89,9 | 113 | |
| CIV_4 | 90 | Fator de alongamento eucariótico 2 Divisão celular controlar homólogo 48 de proteína A | B. napus B. napus | CDX90241 CDY41316.1 | 89,5 89,5 | 111 197 | |
| CIV_5 | 85 | Calor choque proteína 90-2-como | B. rapa | XP_009132342 | 79,8 | 172 | |
| CIV_6 | 80 | Treonina - ligase do tRNA Glicina - ligase do tRNA | B. oleracea B. napus | XP_013599115 CDY43195 | 81,5 80,8 | 110 88 | |
| CIV_7 | 70 | 70 kDa proteína de choque do calor Lisina - tRNA ligase-como | B. oleracea B. napus | XP_013685267 XP_013747530 | 67,8 69,9 | 230 150 | |
| CIV_8 | 65 | Tioglucosidase Aspartato - tRNA ligase do 2 Asparagina - tRNA ligase do 1 | B. napus B. napus B. napus | ABQ42337 XP_013670803 XP_013729126 | 60,6 61,6 63.5 | 183 141 153 | |
| CIV_9 | 60 | Tioglucosidase | B. napus | ABQ42337 | 60,6 | 164 | |
| CIV_10 | 55 | Adenosylhomocysteinase 2-como | B. rapa | XP_009135865 | 53,1 | 139 | |
| CIV_11 | 55 | 1-Alfa 1-como fator de alongamento | B. oleracea | XP_013586115 | 51,9 | 161 | |
| CIV_12 | 50 | Liase cistina CORI3, como | B. napus | XP_013653143 | 48,1 | 237 | |
| CIV_13 | 44 | Liase cistina CORI3, como | B. rapa | XP_009108611 | 48.3 | 213 | |
| CIV_14 | 38 | Frutose-bisphosphate aldolase | B. rapa | XP_009115993 | 38,4 | 226 | |
| CIV_15 | 45 | Liase cistina CORI3, como | B. rapa | XP_009108611 | 48.3 | 219 | |
| CIV_16 | 45 | Liase cistina CORI3 | B. rapa | CDY69765 | 46,9 | 209 | |
| CIV_17 | 38 | Frutose-bisphosphate aldolase | B. rapa | XP_009115993 | 38,4 | 124 | |
| CIV_18 | 18 | Peptidyl-prolil cis-trans isomerase CYP18-3-como | B. napus | XP_009101932 | 18,3 | 128 | |
| CIV_19 | 45 | Liase cistina CORI3, como | B. rapa | XP_009108611 | 48.3 | 177 | |
Tabela 3: identificados componentes proteicos do complexo IV. Foram encontradas vários ligases tRNA e outras proteínas dentro do complexo de ligação do tRNA usando MALDI-TOF massa análise espectrométrica após 3D-página.
Discussão
O floema é um compartimento de grande interesse, uma vez que constitui a rota de transporte principais para fotossimilados e também é essencial para a sinalização de longa distância entre plantas diferentes partes9,20,34, 35. Além de pequenas moléculas, macromoléculas como proteínas e RNAs têm sido implicadas com a manutenção do floema e sinalização4,7,8. A análise da composição do floema é restrito pela acessibilidade limitada para amostras de floema na maioria das espécies de plantas. A técnica de inseto estilete é amplamente aplicável, mas experimentalmente exigentes e resulta em muito pequenas quantidades de amostras de floema11. Uma técnica fácil, usada para amostragem de floema é exsudação EDTA-facilitou12. EDTA quelatos íons divalentes, como o cálcio e, portanto, impede o fechamento das placas de peneira por P-proteínas e callose. É fácil de usar, mas é propenso à contaminação por células danificadas e as amostras são diluídas. Empobrecimento íons divalentes por EDTA também pode levar a um colapso de complexos existentes. No entanto, ele permite a amostragem de uma grande variedade de espécies, incluindo a planta de modelo a. thaliana15. Espontânea exsudação de seiva do floema ocorre apenas em um pequeno número de espécies de plantas. É um método invasivo que envolve significativa lesão de tecidos de planta10. Recentemente estabelecemos b. napus como uma espécie de modelo para estudar o transporte de longa distância4,8,20. Aqui, seiva do floema pode ser degustada de pequenas incisões, que reduz ferindo efeitos e fontes de contaminação.
Usando técnicas de amostragem diferentes, a proteoma das amostras do floema de diferentes espécies de plantas tem sido pesquisada em anos recentes7,8,17,36,37, 38,39. Para estes estudos de proteoma, proteínas foram extraídas e precipitadas sob condições de desnaturação e, portanto, não permitem conclusões sobre proteína: proteína e proteína: interações ácido nucleico presente sob condições nativas. Co-imunoprecipitação (CoIP) e sobreposição ensaios indicaram que um grande complexo de ribonucleoprotein pode existir na seiva do floema de abóbora40, mas não foi demonstrado que qualquer complexos macromoleculares existirem sob condições nativas dentro da sistema de floema.
Azul página nativa, introduzida por Schägger et al . 26, em combinação com passos de eletroforese de gel de alta resolução subsequente permitem a separação dos componentes individuais de grandes complexos de proteínas. Usando o 3D-página análises de nativo b. napus exsudado do floema, nós recentemente pôde demonstrar que várias proteínas: proteína de alto peso molecular e complexos de RNP existem em amostras de floema e são enzimaticamente ativo4. Métodos alternativos para isolar os complexos da proteína, bem como RNPs como cromatografia de exclusão podem existir, mas falham em termos de resolução quando comparado à BN-página. Além disso, para uma razoável qualidade de separação complexa, matrizes de coluna de exclusão de tamanho devem ser adaptados de acordo com os global complexos pesos moleculares sendo investigados. Analisando a complexos de tamanho diferente, portanto, vai exigir diferentes tipos de colunas que é custo intensivo e não permitir como alta potência focagem como BN-página.
Passos críticos para analisar complexos de b. napus incluem a quantidade total de seiva do floema usada como material de partida. Pelo menos 600 µ l de amostra do floema são necessárias e podem ser obtidas de cinco plantas bem regadas. 3D-página e BN mancha do Norte é necessário iniciar o gel BN inicial com uma quantidade suficiente de amostras de floema. Para alcançar este objetivo, amostras de floema estão concentradas até 20 a 30 µ g de proteína pode ser carregado em cada bem e pelo menos que triplica da mesma amostra é executada em paralelo. Muito baixas ou muito altas concentrações reduzem a detecção dos complexos (Figura 3). Floema amostras precisam ser coletadas em tubos de reação no gelo e devem ser armazenadas congelados para uso posterior evitar a rotatividade e a degradação das proteínas. Inibidores de protease têm sido encontrados em todos os floema proteomes analisados, mas também uma Proteassoma totalmente ativa foi descrita no floema de b. napus4. Além disso, volume e composição das amostras de floema dependem do tempo-ponto de amostragem e de condições ambientais10. Portanto, deve-se ter cuidado para coletar ao mesmo tempo do dia em condições similares. Tratamentos de stress (por exemplo, seca) podem reduzir a quantidade de floema que pode ser coletada. Para identificar proteínas única por espectrometria de massa, é obrigatório para limitar as contaminações possíveis queratina por usando luvas o tempo todo. Leva a sinais adicionais durante a análise em massa e dificulta a identificação da proteína queratina. A BN-página em execução em uma tensão mais alta ou a temperatura ambiente pode causar aquecimento do gel que possa resultar na desmontagem dos complexos frágil.
O protocolo aqui apresentado é adequado para a análise de complexos de proteína: proteína. Também mostramos que ele pode ser usado para detectar RNAs específicos contidos na complexos em paralelo. Para conseguir isso, introduzimos recentemente um protocolo para BN norte da mancha a4. RNAs são propensas à degradação por contaminações de RNAse. Para limitar tal degradação DEPC tratada, água deve ser usada.
Principais limitações do método apresentado incluem a estimativa do peso molecular de complexos de proteínas separadas por BN-página, desde que o comportamento de migração depende de tamanho, forma e até mesmo modificações posttranslational de complexos31, 41. Estimativa de tamanho de complexos RNP é ainda mais complicada devido à influência dos ácidos nucleicos sobre o comportamento de migração. Ele também não pode ser evitado que os complexos do mesmo tamanho co migram em uma única banda. Isso pode levar à previsão errônea de composições complexas. Portanto, verificar as interações observadas com técnicas complementares, por exemplo, por ensaios funcionais4, pode ser necessário. Também proteínas apenas fracamente ou transitoriamente associadas a um complexo macromolecular podem ser perdidas no BN buffer usado. Para evitar isso, as amostras podem ser ligação cruzada, o que também pode levar a artefatos ou pode impedir a identificação da proteína, ou as condições de reserva podem ser otimizadas.
Em contraste com o clássico 2D-PAGE, a combinação de ureia - e SDS-PAGE permite a separação de acordo com a hidrofobicidade e peso molecular, em vez de ponto isoelétrico (pI) e peso molecular de 28e não limita a separação de proteínas de um intervalo específico de pI. Similar ao clássico 2D-PAGE, separadas de proteínas são visíveis como pontos simples, mas na diagonal, linha de 4,28 (Figura 5, Figura 6). Mais proteínas hidrofóbicas aparecem em pontos acima a diagonal, Considerando que mais hidrófilas proteínas encontram-se abaixo da linha28. As concentrações de poliacrilamida utilizadas neste protocolo vão separar proteínas entre 25 a 80 kDa bem. Para permitir uma separação de proteínas de menores ou maiores a poliacrilamida concentração pode ser variada ou géis gradientes podem ser usados na terceira dimensão. Os componentes do complexo IV (Figura 3), separados por 3D-página (Figura 6) foram cortados, tripsina digerido e analisados por espectrometria de massa. Isto resultou na identificação de vários ligases de tRNA. Os componentes dos outros complexos têm sido recentemente publicado 4. Nossa página de 3D habilitado a separação de ligases diferentes, ou seja, aspartato, asparagina, treonina, lisina e glicina ligases, com peso moleculares similares (tabela 3). Usando uma sonda de tRNA específico de metionina, foram capazes de detectar o tRNA potencialmente acoplado dentro complexo IV, mas se tRNA completos ou fragmentos de tRNA são no complexo não podem ser discriminados com as sondas utilizadas. Para verificar se os ácidos nucleicos são realmente acoplado dentro do complexo e não co migrando, protease digerido seiva do floema amostras poderá servir como controles de migração adequada.
Foi especulado anteriormente que tradução de proteína pode ocorrer dentro de tubos de peneira do floema, uma vez que quase a maioria dos componentes do Ribossoma inteira, bem como fatores de alongamento foram encontrados em amostras de floema4,7. Nosso achado de tRNA e ligases tRNA parece apoiar esta ideia. No entanto, fragmentos de tRNA presentes nas amostras de floema de abóbora foram mostrados para ser potentes inibidores da tradução42 e ribossomas funcionais parecem estar ausentes da4, sugerindo que a tradução não pode ter lugar.
Tomados em conjunto, o protocolo aqui apresentado permite a separação de proteínas: proteína nativa e até mesmo RNP complexos de amostras de floema e a separação e identificação dos seus componentes individuais com alta resolução. A aplicação deste método permite a descoberta de novas proteínas e complexos de RNP em amostras de floema e, portanto, pode elucidar novas funções neste compartimento planta altamente especializados.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a Jennifer Deke e Urszula Zarzenska pelo apoio científico. Este trabalho foi apoiado financeiramente por uma concessão de integração de carreira (CIG, PCIG14-GA-2013-63 0734) pela Comissão Europeia no âmbito do 7º programa-quadro, a concessão LFF-GK06 'DELIGRAH' (Landesforschungsförderung Hamburgo) e a concessão DFG (DFG KE 856_6-1) atribuído a JK.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL reaction tubes | Eppendorf | 30120086 | |
| 10 well comb for SDS PAGE, thickness 1 mm | BioRad | 1653359 | |
| 2-Propanol | AppliChem | 131090 | |
| 30 % Acrylamide-bisacrylamide solution (29:1) solution | BioRad | 1610156 | |
| 30 % Acrylamide-bisacrylamide solution (37.5:1) solution | BioRad | 1610158 | |
| 96 % Ethanol | Carl Roth | P075 | |
| Acetic acid | Carl Roth | 6755 | |
| Agarose | Lonza | 50004 | |
| Aluminum sulfate-(14-18)-hydrate | AppliChem | 141101 | |
| Ammonium peroxodisulfate (APS) | Carl Roth | 9592.3 | |
| Bis-Tris | AppliChem | A3992 | |
| Boric acid | AppliChem | A2940 | |
| Bromophenol blue | AppliChem | A2331 | |
| Centrifugal concentrators e.g. Vivaspin 500 (Mwco 10 kDa) | Sartorius | VS0102 | |
| Chemiluminescent Nucleic Acid Detection Module Kit | Thermo Fisher Scientific | 89880 | |
| Chromatography papers e.g. 3 mm CHR | Whatman | 3030-153 | |
| CoolBox M30 System | Biocision | BCS-133 | |
| Coomassie brilliant Blue G-250 | AppliChem | A3480 | |
| Diethyl pyrocarbonate (DEPC) | AppliChem | A0881 | |
| Dithiothreitol (DTT) | AppliChem | A1101 | |
| DNase I | AppliChem | A3778 | |
| Ethanol abs. | AppliChem | A3693 | |
| Ethylenediaminetetraacetic acid (EDTA) | AppliChem | A1103 | |
| Gel Imaging system e.g. Chemidoc Touch | BioRad | 1708370 | |
| GeneRuler 1kb plus | Thermo Fisher Scientific | SM1331 | |
| Glycerol | AppliChem | 141339 | |
| Glycine | AppliChem | 131340 | |
| Heating block TS1 | Biometra | 846-051-500 | |
| Hybridization oven e.g. GFL Hybridization Incubator 7601 | GFL | 7601 | |
| Hypodermic needle (0.8 mm) | B Braun | 4658309 | |
| IPG gel comb, thickness 1 mm | BioRad | 1653367 | |
| Labeling of RNA e.g.Biotin 3'end DNA Labeling Kit | Thermo Fisher Scientific | 89818 | |
| Native gradient gel e.g. Novex NativePAGE 4–16% Bis-Tris protein gel | Invitrogen | BN1002BOX | |
| Nylon membrane e.g. Hybond-N+ | Amersham Pharmacia | RPN203B | |
| Ortho-phosphoric acid | Carl Roth | 6366.1 | |
| PageRuler prestained protein ladder | Thermo Fisher Scientific | 26616 | |
| Power supply for Gel electrophoresis EPS | Amersham Pharmacia | 18-1130-01 | available from GE Healthcare |
| RNA Cleanup Kit | Qiagen | 74204 | |
| Semi dry blot e.g. Fastblot 43B semi dry Blot | Biometra | 846-015-100 | |
| Sodium chloride (NaCl) | AppliChem | A1149 | |
| Sodium dodecyl sulfate (SDS) | AppliChem | 142363 | |
| Synthesis of cDNA e.g. RevertAid First Strand cDNA Synthesis Kit | Thermo Fisher Scientific | K1621 | |
| Tetramethylethylenediamine (TEMED) | AppliChem | A1148 | |
| Tricine | AppliChem | A3954 | |
| Tris | AppliChem | A1086 | |
| Tri-sodium citrate dihydrate | AppliChem | A3901 | |
| TRIzol Reagent | Thermo Fisher Scientific | 15596026 | |
| ULTRAhyb Ultrasensitive Hybridization Buffer | Thermo Fisher Scientific | AM8670 | |
| Urea | AppliChem | A1360 | |
| UV Crosslinker e.g. Stratalinker 2400 | Agilent | NC0477671 | from Fisher Scientific |
| Vertical electrophoresis apparatus e.g.The XCell SureLock Mini-Cell or Mini-Protean III System | Thermo Fisher Scientific or BioRad | EI0001 or 1658004 | |
| Wipers e.g. KIMWIPES Delicate Task Wipers | Kimberly-Clark | 34120 |
Referências
- Kempers, R., van Bel, A. J. E. Symplasmic connections between sieve element and companion cell in the stem phloem ofVicia faba L. have a molecular exclusion limit of at least 10 kDa. Planta. 201 (2), 195-201 (1997).
- Stadler, R., et al. Expression of GFP-fusions in Arabidopsis companion cells reveals non-specific protein trafficking into sieve elements and identifies a novel post-phloem domain in roots. Plant J. 41 (2), 319-331 (2005).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11 (3), 309-322 (1999).
- Ostendorp, A., et al. Functional analysis of Brassica napus phloem protein and ribonucleoprotein complexes. New Phytol. 214 (3), 1188-1197 (2017).
- Paultre, D. S. G., Gustin, M. -. P., Molnar, A., Oparka, K. J. Lost in Transit: Long-Distance Trafficking and Phloem Unloading of Protein Signals in Arabidopsis Homografts. Plant Cell. 28 (9), 2016-2025 (2016).
- Sali, A., Glaeser, R., Earnest, T., Baumeister, W. From words to literature in structural proteomics. Nature. 422 (6928), 216-225 (2003).
- Lin, M. -. K., Lee, Y. -. J., Lough, T. J., Phinney, B. S., Lucas, W. J. Analysis of the Pumpkin Phloem Proteome Provides Insights into Angiosperm Sieve Tube Function. Mol. Cell. Proteomics. 8 (2), 343-356 (2008).
- Giavalisco, P., Kapitza, K., Kolasa, A., Buhtz, A., Kehr, J. Towards the proteome of Brassica napus phloem sap. Proteomics. 6 (3), 896-909 (2006).
- Lucas, W. J., Yoo, B. C., Kragler, F. RNA as a long-distance information macromolecule in plants. Nat. Rev. Mol. Cell. Bio. 2 (11), 849-857 (2001).
- Dinant, S., Kehr, J. Sampling and Analysis of Phloem Sap. Plant Mineral Nutrients. 953, 185-194 (2013).
- Kennedy, J. S., Mittler, T. E. A Method of obtaining Phloem Sap via the Mouth-parts of Aphids. Nature. 171 (4351), 528 (1953).
- King, R. W., Zeevaart, J. A. Enhancement of Phloem exudation from cut petioles by chelating agents. Plant Physiol. 53 (1), 96-103 (1974).
- Alosi, M. C., Melroy, D. L., Park, R. B. The regulation of gelation of Phloem exudate from cucurbita fruit by dilution, glutathione, and glutathione reductase. Plant Physiol. 86 (4), 1089-1094 (1988).
- Dinant, S., Bonnemain, J. -. L., Girousse, C., Kehr, J. Phloem sap intricacy and interplay with aphid feeding. Comptes rendus biologies. 333 (6-7), 504-515 (2010).
- Tetyuk, O., Benning, U. F., Hoffmann-Benning, S. Collection and analysis of Arabidopsis phloem exudates using the EDTA-facilitated Method. J Vis Exp. (80), e51111 (2013).
- Kovalskaya, N., Owens, R., Baker, C. J., Deahl, K., Hammond, R. W. Application of a modified EDTA-mediated exudation technique and guttation fluid analysis for Potato spindle tuber viroid RNA detection in tomato plants (Solanum lycopersicum). J. Virol. Methods. 198, 75-81 (2014).
- Rodriguez-Medina, C., Atkins, C. A., Mann, A. J., Jordan, M. E., Smith, P. M. Macromolecular composition of phloem exudate from white lupin (Lupinus albus L). BMC Plant Biol. 11 (1), 36 (2011).
- Taylor, J. S., Thompson, B., Pate, J. S., Atkins, C. A., Pharis, R. P. Cytokinins in the Phloem Sap of White Lupin (Lupinus albus L.). Plant Physiol. 94 (4), 1714-1720 (1990).
- Yoo, B., et al. A Systemic Small RNA Signaling System in Plants. Plant Cell. 16 (8), 1979-2000 (2004).
- Buhtz, A., Springer, F., Chappell, L., Baulcombe, D. C., Kehr, J. Identification and characterization of small RNAs from the phloem of Brassica napus. Plant J. 53 (5), 739-749 (2008).
- Chalhoub, B., et al. Plant genetics. Early allopolyploid evolution in the post-Neolithic Brassica napus oilseed genome. Science. 345 (6199), 950-953 (2014).
- Sasaki, T., Chino, M., Hayashi, H., Fujiwara, T. Detection of several mRNA species in rice phloem sap. Plant Cell Phys. 39 (8), 895-897 (1998).
- Doering-Saad, C., Newbury, H. J., Bale, J. S., Pritchard, J. Use of aphid stylectomy and RT-PCR for the detection of transporter mRNAs in sieve elements. J Exp. Bot. 53 (369), 631-637 (2002).
- Ruiz-Medrano, R., Xoconostle-Cázares, B., Lucas, W. J. Phloem long-distance transport of CmNACP mRNA: implications for supracellular regulation in plants. Dev. 126 (20), 4405-4419 (1999).
- Schägger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Fiala, G. J., Schamel, W. W. A., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. (48), e2164 (2011).
- Rais, I., Karas, M., Schägger, H. Two-dimensional electrophoresis for the isolation of integral membrane proteins and mass spectrometric identification. Proteomics. 4 (9), 2567-2571 (2004).
- Schägger, H. Tricine-SDS-PAGE. Nature protocols. 1 (1), 16-22 (2006).
- Wittig, I., Braun, H. -. P., Schägger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Eubel, H., Braun, H. -. P., Millar, A. H. Blue-native PAGE in plants: a tool in analysis of protein-protein interactions. Plant Methods. 1 (1), 11 (2005).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Turnbull, C. G. N., Lopez-Cobollo, R. M. Heavy traffic in the fast lane: long-distance signalling by macromolecules. New Phytol. 198 (1), 33-51 (2013).
- Hall, S. M., Baker, D. A. The chemical composition of Ricinus phloem exudate. Planta. 106 (2), 131-140 (1972).
- Barnes, A., Bale, J., Constantinidou, C., Ashton, P., Jones, A., Pritchard, J. Determining protein identity from sieve element sap in Ricinus communis L. by quadrupole time of flight (Q-TOF) mass spectrometry. J. Exp. Bot. 55 (402), 1473-1481 (2004).
- Walz, C., Giavalisco, P., Schad, M., Juenger, M., Klose, J., Kehr, J. Proteomics of curcurbit phloem exudate reveals a network of defence proteins. Phytochemistry. 65 (12), 1795-1804 (2004).
- Walz, C., Juenger, M., Schad, M., Kehr, J. Evidence for the presence and activity of a complete antioxidant defence system in mature sieve tubes. Plant J. 31 (2), 189-197 (2002).
- Kehr, J. Phloem sap proteins: their identities and potential roles in the interaction between plants and phloem-feeding insects. J Exp. Bot. 57 (4), 767-774 (2006).
- Ham, B. -. K., Brandom, J. L., Xoconostle-Cázares, B., Ringgold, V., Lough, T. J., Lucas, W. J. A polypyrimidine tract binding protein, pumpkin RBP50, forms the basis of a phloem-mobile ribonucleoprotein complex. Plant Cell. 21 (1), 197-215 (2009).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J. Immunol. Methods. 252 (1-2), 171-174 (2001).
- Zhang, S., Sun, L., Kragler, F. The phloem-delivered RNA pool contains small noncoding RNAs and interferes with translation. Plant Physiol. 150 (1), 378-387 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados