Method Article
Floema Sap campionamento da Brassica napus per 3D-pagina di proteine e complessi della ribonucleoproteina
In questo articolo
Riepilogo
Qui presentiamo un protocollo per analizzare la composizione proteica della grande proteina nativa: proteina e proteina: complessi di acidi nucleici da colza (b. napus) essudato floema utilizzando un approccio di elettroforesi (pagina) del gel di poliacrilammide 3D combinando blu nativo (BN) con due pagine di denaturazione seguita dall'identificazione spettrometria di massa.
Abstract
Floema delle piante superiori di campionamento è spesso laborioso e significativamente dipende la specie di pianta. Tuttavia, proteoma studi sotto condizioni di denaturazione potrebbero essere realizzati in diverse specie vegetali. Proteine: proteina nativa e proteina: complessi di acidi nucleici da campioni di floema ancora sono a malapena stati analizzati, anche se potrebbe giocano ruoli importanti nel mantenimento di questo comparto specializzato o nella segnalazione a lunga distanza. Assiemi di grandi dimensioni molecolari possono essere isolati utilizzando un'elettroforesi Natale blu del gel (BN-PAGE). Loro componenti proteici possono essere separate da un successiva sodio dodecil solfato (SDS-pagina). Tuttavia, le proteine con pesi molecolari simili co-migrano, ciò che può ostacolare la identificazione delle proteine mediante spettrometria di massa. BN-PAGE la combinazione con due differenti denaturante gel elettroforesi passi, vale a dire Tris-Tricine-urea e SDS-PAGE, consente l'ulteriore separazione delle proteine secondo loro idrofilicità/idrofobicità e così aumenta la risoluzione e il successo di identificazione della proteina. Esso consente anche di distinguere una proteina che differiscono solo nelle loro modifiche di posttranslational. Inoltre, Macchiarsi nordico nativo blu può essere applicato per identificare i componenti di RNA in complessi macromolecolari. Indichiamo che il nostro protocollo è adatto per svelare le proteine e RNA componenti di proteine: proteina nativa e complessi della ribonucleoproteina (RNP) che si verificano nei campioni del floema. Combinando un blu PAGE nativo con due diverse fasi di pagina denaturazione può aiutare a separare i diversi tipi di complessi proteici grande e consente inoltre un tasso aumentato di identificazione dei loro componenti mediante spettrometria di massa. Inoltre, il protocollo è abbastanza robusto per rilevare contemporaneamente acidi nucleici potenzialmente associati all'interno di complessi di singole proteine.
Introduzione
I condotti a lunga distanza del floema sono essenziali per la ripartizione dei nutrienti organici nelle piante superiori, ma sono anche coinvolti nella regolazione di molti processi differenti importanti per la crescita e lo sviluppo, difesa degli agenti patogeni e l'adattamento alle avverse condizioni ambientali. Oltre a piccoli effettori come ioni, fitormoni o metaboliti stessi, macromolecole come proteine ed RNA recentemente sono emerso come segnali di potenziali.
Gli studi hanno indicato che il caricamento del floema delle proteine è dimensione dipendente e controllato dal limite di esclusione di formato (SEL) delle unità poro-plasmodesmal collega compagno cellule (CC) ed il setaccio elementi (SE) che sono in genere nel range di 10-> 67 kDa1 , 2 , 3. Tuttavia, nonostante queste proteine più grandi limitazioni di dimensioni e proteina complessi sono stati trovati all'interno del sistema di floema sfidando l'idea di dimensione esclusione4, e anche non specifico perdita di proteine da CC a SE è stato suggerito5 .
Complessi multiproteici, nonché grandi ribonucleoproteina giocano un ruolo fondamentale nella biosintesi e mantenimento dell'integrità strutturale della cellula6. C'è evidenza che complessi proteina-proteina e ribonucleoproteina floema-mobile esistano4,7, ma fino ad oggi si sa poco sulla loro funzione. In elementi di setaccio del floema: proteina e RNP complessi sono stati implicati con trasporto su lunghe distanze e / o segnalazione8,9. Per svelare le funzioni dei complessi spostati, lo studio della loro composizione in variabili ambientali o condizioni di stress sono necessarie. Per raggiungere questo obiettivo, nativi complessi devono essere isolato e loro componenti devono essere separati con una risoluzione sufficiente.
Per isolare i complessi ad alto peso molecolare da floema, è innanzitutto necessario ottenere campioni di sap in qualità e quantità sufficiente. La tecnica che può essere utilizzata per il campionamento del floema dipende la specie vegetali di interesse. Esistono tre metodi principali per ottenere sap floema 10: insetto stylectomy11, EDTA-facilitato essudazione12ed essudazione spontanea13.
Campioni del floema da thaliana di Arabidopsis (a. thaliana), l'impianto modello principali nei laboratori in tutto il mondo, può di EDTA-facilitato essudazione o afide stylectomy14,15. Entrambi i metodi portano a sap floema altamente diluite o importi molto basso del campione. EDTA-facilitato essudazione è anche soggetto a contaminazione e potrebbe non rappresentare il floema reale composizione16. Essudazione spontanea del floema è limitato a piantare specie come cucurbitacee, lupino o yucca, dove tagliare le parti della pianta porta a un'emissione spontanea di sap floema che possono essere facilmente raccolti13,17,18, 19. Abbiamo recentemente stabilito colza (Brassica napus) come un sistema di modello adatto per l'analisi del floema, poiché è un parente stretto di a. thaliana e diversi microlitri di sap floema possono essere ottenuti da piccole incisioni che ha dimostrato di essere di elevata purezza4,8,20. Inoltre, la sequenza del genoma di b. napus è stata rilasciata nel 201421.
Ad eccezione di afide stylectomy, tutti i metodi di raccolta del floema descritti includono il danneggiamento del tessuto presso il sito di campionamento circostante e la composizione della linfa del floema può cambiare in risposta alla lesione. Pertanto è indispensabile controllare la qualità dei campioni del floema, indipendentemente dal metodo di campionamento applicato. Ci sono diversi metodi per il controllo di qualità di sap floema raccolti, ad esempio tramite determinazione di RNAsi attività22,23, RT-PCR con primer contro Rubisco8,24o l'analisi dello zucchero composizione8.
Diversi metodi per isolare e separare i complessi della proteina possono essere applicati, tra cui la cromatografia di esclusione di formato, saccarosio densità ultracentrifugazione o filtrazione del campione attraverso membrane con peso molecolare distinti taglio off. Tuttavia, questi approcci non consentono ad alta risoluzione. La tecnica chiamata PAGE nativo blu (BN-PAGE), in primo luogo descritta da Schägger et al. 25, è superiore in termini di risoluzione. È stato usato con successo per determinare i pesi molecolari dei complessi della proteina nativa grande da vari organelli o da lisati cellulari e loro abbondanze relative26,27.
Per più ulteriormente delucidare la complessa composizione dei complessi della proteina, è necessario separare i singoli componenti sotto denaturare le condizioni, che portano al completo smontaggio di componenti complessi. Ciò può essere ottenuto da una seconda dimensione di SDS-PAGE 28,29 o, per raggiungere la più alta risoluzione, da una seconda dimensione di isoelettrofocalizzazione (IEF) seguita da un third dimension di SDS-PAGE30 e la successiva identificazione di le proteine mediante spettrometria di massa.
In questo protocollo, descriviamo il campionamento di sap floema puro da b. napus piante e l'analisi dei complessi della proteina da tali esempi di floema utilizzando un approccio elettroforetico 3D combinando BN-PAGE con Tris-Tricine-urea-PAGE e SDS-PAGE. Le proteine separate componenti complessi vengono successivamente identificati mediante spettrometria di massa. Inoltre, introduciamo Macchiarsi nordico nativo blu come un metodo che permette la rilevazione di RNA in grande RNP complessi4, estendere l'applicabilità dell'approccio.
Protocollo
1. il campionamento e la preparazione di sap floema da b. napus piante 4,8,20
- Per sap floema di campionamento, utilizzare ben irrigato 8-settimana-vecchio che visualizza solo iniziale fioritura per evitare contaminazioni di polline di piante di b. napus .
- Utilizzare un ago ipodermico (Ø 0,8 mm) e punctate infiorescenza staminali diverse volte. Ripetere a numerosi altri fusti infiorescenza e su altre piante per ottenere abbastanza sap floema (Figura 2a).
Nota: Per analisi complesse, si consiglia di iniziare con almeno 600 µ l di sap del floema. 4 a 5 piante produrranno tra 200 e 700 µ l di sap del floema. - Eliminare la prima goccia dai siti feriti con carta da filtro. Queste gocce principalmente contengono materiale altamente contaminato dal circostante tessuto danneggiato e devono essere scartati.
- Raccogliere le gocce seguenti pipettando e memorizzare l'essudato raccolto in una provetta di reazione pre-refrigerati conico 1,5 mL a-20 ° C utilizzando un sistema di raffreddamento libero dai ghiacci.
- Continua a raccogliere fino a quando nessun ulteriore formazione di goccia è osservabile, ma non più di 1 h. Questa procedura può essere ripetuta dopo due giorni senza perdita significativa di sap floema raccolti.
Nota: La linfa del floema raccolti può essere usata immediatamente o conservata a-80 ° C per le analisi future. Per deposito di-80 ° C,-congelamento la provetta di reazione in azoto liquido. - Concentrare il campione di floema per circa 1/6th del volume iniziale usando concentratori centrifughi con un peso molecolare tagliato fuori (MWCO) di 10.000 Dalton (Da). Centrifugare il campione concentrato a 4 ° C e 20.000 x g per almeno 15 min rimuovere le particelle di polvere.
Nota: Concentrazione di sap floema non comporta una perdita significativa di proteine. - Per la successiva analisi complessa, procedere con il passaggio 3.1.
2. controllo della purezza floema sap mediante reverse transcriptase PCR (RT-PCR) 4,8,20
- Isolare il RNA totale da sap floema utilizzando un metodo di estrazione di RNA standard per materiale liquido (ad es. estrazione TRIzol o fenolo-cloroformio seguita da precipitazione di isopropanolo dalla fase acquosa ed etanolo lavatrice passi secondo il protocollo del produttore).
Attenzione: Fenolo-cloroformio è tossico. Lavorare sotto una cappa con indumenti protettivi appropriati. il RNA estratto può essere conservato in etanolo a-80 ° C per fino a sei mesi. - Rimuovere la contaminazione del DNA tramite digestione con dnasi I (1 u / µ g) per 45 min a 37 ° C e inattivare l'enzima con l'aggiunta di EDTA a una concentrazione finale di 5 mM e incubare il campione a 75 ° C per 10 min.
- Per ottenere RNA puro, purificare e concentrare il campione da un altro passaggio di purificazione (per esempio usando i kit di pulitura di RNA, secondo le istruzioni del produttore).
- Eseguire un reverse transcriptase PCR (RT-PCR) per la sintesi di cDNA con un kit di sintesi di cDNA utilizzando 150 ng di RNA puro come descritto dal produttore di protocollo.
Nota: Il cDNA può essere conservato a-20 ° C fino ulteriore uso. - Utilizzare 5 µ l di cDNA come modello per una reazione di PCR standard come specificato dal fabbricante, per amplificare vano specifici trascritti e verifica tramite l'elettroforesi del gel dell'agarosi. Confermare la purezza dei campioni del floema utilizzando ad esempio gli iniettori per subunità piccola rubisco, thioredoxin h e la proteina del cappotto di polline (Figura 1b, tabella 1).
3. blu nativo pagina 4,25,26,31
- Utilizzare entrambi self-colata gel gradiente nativo come descritto altrove27 o commerciale gel gradiente Bis-Tris.
- Carico 20-30 µ g del campione concentrato della proteina per pozzetto sul gel in almeno triplicates.
- Esegua il gel a 4 ° C e 150 V con catodo blu scuro buffer B e buffer di anodo (tabella 2) fino a quando il campione passato 1/3rd del gel (ca. 20-30 min, Figura 3a).
Nota: Per macchiarsi nordico, una corsia singola gel è sufficiente, mentre per l'analisi della composizione proteica di pagina 3D e spettrometria di massa che si consiglia di combinare la stessa banda da fino a dieci corsie di gel a concentrarsi meno abbondanti proteine. - Mettere in pausa l'esecuzione e cambio catodo blu scuro buffer B con luce blu catodo tampone B/10 (tabella 2) e continuare l'esecuzione. Finire il gel eseguito all'avvio parte anteriore blu eluire fuori il gel (ca. 120-180 min, Figura 3a).
Nota: Il finito Natale blu del gel può essere memorizzato a 4 ° C per almeno una settimana. Conservazione prolungata può portare a diffondere bande e dovrebbe essere evitata. Scuro blu tampone B può essere riutilizzato.
4. facoltativo: Rilevazione del RNA usando blu nativo northern blotting 4
- Tagliare le fasce distinte o usare la corsia di gel tutto dal blu gel nativo e trasferirli su una membrana di nylon di semi-secco macchiare a 3,5 mA/cm2 per 60 min e segnano il confine di gel superiore e inferiore con una matita sulla membrana (Figura 4a).
- Dopo blotting, lavare la membrana con acqua trattata con DEPC e asciugare tra due fogli di carta filtro.
- Eseguire UV-reticolazione della membrana blotted con 120.000 µ j/cm2 (85 s se utilizza il reticolante in Tabella materiali).
- Pre-ibridare la membrana con 6 mL di tampone di ibridazione (commerciale o self-made) per 60 min a 68 ° C in un forno di ibridazione (Figura 4a).
- Aggiungere un ulteriore 1 mL di tampone di ibridazione contenente 4 µ l di 3'-biotinylated sonde (100 nM).
- Incubare la membrana con la sonda in una notte, durante il raffreddamento del forno da 68 ° C a 37 ° C.
- Lavare la membrana con tampone contenente SDS x SSC e 0,1% 2, per 5 min a temperatura ambiente per rimuovere le sonde associati non specifico.
Attenzione: SDS possono causare irritazioni. Lavorando con SDS e soluzioni contenenti SDS, indossare guanti e camice da laboratorio. - Eseguire il rilevamento delle sonde 3'-biotinylated sulla membrana ad esempio con streptavidina-HRP-coniugato e luminol come substrato rafano perossidasi (HRP), provocando una reazione chemiluminescente sensibile (Figura 4a).
5. seconda dimensione: Tris-Tricine-urea pagina 4,28
- Accise singole bande dal blu gel nativo. Combinare le bande da campioni eseguiti in corsie parallele per ottenere un'ulteriore concentrazione di proteine complesse (Figura 5).
Nota: Asportati bande possono essere memorizzati in singole provette fino all'ulteriore utilizzo a 4 ° C. - Versare un gel di Tris-Tricine-urea 12% (spessore di 1 mm, 6,8 cm x 8,6 cm (larghezza x lunghezza)). Preparare 10 mL di soluzione di gel A per il gel di separazione (tabella 2), versare tra due lastre di vetro e overlay con isopropanolo. Rimuovere l'isopropanolo al termine della polimerizzazione e trasferire 4 mL di soluzione di gel B (tabella 2) per il gel d'impilamento sul gel e Inserisci che un 10 ben pettine.
Attenzione: Non polimerizzate acrilamide può essere neurotossico e TEMED è nocivo se inalato. Sempre indossare dispositivi di protezione individuale e lavorare sotto una cappa. - Trasferire le bande di gel asportato in una provetta di reazione da 1,5 mL e aggiungere 1 mL di tampone del campione SDS di equilibramento dei pezzi gel (Figura 5, tabella 2): 2x.
- Incubare i campioni per 10 min a temperatura ambiente prima dell'ebollizione in un blocco di riscaldamento (95 ° C) o in un forno a microonde e incubare i campioni nuovamente a temperatura ambiente per ulteriori 15 minuti.
- Impilare diversi pezzi di gel equilibrato nello stesso complesso che rappresenta in un gel singola tasca.
- Eseguire l'elettroforesi con anodo e catodo in esecuzione buffer a 150 V per 45-60 min e asportare la corsia di gel tutto.
- Incubare la corsia di taglio per 20 min nel buffer acide (100 mM Tris, acido acetico 100 mM) ed equilibrare in 125 mM Tris-HCl, pH 6,8 per un altro 20 min (Figura 5).
6. terza dimensione: SDS-PAGE 4,32
- Versare un 15% SDS che separa gel secondo Laemmli32 (spessore: 1,5 mm, 6,8 cm x 8,6 cm (larghezza x lunghezza)) (tabella 2) e aggiungere un sottile strato di un 4% stacking gel sopra.
Attenzione: SDS, acrilammide e TEMED sono tossiche e nocive. Lavorare sotto una cappa e indossare dispositivi di protezione individuale. - Trasferire la corsia equilibrato gel sul gel SDS e coprire il gel con 0,5% (w/w) agarosio in 1x SDS completati con una traccia di blu di bromofenolo (Figura 5) tampone di corsa.
- Bollire il tampone di corsa con agarosio nel microonde previo caricamento su gel di SDS.
- Per l'esecuzione di un marcatore di proteina per stimare i pesi molecolari dei singoli componenti, inserire un pezzo di carta da filtro su un'estremità del gel fino all'agarosio solidificato o utilizzare un pettine speciale utilizzato in genere per IPG gel.
- Esegua il gel a 150 V per 60 min e macchia il gel con Coomassie colloidale, macchia d'argento o di qualsiasi altro metodo di colorazione adatto per la successiva analisi di spettrometria di massa.
- Analizzare le macchie visibili proteine mediante spettrometria di massa approcci come desorbimento/ionizzazione laser assistito da matrice (MALDI-TOF) tempo di volo o spettrometria di massa LC-MS/MS.
Nota: Si consiglia di utilizzare il Coomassie colloidale colorazione come già descritto33. Nelle nostre mani, anche meno abbondanti proteine può essere sufficientemente macchiato e consente un'analisi di spettrometria di massa con qualità ragionevole dei dati.
Risultati
Qui presentiamo un protocollo che consente l'analisi della proteina/proteina così come complessi proteina-RNA in campioni di floema da Brassica napus. Il flusso di lavoro è illustrato nella Figura 1. Uno dei principali vantaggi di b. napus sopra altri organismi di modello è la possibilità di raccolta di campioni di floema relativamente facile da piccole forature nello stelo dell'infiorescenza. Questo permette di ottenere campioni di floema puro in quantità relativamente grandi. Durante il campionamento del floema, è sempre opportuno controllare per contaminazioni, per esempio da RT-PCR8. Un rappresentanza risultato ottenuto da un campione puro floema è raffigurato in Figura 2. Campioni del floema non contaminato devono mostrare una banda visibile per thioredoxin h, mentre nessun segnale per rubisco e la proteina del cappotto di polline dovrebbe apparire. La subunità piccola rubisco può servire come un controllo in campioni da foglie, Infiorescenza steli o polline. Thioredoxin h dovrebbe essere rilevabile in tutti i campioni, poiché suo mRNA è stato trovato nel floema delle diverse specie, mentre la trascrizione della proteina di polline cappotto dovrebbe essere solo visibile nei campioni di bocciolo di fiore. Contaminazioni possono verificarsi quando il floema campionamento viene effettuato alle piante da fiore (proteina del cappotto di polline) completamente o quando le goccioline prime dal floema forature di campionamento non vengono eliminate correttamente (rubisco).
Prima del BN-PAGE è obbligatorio per concentrare la linfa del floema. Utilizzando 20-30 µ g di proteina per pozzetto, almeno quattro bande complessi proteina principale diventano visibili dopo BN-PAGE di b. napus sap del floema, troppo basse o troppo alte concentrazioni non consentono una chiara separazione dei complessi (Figura 3). Si raccomanda di caricare diverse bande di gel che rappresenta lo stesso complesso in una tasca singola del gel seconda dimensione di concentrarsi ulteriormente le proteine da ogni singolo complesso per l'elaborazione a valle e successiva identificazione spettrometria di massa.
Per identificare i singoli componenti di complessi macromolecolari floema, abbiamo combinato la BN-pagina iniziale con una seconda dimensione Tris-Tricine-urea e una terza dimensione SDS-PAGE per ottenere una separazione di singole proteine. Qui, una separazione con alta risoluzione può essere osservata a causa dei comportamenti di migrazione differenti della proteina in urea e gel di SDS-PAGE. In genere, proteine appartenenti a un unico complesso sarà visibile come una linea diagonale attraverso il gel. Proteine sopra di questa linea hanno una maggiore idrofobicità, mentre proteine sotto la linea rappresentano quelli più idrofile28 (Figura 5, Figura 6).
Per la caratterizzazione di complessi di RNP, abbiamo usato una parte di un gel di BN-PAGE per eseguire BN Macchiarsi nordico. Dopo macchiarsi di un'intera lane su una membrana di nylon e reticolazione tramite radiazione UV, il RNA può essere visualizzato usando le sonde del RNA-specifico come illustrato nella Figura 4. Qui è indicato che è presente in un unico complesso specifico solo un tRNA specifico. Le componenti proteiche di questo complesso di tRNA-associazione possono essere ulteriormente approfondite utilizzando l'approccio di gel 3D sopra descritto. Analisi di spettrometrihe di massa ha dimostrato che questo complesso contiene principalmente tRNA-ligasi ciò che conferma l'attività obbligatoria di tRNA trovato da BN Macchiarsi nordico.
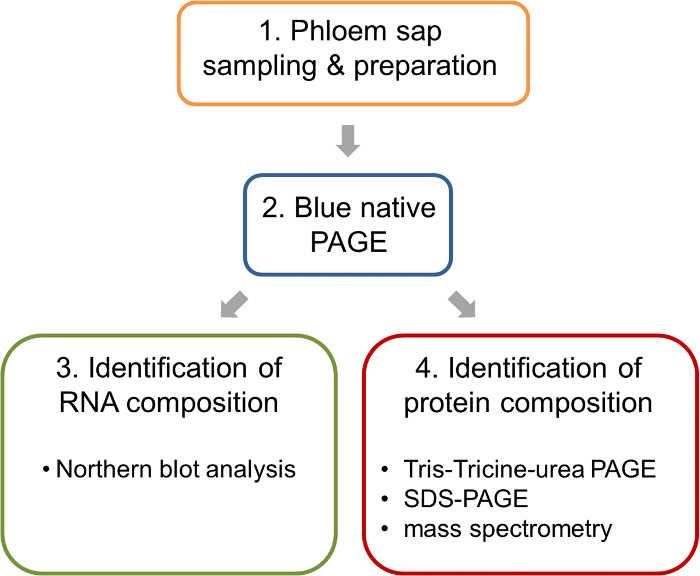
Figura 1: flusso dell'analisi dei complessi della ribonucleoproteina di lavoro nel sap floema della colza. Dopo il campionamento e preparazione dei campioni del floema, BN-PAGE viene eseguita per separare nativi complessi. Tale gel BN-PAGE permettono l'analisi parallela di acidi nucleici da BN Macchiarsi nordico e l'identificazione delle componenti proteiche dei complessi mediante spettrometria di massa. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: controllo di campionamento e la purezza di sap del floema di b. napus. Dopo perforare lo stelo dell'infiorescenza di oleaginose colza per 8-10 settimane vecchio con un ago ipodermico sterile, essudato è raccolto con una pipetta e trasferito in una provetta di reazione ghiacciata (a) per confermare la purezza dei campioni del floema CHE RT-PCR è effettuato, amplificando le trascrizioni di thioredoxin h e rubisco piccola unità secondaria della proteina del cappotto di polline in campioni di tessuto-specific RT-PCR (b) senza trascrittasi inversa è stata eseguita come controllo (-). Clicca qui per visualizzare una versione più grande di questa figura.
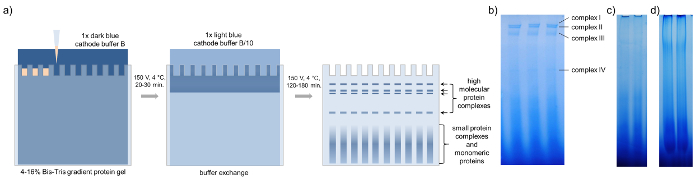
Figura 3: BN-PAGE. Rappresentazione schematica della pagina nativa blu con campioni di concentrato del floema di b. napus. (a) dopo il caricamento del gel di gradiente della proteina con 15-20 µ l di sap concentrato del floema, BN-PAGE viene eseguita con buffer da catodo blu scuro 1 x B 150 V per 20-30 minuti in una stanza fredda. Quindi il buffer viene scambiato contro tampone catodo blu luce 1x B/10 e la pagina è finita a 150 V per 120-180 min fino al blu scuro in esecuzione funzionamenti anteriori fuori il gel. I gel di BN-PAGE Visualizza quattro bande distinte che rappresentano quattro diversi complessi ad alto peso molecolare. (b) carico troppo poco (c) o troppo proteine del floema (d) riduce la visibilità dei singoli complessi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Macchiarsi nordico BN. Rappresentazione schematica della BN northern blotting metodo. (a) una corsia della BN-pagina viene trasferita su una membrana di nylon semi-asciugare tamponando. Dopo reticolazione UV e pre-ibridazione, la membrana viene incubata con sonde specifiche di RNA (sonda qui una metionina tRNA-specifica), che sono biotinilati all'estremità 3' in un forno di ibridazione tutta la notte. Gratuito sonde vengono rimossi da fasi di lavaggio e la rilevazione del RNA avviene tramite una streptavidina-HRP coniugato e luminol. Usando questo approccio, abbiamo osservato che il complesso IV da BN-PAGE contiene metionina tRNA. (b) il gel di Coomassie macchiato e la macchia di tRNA assomigliano a due corsie di diversi gel eseguire in parallelo per evitare differenze di migrazione. Clicca qui per visualizzare una versione più grande di questa figura.
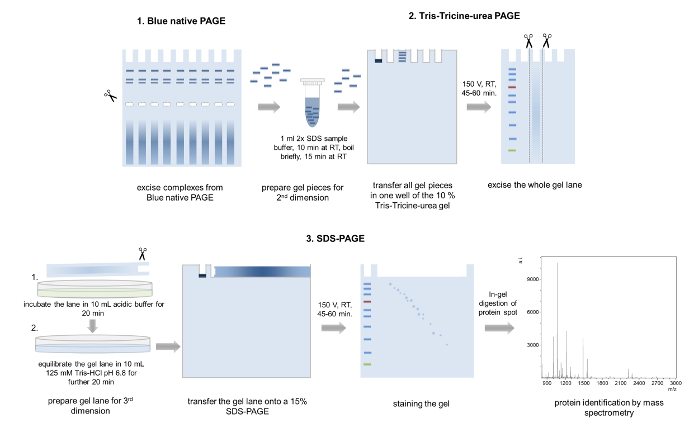
Figura 5: 3D-pagina. Rappresentazione schematica dell'approccio 3D-pagina. Diverse band dal complesso stesso sono asportati da un gel di BN-PAGE, incubato in tampone di caricamento e trasferito in un pozzo della seconda dimensione Tris-Tricine-urea-PAGE. Dopo l'elettroforesi, gel tutto corsie sono tagliate, lavate in tampone acido acida, equilibrate e collocate su un gel di SDS-PAGE 15%. Dopo la terza dimensione pagina, le proteine separate sono Coomassie macchiati e analizzati mediante spettrometria di massa. Clicca qui per visualizzare una versione più grande di questa figura.
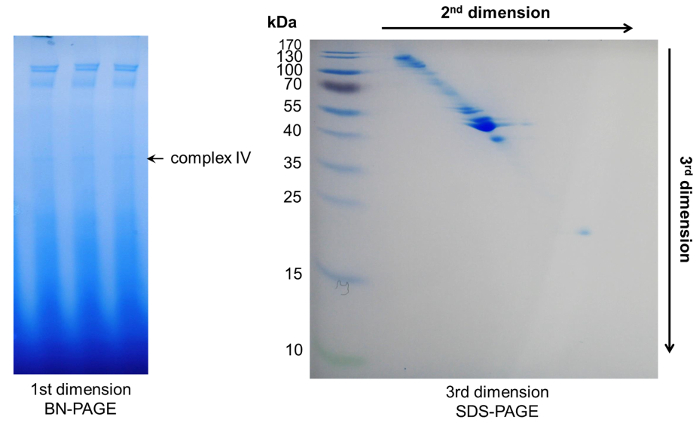
Figura 6: rappresentante risultati dopo 3D-pagina. All'interno della prima dimensione BN-PAGE è apparso diversi complessi. Loro componenti proteiche potrebbero essere ulteriormente separati da due pagine successive di denaturazione, risultante in un spot modello diagonale. Clicca qui per visualizzare una versione più grande di questa figura.
| Sonda | Sequenza |
| Thioredoxin h |
Avanti: CTCAAGGCAGCCAAAGAATC inversa: ATGGCCTGAACATCGAACTC |
| RubisCO piccola catena |
Avanti: TTCACCGGCTTGAAGTCATC inversa: CCGGGTACTCCTTCTTGCAT |
| Proteina di polline cappotto BRU77666 |
Avanti: TCAGAACTGGAGCTTCAACG inversa: TTCCTTAATGGCCTCAGTGG |
Tabella 1: primer usati per controllo della purezza del campione del floema. Per confermare la purezza del campione del floema primer specifici per rubisco piccola catena, thioredoxin h e proteina del cappotto di polline può essere utilizzato per l'amplificazione del cDNA.
| Buffer e soluzioni | Contenuto | Commento | |
| buffer di catodo blu scuro B | 15 mM Bis-Tris a pH 7.0 50 mM Tricine 0.02% (p/v) blu di Coomassie G250 | ricetta è adattata dalla Fiala et al. 17 pH dovrebbe essere regolata a 7.0 Buffer può essere fatto come uno stock di 10 x | |
| buffer di luce catodo blu B/10 | 15 mM Bis-Tris a pH 7.0 50 mM Tricine 0,002% (p/v) blu di Coomassie G250 | Buffer può essere preparata diluendo buffer catodo B con buffer di catodo senza Coomassie | |
| buffer di anodo |
50 mM Bis-Tris a pH 7.0 | Buffer può essere preparato come un 10 x soluzione stock | |
| 2 x tampone campione SDS |
125 mM Tris-HCl a pH 6.8 4% SDS 20% glicerolo 0,2 M DTT blu di bromofenolo 0.02% (p/v) | ||
| Tampone di trasferimento buffer 1 x TBE |
89 millimetri Tris pH 7,6 acido borico 89 mM 2 mM EDTA | Tampone TBE può essere fatto e memorizzati come scorta di 5x o 10x. È importante utilizzare RNAsi-libera deionizzata acqua. | |
| 2 x buffer di SSC |
300 mM NaCl citrato a pH 30mm Na37.0 | ||
| 3 x gel tampone |
Tris di 3 M 1 M HCl 0,3% SDS pH 8,45 | Ricetta adattata da Schägger 19 | |
| Tris-Tricine gel soluzione A |
Per 10ml: 30% acrilammide-bisacrylamide (29: 1) 3,34 mL 6 M Urea 3 x gel mL 3,34 del buffer 70% glicerolo 1,4 mL aggiungere ddH2O 10 mL 10% APS 40 Μ l Μ L DI TEMED 4 | Peso 6 M Urea e aggiungere 3 x buffer del gel, la soluzione di acrilammide-bisacrylamide e 70% gycerol. Riscaldare a 60 ° C in bagnomaria a solubilizzare l'urea. Aggiungere ddH2O 10 mL, 10% APS e infine TEMED per polimerizzazione. | |
| Tris-Tricine gel soluzione B |
Per 6 mL: 30% acrilammide-bisacrylamide (29: 1) 0,8 mL 6 M Urea 3 x 1,5 mL di buffer di gel aggiungere ddH2O 6 mL 10% APS 45 Μ l Μ L DI TEMED 4.5 | Peso 6 M Urea e aggiungere 3 x soluzione tampone e acrilammide-bisacrylamide gel. Riscaldare a 60 ° C in bagnomaria a solubilizzare l'urea. Aggiungere ddH2O 10 mL, 10% APS e infine TEMED per polimerizzazione. | |
| 1 x Tris-Tricine tampone in esecuzione (anodo) |
100 mM Tris 22,5 mM HCl pH 8,9 | Ricetta adattata da Schägger 19 | |
| 1 x Tris-Tricine tampone in esecuzione (catodo) |
100 mM Tris 100 mM Tricine 1% SDS pH 8.25 | Ricetta adattata da Schägger 19 | |
| Tampone acido |
100 mM Tris 100 mM acido acetico | ||
| 4% gel d'impilamento di SDS |
Per 2 mL: ddH2O 1.4 mL 30% acrilammide-bisacrylamide (37.5:1) 0,33 mL 1 M Tris pH 6,8 0,25 mL 10% SDS 20 Μ l 10% APS 20 Μ l Μ L DI TEMED 2 | ||
| 15% SDS gel di separazione |
Per 10ml: ddH2O 2.3 mL 30% acrilammide-bisacrylamide (37.5:1) da 5 mL 1,5 M Tris pH 8,8 2.5 mL 10% SDS 100 Μ l 10% APS 100 Μ l Μ L DI TEMED 4 | ||
| 1x buffer in esecuzione SDS |
25 mM Tris glicina 192 mM 0,1% SDS | ||
| Soluzioni di colorante Coomassie |
-(14-18)-idrato del solfato di alluminio di 5% (p/v) 10% (v/v) etanolo (96%) 2% (v/v) acido ortofosforico (85%) 0.02% (p/v) G-250 Coomassie Brilliant Blue | ||
| Tampone di ibridazione ultrasensibile ULTRAhyb | Ambion, Life Technologies | ||
Tabella 2: soluzioni e ricette del buffer. Elenco di tutte le soluzioni necessarie per l'analisi 3D-pagina e buffer.
| Spot n. | OBS. MW [kDa] | Identificazione | Organismo | No di adesione. | MW [kDa] | Punteggio di mascotte | |
| CIV_1 | 130 | Proteina di presunta malattia resistenza At4g19050 | B. napus | CDX78917 | 131,1 | 110 | |
| CIV_2 | 130 | Proteina di presunta malattia resistenza At4g19050 | B. napus | CDX78917 | 131,1 | 89 | |
| CIV_3 | 100 | Proteina da shock 70 kDa 14-come termico | B. napus | XP_013748865 | 89,9 | 113 | |
| CIV_4 | 90 | Fattore di allungamento eucariotico 2 Controllare la divisione cellulare omologo 48 proteina A | B. napus B. napus | CDX90241 CDY41316.1 | 89,5 89,5 | 111 197 | |
| CIV_5 | 85 | 90-2-come proteina di scossa di calore | B. rapa | XP_009132342 | 79,8 | 172 | |
| CIV_6 | 80 | Treonina - ligasi di tRNA Glicina - ligasi di tRNA | B. oleracea B. napus | XP_013599115 CDY43195 | 81,5 80,8 | 110 88 | |
| CIV_7 | 70 | Heat shock protein 70 kDa Lisina - tRNA ligasi-come | B. oleracea B. napus | XP_013685267 XP_013747530 | 67,8 69,9 | 230 150 | |
| CIV_8 | 65 | Mirosinasi Aspartato - ligasi tRNA 2 Asparagina - ligasi tRNA 1 | B. napus B. napus B. napus | ABQ42337 XP_013670803 XP_013729126 | 60,6 61,6 63,5 | 183 141 153 | |
| CIV_9 | 60 | Mirosinasi | B. napus | ABQ42337 | 60,6 | 164 | |
| CIV_10 | 55 | Adenosylhomocysteinase 2-come | B. rapa | XP_009135865 | 53,1 | 139 | |
| CIV_11 | 55 | 1-alfa 1-come di fattore di allungamento | B. oleracea | XP_013586115 | 51,9 | 26R | |
| CIV_12 | 50 | Liasi di cistina CORI3-come | B. napus | XP_013653143 | 48,1 | 237 | |
| CIV_13 | 44 | Liasi di cistina CORI3-come | B. rapa | XP_009108611 | 48,3 | 213 | |
| CIV_14 | 38 | Fruttosio-bifosfato aldolasi | B. rapa | XP_009115993 | 38,4 | 226 | |
| CIV_15 | 45 | Liasi di cistina CORI3-come | B. rapa | XP_009108611 | 48,3 | 219 | |
| CIV_16 | 45 | Liasi di cistina CORI3 | B. rapa | CDY69765 | 46,9 | 209 | |
| CIV_17 | 38 | Fruttosio-bifosfato aldolasi | B. rapa | XP_009115993 | 38,4 | 124 | |
| CIV_18 | 18 | Peptidil-prolil isomerasi cis-trans CYP18-3-come | B. napus | XP_009101932 | 18,3 | 128 | |
| CIV_19 | 45 | Liasi di cistina CORI3-come | B. rapa | XP_009108611 | 48,3 | 177 | |
Tabella 3: identificati componenti proteiche dal complesso IV. Diverse ligasi di tRNA e ulteriori proteine sono stati trovati all'interno del complesso di associazione tRNA mediante MALDI-TOF analisi spettrometrica di massa dopo 3D-pagina.
Discussione
Il floema è un comparto di grande interesse, poiché costituisce la via di trasporto principali per fotoassimilati ed è anche essenziale per la segnalazione a lunga distanza tra piante diverse parti9,20,34, 35. Oltre a piccole molecole, macromolecole come proteine ed RNA sono stati implicati con manutenzione del floema e segnalazione4,7,8. L'analisi della composizione del floema è limitato dall'accessibilità limitata ai campioni del floema nella maggior parte delle specie di piante. La tecnica del mandrino dell'insetto è ampiamente applicabile, ma sperimentalmente esigenti e si traduce in quantità molto piccole di floema campioni11. Una tecnica facile utilizzata per il campionamento del floema è EDTA-facilitato essudazione12. EDTA chelata ioni bivalenti come calcio e quindi impedisce la chiusura del setaccio piastre di P-proteine e callosio. È facile da usare, ma è soggetto a contaminazione da parte di cellule danneggiate e campioni vengono diluiti. Che riducono gli ioni bivalenti con EDTA potrebbe anche portare ad una rottura dei complessi esistenti. Tuttavia, esso consente il campionamento da una vasta gamma di specie tra cui l'impianto di modello di a. thaliana15. Essudazione spontanea di sap floema si verifica solo in un piccolo numero di specie di piante. È un metodo invasivo che coinvolge la ferita significativa di pianta tessuti10. Recentemente abbiamo stabilito b. napus come una specie di modello per studiare il trasporto a lunga percorrenza4,8,20. Qui, sap floema possono essere campionati da piccole incisioni, che riduce gli effetti pungenti e fonti di contaminazione.
Utilizzando tecniche di campionamento diverso, il proteoma dei campioni del floema da diverse specie vegetali è stato studiato in anni recenti7,8,17,36,37, 38,39. Per questi studi di proteomica, proteine sono state estratte e precipitate sotto condizioni di denaturazione e pertanto non consentono conclusioni sulla proteina/proteina e proteina: interazioni acido nucleico presentano in condizioni native. Sovrapposizione dosaggi e co-immunoprecipitazione (CoIP) hanno indicato che una ribonucleoproteina principale complessa potrebbe esistere in sap floema da zucca40, ma non è stato dimostrato che qualsiasi complessi macromolecolari esistono condizioni nativo all'interno del sistema del floema.
Blu PAGE nativo, introdotta da Schägger et al. 26, in combinazione con passaggi di elettroforesi su gel ad alta risoluzione successiva attivare la separazione dei singoli componenti dei complessi della proteina grande. Usando le analisi 3D-pagina di nativo b. napus essudato del floema, recentemente potremmo dimostrare che parecchi RNP complessi e ad alto peso molecolare della proteina: esistono nei campioni del floema e sono enzimaticamente attivo4. Metodi alternativi per isolare i complessi della proteina come pure RNP come cromatografia di esclusione di formato potrebbero esistere, ma non in termini di risoluzione rispetto ai BN-PAGE. Inoltre, per una ragionevole qualità della separazione complessi, matrici di dimensione esclusione colonna devono essere adattato secondo i pesi molecolari nel complesso complessi indagati. L'analisi di complessi di diverse dimensioni richiederà pertanto diversi tipi di colonne che è costosa e non è consentito come messa a fuoco ad alta potenza come una BN-PAGE.
Passaggi critici per analizzare complessi da b. napus comprendono la quantità totale di floema sap utilizzato come materiale di partenza. Almeno 600 µ l di campione del floema sono necessari e possono essere ottenuti da cinque piante ben irrigate. Per 3D-pagina e BN Macchiarsi nordico è necessario avviare il gel BN iniziale con una quantità sufficiente di campioni del floema. Per raggiungere questo obiettivo, i campioni del floema sono concentrati fino a 20 a 30 µ g di proteina possono essere caricati in ogni bene e almeno triplici copie dello stesso campione vengono eseguiti in parallelo. Concentrazioni troppo basse o troppo alte riducono la rilevazione dei complessi (Figura 3). Floema campioni devono essere raccolti in provette di reazione sul ghiaccio e devono essere conservati congelati per un uso successivo evitare fatturato e degradazione delle proteine. Inibitori della proteasi sono stati trovati in tutti i proteomi di floema analizzati, ma anche un proteasoma pienamente attiva è stata descritta nel floema delle b. napus4. Inoltre, volume e composizione dei campioni di floema dipendono il tempo-punto di campionamento e condizioni ambientali10. Pertanto si deve prestare attenzione a raccogliere allo stesso tempo del giorno in condizioni simili. Trattamenti (ad es. la siccità) possono ridurre la quantità di floema che possa essere raccolti. Per identificare singole proteine tramite spettrometria di massa, è obbligatorio limitare contaminazioni possibili cheratina di guanti da portare tutto il tempo. Cheratina porta a segnali addizionali durante l'analisi di massa spec e ostacola l'identificazione della proteina. Esecuzione della BN-pagina ad una tensione superiore o a temperatura ambiente può portare a riscaldamento del gel che potrebbero tradursi in smontaggio dei complessi fragile.
Il protocollo qui presentato è adatto per l'analisi dei complessi proteina/proteina. Mostriamo anche che può essere utilizzato per rilevare specifici RNA contenuto nei complessi in parallelo. Per raggiungere questo obiettivo, abbiamo recentemente introdotto un protocollo per i BN northern blotting4. RNAs sono inclini alla degradazione da contaminazioni di RNAsi. Per limitare tale degradazione DEPC-trattati, acqua deve essere utilizzato.
Principali limitazioni del metodo presentato includono la stima del peso molecolare di complessi proteici separati da BN-PAGE, poiché il comportamento di migrazione dipende dalle dimensioni, forma e anche su modifiche di posttranslational dei complessi31, 41. Stima delle dimensioni dei complessi RNP è ancora più complicata a causa dell'influenza degli acidi nucleici sul comportamento di migrazione. Può anche non essere prevenuta che complessi della stessa dimensione co-migrano in una singola banda. Questo può portare alla previsione errata delle composizioni complesse. Pertanto verificare le interazioni osservate con tecniche complementari, ad esempio da saggi funzionali4, potrebbe essere necessario. Anche proteine solo debolmente o transitoriamente associate ad un complesso macromolecolare potrebbero essere perso in BN buffer utilizzato. Per evitare questo, campioni potrebbero essere reticolati, ciò che può anche portare a manufatti o può impedire l'identificazione della proteina, o le condizioni di buffer possono essere ottimizzate.
In contrasto con il classico 2D-PAGE, la combinazione di urea e di SDS-PAGE permette la separazione secondo idrofobicità e peso molecolare invece di punto isoelettrico (pI) e peso molecolare 28e non limita la separazione di proteine di un spettro specifico pI. Proteine simili alla classica 2D-PAGE, separate sono visibili come punti singoli, ma su una diagonale linea 4,28 (Figura 5, , Figura 6). Altre proteine idrofobiche compaiono nei punti sopra la diagonale, mentre più proteine idrofiliche si trovano sotto la linea28. Le concentrazioni di poliacrilammide utilizzate nel presente protocollo saranno ben separare le proteine tra 25 a 80 kDa. Per consentire la separazione delle proteine più piccole o più grandi il poliacrilammide concentrazione può essere variata o gel gradiente può essere utilizzato nella terza dimensione. I componenti del complesso IV (Figura 3) separati da 3D-pagina (Figura 6) sono stati tagliati fuori, tripsina digerito ed analizzati mediante spettrometria di massa. Ciò ha provocato l'identificazione di diverse ligasi di tRNA. I componenti dei altri complessi sono stati recentemente pubblicati 4. Il nostro 3D-pagina abilitata la separazione delle diverse ligasi, vale a dire aspartato, asparagina, treonina, lisina e glicina ligasi, con pesi molecolari simili (tabella 3). Utilizzando una sonda di tRNA-specific di metionina, siamo stati in grado di rilevare il tRNA potenzialmente associati all'interno del complesso IV, ma se full-length tRNA o frammenti di tRNA sono nel complesso non possono essere discriminati con le sonde utilizzate. Per verificare se gli acidi nucleici sono davvero legato all'interno del complesso e non co-migrazione, proteasi digerito sap floema campioni potrebbero servire come controlli di migrazione adatto.
Si è ipotizzato, all'inizio, che la traduzione della proteina può verificarsi all'interno di tubi cribrosi del floema, poiché quasi la maggior parte dei componenti del ribosoma intero così come i fattori di allungamento sono stati trovati nel floema campioni4,7. La nostra individuazione del tRNA e ligasi tRNA sembra supportare questa idea. Tuttavia, frammenti di tRNA presenti nei campioni del floema di zucca sono stati indicati per essere inibitori potenti di traduzione42 e ribosomi funzionali sembrano essere assenti4, suggerendo che la traduzione non può avvenire.
Presi insieme, il protocollo presentato qui consente la separazione di proteine: proteina nativa e persino RNP complessi da campioni del floema e la separazione e l'identificazione dei loro singoli componenti con alta risoluzione. L'applicazione di questo metodo consente la scoperta di nuova proteina e RNP complessi nei campioni del floema e pertanto può delucidare nuove funzioni in questo compartimento pianta altamente specializzati.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo Jennifer Deke e Urszula Zarzenska per il loro sostegno scientifico. Questo lavoro è stato sostenuto finanziariamente da una sovvenzione di integrazione di carriera (CIG, 0734 PCIG14-GA-2013-63) dalla Commissione europea nell'ambito del 7 ° programma quadro, la sovvenzione LFF-GK06 'DELIGRAH' (Landesforschungsförderung Hamburg) e della concessione di DFG (DFG KE 856_6-1) assegnato a JK.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL reaction tubes | Eppendorf | 30120086 | |
| 10 well comb for SDS PAGE, thickness 1 mm | BioRad | 1653359 | |
| 2-Propanol | AppliChem | 131090 | |
| 30 % Acrylamide-bisacrylamide solution (29:1) solution | BioRad | 1610156 | |
| 30 % Acrylamide-bisacrylamide solution (37.5:1) solution | BioRad | 1610158 | |
| 96 % Ethanol | Carl Roth | P075 | |
| Acetic acid | Carl Roth | 6755 | |
| Agarose | Lonza | 50004 | |
| Aluminum sulfate-(14-18)-hydrate | AppliChem | 141101 | |
| Ammonium peroxodisulfate (APS) | Carl Roth | 9592.3 | |
| Bis-Tris | AppliChem | A3992 | |
| Boric acid | AppliChem | A2940 | |
| Bromophenol blue | AppliChem | A2331 | |
| Centrifugal concentrators e.g. Vivaspin 500 (Mwco 10 kDa) | Sartorius | VS0102 | |
| Chemiluminescent Nucleic Acid Detection Module Kit | Thermo Fisher Scientific | 89880 | |
| Chromatography papers e.g. 3 mm CHR | Whatman | 3030-153 | |
| CoolBox M30 System | Biocision | BCS-133 | |
| Coomassie brilliant Blue G-250 | AppliChem | A3480 | |
| Diethyl pyrocarbonate (DEPC) | AppliChem | A0881 | |
| Dithiothreitol (DTT) | AppliChem | A1101 | |
| DNase I | AppliChem | A3778 | |
| Ethanol abs. | AppliChem | A3693 | |
| Ethylenediaminetetraacetic acid (EDTA) | AppliChem | A1103 | |
| Gel Imaging system e.g. Chemidoc Touch | BioRad | 1708370 | |
| GeneRuler 1kb plus | Thermo Fisher Scientific | SM1331 | |
| Glycerol | AppliChem | 141339 | |
| Glycine | AppliChem | 131340 | |
| Heating block TS1 | Biometra | 846-051-500 | |
| Hybridization oven e.g. GFL Hybridization Incubator 7601 | GFL | 7601 | |
| Hypodermic needle (0.8 mm) | B Braun | 4658309 | |
| IPG gel comb, thickness 1 mm | BioRad | 1653367 | |
| Labeling of RNA e.g.Biotin 3'end DNA Labeling Kit | Thermo Fisher Scientific | 89818 | |
| Native gradient gel e.g. Novex NativePAGE 4–16% Bis-Tris protein gel | Invitrogen | BN1002BOX | |
| Nylon membrane e.g. Hybond-N+ | Amersham Pharmacia | RPN203B | |
| Ortho-phosphoric acid | Carl Roth | 6366.1 | |
| PageRuler prestained protein ladder | Thermo Fisher Scientific | 26616 | |
| Power supply for Gel electrophoresis EPS | Amersham Pharmacia | 18-1130-01 | available from GE Healthcare |
| RNA Cleanup Kit | Qiagen | 74204 | |
| Semi dry blot e.g. Fastblot 43B semi dry Blot | Biometra | 846-015-100 | |
| Sodium chloride (NaCl) | AppliChem | A1149 | |
| Sodium dodecyl sulfate (SDS) | AppliChem | 142363 | |
| Synthesis of cDNA e.g. RevertAid First Strand cDNA Synthesis Kit | Thermo Fisher Scientific | K1621 | |
| Tetramethylethylenediamine (TEMED) | AppliChem | A1148 | |
| Tricine | AppliChem | A3954 | |
| Tris | AppliChem | A1086 | |
| Tri-sodium citrate dihydrate | AppliChem | A3901 | |
| TRIzol Reagent | Thermo Fisher Scientific | 15596026 | |
| ULTRAhyb Ultrasensitive Hybridization Buffer | Thermo Fisher Scientific | AM8670 | |
| Urea | AppliChem | A1360 | |
| UV Crosslinker e.g. Stratalinker 2400 | Agilent | NC0477671 | from Fisher Scientific |
| Vertical electrophoresis apparatus e.g.The XCell SureLock Mini-Cell or Mini-Protean III System | Thermo Fisher Scientific or BioRad | EI0001 or 1658004 | |
| Wipers e.g. KIMWIPES Delicate Task Wipers | Kimberly-Clark | 34120 |
Riferimenti
- Kempers, R., van Bel, A. J. E. Symplasmic connections between sieve element and companion cell in the stem phloem ofVicia faba L. have a molecular exclusion limit of at least 10 kDa. Planta. 201 (2), 195-201 (1997).
- Stadler, R., et al. Expression of GFP-fusions in Arabidopsis companion cells reveals non-specific protein trafficking into sieve elements and identifies a novel post-phloem domain in roots. Plant J. 41 (2), 319-331 (2005).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11 (3), 309-322 (1999).
- Ostendorp, A., et al. Functional analysis of Brassica napus phloem protein and ribonucleoprotein complexes. New Phytol. 214 (3), 1188-1197 (2017).
- Paultre, D. S. G., Gustin, M. -. P., Molnar, A., Oparka, K. J. Lost in Transit: Long-Distance Trafficking and Phloem Unloading of Protein Signals in Arabidopsis Homografts. Plant Cell. 28 (9), 2016-2025 (2016).
- Sali, A., Glaeser, R., Earnest, T., Baumeister, W. From words to literature in structural proteomics. Nature. 422 (6928), 216-225 (2003).
- Lin, M. -. K., Lee, Y. -. J., Lough, T. J., Phinney, B. S., Lucas, W. J. Analysis of the Pumpkin Phloem Proteome Provides Insights into Angiosperm Sieve Tube Function. Mol. Cell. Proteomics. 8 (2), 343-356 (2008).
- Giavalisco, P., Kapitza, K., Kolasa, A., Buhtz, A., Kehr, J. Towards the proteome of Brassica napus phloem sap. Proteomics. 6 (3), 896-909 (2006).
- Lucas, W. J., Yoo, B. C., Kragler, F. RNA as a long-distance information macromolecule in plants. Nat. Rev. Mol. Cell. Bio. 2 (11), 849-857 (2001).
- Dinant, S., Kehr, J. Sampling and Analysis of Phloem Sap. Plant Mineral Nutrients. 953, 185-194 (2013).
- Kennedy, J. S., Mittler, T. E. A Method of obtaining Phloem Sap via the Mouth-parts of Aphids. Nature. 171 (4351), 528 (1953).
- King, R. W., Zeevaart, J. A. Enhancement of Phloem exudation from cut petioles by chelating agents. Plant Physiol. 53 (1), 96-103 (1974).
- Alosi, M. C., Melroy, D. L., Park, R. B. The regulation of gelation of Phloem exudate from cucurbita fruit by dilution, glutathione, and glutathione reductase. Plant Physiol. 86 (4), 1089-1094 (1988).
- Dinant, S., Bonnemain, J. -. L., Girousse, C., Kehr, J. Phloem sap intricacy and interplay with aphid feeding. Comptes rendus biologies. 333 (6-7), 504-515 (2010).
- Tetyuk, O., Benning, U. F., Hoffmann-Benning, S. Collection and analysis of Arabidopsis phloem exudates using the EDTA-facilitated Method. J Vis Exp. (80), e51111 (2013).
- Kovalskaya, N., Owens, R., Baker, C. J., Deahl, K., Hammond, R. W. Application of a modified EDTA-mediated exudation technique and guttation fluid analysis for Potato spindle tuber viroid RNA detection in tomato plants (Solanum lycopersicum). J. Virol. Methods. 198, 75-81 (2014).
- Rodriguez-Medina, C., Atkins, C. A., Mann, A. J., Jordan, M. E., Smith, P. M. Macromolecular composition of phloem exudate from white lupin (Lupinus albus L). BMC Plant Biol. 11 (1), 36 (2011).
- Taylor, J. S., Thompson, B., Pate, J. S., Atkins, C. A., Pharis, R. P. Cytokinins in the Phloem Sap of White Lupin (Lupinus albus L.). Plant Physiol. 94 (4), 1714-1720 (1990).
- Yoo, B., et al. A Systemic Small RNA Signaling System in Plants. Plant Cell. 16 (8), 1979-2000 (2004).
- Buhtz, A., Springer, F., Chappell, L., Baulcombe, D. C., Kehr, J. Identification and characterization of small RNAs from the phloem of Brassica napus. Plant J. 53 (5), 739-749 (2008).
- Chalhoub, B., et al. Plant genetics. Early allopolyploid evolution in the post-Neolithic Brassica napus oilseed genome. Science. 345 (6199), 950-953 (2014).
- Sasaki, T., Chino, M., Hayashi, H., Fujiwara, T. Detection of several mRNA species in rice phloem sap. Plant Cell Phys. 39 (8), 895-897 (1998).
- Doering-Saad, C., Newbury, H. J., Bale, J. S., Pritchard, J. Use of aphid stylectomy and RT-PCR for the detection of transporter mRNAs in sieve elements. J Exp. Bot. 53 (369), 631-637 (2002).
- Ruiz-Medrano, R., Xoconostle-Cázares, B., Lucas, W. J. Phloem long-distance transport of CmNACP mRNA: implications for supracellular regulation in plants. Dev. 126 (20), 4405-4419 (1999).
- Schägger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Fiala, G. J., Schamel, W. W. A., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. (48), e2164 (2011).
- Rais, I., Karas, M., Schägger, H. Two-dimensional electrophoresis for the isolation of integral membrane proteins and mass spectrometric identification. Proteomics. 4 (9), 2567-2571 (2004).
- Schägger, H. Tricine-SDS-PAGE. Nature protocols. 1 (1), 16-22 (2006).
- Wittig, I., Braun, H. -. P., Schägger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Eubel, H., Braun, H. -. P., Millar, A. H. Blue-native PAGE in plants: a tool in analysis of protein-protein interactions. Plant Methods. 1 (1), 11 (2005).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Turnbull, C. G. N., Lopez-Cobollo, R. M. Heavy traffic in the fast lane: long-distance signalling by macromolecules. New Phytol. 198 (1), 33-51 (2013).
- Hall, S. M., Baker, D. A. The chemical composition of Ricinus phloem exudate. Planta. 106 (2), 131-140 (1972).
- Barnes, A., Bale, J., Constantinidou, C., Ashton, P., Jones, A., Pritchard, J. Determining protein identity from sieve element sap in Ricinus communis L. by quadrupole time of flight (Q-TOF) mass spectrometry. J. Exp. Bot. 55 (402), 1473-1481 (2004).
- Walz, C., Giavalisco, P., Schad, M., Juenger, M., Klose, J., Kehr, J. Proteomics of curcurbit phloem exudate reveals a network of defence proteins. Phytochemistry. 65 (12), 1795-1804 (2004).
- Walz, C., Juenger, M., Schad, M., Kehr, J. Evidence for the presence and activity of a complete antioxidant defence system in mature sieve tubes. Plant J. 31 (2), 189-197 (2002).
- Kehr, J. Phloem sap proteins: their identities and potential roles in the interaction between plants and phloem-feeding insects. J Exp. Bot. 57 (4), 767-774 (2006).
- Ham, B. -. K., Brandom, J. L., Xoconostle-Cázares, B., Ringgold, V., Lough, T. J., Lucas, W. J. A polypyrimidine tract binding protein, pumpkin RBP50, forms the basis of a phloem-mobile ribonucleoprotein complex. Plant Cell. 21 (1), 197-215 (2009).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J. Immunol. Methods. 252 (1-2), 171-174 (2001).
- Zhang, S., Sun, L., Kragler, F. The phloem-delivered RNA pool contains small noncoding RNAs and interferes with translation. Plant Physiol. 150 (1), 378-387 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon