A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת רשת ספין-סריג הרפיה השדה המגנטי של היפרקוטב [1-13ג] פיבט
In This Article
Summary
אנו מציגים פרוטוקול כדי למדוד את התלות בשדה המגנטי של זמן ההרפיה של רשת הסחרור של 13C-תרכובות מועשר, היפרקוטביות באמצעות פולריזציה גרעינית דינמית, תוך שימוש במהירות מהירה על אופניים בשדה. באופן ספציפי, הדגמנו את זה עם הפירובט [1-13ג], אבל הפרוטוקול יכול להיות מורחב לשני מצעים היפרקוטב אחרים.
Abstract
הגבול הבסיסי לvivo יישומים הדמיה של היפרקוטב 13C-תרכובות מועשר הוא זמני ההרפיה הסופיים שלהם ברשת. גורמים שונים משפיעים על שיעורי ההרפיה, כגון הרכב מאגר, ה-pH של התמיסה, הטמפרטורה והשדה המגנטי. בהקשר זה האחרון, זמן הרפיה ספין-סריג ניתן למדוד בעוצמות שדה קליני, אבל בשדות נמוכים יותר, שם תרכובות אלה הם ויתרו מן הקיטוב מועבר ל-MRI, הרפיה היא אפילו מהירה יותר קשה למדוד. כדי לקבל הבנה טובה יותר של כמות המגנטיזציה שאבדו במהלך ההובלה, השתמשנו במהירות מהירה בתחום הרכיבה על אופניים, עם זיהוי תהודה מגנטית של 13C גרעינים ב ~ 0.75 T, כדי למדוד את פיזור התהודה המגנטית הגרעינית של ה שעון מרגוע של הרפיה-סריג של היפרקוטב [1-13ג] פיבט. קיטוב גרעיני דינמי התפרקות שימש כדי לייצר דגימות היפרקוטב של פירובט בריכוז של 80 mmol/L ו-pH פיסיולוגיים (~ 7.8). הפתרונות הללו הועברו במהירות למטרים מהירים של רכיבת שדות, כך שניתן יהיה למדוד את ההרפיה של המגנטיזציה לדוגמה כפונקציה של זמן תוך שימוש בזווית היפוך קטנה מכויל (3 °-5 °). כדי למפות את הפיזור T1 של C-1 של פירובט, הקלטנו נתונים עבור שדות הרפיה שונים הנע בין 0.237 mT ו 0.705 T. באמצעות מידע זה, קבענו משוואה אמפירית להערכת הרפיה הספין-סריג של המצע היפרקוטב בתוך הטווח המוזכר של השדות המגנטיים. תוצאות אלה ניתן להשתמש כדי לנבא את כמות המגנטיזציה שאבדו במהלך התחבורה כדי לשפר את העיצובים הניסיוניים כדי למזער את אובדן האות.
Introduction
הדמיה מגנטית ספקטרוסקופית תהודה (MRSI) יכול לייצר מפות מרחבית של מטבוליטים שזוהו על ידי הדמיה ספקטרוסקופית, אבל השימוש המעשי שלה מוגבל לעתים קרובות על ידי רגישות נמוכה יחסית שלה. זו רגישות נמוכה של הדמיה vivo מגנטית ושיטות ספקטרוסקופיה נובעת במידה קטנה של מגנטוטיזציה גרעינית השגה בטמפרטורת הגוף והסבירות שדה מגנטי החוזק. עם זאת, מגבלה זו ניתן להתגבר על ידי שימוש של פולריזציה גרעינית דינמית (dnp) כדי לשפר מאוד את המגנטיזציה מחוץ למבחנה של מצעים נוזליים, אשר מוזרק לאחר מכן לחקור בתוך vivo מטבוליזם באמצעות mrsi1,2 , מיכל שלוש , 4. dnp הוא מסוגל לשפר את המגנטיזציה של רוב הגרעינים עם ספין גרעיני שאינו אפס ושימש להגדיל vivo mrsi רגישות של 13C-מועשר תרכובות כגון פירובט5,6, ביקרבונט 7,8, fumarate9, לקטט10, גלוטמין11, ואחרים על ידי יותר מארבע הזמנות של סדר גודל12. היישומים שלה כוללים הדמיה של מחלת כלי דם13,14,15, איברים זלוף13,16,17,18, סרטן זיהוי1,19,20,21,22, גידול האחסון הזמני23,24, וכימות התגובה הטיפולית2 , מיכל בן 6 , מיכל בן 23 , בת 24 , מיכל בן 25 , . עשרים ושש
הרפיה ספין-סריג איטית חיונית לאיתור vivo עם MRSI. זמני הרפיה של סריג (T1s) על סדר עשרות שניות אפשריים עבור גרעינים עם יחסי gyromגנטיות נמוכה בתוך מולקולות קטנות בפתרון. מספר גורמים פיזיים משפיעים על העברת האנרגיה בין מעבר של ספין גרעיני לסביבתו (סריג) המובילה להרפיה, כולל חוזק השדה המגנטי, הטמפרטורה והקונפורמציה המולקולרית27. הרפיה קשר קואורדינטיבי מופחתת במולקולות עבור משרות פחמן ללא פרוטונים המצורפת ישירות, ו הדאוציה של מדיה התפרקות יכול עוד להפחית הרפיה מולקולרית קשר קואורדינטיבי. למרבה הצער, ממיסים מוגבלים יש יכולות מוגבלות להאריך בהרפיה vivo. הרפיה מוגברת של פחמן או חומצות קרבוקסיליות (כגון pyruvate) יכול להתרחש ב החוזק המגנטי של שדה מגנטי עקב משמרת כימית anisotropy. הנוכחות של פאראגנט מזהמים מנתיב הנוזלים במהלך הפירוק לאחר הקיטוב יכול לגרום הרפיה מהירה צריך להימנע או מסולק באמצעות כלטורים.
מעט מאוד נתונים קיימים עבור הרפיה של 13C-תרכובות המכילות בשדות נמוכים, שם הרפיה ספין-סריג יכול להיות מהיר יותר באופן משמעותי. עם זאת, חשוב למדוד T1 בשדות נמוכים כדי להבין הרפיה במהלך הכנת הסוכן בשימוש הדמיה vivo, מאז סוכני ניגודיות היפרקוטב בדרך כלל ויתרו ממנגנון dnp ליד או על כדור הארץ שדה. גורמים פיזיים נוספים כגון 13ג-ריכוז מצע מועשר, pH הפתרון, מאגרים וטמפרטורה גם להשפיע על הרפיה, וכתוצאה מכך יש השפעה על הניסוח של הסוכן. כל הגורמים הללו חיוניים לקביעת פרמטרים מרכזיים במיטוב תהליך הפירוק DNP, ואת החישוב של הגודל של אובדן האות המתרחשת בהובלה של המדגם ממנגנון DNP למגנט הדמיה.
פיזור התהודה המגנטית הגרעינית (NMRD) מדידות, כלומר, T1 מדידות, כפונקציה של השדה המגנטי נרכשים בדרך כלל באמצעות ספקטרומטר nmr. כדי לרכוש מדידות אלה, ניתן יהיה להשתמש בשיטת הלוך ושוב במקום שבו המדגם הוא הראשון דילג מתוך ספקטרומטר להירגע בשדה מסוים שנקבע על ידי מיקומו בשדה שוליים של המגנט28,29,30 ואז במהירות הועבר חזרה למגנט NMR כדי למדוד את המגנטיזציה הנותרים. על ידי חזרה על תהליך זה באותה נקודה בשדה המגנטי אבל עם הגדלת תקופות של הרפיה, עקומת הרפיה ניתן להשיג, אשר לאחר מכן ניתן לנתח כדי להעריך T1.
אנו משתמשים בטכניקה חלופית המכונה מהירות האופניים להרפמטריה31,32,33 לרכוש נתונים NMRD שלנו. שנינו שינו משטח מסחרי להרגעת האופניים (ראה טבלת חומרים), עבור מדידות T1 של פתרונות המכילים היפרקוטב 13C גרעינים. בהשוואה לשיטת ההסעות, השדה-רכיבת אופניים מאפשר מדידת מרפה זו לרכוש באופן שיטתי נתונים NMRD על פני מגוון קטן יותר של שדות מגנטיים (0.25 mT עד 1 T). זה מתבצע על ידי שינוי מהיר של השדה המגנטי עצמו, לא את המיקום לדוגמה בשדה המגנטי. לכן, מדגם יכול להיות ממוגנט בחוזק שדה גבוה, "רגוע" בחוזק שדה נמוך יותר, ולאחר מכן נמדד על-ידי רכישת השראה בשדה קבוע (ותדר לרמור) כדי למקסם את האות. משמעות הדבר היא כי הטמפרטורה לדוגמה יכול להיות נשלט במהלך המדידה, ואת הבדיקה NMR לא צריך להיות מכוון על כל שדה הרפיה קידום רכישה אוטומטית מעל טווח שדה מגנטי כולו.
מיקוד המאמצים שלנו להשפעות של מעביר והובלת פתרונות היפרקוטב בשדות מגנטיים נמוכים, עבודה זו מציגה מתודולוגיה מפורטת כדי למדוד את זמן הרפיה הספין-סריג של היפרקוטב 13ג-פירובט באמצעות מהיר שדה-אופניים להרפמטריה עבור שדות מגנטיים בטווח של 0.237 mT ל 0.705 T. התוצאות העיקריות של שימוש במתודולוגיה זו הוצגו בעבר עבור [1-13ג] pyruvate34 ו -13C-מועשר נתרן ו צסיום ביקרבונט35 שבו גורמים אחרים כגון ריכוז רדיקלי ו-pH התפרקות יש גם נחקרו.
Protocol
1. הכנה לדוגמא
הערה: שלבים 1.1-1.8 מתבצעים רק פעם אחת
- הכינו 1 מ ל של מלאי 13ג מועשר החומצה פירובט, המשמש באופן נרחב ב vivo מחקר1,2,5,6, המורכב של 15 ממול/L של triarylmethyl תיל מומס רדיקלי ב [1- מיכל בן 13 ג] פירובט חומצה (ראה לוח חומרים). מתוך פתרון מניות זה ישמש לדגימות שיהיו מקוטבות באופן אינדיבידואלי ולאחר מכן יעברו מרפה בשדות מגנטיים שונים. ייצוג של מולקולת החומצה הפירובורית מוצגת באיור 1.
- על ממשק התוכנה הדינמי מקטפולייזר גרעינית (ראה טבלת חומרים), לחץ על לחצן Cooldown כדי להקטין את הטמפרטורה של הוספת טמפרטורה משתנה (vti) כדי 1.4 K.
- לאחר DNP הגיע לטמפרטורה הרצויה, טען 10 μL של פתרון המניה בספל לדוגמה, לפתוח את דלתות צריח ולהכניס את הספל לתוך VTI באמצעות שרביט הכניסה במיוחד שתוכנן עבור משימה זו.
- לאחר מכן, לחלץ במהירות את השרביט ולוודא הגביע משוחרר. לאחר מכן לסגור את דלתות צריח ולהמשיך עם השלבים הבאים בעוד הטמפרטורה של VTI חוזר 1.4 K.
- הכן את ה-DNP להפעלת מיקרוגל כדי למצוא את תדר ה-RF האופטימלי עבור היפרפולריזציה של פתרון המניה.
- במחשב השולט על הספקטרומטר (חלק ממערכת DNP), צור את התקשורת בין הספקטרומטר ותוכנת הבקרה של DNP על-ידי לחיצה כפולה על סמל ההיפר-מסוף, שהוגדרה בעבר עם התקשורת הטורית המתאימה. פרמטרים.
- לאחר הקמת התקשורת, הפעל את תוכנת RINMR, הקלד את שורת הפקודה שלו . .ולאחר מכן הקש enter
- לאחר מכן, חלון חדש יוצג על המסך ועליו להקליד את מספר אחת (1) בשדה מספר התצורה . לאחר מכן, לחצו על הלחצן ' בחר תצורה '.
- לחץ על הכפתור לעשות לטאטא מיקרוגל. חלון קטן עם מונה יורד של שניות יושק המציין כי ספקטרומטר מוכן והוא יחכה אותות ההדק התקופתי, מגיע תוכנת בקרת DNP, כדי לדגום את הקיטוב.
- בתוכנת הבקרה של DNP, בחר בכרטיסיה כיול ולחץ על הלחצן צור .
- באמצעות חלון הגדרת הכיול, הזן את הפרטים הבאים: תדירות התחלה = 94.117 GHz, סוף תדר = 94.137 GHz, גודל שלב = 1 מגה-הרץ, שלב משך = 300 s, Power = 50 mW, רמת הליום נוזלית = 65%, ו טמפרטורה = 1.4 K.
- לחץ על הלחצן צור, אשר יסגור את חלון ההתקנה ויחזור ללשונית כיול שתציג את מספר השלבים ואת הזמן הנדרש לביצוע סריקת המיקרוגל הרצויה.
- לאחר השגת טמפרטורת ה-VTI הרצויה, לחץ על הלחצן הפעל ולאחר מכן התחל לאתחל את תהליך הניקוי של המיקרוגל.
- בסוף הניקוי של המיקרוגל, שחזר את הדגימה והקלט את התדר האופטימלי שבו מושגת הקיטוב המקסימלי. תדר אופטימלי זה מוגדר כתדר הקיטוב המספק את הקיטוב המקסימלי כפי שמוצג באיור 2. תדר זה ישמש להפרפולזציה של כל האלירוטים שהתקבלו מפתרון מניות ספציפי זה של חומצת פירובט.
- להכין 250 mL של הפירוק מניות בינונית באמצעות פתרון של 40-mmol/L טריס בסיס, 50 mmol/L של נתרן כלוריד, ו-80 ממול/L נתרן הידרוקסיד במים דה מייבים. הוסף את החומצה האצתית (EDTA) בריכוז של 100 mg/L כדי לעצב כל זיהום יון מתכת. בדומה לפתרון מניות חומצה פירובט, זו בינונית הפירוק ישמש עבור כל הדגימות שונות כי יהיה מקוטב. עיין בטבלה של חומרים לקבלת פרטים ספציפיים יותר לגבי הכימיקלים המשמשים.
- גם, להכין 500 mL של פתרון ניקוי מניות המורכב 100 mg/L EDTA מומס במים מוהים. כ 10 מ ל של פתרון זה ניקוי משמש לאחר כל פולריזציה לנקות את נתיב הפירוק של DNP.
הערה: שלבים 1.9-1.27 מבוצעים עבור כל דוגמה בודדת. - מגניב מכשיר DNP כדי 1.4 K בהכנה של הפחתת הקיטוב [1-13ג] דגימת חומצה Pyruvic על ידי לחיצה על כפתור Cooldown בחלון הראשי dnp.
- אם התוכנה המשמשת את הספקטרומטר העצמי פעילה כבר עם הגדרת התצורה 1 , המשך בשלבים הבאים. אחרת, בצע את השלבים ה1.5.1 ל1.5.3 ולאחר מכן המשך בשלבים הבאים.
- לאחר אימות כי התצורה 1 נבחרה בחלון שליטה הספקטרומטר של dnp, לחץ על לחצן בנייה מוצק .
- הזן את שם הקובץ Ssbuild Upxxx, כאשר "XXX" הוא מספר ברצף הקבצים המאוחסנים עם נתוני הצטברות. מספר זה גדל באופן אוטומטי על-ידי התוכנה. לאחר מכן לחץ על אישור. בדומה למקרה מטאטא מיקרוגל, חלון קטן עם מונה יורד של שניות יושק המציין כי ספקטרומטר מוכן והוא יחכה אותות ההדק התקופתי, מגיע תוכנת הבקרה DNP, כדי לדגום את הקיטוב .
- באמצעות פירובט חומצה-OX063 מלאי פתרון מוכן בשלב 1.1, שוקל 30 מ"ג בספל לדוגמה.
- כאשר טמפרטורת VTI הרצויה מושגת (1.4 K) לחץ על הוספת לדוגמה, ולאחר מכן בחר מדגם רגיל ולאחר מכן לחץ על הבא. בעקבות אמצעי הזהירות המוצגים על המסך, הכניסו את הספל למנגנון ה-DNP הקר, תוך שימוש בשרביט ארוך שתוכנן במיוחד עבור משימה זו.
- לאחר הוספת הספל, השרביט הוסר ודלתות DNP נסגרו, לחץ על הבא ולאחר מכן סיים. בשלב זה המערכת מורידה את הספל לדוגמה לחדר ההקרנה ממולא חלקית (65%) עם הליום נוזלי.
- המתן עד שהטמפרטורה חזרה ל-1.4 K ולאחר מכן לחץ על כפתור מקטזי לדוגמה .
- בחלון הנפתח החדש, הגדר את ערך התדר שהושג מסריקת המיקרוגל בשלב 1.6. באותו חלון, גם להגדיר את הכוח 50 mW ואת זמן הדגימה ל 300 s. לחץ על הבא, בדוק את התיבה הפעל את ניטור הבנייה , ולאחר מכן לחץ על סיום.
הערה: לאחר התחלת הקיטוב, תוכנת הבקרה של DNP מייצרת אותות ההדק כל 300 כדי להנחות את הספקטרומטר לדגום את הקיטוב באמצעות זווית קצה קטנה. בדרך זו, התוכנה הספקטרומטר מוסיף נקודה לדוגמה לעקומת מגנטיזציה של מצב מוצק, המוצג כעת הן בתוכנה הספקטרומטר והן בתוכנת הבקרה של DNP תחת הכרטיסייה Polarization הבנייה. לאחר המדגם הרביעי וכל דוגמה לאחר מכן, התוכנה הספקטרומטר מתאימה את העקומה לפונקציה של גידול אקספוננציאלי של הטופס:
S = A * exp (-t/tp) + y0
כאשר הוא משרעת הקיטוב, ביחידות שרירותיות, t הוא זמן הדגימה, tp הוא קבוע הזמן הקיטוב (הן בשניות), ו- y0 הוא היסט. בהתבסס על הפרמטרים המצוידים, התוכנה גם מחשבת את אחוז הקיטוב שהושג עד לנקודה זו בזמן, המוצג גם בכרטיסיה ' מצב פולריזציה ' של DNP. - הקיטוב עד הבנייה של המגנטיזציה מוצק מדינה מגיע לפחות 95% של מקסימום (כשעה אחת).
- בעוד המדגם הוא הקיטוב, להכין את מהירות מרפה אופניים מהיר כמוסבר בסעיף 2 להלן.
- כאשר הקיטוב הרצוי מושגת, לחץ על הפעל פירוק ותחת שיטה, בחר מבחן חומצה pyruvic. לאחר מכן, לחץ על הבא.
- בעקבות ההוראות על המסך, לפתוח את דלתות הצריח DNP ולטעון את החימום ואת החדר הלחץ בחלק העליון של המנגנון עם ~ 4.55 mL של מדיום הפירוק מוכן בסעיף 1.5 לייצר ריכוז של 80 מ ' מול/L פירובט על התפרקות ב-pH של ~ 7.75 וטמפרטורה של ~ 37 ° c.
- הצב את השרביט התאושש במיקום הנכון, לסגור את דלתות צריח, ובמחשב ללחוץ על הבא ולאחר מכן על סיום. בשלב זה, מדיית הפירוק תהיה מחוממת עד שהלחץ יגיע ל -10 בר.
- לאחר 10 הלחץ בר מושגת, פירובט קפוא ומקוטב מוסר באופן אוטומטי מן האמבט הליום נוזלי, מעורבב במהירות, והופלה עם מדיית הפירוק סופר מחומם ונפלט דרך צינורות קפילר לתוך בקבוקון אגס. בעוד התערובת פירובט מקוטב/הפירוק מוציאה, כל הזמן מערבולת את הבקבוקון כדי להבטיח תערובת הומוגנית.
- כאשר כל התערובת הוצאה, במהירות לצייר 1.1 mL של הנוזל לתוך מזרק, העברה לעבר מחומם מראש (37 ° c) שפופרת NMR בקוטר 10 מ"מ, והובלה במהירות אל השדה-מהירות להרגעת האופניים (ראה שלב 2.2.12).
- מחלק את השארית הנותרת של כל פירוק פירובט לתוך ספקטרומטר NMR 0.55-T (ראה טבלת חומרים) כדי לבדוק אם יש השפעות נסיוניות אפשריות.
- מיד לנקות את הנתיב נוזל DNP באמצעות בינוני הפירוק נקי ואחריו אתנול. לפוצץ גז הליום באמצעות שביל הנוזלים כדי להסיר את נוזלי הניקוי הנותרים ולטהר את נתיב החמצן. לנקות את כל כלי הזכוכית.
- לאחר כל מדידה, להקליט את ה-pH של דגימות מתוך ספקטרומטר הספסל העליון ואת מד מרפה השדה.
הערה: כל מדידה T1 היא פירוק היפרקוטב נפרד ממנגנון dnp, ולכן הטיפול נדרש כדי להבטיח מדידה למדידה של ההרכב לדוגמה. זה מושגת על ידי שקילה כל הסוכנים וממיסים עם דיוק של 0.1 mg כדי להבטיח הכנה מדויקת ושיובית של פתרונות hyperpolarized קוטב הסופי.
2. להרפמטריה
הערה נא עיין בטבלה 1 לקבלת הבנה טובה יותר של הבחירה והשימוש בפרמטרים השונים המתוארים בשלבים הבאים. לפני פירוק, את הזווית היפוך הלחץ חייב להיות מחשב ואת מהירות ההרגעת חייב להיות ההתקנה ומוכן למדידה של הפתרון היפרקוטב (ראה להלן).
- כיול זווית הפוך
- להכין 1 מ ל של מסודר [1-13ג] Pyruvic חומצה בצינור nmr ולהוסיף סוכן ניגודיות גדוליניום כדי להפחית את T1 של גרעיני 13C ערך של פחות מ 200 ms אבל יותר מ 50 ms.
- אטום את צינור NMR כדי שניתן יהיה להשתמש בו מספר פעמים כתקן כיול.
- באמצעות מד העומק של מדידת הלחץ, להגדיר את עומק ההכנסה של הצינור NMR לגובה הנכון כדי להבטיח את המדגם יהיה ממוקם במרכז סליל להרפמטר RF.
- סמן את עומק ההכנסה של תקן הכיול הפירובט של 13הג עם סרט דביק כדי להבטיח חזרה על היכולת.
- הנח את פקק העומק על צינור NMR למיקום המצוין על ידי הקלטת והכנס את תקן כיול זה לתוך נשא של מדידת מרפה השדה-אופניים. השתמש במשקל כדי להשאיר את צינור NMR בעמדה.
- פתחו את שסתום האוויר של המכשיר ומלוח הקדמי להרגעת הטמפרטורות, קבעו את בקר הטמפרטורה 37 ° c. זה יהיה לשמור על טמפרטורת המדגם ב 37 ° צ' (± 0.5 ° c) באמצעות אוויר מחומם במהלך הניסוי.
- הגדר את חומרת מהירות ההרגעת השדות לרכיבת אופניים כדי לרכוש אותות גרעינים בעלי 13C. הכולל התקנה וממריץ את סליל shim חיצוני (ראה טבלת חומרים), כוונון והתאמת סליל RF ל 8 MHz (~ 0.75 T עבור גרעינים 13C), ובאמצעות כבל λ/4 המתאים.
- בתוכנת המכשיר, בצע את השלבים הבאים:
- בחר בכרטיסיה המנה הראשית
- לחץ על התא ליד הניסוי תווית וגלול מטה בחלון המוקפץ כדי לבחור את רצף הדופק "13CANGLE. FFC.
- הגדר את פרמטרי הרכישה הבאים: RFA = 5; SWT = 0.005, RD = 0.5, BPOL = 30 MHz, TPOL = 0.5.
- בחר את הכרטיסיה Acq. par ולאחר מכן בחר בלשונית המשנה הבסיסית .
- לחץ על התא ליד גרעין התווית וגלול מטה בחלון המוקפץ כדי לבחור 13c.
- לאחר מכן, להגדיר את הפרמטרים הבאים: SF = 8 MHz, SW = 1000000, BS = 652, FLTR = 100000, MS = 32.
- בחר את הכרטיסיה משנה Conf .
- הגדר את הפרמטרים הבאים: RINH = 25, ACQD = 25.
- בחר בכרטיסיית המשנה Ndim
- Set NBLK = 32, ביני = 2, עיקול = 62.
- בחר בכרטיסיה הערכה ולאחר מכן בכרטיסיית המשנה של הפרמטרים .
- הגדר את הפרמטרים הבאים: EWIP = 10, EWIP = 128, EWIB = 1, EWIP = 32.
- לאחר מכן, לחץ על הסמל התחל רכישה כדי להפעיל את רצף הפעימה.
- לאחר שהרכישה תסתיים, שמור את הנתונים, בחר את סמל תיבת הדו הערכה ומתפריט הניתוח בחר wam חלון: בגודל מוחלט. לאחר מכן בחר גיליון דוח, גרפים וקובץ ייצוא ולבסוף לחץ על ביצוע.
- בחלון הדוח למצוא את רוחב הדופק RF המספק משרעת מקסימלית ולכוונן את הערך בעזרת הסמן בגרף המוצג, הדומה לחלקות המוצגות בשורה התחתונה של איור 3. רוחב הדופק הזה ישמש עבור הפרמטר PW90 של הניסויים הבאים.
- לחצו על הסמל F1 כדי לכוונן את השינוי בתדירות של מדידת ההרגעת.
הערה: החלון Wam: בסדר גודל מוחלט הוא הליך לשילוב הסדר של בודד או רצף של רכישות האינדוקציה בחינם (fids) מהנקודה שהוגדרה על ידי ewip עד לנקודה שצוינה על ידי ewip ומתוך הבלוק וגדר על-ידי Ewib לבלוק שצוין באמצעות eweb.
- T1-מדידות
- ודא שסליל shim חיצוני מותקן ומאנרגיה.
- בתוכנת המכשיר בצע את השלבים הבאים:
- בחר בכרטיסיה המנה הראשית
- לחץ על התא הסמוך לניסוי התווית וגלול למטה בחלון המוקפץ כדי לבחור את רצף הדופק Hpub/S, המוצג באיור 4.
- הגדר את פרמטרי הרכישה הבאים: RFA = 25, T1MX = ערכים בין 3 ל-5; SWT = 0.2, RD = 0, BRLX = שדה הרפיה רצוי במגה-הרץ (תדירות לרמור פרוטון).
- בחר את הכרטיסיה Acq. par ולאחר מכן בחר בלשונית המשנה הבסיסית .
- לחץ על התא ליד גרעין התווית וגלול מטה בחלון המוקפץ כדי לבחור 13c.
- לאחר מכן, להגדיר את הפרמטרים הבאים: SF = 8 MHz, SW = 1000000, BS = 652, FLTR = 50000.
- בחר את הכרטיסיה משנה Conf .
- הגדר את הפרמטרים הבאים: PW90 שווה לערך שנמצא בשלב 2.1.10, RINH = 25, ACQD = 25.
- בחר את לשונית המשנה Puls והגדר את pw = 5.
- בחר בכרטיסיית המשנה Ndim והגדר את NBLK = 100.
- המתן והתכונן לקבלת הפתרון ההיפר-מקוטב כדי ליזום את רכישת הנתונים.
- מיד לפני הכנסת הדגימה לתוך מדידת הזמן, הפעל באופן ידני את רצף הדופק מהמסוף, כדי להימנע מהכנסת המדגם לשדה מגנטי ריק. מסיבה זו, חשוב להתעלם הראשונה הראשון השראה ריקבון (הפיד) במהלך ניתוח נתונים.
- לאחר הרכישה נעשה, לשמור את הנתונים על ידי לחיצה על לחצן שמור .
- באמצעות תוכנת הניתוח, לשלב את סדר הגודל של כל אות הפיד כדי ליצור סדרת נתונים המורכבת של מגנטיזציה דוגמה כפונקציה של זמן.
- חלץ את זמן ההרפיה של רשת הסחרור ממודל מעריכי בעל שלושה פרמטרים, באמצעות אלגוריתם התאמה לפחות ריבועים לא-ליניארי המיושם בתוכנה אנליטית מסחרית (ראה טבלת חומרים) הנחה אפילו שקלול ל כל הנתונים:
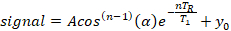
כאשר A הוא משרעת האות הראשונית (חיתוךy), t1 הוא זמן הרפיה של רשת ספין, tR הוא זמן החזרה, שהוא ערך ידוע, y0 הוא האות היסט, ו- cos(n-1)(α) הוא תיקון לאובדן מגנטוטיזציה אורכי במדידה nעבור זווית להעיף, α.
תוצאות
איור 2 מציג דוגמא לניקוי מיקרוגל ברזולוציה גבוהה לחומצה פירווית. עבור המקרה המוצג, כי תדר מיקרוגל אופטימלי תואם 94.128 GHz, מודגש בהכנסת הדמות. מערכת DNP שלנו יכול בדרך כלל לעבוד בטווח של 93.750 GHz כדי 94.241 GHz עם גודל השלב של 1 MHz, זמן פולריזציה של עד 600 s, והכוח של עד 100 mW. מגוון רחב של תדרים...
Discussion
השימוש ב-DNP כדי לשפר את רכישת האותות הוא פתרון טכני לאות תהודה מגנטית מספקת הזמינה מ- 13הגרעינים בריכוזים מוגבלים, כמו אלה המשמשים זריקות בעלי חיים, אך מציג אתגרים ניסיוניים אחרים. כל מידת הרפיה המוצגת באיור 7 מייצגת מדידה של מדגם שהוכן באופן ייחודי, משום שהיא אינה יכול?...
Disclosures
למחברים אין כל גילוי.
Acknowledgements
המחברים רוצים להודות למכון אונטריו לחקר הסרטן, תוכנית תרגום הדמיה ומדעי הטבע והמועצה למחקר הנדסי של קנדה למימון מחקר זה. אנחנו גם רוצים להכיר בדיונים שימושיים עם אלברט צ'ן, ג ' נרל אלקטריק בריאות, טורונטו, קנדה, ג'אני Ferrante, רח' האינרוסטריאלניה סטלאר, איטליה, ויליאם Mander, אוקספורד אינסטרומנטס, בריטניה.
Materials
| Name | Company | Catalog Number | Comments |
| [1-13C]Pyruvic Acid | Sigma-Aldrich, St. Louis, MO, USA | 677175 | |
| 10mm NMR Tube | Norell, Inc., Morganton NC, USA | 1001-8 | |
| De-ionized water | |||
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich, St. Louis, MO, USA | E5134 | |
| HyperSense Dynamic Nuclear Polarizer | Oxford Instruments, Abingdon, UK | Includes the following: "DNP-NMR Polarizer" software used to control and monitor the whole DNP polarizer; "RINMR" used to monitor the solid state polarization levels; "HyperTerminal" used to communicate the DNP software with the RINMR software that monitors the solid state polarization level. Also includes the MQC bench top spectrometer to monitor the liquid state polarization in conjunction with it own RINMR software | |
| MATLAB R2017b | MathWorks, Natick, MA | Include scripts for non-linear fitting of magnetization decay over time and T1 NMRD analysis of hyperpolarized pyruvic acid. | |
| OX063 Triarylmethyl radical | Oxford Instruments, Abingdon, UK | ||
| pH meter - SympHony | VWR International, Mississauga, ON., Canada | SB70P | |
| ProHance | Bracco Diagnostics Inc. | Gadoteridol, Gd-HP-DO3A | |
| Pure Ethanol (100% pure) | Commercial Alcohols, Toronto, ON, Canada | P016EAAN | |
| Shim Coil | Developed in-house | ||
| Sodium Chloride | Sigma-Aldrich, St. Louis, MO, USA | S7653 | |
| Sodium Hydroxide | Sigma-Aldrich, St. Louis, MO, USA | S8045 | |
| SpinMaster FFC2000 1T C/DC | Stelar s.r.l., Mede (PV) Italy | Includes the software "AcqNMR" that is used to set experimental parameters, monitor the tuning and matching of the RF coil, loading different pulse sequences, calibrate flip angle, data acquisition and curve fitting, among other functions. Also includes a depth gauge, some weights and a depth stopper. | |
| Trizma Pre-Set Crystals (pH 7.6) | Sigma-Aldrich, St. Louis, MO, USA | T7943 |
References
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Research. 66 (22), 10855-10860 (2006).
- Witney, T. H., Brindle, K. M. Imaging tumour cell metabolism using hyperpolarized 13C magnetic resonance spectroscopy. Biochemical Society Transactions. 38 (5), 1220-1224 (2010).
- Kurhanewicz, J., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Golman, K., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magnetic Resonance in Medicine. 59 (5), 1005-1013 (2008).
- Golman, K., in 't Zandt, R., Thaning, M. Real-time metabolic imaging. Proceedings of the National Academy of Science of the United States of America. 103 (30), 11270-11275 (2006).
- Day, S. E., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magnetic Resonance in Medicine. 65 (2), 557-563 (2011).
- Gallagher, F. A., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Wilson, D. M., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. Journal of Magnetic Resonance. 205 (1), 141-147 (2010).
- Gallagher, F. A., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proceedings of the National Academy of Science of the United States of America. 106 (47), 19801-19806 (2009).
- Chen, A. P., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magnetic Resonance Imaging. 26 (6), 721-726 (2008).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magnetic Resonance in Medicine. 60 (2), 253-257 (2008).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Ishii, M., et al. Hyperpolarized 13C MRI of the pulmonary vasculature and parenchyma. Magnetic Resonance in Medicine. 57 (3), 459-463 (2007).
- Lau, A. Z., Chen, A. P., Cunningham, C. H. Integrated Bloch-Siegert B(1) mapping and multislice imaging of hyperpolarized (1)(3)C pyruvate and bicarbonate in the heart. Magnetic Resonance in Medicine. 67 (1), 62-71 (2012).
- Lau, A. Z., et al. Rapid multislice imaging of hyperpolarized 13C pyruvate and bicarbonate in the heart. Magnetic Resonance in Medicine. 64 (5), 1323-1331 (2010).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10435-10439 (2003).
- Johansson, E., et al. Cerebral perfusion assessment by bolus tracking using hyperpolarized 13C. Magnetic Resonance in Medicine. 51 (3), 464-472 (2004).
- Johansson, E., et al. Perfusion assessment with bolus differentiation: a technique applicable to hyperpolarized tracers. Magnetic Resonance in Medicine. 52 (5), 1043-1051 (2004).
- Albers, M. J., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Research. 68 (20), 8607-8615 (2008).
- Chen, A. P., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magnetic Resonance in Medicine. 58 (6), 1099-1106 (2007).
- Lupo, J. M., et al. Analysis of hyperpolarized dynamic 13C lactate imaging in a transgenic mouse model of prostate cancer. Magnetic Resonance Imaging. 28 (2), 153-162 (2010).
- von Morze, C., et al. Imaging of blood flow using hyperpolarized [(13)C]urea in preclinical cancer models. Journal of Magnetic Resonance Imaging. 33 (3), 692-697 (2011).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magnetic Resonance in Medicine. 66 (2), 505-519 (2011).
- Park, I., et al. Detection of early response to temozolomide treatment in brain tumors using hyperpolarized 13C MR metabolic imaging. Journal of Magnetic Resonance Imaging. 33 (6), 1284-1290 (2011).
- Bohndiek, S. E., et al. Detection of tumor response to a vascular disrupting agent by hyperpolarized 13C magnetic resonance spectroscopy. Molecular Cancer Therapeutics. 9 (12), 3278-3288 (2010).
- Witney, T. H., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-13C]pyruvate and [1,4-13C2]fumarate. British Journal of Cancer. 103 (9), 1400-1406 (2010).
- Levitt, M. H. . Spin dynamics: basics of nuclear magnetic resonance. , (2001).
- Mieville, P., Jannin, S., Bodenhausen, G. Relaxometry of insensitive nuclei: optimizing dissolution dynamic nuclear polarization. Journal of Magnetic Resonance. 210 (1), 137-140 (2011).
- Redfield, A. G. Shuttling device for high-resolution measurements of relaxation and related phenomena in solution at low field, using a shared commercial 500 MHz NMR instrument. Magnetic Resonance in Chemistry. 41 (10), 753-768 (2003).
- Grosse, S., Gubaydullin, F., Scheelken, H., Vieth, H. -. M., Yurkovskaya, A. V. Field cycling by fast NMR probe transfer: Design and application in field-dependent CIDNP experiments. Applied Magnetic Resonance. 17 (2), 211-225 (1999).
- Kimmich, R., Anoardo, E. Field-cycling NMR relaxometry. Progress in Nuclear Magnetic Resonance Spectroscopy. 44 (3-4), 257-320 (2004).
- Guðjónsdóttir, M., Belton, P., Webb, G. . Magnetic Resonance in Food Science: Challenges in a Changing World. , 65-72 (2009).
- Anoardo, E., Galli, G., Ferrante, G. Fast-field-cycling NMR: Applications and instrumentation. Applied Magnetic Resonance. 20 (3), 365-404 (2001).
- Chattergoon, N., Martinez-Santiesteban, F., Handler, W. B., Ardenkjaer-Larsen, J. H., Scholl, T. J. Field dependence of T1 for hyperpolarized [1-13C]pyruvate. Contrast Media & Molecular Imaging. 8 (1), 57-62 (2013).
- Martínez-Santiesteban, F. M., Dang, T. P., Lim, H., Chen, A. P., Scholl, T. J. T1 nuclear magnetic relaxation dispersion of hyperpolarized sodium and cesium hydrogencarbonate-13C. NMR in Biomedicine. 30 (9), 3749 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved