Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение спин-латеттической релаксации Магнитное поле зависимость гиперполяризованных No 1-13C pyruvate
В этой статье
Резюме
Мы представляем протокол для измерения зависимости магнитного поля времени релаксации спин-решетки 13C-обогащенных соединений, гиперполяризованных с помощью динамической ядерной поляризации, с использованием быстрого поля циклреционной релаксометрии. В частности, мы продемонстрировали это с помощью1-13C pyruvate, но протокол может быть распространен на другие гиперполяризованные субстраты.
Аннотация
Фундаментальным ограничением для применения in vivo изображений гиперполяризованных 13C-обогащенных соединений является их конечное время релаксации спин-решетки. На темпы релаксации влияют различные факторы, такие как состав буфера, рН раствора, температура и магнитное поле. В этом последнем отношении время релаксации спин-решетки может быть измерено на клинических полях, но на нижних полях, где эти соединения отпускаются из поляризатора и транспортируются на МРТ, релаксация еще быстрее и трудно измерить. Чтобы лучше понять количество намагниченности, потерянной во время транспортировки, мы использовали быстрое полевелового релаксометрии, с магнитным резонансным обнаружением 13C ядер при 0,75 Т, для измерения рассеяния ядерного магнитного резонанса спин-решетка релаксации время гиперполяризованной No 1-13C pyruvate. Роспуск динамической ядерной поляризации был использован для производства гиперполяризованных образцов пирувата в концентрации 80 ммоль/л и физиологического рН (7,8 евро). Эти решения были быстро перенесены на быстрый фартетометр для езды на велосипеде, чтобы можно было измерить расслабление намагнительности образца как функцию времени с помощью откалиброванный небольшой флипайный угол (3-5"). Чтобы сопоставить дисперсию Т1 пирувата C-1,мы зафиксировали данные по различным полям релаксации в диапазоне от 0,237 мТ до 0,705 Т. С помощью этой информации мы определили эмпирическое уравнение для оценки релаксации спин-латеттики гиперполяризованного субстрата в пределах упомянутого диапазона магнитных полей. Эти результаты могут быть использованы для прогнозирования количества намагниченности, потерянной во время транспортировки, и для улучшения экспериментальных конструкций, чтобы свести к минимуму потерю сигнала.
Введение
Магнитно-резонансная спектроскопическая визуализация (МРСИ) может производить пространственные карты метаболитов, обнаруженных спектроскопической визуализацией, но ее практическое применение часто ограничено его относительно низкой чувствительностью. Эта низкая чувствительность методов магнитно-резонансной томографии in vivo и спектроскопии обусловлена небольшой степенью ядерной намагнигализации, достижимой при температуре тела и разумными сильными магнитными полями. Тем не менее, это ограничение может быть преодолено с помощью динамической ядерной поляризации (DNP) значительно повысить в пробирке намагничивание жидких субстратов, которые впоследствии вводят для зондирования метаболизма vivo с помощью MRSI1,2 , 3 , 4. DNP способен повысить намагничивание большинства ядер с ненулевым ядерным спином и был использован для увеличения чувствительности vivo MRSI 13C-обогащенных соединений, таких как пируват5,6, бикарбонат 7,8,фумерат9, лактат10, глутамин11, и другие более чем на четыре порядка величины12. Его применение включает визуализацию сосудистых заболеваний13,14,15,перфузии органов13,16,17,18,рака выявление1,19,20,21,22, инсценировка опухоли23,24,и количественная оценка терапевтического ответа2 , 6 , 23 , 24 , 25 , 26.
Медленная релаксация спин-решетки имеет важное значение для обнаружения in vivo с ПОМОЩЬю MRSI. Спин-решетка релаксации раз(T1s) на порядок десятков секунд возможны для ядер с низкими гиромагнитными соотношениями в малых молекул в растворе. Несколько физических факторов влияют на передачу энергии между переходом ядерного спина и его окружающей среды (решетки), что приводит к релаксации, в том числе сила магнитного поля, температура, и молекулярной конформации27. Диполярное расслабление уменьшается в молекулах для углеродных позиций без протонов непосредственно прилагается, и deuteration растворения средств массовой информации может еще больше уменьшить межмолекулярную диполярное расслабление. К сожалению, дейтерированные растворители имеют ограниченные возможности для расширения релаксации in vivo. Повышенная релаксация карбосиловых или карбоксилевых кислот (таких как пируват) может происходить при высокой силе магнитного поля из-за химической анисотропии. Наличие парамагнитных примесей от жидких путей во время растворения после поляризации может вызвать быстрое расслабление и их необходимо избегать или устранять с помощью хелаторов.
Существует очень мало данных для релаксации 13C-содержащих соединений на низких полях, где релаксация спин-решетки может быть значительно быстрее. Тем не менее, важно измерить T1 на низких полях, чтобы понять релаксацию во время подготовки агента, используемого для визуализации in vivo, так как гиперполяризованные контрастные агенты обычно выдаются из аппарата DNP вблизи или на земле. Поле. Дополнительные физические факторы, такие как концентрация субстрата, обогащенная С, рН раствора, буферы и температура также влияют на расслабление и, следовательно, оказывают влияние на состав агента. Все эти факторы имеют важное значение для определения ключевых параметров в оптимизации процесса роспуска DNP, а также для расчета величины потери сигнала, которая происходит при транспортировке образца из аппарата DNP к магниту визуализации.
Измерения рассеиваемости ядерного магнитного резонанса (NMRD), т.е. измерения T1, как функция магнитного поля обычно приобретаются с помощью спектрометра ЯМР. Для приобретения этих измерений, челночный метод может быть использован, где образец впервые курсирует из спектрометра, чтобы расслабиться в каком-то поле определяется его положение в поле бахромымагнита 28,29,30 а затем быстро возвращается в магнит NMR для измерения его оставшейся намагници. Повторяя этот процесс в той же точке в магнитном поле, но с увеличением периодов релаксации, кривая релаксации может быть получена, которая затем может быть проанализирована для оценки T1.
Мы используем альтернативный метод, известный как быстрое поле велосипедного relaxometry31,32,33 для получения наших данных NMRD. Мы модифицировали коммерческий полевой велосипедный релаксометром (см. Таблица Материалов),для T1 измерений решений, содержащих гиперполяризованные ядра 13C. По сравнению с шаттлом, полевой велосипед позволяет этому релаксометру систематически приобретать данные NMRD по меньшему диапазону магнитных полей (0,25 мТ до 1 Т). Это достигается путем быстрого изменения самого магнитного поля, а не места образца в магнитном поле. Таким образом, образец может быть намагниченным при высокой силе поля, «расслабленным» при более низкой силе поля, а затем измеряться путем приобретения свободного индукционного распада на фиксированном поле (и частоте Larmor) для максимизации сигнала. Это означает, что температура образца может контролироваться во время измерения, и зонд NMR не должен быть настроен на каждом поле релаксации, способствуя автоматическому приобретению по всему диапазону магнитного поля.
Сосредоточив наши усилия на последствиях дозирования и транспортировки гиперполяризованных растворов на низких магнитных полях, эта работа представляет собой подробную методологию для измерения времени релаксации спин-решетки гиперполяризованного 13C-пируватс с помощью быстрого полевой реаксеметрия для магнитных полей в диапазоне от 0,237 мТ до 0,705 Т. Основные результаты использования этой методологии были ранее представлены для No 1-13C pyruvate34 и 13C-обогащенного натрия и цезия бикарбонат35, где другие факторы, такие как радикальная концентрация и растворение рН есть также были изучены.
протокол
1. Подготовка образцов
ПРИМЕЧАНИЕ: Шаги 1.1-1.8 выполняются только один раз
- Подготовка 1 мл бульона 13C-обогащенный пирувиккислотный раствор, широко используемый для исследования in vivo 1,2,5,6, состоящий из 15-ммоль/л триарилметилового радикального растворяется в No 1- 13 Год Спирувикская кислота (см. Таблица материалов). Aliquots из этого запаса решение будет использоваться для образцов, которые будут индивидуально поляризованы и впоследствии пройти relaxometry на различных магнитных полях. На рисунке 1показано представление молекулы кислоты No1-13C pyruvic.
- На динамическом интерфейсе программного обеспечения ядерного поляризатора (см. Таблица материалов)нажмите на кнопку Cooldown, чтобы снизить температуру вставки переменной температуры (VTI) до 1,4 К.
- После того, как DNP достиг желаемой температуры, загрузите 10 злику стокового раствора в чашку образца, откройте двери башни и вставьте чашку в VTI с помощью палочки для вставки, специально разработанной для этой задачи.
- После этого, быстро извлечь палочку и убедитесь, что чашка выпущена. Затем закройте двери башни и продолжайте следующие шаги, в то время как температура VTI восходит к 1,4 K.
- Подготовьте DNP для запуска микроволновой развертки для того, чтобы найти оптимальную частоту RF для гиперполяризации фондового раствора.
- На компьютере, управляющем спектрометром (частью системы DNP), установите связь между спектрометром и программным обеспечением управления DNP, дважды нажав на значок HyperTerminal, ранее настроенный с соответствующей серийной связью Параметры.
- Как только связь установлена, запустите программное обеспечение RINMR, введите его командную строку. HYPERSENSENMR, а затем нажмите войти.
- После этого на экране будет показано новое окно и на нем введите номер один (1) в поле Configuration Number. Затем нажмите на кнопку «Выберите конфигурацию».
- Нажмите на кнопку Ли микроволновой развертки. Будет запущено небольшое окно с нисходящим счетчиком секунд, указывая, что спектрометр готов и он будет ждать периодических триггерных сигналов, исходящих от программного обеспечения управления DNP, для пробы поляризации.
- На программном обеспечении управления DNP выберите вкладку Калибра и нажмите на кнопку Generate.
- Используя окно установки калибровки, введите следующую информацию: Частота запуска 94.117 ГГц, Конечная частота 94.137 ГГц, Размер шага - 1 МГц, Продолжительность шага - 300 с, мощность 50 мВт, уровень жидкого гелия - 65%, температура - 1,4 КГц.
- Нажмите на кнопку Generate,которая закроет окно установки и вернется к вкладке Калибр, которая будет отображать количество шагов и время, необходимое для выполнения желаемого сваса развертки.
- Как только желаемая температура VTI будет достигнута, нажмите кнопку Enable, а затем начните инициализировать процесс микроволновой развертки.
- В конце микроволновой зачистки, восстановить образец и записать оптимальную частоту, где максимальная поляризация достигается. Эта оптимальная частота определяется как частота поляризации, которая обеспечивает максимальную поляризацию, как показано на рисунке 2. Эта частота будет использоваться для гиперполяризации всех аликвотов, полученных из этого конкретного запаса раствора пирувиковой кислоты.
- Приготовьте 250 мл средоотания раствора запасов с использованием раствора 40-мольоль/л базы Tris, 50 ммоль/л хлорида натрия и 80-ммоль/л гидроксида натрия в деионизированной воде. Добавьте этиленедиаминететраацетическую кислоту (ЭДТА) в концентрации 100 мг/л, чтобы улавливать любое металлическое ионное загрязнение. Как и раствор пирувиковой кислоты, эта среда растворения будет использоваться для всех различных образцов, которые будут поляризованы. Для более подробной информации об используемых химических веществах обратитесь к таблице материалов.
- Также приготовьте 500 мл очистного раствора, состоящего из 100 мг/л EDTA, растворенного в деионизированной воде. Приблизительно 10 мл этого чистящего раствора используется после каждой поляризации для очистки пути растворения DNP.
ПРИМЕЧАНИЕ: Шаги 1.9-1.27 выполняются для каждого отдельного образца. - Охладите аппарат DNP до 1,4 K в рамках подготовки гиперполяризации образца кислоты No1-13C pyruvic, нажав кнопку Cooldown в главном окне DNP.
- Если программное обеспечение, используемое для спектрометра, уже активно с выбранной конфигурацией 1, приступаем к следующим шагам. В противном случае выполните шаги 1.5.1 до 1.5.3, а затем продолжите следующие шаги.
- После проверки того, что конфигурация 1 выбрана в окне, контролирующей спектрометр DNP, нажмите на кнопку Solid Build Up.
- Введите имя файла SSBuilupXXX, где "XXX" является номером в последовательности файлов, хранящихся с данными наращивания. Это число автоматически приравнывается программным обеспечением. Затем нажмите OK. Подобно случае свечразить развертки, небольшое окно с нисходящей счетчик секунд будет запущен с указанием, что спектрометр готов, и он будет ждать периодических триггерных сигналов, исходящих от программного обеспечения управления DNP, чтобы попробовать поляризации .
- Используя пирувиковую кислоту - бульонный раствор OX063, приготовленный в шаге 1.1, взвесить 30 мг в чашке образца.
- Когда желаемая температура VTI достигается (1,4 K) нажмите на вставить образец,а затем выберите Нормальный образец, а затем нажмите на Следующий. Следуя мерам предосторожности, отображаемым на экране, вставьте чашку в холодный аппарат DNP, используя длинную палочку, специально предназначенную для этой задачи.
- После того, как чашка вставляется, палочка удалена, и двери DNP закрыты, нажмите Далее, а затем закончить. В этот момент система гиперполяризатора опускает чашку образца в частично заполненную камеру облучения (65%) с жидким гелием.
- Подождите, пока температура не вернется к 1.4K, а затем нажмите на кнопку Polarize Sample.
- В новом всплывающем окне установите значение частоты, полученное из микроволновой развертки в шаге 1.6. В том же окне, также установить мощность до 50 мВт и время отбора проб до 300 с. Нажмите на следующий, проверить Включить Build-up Мониторинг поле, а затем нажмите на finish.
ПРИМЕЧАНИЕ: Как только поляризация начата, программное обеспечение управления DNP генерирует триггерные сигналы каждые 300 с, чтобы проинструктировать спектрометр, чтобы попробовать поляризацию с помощью небольшого угла наклона. Таким образом, программное обеспечение спектрометра добавляет образец точки твердотельного намагниченности кривой, в настоящее время отображается как в спектрометр программного обеспечения и в программном обеспечении управления DNP под вкладкой Polarization Build-Up. После 4-го образца и каждого образца после этого, программное обеспечение спектрометра соответствует кривой экспоненциальной функции роста формы:
S - Зайкп(-т/Тр)
где А является амплитудой поляризации, в произвольных единицах, т является время отбора проб, Tp является постоянным временем поляризации (как в секундах), и y0 является смещением. На основе установленных параметров, программное обеспечение также вычисляет процент поляризации, достигнутой до этого момента времени, которая также отображается во вкладке статуса поляризации DNP. - Поляризуйте до тех пор, пока накопление твердотельной намагниченности не достигнет не менее 95% от максимума (примерно один час).
- В то время как образец поляризуется, подготовьте фаст-Филд-Велосипедный Релаксомеметр, как это объясняется в разделе 2 ниже.
- Когда желаемая поляризация достигается, нажмите на Run Растворение и в соответствии с методом, выберите Pyruvic кислоты испытаний. Затем нажмите на Next.
- Следуя инструкциям на экране, откройте двери башни DNP и загрузите нагревательную и герметичная камеру в верхней части аппарата с 4,55 мл среды растворения, подготовленной в разделе 1.5 для получения концентрации 80-моль/Л пирувата на растворения при рН в 7,75 евро и температуре 37 градусов по Цельсию.
- Расположите восстанавливающуюся палочку в нужном положении, закройте двери башни, а на компьютер нажмите на Next, а затем на Finish. В этот момент средства растворения будут перегреты до тех пор, пока давление не достигнет 10 бар.
- Как только давление 10 адвокатского сословий достигается, замороженный и гиперполяризованный пируват автоматически поднимается из жидкой гелиевой ванны, быстро смешивается и размораживается перегретым растворимым носителем и выбрасывается через капиллярную трубку в грушевидную колбу. В то время как гиперполяризованный пируват/ растворитель медиа-смесь выбрасывается, постоянно закружить колбу, чтобы обеспечить однородную смесь.
- Когда вся смесь была выброшена, быстро нарисуйте 1,1 мл жидкости в шприц, перенесите на предварительно разогретую (37 градусов по Цельсию) 10-мм диаметр омичей трубку ИРМ и быстро транспортировать на полевой велосипедный релаксометром (см. шаг 2.2.12).
- Распределите оставшийся аликвот каждого растворения pyruvate в спектрометр 0,55-T скамейки NMR (см. Таблица материалов),чтобы проверить возможные систематические экспериментальные эффекты.
- Немедленно очистите путь жидкости DNP используя чистую среду растворения последовано за этанолом. Удар гелия газа через жидкость путь, чтобы удалить оставшиеся чистящие жидкости и очистить путь кислорода. Очистите всю стеклянную посуду.
- После каждого измерения записывай рН образцов как со скамейки верхней спектрометра и фартетометра полевого цикла.
ПРИМЕЧАНИЕ: Каждое измерение T1 представляет собой отдельное гиперполяризованное растворение из аппарата DNP, поэтому необходимо обеспечить измерение к измерению воспроизводимости состава образца. Это достигается путем взвешивания всех агентов и растворителей с точностью 0,1 мг для обеспечения точной и воспроизводимой подготовки окончательных гиперполяризованных решений.
2. Релаксометрия
ПРИМЕЧАНИЕ Пожалуйста, обратитесь к таблице 1 для лучшего понимания выбора и использования различных параметров, описанных в следующих шагах. Перед растворением необходимо рассчитать угол распатого релаксомера и настроить релаксометр и подготовить его к измерению гиперполяризованного раствора (см. ниже).
- Калибровка флип-угол
- Приготовьте 1 мл аккуратных1-13спирувиковой кислоты в трубке ЯМР и добавьте контрастный агент гадолиния, чтобы уменьшить T1 из ядер 13C до значения менее 200 мс, но более 50 мс.
- Печать трубки NMR, чтобы он мог быть использован несколько раз в качестве стандарта калибровки.
- Используя датчик глубины релаксометры, установите глубину вставки трубки ЯМР на соответствующую высоту, чтобы обеспечить, чтобы образец был расположен в центре релаксометера RF катушки.
- Отметьте глубину вставки стандарта калибровки 13C pyruvate клейкой лентой, чтобы обеспечить повторяемость.
- Поместите глубину пробки на трубку ЯМР в положение, указанное лентой и вставьте этот стандарт калибровки в отверстие полевого велосипедного релаксометры. Используйте вес, чтобы держать трубку ЯМР в положении.
- Откройте воздушный клапан прибора и от передней панели рестерциометра установите контроллер температуры до 37 градусов по Цельсию. Это позволит поддерживать температуру образца на уровне 37 градусов по Цельсию (0,5 градусов по Цельсию) с использованием нагретого воздуха во время эксперимента.
- Настройка полевого велосипедного релаксометры оборудования для приобретения 13C ядер сигналов. Это включает в себя установку и активизацию внешней катушки оболья (см. Таблица материалов),тюнинг и сопоставление КАТушки RF до 8 МГц (0,75 Т для ядер 13C), а также использование соответствующего кабеля q/4.
- В программном обеспечении прибора выполните следующие шаги:
- Выберите вкладку Main par
- Нажмите на ячейку рядом с меткой Эксперимент и прокрутите вниз в всплывающем окне, чтобы выбрать последовательность импульса "13CANGLE. FFC ".
- Установить следующие параметры приобретения: RFA 5; SWT - 0,005, RD - 0,5, БПОЛ - 30 МГц, ТПОЛ - 0,5.
- Выберите вкладку Acq. par, а затем выберите базовую подкладку.
- Нажмите на ячейку рядом с этикеткой Nucleus и прокрутите вниз в всплывающем окне, чтобы выбрать 13C.
- Затем установите следующие параметры: SF 8 МГц, SW 1000000, BS No 652, FLTR - 100000, MS No 32.
- Выберите конф подкладку.
- Установите следующие параметры: RINH 25, AC-D 25.
- Выберите подкладку nDim
- Комплект НБЛК No 32, БИНИ No 2, Бенд No 62.
- Выберите вкладку «Оценка», а затем подкладку «Параметры».
- Установить следующие параметры: EWIP No 10, EWEP No 128, EWIB No 1, EWEB No 32.
- Затем щелкните значок Start Acquisition, чтобы запустить последовательность пульса.
- После завершения приобретения сохраните данные, выберите значок диалога оценки и из меню анализа выберите WAM Window: Absolute Magnitude. Затем выберите отчет листа, Графики и экспорт файлии и, наконец, нажмите на выполнение.
- В окне отчета найти ширину импульса RF, которая обеспечивает максимальную амплитуду и точно настроить значение с помощью курсора на отображенном графике, который похож на участки, показанные в нижнем ряду рисунка 3. Эта ширина импульса будет использоваться для параметра PW90 следующих экспериментов.
- Нажмите значок F1, чтобы настроить частотное смещение релаксомера.
ПРИМЕЧАНИЕ: WAM Window: Абсолютная величина представляет собой процедуру для интеграции величины одного или последовательности свободной индукции распада приобретений (FIDs) от точки, определенной EWIP в точку, указанную EWEP и из блока определяется EWIB к блоку, указанному EWEB.
- T1-Измерения
- Убедитесь, что внешняя катушки зуд установлен и под напряжением.
- В инструменте программное обеспечение выполняет следующие шаги:
- Выберите вкладку Main par
- Нажмите на ячейку рядом с этикеткой Эксперимент и прокрутите вниз в всплывающем окне, чтобы выбрать последовательность импульса HPUB/S, которая показана на рисунке 4.
- Установите следующие параметры приобретения: RFA 25, T1MX - значения от 3 до 5; SWT 0,2, RD 0, BRLX - Желаемое поле релаксации в МГц (частота протонного larmor).
- Выберите вкладку Acq. par, а затем выберите базовую подкладку.
- Нажмите на ячейку рядом с этикеткой Nucleus и прокрутите вниз в всплывающем окне, чтобы выбрать 13C.
- Затем установите следующие параметры: SF 8 МГц, SW - 1000000, BS - 652, FLTR - 50000.
- Выберите конф подкладку.
- Установите следующие параметры: PW90, равный значению, найденному в шаге 2.1.10, RINH 25, AC-D 25.
- Выберите подкладку Puls и установите PW 5.
- Выберите nDim подкладка и установить NBLK 100.
- Подождите и приготовьтесь к получению гиперполяризованного решения для инициирования получения данных.
- Непосредственно перед вставкой образца в релаксометром, вручную запустите последовательность импульса с консоли, чтобы избежать вставки образца в нулевое магнитное поле. По этой причине важно игнорировать первый распад свободной индукции (FID) во время анализа данных.
- Как только приобретение будет сделано, сохраните данные, нажав кнопку Сохранить.
- Используя программное обеспечение для анализа, интегрируйте величину каждого сигнала FID для создания серии данных, состоящей из намагниченности образцов в качестве функции времени.
- Извлеките время релаксации спин-решетки из экспоненциальной модели из трех параметров, используя стандартный нелинейный алгоритм установки наименьших квадратов, реализованный в коммерческом аналитическом программном обеспечении (см. Таблица материалов),предполагая, что даже взвешивание для все данные:
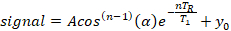
где A является начальной амплитуды сигнала(y-перехват), T1 является спин-решетка время релаксации, TR является время повторения, которое является известным значением, у0 является сигналом смещение, и cos(n-1)(q) является коррекцией для потери продольной намагнительности при nth измерении для угла флип, .
Результаты
Рисунок 2 представляет собой пример с высоким разрешением свеч-развертки с асеифом для пирувиковой кислоты. Для представленного случая оптимальная частота микроволновой печи соответствует 94,128 ГГц, подчеркнутой в вставке фигуры. Наша система DNP обычно может работать в ?...
Обсуждение
Использование DNP для повышения приобретения сигнала является техническим решением недостаточного магнитно-резонансного сигнала, доступного из 13ядер C при ограниченных концентрациях, как те, которые используются в инъекциях животных, но представляет другие экспериментальные пр...
Раскрытие информации
Авторы не раскрытии информации.
Благодарности
Авторы хотели бы поблагодарить Онтарио Институт исследований рака, визуализации Перевод программы и естественных наук и инженерных исследований Совета Канады для финансирования этого исследования. Мы также хотели бы отметить полезные дискуссии с Альбертом Ченом, GE Healthcare, Торонто, Канада, Джанни Ферранте, Stelar s.r.l., Италия, и Уильямом Мандером, Oxford Instruments, Великобритания.
Материалы
| Name | Company | Catalog Number | Comments |
| [1-13C]Pyruvic Acid | Sigma-Aldrich, St. Louis, MO, USA | 677175 | |
| 10mm NMR Tube | Norell, Inc., Morganton NC, USA | 1001-8 | |
| De-ionized water | |||
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich, St. Louis, MO, USA | E5134 | |
| HyperSense Dynamic Nuclear Polarizer | Oxford Instruments, Abingdon, UK | Includes the following: "DNP-NMR Polarizer" software used to control and monitor the whole DNP polarizer; "RINMR" used to monitor the solid state polarization levels; "HyperTerminal" used to communicate the DNP software with the RINMR software that monitors the solid state polarization level. Also includes the MQC bench top spectrometer to monitor the liquid state polarization in conjunction with it own RINMR software | |
| MATLAB R2017b | MathWorks, Natick, MA | Include scripts for non-linear fitting of magnetization decay over time and T1 NMRD analysis of hyperpolarized pyruvic acid. | |
| OX063 Triarylmethyl radical | Oxford Instruments, Abingdon, UK | ||
| pH meter - SympHony | VWR International, Mississauga, ON., Canada | SB70P | |
| ProHance | Bracco Diagnostics Inc. | Gadoteridol, Gd-HP-DO3A | |
| Pure Ethanol (100% pure) | Commercial Alcohols, Toronto, ON, Canada | P016EAAN | |
| Shim Coil | Developed in-house | ||
| Sodium Chloride | Sigma-Aldrich, St. Louis, MO, USA | S7653 | |
| Sodium Hydroxide | Sigma-Aldrich, St. Louis, MO, USA | S8045 | |
| SpinMaster FFC2000 1T C/DC | Stelar s.r.l., Mede (PV) Italy | Includes the software "AcqNMR" that is used to set experimental parameters, monitor the tuning and matching of the RF coil, loading different pulse sequences, calibrate flip angle, data acquisition and curve fitting, among other functions. Also includes a depth gauge, some weights and a depth stopper. | |
| Trizma Pre-Set Crystals (pH 7.6) | Sigma-Aldrich, St. Louis, MO, USA | T7943 |
Ссылки
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Research. 66 (22), 10855-10860 (2006).
- Witney, T. H., Brindle, K. M. Imaging tumour cell metabolism using hyperpolarized 13C magnetic resonance spectroscopy. Biochemical Society Transactions. 38 (5), 1220-1224 (2010).
- Kurhanewicz, J., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Golman, K., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magnetic Resonance in Medicine. 59 (5), 1005-1013 (2008).
- Golman, K., in 't Zandt, R., Thaning, M. Real-time metabolic imaging. Proceedings of the National Academy of Science of the United States of America. 103 (30), 11270-11275 (2006).
- Day, S. E., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magnetic Resonance in Medicine. 65 (2), 557-563 (2011).
- Gallagher, F. A., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Wilson, D. M., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. Journal of Magnetic Resonance. 205 (1), 141-147 (2010).
- Gallagher, F. A., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proceedings of the National Academy of Science of the United States of America. 106 (47), 19801-19806 (2009).
- Chen, A. P., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magnetic Resonance Imaging. 26 (6), 721-726 (2008).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magnetic Resonance in Medicine. 60 (2), 253-257 (2008).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Ishii, M., et al. Hyperpolarized 13C MRI of the pulmonary vasculature and parenchyma. Magnetic Resonance in Medicine. 57 (3), 459-463 (2007).
- Lau, A. Z., Chen, A. P., Cunningham, C. H. Integrated Bloch-Siegert B(1) mapping and multislice imaging of hyperpolarized (1)(3)C pyruvate and bicarbonate in the heart. Magnetic Resonance in Medicine. 67 (1), 62-71 (2012).
- Lau, A. Z., et al. Rapid multislice imaging of hyperpolarized 13C pyruvate and bicarbonate in the heart. Magnetic Resonance in Medicine. 64 (5), 1323-1331 (2010).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10435-10439 (2003).
- Johansson, E., et al. Cerebral perfusion assessment by bolus tracking using hyperpolarized 13C. Magnetic Resonance in Medicine. 51 (3), 464-472 (2004).
- Johansson, E., et al. Perfusion assessment with bolus differentiation: a technique applicable to hyperpolarized tracers. Magnetic Resonance in Medicine. 52 (5), 1043-1051 (2004).
- Albers, M. J., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Research. 68 (20), 8607-8615 (2008).
- Chen, A. P., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magnetic Resonance in Medicine. 58 (6), 1099-1106 (2007).
- Lupo, J. M., et al. Analysis of hyperpolarized dynamic 13C lactate imaging in a transgenic mouse model of prostate cancer. Magnetic Resonance Imaging. 28 (2), 153-162 (2010).
- von Morze, C., et al. Imaging of blood flow using hyperpolarized [(13)C]urea in preclinical cancer models. Journal of Magnetic Resonance Imaging. 33 (3), 692-697 (2011).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magnetic Resonance in Medicine. 66 (2), 505-519 (2011).
- Park, I., et al. Detection of early response to temozolomide treatment in brain tumors using hyperpolarized 13C MR metabolic imaging. Journal of Magnetic Resonance Imaging. 33 (6), 1284-1290 (2011).
- Bohndiek, S. E., et al. Detection of tumor response to a vascular disrupting agent by hyperpolarized 13C magnetic resonance spectroscopy. Molecular Cancer Therapeutics. 9 (12), 3278-3288 (2010).
- Witney, T. H., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-13C]pyruvate and [1,4-13C2]fumarate. British Journal of Cancer. 103 (9), 1400-1406 (2010).
- Levitt, M. H. . Spin dynamics: basics of nuclear magnetic resonance. , (2001).
- Mieville, P., Jannin, S., Bodenhausen, G. Relaxometry of insensitive nuclei: optimizing dissolution dynamic nuclear polarization. Journal of Magnetic Resonance. 210 (1), 137-140 (2011).
- Redfield, A. G. Shuttling device for high-resolution measurements of relaxation and related phenomena in solution at low field, using a shared commercial 500 MHz NMR instrument. Magnetic Resonance in Chemistry. 41 (10), 753-768 (2003).
- Grosse, S., Gubaydullin, F., Scheelken, H., Vieth, H. -. M., Yurkovskaya, A. V. Field cycling by fast NMR probe transfer: Design and application in field-dependent CIDNP experiments. Applied Magnetic Resonance. 17 (2), 211-225 (1999).
- Kimmich, R., Anoardo, E. Field-cycling NMR relaxometry. Progress in Nuclear Magnetic Resonance Spectroscopy. 44 (3-4), 257-320 (2004).
- Guðjónsdóttir, M., Belton, P., Webb, G. . Magnetic Resonance in Food Science: Challenges in a Changing World. , 65-72 (2009).
- Anoardo, E., Galli, G., Ferrante, G. Fast-field-cycling NMR: Applications and instrumentation. Applied Magnetic Resonance. 20 (3), 365-404 (2001).
- Chattergoon, N., Martinez-Santiesteban, F., Handler, W. B., Ardenkjaer-Larsen, J. H., Scholl, T. J. Field dependence of T1 for hyperpolarized [1-13C]pyruvate. Contrast Media & Molecular Imaging. 8 (1), 57-62 (2013).
- Martínez-Santiesteban, F. M., Dang, T. P., Lim, H., Chen, A. P., Scholl, T. J. T1 nuclear magnetic relaxation dispersion of hyperpolarized sodium and cesium hydrogencarbonate-13C. NMR in Biomedicine. 30 (9), 3749 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены