Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesurer la dépendance au champ magnétique de relaxation spin-lattice de l'hyperpolarisé [1-13C]pyruvate
Dans cet article
Résumé
Nous présentons un protocole pour mesurer la dépendance de champ magnétique du temps de relaxation spin-lattice de 13composés C-enrichis, hyperpolarisés au moyen de la polarisation nucléaire dynamique, utilisant la relaxométrie champ-cycle rapide. Plus précisément, nous l'avons démontré avec [1-13C]pyruvate, mais le protocole pourrait être étendu à d'autres substrats hyperpolarisés.
Résumé
La limite fondamentale aux applications d'imagerie in vivo des composés hyperpolarisés 13C-enrichis est leurs temps finis de relaxation spin-lattice. Divers facteurs influent sur les taux de relaxation, tels que la composition tampon, le pH de la solution, la température et le champ magnétique. À cet égard, le temps de relaxation spin-lattice peut être mesuré aux forces cliniques de champ, mais aux champs inférieurs, où ces composés sont distribués du polariseur et transportés à l'IRM, la relaxation est encore plus rapide et difficile à mesurer. Pour avoir une meilleure compréhension de la quantité de magnétisation perdue pendant le transport, nous avons utilisé la relaxométrie rapide de champ-cyclisme, avec la détection de résonance magnétique de 13noyaux de C à 0,75 T, pour mesurer la dispersion de résonance magnétique nucléaire de la temps de relaxation spin-lattice de hyperpolarisé [1-13C]pyruvate. La polarisation nucléaire dynamique de dissolution a été employée pour produire des échantillons hyperpolarisés de pyruvate à une concentration de 80 mmol/L et pH physiologique (7,8). Ces solutions ont été rapidement transférées à un relaxomètre rapide de vélo de champ de sorte que la relaxation de la magnétisation d'échantillon pourrait être mesurée en fonction du temps en utilisant un petit angle de flip calibré (3-5 ' . Pour cartographier la dispersion T1 du C-1 du pyruvate, nous avons enregistré des données pour différents champs de relaxation allant de 0,237 mT à 0,705 T. Avec cette information, nous avons déterminé une équation empirique pour estimer la relaxation spin-lattice du substrat hyperpolarisé dans la gamme mentionnée des champs magnétiques. Ces résultats peuvent être utilisés pour prédire la quantité de magnétisation perdue pendant le transport et pour améliorer les conceptions expérimentales pour minimiser la perte de signal.
Introduction
L'imagerie spectroscopique par résonance magnétique (IRM) peut produire des cartes spatiales de métabolites détectés par imagerie spectroscopique, mais son utilisation pratique est souvent limitée par sa sensibilité relativement faible. Cette faible sensibilité des méthodes d'imagerie par résonance magnétique in vivo et de spectroscopie provient du petit degré de magnétisation nucléaire réalisable à la température du corps et des forces raisonnables du champ magnétique. Cependant, cette limitation peut être surmontée par l'utilisation de la polarisation nucléaire dynamique (DNP) pour améliorer considérablement la magnétisation in vitro des substrats liquides, qui sont ensuite injectés pour sonder le métabolisme in vivo en utilisant MRSI1,2 , 3 (en) , 4. DNP est capable d'améliorer la magnétisation de la plupart des noyaux avec spin nucléaire non-zéro et a été utilisé pour augmenter in vivo la sensibilité MRSI de 13composés enrichis en C tels que pyruvate5,6, bicarbonate 7,8, fumarate9, lactate10, glutamine11, et d'autres par plus de quatre ordres de magnitude12. Ses applications incluent l'imagerie de la maladie vasculaire13,14,15, perfusion d'organes13,16,17,18, cancer détection1,19,20,21,22, tumeur staging23,24, et quantification de la réponse thérapeutique2 , 6 Annonces , 23 Ans, états-unis , 24 Ans, états-unis , 25 Annonces , 26.
La relaxation lente de spin-lattice est essentielle pour la détection in vivo avec MRSI. Les temps de relaxation spin-lattice(T1s) de l'ordre de dizaines de secondes sont possibles pour les noyaux avec de faibles rapports gyromagnétiques dans de petites molécules en solution. Plusieurs facteurs physiques influencent le transfert d'énergie entre une transition de spin nucléaire et son environnement (lattice) conduisant à la relaxation, y compris la force du champ magnétique, la température et la conformation moléculaire27. La relaxation dipolaire est réduite en molécules pour les positions de carbone sans protons directement attachés, et la deutération des médias de dissolution peut encore réduire la relaxation dipolar intermoléculaire. Malheureusement, les solvants deuterated ont des capacités limitées pour prolonger la relaxation in vivo. Une relaxation accrue des carbonyles ou des acides carboxyliques (comme le pyruvate) peut se produire à des forces de champ magnétique élevées en raison de l'anisotropie chimique de décalage. La présence d'impuretés paramagnetic du chemin fluide pendant la dissolution après polarisation peut causer la relaxation rapide et doivent être évitées ou éliminées utilisant des chélateurs.
Il existe très peu de données pour la relaxation de 13composés contenant des C dans les champs bas, où la relaxation du lattice de spin pourrait être beaucoup plus rapide. Cependant, il est important de mesurer T1 à des champs bas pour comprendre la relaxation lors de la préparation de l'agent utilisé pour l'imagerie in vivo, puisque les agents de contraste hyperpolarisés sont généralement distribués à partir de l'appareil DNP près ou à la terre champ. D'autres facteurs physiques tels que la concentration de substrat enrichie de 13C, le pH de solution, les tampons et la température influencent également la relaxation, et ont par conséquent un effet sur la formulation de l'agent. Tous ces facteurs sont essentiels dans la détermination des paramètres clés dans l'optimisation du processus de dissolution du DNP, et le calcul de l'ampleur de la perte de signal qui se produit dans le transport de l'échantillon de l'appareil DNP à l'aimant d'imagerie.
Les mesures de dispersion de résonance magnétique nucléaire (RmND), c'est-à-à-d., les mesures T1, en fonction du champ magnétique, sont généralement acquises à l'aide d'un spectromètre RMN. Pour obtenir ces mesures, une méthode de fermeture pourrait être utilisée lorsque l'échantillon est d'abord transporté hors du spectromètre pour se détendre à un champ déterminé par sa position dans le champ de frange de l'aimant28,29,30 puis rapidement transféré dans l'aimant RMN pour mesurer sa magnétisation restante. En répétant ce processus au même point dans le champ magnétique, mais avec des périodes croissantes de relaxation, une courbe de relaxation peut être obtenue, qui peut ensuite être analysée pour estimer T1.
Nous utilisons une technique alternative connue sous le nom de relaxométrie rapide de champ-cyclisme31,32,33 pour acquérir nos données de NMRD. Nous avons modifié un relaxomètre commercial de vélo de terrain (voir Tableau des matériaux), pour des mesures T1 de solutions contenant des noyaux hyperpolarisés de 13C. Par rapport à la méthode de la navette, le vélo sur le terrain permet à ce relaxomètre d'acquérir systématiquement des données NMRD sur une plus petite gamme de champs magnétiques (0,25 mT à 1 T). Ceci est accompli en changeant rapidement le champ magnétique lui-même, pas l'emplacement de l'échantillon dans le champ magnétique. Par conséquent, un échantillon peut être magnétisé à une force de champ élevée, « détendu » à une force de champ inférieure, puis mesuré par l'acquisition d'une induction libre-décroissance à un champ fixe (et fréquence de Larmor) pour maximiser le signal. Cela signifie que la température de l'échantillon peut être contrôlée pendant la mesure, et la sonde RMN n'a pas besoin d'être réglée à chaque champ de relaxation favorisant l'acquisition automatique sur toute la plage de champ magnétique.
Concentrant nos efforts aux effets de la distribution et du transport des solutions hyperpolarisées à faible champ magnétique, ce travail présente une méthodologie détaillée pour mesurer le temps de relaxation spin-lattice de 13C-pyruvate hyperpolarisé à l'aide rapide relaxométrie sur le terrain pour les champs magnétiques de l'ordre de 0,237 mT à 0,705 T. Les principaux résultats de l'utilisation de cette méthodologie ont déjà été présentés pour [1-13C]pyruvate34 et 13C enrichi soudsodium et césium bicarbonate35 où d'autres facteurs tels que la concentration radicale et le pH de dissolution ont également été étudié.
Protocole
1. Préparation de l'échantillon
REMARQUE : Les étapes 1.1-1.8 ne sont effectuées qu'une seule fois
- Préparer 1 mL de stock 13C-enrichi solution d'acide pyruvic, largement utilisé pour la recherche in vivo 1,5,6, composé de 15 mmol/L de radical triarylmethyl dissous en [1- 13 (en) C]pyruvic acid (voir Tableau des matériaux). Aliquots de cette solution de stock sera utilisé pour les échantillons qui seront individuellement polarisés et subiront par la suite la relaxométrie à différents champs magnétiques. Une représentation de la molécule d'acide pyruvic [1-13C]est montrée dans la figure 1.
- Sur l'interface logicielle de polarisation nucléaire dynamique (voir Tableau des matériaux),cliquez sur le bouton Cooldown pour abaisser la température de l'insert à température variable (VTI) à 1,4 K.
- Une fois que le DNP a atteint la température désirée, chargez 10 l de la solution de stock dans une tasse d'échantillon, ouvrez les portes de la tourelle et insérez la tasse dans le VTI à l'aide d'une baguette d'insertion spécialement conçue pour cette tâche.
- Après cela, extraire rapidement la baguette magique et assurez-vous que la tasse est libérée. Fermez ensuite les portes de la tourelle et continuez avec les étapes suivantes pendant que la température de la VTI remonte à 1,4 K.
- Préparer le DNP pour exécuter un balayage micro-ondes afin de trouver la fréquence RF optimale pour l'hyperpolarisation de la solution de stock.
- Sur l'ordinateur contrôlant le spectromètre (partie du système DNP), établir la communication entre le spectromètre et le logiciel de contrôle DNP en cliquant en deux clics sur l'icône HyperTerminal, précédemment configurée avec la communication en série appropriée Paramètres.
- Une fois la communication établie, lancez le logiciel RINMR, tapez dans sa ligne de commande. HYPERSENSENMR, puis appuyez sur entrez.
- Après cela, une nouvelle fenêtre sera affichée sur l'écran et sur elle tapez le numéro un (1) dans le champ numéro de configuration. Ensuite, cliquez sur le bouton Configuration Sélectionner.
- Cliquez sur le bouton Ne micro-ondes balayage. Une petite fenêtre avec un compteur descendant de secondes sera lancée indiquant que le spectromètre est prêt et qu'il attendra des signaux de déclenchement périodiques, provenant du logiciel de contrôle DNP, pour échantillonner la polarisation.
- Sur le logiciel de contrôle DNP, sélectionnez l'onglet Calibrate et cliquez sur le bouton Générer.
- À l'aide de la fenêtre d'étalonnage, entrez les informations suivantes : Fréquence de démarrage 94,117 GHz, Fréquence finale 94,137 GHz, Taille de l'étape 1 MHz, Durée de l'étape 300 s, Puissance de 50 mW, Niveau d'hélium liquide de 65 %, et Température 1,4 K.
- Cliquez sur le bouton Générer, qui fermera la fenêtre de configuration et de revenir à l'onglet Calibrate qui affichera le nombre d'étapes et le temps nécessaire pour effectuer le balayage micro-ondes souhaité.
- Une fois que la température VTI souhaitée est atteinte, cliquez sur le bouton Activer, puis commencez à paraphéler le processus de balayage des micro-ondes.
- À la fin du balayage des micro-ondes, récupérez l'échantillon et enregistrez la fréquence optimale là où la polarisation maximale est atteinte. Cette fréquence optimale est définie comme la fréquence de polarisation qui fournit la polarisation maximale comme indiqué dans la figure 2. Cette fréquence sera utilisée pour hyperpolariser tous les aliquots obtenus à partir de cette solution de stock spécifique d'acide pyruvic.
- Préparer 250 ml de milieu de dissolution des stocks à l'aide d'une solution de base tris de 40 mmol/L, de 50 mmol/L de chlorure de sodium et d'hydroxyde de sodium de 80 mmol/L dans de l'eau désionisée. Ajouter l'acide éthylènediaminetetraacetic (EDTA) à une concentration de 100 mg/L pour séquestrer toute contamination d'ions métalliques. Comme pour la solution de stock d'acide pyruvic, ce milieu de dissolution sera utilisé pour tous les différents échantillons qui seront polarisés. Consultez le Tableau des matériaux pour plus de détails sur les produits chimiques utilisés.
- En outre, préparez 500 ml de solution de nettoyage de stock composée de 100 mg/L EDTA dissous dans l'eau déionisée. Environ 10 ml de cette solution de nettoyage est utilisé après chaque polarisation pour nettoyer la voie de dissolution du DNP.
REMARQUE : Les étapes 1.9-1.27 sont exécutées pour chaque échantillon individuel. - Refroidir l'appareil DNP à 1,4 K en préparation de l'hyperpolarisation d'un échantillon d'acide pyruvic [1-13C]en appuyant sur le bouton De refroidissement dans la fenêtre principale du DNP.
- Si le logiciel utilisé pour le spectromètre est déjà actif avec la configuration 1 sélectionnée, procédez aux étapes suivantes. Sinon, effectuez des étapes 1.5.1 à 1.5.3 et continuez ensuite avec les étapes suivantes.
- Après vérification de la sélection de la configuration 1 dans la fenêtre contrôlant le spectromètre du DNP, cliquez sur le bouton Solid Build Up.
- Entrez le nom de fichier SSBuilupXXX, où "XXX" est un nombre dans la séquence de fichiers stockés avec des données d'accumulation. Ce nombre est automatiquement incrémenté par le logiciel. Ensuite, cliquez sur OK. Comme le cas de balayage micro-ondes, une petite fenêtre avec un compteur descendant de secondes sera lancée indiquant que le spectromètre est prêt et qu'il attendra des signaux de déclenchement périodiques, provenant du logiciel de contrôle DNP, pour échantillonner la polarisation .
- À l'aide de l'acide pyruvic - la solution de bouillon OX063 préparée à l'étape 1.1, peser 30 mg dans une tasse d'échantillon.
- Lorsque la température VTI souhaitée est atteinte (1,4 K) cliquez sur Insérer l'échantillon, puis sélectionnez L'échantillon normal, puis cliquez sur Suivant. En suivant les précautions de sécurité affichées sur l'écran, insérez la tasse dans l'appareil DNP froid, à l'aide d'une longue baguette spécialement conçue pour cette tâche.
- Une fois la tasse insérée, la baguette a été enlevée et les portes DNP fermées, cliquez sur Suivant et terminez. À ce moment-là, le système d'hyperpolarisateur abaisse la tasse d'échantillon à la chambre d'irradiation partiellement remplie (65%) avec de l'hélium liquide.
- Attendez que la température soit revenue à 1,4 K, puis cliquez sur le bouton Polarize Sample.
- Dans la nouvelle fenêtre pop up, définir la valeur de fréquence à celle obtenue à partir du balayage micro-ondes dans l'étape 1.6. Dans la même fenêtre, placez également la puissance à 50 mW et le temps d'échantillonnage à 300 s. Cliquez sur Suivant, cochez la case de surveillance de l'accumulation d'activer, puis cliquez sur Finish.
REMARQUE : Une fois que la polarisation est commencée, le logiciel de contrôle DNP génère des signaux de déclenchement tous les 300 s pour instruire le spectromètre pour échantillonner la polarisation à l'aide d'un petit angle de pointe. De cette façon, le logiciel de spectromètre ajoute un point d'échantillon à une courbe de magnétisation à l'état solide, maintenant affiché à la fois dans le logiciel de spectromètre et dans le logiciel de contrôle DNP sous l'onglet Polarisation Build-Up. Après le 4ème échantillon et chaque échantillon après cela, le logiciel de spectromètre s'adapte à la courbe à une fonction de croissance exponentielle de la forme:
S - A exp (-t/Tp) 'y0
où A est l'amplitude de polarisation, dans les unités arbitraires, t est le temps d'échantillonnage, Tp est le temps de polarisation constante (à la fois en secondes), et y0 est un décalage. Sur la base des paramètres ajustés, le logiciel calcule également le pourcentage de polarisation atteint jusqu'à ce point dans le temps, qui est également affiché dans l'onglet Statut de polarisation du DNP. - Polariser jusqu'à ce que l'accumulation de la magnétisation à l'état solide atteigne au moins 95 % du maximum (environ une heure).
- Pendant que l'échantillon est polarisant, préparez le Relaxomètre Fast-Field-Cycling comme expliqué dans la section 2 ci-dessous.
- Lorsque la polarisation souhaitée est atteint, cliquez sur Run Dissolution et sous Méthode, sélectionnez Pyruvic Acid Test. Ensuite, cliquez sur Suivant.
- En suivant les instructions sur l'écran, ouvrez les portes de la tourelle DNP et chargez la chambre chauffante et pressurisante en haut de l'appareil avec 4,55 ml du support de dissolution préparé à la section 1.5 pour produire une concentration de 80 mmol/L pyruvate sur dissolution à un pH de 7,75 euros et à une température de 37 oC.
- Placez la baguette de récupération dans la bonne position, fermez les portes de la tourelle, et à l'ordinateur cliquez sur Suivant, puis sur la finition. À ce moment-là, les supports de dissolution seront surchauffés jusqu'à ce que la pression atteigne 10 barres.
- Une fois que la pression de 10 barres est atteinte, le pyruvate congelé et hyperpolarisé est automatiquement soulevé du bain d'hélium liquide, rapidement mélangé, et décongelé avec le support de dissolution surchauffé et éjecté par un tube capillaire dans un flacon en forme de poire. Pendant que le mélange de pyruvate/dissolution hyperpolarisé est éjecté, faites constamment tourbillonner le flacon pour assurer un mélange homogène.
- Lorsque tout le mélange a été éjecté, puisez rapidement 1,1 ml du liquide dans une seringue, transférez-le dans un tube RMN de 10 mm de diamètre préréchauffé (37 oC) et transportez rapidement vers le défrisant sur le terrain (voir l'étape 2.2.12).
- Distribuez l'aliquot restant de chaque dissolution pyruvate dans un spectromètre NMR de 0,55 T (voir Tableau des matériaux) pour vérifier les effets expérimentaux systématiques possibles.
- Immédiatement nettoyer la voie de fluide DNP en utilisant le milieu de dissolution propre suivie de l'éthanol. Soufflez le gaz d'hélium par le chemin fluide pour enlever les fluides de nettoyage restants et purgez le chemin de l'oxygène. Nettoyer toute la verrerie.
- Après chaque mesure, enregistrez le pH des échantillons du spectromètre de prés et du défrisant sur le terrain.
REMARQUE : Chaque mesure T1 est une dissolution hyperpolarisée séparée de l'appareil DNP, de sorte qu'il faut veiller à assurer la reproductibilité de la reproductibilité de la mesure à la mesure de la composition de l'échantillon. Pour ce faire, il faut peser tous les agents et solvants avec une précision de 0,1 mg pour assurer une préparation précise et reproductible des solutions finales hyperpolarisées.
2. Relaxométrie
REMARQUE Veuillez consulter le tableau 1 pour mieux comprendre la sélection et l'utilisation des différents paramètres décrits dans les étapes suivantes. Avant la dissolution, l'angle de flip de relaxomètre doit être calculé et le relaxomètre doit être installé et prêt pour la mesure de la solution hyperpolarisée (voir ci-dessous).
- Calibrage à angle de bascule
- Préparer 1 ml d'acide pylrévic (1-13C]dans un tube RMN et ajouter un agent de contraste de gadolinium pour réduire le T1 des noyaux de 13C à une valeur inférieure à 200 ms mais plus de 50 ms.
- Scellez le tube RMN afin qu'il puisse être utilisé plusieurs fois comme norme d'étalonnage.
- À l'aide de la jauge de profondeur du relaxomètre, définir la profondeur d'insertion du tube RMN à la hauteur appropriée pour s'assurer que l'échantillon sera situé au centre de la bobine de réfrons.
- Marquez la profondeur d'insertion de la norme d'étalonnage du pyruvate 13C avec du ruban adhésif pour assurer la répétabilité.
- Placez le bouchon de profondeur sur le tube RMN à la position indiquée par le ruban adhésif et insérez cette norme d'étalonnage dans l'alésage du défrisant sur le terrain. Utilisez un poids pour maintenir le tube RMN en position.
- Ouvrez la soupape d'air de l'instrument et à partir du panneau avant relaxomètre, le contrôleur de température est passé à 37 oC. Cela maintiendra la température de l'échantillon à 37 oC (0,5 oC) à l'aide d'air chauffé pendant l'expérience.
- Configurez le matériel de relaxomètre de vélo sur le terrain pour acquérir des signaux de noyaux de 13C. Cela comprend l'installation et l'énergisation de la bobine de cale externe (voir Tableau des matériaux),l'accordage et l'appariement de la bobine RF à 8 MHz (0,75 T pour 13noyaux C), et en utilisant le câble approprié .
- Dans le logiciel d'instrument, effectuez les étapes suivantes :
- Sélectionnez l'onglet Main par
- Cliquez sur la cellule à côté de l'étiquette Expérience et faites défiler vers le bas dans la fenêtre pop-up pour sélectionner la séquence d'impulsion "13CANGLE. FFC ".
- Définir les paramètres d'acquisition suivants : RFA 5; SWT 0,005, RD 0,5, BPOL 30 MHz, TPOL 0,5.
- Sélectionnez l'onglet Acq. par, puis sélectionnez le sous-tab de base.
- Cliquez sur la cellule à côté de l'étiquette Nucleus et faites défiler vers le bas dans la fenêtre pop-up pour sélectionner 13C.
- Ensuite, définiz les paramètres suivants : SF 8 MHz, SW 1000000, BS 652, FLTR , 100000, MS 32.
- Sélectionnez le sous-tab Conf.
- Définiz les paramètres suivants : RINH 25, ACQD et 25.
- Sélectionnez le sous-tab nDim
- Ensemble NBLK 32, BINI 2, BEND 62.
- Sélectionnez l'onglet Évaluation, puis le sous-tab Paramètres.
- Définiz les paramètres suivants : EWIP 10, EWEP 128, EWIB 1, EWEB 32.
- Ensuite, cliquez sur l'icône Démarrer l'acquisition pour exécuter la séquence d'impulsion.
- Une fois l'acquisition terminée, enregistrez les données, sélectionnez l'icône de dialogue d'évaluation et dans le menu d'analyse sélectionnez fenêtre WAM : magnitude absolue. Sélectionnez ensuite La feuille de rapport, les graphiques et le fichier d'exportation et cliquez enfin sur Execute.
- Dans la fenêtre Rapport, trouver la largeur de l'impulsion RF qui fournit l'amplitude maximale et affiner la valeur à l'aide du curseur dans le graphique affiché, qui est similaire aux parcelles montrées à la rangée inférieure de la figure 3. Cette largeur d'impulsion sera utilisée pour le paramètre PW90 des expériences suivantes.
- Cliquez sur l'icône F1 pour ajuster le changement de fréquence du relaxomètre.
REMARQUE : Fenêtre WAM : La magnitude absolue est une procédure visant à intégrer l'ampleur d'une seule ou d'une séquence d'acquisitions de désintégration à induction libre (FID) à partir du point défini par EWIP jusqu'au point spécifié par EWEP et du bloc défini par EWIB au bloc spécifié par EWEB.
- T1-Mesures
- Assurez-vous que la bobine de shim externe est installée et sous tension.
- Dans le logiciel d'instrument effectuer les étapes suivantes:
- Sélectionnez l'onglet Main par
- Cliquez sur la cellule à côté de l'étiquette Expérience et faites défiler vers le bas dans la fenêtre pop-up pour sélectionner la séquence d'impulsion HPUB / S, qui est affiché dans la figure 4.
- Définiz les paramètres d'acquisition suivants : RFA 25, T1MX et valeurs entre 3 et 5 ; SWT 0,2, RD 0, BRLX - Champ de relaxation désiré en MHz (fréquence Proton Larmor).
- Sélectionnez l'onglet Acq. par, puis sélectionnez le sous-tab de base.
- Cliquez sur la cellule à côté de l'étiquette Nucleus et faites défiler vers le bas dans la fenêtre pop-up pour sélectionner 13C.
- Ensuite, définiz les paramètres suivants : SF 8 MHz, SW 1000000, BS 652, FLTR 50000.
- Sélectionnez le sous-tab Conf.
- Définiz les paramètres suivants : PW90 égal à la valeur trouvée à l'étape 2.1.10, RINH 25, ACQD 25.
- Sélectionnez le sous-tab Puls et configurez PW 5.
- Sélectionnez le sous-tab nDim et configurez NBLK '100.
- Attendez et préparez-vous à recevoir la solution hyperpolarisée pour initier l'acquisition de données.
- Immédiatement avant d'insérer l'échantillon dans le relaxomètre, démarrer manuellement la séquence d'impulsion de la console, pour éviter d'insérer l'échantillon dans un champ magnétique nul. Pour cette raison, il est important d'ignorer la première désintégration d'induction libre (FID) au cours de l'analyse des données.
- Une fois l'acquisition terminée, enregistrez les données en cliquant sur le bouton Enregistrer.
- À l'aide du logiciel d'analyse, intégrer l'ampleur de chaque signal FID pour produire une série de données composée de magnétisation d'échantillons en fonction du temps.
- Extraire le temps de relaxation spin-lattice à partir d'un modèle exponentiel à trois paramètres à l'aide d'un algorithme standard de montage des moins carrés non linéaire s'est mis en œuvre dans un logiciel d'analyse commerciale (voir Tableau des matériaux) en supposant même une pondération pour toutes les données:
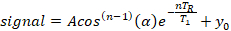
où A est l'amplitude du signal initial(y-intercept), T1 est le temps de relaxation spin-lattice, T R est le temps de répétition, qui est une valeur connue, y0 est le signal offset, et cos(n-1)() est une correction pour la perte de magnétisation longitudinale à la mesure nth pour un angle de flip, ..
Résultats
La figure 2 présente un exemple de balayage à micro-ondes à haute résolution pour l'acide pyruvic. Pour le cas présenté, cette fréquence optimale de micro-ondes correspond à 94.128 GHz, accentuée dans l'insert de figure. Notre système DNP peut normalement fonctionner dans la gamme de 93.750 GHz à 94.241 GHz avec la taille d'étape de 1 MHz, le temps de polarisation de jusqu'à 600 s, et la puissance de jusqu'à 100 mW. Une gamme complète de fréquences est étudiée uniquement po...
Discussion
L'utilisation de DNP pour améliorer l'acquisition du signal est une solution technique à un signal de résonance magnétique insuffisant disponible à partir de 13noyaux C à des concentrations limitées, comme ceux utilisés dans les injections animales, mais présente d'autres défis expérimentaux. Chaque mesure de relaxation présentée à la figure 7 représente une mesure d'un échantillon préparé de façon unique parce qu'il ne peut pas être repolarisé après la disso...
Déclarations de divulgation
Les auteurs n'ont pas de divulgations.
Remerciements
Les auteurs aimeraient remercier l'Institut ontarien de recherche sur le cancer, le Programme de traduction en imagerie et le Conseil de recherches en sciences naturelles et en génie du Canada d'avoir financé cette recherche. Nous tenons également à souligner les discussions utiles avec Albert Chen, GE Healthcare, Toronto, Canada, Gianni Ferrante, Stelar s.r.l., Italie, et William Mander, Oxford Instruments, Royaume-Uni.
matériels
| Name | Company | Catalog Number | Comments |
| [1-13C]Pyruvic Acid | Sigma-Aldrich, St. Louis, MO, USA | 677175 | |
| 10mm NMR Tube | Norell, Inc., Morganton NC, USA | 1001-8 | |
| De-ionized water | |||
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich, St. Louis, MO, USA | E5134 | |
| HyperSense Dynamic Nuclear Polarizer | Oxford Instruments, Abingdon, UK | Includes the following: "DNP-NMR Polarizer" software used to control and monitor the whole DNP polarizer; "RINMR" used to monitor the solid state polarization levels; "HyperTerminal" used to communicate the DNP software with the RINMR software that monitors the solid state polarization level. Also includes the MQC bench top spectrometer to monitor the liquid state polarization in conjunction with it own RINMR software | |
| MATLAB R2017b | MathWorks, Natick, MA | Include scripts for non-linear fitting of magnetization decay over time and T1 NMRD analysis of hyperpolarized pyruvic acid. | |
| OX063 Triarylmethyl radical | Oxford Instruments, Abingdon, UK | ||
| pH meter - SympHony | VWR International, Mississauga, ON., Canada | SB70P | |
| ProHance | Bracco Diagnostics Inc. | Gadoteridol, Gd-HP-DO3A | |
| Pure Ethanol (100% pure) | Commercial Alcohols, Toronto, ON, Canada | P016EAAN | |
| Shim Coil | Developed in-house | ||
| Sodium Chloride | Sigma-Aldrich, St. Louis, MO, USA | S7653 | |
| Sodium Hydroxide | Sigma-Aldrich, St. Louis, MO, USA | S8045 | |
| SpinMaster FFC2000 1T C/DC | Stelar s.r.l., Mede (PV) Italy | Includes the software "AcqNMR" that is used to set experimental parameters, monitor the tuning and matching of the RF coil, loading different pulse sequences, calibrate flip angle, data acquisition and curve fitting, among other functions. Also includes a depth gauge, some weights and a depth stopper. | |
| Trizma Pre-Set Crystals (pH 7.6) | Sigma-Aldrich, St. Louis, MO, USA | T7943 |
Références
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Research. 66 (22), 10855-10860 (2006).
- Witney, T. H., Brindle, K. M. Imaging tumour cell metabolism using hyperpolarized 13C magnetic resonance spectroscopy. Biochemical Society Transactions. 38 (5), 1220-1224 (2010).
- Kurhanewicz, J., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Golman, K., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magnetic Resonance in Medicine. 59 (5), 1005-1013 (2008).
- Golman, K., in 't Zandt, R., Thaning, M. Real-time metabolic imaging. Proceedings of the National Academy of Science of the United States of America. 103 (30), 11270-11275 (2006).
- Day, S. E., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magnetic Resonance in Medicine. 65 (2), 557-563 (2011).
- Gallagher, F. A., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Wilson, D. M., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. Journal of Magnetic Resonance. 205 (1), 141-147 (2010).
- Gallagher, F. A., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proceedings of the National Academy of Science of the United States of America. 106 (47), 19801-19806 (2009).
- Chen, A. P., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magnetic Resonance Imaging. 26 (6), 721-726 (2008).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magnetic Resonance in Medicine. 60 (2), 253-257 (2008).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Ishii, M., et al. Hyperpolarized 13C MRI of the pulmonary vasculature and parenchyma. Magnetic Resonance in Medicine. 57 (3), 459-463 (2007).
- Lau, A. Z., Chen, A. P., Cunningham, C. H. Integrated Bloch-Siegert B(1) mapping and multislice imaging of hyperpolarized (1)(3)C pyruvate and bicarbonate in the heart. Magnetic Resonance in Medicine. 67 (1), 62-71 (2012).
- Lau, A. Z., et al. Rapid multislice imaging of hyperpolarized 13C pyruvate and bicarbonate in the heart. Magnetic Resonance in Medicine. 64 (5), 1323-1331 (2010).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10435-10439 (2003).
- Johansson, E., et al. Cerebral perfusion assessment by bolus tracking using hyperpolarized 13C. Magnetic Resonance in Medicine. 51 (3), 464-472 (2004).
- Johansson, E., et al. Perfusion assessment with bolus differentiation: a technique applicable to hyperpolarized tracers. Magnetic Resonance in Medicine. 52 (5), 1043-1051 (2004).
- Albers, M. J., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Research. 68 (20), 8607-8615 (2008).
- Chen, A. P., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magnetic Resonance in Medicine. 58 (6), 1099-1106 (2007).
- Lupo, J. M., et al. Analysis of hyperpolarized dynamic 13C lactate imaging in a transgenic mouse model of prostate cancer. Magnetic Resonance Imaging. 28 (2), 153-162 (2010).
- von Morze, C., et al. Imaging of blood flow using hyperpolarized [(13)C]urea in preclinical cancer models. Journal of Magnetic Resonance Imaging. 33 (3), 692-697 (2011).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magnetic Resonance in Medicine. 66 (2), 505-519 (2011).
- Park, I., et al. Detection of early response to temozolomide treatment in brain tumors using hyperpolarized 13C MR metabolic imaging. Journal of Magnetic Resonance Imaging. 33 (6), 1284-1290 (2011).
- Bohndiek, S. E., et al. Detection of tumor response to a vascular disrupting agent by hyperpolarized 13C magnetic resonance spectroscopy. Molecular Cancer Therapeutics. 9 (12), 3278-3288 (2010).
- Witney, T. H., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-13C]pyruvate and [1,4-13C2]fumarate. British Journal of Cancer. 103 (9), 1400-1406 (2010).
- Levitt, M. H. . Spin dynamics: basics of nuclear magnetic resonance. , (2001).
- Mieville, P., Jannin, S., Bodenhausen, G. Relaxometry of insensitive nuclei: optimizing dissolution dynamic nuclear polarization. Journal of Magnetic Resonance. 210 (1), 137-140 (2011).
- Redfield, A. G. Shuttling device for high-resolution measurements of relaxation and related phenomena in solution at low field, using a shared commercial 500 MHz NMR instrument. Magnetic Resonance in Chemistry. 41 (10), 753-768 (2003).
- Grosse, S., Gubaydullin, F., Scheelken, H., Vieth, H. -. M., Yurkovskaya, A. V. Field cycling by fast NMR probe transfer: Design and application in field-dependent CIDNP experiments. Applied Magnetic Resonance. 17 (2), 211-225 (1999).
- Kimmich, R., Anoardo, E. Field-cycling NMR relaxometry. Progress in Nuclear Magnetic Resonance Spectroscopy. 44 (3-4), 257-320 (2004).
- Guðjónsdóttir, M., Belton, P., Webb, G. . Magnetic Resonance in Food Science: Challenges in a Changing World. , 65-72 (2009).
- Anoardo, E., Galli, G., Ferrante, G. Fast-field-cycling NMR: Applications and instrumentation. Applied Magnetic Resonance. 20 (3), 365-404 (2001).
- Chattergoon, N., Martinez-Santiesteban, F., Handler, W. B., Ardenkjaer-Larsen, J. H., Scholl, T. J. Field dependence of T1 for hyperpolarized [1-13C]pyruvate. Contrast Media & Molecular Imaging. 8 (1), 57-62 (2013).
- Martínez-Santiesteban, F. M., Dang, T. P., Lim, H., Chen, A. P., Scholl, T. J. T1 nuclear magnetic relaxation dispersion of hyperpolarized sodium and cesium hydrogencarbonate-13C. NMR in Biomedicine. 30 (9), 3749 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon