Method Article
מטריקס מבוסס על גידול אדם במלואו באופן שלוש מימדי הפלישה ספרואיד שיטת
* These authors contributed equally
In This Article
Summary
מיקרוסביבה הגידול הוא חלק חיוני של גידול בסרטן ופלישה. כדי לחקות התקדמות קרצינומה, צריך מטריצה אנושית רלוונטית ביולוגית. פרוטוקול זה מציג שיפור לגבי שיטת החדירה החיצונית התלת-ממדית של שלושה מימדים על-ידי החלת מטריצה אנושית המבוססת על מייומה. הפרוטוקול גם מציג ניתוח הפלישה לתא מבוסס-מחשב.
Abstract
מבוסס על תרבית דו-מימדי המבוסס על שימוש נפוץ בחקר הסרטן מחוץ לתחום. עם זאת, חסרים להם מספר אלמנטים בסיסיים היוצרים את מיקרוסביבה הגידול. כדי לקבל יותר אמין בתוצאות מחוץ לגופית, כמה תלת מימדי (3D) תרבית התרבות התאים הוכנסו. האלה מאפשרים לתאי סרטן לקיים אינטראקציה עם המטריצה המעלת. אינטראקציה זו משפיעה על התנהגות התא, כגון התפשטות ופלישה, כמו גם מורפולוגיה של תאים. בנוסף, אינטראקציה זו יכולה לגרום או לדכא את הביטוי של כמה מולקולות פרו-מוריגניים. שיטת הפלישה ספרואיד פותחה כדי לספק 3D מתאים בשיטת החוץ הגופית כדי ללמוד הפלישה לתא הסרטן. כיום, בעלי חיים נגזר מטריצות, כגון סרקומה של העכבר הנגזר מטריצה (MSDM) ו הזנב עכברוש סוג אני קולגן, משמשים בעיקר הפלישה ספרואיד הפריצה. לוקח בחשבון את ההבדלים בין סביבת מיקרו הגידול האנושי מטריצות בעלי חיים נגזר, מטריצה אנושית myoma-נגזר (HMDM) פותחה מרקמת הרחם שפיר ליפויומה. זה הוכח כי HMDM גורם הגירה ופלישה של תאים קרצינומה טוב יותר MSDM. פרוטוקול זה סיפק פשוט, הניתן לשימוש, ואמין האדם 3D המבוסס על גידול ספרואיד הפלישה באמצעות מטריצה HMDM/פיבין. הוא כולל גם הנחיות מפורטות לגבי דימות וניתוח. הספרואידים גדלים בצלחת מצורף בצורת פרסה נמוכה בתוך מטריצה של הmdm/פיבראן ופולשים דרכו. הפלישה היא התמונה היומית, נמדד, ונותחו באמצעות התוכנה ilastik ו-פיג'י ImageJ. פלטפורמת השיקול הוכחו באמצעות הגוף האנושי הראשוני גרורות קרצינומה של תאים תאים. עם זאת, הפרוטוקול מתאים גם עבור שורות אחרות תאים סרטניים מוצק.
Introduction
קונבנציונלי דו מימדי (2D) מחקרים בתרבות התא תרמו במידה ניכרת לחקר הסרטן. כיום, החוקרים הם הסטה יותר לכיוון תלת מימדי (3d) התרבות התא בחני לחקות טוב יותר את התנאים vivo1. תרבות התא 3d סרטן מדויק יותר משקף מיקרוסביבה מורכבת הגידול במונחים של תא תא ואינטראקציות תא מטריקס, פרופילי ביטוי גנטי, רגישות לסמים, ו איתות הפעילות מסלול2,3.
מספר מודלים של תאים תלת-ממדיים משמשים בחקר הסרטן כגון רקמת הגידול לחקור, גידול על שבב, ו מספרדות גידול רב-תאיים3,4. Spheroids גידול רב-תאיים הם עכשיו בשימוש נרחב, כפי שהם לחקות מספר תכונות של בתנאים vivo בגידולים אנושיים1,5. כאשר קוטר ספרואיד גדול יותר מ-500 μm, יש לו אפילו אזורים ארוי ומרכז נקרוטיק, המייצג כך במצב הגידול vivo2.
סינתטי רבים (למשל, polydiמתיל siloxane) ובעלי חיים נגזר (למשל, זנב חולדה סוג אני קולגן ועכבר סרקומה מטריצה נגזר, מטריקס, המכונה msdm) מטריצות פותחו עבור 3d התרבות התאית בחני3,6, 7,8. עד כה, אף אחד מטריצות מסחרית זמין מתוך רקמת הגידול האנושי. לכן, הם חסרים את התכונות של סביבת מיקרו הגידול האנושי, אשר יש השפעות משמעותיות על תהליכים הפלישה תאים לסרטן8.
מיוג'ל (האדם הנגזר myoma מטריצה, המכונה HMDM) מופק מרקמת הסרטן האנושי ליימיקו הגידול9. הוכח כי תוכן החלבון של HMDM שונה באופן משמעותי מזה של MSDM. למעשה, 66% של חלבונים של HMDM שונים מחלבונים MSDM. מצד שני, כמה חלבונים, כגון למינציה, סוג IV קולגן, הפאראן גופרתי פרוטאוגליקנים, nidogen, וגורם גדילה באפידרמיס, נמצאים שני מטריצות10. בנוסף, העכבר שונה מן האדם בתוכן האנזים, עם בני אדם שיש 78 פחות פרוטסים מאשר עכברים11.
פיבית נעשה בשימוש נרחב לבד או בשילוב עם חומרים אחרים כחומר הגרדום12. ב 3D התרבות התאית, מסחרית האדם זמין והתרומבין משולבים ליצירת פיג'ל הידרוגל12.
פרוטוקול זה מתאר שיפור של שהוצג בעבר 3D גידול ספרואיד הפלישה החדירה7. הפרוטוקול החדש הזה מיישם את הגידול האנושי מטריצה נגזרת במקום העכבר מטריצה הגידול הנגזר. זה כולל גם טכניקות הדמיה וניתוח באמצעות התוכנה ilastik ו-פיג'י ImageJ. פרוטוקול זה יכול לשמש לצורך שיטת שכבה של מספר קווי תאים שונים של סרטן אחיד. הוא מציע כלי רלוונטי ביולוגית כדי לפתח את הרומן נגד סרטן טיפולים כדי ללמוד את ההשפעות של מולקולות ספציפיות על הפלישה תאים סרטניים.
Protocol
1. הדור של הגידולים בגידול רב-תאי
הערה: הפרוטוקול מוצג כאן עם קווי התאים UT-SCC-42A ו-42A אבל זה גם יכול להיות מוחל באמצעות קווי תאים אחרים.
- לרחוץ את UT-SCC-42A ו-42A תאים עם 6 מ ל של פוספט מתכלה באגירה (PBS), להוסיף 0.05% טריפסין-EDTA (3 מ ל עבור 75 ס"מ2 בקבוקון), ולמקם את הבקבוקון בחממה תרבות התא (37 ° c, 5% CO2, 95% לחות) עבור 2-5 min.
- בדוק כי התאים התנתק תחת מיקרוסקופ. לאחר מכן להוסיף בינונית שונה ביותר של Dulbecco של הנשר (DMEM דיה) התקשורת (DMEM גברת + 10% סרום העובר, 100 U/mL פניצילין, 100 μg/mL סטרפטומיצין, 250 ng/mL אמפוריטיצין B, 0.4 μg/mL הידרוקורטיזון, ו 50 μg/mL חומצה אסקורבית) כדי לנטרל את האנזים 2 בקבוקון) ולהעביר את ההשעיה התא לתוך 15 מ"ל צינור חרוט.
הערה: בחר את המדיום התרבותי של התאים המתאים לתאים הנלמדים. - צנטריפוגה את ההשעיה התא ב 200 x g עבור 5 דקות.
- הסר את הסופרנטאנט והשהה את הגלולה הסלולרית ב-2-5 mL של DMEM מלא.
- לספור את התאים ולדלל את ההשעיה התא עם DMEM מלאה לריכוז הסופי של 20,000 תאים/mL.
הערה: יש לקבוע ספירת תאים אופטימלית עבור כל קו תא. - לחלק 50 μL של השעיית התא לתוך כל מצורף במיוחד נמוכה 96-הצלחת התחתונה עגול היטב גם לריכוז הסופי של 1,000 תאים לכל טוב.
- העבר את הצלחת לאינקובטור תרבות התא (37 ° c, 5% CO2, 95% לחות). ארבעה ימים מאוחר יותר, לאשר חזותית היווצרות הגידול ספרואיד עם מיקרוסקופ הפוך ולהמשיך עם התשובה. ודא שיש רק ספרואיד אחד בבאר.
הערה: הזמן שנלקח ליצירת ספרואיד משתנה בין קווי תאים שונים.
2. שיטת הפלישה תלת ממדית
הערה: להכין פתרון 2x כי ג'ל יהיה מדולל 1:1 כאשר הוסיף לתוך הבארות.
- הפשרת HMDM בתמיסה של מניות קרח ופיברינוגן באמבט מים הנשמרת ב-37 ° c. אין להפריע הפיברינוגן עד שהוא מסיסות לחלוטין ולא לשים את הפתרון על קרח; משקעים יתרחשו.
- מערבבים יחד את הנפח המתאים של כל מגיב: 1 מ"ג/mL HMDM (הריכוז הסופי: 0.5 mg/mL), 0.6 U/mL (ריכוז סופי: 0.3 U/mL), 66.6 mg/ml (ריכוז סופי: 33.3 ומיל), ו 1 מ"ג/ml fiברינוגן (הריכוז הסופי: 0.5 mg/ml ).
הערה: מוסיפים בדיוק לפני שאתם מרימים את התערובת לבארות ועובדים במהירות; זה יהיה ליצור ג'ל בעוד כמה דקות. . לטפל רק בכמה בארות בכל פעם - הוסף 50 μL של הג לתוך כל טוב. מכוונים את הקצה לכיוון הקיר הפנימי של הבאר ומכאן באיטיות. להימנע בועות אוויר (באמצעות טכניקת הפוך ליטוף) ולנסות לא להזיז את הספרואיד ממרכז הבאר.
- החזר את הצלחת בחזרה אל החממה תרבות התא ולאפשר את המטריצה HMDM/פיברומין כדי לגבש 30 דקות, ובעדינות להוסיף 100 μL של DMEM להשלים את החלק העליון של הג.
3. הדמיה
- התמונה היומית של הספרואידים באמצעות מיקרוסקופ אור הפוך. לחילופין, השתמש במערכות הדמיה אוטומטיות.
4. מקטעי תמונה עם Ilastik
- פתח את ilastik ובחר זרימת עבודה של סיווג פיקסלים (איור 1א). הוא מסווג את הפיקסלים המבוססים על ביאורים שבוצעו על-ידי המשתמש. שמור פרוייקט ilastik (. ilp) למחשב.
- הוסף תמונות לניתוח. לחץ על נתוני קלט והוסף חדש ולאחר מכן בחר תמונות (איור 1ב).
-
לבחירת תכונה, לחצו על ' בחירת תכונות ' ובחרו ' מאפיינים ' (איור 1ג, מלבן אדום).
הערה: התכונות הנבחרות צריכות להתאים בערך למאפיינים החזותיים המפרידים בין האובייקטים לרקע, והם ישמשו להכשרת המסווג.- בחר תכונות על-ידי לחיצה על התיבות. התיבות שנבחרו הופכים לירוקות (איור 1ג, מלבן כחול).
הערה: כאן המשתמש יכול לבחור מתוך מספר סוגים שונים של תכונות וסולמות. יש לבחור בצבע/עוצמה כדי להפריד אובייקטים בהתבסס על צבע או בהירות. יש לבחור באפשרות ' קצה ' כדי להפריד אובייקטים בהתבסס על מעברי צבע של בהירות או צבעים. ' מרקם ' הוא תכונה חשובה אם האובייקטים בתמונה הם בעלי מראה מיוחד. עבור שימוש זה, צבע/עוצמה (סיגמא 0) ו-Edge (סיגמא 6) משמשים.
- בחר תכונות על-ידי לחיצה על התיבות. התיבות שנבחרו הופכים לירוקות (איור 1ג, מלבן כחול).
-
להדרכה, לחץ על הדרכה ובסעיף ' הדרכה ' קיימות שתי תוויות: תווית 1 ותווית 2 (איור 1D, מלבן אדום). אם קיימת תווית אחת בלבד, הוסף תווית חדשה על-ידי הקשה על הוסף תווית (איור 1D, מלבן כחול).
- סמן את הרקע באחת התוויות (איור 1d, צהוב) והתאים עם התווית האחרת (איור 1d, blue).
- הרכבת את התוכנה עבור 10% הראשונים של התמונות. בחרו בתמונה הבאה מהתצוגה הנוכחית.
- לאחר שהתאים והרקע מסומנים (של התמונה הראשונה), הקש על עדכון חי (איור 1D, מלבן סגול).
הערה: עם התמונה הבאה, אילאסטיק יבצע באופן אוטומטי את הניתוח בהתאם לתמונות הקודמות.
- לאחר האימון נעשה ilastik ניתח את כל התמונות, לחץ חיזוי ייצוא. בחר פילוח פשוט מהמקור; אל תבחר באפשרות ' הסתברות ' או כל דבר אחר (איור 1E).
- בחרו בתבנית הרצויה של קובץ הפלט מבחירת ' ייצוא הגדרות תמונה ' ... במקטע ' ייצוא חיזוי ' (איור 1E). לייצא את התוצאות של תיוג על ידי לחיצה על ייצוא הכל (איור 1F). הקבצים יוצאו לאותה תיקיה עם התמונות המקוריות.
הערה: בניסוי זה, נעשה שימוש בתבנית h5.
5. ניתוח שטח עם הצילום של פיג'י
-
הגדרת קנה מידה
- פתחו את התמונה המקורית עם סרגל בקנה מידה ב-פיג'י ImageJ (איור 2א). ודא שהתמונה כוללת את הגודל והממד הזהים לאלה של התמונות שנותחו. השתמש בכלי בחירת קו כדי לשרטט שורה של אורך מוכר (איור 2B).
הערה: פרוטוקול זה מבוצע על-ידי שימוש ב-1.3.2 ImageJ 1.51 (64-bit) ו-ilastik-באמצעות rc. - לחץ על ' ניתוח ' וקבע קנה מידה (איור 2ג). הגדר את המרחק הידוע בשדה ' מרחק מוכר ' והגדר את היחידה המתאימה ולחץ על הכללי (איור 2ד).
- פתחו את התמונה המקורית עם סרגל בקנה מידה ב-פיג'י ImageJ (איור 2א). ודא שהתמונה כוללת את הגודל והממד הזהים לאלה של התמונות שנותחו. השתמש בכלי בחירת קו כדי לשרטט שורה של אורך מוכר (איור 2B).
-
התקנת המאקרו
- אם תוסף ilastik אינו מותקן, בצע את הפעולות הבאות: לחץ על עזרה, עדכן.... על Imagejהחלון הפתוח, לחץ על ניהול אתרים של עדכון. בחלון הפתוח נהל את העדכון אתרים, לחץ על הבא כדי ilastik ולאחר מכן לחץ על סגור. לאחר מכן לחץ על החל שינויים בimagej של החלון ' המעדכן'. . התהליך הזה יכול להימשך זמן מה החלון הבא יהיה מידע עם הטקסט שעודכן בהצלחה. לחץ על אישור והפעל מחדש את הimagej.
- לחץ על תוספים, פקודות מאקרווהתקן (איור 3א). לאחר מכן בחר את קובץ המונה. ijm (ראה מידע משלים) ולחץ על פתח.
הערה: המאקרו נכתב במיוחד למדידת האזור. יש להתקין את המאקרו בכל פעם שהתוכנה נפתחת.
-
ניתוח שטח
- ניתוח תמונות כאשר כל התוספים מותקנים. לחץ על תוספים וגלול מטה אל ilastik (איור 3ג). בחר באפשרות יבא HDF5, בחר את הקובץ בתבנית. h5, לחץ על פתח וטען ויישם את lut (איור 3C, D).
- לחץ על לחצן a מהמקלדת (מאקרו) והאזור יופיע בחלון התקציר כאזור כולל ( איור 3E).
תוצאות
ארבעה ימים לאחר UT-SCC-42B (הקו הנייד SCC הלוע הגרורות) תא זריעה, את המטריצה (HMDM/פיברוב, MSDM, או קולגן) נוספה על spheroids הוקמה (יום 0) והפלישה היה מפוקח במשך שלושה ימים. התמונות כאן התקבלו מדי יום באמצעות מיקרוסקופ הפוך (איור 4).
לאחר שהוטבע, התאים במטריצה של הmdm/פיברוין החלו לפלוש במהירות לאחר יום אחד והאריכו את המטריצה (איור 4א). תאים ב-MSDM לא פלשו לתוך המטריצה שמסביב, במקום זאת יצרו מבנה סימטרי (איור 4ב). מצד שני, תאים בקולגן פלשו מעט, אבל בגלל הצטמקות המטריצה הניתוח היה קשה (איור 4ג). בכמה בארות קולגן, הספרואידים אפילו נעלמו לאחר שלושה ימים (איור 4ג).
איור 5 ממחיש את הקוונפיקציה של הפלישה התא ב hmdm/פיברומין של קו הגרון הראשי SCC תא UT-Scc-42a ואת קו התאים גרורתי המקביל UT-scc-42a. הווידאו (סרט 1) נלקח באמצעות מערכת ניתוח תאים בשידור חי של הmdm/פיברומין ספרואיד מראה את התנועה של תאי scc בתוך המטריצה שבה הם יוצרים קווצות ואחריו התאים האחרים.
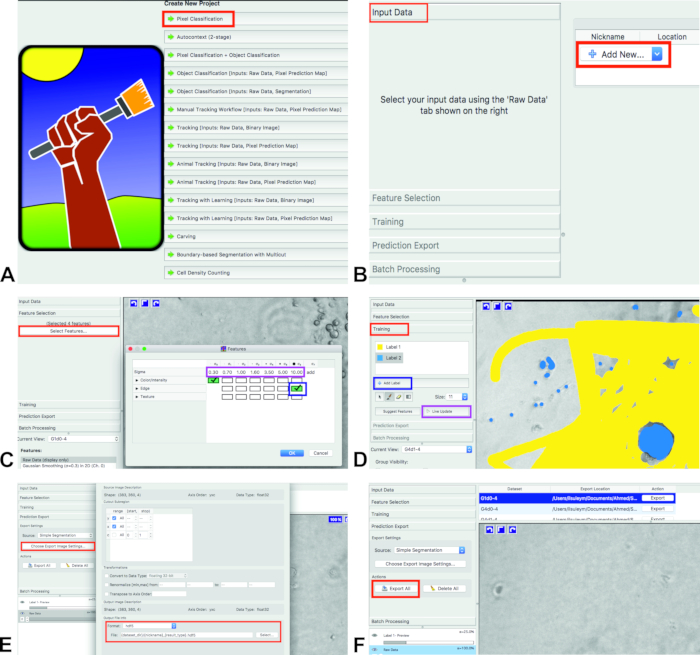
איור 1 : מקטעי תמונה. שלבים נבחרים של מקטעי תמונה באמצעות ilastik. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
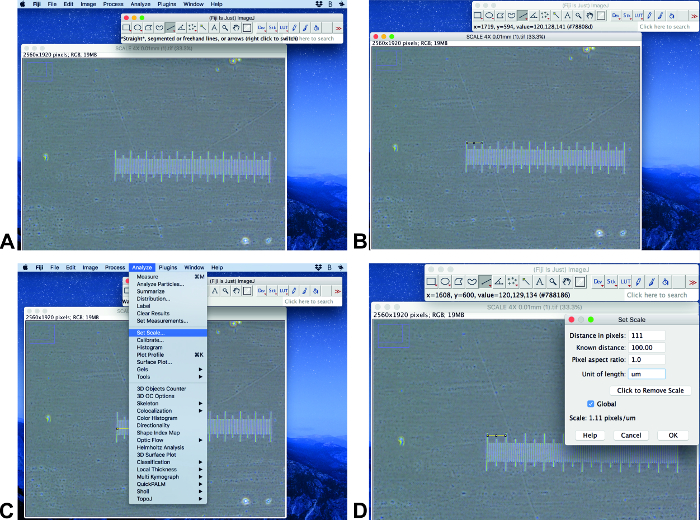
איור 2 : הגדרת קנה מידה. השלבים הנבחרים של הגדרת קנה המידה באמצעות האפשרות ImageJ של פיג'י. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
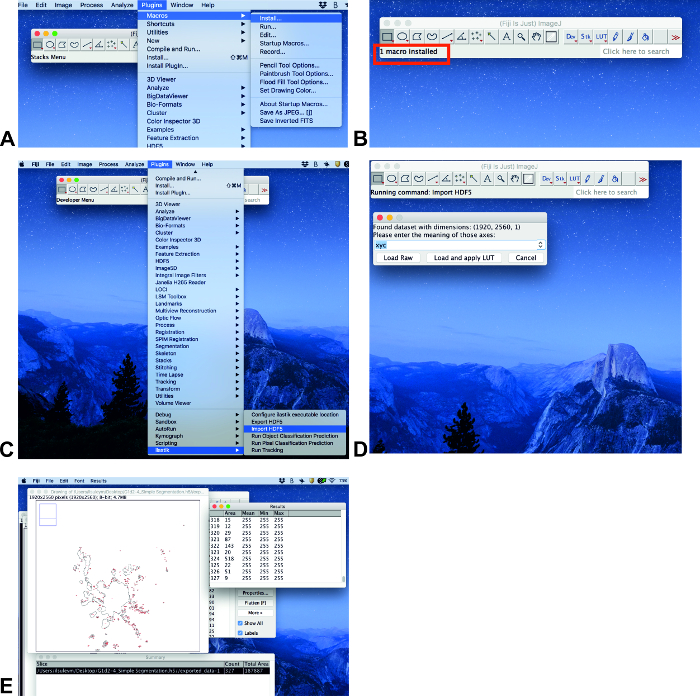
איור 3 : ניתוח פלישה באמצעות ImageJ. שלבים נבחרים בניתוח תמונה באמצעות תמונות פיג'י. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
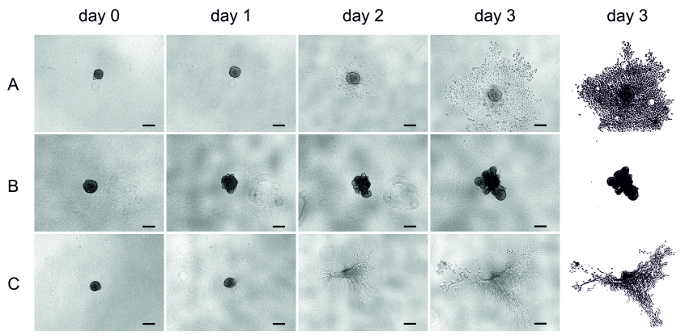
איור 4 : UT-SCC-42B תא הפלישה בשלושה מטריצות שונות. תמונות מייצגות של הפלישה תא SCC ב spheroids 3D. הפלישה הייתה בעקבותיו שלושה ימים ותמונות נלקחו מדי יום באמצעות מיקרוסקופ הפוך. (א) חmdm/פיבין, (ב) msdm, (ג) קולגן. הטור האחרון מייצג הבהרה. של הפלישה ליום השלישי סרגל קנה מידה = 200 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
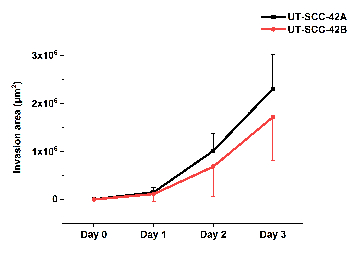
איור 5 : קוונפיקציה של פלישת התאים SCC ב-HMDM/ פימין. בדיקה ראשונית והלוע הראשי-scc-42A ו-scc המקביל הפריצה לבית המשפט הדו-שורה של הפלישה באמצעות ilastik ו-פיג'י ImageJ. תוצאות מייצגות ממוצע של ± סטיית תקן של שלושה ניסויים עצמאיים, כל אחד בטרילקאט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

וידאו 1: תנועת התאים Scc בתוך ההMDM/פיבין במשך שלושה ימים. אנא לחץ כאן כדי לצפות בסרטון וידאו זה. (לחץ לחיצה ימנית להורדה).
Discussion
השיטה המוצגת מספקת בסיס הגידול האנושי 3D של האדם כדי להעריך את הפלישה של תאים סרטניים בתוך מיקרוסביבה האדם הגידול המיקרו מטריצה. הפלישה התא סרטן ניתן למדוד בקלות על ידי הדמיה יומית עם מיקרוסקופ רגיל באמצעות תוכנת ניתוח תמונה. השיטה ממחישה את הפלישה לתא ולא רק התפשטות.
בניגוד ל-MSDM, המטריצה של HMDM/פיברוין אינה דורשת בקרת טמפרטורה. שיטה זו קלה לביצוע, במיוחד ללא צורך להעביר את הספרואידים מלוח אחד למשנהו. יש לו רק צעד אחד רגיש מבחינה טכנית, תוספת של פיבריעוגן למטריקס. מאז פיברינוגן מתחיל ג'ל לאחר כמה דקות, הוספת פיברינוגן דורש ליטוף חזק וטיפול של רק כמה בארות בכל פעם. יש גם סיכון להטריד את הספרואיד ולהניע אותו ממיקומו המרכזי בבאר בצורת U אם ליטוף נעשה באופן בלחץ גבוה. נקע של הספרואיד יכול לסבך. את ההדמיה ובסופו של דבר הניתוח
ניתן לשנות את השינוי על-ידי שינוי הריכוז של HMDM או פיברינוגן. התאים יכולים גם להיות קבועים ומוכתמים עבור מחקרים מולקולריים עוקבות. למרות ששיטה זו ניתנת לשינוי בצורה אוטומטית לחלוטין, היא יכולה גם להתבצע עם מיקרוסקופ רגיל ושתי תוכנות קוד פתוח, ללא צורך בציוד יקר.
לעומת המסורתי MSDM מבוססי 3D assays, היכולת הזאת יכולה להציג טוב יותר את המאפיינים הפלישה התא. Spheroids גדל בתוך קרום המרתף-המכיל מטריצה עשירה למינציה, כגון msdm, יכול להיות יותר התפשטות של תאים סרטניים מאשר הפלישה בפועל, עיבוד זה לא מתאים עבור בחני הפלישה מספר קווי התאים של סרטן בשל קיבולת הפולש נמוך שלהם. עוד מטריצה בשימוש תכוף, סוג אני קולגן, נוטה להתכווץ מן הקצוות במהלך טיפוח 3D, אשר משפיע על לוקליזציה ספרואיד והדמיה של הבארות. בנוסף, ההבדלים בין המאפיינים פולשני הפנימי של יותר (HSC-3) ופחות (SCC-25) הלשון אגרסיבי קרצינומה של תאים הוכחו באמצעות האדם מיקרוסביבה הגידול האנושי מחקה מודלים (myoma דיסקים ואת צורתו מסיס מטריקס)10,13.
השיטה היא גם יותר אתית משימוש ב-MSDM מאז ה-HMDM מופק מן החומר השאריות של הגידול האנושי מיומה. כיום, hmdm הוא היחיד זמין הגידול האנושי מוצר ecm שנראה להיות מתאים רבים הקשורים לסרטן בתחום החוץ מבחנהשמונה,10. בעתיד, מטריצות בעלי חיים שנגזרו על רקמות יכול להיות מוחלף על ידי מטריצות מבוססות גידול אדם כדי להפחית את הצורך להקריב בעלי חיים עבור ייצור מטריקס.
החלפת מספר התרבות של תא דו-ממדי עם שיטות תלת-ממד מספקת מידע מדויק יותר על התנהגות תא הסרטן. כיום, ישנם מספר דגמי תלת-ממד ומטריצות מסחריות, אבל, למרבה הצער, אף אחד לא מתאים לקווי התאים הסרטניים. חוקרים צריכים לבחור את המטריצה המתאימה ביותר לצורך שלהם במיוחד. התאמה אופטימלית של שיטת ומטריצה יכולה להיות מאתגרת, אך היא עשויה להגביר באופן משמעותי את האמינות של התוצאות.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המחברים מודים לתורמים של מחקר זה: הקרן הסיגליאס ג'ושי, האגודה הסרטנית של פינלנד וקרנות המחקר המרכזי של אוניברסיטת הלסינקי. המחברים מכירים את יחידת דימות ביונומרוcum באוניברסיטת הלסינקי לקבלת עזרה טכנית.
Materials
| Name | Company | Catalog Number | Comments |
| Amphotericin B solution | Merck | A2942 | |
| Aprotinin from bovine lung | Merck | A6279 | Measure the protein concentration before use. |
| Ascorbic acid | Applichem | A1052 | |
| BioLite Cell Culture Treated Flasks | Thermo Scientific | 130190 | |
| DMEM/F-12 | Gibco by Life Technologies | 31330-038 | |
| DS-Fi2 Digital Camera | Nikon Instruments | ||
| DS-U3 Digital Camera Controller | Nikon Instruments | ||
| Eclipse TS100 Inverted Microscope | Nikon Instruments | ||
| Fetal bovine serum (FBS) | Gibco by Life Technologies | 10270106 | Heat inactivate for 30 min at 56 °C in waterbath before use. |
| Fibrinogen, Plasminogen-Depleted, Human Plasma | Merck | 341578 | Solubility: 25 mg/ml in H2O. Warm the H2O and the fibrinogen to 37 °C prior to dissolution. Do not disturb until the fibrinogen is completely solubilized. Stock solutions stored at -70 °C should be thawed in a water bath maintained at 37 °C. |
| Fiji ImageJ 1.51 image processing program | Freeware, NIH | ||
| Hydrocortisone | Merck | H0888 | |
| Ilastik software for image classification and segmentation | Freeware | ||
| IncuCyte Zoom Live-Cell Analysis System | Essen BioScience | ||
| Myogel | Lab made | ||
| Penicillin-Streptomycin | Gibco by Life Technologies | 15140-122 | |
| Phosphate buffered saline (PBS) | Lab made | ||
| Scepter 2.0 Cell Counter | Merck | PHCC20040 | |
| Scepter Cell Counter Sensors, 60 µm | Merck | PHCC60050 | |
| Thrombin from human plasma | Merck | T6884-100UN | |
| Trypsin-EDTA (0.5%) 10x, no phenol red | Gibco by Life Technologies | 15400054 | |
| Ultra-Low Attachment 96-Well Plate | Corning | 7007 | |
| UT-SCC-42A and UT-SCC-42-B cell lines | The cell lines were established at the Department of Otorhinolaryngology-Head and Neck Surgery, Turku University Hospital (Turku, Finland). |
References
- Jung, H., et al. Cell Spheroids with Enhanced Aggressiveness to Mimic Human Liver Cancer In vitro and In Vivo. Scientific Reports. 7, 10499-10514 (2017).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology and Therapeutics. , 94-108 (2016).
- Albanese, A., Lam, A. K., Sykes, E. A., Rocheleau, J. V., Chan, W. C. W. Tumour-on-a-chip provides an optical window into nanoparticle tissue transport. Nature Communications. 4, 2718 (2013).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4, 309-324 (2009).
- Berens, E. B., Holy, J. M., Riegel, A. T., Wellstein, A. A Cancer Cell Spheroid Assay to Assess Invasion in a 3D Setting. Journal of Visualized Experiments. (105), e53409 (2015).
- Vinci, M., Box, C., Eccles, S. A. Three-Dimensional (3D) Tumor Spheroid Invasion Assay. Journal of Visualized Experiments. (99), e52686 (2015).
- Salo, T., et al. A novel human leiomyoma tissue derived matrix for cell culture studies. BMC Cancer. 15, 981 (2015).
- Nurmenniemi, S., et al. A novel organotypic model mimics the tumor microenvironment. The American Journal of Pathology. 175, 1281-1291 (2009).
- Salo, T., et al. Organotypic three-dimensional assays based on human leiomyoma-derived matrices. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 373 (1737), 20160482 (2018).
- Overall, C. M., Blobel, C. P. In search of partners: linking extracellular proteases to substrates. Nature Reviews Molecular Cell Biology. 8, 245-257 (2007).
- Ahmed, T. A. E., Dare, E. V., Hincke, M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Engineering Part B: Reviews. 14 (2), 199-215 (2008).
- Hoornstra, D., et al. Fermented Lingonberry Juice Inhibits Oral Tongue Squamous Cell Carcinoma Invasion In vitro Similarly to Curcumin. In Vivo. 32, 1089-1095 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved