Method Article
Voll menschliche Tumor-basierte Matrix im dreidimensionalen Spheroid-Invasions-Assay
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Mikroumgebung von Tumoren ist ein wesentlicher Bestandteil des Krebswachstums und-einmarsches. Um die Fortschreibung des Karzinoms zu imitieren, wird eine biologisch relevante menschliche Matrix benötigt. Dieses Protokoll führt eine Verbesserung für den in vitro dreidimensionalen spheroizider Invasionsuntergang ein, indem es eine menschliche, auf Gelotem basierende Matrix verwendet. Das Protokoll führt auch eine computergestützte Zellinvasion ein.
Zusammenfassung
In der In-vitro-Krebs-Forschung werden häufig zweidimensionale zellkulturbasierte Assays eingesetzt. Allerdings fehlen ihnen mehrere Grundelemente, die die Tumormikroumgebung bilden. Um zuverlässigere In-vitro-Ergebnisse zu erhalten, wurden mehrere dreidimensionale (3D) Zellkultur-Assays eingeführt. Diese Assays ermöglichen es Krebszellen, mit der extrazellulären Matrix zu interagieren. Diese Interaktion beeinflusst das Zellverhalten, wie etwa die Proliferation und Invasion, sowie die Zellmorphologie. Zusätzlich könnte diese Interaktion den Ausdruck mehrerer pro-und antitumorigener Moleküle auslösen oder unterdrücken. Spheroid-Invasionsuntersuchung wurde entwickelt, um eine geeignete 3D-In-vitro-Methode zur Untersuchung der Krebszellinfall zu bieten. Derzeit werden tierisch abgeleitete Matrizen, wie zum Beispiel Maus-Sarkom-abgeleitete Matrix (MSDM) und Rattenschwanz-Typ I Kollagen, hauptsächlich in den spheroiden Invasionsuntersuchungen verwendet. Unter Berücksichtigung der Unterschiede zwischen der menschlichen Tumormikroumgebung und tierischen Matrizen wurde eine menschliche, myoma-abgeleitete Matrix (HMDM) aus gutartigem Gebärmutterleiomgewebe entwickelt. Es hat sich gezeigt, dass HMDM die Migration und Invasion von Karzinomzellen besser bewirkt als MSDM. Dieses Protokoll lieferte einen einfachen, reproduzierbaren und zuverlässigen 3D-menschlichen Tumor-basierten Spheroin-Invasionsuntergang mit der HMDM/Fibrin-Matrix. Es enthält auch detaillierte Anweisungen zur Bildgebung und-analyse. Die Spheroide wachsen in einer U-förmigen ultraniedrigen Befestigungsplatte innerhalb der HMDM/fibrin-Matrix und dringen durch sie ein. Die Invasion wird täglich mit Hilfe von ilastik und Fidschi ImageJ Software abgebildet, gemessen und analysiert. Die Assay-Plattform wurde mit Hilfe von menschlichen Kehlkopf-Primär-und metastasierenden Plattenepithelkarzinomzelllinien demonstriert. Das Protokoll eignet sich aber auch für andere feste Krebszelllinien.
Einleitung
Konventionelle zweidimensionale (2D) Zellkulturstudien haben wesentlich zur Krebsforschung beigetragen. Derzeit bewegen sich die Forscher eher in Richtung dreidimensionaler (3D) Zellkultur, um die in-vivo-Bedingungen besser nachzuahmen. Die 3D-Krebszellkultur reflektiert die komplexe Tumormikroumgebung in Bezug auf Zell-und Zellmatrix-Wechselwirkungen, Genexpressionsprofile, Medikamentenempfindlichkeitund Signalweg-Aktivität 2,3.
In der Krebsforschung werden mehrere 3D-Zellkulturmodelle eingesetzt, wie Tumorgewebeforscher, Tumor auf einem Chip und multizelluläre Tumorspheroide3,4. Multikelluläre Tumorspheroide sind heute weit verbreitet, da sie mehrere Merkmale der in vivo Bedingungen bei menschlichen Tumoren 1,5imitieren. Wenn der Kugeldurchmesser größer als 500 μm ist, hat er sogar hypoxische Regionen und ein nekrotisches Zentrum, das somit die in vivo tumor Situation2darstellt.
Viele synthetische (z.B. Polydimethylsiloxan) und tierabgeleitete (z.B.Rattenschwanz-TypI Kollagen und Maus-Sarkom-abgeleitete Matrix, Matrigel, genannt MSDM) wurden für 3D-Zellkultur Assays 3, 6 entwickelt, 7,8. Bisher stammt keine der kommerziell erhältlichen Matrizen aus menschlichem Tumorgewebe. Daher fehlen ihnen die Merkmale der menschlichen Tumormikroumgebung, die erhebliche Auswirkungen auf die Prozesse der Krebszellen hat8.
Myogel (menschliche Myoma-abgeleitete Matrix, genannt HMDM) wird aus dem menschlichen Gebärmutter-Kärteryomyomomomyom-Tumorgewebe 9 extrahiert. Es hat sich gezeigt, dass sich der Proteingehalt von HMDM deutlich von dem von MSDM unterscheidet. Tatsächlich unterscheiden sich 66% der HMDM-Proteine von MSDM-Proteinen. Auf der anderen Seite sind in beiden Matrizen 10 Proteine wie Laminin, Typ-IV-Kollagen, Heparansulfat-Proteoglykane, Nidogen und epidermale Wachstumsfaktor vorhanden. Darüber hinaus unterscheidet sich die Maus vom Menschen im Enzym-Gehalt, wobei Menschen 78 weniger Proteasen haben als Mäuse 11.
Fibrin wurde allein oder in Kombination mit anderen Materialien als Gerüst 12 verwendet. In der 3D-Zellkultur werden die kommerziell erhältlichen menschlichen Fibrinogen und Thrombin zu einem Fibrin-Hydrogel12kombiniert.
Dieses Protokoll beschreibt eine Verbesserung der zuvor eingeführten 3D-Tumor-Spheroid-Invasion Assay7. Dieses neue Protokoll wendet menschliche Tumor-abgeleitete Matrix anstelle von Maus-abgeleiteter Tumormatrix an. Dazu gehören auch bildgebende und Analysetechniken mit Hilfe von ilastik und Fidschi ImageJ Software. Dieses Protokoll könnte für Spheroid-Test von mehreren verschiedenen Festkörperkörperspelinien verwendet werden. Es bietet ein biologisch relevantes Werkzeug, um neuartige Krebstherapien zu entwickeln und die Auswirkungen bestimmter Moleküle auf die Invasion von Krebszellen zu untersuchen.
Protokoll
1. Generation von Multicellular Tumor Spheroids
NOTE: Das Protokoll wird hier mit UT-SCC-42A und -42B-Zelllinien demonstriert, könnte aber auch mit anderen Zelllinien angewendet werden.
- Waschen Sie die UT-SCC-42A und -42B Zellen mit 6 ml Phosphat-gepufferten Saline (PBS), Fügen Sie 0,05% Trypsin-EDTA (3 mL für 75 cm 2 Flasche) hinzu und legen Sie die Flasche in einen Zellkultur-Inkubator (37 ° C, 5% CO2,95% Luftfeuchtigkeit) für 2-5 min.
- Überprüfen Sie, ob sich die Zellen unter einem Mikroskop gelöst haben. Dann fügen Sie das modifizierte Eagle-Medium (DMEM)-Medium (DMEM) hinzu, 100 U/mL Penicillin, 100 μg/mL Streptomycin, 250 ng/mL amphotericin B, 0,4 μg/mL Hydrocortison, und 50 μg/mL Ascorbinsäure), um das Enzym zu neutralisieren (6 mL für 75 cm 2 Flasche) und die Zellaufhängung in ein 15 ml konisches Rohr übertragen.
NOTE: Wählen Sie das Zellkulturmedium aus, das zu den untersuchten Zellen passt. - Zentrifugen Sie die Zellaufhängung auf 200 x g für 5 min.
- Entfernen Sie den Supernatant und suspendieren Sie das Zellpellet in 2-5 ml kompletter DMEM.
- Zählen Sie die Zellen und verdünnen Sie die Zellaufhängung mit kompletter DMEM auf eine Endkonzentration von 20.000 Cells/mL.
NOTE: Für jede Zelllinie muss eine optimale Zellzahl festgelegt werden. - Disppense 50 μL der Zellaufhängung in jede ultraniedrige Befestigung 96-gut runde Bodenplatte gut für eine endgültige Konzentration von 1.000 Zellen pro Brunnen.
- Verlegen Sie die Platte auf den Zellkultur-Inkubator (37 ° C,5% CO 2,95% Luftfeuchtigkeit). Vier Tage später die Tumorspheroidbildung mit einem umgekehrten Mikroskop visuell bestätigen und mit dem Test fortfahren. Achten Sie darauf, dass es nur einen Spheroid pro Brunnen gibt.
NOTE: Die Zeit, die für die Bildung eines Wirbelsäule benötigt wird, variiert zwischen verschiedenen Zelllinien.
2. Dreidimensionale Spheroid-Invasion Assay
NOTE: Bereiten Sie eine 2x Lösung vor, da das Gel verdünnt wird 1:1, wenn es in die Brunnen gegeben wird.
- Tauwetter HMDM auf Eis und Fibrinogen Bestandslösung in einem Wasserbad bei 37 ° C gepflegt. Stören Sie den Fibrinogen nicht, bis er vollständig gelöst ist und legen Sie die Lösung nicht auf Eis; Niederschlag wird auftreten.
- Mischen Sie das passende Volumen jedes Reagenzes: 1 mg/mL HMDM (Endkonzentration: 0,5 mg/mL), 0,6 U/mL Thrombin (Endkonzentration: 0,3 U/mL), 66,6 mg/mL aprotinin (Endkonzentration: 33,3 ug/mL), und 1 mg/mL fibrinogen (Endkonzentration: 0,5 mg/mL ).
NOTE: Fibrinogen kurz vor der Abgabe der Mischung in die Brunnen geben und schnell arbeiten; Es wird in wenigen Minuten ein Gel bilden. Behandeln Sie nur ein paar Brunnen auf einmal. - 50 μL des Gels in jeden Brunnen geben. Die Spitze in Richtung der Innenwand des Brunnens richten und langsam pipeln. Vermeiden Sie Luftblasen (mit der umgekehrten Pipettiertechnik) und versuchen Sie, das Kugelschreibwerk nicht aus der Mitte des Brunnens zu bewegen.
- Bringe die Platte zurück zum Zellkultur-Inkubator und lasse die HMDM/fibrin-Matrix 30 Minuten lang verfestigen und fügt sanft 100 μL komplette DMEM in jedes Gut oben auf dem Gel ein.
3. Bildgebung
- Bildt die Spheroide täglich mit einem umgekehrten Lichtmikroskop ab. Alternativ können Sie auch automatische Bildgebungssysteme verwenden.
4. Bildsegmentierung mit Ilastik
- Öffnen Sie die ilastik und wählen Sie den Workflow der Pixelklassifikation (Abbildung 1A). Es klassifiziert die Pixel auf der Grundlage von Anmerkungen, die vom Benutzer gemacht werden. Speichern Sie ilastik Projekt (.ilp) auf den Computer.
- Fügen Sie Bilder für Analysen hinzu. Klicken Sie auf Eingabedaten und fügen Sie Neues hinzu und wählen Sie dann die Bilder aus (Bild 1B).
-
Für die Auswahl der Funktionen klicken Sie auf Feature Selection und SelektionFeatures (Abbildung1 C, rotes Rechteck).
Hinweis: Die ausgewählten Merkmale sollten in etwa den visuellen Eigenschaften entsprechen, die die Objekte vom Hintergrund trennen, und sie werden für die Ausbildung des Klassifizierers verwendet.- Wählen Sie Funktionen aus, indem Sie auf die Kästchen klicken. Die ausgewählten Boxen werden grün (Abbildung 1C, blaues Rechteck).
NOTE: Hier kann der Benutzer aus verschiedenen Funktionstypen und Skalen auswählen. Die Color/-Intensität sollte ausgewählt werden, um Objekte zu trennen, die auf Farbe oder Helligkeit basieren. Edge sollte ausgewählt werden, um Objekte zu trennen, die auf Helligkeit oder Farbverläufen basieren. Textur ist ein wichtiges Merkmal, wenn die Objekte im Bild ein besonderes texturales Aussehen haben. Für diesen Test werden Color/Intensität (Sigma 0) und Edge (Sigma 6) verwendet.
- Wählen Sie Funktionen aus, indem Sie auf die Kästchen klicken. Die ausgewählten Boxen werden grün (Abbildung 1C, blaues Rechteck).
-
Für das Training, Klicktraining und im Training gibt es zwei Labels: Label 1 und Label 2 (Abbildung1 D, rotes Rechteck). Wenn es nur ein Etikett gibt, fügen Sie ein neues Etikett hinzu, indem Sie das Label Add drücken (Abbildung 1D, blaues Rechteck).
- Markieren Sie den Hintergrund mit einem der Etiketten (Abbildung 1D, gelb) und die Zellen mit dem anderen Etikett (Abbildung1D, blau).
- Trainieren Sie die Software für die ersten 10% der Bilder. Wählen Sie das nächste Bild aus der aktuellen Ansicht.
- Nachdem die Zellen und der Hintergrund markiert sind (des ersten Bildes), drücken Sie Live Update (Abbildung1D,lila Rechteck).
Hinweis: Mit dem nächsten Bild führt ilastik die Analyse automatisch nach den vorherigen Bildern durch.
- Nachdem das Training abgeschlossen ist und ilastik alle Bilder analysiert hat, klicken Sie auf Vorhersage Export. Wählen Sie die einfache Segmentierung von der Quelle; Wählen Sie keine Wahrscheinlichkeiten oder irgendetwas anderes (Abbildung 1E).
- Wählen Sie das gewünschte Ausgabedateformat aus den Einstellungen für Exporten Export wählen ... in der Rubrik Vorhersage Export(Abbildung1E). Exportieren Sie die Ergebnisse der Beschriftung, indem Sie auf Export All klicken (Abbildung 1F). Die Dateien werden in denselben Ordner mit den Originalbildern exportiert.
Hinweis: In diesem Experiment wird. h5-Format verwendet.
5. Flächenanalyse mit Fidschi-ImageJ
-
Skala Einstellung
- Öffnen Sie das Originalbild mit einem Skalenbalken in Fidschi ImageJ (Abbildung 2A). Stellen Sie sicher, dass das Bild die gleiche Größe und Dimension hat wie die analysierten Bilder. Verwenden Sie das Werkzeug für die Linienauswahl, um eine Linie mit einer bekannten Länge zu zeichnen (Abbildung 2B).
NOTE: Dieses Protokoll wird durch die Verwendung von Fiji ImageJ 1.51 (64-Bit) und ilastik-1.3.2rc ausgeführt. - Klicken Sie auf Analyse und Scale ( Abbildung2C). Stellen Sie die bekannte Distanz im Feld " Bekannte Distanz " ein und stellen Sie die richtige Einheit ein und klicken Sie auf Global (Abbildung2D).
- Öffnen Sie das Originalbild mit einem Skalenbalken in Fidschi ImageJ (Abbildung 2A). Stellen Sie sicher, dass das Bild die gleiche Größe und Dimension hat wie die analysierten Bilder. Verwenden Sie das Werkzeug für die Linienauswahl, um eine Linie mit einer bekannten Länge zu zeichnen (Abbildung 2B).
-
Installation des Makros
- Wenn ein Plugin ilastik nicht installiert ist, folgen Sie diesen Schritten: Klicken Sie auf Hilfe, Update .... Auf dem geöffneten Fenster ImageJ Updater, klicken Sie auf Aktualisierungs-Websitesverwalten. Auf dem geöffneten Fenster Aktualisierungs-Websites verwalten, klicken Sie neben ilastik und klicken Sie dann auf Schließen. Dann klicken Sie auf Änderungen im Fenster ImageJ Updateranwenden. Dieser Prozess kann einige Zeit in Anspruch nehmen. Das nächste Fenster wird Informationen mit dem Text aktualisiert erfolgreich. Klicken Sie auf OK und starten Sie ImageJ neu.
- Klicken Sie auf Plugins, Macrosund Install (Abbildung 3A). Dann wählen Sie die Datei counter.ijm (siehe Ergänzende Informationen) und klicken Sie auf Öffnen.
NOTE: Das Makro wurde speziell für die Messung des Bereichs geschrieben. Das Makro sollte bei jedem Öffnen der Software installiert werden.
-
Flächenanalyse
- Analysieren Sie Bilder, wenn alle Plugins installiert sind. Klicken Sie auf Plugins und scrollen Sie nach unten zu ilastik (Abbildung 3C). Wählen Sie Import HDF5, wählen Sie die Datei mit. h5-Format, klicken Sie auf Öffnen und Laden und wenden Sie LUT an ( Abbildung3C, D).
- Drücken Sie den Knopf von der Tastatur (Makro) und der Bereich wird im Summary-Fenster als Gesamtbereich (Abbildung3 E) angezeigt.
Ergebnisse
Vier Tage nach der Absagekät-Zell-Zell-Saat-Saeding UT-SCC-42B (metastasierende Kehlkopfkörper-Zelllinie) wurde die Matrix (HMDM/Fibrin, MSDM oder Kollagen) auf den gebildeten Spheroiden (Tag 0) hinzugefügt und die Invasion drei Tage lang überwacht. Die Bilder hier wurden täglich mit einem umgekehrten Mikroskop gewonnen (Abbildung 4).
Nach dem Einbetten begannen die Zellen in der HMDM/fibrin-Matrix nach einem Tag schnell einzudringen und dehnten sich in die Matrixaus (Abbildung4A). Zellen im MSDM sind nicht in die umgebende Matrix eingedrungen, sondern bildeten eine asymmetrische Struktur (Abbildung4B). Auf der anderen Seite drangen Zellen im Kollagen leicht ein, aber aufgrund der Matrixschrumpfungwardie Analyse schwierig (Abbildung 4C). In einigen Kollagenbrunnen verschwanden die Spheroide sogar nach drei Tagen (Abbildung 4C).
Abbildung 5 zeigt die Quantifizierung der Zellinvasion in HMDM/Fibrin der primären Kehlkopfnummer UT-SCC-42A und der dazugehörigen metastasierenden Zelllinie UT-SCC-42B. Das Video (Movie 1), das mit einem Live-Zell-Analysesystem des HMDM/Fibrin-Spheroids aufgenommen wurde, zeigt die Bewegung der SCC-Zellen innerhalb der Matrix, in der sie Stränge bilden, gefolgt von den anderen Zellen.
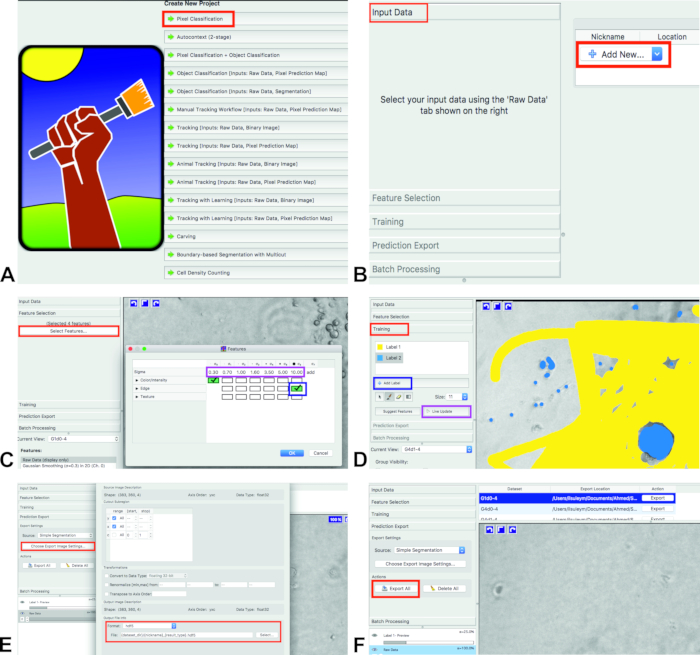
Bild 1 : Bildsegmentierung. Ausgewählte Schritte der Bildsegmentierung mit ilastik. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
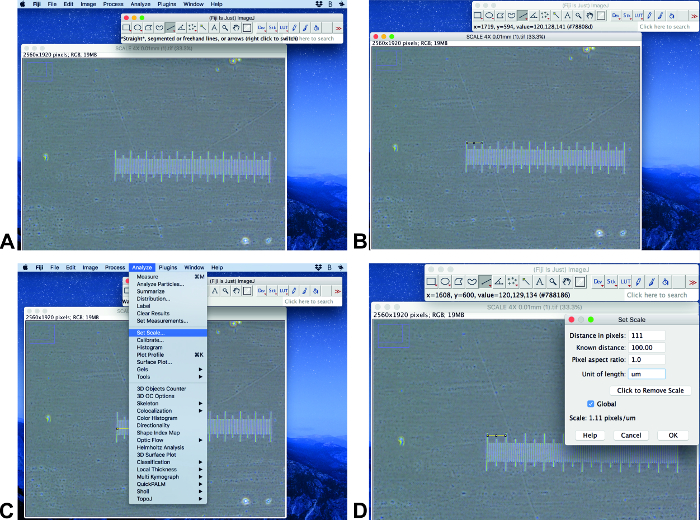
Bild 2 : Skaleneinstellung. Ausgewählte Schritte der Skalenseinstellung mit Fidschi ImageJ. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
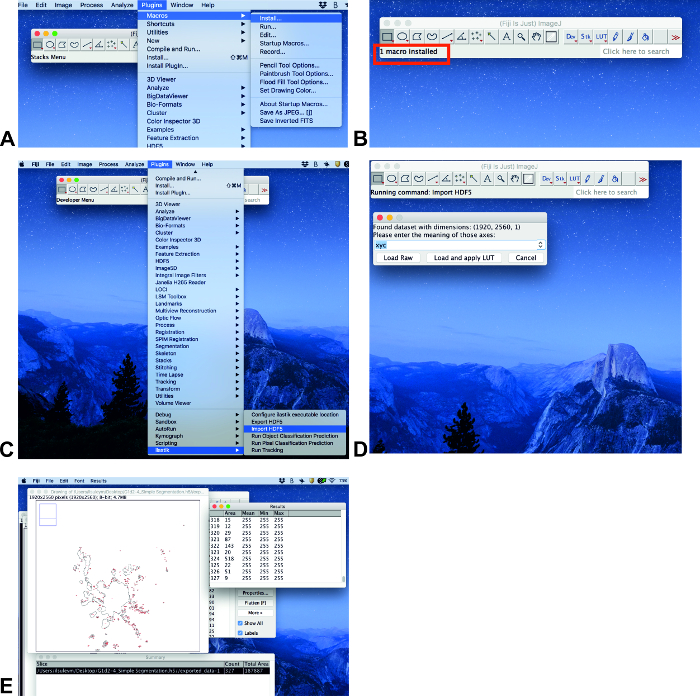
Bild 3 : Invasionsanalyse mit ImageJ. Ausgewählte Schritte der Bildanalyse mit Fidschi ImageJ. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
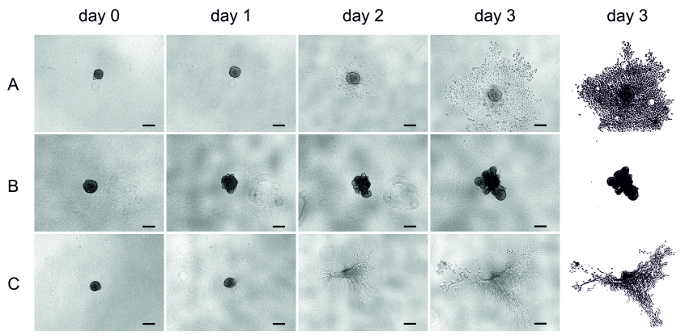
Bild 4 : UT-SCC-42B Zell-Invasion in drei verschiedenen Matrizen. Repräsentative Bilder der SCC-Zellinvasion in den 3D-Spheroiden. Drei Tage lang folgte die Invasion und täglich wurden Bilder mit einem umgekehrten Mikroskop aufgenommen. (A) HMDM/fibrin, (B) MSDM, (C) collagen. Die letzte Spalte stellt eine Klärung der Invasion des Tages 3 dar. Skalierbalken = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
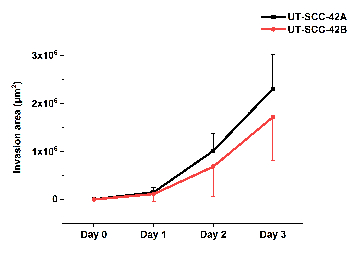
Bild 5 : Quantifizierung der SCC-Zellinvasion in HMDM/Fibrin. Die primäre Kehlkopfversion UT-SCC-42A und die entsprechende metastasierende Kehlkopflinieninär-Invasion UT-SCC-42B SCC wurden mit Hilfe von ilastik und Fiji ImageJ Software analysiert. Die Ergebnisse stellen eine mittlere ± Standardabweichung von drei unabhängigen Experimenten dar, die jeweils in dreifacher Qualität sind. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Video 1: Die SCC-Zellbewegung innerhalb der HMDM/Fibrin für drei Tage. Bitte klicken Sie hier, um dieses Video zu sehen. (Rechtsklick zum Download.)
Diskussion
Die vorgestellte Methode bietet einen 3D-menschlichen Tumor-basierten Assay, um die Invasivität von Krebszellen innerhalb der menschlichen Tumormikroumgebung imitierenden Matrix zu bewerten. Die Invasion von Krebszellen lässt sich leicht messen, indem man täglich mit einem Standard-Mikroskop abilmt und durch die Verwendung von Bildanalyse-Software. Die Methode demonstriert eher die Zellinvasion als nur die Proliferation.
Im Gegensatz zu MSDM benötigt die HMDM/fibrin-Matrix keine Temperaturregelung. Diese Methode ist leicht durchzuführen, insbesondere ohne die Notwendigkeit, die Spheroide von einer Platte auf eine andere zu übertragen. Es hat nur einen technisch sensiblen Schritt, die Zugabe von Fibrinogen in die Matrix. Da Fibrinogen nach wenigen Minuten zu Glatzen beginnen, erfordert das Hinzufügen von Fibrinogen eine robuste Pipettierung und Behandlung von nur wenigen Brunnen gleichzeitig. Es besteht auch die Gefahr, dass der Spheroid gestört wird und ihn von seiner zentralen Position in den U-förmigen Brunnen bewegt wird, wenn Pipettieren hochdruckfreundlich erfolgt. Die Verzierung des Wirbelsäule kann die Bildgebung und schließlich die Analyse erschweren.
Der Test kann durch eine Änderung der Konzentration von HMDM oder Fibrinogen verändert werden. Die Zellen können auch für spätere molekulare Studien fixiert und gebeizt werden. Auch wenn diese Methode in vollautomatischer Form modifiziert werden kann, kann sie auch mit einem normalen Mikroskop und zwei Open-Source-Software durchgeführt werden, ohne dass teure Geräte benötigt werden.
Im Vergleich zu den herkömmlichen MSM-basierten 3D-Assays könnte dieser Test die Eigenschaften der Zellinvasion besser darstellen. Spheroide, die in einer kellerhaltigen, laminininhaltigen Matrix wie MSDM angebaut werden, könnten eine größere Vermehrung von Krebszellen haben als die tatsächliche Invasion, wodurch sie aufgrund ihrer geringen Einfallsfähigkeit für Invasionsuntersuchungen in mehreren Krebszelllinien ungeeignet ist. Eine andere häufig verwendete Matrix, Typ I-Collagen, neigt dazu, während des 3D-Anbaus von den Rändern zu schrumpfen, was die Lokalisierung und Abbildung der Brunnen durch die Spheroid beeinflusst. Darüber hinaus wurden die Unterschiede zwischen den intrinsischen invasiven Eigenschaften der mehr (HSC-3) und weniger (SCC-25) aggressiven Zungenkarzinomzelllinien anhand von menschlichen Tumormikrokörper-Mimitierungsmodellen nachgewiesen (Myomscheiben und seine lösliche Form). Matrix)10,13.
Der Test ist auch ethischer als die Verwendung von MSDM, da HMDM aus dem übrig gebliebenen Material des menschlichen Leiomyomtumors gewonnen wird. Derzeit ist HMDM das einzige von Menschentoren abgeleitete ECM-Produkt, das für viele krebsbezogene In-vitro-Assays 8,10geeignetzu sein scheint. In Zukunft könnten tierisch gewebte Matrizen durch menschliche tumorbasierte Matrizen ersetzt werden, um die Notwendigkeit zu verringern, Tiere für die Matrixproduktion zu opfern.
Der Austausch von 2D-Zellkultur-Assays durch 3D-Methoden liefert genauere Informationen über das Verhalten von Krebszellen. Derzeit gibt es mehrere 3D-Modelle und kommerzielle Matrizen, aber leider sind keines für alle Krebszelllinien geeignet. Die Forscher sollten die für ihren speziellen Test am besten geeignete Matrix auswählen. Eine optimale Abstimmung von Test und Matrix kann eine Herausforderung sein, aber die Zuverlässigkeit der Ergebnisse deutlich erhöhen.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren danken den Geldgebern dieser Studie: Der Sigrid Jusélius Stiftung, der Krebsgesellschaft Finnlands und den Forschungsmitteln des Zentralklinikums Helsinki. Die Autoren zeichnen die Biomedicum Imaging Unit der Universität Helsinki für technische Hilfe aus.
Materialien
| Name | Company | Catalog Number | Comments |
| Amphotericin B solution | Merck | A2942 | |
| Aprotinin from bovine lung | Merck | A6279 | Measure the protein concentration before use. |
| Ascorbic acid | Applichem | A1052 | |
| BioLite Cell Culture Treated Flasks | Thermo Scientific | 130190 | |
| DMEM/F-12 | Gibco by Life Technologies | 31330-038 | |
| DS-Fi2 Digital Camera | Nikon Instruments | ||
| DS-U3 Digital Camera Controller | Nikon Instruments | ||
| Eclipse TS100 Inverted Microscope | Nikon Instruments | ||
| Fetal bovine serum (FBS) | Gibco by Life Technologies | 10270106 | Heat inactivate for 30 min at 56 °C in waterbath before use. |
| Fibrinogen, Plasminogen-Depleted, Human Plasma | Merck | 341578 | Solubility: 25 mg/ml in H2O. Warm the H2O and the fibrinogen to 37 °C prior to dissolution. Do not disturb until the fibrinogen is completely solubilized. Stock solutions stored at -70 °C should be thawed in a water bath maintained at 37 °C. |
| Fiji ImageJ 1.51 image processing program | Freeware, NIH | ||
| Hydrocortisone | Merck | H0888 | |
| Ilastik software for image classification and segmentation | Freeware | ||
| IncuCyte Zoom Live-Cell Analysis System | Essen BioScience | ||
| Myogel | Lab made | ||
| Penicillin-Streptomycin | Gibco by Life Technologies | 15140-122 | |
| Phosphate buffered saline (PBS) | Lab made | ||
| Scepter 2.0 Cell Counter | Merck | PHCC20040 | |
| Scepter Cell Counter Sensors, 60 µm | Merck | PHCC60050 | |
| Thrombin from human plasma | Merck | T6884-100UN | |
| Trypsin-EDTA (0.5%) 10x, no phenol red | Gibco by Life Technologies | 15400054 | |
| Ultra-Low Attachment 96-Well Plate | Corning | 7007 | |
| UT-SCC-42A and UT-SCC-42-B cell lines | The cell lines were established at the Department of Otorhinolaryngology-Head and Neck Surgery, Turku University Hospital (Turku, Finland). |
Referenzen
- Jung, H., et al. Cell Spheroids with Enhanced Aggressiveness to Mimic Human Liver Cancer In vitro and In Vivo. Scientific Reports. 7, 10499-10514 (2017).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology and Therapeutics. , 94-108 (2016).
- Albanese, A., Lam, A. K., Sykes, E. A., Rocheleau, J. V., Chan, W. C. W. Tumour-on-a-chip provides an optical window into nanoparticle tissue transport. Nature Communications. 4, 2718 (2013).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4, 309-324 (2009).
- Berens, E. B., Holy, J. M., Riegel, A. T., Wellstein, A. A Cancer Cell Spheroid Assay to Assess Invasion in a 3D Setting. Journal of Visualized Experiments. (105), e53409 (2015).
- Vinci, M., Box, C., Eccles, S. A. Three-Dimensional (3D) Tumor Spheroid Invasion Assay. Journal of Visualized Experiments. (99), e52686 (2015).
- Salo, T., et al. A novel human leiomyoma tissue derived matrix for cell culture studies. BMC Cancer. 15, 981 (2015).
- Nurmenniemi, S., et al. A novel organotypic model mimics the tumor microenvironment. The American Journal of Pathology. 175, 1281-1291 (2009).
- Salo, T., et al. Organotypic three-dimensional assays based on human leiomyoma-derived matrices. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 373 (1737), 20160482 (2018).
- Overall, C. M., Blobel, C. P. In search of partners: linking extracellular proteases to substrates. Nature Reviews Molecular Cell Biology. 8, 245-257 (2007).
- Ahmed, T. A. E., Dare, E. V., Hincke, M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Engineering Part B: Reviews. 14 (2), 199-215 (2008).
- Hoornstra, D., et al. Fermented Lingonberry Juice Inhibits Oral Tongue Squamous Cell Carcinoma Invasion In vitro Similarly to Curcumin. In Vivo. 32, 1089-1095 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten