Method Article
Matrice a base di tumore umano in un saggio di invasione sferoide tridimensionale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il microambiente tumorale è una parte essenziale della crescita e dell'invasione del cancro. Per simulare la progressione del carcinoma, è necessaria una matrice umana biologicamente rilevante. Questo protocollo introduce un miglioramento per il saggio di invasione sferoidale tridimensionale in vitro applicando una matrice a base di leiomioma umano. Il protocollo introduce anche un'analisi di invasione cellulare basata su computer.
Abstract
I saggi bidimensionali basati sulla coltura cellulare sono comunemente usati nella ricerca sul cancro in vitro. Tuttavia, mancano diversi elementi di base che formano il microambiente tumorale. Per ottenere risultati più affidabili in vitro, sono stati introdotti diversi saggi di coltura cellulare tridimensionali (3D). Questi saggi consentono alle cellule tumorali di interagire con la matrice extracellulare. Questa interazione influisce sul comportamento delle cellule, come la proliferazione e l'invasione, così come la morfologia delle cellule. Inoltre, questa interazione potrebbe indurre o sopprimere l'espressione di diverse molecole pro-e anti-tumorigene. Il saggio di invasione di Spheroid è stato sviluppato per fornire un metodo 3D in vitro adatto per studiare l'invasione delle cellule tumorali. Attualmente, le matrici derivate da animali, come la matrice derivata dal sarcoma del topo (MSDM) e il collagene di tipo I di coda di ratto, sono utilizzate principalmente nei saggi di invasione sferoide. Prendendo in considerazione le differenze tra il microambiente del tumore umano e le matrici derivate dagli animali, una matrice derivata da mioma umano (HMDM) è stata sviluppata dal tessuto del leiomioma dell'utero benigno. È stato dimostrato che HMDM induce la migrazione e l'invasione delle cellule di carcinoma meglio di MSDM. Questo protocollo ha fornito un saggio di invasione sferoidale 3D basato su tumore umano semplice, riproducibile e affidabile utilizzando la matrice HMDM/Fibrin. Include anche istruzioni dettagliate sull'imaging e l'analisi. Gli sferoidi crescono in una piastra di attacco ultra-bassa a forma di U all'interno della matrice HMDM/fibrina e invadono attraverso di essa. L'invasione è quotidianamente imaged, misurato, e analizzato utilizzando ilastik e Fiji software ImageJ. La piattaforma di saggio è stata dimostrata utilizzando linee cellulari di carcinoma squamoso laringeo umano primario e metastatico. Tuttavia, il protocollo è adatto anche per altre linee cellulari di cancro solido.
Introduzione
Gli studi convenzionali di coltura cellulare bidimensionale (2D) hanno notevolmente contribuito alla ricerca sul cancro. Attualmente, i ricercatori stanno spostando più verso saggi tridimensionali (3D) colture cellulari per simulare meglio le condizioni in vivo1. La coltura delle cellule tumorali 3D rispecchia in modo più accurato il complesso microambiente tumorale in termini di interazioni tra cellule cellulari e matrici cellulari, profili di espressione genica, sensibilità ai farmaci e attività del pathway di segnalazione2,3.
Diversi modelli di coltura cellulare 3D sono utilizzati nella ricerca sul cancro come l'espiante del tessuto tumorale, il tumore su un chip e gli sferoidi del tumore multicellulare3,4. Gli sferoidi tumorali multicellulari sono ora ampiamente utilizzati, in quanto simulano diverse caratteristiche delle condizioni in vivo nei tumori umani1,5. Quando il diametro sferoide è maggiore di 500 μm, ha anche regioni ipoxiche e un centro necrotico, rappresentando così la situazione tumorale in vivo2.
Sono stati sviluppati molti tipi di matrici sintetiche (ad es. polidimetilsilossano) e derivate da animali (ad esempio, collagene di tipo I di ratto e matrice derivata da sarcoma del topo, Matrigel, denominata msdm) per i saggi di coltura cellulare 3D3,6, 7,8. Finora, nessuna delle matrici disponibili commercialmente ha avuto origine dal tessuto tumorale umano. Pertanto, mancano le caratteristiche del microambiente del tumore umano, che ha effetti significativi sui processi di invasione delle cellule tumorali8.
Myogel (matrice derivata da mioma umano, denominata HMDM) viene estratta dal tessuto tumorale leiomioma dell'utero umano9. È stato dimostrato che il contenuto proteico di HMDM differisce significativamente da quello di MSDM. Infatti, 66% delle proteine HMDM sono diverse dalle proteine MSDM. D'altra parte, alcune proteine, come la laminina, il collagene di tipo IV, i proteoglicani eparan solfato, il nidogen e il fattore di crescita epidermico, sono presenti in entrambe le matrici10. Inoltre, il mouse differisce da quello umano nel contenuto enzimatico, con gli esseri umani che hanno 78 meno proteasi rispetto ai topi11.
Fibrina è stato ampiamente usato da solo o in combinazione con altri materiali come un materiale di scaffold12. Nei saggi di coltura cellulare 3D, il fibrinogeno umano disponibile in commercio e la trombina sono combinati per formare un idrogel di fibrina12.
Questo protocollo descrive un miglioramento del test di invasione di sferoidi tumorali 3D precedentemente introdotto7. Questo nuovo protocollo applica la matrice derivata dal tumore umano invece della matrice tumorale derivata dal topo. Esso coinvolge anche tecniche di imaging e analisi utilizzando ilastik e Fiji software ImageJ. Questo protocollo potrebbe essere utilizzato per il saggio sferoide di diverse linee cellulari di tumori solidi diversi. Offre uno strumento biologicamente pertinente per sviluppare nuove terapie antitumorali e per studiare gli effetti di molecole specifiche sull'invasione delle cellule tumorali.
Protocollo
1. generazione di sferoidi tumorali multicellulari
Nota: Il protocollo è dimostrato qui con linee cellulari UT-SCC-42A e-42B, ma potrebbe anche essere applicato utilizzando altre linee cellulari.
- Lavare le cellule UT-SCC-42A e-42B con 6 mL di soluzione salina tampone fosfato (PBS), aggiungere 0,05% di tripsina-EDTA (3 mL per 75 cm2 Flask) e posizionare il pallone in un incubatore di colture cellulari (37 ° c, 5% Co2, 95% di umidità) per 2-5 min.
- Controllare che le cellule si siano staccate al microscopio. Quindi aggiungere il supporto di Dulbecco modificato (DMEM) media (DMEM + 10% siero bovino fetale, 100 U/mL di penicillina, 100 μg/mL di streptomicina, 250 ng/mL di amfotericina B, 0,4 μg/mL di idrocortisone e 50 μg/mL di acido ascorbico) per neutralizzare l'enzima (6 mL per 75 cm 2 Flask) e trasferire la sospensione cellulare in un tubo conico da 15 ml.
Nota: selezionare il supporto di coltura cellulare adatto alle cellule studiate. - Centrifugare la sospensione cellulare a 200 x g per 5 min.
- Rimuovere il surnatante e sospendere il pellet cellulare in 2-5 mL di DMEM completo.
- Contare le cellule e diluire la sospensione cellulare con DMEM completo ad una concentrazione finale di 20.000 cellule/mL.
Nota: Il conteggio ottimale delle celle deve essere determinato per ogni linea di cella. - Erogare 50 μL di sospensione della cellula in ogni attacco ultra-basso 96-ben rotondo piastra inferiore bene per una concentrazione finale di 1.000 cellule per pozzo.
- Trasferire la piastra all'incubatore di colture cellulari (37 ° c, 5% CO2, 95% di umidità). Quattro giorni dopo, confermare visivamente la formazione di sferoidi tumorali con un microscopio invertito e procedere con il saggio. Assicurarsi che vi sia un solo sferoide per pozzetto.
Nota: Il tempo preso per formare uno sferoide varia tra le diverse linee cellulari.
2. saggio di invasione di sferoidi tridimensionali
Nota: Preparare 2x soluzione perché il gel sarà diluito 1:1 quando aggiunto nei pozzi.
- Scongelare HMDM sulla soluzione di stock di ghiaccio e fibrinogeno in un bagno d'acqua mantenuto a 37 ° c. Non disturbare il fibrinogeno fino a quando non è completamente solubilizzato e non mettere la soluzione sul ghiaccio; si verificano precipitazioni.
- Mescolare insieme il volume appropriato di ciascun reagente: 1 mg/mL HMDM (concentrazione finale: 0,5 mg/mL), 0,6 trombina U/mL (concentrazione finale: 0,3 U/mL), 66,6 mg/mL di aprotinina (concentrazione finale: 33,3 UG/mL) e 1 mg/mL di fibrinogeno (concentrazione finale: 0,5 mg/mL ).
Nota: Aggiungere fibrinogeno appena prima di dispensare la miscela nei pozzi e lavorare rapidamente; formerà un gel in pochi minuti. Trattare solo pochi pozzi alla volta. - Aggiungere 50 μL di gel in ogni pozzetto. Dirigere la punta verso la parete interna del pozzo e Pipet lentamente. Evitare le bolle d'aria (utilizzando la tecnica di pipettaggio inverso) e cercare di non spostare lo sferoide dal centro del pozzo.
- Riportare la piastra all'incubatore di colture cellulari e lasciare che la matrice HMDM/fibrina si solidifichi per 30 minuti, e aggiungere delicatamente 100 μL di DMEM completo in ogni pozzetto sopra il gel.
3. l'imaging
- Immagini gli sferoidi quotidianamente usando un microscopio a luce rovesciata. In alternativa, utilizzare sistemi di imaging automatici.
4. segmentazione dell'immagine con Ilastik
- Aprire ilastik e selezionare flusso di lavoro di classificazione dei pixel (Figura 1A). Classifica i pixel in base alle annotazioni effettuate dall'utente. Salvare il progetto ilastik (. ILP) al computer.
- Aggiungere immagini per le analisi. Fare clic su dati di input e aggiungere nuovo , quindi scegliere immagini (Figura 1B).
-
Per la selezione delle feature, fare clic su selezione feature e seleziona feature (Figura 1C, rettangolo rosso).
Nota: le feature selezionate devono corrispondere approssimativamente alle proprietà visive che separano gli oggetti dallo sfondo e verranno utilizzate per addestrare il classificatore.- Selezionare le feature facendo clic sulle caselle. Le caselle selezionate si trasformeranno in verde (Figura 1C, rettangolo blu).
Nota: Qui l'utente può scegliere tra diversi tipi di feature e scale. Colore/intensità deve essere selezionato per separare gli oggetti in base al colore o alla luminosità. Bordo deve essere selezionato per separare gli oggetti in base alla luminosità o gradienti di colore. La texture è una caratteristica importante se gli oggetti nell'immagine hanno uno speciale aspetto materici. Per questo saggio vengono utilizzati colore/intensità (Sigma 0) e bordo (Sigma 6).
- Selezionare le feature facendo clic sulle caselle. Le caselle selezionate si trasformeranno in verde (Figura 1C, rettangolo blu).
-
Per la formazione, fare clic su training e nella sezione training sono presenti due etichette: etichetta 1 ed etichetta 2 (Figura 1D, rettangolo rosso). Se è presente una sola etichetta, aggiungere una nuova etichetta premendo Aggiungi etichetta (Figura 1D, rettangolo blu).
- Contrassegnare lo sfondo con una delle etichette (Figura 1d, giallo) e le celle con l'altra etichetta (Figura 1d, blu).
- Addestrare il software per il primo 10% delle immagini. Scegli immagine successiva dalla vista corrente.
- Dopo che le celle e lo sfondo sono contrassegnati (della prima immagine), premere Live Update (Figura 1D, rettangolo viola).
Nota: con l'immagine successiva, ilastik eseguirà automaticamente l'analisi in base alle immagini precedenti.
- Dopo l'allenamento è fatto e ilastik ha analizzato tutte le immagini, fare clic su stima esportazione. Scegliere semplice segmentazione da origine; Non scegliere le probabilità o qualsiasi altra cosa (Figura 1E).
- Scegliere il formato di file di output desiderato scegliendo Esporta impostazioni immagine... nella sezione esportazione previsione (Figura 1E). Esportare i risultati dell'etichettatura facendo clic su Esporta tutto (Figura 1F). I file verranno esportati nella stessa cartella con le immagini originali.
Nota: in questo esperimento, viene utilizzato il formato. H5.
5. analisi di area con Fiji ImageJ
-
Impostazione della scala
- Aprire l'immagine originale con una barra di scala in Fiji ImageJ (Figura 2a). Assicurarsi che l'immagine abbia le stesse dimensioni e dimensione delle immagini analizzate. Utilizzare lo strumento selezione linea per tracciare una linea di lunghezza nota (Figura 2B).
Nota: Questo protocollo viene eseguito utilizzando Fiji ImageJ 1,51 (64-bit) e ilastik-1.3.2 RC. - Fare clic su analizza e Imposta scala (Figura 2C). Impostare la distanza nota nel campo distanza nota e impostare l'unità corretta e fare clic su globale (Figura 2D).
- Aprire l'immagine originale con una barra di scala in Fiji ImageJ (Figura 2a). Assicurarsi che l'immagine abbia le stesse dimensioni e dimensione delle immagini analizzate. Utilizzare lo strumento selezione linea per tracciare una linea di lunghezza nota (Figura 2B).
-
Installazione della macro
- Se non è installato un plugin ilastik , attenersi alla seguente procedura: fare clic su aiuto, Aggiorna.... Nella finestra aperta ImageJ Updater, fare clic su Gestisci siti di aggiornamento. Nella finestra aperta Gestisci siti di aggiornamento, fare clic su Avanti per ilastik e quindi fare clic su Chiudi. Quindi fare clic su Applica modifiche nella finestra ImageJ Updater. Questo processo può richiedere un certo tempo. La finestra successiva sarà informazioni con il testo aggiornato correttamente. Fare clic su OK e riavviare ImageJ.
- Fare clic su plug-in, macroe Installa (Figura 3A). Quindi scegliere il file Counter. IJM (vedere informazioni supplementari) e fare clic su Apri.
Nota: La macro è stata scritta appositamente per misurare l'area. La macro deve essere installata ogni volta che il software viene aperto.
-
Analisi area
- Analizza le immagini quando tutti i plugin sono installati. Fare clic su plugins e scorrere verso il basso fino a ilastik (Figura 3C). Scegliere Importa HDF5, scegliere il file con formato. H5, fare clic su Apri e caricare e applicare LUT (Figura 3C, D).
- Premere il pulsante a dalla tastiera (macro) e l'area apparirà nella finestra di Riepilogo come area totale (Figura 3e).
Risultati
Quattro giorni dopo la semina delle cellule di UT-SCC-42B (linea cellulare SCC laringea metastatica), la matrice (HMDM/fibrina, MSDM o collagene) è stata aggiunta sugli sferoidi formati (giorno 0) e l'invasione è stata monitorata per tre giorni. Le immagini sono state ottenute quotidianamente utilizzando un microscopio invertito (Figura 4).
Una volta incorporate, le cellule della matrice HMDM/fibrina iniziarono a invadere rapidamente dopo un giorno ed estese nella matrice (Figura 4a). Le cellule del MSDM non hanno invaso la matrice circostante, formando invece una struttura asimmetrica (Figura 4B). D'altra parte, le cellule del collagene hanno invaso leggermente, ma a causa del restringimento della matrice l'analisi è stata difficile (Figura 4C). In alcuni pozzi di collagene, gli sferoidi sono scomparsi anche dopo tre giorni (Figura 4C).
La Figura 5 illustra la quantificazione dell'invasione cellulare in HMDM/fibrina della linea cellulare SCC laringea primaria UT-SCC-42a e della corrispondente linea cellulare metastatica UT-SCC-42B. Il video (filmato 1) preso utilizzando un sistema di analisi Live-Cell dello SFEROIDE HMDM/Fibrin Mostra il movimento delle cellule SCC all'interno della matrice in cui formano i fili seguiti dalle altre cellule.
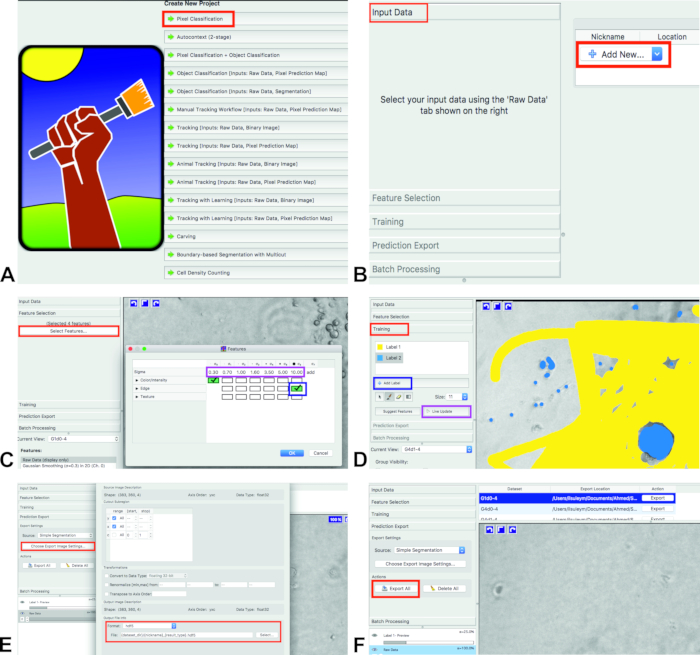
Figura 1 : Segmentazione delle immagini. Passaggi selezionati di segmentazione dell'immagine con ilastik. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
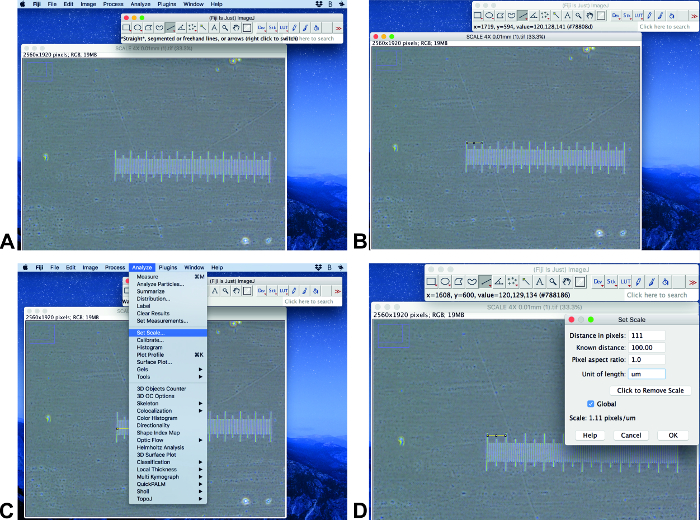
Figura 2 : Impostazione della scala. Passaggi selezionati di impostazione della scala utilizzando Fiji ImageJ. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
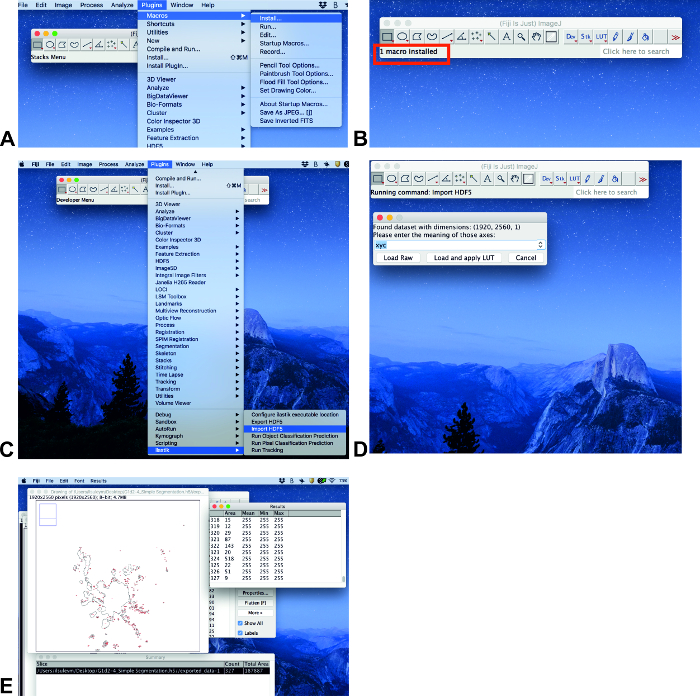
Figura 3 : Analisi dell'invasione tramite ImageJ. Passaggi selezionati di analisi delle immagini utilizzando Fiji ImageJ. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
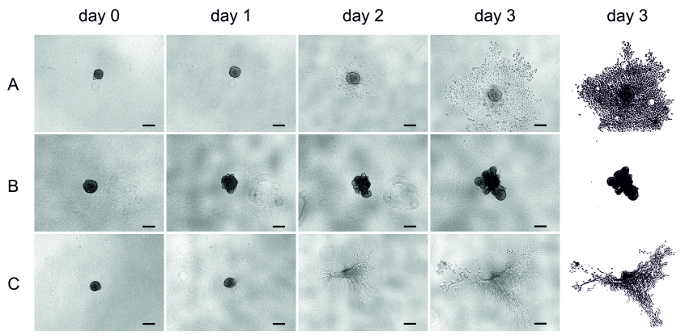
Figura 4 : L'invasione delle cellule UT-SCC-42B in tre diverse matrici. Immagini rappresentative dell'invasione delle cellule SCC negli sferoidi 3D. L'invasione è stata seguita per tre giorni e le immagini sono state scattate quotidianamente usando un microscopio invertito. (A) HMDM/fibrina, (B) msdm, (C) collagene. L'ultima colonna rappresenta un chiarimento dell'invasione del giorno 3. Barra di scala = 200 μm. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
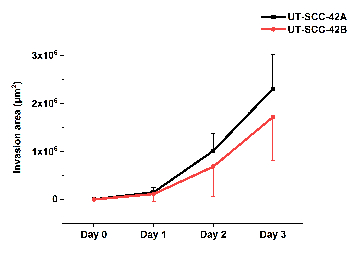
Figura 5 : Quantificazione dell'invasione delle cellule SCC in HMDM/fibrina. Il laringeo primario UT-SCC-42A e la corrispondente invasione metastatica della linea di cellule UT-SCC-42B SCC è stata analizzata utilizzando il software ilastik e Fiji ImageJ. I risultati rappresentano media ± deviazione standard di tre esperimenti indipendenti, ciascuno in triplice plicato. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Video 1: Il movimento delle cellule SCC all'interno dell'HMDM/fibrina per tre giorni. Clicca qui per vedere questo video. (Fare clic con il pulsante destro del mouse per scaricarlo).
Discussione
Il metodo presentato fornisce un saggio basato su tumore umano 3D per valutare l'invasività delle cellule tumorali all'interno microambiente del tumore umano imitando matrice. L'invasione delle cellule tumorali può essere facilmente misurata dall'imaging quotidiano con un microscopio standard e utilizzando il software di analisi delle immagini. Il metodo dimostra l'invasione delle cellule piuttosto che la semplice proliferazione.
A differenza di MSDM, la matrice HMDM/Fibrin non richiede alcun controllo della temperatura. Questo metodo è facile da eseguire, in particolare senza la necessità di trasferire gli sferoidi da una piastra all'altra. Ha un solo passo tecnicamente sensibile, l'aggiunta di fibrinogeno alla matrice. Poiché il fibrinogeno inizia a gel dopo pochi minuti, l'aggiunta di fibrinogeno richiede un pipettaggio robusto e un trattamento di pochi pozzi alla volta. C'è anche il rischio di disturbare lo sferoide e spostarlo dalla sua posizione centrale nel pozzo a forma di U se il pipettaggio viene fatto in modo ad alta pressione. La dislocazione dello sferoide può complicare l'imaging e, infine, l'analisi.
Il saggio può essere modificato modificando la concentrazione di HMDM o fibrinogeno. Le cellule possono anche essere fissate e macchiate per successivi studi molecolari. Anche se questo metodo può essere modificato in una forma completamente automatizzata, può anche essere effettuato con un microscopio normale e due software open source, senza bisogno di costose attrezzature.
Rispetto ai tradizionali test 3D basati su MSDM, questo saggio potrebbe visualizzare meglio le proprietà di invasione delle cellule. Gli sferoidi coltivati in una matrice ricca di laminina contenente membrana, come MSDM, potrebbero avere più proliferazione delle cellule tumorali rispetto all'invasione reale, rendendolo inadatto per i saggi di invasione in diverse linee cellulari tumorali a causa della loro bassa capacità di invadere. Un'altra matrice di uso frequente, collagene di tipo I, tende a ridursi dai bordi durante la coltivazione 3D, che colpisce la localizzazione degli sferoidi e l'imaging dei pozzi. Inoltre, le differenze tra le proprietà invasive intrinseche delle linee cellulari di carcinoma della lingua più (HSC-3) e meno (SCC-25) sono state dimostrate utilizzando i modelli di microambiente del tumore umano che simulano (i dischi di mioma e la sua forma solubile matrice)10,13.
Il saggio è anche più etico rispetto all'utilizzo di MSDM poiché HMDM viene estratto dal materiale residuo del tumore del leiomioma umano. Attualmente, HMDM è l'unico prodotto ECM derivato dal tumore umano disponibile che sembra essere adatto a molti saggi in vitro relativi al cancro8,10. In futuro, le matrici derivate dai tessuti animali potevano essere sostituite da matrici umane basate su tumori per ridurre la necessità di sacrificare gli animali per la produzione di matrici.
La sostituzione dei saggi delle colture cellulari 2D con i metodi 3D fornisce informazioni più accurate sul comportamento delle cellule tumorali. Attualmente, ci sono diversi modelli 3D e matrici commerciali, ma, sfortunatamente, nessuno è adatto a tutte le linee cellulari di cancro. I ricercatori dovrebbero selezionare la matrice più adatta per il loro particolare saggio. La corrispondenza ottimale tra saggio e matrice può essere impegnativa, ma potrebbe aumentare significativamente l'affidabilità dei risultati.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano i finanziatori di questo studio: la Fondazione Sigrid Jusélius, la società del cancro della Finlandia e i fondi di ricerca dell'ospedale centrale dell'Università di Helsinki. Gli autori riconoscono la Biomedicum Imaging unit presso l'Università di Helsinki per l'assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| Amphotericin B solution | Merck | A2942 | |
| Aprotinin from bovine lung | Merck | A6279 | Measure the protein concentration before use. |
| Ascorbic acid | Applichem | A1052 | |
| BioLite Cell Culture Treated Flasks | Thermo Scientific | 130190 | |
| DMEM/F-12 | Gibco by Life Technologies | 31330-038 | |
| DS-Fi2 Digital Camera | Nikon Instruments | ||
| DS-U3 Digital Camera Controller | Nikon Instruments | ||
| Eclipse TS100 Inverted Microscope | Nikon Instruments | ||
| Fetal bovine serum (FBS) | Gibco by Life Technologies | 10270106 | Heat inactivate for 30 min at 56 °C in waterbath before use. |
| Fibrinogen, Plasminogen-Depleted, Human Plasma | Merck | 341578 | Solubility: 25 mg/ml in H2O. Warm the H2O and the fibrinogen to 37 °C prior to dissolution. Do not disturb until the fibrinogen is completely solubilized. Stock solutions stored at -70 °C should be thawed in a water bath maintained at 37 °C. |
| Fiji ImageJ 1.51 image processing program | Freeware, NIH | ||
| Hydrocortisone | Merck | H0888 | |
| Ilastik software for image classification and segmentation | Freeware | ||
| IncuCyte Zoom Live-Cell Analysis System | Essen BioScience | ||
| Myogel | Lab made | ||
| Penicillin-Streptomycin | Gibco by Life Technologies | 15140-122 | |
| Phosphate buffered saline (PBS) | Lab made | ||
| Scepter 2.0 Cell Counter | Merck | PHCC20040 | |
| Scepter Cell Counter Sensors, 60 µm | Merck | PHCC60050 | |
| Thrombin from human plasma | Merck | T6884-100UN | |
| Trypsin-EDTA (0.5%) 10x, no phenol red | Gibco by Life Technologies | 15400054 | |
| Ultra-Low Attachment 96-Well Plate | Corning | 7007 | |
| UT-SCC-42A and UT-SCC-42-B cell lines | The cell lines were established at the Department of Otorhinolaryngology-Head and Neck Surgery, Turku University Hospital (Turku, Finland). |
Riferimenti
- Jung, H., et al. Cell Spheroids with Enhanced Aggressiveness to Mimic Human Liver Cancer In vitro and In Vivo. Scientific Reports. 7, 10499-10514 (2017).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology and Therapeutics. , 94-108 (2016).
- Albanese, A., Lam, A. K., Sykes, E. A., Rocheleau, J. V., Chan, W. C. W. Tumour-on-a-chip provides an optical window into nanoparticle tissue transport. Nature Communications. 4, 2718 (2013).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4, 309-324 (2009).
- Berens, E. B., Holy, J. M., Riegel, A. T., Wellstein, A. A Cancer Cell Spheroid Assay to Assess Invasion in a 3D Setting. Journal of Visualized Experiments. (105), e53409 (2015).
- Vinci, M., Box, C., Eccles, S. A. Three-Dimensional (3D) Tumor Spheroid Invasion Assay. Journal of Visualized Experiments. (99), e52686 (2015).
- Salo, T., et al. A novel human leiomyoma tissue derived matrix for cell culture studies. BMC Cancer. 15, 981 (2015).
- Nurmenniemi, S., et al. A novel organotypic model mimics the tumor microenvironment. The American Journal of Pathology. 175, 1281-1291 (2009).
- Salo, T., et al. Organotypic three-dimensional assays based on human leiomyoma-derived matrices. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 373 (1737), 20160482 (2018).
- Overall, C. M., Blobel, C. P. In search of partners: linking extracellular proteases to substrates. Nature Reviews Molecular Cell Biology. 8, 245-257 (2007).
- Ahmed, T. A. E., Dare, E. V., Hincke, M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Engineering Part B: Reviews. 14 (2), 199-215 (2008).
- Hoornstra, D., et al. Fermented Lingonberry Juice Inhibits Oral Tongue Squamous Cell Carcinoma Invasion In vitro Similarly to Curcumin. In Vivo. 32, 1089-1095 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon