Method Article
Üç boyutlu Küroid Istilası tahlil tam ınsan tümör tabanlı matris
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Tümör mikroçevre kanser büyüme ve işgali önemli bir parçasıdır. Karsinom ilerlemesini taklit etmek için biyolojik olarak alakalı bir insan matrisine ihtiyaç vardır. Bu protokol, insan leiomyoma tabanlı matris uygulayarak in vitro üç boyutlu küroid invazyonu tahlil için bir gelişme tanıtır. Protokol aynı zamanda bilgisayar tabanlı bir hücre istilası analizi sunar.
Özet
İki boyutlu hücre kültürü tabanlı asder yaygın olarak in vitro kanser araştırma kullanılır. Ancak, tümör mikroortamını oluşturacak birkaç temel unsur eksiktir. Daha güvenilir in vitro sonuçlar elde etmek için, birkaç üç boyutlu (3D) hücre kültürü tanıtılmıştır. Bu, kanser hücrelerinin hücre dışı matriks ile etkileşime girmesine izin verir. Bu etkileşim, proliferasyon ve istilanın yanı sıra hücre morfolojisi gibi hücre davranışlarını etkiler. Buna ek olarak, bu etkileşim birkaç yanlısı ve anti-tümörorjenik moleküllerin ifadesine neden olabilir veya bastırabilir. Küroid invazyon tahlil kanser hücresi istilası çalışmak için uygun bir 3D in vitro yöntemi sağlamak için geliştirilmiştir. Şu anda, fare sarkomu-türetilen matris (MSDM) ve sıçan kuyruk tipi ı kollajen gibi hayvansal türevi matrisler, esas olarak küroid istilası alanında kullanılır. İnsan tümörü mikroçevre ve hayvansal türevi matrisler arasındaki farklılıkları dikkate alarak, benign uterus Leyomiyom dokusundan insan Miyoma türevi bir matris (hmdm) geliştirilmiştir. HMDM 'nin, karsinom hücrelerinden daha iyi bir şekilde göç ve istilası olduğunu göstermiştir. Bu protokol, HMDM/fibrin matrisini kullanarak basit, reproducible ve güvenilir 3D insan tümörü bazlı küroid invazyonu tahlil sağladı. Ayrıca görüntüleme ve analiz hakkında ayrıntılı talimatlar içerir. Kürler, HMDM/fibrin matrisinde U şeklinde Ultra düşük bir ataşman plakası içinde büyür ve onu istila ederler. İstilası günlük, ölçülen ve ılastik ve Fiji ımagej yazılımı kullanılarak analiz edilmiştir. Tahlil platformu insan laringeal primer ve metastatik skuayöz Hücre Karsinomu hücre hatları kullanılarak gösterilmiştir. Ancak, protokol diğer katı kanser hücre hatları için de uygundur.
Giriş
Geleneksel iki boyutlu (2D) hücre kültürü çalışmaları kanser araştırmalarına önemli ölçüde katkı sağladı. Şu anda, araştırmacılar üç boyutlu (3D) hücre kültürü daha iyi in vivo koşullar1taklit etmek için daha doğru değişen vardır. 3D kanser hücresi kültürü, hücre hücresi ve hücre matris etkileşimleri, gen ifade profilleri, ilaç hassasiyeti ve sinyal yolu aktivitesi2,3açısından karmaşık tümör mikroortamını daha doğru bir şekilde yansıtır.
Çeşitli 3D hücre kültürü modelleri tümör dokusu explant gibi kanser araştırmalarında kullanılır, bir çip üzerinde tümör, ve çok hücreli tümör kürleri3,4. Çok hücreli tümör kürleri artık yaygın olarak kullanılmaktadır, çünkü insan tümörlerinde in vivo koşulların çeşitli özelliklerini taklit eder1,5. Küroid çapı 500 μm ' den büyükse, hipoktik bölgelere ve nekrotik bir merkeze sahiptir, böylece in vivo tümör durumu2' ye temsil edilir.
Birçok sentetik (örneğin, polydimetilsiloxane) ve hayvan türevi (örn., Rat kuyruk tipi ı kollajen ve fare sarkomu türevi matris, matrigel, MSDM olarak adlandırılır) matrisler 3D hücre kültürü için geliştirilmiştir3,6, 7,8. Şimdiye kadar, piyasada bulunan Matrislerin hiçbiri insan tümörü dokusundan kaynaklanmıştır. Bu nedenle, kanser hücresi invazyonu süreçleri üzerinde önemli etkileri olan insan tümörü mikroortamının özellikleri eksikliği8.
Myogel (insan Miyoma türevi matris, hmdm olarak adlandırılır) insan uterusu Leyomiyom tümör dokusundan ayıklanır9. HMDM 'nin protein içeriğinin MSDM 'den önemli ölçüde farklı olduğu gösterilmiştir. Aslında, HMDM proteinlerinin% 66 ' i MSDM proteinlerden farklıdır. Öte yandan, laminin, tip IV kollajen, heparan sülfat proteoglycans, Nidogen ve Epidermal büyüme faktörü gibi bazı proteinlerin her iki matrisinde de mevcut olması10. Ayrıca, fare11' den daha az protein 78 sahip insanlarla, enzim içeriğinde insan farklı.
Fibrin yaygın olarak tek başına veya diğer malzemeler ile birlikte bir iskele malzemesi olarak kullanılan12. 3D hücre kültüründe, piyasada bulunan insan fibrinojen ve Trombin bir fibrin hidrojel12oluşturmak için birleştirilir.
Bu protokol daha önce tanıtıldı 3D tümör küroid invazyonu tahlil bir iyileştirme açıklar7. Bu yeni protokol, fare türetildiği tümör matrisinin yerine insan tümörü türeyen matris uygular. Ayrıca ılastik ve Fiji ımagej yazılımı kullanarak görüntüleme ve analiz teknikleri içerir. Bu protokol birkaç farklı katı kanser hücresi hatları küroid tahlil için kullanılabilir. Bu yeni anti-kanser tedavileri geliştirmek ve kanser hücresi istilası belirli moleküllerin etkilerini incelemek için biyolojik olarak ilgili bir araç sunuyor.
Protokol
1. çok hücreli tümör kürleri üretimi
Not: Protokol burada UT-SCC-42A ve-42B hücre hatları ile gösterilmiştir, ancak diğer hücre hatları kullanılarak da uygulanabilir.
- UT-SCC-42A ve-42B hücreleri 6 mL fosfat-tamponlu tuz (PBS) ile yıkayın, 0,05% Trypsin-EDTA ekleyin (75 cm2 Flask Için 3 ml) ve Flask 'ı bir hücre kültürü kuluçkörü (37 °c,% 5 Co2, 95% nem) için 2-5 dakika olarak yerleştirin.
- Hücrelerin mikroskop altında ayrılmış olup olmadığını kontrol edin. Sonra tam Dulbecco modifiye kartal Orta (dmem) medya (dmem +% 10 fetal sığır serumu, 100 U/ml penisilin, 100 μg/ml streptomisin, 250 ng/ml Amfoterisin B, 0,4 μg/ml hidrokortizon, ve 50 μg/ml askorbik asit) enzim nötralize etmek için (6 ml için 75 cm 2 Flask) ve hücre süspansiyonunu 15 ml konik tüpüne aktarın.
Not: incelenmekte olan hücrelere uygun hücre kültürü ortamını seçin. - 200 x g 'de hücre süspansiyonunu 5 dakika boyunca santrifüjün.
- Süpernatant çıkarın ve tam dmem 2-5 ml hücre Pelet askıya.
- Hücreleri saymak ve 20.000 hücreler/mL son konsantrasyonuna tam DMEM ile hücre süspansiyon seyreltmeli.
Not: Her hücre çizgisi için en uygun hücre sayısı belirlenmelidir. - Hücre süspansiyonunun her Ultra düşük ataşman 96-iyi yuvarlak alt plakasına, iyi başına 1.000 hücrelerin son konsantrasyonu için de 50 μL dispense edilir.
- Plakayı hücre kültürü inkükodiye aktarın (37 °C,% 5 CO2, 95% nem). Dört gün sonra, görsel olarak ters bir mikroskop ile tümör küre oluşumu onaylamak ve tahlil ile devam. İyi başına sadece bir küroid olduğundan emin olun.
Not: Bir küroid oluşturmak için alınan zaman farklı hücre hatları arasında değişir.
2. üç-boyutlu Küroid Istilası tahlil
Not: Hazırlama 2x çözüm çünkü jel seyreltilir olacak 1:1 zaman kuyular içine eklenir.
- 37 °C ' de tutulan su banyosunun buz ve fibrinojen stok çözeltisi üzerinde HMDM çözülür. Tamamen çözünene kadar fibrinojen rahatsız etmeyin ve buz üzerinde çözüm koymayın; yağış meydana gelir.
- Her reaktif için uygun hacmi birlikte karıştırın: 1 mg/mL HMDM (son konsantrasyon: 0,5 mg/mL), 0,6 U/mL Trombin (son konsantrasyon: 0,3 U/mL), 66,6 mg/mL Aprotinin (son konsantrasyon: 33,3 UG/mL), ve 1 mg/mL Fibrinojen (son konsantrasyon: 0,5 mg/mL ).
Not: Sadece kuyuların içine karışımı dağıtma ve hızlı bir şekilde çalışmak önce fibrinojen ekleyin; birkaç dakika içinde bir jel oluşturacaktır. Bir kerede sadece birkaç kuyuya bakırsın. - Her kuyunda jel 50 μL ekleyin. Ucu, kuyun iç duvarına doğru ve pipet yavaşça yönlendirin. Hava kabarcıkları kaçının (ters pipetleme tekniği kullanarak) ve kuyu merkezinden küroid hareket etmeye çalışmayın.
- Plaka geri hücre kültürü kuluçca dönmek ve HMDM/fibrin matris 30 dakika için katılaşma izin ve yavaşça jel üst her iyi içine tam DMEM 100 μL ekleyin.
3. görüntüleme
- Ters ışık mikroskobu kullanarak her gün kürleri görüntüler. Alternatif olarak, otomatik görüntüleme sistemlerini kullanın.
4. ılastik ile görüntü Segmentation
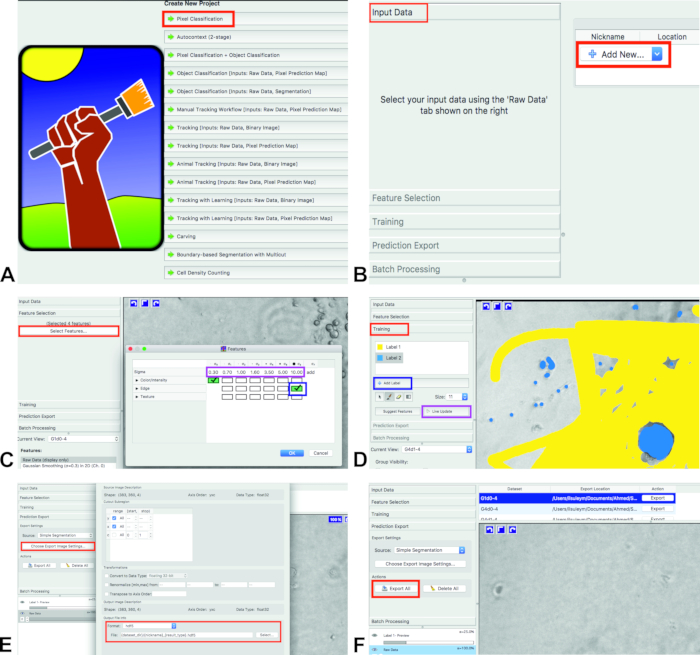
- Ilastik 'i açın ve piksel sınıflandırma iş akışını seçin (Şekil 1A). Bu, Kullanıcı tarafından yapılan ek açıklamaları temel alarak pikselleri sınıflandırır. Kaydet ilastik proje (. ilp) bilgisayara.
- Analizler için görüntü ekleyin. Giriş verileri 'ni tıklayın ve yeni Ekle 'yi seçin ve ardından resimler (Şekil 1B) seçeneğini belirleyin.
-
Özellik seçimi için, unsur seçimi ve Özellikleri Seç (Şekil 1C, kırmızı dikdörtgen) seçeneğini tıklatın.
Not: seçili özellikler kabaca nesneleri arka planda ayıran görsel özelliklerine karşılık gelmelidir ve sınıflandırıcı eğitim için kullanılır.- Kutuları tıklatarak özellikleri seçin. Seçilen kutular yeşile dönecek (Şekil 1C, mavi dikdörtgen).
Not: Burada Kullanıcı birkaç farklı özellik türleri ve ölçekleri seçebilirsiniz. Renk/yoğunluk, nesneleri renk veya parlaklığa göre ayırmak için seçilmelidir. Parlaklık veya renk degradelerine göre nesneleri ayırmak için kenar seçilmelidir. Resimde nesnelerin özel bir metin görünümü varsa doku önemli bir özelliktir. Bu tahlil için, renk/yoğunluk (Sigma 0) ve Edge (Sigma 6) kullanılır.
- Kutuları tıklatarak özellikleri seçin. Seçilen kutular yeşile dönecek (Şekil 1C, mavi dikdörtgen).
-
Eğitim için, eğitim 'i tıklatın ve eğitim bölümünde iki etiket vardır: etiket 1 ve etiket 2 (Şekil 1D, kırmızı dikdörtgen). Yalnızca bir etiket varsa, etiket ekle (Şekil 1D, mavi dikdörtgen) tuşuna basarak yeni bir etiket ekleyin.
- Arka planı etiketlerden biriyle (Şekil 1d, sarı) ve diğer etikete sahip hücreler (Şekil 1d, mavi) olarak işaretleyin.
- Görüntüleri ilk% 10 için yazılım eğitmek. Geçerli görünümdensonraki görüntüyü seçin.
- Hücreler ve arka plan işaretlendikten sonra (ilk görüntünün), Live Update (Şekil 1D, mor dikdörtgen) tuşuna basın.
Not: bir sonraki görüntü Ile, ilastik otomatik olarak önceki görüntüleri göre analiz gerçekleştirir.
- Eğitim yapıldıktan sonra ve ilastik tüm görüntüleri analiz etti, tıklayın tahmin Export. Kaynaktan basit segmentasyon seçin ; Olasılıklar veya başka bir şey (Şekil 1E) seçmeyin.
- İstediğiniz çıkış dosyası formatını seçin seçin görüntü ayarlarını dışa aktar... Içinde tahmin verme bölümünde (Şekil 1E). Tümünü Dışa Aktar 'ı tıklatarak etiketlemenin sonuçlarını dışa aktarın (Şekil 1F). Dosyalar orijinal görüntülerle aynı klasöre dışa aktarılacak.
Not: Bu denemede. H5 biçimi kullanılır.
5. Fiji ımagej ile alan Analizi
-
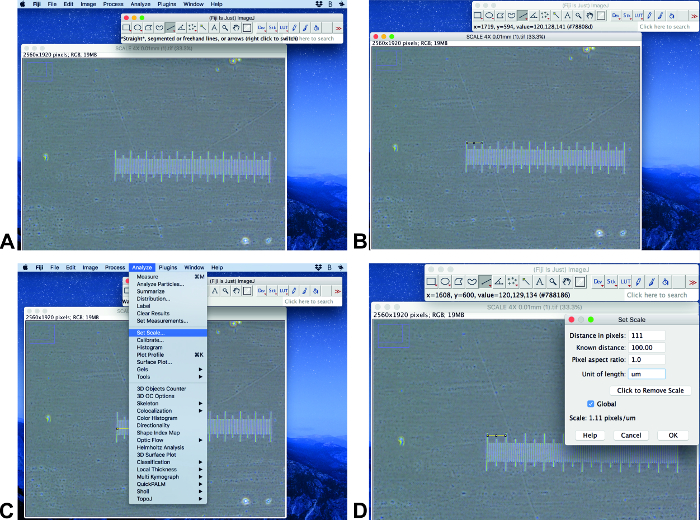
Ölçek ayarı
- Orijinal görüntüyü Fiji ımagej 'de bir ölçek çubuğu ile açın (Şekil 2a). Görüntünün, analiz edilen görüntülerle aynı boyuta ve boyuta sahip olduğundan emin olun. Bilinen uzunlukta bir çizgi çizmek için satır seçimi aracını kullanın (Şekil 2B).
Not: Bu protokol Fiji ımagej 1,51 (64-bit) ve ilastik-1.3.2 RC kullanılarak yürütülür. - Analiz et ve Ölçek ayarla 'yı tıklayın (Şekil 2C). Bilinen mesafe alanında bilinen mesafeyi ayarlayın ve uygun birimi ayarlayın ve Global (Şekil 2D) seçeneğini tıklatın.
- Orijinal görüntüyü Fiji ımagej 'de bir ölçek çubuğu ile açın (Şekil 2a). Görüntünün, analiz edilen görüntülerle aynı boyuta ve boyuta sahip olduğundan emin olun. Bilinen uzunlukta bir çizgi çizmek için satır seçimi aracını kullanın (Şekil 2B).
-
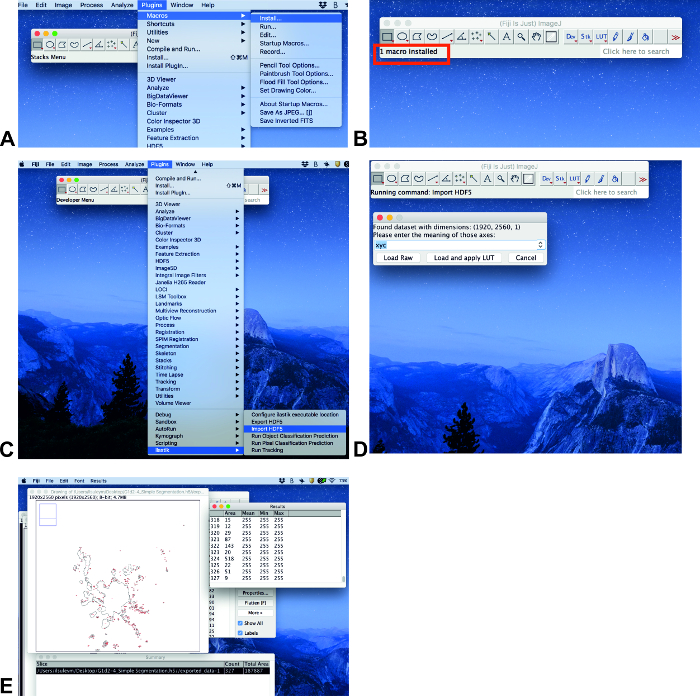
Makroyu yükleme
- Bir eklenti ilastik yüklü değilse, şu adımları Izleyin: Yardım, güncelleştirme.... tıklayın Açık pencerede ımagej Updater'Da güncelleştirme sitelerini Yönet'i tıklayın. Açık pencerede güncelleştirme sitelerini Yönet, ilastik için ileri ' yi tıklatın ve sonra Kapat' ı tıklatın. Ardından ımagej Updaterpenceresindeki Değişiklikleri Uygula 'ya tıklayın. Bu işlem biraz zaman alabilir. Sonraki pencere başarıyla güncelleştirilmişmetin ile bilgi olacaktır. Tamam 'ı tıklatın ve ımagej 'yi yeniden başlatın.
- Eklentiler, makrolarve yükleme (Şekil 3A) ' yı tıklatın. Ardından sayaç. ijm dosyasını seçin (bkz. ek bilgiler) ve Aç'ı tıklatın.
Not: Makro özellikle bölgeyi ölçmek için yazılmıştır. Yazılım her açıldığında makro yüklenmesi gerekir.
-
Alan Analizi
- Tüm eklentiler yüklendiğinde görüntüleri analiz edin. Eklentileri tıklayın ve ılastik (Şekil 3C) aşağı kaydırın. HDF5 al'ı seçin,. H5 formatıyla dosyayı seçin, Aç ve yükle 'yi tıklatın ve Lut 'u uygulayın (Şekil 3C, D).
- Klavyeden (makro) a düğmesine basın ve alan Özet penceresinde Toplam alan olarak görünecektir (Şekil 3E).
Sonuçlar
4 gün sonra UT-SCC-42B (metastatik laringeal SCC hücre hattı) hücre tohumlama, matris (HMDM/fibrin, MSDM veya kollajen) oluşturulan küritler üzerine eklendi (gün 0) ve işgali üç gün boyunca izleniyor. Buradaki görüntüler her gün ters çevrilmiş bir mikroskop kullanılarak elde edilmiştir (Şekil 4).
Gömülü bir kez, HMDM/fibrin matrisindeki hücreler bir gün sonra hızla istila etmeye başladı ve matrisin içine uzatıldı (Şekil 4A). MSDM 'deki hücreler çevreleyen matrisin içine işgal etmedi, bunun yerine asimetrik bir yapı oluşturmadı (Şekil 4B). Öte yandan, kollajen hücreler biraz işgal, ancak matris daralma nedeniyle analiz zordu (Şekil 4C). Bazı kollajen kuyuları, kürler bile üç gün sonra kayboldu (Şekil 4C).
Şekil 5 , primer laringeal SCC hücre hattı UT-SCC-42A ve karşılık gelen metastatik hücre hattı UT-SCC-42B hmdm/fibrin hücre Istilasının miktarını göstermektedir. HMDM/fibrin kürelinin canlı hücre analiz sistemi kullanılarak çekilen video (Film 1), diğer hücrelerin ardından iplerin bulunduğu MATRIS içindeki SCC hücrelerinin hareketini gösterir.
Şekil 1 : Görüntü Segmentation. Ilastik kullanarak görüntü segmentasyon seçilen adımlar. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Şekil 2 : Ölçek ayarı. Fiji ımagej kullanarak ölçek ayarı seçilen adımlar. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Şekil 3 : Invasion Analizi ımagej kullanarak. Fiji ımagej kullanarak görüntü analizi seçilen adımlar. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
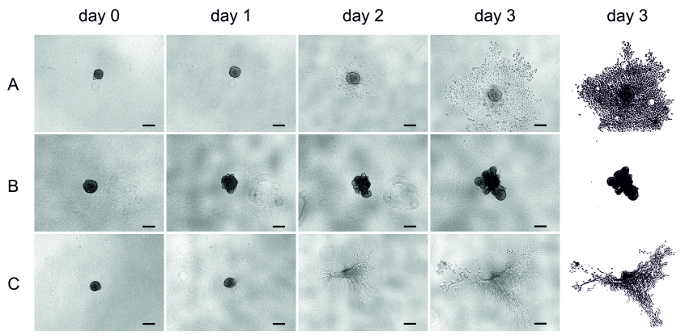
Şekil 4 : Üç farklı matrislerde UT-SCC-42B hücre istilası. 3D kürlerde SCC hücre istilası temsilcisi görüntüleri. İstila üç gün boyunca takip edildi ve görüntüleri her gün ters bir mikroskop kullanılarak alınmıştır. (A) hmdm/fibrin, (B) MSDM, (C) kollajen. Son sütun gün 3 istilası açıklama temsil eder. Ölçek çubuğu = 200 μm. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
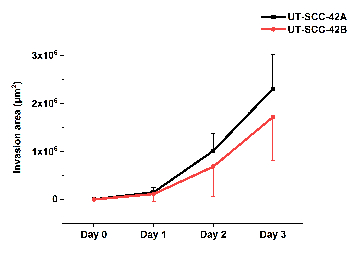
Şekil 5 : HMDM/fibrin 'de SCC hücre istilasının ölçülmesini. Primer laringeal UT-SCC-42A ve karşılık gelen metastatik laringeal UT-SCC-42B SCC hücre hattı istilası ilastik ve Fiji ımagej yazılımı kullanılarak incelenmiştir. Sonuçlar üç bağımsız denemelerin ortalama ± standart sapmasını, her biri triplicate olarak temsil eder. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Video 1: 3 gün boyunca HMDM/fibrin Içinde SCC hücre hareketi. Bu videoyu görüntülemek Için lütfen tıklayınız. (İndirmek için sağ tıklayın.)
Tartışmalar
Sunulan yöntem, matris taklit insan tümörü mikroçevre içinde kanser hücrelerinin invaziv değerlendirmek için bir 3D insan tümörü tabanlı tahlil sağlar. Kanser hücresi istilası, standart mikroskop ile günlük görüntüleme ve görüntü analiz yazılımını kullanarak kolayca ölçülebilir. Yöntem sadece proliferasyon yerine hücre istilası gösterir.
MSDM aksine, HMDM/fibrin matris herhangi bir sıcaklık kontrolü gerektirmez. Bu yöntem, özellikle bir plakadan diğerine kürleri aktarmak için gerek kalmadan, gerçekleştirmek kolaydır. Sadece bir teknik duyarlı adım, matris fibrinojen eklenmesi vardır. Fibrinojen birkaç dakika sonra jel başlar beri, fibrinojen ekleyerek bir defada sadece birkaç kuyuların sağlam pipetleme ve tedavisi gerektirir. Ayrıca, pipetleme yüksek basınçlı bir şekilde yapılırsa, küreyi rahatsız etme ve U şeklindeki iyi merkezi pozisyonuna taşıma riski de vardır. Kürenin dislocation görüntüleme ve sonunda analiz zorlaştırabilir.
Tahlil HMDM veya fibrinojen konsantrasyonu değiştirerek değiştirilebilir. Hücreler de sabit ve sonraki Moleküler çalışmalar için lekeli olabilir. Bu yöntem tam otomatik bir forma değiştirilebilir olsa da, normal bir mikroskop ve iki açık kaynaklı yazılım ile, pahalı donanıma gerek olmadan da gerçekleştirilebilir.
Geleneksel MSDM tabanlı 3D assays ile karşılaştırıldığında, bu tahlil daha iyi hücre istilası özellikleri görüntüleyebilir. , MSDM gibi bir Bodrum membranı içeren laminin zengin matrisinde yetiştirilen küreler, gerçek istiladan daha fazla kanser hücrelerinin proliferasyonu olabilir, bu da düşük istila kapasitesine bağlı olarak çeşitli kanser hücresi hatlarında invazyon için uygun değildir. Başka bir sık kullanılan matris, tip ı kollajen, 3D ekimi sırasında kenarlardan küçültmek eğilimindedir, hangi küre lokalizasyonu ve kuyuların görüntülenmesi etkiler. Ayrıca, daha fazla içsel invaziv özellikleri arasındaki farklar (HSC-3) ve daha az (SCC-25) agresif Dil Karsinomu hücre hatları insan tümörü mikroçevre modelleri taklit kullanılarak gösterilmiştir (myoma diskler ve çözünür formu Matrix)10,13.
Tahlil, hmdm 'nin insan Leyomiyom tümörünün kalan malzemesinin çıkartıldığı bu yana MSDM kullanmaktan daha etik. Şu anda, hmdm tek mevcut insan tümörü-türev ECM ürün birçok kanserle ilgili olarak uygun görünüyor-vitro asder8,10. Gelecekte, hayvan dokusu-türetilen matrisler, matris üretimi için hayvanları feda etme ihtiyacını azaltmak için insan tümörü bazlı matrisler tarafından değiştirilebilir.
2D hücre kültürü 3D yöntemleri ile değiştirme kanser hücresi davranışı hakkında daha doğru bilgi sağlar. Şu anda, birkaç 3D modelleri ve ticari matrisler vardır, ama, maalesef, hiçbiri tüm kanser hücresi hatları için uygundur. Araştırmacılar kendi özel tahlil için en uygun matris seçmelisiniz. Tahlil ve matris optimum eşleştirme zorlu olabilir, ama önemli ölçüde sonuçların güvenilirliğini artırabilir.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Yazarlar bu çalışmanın fon teşekkür: Sigrid Jusélius Vakfı, Kanser Derneği Finlandiya ve Helsinki Üniversitesi Merkez Hastanesi araştırma fonları. Yazarlar, teknik yardım için Helsinki Üniversitesi 'nde Biomedicum görüntüleme birimini kabul eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amphotericin B solution | Merck | A2942 | |
| Aprotinin from bovine lung | Merck | A6279 | Measure the protein concentration before use. |
| Ascorbic acid | Applichem | A1052 | |
| BioLite Cell Culture Treated Flasks | Thermo Scientific | 130190 | |
| DMEM/F-12 | Gibco by Life Technologies | 31330-038 | |
| DS-Fi2 Digital Camera | Nikon Instruments | ||
| DS-U3 Digital Camera Controller | Nikon Instruments | ||
| Eclipse TS100 Inverted Microscope | Nikon Instruments | ||
| Fetal bovine serum (FBS) | Gibco by Life Technologies | 10270106 | Heat inactivate for 30 min at 56 °C in waterbath before use. |
| Fibrinogen, Plasminogen-Depleted, Human Plasma | Merck | 341578 | Solubility: 25 mg/ml in H2O. Warm the H2O and the fibrinogen to 37 °C prior to dissolution. Do not disturb until the fibrinogen is completely solubilized. Stock solutions stored at -70 °C should be thawed in a water bath maintained at 37 °C. |
| Fiji ImageJ 1.51 image processing program | Freeware, NIH | ||
| Hydrocortisone | Merck | H0888 | |
| Ilastik software for image classification and segmentation | Freeware | ||
| IncuCyte Zoom Live-Cell Analysis System | Essen BioScience | ||
| Myogel | Lab made | ||
| Penicillin-Streptomycin | Gibco by Life Technologies | 15140-122 | |
| Phosphate buffered saline (PBS) | Lab made | ||
| Scepter 2.0 Cell Counter | Merck | PHCC20040 | |
| Scepter Cell Counter Sensors, 60 µm | Merck | PHCC60050 | |
| Thrombin from human plasma | Merck | T6884-100UN | |
| Trypsin-EDTA (0.5%) 10x, no phenol red | Gibco by Life Technologies | 15400054 | |
| Ultra-Low Attachment 96-Well Plate | Corning | 7007 | |
| UT-SCC-42A and UT-SCC-42-B cell lines | The cell lines were established at the Department of Otorhinolaryngology-Head and Neck Surgery, Turku University Hospital (Turku, Finland). |
Referanslar
- Jung, H., et al. Cell Spheroids with Enhanced Aggressiveness to Mimic Human Liver Cancer In vitro and In Vivo. Scientific Reports. 7, 10499-10514 (2017).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology and Therapeutics. , 94-108 (2016).
- Albanese, A., Lam, A. K., Sykes, E. A., Rocheleau, J. V., Chan, W. C. W. Tumour-on-a-chip provides an optical window into nanoparticle tissue transport. Nature Communications. 4, 2718 (2013).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4, 309-324 (2009).
- Berens, E. B., Holy, J. M., Riegel, A. T., Wellstein, A. A Cancer Cell Spheroid Assay to Assess Invasion in a 3D Setting. Journal of Visualized Experiments. (105), e53409 (2015).
- Vinci, M., Box, C., Eccles, S. A. Three-Dimensional (3D) Tumor Spheroid Invasion Assay. Journal of Visualized Experiments. (99), e52686 (2015).
- Salo, T., et al. A novel human leiomyoma tissue derived matrix for cell culture studies. BMC Cancer. 15, 981 (2015).
- Nurmenniemi, S., et al. A novel organotypic model mimics the tumor microenvironment. The American Journal of Pathology. 175, 1281-1291 (2009).
- Salo, T., et al. Organotypic three-dimensional assays based on human leiomyoma-derived matrices. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 373 (1737), 20160482 (2018).
- Overall, C. M., Blobel, C. P. In search of partners: linking extracellular proteases to substrates. Nature Reviews Molecular Cell Biology. 8, 245-257 (2007).
- Ahmed, T. A. E., Dare, E. V., Hincke, M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Engineering Part B: Reviews. 14 (2), 199-215 (2008).
- Hoornstra, D., et al. Fermented Lingonberry Juice Inhibits Oral Tongue Squamous Cell Carcinoma Invasion In vitro Similarly to Curcumin. In Vivo. 32, 1089-1095 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır