Method Article
בידוד וטיהור של קרום הלב של מורלין
In This Article
Summary
על מנת לבודד ולטהר את קרום הלב למחקרים בסיסיים ולחקור את הפוטנציאל הטיפולי של הביולוגיה שלהם.
Abstract
בתאי קרום הלב, התאים הפריכריים של כלי הדם והנימים, ידועים כחלק ב אנגיוגנזה, ייצוב כלי, ושלמות המכשול האנדותל. עם זאת, פונקציות ספציפיות לרקמות שלהן בלב אינן מובנות היטב. כמו-כן, אין בשלב זה פרוטוקול ניצול חומרים נגישים כדי לבודד ולטהר את קרום הלב ממקור הלב. הפרוטוקול שלנו מתמקד בשימוש במודל היונקים הנפוץ ביותר, בעכבר, כמקור התאים שלנו. בעזרת העיכול האנזימטי והדיסוציאציה המכנית של רקמת הלב, הצלחנו להשיג תערובת תאית גסה שהייתה מטוהרת עוד יותר על-ידי הפעלת מיון תאים באמצעות קרינה פלואורסצנטית (FACS) על ידי שפע של סמנים. מכיוון שאין סמן חד משמעי אחד לקרום הלב, אנו מגודרת עבור תאים שהיו CD31-CD34-CD45-CD140b+NG2+CD146+. לאחר הטיהור, תאים ראשוניים אלה היו מתורבתים ומעבר מספר פעמים ללא כל שינוי מורפולוגיה וביטוי סמן. עם היכולת להשיג באופן קבוע קרום הלב מורלין העיקרי באמצעות הפרוטוקול שלנו, אנו מקווים להבין עוד יותר את התפקיד של קרום הלב בפיזיולוגיה לב וכלי דם הפוטנציאל התרפויטי שלהם.
Introduction
התאים הפריכריים הידועים בשם קרום הלב להקיף את המיקרוכלים נימים של עץ כלי הדם1,2. פיזיולוגית, הם ידועים לקדם ולשחק חלק באנגיוגנזה, להגדיל את שלמות המכשול בשל הקשר ההדוק שלהם עם תאי האנדותל, כמו גם ייצוב כלי בוגרים1,2. יתר על כן, תפקוד לקוי ו/או אובדן של תאים אלה היו מעורבים במחלות כגון מחלת אלצהיימר2,3 ומחלות לב וכלי דם שונות4. תאים אלה נמצאים ברחבי הגוף כולו, אך מספרי התאים תלויים ברקמות. כתוצאה מהvasציטים הגבוהות של המכשול ממוח הדם1,2. עם זאת, בלב, הביולוגיה של כלבי קרום הלב היא לומדת באופן לא מנוצל.
לאחרונה, יש הרבה אינטרסים בתחום של קרום הלב, אבל כרגע אין פרוטוקול יעיל זמין לבידוד שלהם מאחד הכלים הנפוצים ביותר בביולוגיה — העכבר. ישנם פרוטוקולים בספרות על בידוד קרום הלב מהמוח5, רשתית6, שליה7, שריר השלד8,9; עם זאת, פרוטוקולים מעטים הם על בידוד כלבי קרום הלב. ישנן מספר קבוצות שיש להם בידוד קרום הלב. בתוך מינים רבים, כולל העכבר, הצליחו לבודד כמות שופעת של קרום הלב. עם זאת, השיטות שלהם השתמשו בציוד ספציפי בתוך הבית אשר מפחית את השגות10. Avolio ואח '11, חן ואח '12, ו baily et al.13 גם בהצלחה בבידוד לב קרום הלב מרקמת לב האדם, אבל רקמות האדם הם לא תמיד זמין וקשה להשיג עבור כמה חוקרים. כאן, פיתחנו שיטת בידוד כדי לקבל קרום הלב מדגמי העכבר עבור חוקרים כדי לחקור את הביולוגיה שלהם עם חומרים זמינים בקלות.
באמצעות מיון והפעלה של תאים מבוססי (FACS)עם סמניםמרכזיים, מאפשר לנו לבודד ולטהר אוכלוסייה של כנוציטים המאופיינת ב-CD31-CD34-CD45- CD140b+NG2+CD146+. לוח הסמנים שלנו מכיל הן סמני הכללה והן סמנים להדרה. CD45 משמש כסמן כדי להוציא תאים המטפאות. CD31 משמש כסמן כדי להוציא תאים אנדותל. CD34 משמש כסמן כדי להוציא את התאים המטפאות והאנדותל. CD146 הוא סמן עבור תאים פריסקולרית. לבסוף, NG2 ו-CD140b (הידוע גם בשם טסיות הנגזרת הצמיחה מקדם הגדילה ביתא-PDGFRβ) הם שני סמנים מקובלים עבור קרום הלב14. התרבות העיקרית המתקבלת יכולה להיות תרבותית ומעבר מספר פעמים ללא שינויים במבנה או בביטוי הסמן. יתר על כן, תאים אלה יכולים להיות שותפים לתרבות עם תאים אנדותל כדי ללמוד אינטראקציות שלהם הצלבות אחד עם השני. שיטת בידוד התא תאפשר לחוקרים ללמוד את הביולוגיה ואת הפתופסולוגיה של קרום הלב מסוג פראי, מחלות, ומודלים גנטית של העכבר משתנה.
Protocol
כל החיות היו שוכנו ונעשה שימוש באגודה להערכת והסמכה של מעבדה טיפול בבעלי חיים הבינלאומי (AAALAC) מתקן מוכר וכל העבודה בעלי חיים נערכה תחת פיקוח וטרינרי המתאים ותחת החיה המוסדית הוועדה טיפול ושימוש (IACUC) אישר את הפרוטוקול של Amgen Inc.
1. הכנת כלים ומדיה לתרבות
- אוטוקלב כירורגית 9 ס מ ישר טיפ דק מספריים נקודה 10 ס מ מלקחיים זוויתי משונן.
- הוסף 25 מ ל של 5% סרום של שור עוברי (FBS) ו 5 מ ל של 1% פניצילין סטרפטומיצין (P/S) לתוך 500 mL בקבוק של סידן מגנזיום מלוחים חינם באגירה של הפוספט מדולצ (CMF-DPBS). המקום פתרון באמבט קרח כדי להבטיח שיהיה קר בזמן השימוש. מ50 mL לתוך צינור הבידוד של האדם 50 mL. הוסף 250 יחידות/mL של הפארין תמיסת נתרן לתוך 50 mL aliquot. . זה נקרא הפרניזזד-דPBS
- הוסף 20% FBS (100 mL) ו 1% P/S (5 מ ל) לתוך בקבוק 500 mL של גלוקוז גבוהה בינונית הנשר שונה של דולבקה (DMEM). הדבר נקרא מדיה לתרבות נטולת אנזימים. הורדה 20 מ ל של DMEM זיכרון + 20% FBS + 1% P/S ולהוסיף ב 500 μg/mL של הקולגנאז B. הדבר נקרא פתרון האנזים. שמרו גם על מדיית התרבות ופתרון האנזימים החמים ב-37 ° c בחממה או באמבט מים.
2. הכנת בעלי חיים ורכש של רקמת לב
- Intraperitoneally להזריק עכבר עם 250 יחידות של פתרון הפארין נתרן עם מזרק המחט 31 G. לאחר מכן המתן 10 עד 15 דקות בעוד העכבר נשאר פעיל בכלוב הבית שלה.
הערה: נתונים מייצגים במחקר זה הושגו מזכר בן 4 חודשים C57BL/6 עכבר. עם זאת, פרוטוקול זה יכול לשמש על כל עכבר ללא קשר למתח, גיל, מין, משקל, וכו '. - . שיהיה בסדר בדוק את עומק ההרדמה של העכבר על ידי רפלקס צביטה.
- הציבו את העכבר הורדם במיקום פרקדן והקלטת את המצלמה שלו. פתח בזהירות את חלל החזה וצינורית העורקים היורדים באמצעות מחט פרפר 25 G.
- לעשות ניק בפרוזדור הימני ומבשם הלב עם לפחות 20 מ ל של 250 יחידות/mL heparinized CMF-DPBS ב 2 מ"ל/min עם משאבת משתנה משאבה פריסטלטית. כשהpbs יוצאת מימין. הריאה, הפרזיה הושלמה
- . והניחו אותו לתוך הקרח הקפוא
3. דיסוציאציה של רקמת הלב
- העבירו את הלב לצלחת פטרי בגובה 15 ס מ בגודל 15 ס"מ. חותכים את הלב לחתיכות זעירות (1 מ"מ/פיסת) באמצעות מספריים באביב ומלקחיים נקודה עדינה עם פתרון אנזים מספיק כדי לכסות את החלקים (10 עד 15 מ"ל).
- להעביר את החלקים ואת הפתרון לתוך שפופרת 50 mL, חותם עם פרפין סרט פלסטיק, ו-דגירה ב 37 ° צ' על שייקר מסלולית ב 120 rpm עבור 75 min.
- לאחר העיכול הקולגן עם פתרון האנזים, decant הנוזל באמצעות מסננת תא 100 יקרומטר לתוך צינור חדש 50 mL אבל להשאיר מספיק פתרון כדי לוודא את החלקים לא להתייבש.
- באמצעות מלקחיים נקודה עדין, להוציא את הרקמה מן הצינור ומניחים כמה חתיכות על שקופית מיקרוסקופ. ואז לטחון את הרקמה בין שתי שקופיות מיקרוסקופ כדי לשבור את הרקמה. שטוף את השקופיות עם מדיית תרבות חופשית של אנזימים לתוך צינורית חרוט 50 mL חדשה.
- חזור על השלב 3.4 עד לנתק את כל חלקי הרקמה.
- שלב את הפתרונות משלבים 3.3-3.5 לתוך צינורית אחת. מסננים את ההשעיה שנוצר באמצעות מסננת תא 100 יקרומטר לתוך צינור חדש 50 mL חרוט.
- צנטריפוגה ב 220 x g, 4 ° צ', עבור 5 דקות. להוריד את הפתרון הקודם ובעדינות להשעות מחדש את כדור התאים של האנזים החדש ללא אנזימים בתקשורת.
- ספירת תאים ובדיקת כדאיות באמצעות מונה תאים. לדלל את התאים 1 x 106/mL עם הצביעת facs קר מאגר המכיל 500 ML של dpbs ו 10-25 מ ל של 2-5% בסרום שור (bsa). התאים מוכנים להיות מוכתמים וממוינים.
4. טיהור כולציטים מתערובת תא גולמי באמצעות FACS
- הכן ותייג את הצינורות 5 מ"ל עבור כל הפקדים ודגימות התא. מחלק את התאים (1 מ ל של תאים לצינור) עבור מדגם לא מוכתם, הזריחה מינוס אחד (FMO) בקרות, ו-isotype התואמים פקדים. השתמש בתאים הנותרים עבור המיון. כל הפקדים והדגימות יכולים להיות מוכנים ומוכתמים באותו זמן.
הערהסך של 13 מ ל ב 0.5 x 106תאים/mL שימשו עבור הנציג מסוג לב אחד. עם זאת, אמצעי האחסון תלוי במספר התאים שהחוקר מקבל מבידוד שלהם, כמה לבבות הם משתמשים, וכמה טוב רקמת הלב מתעכל; הגודל של כל לב הוא גם משתנה שיכול לשנות את עוצמת הקול.- השתמש בחרוזי פיצוי (טבלת חומרים) כדי למטב את שולטת הפיצוי הפלואורסצנטית. הכינו בקרת פיצוי אחד עבור כל fluorochrome בניסוי בשפופרת מתויג 5 mL FACS. עבור ניסוי זה, להכין סך של 9 פקדים פיצוי-2 סוגים של חרוזים בלתי מוכתמים ועוד 7 fluorochromes שונים מהחלונית סמן כולל NG2-FITC, CD31-APC, CD140b-PE, CD146 BV605, CD34-BV421, CD45-PE-Cy7, ואת הכדאיות תא-APC-Cy7 ( טבלת חומרים).
- הוסף טיפה אחת של חרוזי פיצוי (~ 50 μL) מבקבוקון הסחיטה לכל צינור. ואז להוסיף 1 μL של נוגדן לחרוזים. חזרו על כל נוגדן מהחלונית ' סמן '. מערבבים במרץ על ידי הדופק-vortexing. דגירה של 30 דקות ב 4 ° צ' מוגן מפני אור למעט חרוזי הכדאיות התא אשר ניתן להשאיר בטמפרטורת החדר מוגן מפני אור.
- הבא, להוסיף 3 מ ל של FACS הצביעת מאגר לכל צינור וצנטריפוגה ב 300 x g עבור 5 דקות ב 4 ° c. מכתים את הפתרון ולהשעות מחדש כל גלולה חרוז ב 400 μL של מאגר כתמים של FACS. . שולטת הפיצויים מוכנים לשימוש . המשיכו לאכול
- השתמש בפקדי FMO כדי למטב את צביעת הרקע עקב חפיפה ספקטרלית.
- הכינו שולטת FMO באמצעות 1 mL של תאים שהיה מצוטט מסעיף 4.1 בצינור 5 mL FACS והוסיף בכל הנוגדנים מהחלונית סמן המתואר בשלב 4.1.1 ב-1:100 דילול אך למעט נוגדן אחד. לדוגמה, להכין FMO NG2-AF488 על ידי כולל נוגדנים עבור CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, הכדאיות תא לצבוע אבל לא את הנוגדן NG2-AF488. מערבבים בעדינות על ידי הדופק-וורטקנג. חזור על כל נוגדן עבור סך של 7 פקדים. המשך 30 דקות ב -4 ° צ' מוגן מפני אור.
- הבא, להוסיף 3 מ ל של FACS הצביעת מאגר לכל צינור וצנטריפוגה ב 300 x g עבור 5 דקות ב 4 ° c. מכתים את הפתרון ומשהה מחדש כל גלולה תא ב 400 μL של מאגר כתמים של FACS. פקדי FMO מוכנים לשימוש. . המשיכו לאכול
- השתמש בנוגדנים בקרה מתאימים (טבלת חומרים) עבור כתמים לא ספציפיים.
- הכינו שולטת isotype על ידי הוספת הנוגדן בקרת בקרה בהתאמה (טבלה של חומרים) ל 1 מ ל של דגימת תאים שהוכנו מסעיף 4.1 בשעה 1:100 דילול כל אחד ב 5 מ ל facs צינור. מערבבים בעדינות על ידי הדופק-וורטקנג. המשך 30 דקות ב -4 ° צ' מוגן מפני אור.
- הבא, להוסיף 3 מ ל של FACS הצביעת מאגר לכל צינור וצנטריפוגה ב 300 x g עבור 5 דקות ב 4 ° c. מכתים את הפתרון ומשהה מחדש כל גלולה תא ב 400 μL של מאגר כתמים של FACS. פקדי isotype מוכנים לשימוש. . המשיכו לאכול
- הכן תאים להיות ממוינים על ידי הוספת קוקטייל נוגדן לתאים טריים מבודדים.
- להכין דגימת תא מסעיף 4.1 על-ידי הוספת בקוקטייל נוגדן המכיל אנטי-עכבר NG2-AF488, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7 ב 1:100 דילול כל הכדאיות תא לצבוע 1:1000 דילול. . מערבולת עדינה לערבב הגנה על דגימות ב -4 ° c עבור 30 דקות מוגן מפני אור.
- לאחר הצביעת, לשטוף תאים עם מאגר הצביעת FACS ידי צנטריפוגה ב 300 x g עבור 5 דקות 4 ° c. מכתים את הפתרון ולהשעות מחדש את הגלולה התא במאגר כתמים FACS כדי 0.5 x 106 תאים/mL.
- באמצעות צינורות facs חדשים כי יש 35 יקרומטר מסנן צמרות, פיפטה מוכתם דגימות תא על העפעפיים פילטרט הכבידה כדי להשיג השעיות תא יחיד. . המשיכו לאכול
- השתמש בחרוזי פיצוי (טבלת חומרים) כדי למטב את שולטת הפיצוי הפלואורסצנטית. הכינו בקרת פיצוי אחד עבור כל fluorochrome בניסוי בשפופרת מתויג 5 mL FACS. עבור ניסוי זה, להכין סך של 9 פקדים פיצוי-2 סוגים של חרוזים בלתי מוכתמים ועוד 7 fluorochromes שונים מהחלונית סמן כולל NG2-FITC, CD31-APC, CD140b-PE, CD146 BV605, CD34-BV421, CD45-PE-Cy7, ואת הכדאיות תא-APC-Cy7 ( טבלת חומרים).
- השתמש בסדרן תאים כדי לטהר את התאים.
- הפעל את התאים הבלתי מוכתמים בסדרן התא כדי לקבוע את המתח ולתקן את אות הרקע (לדוגמה, קבע מתח לפיזור קדימה ל-490-560 ו-לפיזור צדדי עד 180-250).
- הפעל כל אחת מדוגמאות החרוזים בצבע אחד בכל פעם כדי לכוונן את המתח עבור כל ערוץ ולהתאים את השערים לאות החיובי. איסוף נתונים. השתמש בתוכנה כדי לחשב חפיפה ספקטרלית על-ידי חישוב מטריצת הפיצוי. . כל המתח מוכן ומוכנים
- הפעל כל פקד isotype אחד בכל פעם וניתן להשתמש בנתונים אלה כדי לכוונן את השערים עבור איגוד לא ספציפי אם קיימים.
- הפעל כל מדגם FMO אחד בזמן ולהתאים את המתח עבור כל ערוץ כדי לתקן את הדימום ספקטרלי בגלל לוח מרובה צבעים.
- הפעל את דגימות התא ויטראז ' בסדרן התא ולאסוף תאים ב 10 מ"ל מדיה לתרבות ללא אנזימים (DMEM גברת + 20% FBS + 1% P/S) בתוך שפופרת אוסף של 15 מ"ל. השתמש באסטרטגיה הבאה לאחר הפעולה: שער לתאים בודדים, שער לתאים חיים, שער לתאים שליליים CD45, שער לתאים CD34 וCD31 שליליים, שער לתאים NG2 חיוביים, ולבסוף שער עבור CD146 וCD140b תאים חיוביים.
5. שתיל קרום הלב
- מעיל צלחת 24-באר עם 0.2% ג'לטין עבור 5 דקות ומלא את הפתרון ג'לטין. זרעי התאים שהתקבלו טרי משלב 4.2.5 ב Dמאמ + 20% FBS + 1% P/S עד 2 x 104 תאים/cm2. תאי תרבות באינקובטור תא הממוקם ב37 ° c, 5% CO2 ו 95% O2.
- הפסולוציטים
- לאחר התאים הם 95% confluent, לשטוף תאים עם חם 1x DPBS, ולהרים תאים עם 200 μL של 0.1% טריפסין בכל באר בטמפרטורת החדר עבור 3-5 דקות.
- הקש בעדינות על הצלחת כדי לשחרר את התאים.
- לנטרל את טריפסין עם 3.5 x את כמות התקשורת התרבותית (700 μL Dמאמ + 20% FBS + 1% P/S) ואת הזרע מעבר שני (P2) תאים על צלחת 6-באר מצופה ב 2 x 104 תאים/ס"מ2.
- כל טוב, כאשר שוטפת, ניתן להעביר לתוך הבקבוקון T-75 יחיד כמו תאים P3 אשר לאחר מכן ניתן לפצל ביחס 1:6.
6. אפיון קרום הלב
-
מנתח זרימה
- השתמש באותו פרוטוקול של FACS הצביעת ומעבר אסטרטגיה כפי שתוארה קודם לכן בסעיף 4.
- הפעל פקדים ודגימות מוכתם על cytometer זרם. איסוף נתונים וניתוח נתונים באמצעות תוכנת הניתוח (טבלת חומרים).
- כדי לאסוף תמונות ברייטפילד, לגדול תאים בבקבוקון בחממה תא להגדיר ב 37 ° c, 5% CO2 ו 95% O2. לכידת תמונות על מיקרוסקופ לאחר תאים לצרף אל פני השטח.
-
אימונוציטוטוכימיה
- הגדל תאים בצלחת 96-באר עד 90% באמצעות. לשטוף את התאים עם חם 1x DPBS ולתקן עם 4% פאראמפורמלדהיד עבור 30 דקות בטמפרטורת החדר.
- לשטוף את התאים 3x עם 1x DPBS והחדירות עם 0.1% אבקת כביסה עבור 10 דקות בטמפרטורת החדר.
- דגירה תאים עם חסימה מאגר עבור 1 h בטמפרטורת החדר. לאחר חסימת, להוסיף נוגדנים העיקרי (נוגדן אחד לכל טוב) מדולל 1:100 בתוך חסימת מאגר ו דגירה ב 4 ° c לילה. נוגדנים עיקריים הם: anti-NG2, אנטי-CD140b, anti-CD31, אנטי vimentin, אנטי desmin, ו אנטי אלפא שריר חלק actin.
- למחרת, לשטוף את התאים 3x עם מאגר לשטוף (טבלת חומרים). הוסף נוגדן משני מדולל 1:1000 בתוך חסימת מאגר ו הדגירה עבור 2 h בטמפרטורת החדר בחושך. נוגדן משני הוא אנטי ארנב מצומת FITC.
- לשטוף את התאים 3x עם מאגר לשטוף. הוסף 300 μM כתם גרעיני מדולל ב 1:1000 עבור 5 דקות בטמפרטורת החדר.
- לשטוף את התאים 3x עם DPBS 1x ו הר עם הרכבה מדיה.
- התמונה תאים עם מיקרוסקופ קונפוקלית וקד.
תוצאות
לאחר העיכול האנזימטי והדיסוציאציה של הלב כולו ולפני הטיהור של התאים, התאים הם תערובת גסה המכילה סוגי תאים שונים רבים מהלב (איור 1A). לאחר הטיהור והתפירה של FACS, התאים הם הומוגניים. הם נוקלאוניים בודדים, שטוחים למדי, ויש להם את המבנה האופייני לקרום הלב (איור 1B).
באמצעות FACS, התאים מטוהרים לאירוע הומופאלי. דגימת תא הבקרה הבלתי מוכתמת משמשת להצגת אסטרטגיית החסימה (איור 2). ראשית, פסולת ו doublets היו מגודרת בהתבסס על הפצות פיזור קדימה בצד. ואז התאים המתים היו מגודרת בשל תגובת האמין שלהם עם הצבע אשר מייצרת אות גדול יותר אינטנסיבי יותר מאשר תאים חיים. של תאים לחיות, תאים המטבטיים היו מגודרת על ידי להיות CD45+. כדי להסיר עוד תאים המטפאות והאנדותל, CD34+ ו CD31+ תאים היו מגודרת. לבסוף, NG2+ ו CD140b+/cd146+ תאים נבחרו להיות התאים הפריאוריים עם ביטוי של סמנים אופייני לקרום הלב (איור 3). פאנל הסמן נבדק גם על התאים הכליליים בעכבר כלילית כפקד (איור משלים 1). רק בערך 1% מתערובת התא הגולמי הייתה מורכבת מקרום הלב לאחר המיון.
כדי לוודא כי התאים היו אכן קרום הלב, העברנו את התאים לאפיון נוסף. תאים גדלו במהירות ברגע שהם הגיעו P3 בתוך מבחנות T-75 ללא שינויים הכדאיות כפי שהם הפכו מבוגרים (משלים איור 2). בהשוואה לקרום הלב של המוח האנושי, לתאים היתה מורפולוגיה דומה (איור 4A). כאשר לעומת העכבר האדם תאים שריר חלק, התאים היו מורפולוגיה שונה (איור 4A). היו גם לא שינויים נצפתה מורפולוגיה או ביטוי סמן ב P7 כאשר מוכתם חיסוני או על ידי הזרימה cy, לנסות ניתוח לאחר הפסנת (איור 4B,C).
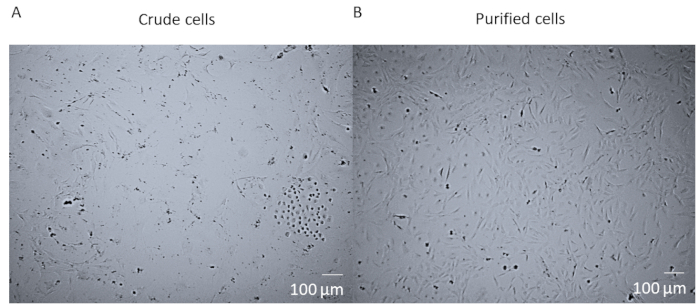
איור 1 : תאים גסים לעומת תאים מטוהרים. (א) התמונה ברייטפילד של תערובת התא הגולמי הצבת את כל העיכול והדיסוציאציה של הלב האנזימטי שהיה מתורבת בבקבוקון T25 במשך 14 יום. (ב) תמונת ברייטפילד של אוכלוסיה הומוגנית בקרום הלב לאחר 14 ימים. סרגל קנה מידה = 100 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
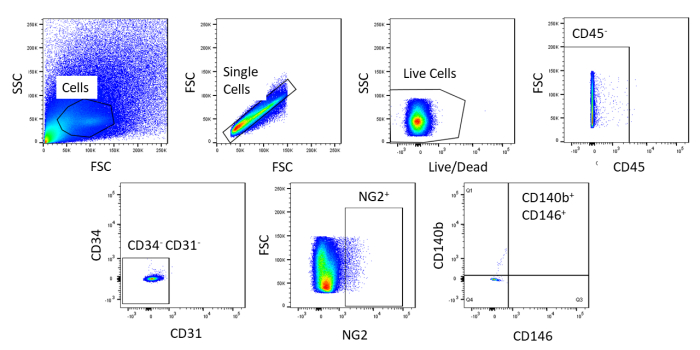
איור 2 : תמונות מייצגות של ניתוח FACS של תאים בלתי מוכתמים. ייצוג סכימטי של אסטרטגיית העליה המשמשת לטיהור שילוב תאים גולמי. שער לתאים בודדים, חיים, CD45-, CD31-, CD34-, NG2+, CD146+וCD140b+. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
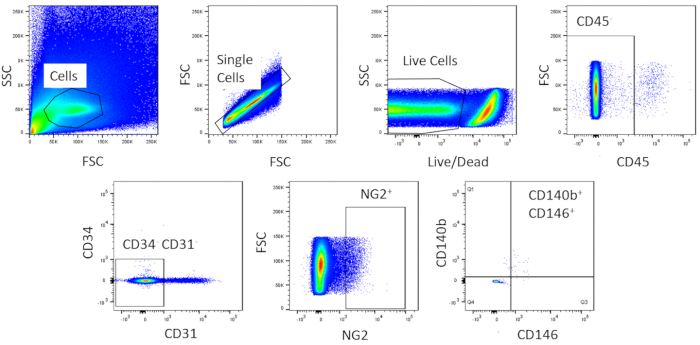
איור 3 : תמונות מייצגות של ניתוח FACS של תאים גולמיים. ייצוג סכמטי של המיון המשמש להשגת אוכלוסיה הומוגנית בקרום הלב. בערך 1% של תאים גולמיים הם CD31-CD34-CD45-CD140b+NG2+CD146+. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
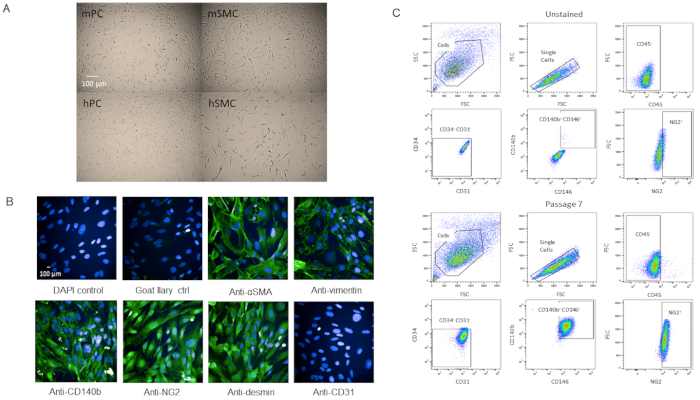
איור 4 : אפיון מבודד בעלי לב קרום הלב (א) ברייטפילד תמונות של תאים מתורבתים מהמוח האנושי (hPC) ולבבות העכבר (mpc) מראים דומה מורפולוגיה של תאי קרום הלב אך מורפולוגיה שונה מתאי השריר החלקים האנושיים hsmc) והעכבר החלק השריר החלקה (mSMC). סרגל בקנה מידה = 100 μm. (ב) אפיון פנוטיציאני של תאים בP7 על ידי אימונוציטוכימיה עבור סמנים כלעיים. סרגל בקנה מידה = 100 μm. (ג) ניתוח על ידי זרימה cyP7 try של קרום הלב ב איפה הם היו מגודרת סמנים שליליים CD31, CD34, CD45 ו סמנים חיוביים NG2, CD140b, ו CD146. האוכלוסיה נשארת אחידה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
משלים איור 1: דמויות מייצגות של הזרימה cy, לנסות בתאי האנדותל באמצעות סמן הפאנל. קו של תא כלילי לעורק העכבר שימש כפקד עבור ספציפיות האיגוד עבור הסמנים. השימוש באותה אסטרטגיה שהיתה בשימוש במיון, למעט שער חיובי עבור CD31 במקום שער שלילי, תאי האנדותל היו שליליים עבור CD45, CD34, NG2, CD140b ו-CD146, אך חיובי עבור CD31 כצפוי. אנא לחץ כאן כדי להוריד את האיור.
איור משלים 2: תמונות מייצגות של הזרימה cy, לנסות לנתח של קטעים שונים של mPC. קרום הלב המבודד והיסודי. היה תרבותי והגיע למעבר 12 תאים היו מוכתמים propidium יודיד ונותחו על cytometer זרימה. אוכלוסיית הבקרה היא תערובת של תאים מתים ותאים חיים. לא היו הבדלים משמעותיים במספר תאים קיימא בין מעברים. אנא לחץ כאן כדי להוריד את האיור.
Discussion
כאשר מחקרים על קרום הלב הם חדשים יחסית, התפקיד של קרום הלב בפיזיולוגיה לב וכלי דם פתופסיולוגיה עדיין לא הוגדרו. באיברים אחרים, הם הוכחו לשחק תפקידים מרכזיים הומאוסטזיס ו זלוף1,2. בהשוואה לספרות של כלולוציטים מאיברים אחרים כגון המוח, יש מספר משמעותי פחות של פרסומים על קרום הלב. הבידוד של קרום הלב הוא קריטי להבנת המאפיינים הפונקציונליים שלהם מנגנוני איתות. לפיכך, פרוטוקול זה יספק לחוקרים דרך קלה יותר לגשת לקרום הלב ממקור רקמות זמין ולקדם את הלימודים בביולוגיה. זה יעזור לענות על שאלות על כמה לב קרום הלב לתרום הומאוסטזיס לב פתופסולוגיה, כמו גם לחקור את הפוטנציאל התרפויטי שלהם.
האוכלוסיה המבודדת מליבו של מוריין ומתאפיינת ב-CD31-CD34-CD45-CD140b+NG2+CD146 הייתה מספר פעמים מרובות (עד P12 ועדיין הולך חזק), שאינו ירידה בכדאיות והפצת במהירות (איור משלים 2). התאים גם היו cryof רוזן והתאושש עם לפחות 95% הכדאיות. עם זאת, אנו מעדיפים להשתמש בתאים P7 או צעירים יותר עבור הניסויים שלנו. השוואת התמונות ברייטפילד של קרום הלב שלנו עם קרום הלב של המוח האנושי, שני קווי התא יש מורפולוגיה תאים דומים (איור 4a) בעוד הם נבדלים במבנה מתאי שריר חלקה (איור 4a). התאים הP7 שלנו הואפיינו על-ידי כימיה חיסונית של סמנים, חלקם מלוח FACS שלנו (NG2 ו-CD140b), ומעטים לא בפאנל (vimentin, desmin, αSMA) ומצאנו כי התאים הביעו סמנים ליטולוציטים (איור 4B). בנוסף, התאים P7 שלנו נותחו על ידי הזרימה cy, לנסות שוב עם פאנל סמן אותו כדי להעריך שינויים בביטוי סמן בשל הפסנה ומצאנו כי לא היו שינויים (איור 4C). לכן, התאים שלנו הם בדרך כלל ומורפולוגית.
המחקרים שנעשו על-ידי העקורים ואח '10, avolio ואח '11, חן ואח '12, ובאלי ואח '13 הראו בדלולי לב מוצלחים. עם זאת, השימוש בציוד מותאם אישית בתוך הבית לנתק את קרום הלב מן המיקרוכלים על ידי המים ואח '10 מעורב שני תאים עם משאבות כי המכונה הפתרון פרוטאז הלוך ושוב דרך מחסנית רשת רשת, אשר היה קשה לשכפל כפי שהם אינו מספק תרשים ו/או תמונה של המנגנון וכיצד הוא נבנה. למרות שאין מדובר ב-10 בהצלחה בבידוד לב הלב ממינים רבים, מעולם לא הצלחנו לשחזר את השיטה שלהם. צעד הניתוק שלנו בפרוטוקול שלנו פשוט משתמש שייקר מסלולית (כדי לנתק את כל התאים) אשר זמין ביותר, אם לא כל המעבדות, עם פתרון הרקמה והאנזים בצינור חרוט ואחריו צעד דיסוציאציה מכני. אין צורך במנגנון מותאם אישית. שנית, הפרוטוקולים הנותרים כוללים את השימוש ברקמות האדם ולכן הרכישה של רקמת האדם מגבילה את החוקרים. הפרוטוקול שלנו הוא שינוי ואופטימיזציה של הפרוטוקולים הנוכחיים9,12 באמצעות מודלים של העכבר (סוג פראי, שונה גנטית, חולה) וחומרים הזמינים בקלות לכל החוקרים.
בגלל התאים הפריסקולריים בכלל רגישים, הכדאיות של התאים הוא קריטי כדי לקבל תשואה טובה. במהלך הרכישה של רקמות לב וכתמים של תאים, את הרקמה/תאים צריך להישמר קרח קר. שנית, העיכול האנזימטי של הרקמה עשוי לדרוש אופטימיזציה על בסיס פרטני. בהתאם ליחידות הפעילות על מבחנות של האחד של אנזימים, ריכוז וזמן העיכול עשוי להיות ממוטב. ודא שהפתרון האנזימטי מוכן טרי בכל פעם שהתשואה אחרת תפחית. שלישית, תערובת גסה מכיל הרבה תאים, כמה מת ו/או גוסס, עדיף להנמיך את הריכוז של FBS במאגר הצביעת מ 5% כדי 2%. אם אתה נתקל בבעיות עם התאים סותם את הזרבובית במהלך מיון, להעשיר את התאים הראשון באמצעות ערכת הסרת תא מת. ניתן גם להוסיף מאגר EDTA/HEPES או הטיפול DNase לתא טרום מיון כדי למנוע כפתור התא. לבסוף, כי הפאנל שלנו של נוגדנים הוא די גדול ומשתמש fluorophores רבים, להיות בטוח שלך FMO פקדים ושולטת פיצוי נעשים כראוי.
מגבלה אחת לשיטה זו היא כמות קרום הלב שניתן להשיג לכל לב. במקרה שלנו, רק 1.1% של התערובת הגולמי שלנו מלב העכבר אחד היו קרום הלב אשר דומה לאחוז של הלב האנושי מבודדים, אבל מספר התאים הוא פחות משמעותית בשל כמות רקמת הלב מספק עכבר. מכיוון שהמספר ההתחלתי של תאים הוא כה נמוך לאחר FACS, עדיף לבודד מכמה לבבות בבת אחת. עם זאת, הבעיה עם זה היא המספר המוחלט של תאים שעליך למיין ביום אחד. אם יש לך יותר מ 30,000,000 תאים, יהיה קשה לעבור את המיון מבלי להשפיע על הכדאיות של התאים. אם היה לחוקר מספר רב של תאים, בידוד ממספר לבבות ביום יהיה בר ביצוע. מגבלה נוספת היא כי אנחנו לא יודעים אם יש אוכלוסיות משנה של קרום הלב בליבו כמו יש שריר השלד15,16, אנחנו לא יודעים אם אנחנו מבטלים תת סוג באסטרטגיית היציאה שלנו. אנחנו בתהליך של אפיון קרום הלב שלנו עד כה בנתונים שלא פורסמו, הם מבחינה פונקציונלית כמו קרום הלב אחרים בספרות.
הפרוטוקול שלנו יאפשר לחוקרים לענות על שאלות על תכונות לב הלב, מאפיינים, פונקציונליות, והיבטים אחרים אשר יסייעו להגדיר את תרומתם להומאוסטזיס הלב והימודינמיקה. תאים אלה יכול להיות פוטנציאל טיפולי למחלות לב וכלי דם פעם ביולוגיה שלהם מובנת טוב יותר.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המחברים רוצים להודות לזרימת Amgen Cy, ליבת הליבה, לעזרתם עם עיצוב לוח fluorophore, פתרון בעיות, מיון תאים.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-053-Cl | dilute with 1x DPBS to get 0.1% |
| 100 μM Cell strainer | FisherSci | 22363549 | |
| 15 mL Falcon conical tubes | BD | 352096 | |
| 24-well plate | Corning | CLS3527 | |
| 25 G butterfly needle | FisherSci | 22-253-146 | |
| 31 G needle syringe | FisherSci | B328446 | |
| 50 mL Falcon conical tubes | BD | 352098 | |
| 6-well plate | Corning | CLS3516 | |
| anti-alpha smooth muscle actin rabbit mAb | abcam | ab32575 | Antibody used in ICC 1:100 dilution |
| anti-CD140b rabbit mAb | Cell Signaling | 28E1 | Antibody used in ICC 1:100 dilution |
| anti-CD31 rabbit pAb | abcam | ab28364 | Antibody used in ICC 1:100 dilution |
| anti-desmin rabbit pAb | abcam | ab8592 | Antibody used in ICC 1:100 dilution |
| anti-NG2 conjugated to AF488 | Millipore | MAB5384A4 | Antibody used in ICC 1:100 dilution |
| anti-vimentin rabbit mAb | abcam | ab92547 | Antibody used in ICC 1:100 dilution |
| ArC Amine Reactive Compensation bead kit | Invitrogen | A10346 | compensation beads for Live/Dead Near IR dye |
| Brightfield Microscope | camera attached | ||
| CD140b-PE (clone APB5) | eBioscience | 12-1402-81 | Antibody used in FACS 1:100 dilution |
| CD146-BV605 (clone ME-9F1) | BD | 740434 | Antibody used in FACS 1:100 dilution |
| CD31-APC (clone MEC 13.3) | BD | 551262 | Antibody used in FACS 1:100 dilution |
| CD34-BV421 (clone RAM 34) | BD | 56268 | Antibody used in FACS 1:100 dilution |
| CD45-PE-Cy7 (clone 30-F11) | BD | 552848 | Antibody used in FACS 1:100 dilution |
| Centrifuge | eppendorf | ||
| Collagenase B | Roche | 11088815001 | 0.226 U/mg lyo. |
| Confocal Microscope | |||
| DAPI | ThermoFisher | D1306 | nuclear stain |
| DMEM with 4.5 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-013-CV | 500 mL |
| Dowell scissors | FST | 15040-11 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Corning | 21-030-CV | 500 mL |
| Dulbecco's Phosphate-Buffered Saline without Ca and Mg (CMF-DPBS) | Corning | 21-031-CV | 500 mL |
| Dumont #5 Fine Forceps | FST | 11254-20 | |
| FACSAria cell sorter | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| FACSAria software | BD | ||
| Falcon tube round-bottom polypropylene, 5 mL | BD | 38057 | |
| Falcon tube with cell strainer cap, 5 mL | BD | 08-771-23 | |
| Fetal Bovine Serum | Corning | 35-015-CV | 500 mL |
| Fine scissors | FST | 14060-09 | |
| FlowJo software | FlowJo LLC | ||
| Fortessa LSR flow cytometer | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| Gelatin-based coating | Cell Biologics | 6950 | |
| Goat anti-rabbit IgG (H+L) Cross-Absorbed Secondary antibody, Alexa Fluor 488 | Invitrogen | A-11008 | Antibody used in ICC 1:1000 dilution |
| Graefe Forceps | FST | 11049-10 | |
| Heparin sodium solution | Hospira | NDC 0409-2720-02 | 10,000 USP units/10 mL; from porcine intestines |
| Incubator | set at 37 °C, 5% CO2, 95% O2 | ||
| Live/Dead-Near IR | Life Technologies | L10119 | |
| Microscope slides | FisherSci | 12-550-343 | |
| NG2-FITC | Millipore | AB5320A4 | Antibody used in FACS 1:100 dilution |
| Oribital shaker | VWR | Inside 37 °C incubator or room | |
| Paraformaldehyde | FisherSci | 50-980-487 | dilute with 1x DPBS to get 4% |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Petri dish | FisherSci | FB0875714 | |
| Pipette and tips | |||
| ProLong Diamond | ThermoFisher | P36965 | mounting media |
| Propidum Iodide | ThermoFisher | cell viability dye for supplemental figure 2 | |
| Rabbit IgG FITC | eBiosciences | 11-4614-80 | Isotype control antibody - FITC |
| Rat IgG2a APC | Biolegend | 400512 | Isotype control antibody - APC |
| Rat IgG2a BV421 | Biolegend | 400536 | Isotype control antibody - BV421 |
| Rat IgG2a BV605 | BD | 563144 | Isotype control antibody - BV605 |
| Rat IgG2a PE | Biolegend | 400308 | Isotype control antibody - PE |
| Rat IgG2b PE-Cy7 | Biolegend | 400617 | Isotype control antibody - PE-Cy7 |
| SuperBlock | ThermoFisher | 37515 | blocking buffer |
| T75 | ThermoFisher | 156499 | |
| Triton X-100 | Sigma | X100 | detergent, dilute with x DPBS to get 0.1% |
| UltraComp beads | Invitrogen | 01-2222-42 | compensation beads |
| Variable-Flow Peristaltic Pump | FisherSci | 13-876-1 | |
| ViCell Cell counter | Beckman | ||
| Wash buffer | 1:10 dilution of Superblock in 1x DPBS |
References
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Sengillo, J. D., et al. Deficiency in mural vascular cells coincides with blood-brain barrier disruption in Alzheimer's disease. Brain Pathology. 23 (3), 303-310 (2013).
- Avolio, E., Madeddu, P. Discovering cardiac pericyte biology: From physiopathological mechanisms to potential therapeutic applications in ischemic heart disease. Vascular Pharmacology. 86, 53-63 (2016).
- Dore-Duffy, P. Isolation and characterization of cerebral microvascular pericytes. Methods in Molecular Medicine. 89, 375-382 (2003).
- Bryan, B. A., D'Amore, P. A. Pericyte isolation and use in endothelial/pericyte coculture models. Methods in Enzymology. 443, 315-331 (2008).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant outgrowth, propagation and characterization of human pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Crisan, M., Corselli, M., Chen, W. C., Peault, B. Perivascular cells for regenerative medicine. Journal of Cellular Molecular Medicine. 16 (12), 2851-2860 (2012).
- Crisan, M., et al. Purification and long-term culture of multipotent progenitor cells affiliated with the walls of human blood vessels: myoendothelial cells and pericytes. Methods in Cellular Biology. 86, 295-309 (2008).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology Heart Circulatory Physiology. 302 (1), H69-H84 (2012).
- Avolio, E., et al. Expansion and characterization of neonatal cardiac pericytes provides a novel cellular option for tissue engineering in congenital heart disease. Journal of the American Heart Association. 4 (6), e002043 (2015).
- Chen, W. C., et al. Human myocardial pericytes: multipotent mesodermal precursors exhibiting cardiac specificity. Stem Cells. 33 (2), 557-573 (2015).
- Baily, J. E., et al. Isolation of Perivascular Multipotent Precursor Cell Populations from Human Cardiac Tissue. Journal of Visualized Experiments. (116), e54252 (2016).
- Murray, I. R., et al. Skeletal and cardiac muscle pericytes: Functions and therapeutic potential. Pharmacology & Therapeutics. 171, 65-74 (2017).
- Birbrair, A., et al. Role of pericytes in skeletal muscle regeneration and fat accumulation. Stem Cells Development. 22 (16), 2298-2314 (2013).
- Birbrair, A., et al. Skeletal muscle pericyte subtypes differ in their differentiation potential. Stem Cell Research. 10 (1), 67-84 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved