Method Article
Isolement et purification des périphytes cardiaques murines
Dans cet article
Résumé
Nous avons optimisé un protocole pour isoler et purifier les péritéytes cardiaques murines pour la recherche fondamentale et l'étude de leur biologie et de leur potentiel thérapeutique.
Résumé
Les péricarténties, cellules périvasculaires des microvaisseaux et des capillaires, sont connues pour jouer un rôle dans l'angiogenèse, la stabilisation des navires et l'intégrité de la barrière endothéliale. Cependant, leurs fonctions spécifiques aux tissus dans le cœur ne sont pas bien comprises. De plus, il n'existe actuellement aucun protocole utilisant des matériaux facilement accessibles pour isoler et purifier les péririytes d'origine cardiaque. Notre protocole se concentre sur l'utilisation du modèle très utilisé des mammifères, la souris, comme source de cellules. En utilisant la digestion enzymatique et la dissociation mécanique du tissu cardiaque, nous avons obtenu un mélange brut de cellules qui a été encore purifié par le tri de cellules activant de fluorescence (FACS) par une pléthore de marqueurs. Parce qu'il n'y a pas de marqueur sans équivoque unique pour les péricartés, nous avons fermé pour les cellules qui étaient CD31-CD34-CD45-CD140b-NG2-CD146. Après la purification, ces cellules primaires ont été cultivées et passages plusieurs fois sans aucun changement dans la morphologie et l'expression de marqueur. Avec la capacité d'obtenir régulièrement des péritéytes cardiaques maurines primaires utilisant notre protocole, nous espérons mieux comprendre le rôle des péritéytes dans la physiologie cardiovasculaire et leur potentiel thérapeutique.
Introduction
Les cellules périvasculaires connues sous le nom de péricartes entourent les microvaisseaux et les capillaires de l'arbre vasculaire1,2. Physiologiquement, ils sont connus pour promouvoir et jouer un rôle dans l'angiogenèse, augmenter l'intégrité de la barrière en raison de leur relation étroite avec les cellules endothéliales ainsi que stabiliser et les vaisseaux matures1,2. En outre, le dysfonctionnement et /ou la perte de ces cellules ont été impliqués dans des maladies telles que la maladie d'Alzheimer2,3 et diverses maladies cardiovasculaires4. Ces cellules se trouvent dans tout le corps, mais les numéros de cellules sont tributaires des tissus. Les péricartes ont notamment été étudiés dans le cerveau en raison de la vascularisation élevée de la barrière hémato-encéphalique1,2. Cependant, dans le cœur, la biologie des péricartes est sous-étudiée.
Récemment, il ya un intérêt accru dans le domaine pour les périytes cardiaques, mais il n'existe actuellement aucun protocole simplifié disponible pour leur isolement de l'un des outils les plus utilisés en biologie - la souris. Il y a des protocoles dans la littérature sur l'isolation des périytes du cerveau5, rétine6, placenta7, et le muscle squelettique8,9; cependant, peu de protocoles sont sur isoler les périytes du cœur. Il y a plusieurs groupes qui ont isolé des péritéytes cardiaques. Nees et coll. ont été en mesure d'isoler une quantité abondante de péritéytes cardiaques de plusieurs espèces, y compris la souris; cependant, leurs méthodes ont employé l'équipement construit interne spécifique qui diminue la reproductibilité10. Avolio et coll.11, Chen et coll.12, et Baily et coll.13 ont également isolé avec succès les périytes cardiaques des tissus cardiaques humains, mais les tissus humains ne sont pas toujours disponibles et difficiles à obtenir pour certains chercheurs. Ici, nous avons développé une méthode d'isolement pour obtenir des péritéytes cardiaques à partir de modèles de souris pour les chercheurs d'étudier davantage leur biologie avec des matériaux facilement disponibles.
Utilisant la digestion enzymatique et le tri activé de cellules de fluorescence (FACS) avec les marqueurs clés connus de périyte14,notre protocole nous permet d'isoler et de purifier une population de péricytes qui sont caractérisés par CD31-CD34-CD45- CD140b-NG2-CD146-. Notre panel de marqueurs contient à la fois des marqueurs d'inclusion et d'exclusion. CD45 est utilisé comme marqueur pour exclure les cellules hématopoïétiques. CD31 est utilisé comme marqueur pour exclure les cellules endothéliales. CD34 est utilisé comme marqueur pour exclure les cellules hématopoïétiques et endothéliales progénitrices. CD146 est un marqueur pour les cellules périvasculaires. Enfin, NG2 et CD140b (également connu sous le nom de bêta récepteur du facteur de croissance dérivé plaquettaire — PDGFRMD) sont tous deux des marqueurs acceptés pour les péritéytes14. La culture primaire obtenue peut être cultivée et adoptée plusieurs fois sans aucun changement dans la morphologie ou l'expression des marqueurs. En outre, ces cellules peuvent être co-cultivées avec des cellules endothéliales pour étudier leurs interactions et se croiser les unes avec les autres. Cette méthode d'isolement cellulaire permettra aux chercheurs d'étudier la biologie et la pathophysiologie des péricytes cardiaques à partir de modèles de souris de type sauvage, de maladie et de variantes génétiques.
Protocole
Tous les animaux ont été logés et utilisés dans une installation accréditée par l'Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC), et tous les travaux sur les animaux ont été effectués sous la surveillance vétérinaire appropriée et sous l'œuvre de l'institution animale. Protocole approuvé par le Comité des soins et de l'utilisation (IACUC) d'Amgen Inc.
1. Préparation des outils et des médias culturels
- Autoclave chirurgicale 9 cm droite pointe ciseaux point fin et 10 cm de forceps dentelés inclinés.
- Ajouter 25 ml de sérum bovin foetal (FBS) à 5 % et 5 ml de streptomycine de pénicilline de 1 % (P/S) dans une bouteille de 500 ml de saline tamponnée de phosphate de Dulbecco (CMF-DPBS). Placez la solution dans un bain de glace pour s'assurer qu'il fera froid au moment de l'utilisation. Aliquot 50 ml dans un tube conique de 50 ml pour l'isolement cardiaque. Ajouter 250 unités/mL de solution de sodium héparine dans l'aliquot de 50 ml. C'est ce qu'on appelle le FMC-DPBS héparinisé.
- Ajouter 20 % de FBS (100 ml) et 1 % de P/S (5 ml) dans une bouteille de 500 ml de milieu d'aigle modifié (DMEM) à haute teneur en glucose du Dulbecco. Ce sera appelé le média de culture sans enzymes. Aliquot 20 mL de DMEM , 20 % DE FBS et 1 % De P/S et ajouter 500 g/mL de collagène B. Ce sera appelé la solution enzymatique. Gardez au chaud le support culturel sans enzymes et la solution enzymatique à 37 oC dans un incubateur ou un bain d'eau.
2. Préparation des animaux et approvisionnement en tissus cardiaques
- Injectez par voie intrapéritone une souris 250 unités de solution de sodium héparine avec une seringue à aiguille s'il y a 31 G. Ensuite, attendez 10 à 15 min pendant que la souris reste active dans sa cage d'origine.
REMARQUE: Des données représentatives dans cette étude ont été obtenues à partir d'une souris c57BL/6 mâle de 4 mois. Cependant, ce protocole peut être utilisé sur n'importe quelle souris indépendamment de la souche, l'âge, le sexe, le poids, etc. - Anesthésiez la souris avec 5% d'isoflurane. Vérifiez la profondeur d'anesthésie de la souris par réflexe de pincement.
- Placez la souris anesthésié en position de supine et collez ses membres antérieurs. Ouvrez soigneusement la cavité thoracique et cannulez l'aorte descendante à l'aide d'une aiguille papillon de 25 G.
- Faire une entaille dans l'atrium droit et perfuser le cœur avec au moins 20 ml de 250 unités/mL heparinized CMF-DPBS à 2 mL/min avec une pompe péristtaltique à débit variable. Lorsque le PBS sort de l'atri-rave droit propre, perfusion est terminée.
- Coupez le cœur à l'aorte et placez-le dans le CMF-DPBS glacé.
3. Dissociation des tissus cardiaques
- Transférer le cœur dans un plat Petri de 15 cm x 15 cm. Couper le cœur en petits morceaux (1 mm/pièce) à l'aide de ciseaux à ressort et de forceps à pointe fine avec une solution enzymatique suffisante pour couvrir les morceaux (10 à 15 ml).
- Transférer les morceaux et la solution dans un tube conique de 50 ml, sceller avec du film plastique paraffine et couver à 37 oC sur un shaker orbital à 120 tr/min pendant 75 min.
- Après la digestion de collagène avec la solution d'enzyme, décanter le liquide par une passoire de cellules de 100 m dans un nouveau tube de 50 ml, mais laissez assez de solution pour s'assurer que les morceaux ne se dessèchent pas.
- À l'aide de forceps à pointe fine, retirer le tissu du tube et placer quelques morceaux sur une lame de microscope. Ensuite, moudre le tissu entre deux lames de microscope pour briser le tissu. Rincer les diapositives avec des supports de culture sans enzymes dans un nouveau tube conique de 50 ml.
- Répétez l'étape 3.4 jusqu'à ce que tous les morceaux de tissu soient dissociés.
- Combinez les solutions des étapes 3.3-3.5 en un seul tube. Passer la suspension résultante à travers une passoire cellulaire de 100 m dans un nouveau tube conique de 50 ml.
- Centrifugeuse à 220 x g, 4 oC, pendant 5 min. Aspirate hors solution précédente et resuspendre doucement le granule cellulaire dans un média de culture frais sans enzymes.
- Comptez les cellules et vérifiez la viabilité à l'aide d'un compteur cellulaire. Diluer les cellules à 1 x 106/mL avec tampon de coloration FACS froid contenant 500 ml de DPBS et 10 à 25 ml d'albumine de sérum bovin de 2 à 5 % (BSA). Les cellules sont prêtes à être tachées et triées.
4. Purification des péricytes du mélange de cellules brutes à l'aide de FACS
- Préparer et étiqueter 5 mL de tubes FACS pour tous les contrôles et échantillons de cellules. Aliquot sur les cellules (1 ml de cellules par tube) pour un échantillon non taché, la fluorescence moins un (FMO) contrôles, et les contrôles isotype-appariement. Utilisez les cellules restantes pour le genre. Tous les contrôles et les échantillons peuvent être préparés et tachés en même temps.
note:Un total de 13 ml à 0,5 x 106cellules/mL ont été employées pour le tri représentatif d'un coeur. Cependant, le volume dépend du nombre de cellules que l'investigateur obtient de leur isolement, du nombre de cœurs qu'ils utilisent, et de la façon dont le tissu cardiaque est digéré; la taille de chaque cœur est également une variable qui peut modifier le volume.- Utilisez des perles de compensation (tableaudes matériaux)pour optimiser les contrôles de compensation de fluorescence. Préparer un contrôle de compensation pour chaque fluorochrome dans l'expérience dans un tube FACS étiqueté de 5 mL. Pour cette expérience, préparez un total de 9 contrôles de compensation — 2 sortes de perles non tachées plus 7 fluorochromes différents du panneau de marqueurcomprenant NG2-FITC, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, et la viabilité cellulaire-APC-Cy7 ( Tableau des matériaux).
- Ajouter une goutte de perles de compensation (50 l) de la fiole de compression à chaque tube. Ajouter ensuite 1 l d'anticorps aux perles. Répétez l'opération pour chaque anticorps du panneau marqueur. Mélanger vigoureusement par le tourbillon d'impulsions. Incuber pendant 30 min à 4 oC à l'abri de la lumière, sauf pour les perles de viabilité cellulaire qui peuvent être laissées à température ambiante protégées de la lumière.
- Ensuite, ajouter 3 mL de tampon de coloration FACS à chaque tube et centrifugeuse à 300 x g pendant 5 min à 4 oC. Aspirer la solution et resuspendre chaque boulette de perle dans 400 'L de tampon de coloration FACS. Les contrôles de compensation sont prêts à être utilisés. Restez sur la glace.
- Utilisez les commandes FMO pour optimiser la coloration de fond due au chevauchement spectral.
- Préparer les contrôles FMO en utilisant 1 mL de cellules qui a été aliquoted de la section 4.1 dans un tube FACS de 5 mL et en ajoutant tous les anticorps du panneau de marqueur décrit à l'étape 4.1.1 à une dilution 1:100, mais à l'exclusion d'un anticorps. Par exemple, préparez un NG2-AF488 FMO en incluant des anticorps pour CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, colorant de viabilité cellulaire mais pas l'anticorps NG2-AF488. Mélanger délicatement par le tourbillon d'impulsions. Répétez l'opération pour chaque anticorps pour un total de 7 contrôles. Incuber pendant 30 min à 4 oC à l'abri de la lumière.
- Ensuite, ajouter 3 mL de tampon de coloration FACS à chaque tube et centrifugeuse à 300 x g pendant 5 min à 4 oC. Aspirer la solution et resuspendre chaque granule de cellule dans 400 'L de tampon de coloration FACS. Les commandes FMO sont prêtes à être utilisées. Restez sur la glace.
- Utilisez des anticorps de contrôle assortis à l'isotype (Tableau des matériaux) pour la coloration non spécifique.
- Préparer les contrôles isotypes en ajoutant l'anticorps de contrôle isotype-assorti (Tableau des matériaux) à 1 ml d'échantillon cellulaire préparé à partir de la section 4.1 à une dilution de 1:100 chacun dans un tube FACS de 5 mL. Mélanger délicatement par le tourbillon d'impulsions. Incuber pendant 30 min à 4 oC à l'abri de la lumière.
- Ensuite, ajouter 3 mL de tampon de coloration FACS à chaque tube et centrifugeuse à 300 x g pendant 5 min à 4 oC. Aspirer la solution et resuspendre chaque granule de cellule dans 400 'L de tampon de coloration FACS. Les commandes isotype sont prêtes à être utilisées. Restez sur la glace.
- Préparer les cellules à trier en ajoutant cocktail anticorps à des cellules fraîchement isolées.
- Préparer l'échantillon cellulaire de la section 4.1 en ajoutant dans un cocktail d'anticorps contenant des anti-souris NG2-AF488, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7 à 1:100 dilution chacun et colorant de viabilité cellulaire à 1:1,000 dilution. Vortex doucement à mélanger. Incuber les échantillons à 4 oC pendant 30 min à l'abri de la lumière.
- Après coloration, laver les cellules avec le tampon de coloration FACS par centrifugation à 300 x g pendant 5 min 4 oC. Aspirer la solution et resuspendre la pastille cellulaire dans le tampon de coloration FACS à 0,5 x 106 cellules/mL.
- À l'aide de nouveaux tubes FACS qui ont des dessus de filtre de 35 m, des échantillons de cellules tachées de pipette sur les couvercles et des filtrates de gravité pour obtenir des suspensions à cellule unique. Restez sur la glace.
- Utilisez des perles de compensation (tableaudes matériaux)pour optimiser les contrôles de compensation de fluorescence. Préparer un contrôle de compensation pour chaque fluorochrome dans l'expérience dans un tube FACS étiqueté de 5 mL. Pour cette expérience, préparez un total de 9 contrôles de compensation — 2 sortes de perles non tachées plus 7 fluorochromes différents du panneau de marqueurcomprenant NG2-FITC, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, et la viabilité cellulaire-APC-Cy7 ( Tableau des matériaux).
- Utilisez un trieur cellulaire pour purifier les cellules.
- Exécutez les cellules non tachées sur le trieur de cellules pour régler les tensions et corriger pour le signal d'arrière-plan (par exemple, définir des tensions pour la diffusion vers l'avant à 490-560 et pour la diffusion latérale à 180-250).
- Exécutez chaque échantillon de perles de compensation d'une couleur une à la fois pour ajuster les tensions pour chaque canal et ajuster les portes pour le signal positif. Recueillir des données. Utilisez le logiciel pour calculer le chevauchement spectral en calculant la matrice de compensation. Toutes les tensions sont prêtes et prêtes.
- Exécutez chaque contrôle isotype un à la fois et ces données peuvent être utilisées pour ajuster les portes pour la liaison non spécifique s'il y en a.
- Exécutez chaque échantillon FMO un à la fois et ajustez les tensions pour chaque canal pour corriger le saignement spectral à travers en raison d'un panneau multicolore.
- Exécuter les échantillons de cellules tachées dans le trieur cellulaire et de recueillir les cellules dans 10 mL de médias de culture sans enzymes (DMEM - 20% FBS - 1% P / S) dans un tube de collecte conique de 15 ml. Utilisez la stratégie de gating suivante : porte pour les cellules simples, porte pour les cellules vivantes, porte pour les cellules négatives CD45, porte pour les cellules négatives CD34 et CD31, porte pour les cellules positives NG2, et enfin porte pour les cellules positives CD146 et CD140b.
5. Cultiver des Péricarténites
- Enrober une plaque de 24 puits avec 0,2 % de gélatine pendant 5 min et aspirer la solution de gélatine. Seed cellules fraîchement obtenues à partir de l'étape 4.2.5 dans DMEM - 20% FBS - 1% P / S jusqu'à 2 x 104 cellules/cm2. Cellules de culture dans un incubateur cellulaire fixé à 37 oC, 5 % CO2 et 95 % O2.
- Passaging des périrites
- Une fois que les cellules sont confluentes à 95 %, lavez les cellules avec du DPBS chaud de 1x, et soulevez les cellules avec 200 l de trypsine de 0,1 % dans chaque puits à température ambiante pendant 3 à 5 min.
- Appuyez doucement sur la plaque pour desserrer les cellules.
- Neutraliser la trypsine avec 3,5 fois la quantité de milieux de culture (700 L DMEM - 20% FBS - 1% P/S) et le passage des graines deux (P2) cellules sur une plaque non couchée 6-puits à 2 x 104 cellules/ cm2.
- Chaque puits, lorsqu'il est confluent, peut être déplacé dans un seul flacon T-75 sous forme de cellules P3 qui peuvent ensuite être divisées à un rapport de 1:6.
6. Caractérisation des Péritéytes
-
Analyse de cytométrie de flux
- Utilisez le même protocole de coloration et la même stratégie de classement des FACS que celui décrit précédemment à la section 4.
- Exécuter les commandes et les échantillons tachés sur le cytomètre d'écoulement. Recueillir des données et analyser les données à l'aide du logiciel d'analyse (Tableau des matériaux).
- Pour recueillir des images de brightfield, faire pousser des cellules dans un flacon dans un incubateur cellulaire réglé à 37 oC, 5 % de CO2 et 95 % D'O2. Capturez des images au microscope après que les cellules se fixent à la surface.
-
Immunocytochimie
- Cultivez les cellules dans une plaque de 96 puits jusqu'à 90% de confluents. Laver les cellules avec 1x DPBS chaud et fixer avec 4% de paraformaldéhyde pendant 30 min à température ambiante.
- Laver les cellules 3x avec 1x DPBS et perméabilize avec 0,1% de détergent pendant 10 min à température ambiante.
- Incuber les cellules avec tampon de blocage pendant 1 h à température ambiante. Après le blocage, ajouter les anticorps primaires (un anticorps par puits) dilué 1:100 dans le tampon de blocage et incuber à 4 oC pendant la nuit. Les anticorps primaires sont : anti-NG2, anti-CD140b, anti-CD31, anti-vimentin, anti-desmin, et actine lisse anti-alpha de muscle.
- Le lendemain, laver les cellules 3x avec tampon de lavage (Table des matériaux). Ajouter l'anticorps secondaire dilué 1:1,000 dans le tampon de blocage et couver pendant 2 h à température ambiante dans l'obscurité. L'anticorps secondaire est un anti-lapin conjugué au FITC.
- Laver les cellules 3x avec tampon de lavage. Ajouter une tache nucléaire de 300 MD diluée à 1:1 000 pendant 5 min à température ambiante.
- Laver les cellules 3x avec 1x DPBS et monter avec des supports de montage.
- Cellules d'image avec un microscope confocal.
Résultats
Après la digestion enzymatique et la dissociation du cœur entier et avant la purification FACS des cellules, les cellules sont un mélange brut qui contient de nombreux types de cellules différentes du cœur (Figure 1A). Après la purification et la culture du FACS, les cellules sont homogènes. Ils sont nucléés simples, assez plats, et ont la morphologie rhomboide péririque typique (Figure 1B).
À l'aide de FACS, les cellules sont purifiées à l'homogénéisme. L'échantillon de cellules témoins non tachées est utilisé pour montrer la stratégie de gating (Figure 2). Tout d'abord, les débris et les doublets ont été fermés en fonction des distributions de dispersion vers l'avant et latérales. Ensuite, les cellules mortes ont été fermées en raison de leur réaction amine avec le colorant qui produit un signal plus grand et plus intense que les cellules vivantes. Parmi les cellules vivantes, les cellules hématopoïétiques ont été fermées en étant CD45. Pour enlever davantage les cellules hématopoïétiques et endothéliales, lescellules CD34et CD31 ont été fermées. Enfin, lescellules NG2et CD140bet CD146 ont été sélectionnées pour être des cellules périvasculaires avec l'expression de marqueurs péritéytes typiques ( Figure3). Le panneau de marqueur a également été testé sur les cellules endothéliales coronaires de souris comme commande (figure supplémentaire 1). Seulement environ 1% du mélange de cellules brutes se composait de péricytes après le tri.
Pour valider que les cellules étaient en effet des péricartétes, nous avons adopté les cellules pour une caractérisation ultérieure. Les cellules se sont développées rapidement une fois qu'elles ont atteint le P3 dans les flacons T-75 sans changements dans la viabilité à mesure qu'elles vieillissaient (Figure supplémentaire 2). Par rapport aux péritéytes du cerveau humain, les cellules avaient une morphologie similaire (Figure 4A). Par rapport aux cellules musculaires lisses de souris et humaines, les cellules avaient une morphologie différente (Figure 4A). Il n'y a pas non plus eu de changements observés dans la morphologie ou l'expression des marqueurs à P7 lorsque l'analyse immunostained ou par cytométrie de flux après passage (Figure 4B,C).
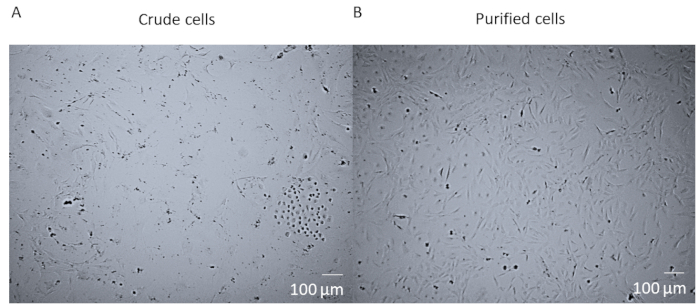
Figure 1 : Cellules brutes contre cellules purifiées. (A) L'image brightfield du mélange brut de cellules post digestion enzymatique de coeur entier et dissociation qui a été cultivée dans un flacon de T25 pendant 14 jours. (B) L'image de brightfield d'une population homogène de péricartétes cardiaques post-tri et la culture après 14 jours. Barre d'échelle de 100 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
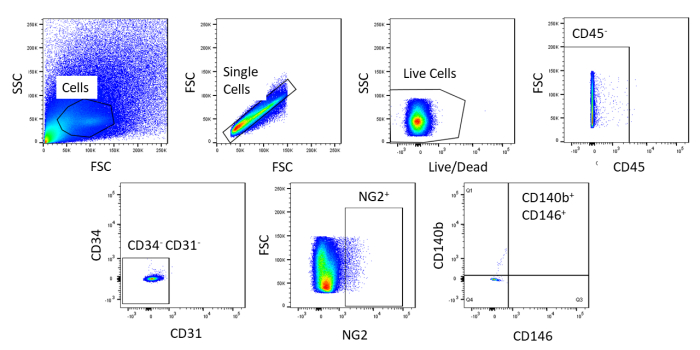
Figure 2 : Images représentatives de l'analyse FACS des cellules non tachées. Représentation schématique de la stratégie de gating utilisée pour purifier le mélange de cellules brutes. Porte pour les cellules qui sont célibataires, en direct, CD45-, CD31-, CD34-, NG2,CD146, et CD140b. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
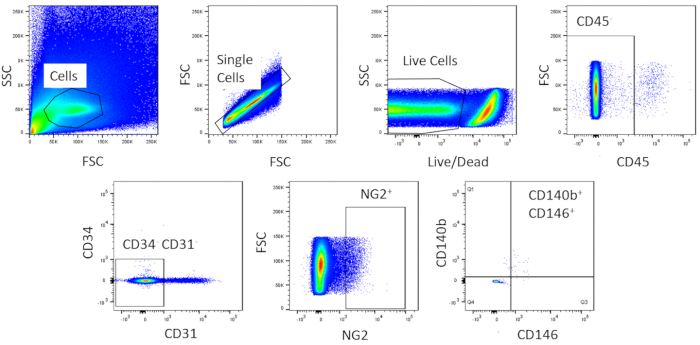
Figure 3 : Images représentatives de l'analyse FACS des cellules brutes. Représentation schématique du tri utilisé pour obtenir une population homogène de péricartétes cardiaques. Environ 1% des cellules brutes sont CD31-CD34-CD45-CD140b-NG2-CD146. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
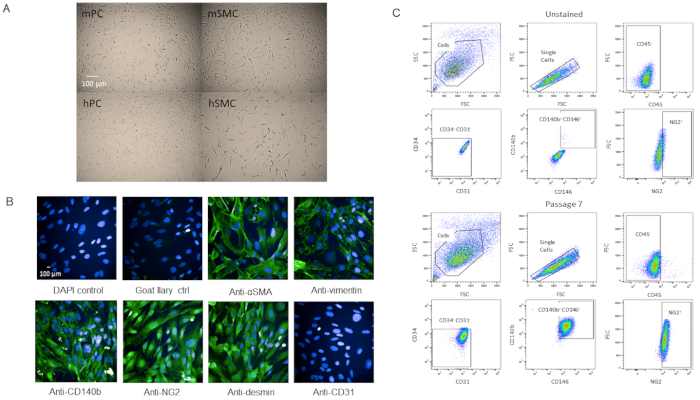
Figure 4 : Caractérisation des péritéytes cardiaques isolés primaires (A) Les images Brightfield de cellules cultivées du cerveau humain (hPC) et des coeurs de souris (mPC) montrent la morphologie semblable de cellules de périyte mais la morphologie différente des cellules lisses humaines de muscle hSMC) et des cellules lisses de muscle de souris (mSMC). Barre d'échelle de 100 m. (B) Caractérisation phénotypique des cellules à P7 par immunocytochimie pour les marqueurs de péricyyte. Barre d'échelle de 100 m. (C) Analyse par cytométrie de flux des péricytes à P7 où ils ont été fermés pour les marqueurs négatifs CD31, CD34, CD45 et marqueurs positifs NG2, CD140b et CD146. La population reste homogène. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Figure supplémentaire 1 : Images représentatives de l'analyse cytométrie du débit des cellules endothéliales à l'aide d'un panneau marqueur. Une ligne de cellules endothéliales coronaires de souris a été employée comme commande pour la spécificité de liaison pour les marqueurs. Utilisant la même stratégie de gating qui a été employée dans le genre excepté une porte positive pour CD31 au lieu d'une porte négative, les cellules endothéliales étaient négatives pour CD45, CD34, NG2, CD140b, et CD146 mais positives pour CD31 comme prévu. S'il vous plaît cliquez ici pour télécharger ce chiffre.
Figure supplémentaire 2 : Images représentatives de l'analyse de cytométrie du débit de différents passages de mPC. Les péritéytes cardiaques isolés primaires ont été cultivés et passageés jusqu'au passage 12. Des cellules ont été souillées avec l'iodure de propidium et analysées sur un cytomètre de flux. La population de contrôle est un mélange de cellules mortes et de cellules vivantes. Il n'y avait aucune différence significative dans le nombre de cellules viables entre les passages. S'il vous plaît cliquez ici pour télécharger ce chiffre.
Discussion
Comme les études sur les péritéytes cardiaques sont relativement nouvelles, le rôle des péritéytes dans la physiologie cardiovasculaire et la physiopathologie n'a pas encore été défini. Dans d'autres organes, il a été démontré qu'ils jouent un rôle clé dans l'homéostasie des vaisseaux et la perfusion1,2. Comparé à la littérature des péritéytes d'autres organes tels que le cerveau, il y a sensiblement moins de publications sur des périytes cardiaques. L'isolement des péritéytes cardiaques est essentiel à la compréhension de leurs caractéristiques fonctionnelles et des mécanismes de signalisation. Par conséquent, ce protocole fournira aux chercheurs un moyen plus facile d'accéder aux péritéytes cardiaques à partir d'une source de tissus plus facilement disponible et de promouvoir des études sur leur biologie. Il aidera à répondre aux questions sur la façon dont les péritéytes cardiaques contribuent à l'homéostasie cardiaque et la pathophysiologie ainsi que d'étudier leur potentiel thérapeutique.
La population de péritéytes isolée du cœur murine et caractérisée par CD31-CD34-CD45-CD140b-NG2-CD146- a été passée plusieurs fois (jusqu'à P12 et allait toujours fort), qui ne fonctionne pas la viabilité et se propage rapidement (figure supplémentaire 2). Les cellules ont également été cryocongelées et récupérées avec au moins 95% de viabilité. Cependant, nous préférons utiliser des cellules P7 ou plus jeunes pour nos expériences. En comparant les images de nos péricytes avec les péricytes du cerveau humain, les deux lignées cellulaires ont une morphologie cellulaire comparable (Figure 4A) alors qu'elles diffèrent en morphologie des cellules musculaires lisses (Figure 4A). Nos cellules P7 ont été caractérisées par l'immunocytochimie pour les marqueurs de péricyyte, certains de notre panneau FACS (NG2 et CD140b), et quelques-uns pas dans le panneau (vimentin, desmin, SMA) et nous avons constaté que les cellules ont exprimé des marqueurs de périyte homogène (Figure 4B). En outre, nos cellules P7 ont été analysées par cytométrie de flux à nouveau avec le même panneau de marqueur pour évaluer les changements dans l'expression des marqueurs en raison de la passaging et nous avons constaté qu'il n'y avait aucun changement (Figure 4C). Par conséquent, à la fois phénotypique et morphologique, nos cellules sont périrites.
Les études de Nees et coll.10, Avolio et coll.11, Chen et coll.12, et Baily et coll.13 ont montré des isolements péritéytes cardiaques réussis. Cependant, l'utilisation d'un équipement construit sur mesure à l'interne pour détacher les péritéytes des micronavires par Nees et coll.10 impliquait deux chambres avec des pompes qui perfusaient la solution de protéase d'avant en arrière à travers une pile de filets à mailles, ce qui était difficile à reproduire lorsqu'ils n'a pas fourni de schéma et/ou d'image de l'appareil et de la façon dont il a été construit. Bien que Nees et coll.10 aient réussi à isoler les péritéytes cardiaques de nombreuses espèces, nous n'avons jamais été en mesure de reproduire leur méthode. Notre étape de détachement de périyte dans notre protocole utilise simplement un shaker orbital (pour dissocier toutes les cellules) qui est disponible dans la plupart, sinon tous les laboratoires, avec le tissu et la solution d'enzyme dans un tube conique suivi d'une étape de dissociation mécanique. Il n'y a pas d'appareil personnalisé requis. Deuxièmement, les protocoles restants impliquent l'utilisation de tissus humains et donc l'achat de tissus humains se limite aux chercheurs. Notre protocole est une modification et l'optimisation des protocoles actuels9,12 en utilisant des modèles de souris (type sauvage, génétiquement modifié, malade) et des matériaux qui sont facilement disponibles pour tous les chercheurs.
Puisque les cellules périvasculaires en général sont sensibles, la viabilité des cellules est critique pour obtenir un bon rendement. Pendant l'acquisition du tissu cardiaque et la coloration des cellules, les tissus/cellules doivent être maintenus froids de glace. Deuxièmement, la digestion enzymatique du tissu peut nécessiter une optimisation individuelle. Selon les unités d'activité sur ses flacons d'enzymes, la concentration et le temps de digestion peuvent devoir être optimisés. Assurez-vous que la solution enzymatique est préparée fraîche à chaque fois que le rendement diminuera. Troisièmement, le mélange brut contient beaucoup de cellules, certaines mortes et / ou mourantes, il est préférable de réduire la concentration de FBS dans le tampon de coloration de 5% à 2%. Si vous rencontrez des problèmes avec les cellules obstruant la buse pendant la tri, enrichissez les cellules d'abord en utilisant un kit de retrait des cellules mortes. Vous pouvez également ajouter edTA/HEPES tampon ou traitement DNase à la cellule pré-tri pour empêcher l'agglutination cellulaire. Enfin, parce que notre panel d'anticorps est assez grand et utilise de nombreux fluorophores, assurez-vous que vos contrôles FMO et les contrôles de compensation sont effectués correctement.
Une limitation à cette méthode est la quantité de périytes cardiaques qui peuvent être obtenus par cœur. Dans notre cas, seulement 1,1% de notre mélange brut d'un coeur de souris étaient des péricartéytes qui est comparable au pour cent dans les isolements de coeur humain, mais le nombre de cellules est sensiblement moins due à la quantité de tissu cardiaque qu'une souris fournit. Parce que le nombre de cellules de départ est si faible après FACS, il serait préférable d'isoler de plusieurs cœurs à la fois. Cependant, le problème avec cela est le nombre de cellules que vous devez trier en une seule journée. Si vous avez plus de 30 millions de cellules, il sera difficile de passer à travers le tri sans affecter la viabilité des cellules. Si l'enquêteur avait plusieurs trieurs cellulaires, isoler de plusieurs cœurs dans une journée serait faisable. Une autre limitation est que parce que nous ne savons pas s'il ya des sous-populations de péritytes dans le cœur comme il ya le muscle squelettique15,16, nous ne savons pas si nous éliminons un sous-type dans notre stratégie de gating. Nous sommes en train de caractériser nos péritéytes cardiaques et jusqu'à présent dans nos données non publiées, ils sont fonctionnellement comme d'autres péricartes dans la littérature.
Notre protocole permettra aux chercheurs de répondre à des questions sur les propriétés, les caractéristiques, les fonctionnalités et d'autres aspects du péricartisme cardiaque qui aideront à définir leur contribution à l'homéostasie cardiaque et à l'hémodynamique. Ces cellules pourraient avoir un potentiel thérapeutique pour les maladies cardiovasculaires une fois que leur biologie est mieux comprise.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tiens à remercier le noyau de cytométrie amgen Flow pour leur aide avec la conception de panneaux de fluorophore, le dépannage et le tri cellulaire.
matériels
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-053-Cl | dilute with 1x DPBS to get 0.1% |
| 100 μM Cell strainer | FisherSci | 22363549 | |
| 15 mL Falcon conical tubes | BD | 352096 | |
| 24-well plate | Corning | CLS3527 | |
| 25 G butterfly needle | FisherSci | 22-253-146 | |
| 31 G needle syringe | FisherSci | B328446 | |
| 50 mL Falcon conical tubes | BD | 352098 | |
| 6-well plate | Corning | CLS3516 | |
| anti-alpha smooth muscle actin rabbit mAb | abcam | ab32575 | Antibody used in ICC 1:100 dilution |
| anti-CD140b rabbit mAb | Cell Signaling | 28E1 | Antibody used in ICC 1:100 dilution |
| anti-CD31 rabbit pAb | abcam | ab28364 | Antibody used in ICC 1:100 dilution |
| anti-desmin rabbit pAb | abcam | ab8592 | Antibody used in ICC 1:100 dilution |
| anti-NG2 conjugated to AF488 | Millipore | MAB5384A4 | Antibody used in ICC 1:100 dilution |
| anti-vimentin rabbit mAb | abcam | ab92547 | Antibody used in ICC 1:100 dilution |
| ArC Amine Reactive Compensation bead kit | Invitrogen | A10346 | compensation beads for Live/Dead Near IR dye |
| Brightfield Microscope | camera attached | ||
| CD140b-PE (clone APB5) | eBioscience | 12-1402-81 | Antibody used in FACS 1:100 dilution |
| CD146-BV605 (clone ME-9F1) | BD | 740434 | Antibody used in FACS 1:100 dilution |
| CD31-APC (clone MEC 13.3) | BD | 551262 | Antibody used in FACS 1:100 dilution |
| CD34-BV421 (clone RAM 34) | BD | 56268 | Antibody used in FACS 1:100 dilution |
| CD45-PE-Cy7 (clone 30-F11) | BD | 552848 | Antibody used in FACS 1:100 dilution |
| Centrifuge | eppendorf | ||
| Collagenase B | Roche | 11088815001 | 0.226 U/mg lyo. |
| Confocal Microscope | |||
| DAPI | ThermoFisher | D1306 | nuclear stain |
| DMEM with 4.5 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-013-CV | 500 mL |
| Dowell scissors | FST | 15040-11 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Corning | 21-030-CV | 500 mL |
| Dulbecco's Phosphate-Buffered Saline without Ca and Mg (CMF-DPBS) | Corning | 21-031-CV | 500 mL |
| Dumont #5 Fine Forceps | FST | 11254-20 | |
| FACSAria cell sorter | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| FACSAria software | BD | ||
| Falcon tube round-bottom polypropylene, 5 mL | BD | 38057 | |
| Falcon tube with cell strainer cap, 5 mL | BD | 08-771-23 | |
| Fetal Bovine Serum | Corning | 35-015-CV | 500 mL |
| Fine scissors | FST | 14060-09 | |
| FlowJo software | FlowJo LLC | ||
| Fortessa LSR flow cytometer | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| Gelatin-based coating | Cell Biologics | 6950 | |
| Goat anti-rabbit IgG (H+L) Cross-Absorbed Secondary antibody, Alexa Fluor 488 | Invitrogen | A-11008 | Antibody used in ICC 1:1000 dilution |
| Graefe Forceps | FST | 11049-10 | |
| Heparin sodium solution | Hospira | NDC 0409-2720-02 | 10,000 USP units/10 mL; from porcine intestines |
| Incubator | set at 37 °C, 5% CO2, 95% O2 | ||
| Live/Dead-Near IR | Life Technologies | L10119 | |
| Microscope slides | FisherSci | 12-550-343 | |
| NG2-FITC | Millipore | AB5320A4 | Antibody used in FACS 1:100 dilution |
| Oribital shaker | VWR | Inside 37 °C incubator or room | |
| Paraformaldehyde | FisherSci | 50-980-487 | dilute with 1x DPBS to get 4% |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Petri dish | FisherSci | FB0875714 | |
| Pipette and tips | |||
| ProLong Diamond | ThermoFisher | P36965 | mounting media |
| Propidum Iodide | ThermoFisher | cell viability dye for supplemental figure 2 | |
| Rabbit IgG FITC | eBiosciences | 11-4614-80 | Isotype control antibody - FITC |
| Rat IgG2a APC | Biolegend | 400512 | Isotype control antibody - APC |
| Rat IgG2a BV421 | Biolegend | 400536 | Isotype control antibody - BV421 |
| Rat IgG2a BV605 | BD | 563144 | Isotype control antibody - BV605 |
| Rat IgG2a PE | Biolegend | 400308 | Isotype control antibody - PE |
| Rat IgG2b PE-Cy7 | Biolegend | 400617 | Isotype control antibody - PE-Cy7 |
| SuperBlock | ThermoFisher | 37515 | blocking buffer |
| T75 | ThermoFisher | 156499 | |
| Triton X-100 | Sigma | X100 | detergent, dilute with x DPBS to get 0.1% |
| UltraComp beads | Invitrogen | 01-2222-42 | compensation beads |
| Variable-Flow Peristaltic Pump | FisherSci | 13-876-1 | |
| ViCell Cell counter | Beckman | ||
| Wash buffer | 1:10 dilution of Superblock in 1x DPBS |
Références
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Sengillo, J. D., et al. Deficiency in mural vascular cells coincides with blood-brain barrier disruption in Alzheimer's disease. Brain Pathology. 23 (3), 303-310 (2013).
- Avolio, E., Madeddu, P. Discovering cardiac pericyte biology: From physiopathological mechanisms to potential therapeutic applications in ischemic heart disease. Vascular Pharmacology. 86, 53-63 (2016).
- Dore-Duffy, P. Isolation and characterization of cerebral microvascular pericytes. Methods in Molecular Medicine. 89, 375-382 (2003).
- Bryan, B. A., D'Amore, P. A. Pericyte isolation and use in endothelial/pericyte coculture models. Methods in Enzymology. 443, 315-331 (2008).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant outgrowth, propagation and characterization of human pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Crisan, M., Corselli, M., Chen, W. C., Peault, B. Perivascular cells for regenerative medicine. Journal of Cellular Molecular Medicine. 16 (12), 2851-2860 (2012).
- Crisan, M., et al. Purification and long-term culture of multipotent progenitor cells affiliated with the walls of human blood vessels: myoendothelial cells and pericytes. Methods in Cellular Biology. 86, 295-309 (2008).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology Heart Circulatory Physiology. 302 (1), H69-H84 (2012).
- Avolio, E., et al. Expansion and characterization of neonatal cardiac pericytes provides a novel cellular option for tissue engineering in congenital heart disease. Journal of the American Heart Association. 4 (6), e002043 (2015).
- Chen, W. C., et al. Human myocardial pericytes: multipotent mesodermal precursors exhibiting cardiac specificity. Stem Cells. 33 (2), 557-573 (2015).
- Baily, J. E., et al. Isolation of Perivascular Multipotent Precursor Cell Populations from Human Cardiac Tissue. Journal of Visualized Experiments. (116), e54252 (2016).
- Murray, I. R., et al. Skeletal and cardiac muscle pericytes: Functions and therapeutic potential. Pharmacology & Therapeutics. 171, 65-74 (2017).
- Birbrair, A., et al. Role of pericytes in skeletal muscle regeneration and fat accumulation. Stem Cells Development. 22 (16), 2298-2314 (2013).
- Birbrair, A., et al. Skeletal muscle pericyte subtypes differ in their differentiation potential. Stem Cell Research. 10 (1), 67-84 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon