Method Article
뮤린 심장 pericytes의 격리 및 정화
요약
우리는 그들의 생물학 과 치료 잠재력의 기본적인 연구 그리고 조사를 위한 뮤린 심장 pericytes를 격리하고 정화하는 프로토콜을 설치했습니다.
초록
회구, 미세 혈관 및 모세 혈관의 혈관 세포는 혈관 신생, 혈관 안정화 및 내피 장벽 무결성에 중요한 역할을하는 것으로 알려져 있습니다. 그러나, 심장에 있는 그들의 조직 특정 기능은 잘 이해되지 않습니다. 더욱이, 현재 심장 기원의 pericytes를 격리하고 정화하기 위하여 쉽게 접근가능한 물자를 이용하는 프로토콜이 없습니다. 우리의 프로토콜은 널리 사용되는 포유류 모델, 마우스를 세포의 근원으로 사용하는 데 중점을 둡니다. 심장 조직의 효소 소화 및 기계적 해리를 사용하여, 우리는 형광 활성화 세포 선별 (FACS)에 의해 더 정제 된 조 세포 혼합물을 과다한 마커에 의해 얻었다. pericytes에 대한 하나의 명백한 마커가 없기 때문에, 우리는 CD31이었다 세포에 대한 게이트-CD34-CD45-CD140b+NG2+CD146+. 정제 후, 이들 1차 세포는 형태학 및 마커 발현의 변화 없이 여러 번 배양및 계관되었다. 우리의 프로토콜을 사용하여 정기적으로 기본 뮤린 심장 pericytes을 얻을 수있는 능력으로, 우리는 더 심장 혈관 생리학과 치료 잠재력에 pericytes의 역할을 이해하기를 바랍니다.
서문
회세포로 알려진 혈관 세포는 혈관 나무의 미세 혈관 및 모세혈관을둘러싸고 1,2. 생리학적으로, 이들은 혈관신생을 촉진하고 역할을 하는 것으로 알려져 있으며, 내피 세포와의 긴밀한 관계로 인해 장벽 무결성을증가시킬 뿐만 아니라 혈관을 안정화및 성숙시키고 성숙시키는 것으로 알려져 있다 1,2. 더욱이, 이들 세포의 기능 장애 및/또는 손실은 알츠하이머병2,3 및 다양한 심혈관 질환 과 같은 질병에 연루되어 있다4. 이 세포는 몸 전체에 걸쳐 발견된다, 하지만 세포 번호는 조직 의존적이다. Pericytes는 혈액-뇌 장벽의 높은 혈관 화로 인해 뇌에서 가장주목할 만한 연구 되었습니다 1,2. 그러나, 심장에서, pericytes의 생물학은 understudyed.
최근, 심장 pericytes에 대 한 분야에서 증가 관심사가 있다, 하지만 현재 생물학에서 가장 많이 사용 되는 도구 중 하나에서 그들의 격리에 사용할 수 있는 간소화 된 프로토콜-마우스. 뇌에서 pericytes를 격리에 문헌에 프로토콜이있다 5, 망막6,태반7,골격 근육8,9; 그러나, 몇몇 프로토콜은 심혼에서 pericytes를 고립에 있습니다. 심장 pericytes를 격리한 몇몇 단이 있습니다. Nees 외. 마우스를 포함 하 여 여러 종에서 심장 pericytes의 풍부한 금액을 분리 할 수 있었다; 그러나, 그들의 방법은 재현성10을감소 시키는 특정 사내 내장 장비를 사용. Avolio 외11,Chen et al.12, 및 Baily et al.13 또한 성공적으로 인간의 심장 조직에서 심장 pericytes를 분리, 하지만 인간의 조직은 항상 사용할 수 있고 일부 조사자에 대 한 얻을 어렵다. 여기에서, 우리는 더 쉽게 유효한 물자를 가진 그들의 생물학을 공부하기 위하여 조사자를 위한 마우스 모형에서 심장 pericytes를 얻기 위하여 격리 방법을 개발했습니다.
효소 소화 및 형광 활성화 세포 선별 (FACS)을 사용하여 알려진 키 pericyte 마커(14)를사용하여, 우리의 프로토콜은 우리가 CD31-CD34-CD45를 특징으로하는 pericytes의 인구를 분리하고 정화 할 수 있습니다- CD140b+NG2+CD146+. 마커 패널에는 포함 마커와 제외 마커가 모두 포함되어 있습니다. CD45는 조혈 세포를 배제하는 마커로서 사용된다. CD31은 내피 세포를 배제하는 마커로서 사용된다. CD34는 조혈 및 내피 전구 세포를 모두 배제하는 마커로서 사용된다. CD146은 혈관세포에 대한 마커이다. 마지막으로, NG2 및 CD140b(또한 혈소판 유래 성장 인자 수용체 베타-PDGFRβ라고도 함)는 모두 pericytes14에대한 허용된 마커이다. 얻어진 1차 배양은 형태또는 마커 발현의 변화 없이 여러 번 배양되고 계관될 수 있다. 게다가, 이 세포는 그들의 상호 작용 및 서로 와 크로스토크를 공부하기 위하여 내피 세포와 공동 배양될 수 있습니다. 이 세포 격리 방법은 조사자가 야생 모형, 질병 및 유전으로 이체 마우스 모형에서 심장 pericytes의 생물학 그리고 병리생리학을 공부하는 것을 허용할 것입니다.
프로토콜
모든 동물은 실험실 동물 관리 국제 (AAALAC) 공인 시설의 평가 및 인증 협회에서 보관및 사용되었으며 모든 동물 작업은 적절한 수의 감독하에 기관 동물에 따라 수행되었습니다. 암젠의 진료 및 사용 위원회(IACUC) 승인 프로토콜
1. 도구 및 문화 미디어 준비
- 오토 클레이브 수술 9cm 직선 팁 미세 점 가위와 10cm 각진 톱니 모양 집게.
- 5% 태아 소 혈청(FBS)의 25 mL과 1% 페니실린 스트렙토마이신(P/S)의 5 mL를 칼슘 마그네슘 프리 덜베코의 인산 완충 식염수(CMF-DPBS)의 500 mL 병에 넣으세요. 사용 시 차가워지도록 얼음 욕조에 용액을 놓습니다. Aliquot 50 mL을 심장 분리를 위한 50 mL 원유 관으로 넣습니다. 헤파린 나트륨 용액의 250 단위/mL를 50 mL aliquot에 추가합니다. 이를 헤파린화된 CMF-DPBS라고 합니다.
- 20% FBS (100 mL) 및 1% P/S (5 mL)를 500 mL 병에 고당포도 덜베코의 수정 된 독수리 배지 (DMEM)를 추가하십시오. 이를 효소 없는 배양 배지로 지칭할 것이다. Aliquot 20 mL의 DMEM + 20% FBS + 1% P/S를 넣고 콜라게나제 B 500 μg/mL에 첨가합니다. 이를 효소 용액으로 지칭한다. 인큐베이터 또는 수조에서 효소가 없는 배양 배지와 효소 용액을 37°C에서 따뜻하게 유지합니다.
2. 동물 준비 및 심장 조직의 조달
- 복강 내 31G 바늘 주사기로 250 단위의 헤파린 나트륨 용액을 마우스에 주입합니다. 그런 다음 마우스가 홈 케이지에서 활성 상태로 유지되는 동안 10-15 분 기다립니다.
참고: 본 연구에서 대표적인 데이터는 4개월 된 남성 C57BL/6 마우스로부터 얻어졌다. 그러나 이 프로토콜은 균주, 연령, 성별, 체중 등에 관계없이 모든 마우스에서 사용할 수 있습니다. - 5 % 이소플루란으로 마우스를 마취시다. 핀치 반사로 마우스의 마취 깊이를 확인합니다.
- 마취된 마우스를 척추 위치에 놓고 앞다리를 테이프로 내려놓습니다. 조심스럽게 가슴 구멍을 열고 25G 나비 바늘을 사용하여 내림차순 대장을 통조림.
- 오른쪽 심방에 닉을 만들고 가변 흐름 연동 펌프로 2mL/min에서 250 단위/mL 의 최소 20mL로 심장을 정중시합니다. PBS가 오른쪽 심방에서 깨끗해지면 관류가 완료됩니다.
- 대장에서 심장을 잘라 얼음 차가운 CMF-DPBS에 넣습니다.
3. 심장 조직의 해리
- 15cm x 15cm 페트리 접시에 마음을 옮김을 옮김. 스프링 가위와 미세 한 점 집게를 사용하여 작은 조각 (1mm / 조각)으로 심장을 잘라 조각을 커버하기에 충분한 효소 용액 (10-15 mL).
- 조각과 용액을 50 mL 원유관으로 옮기고, 파라핀 플라스틱 필름으로 밀봉하고, 120 rpm에서 120 rpm에서 37°C에서 75분 동안 배양합니다.
- 효소 용액으로 콜라게나아제 소화 후, 100 μm 세포 스트레이너를 통해 액체를 새로운 50 mL 튜브로 분해하지만 조각이 마르지 않도록 충분한 용액을 둡니다.
- 미세 점 집게를 사용하여 튜브에서 조직을 꺼내 현미경 슬라이드에 몇 조각을 놓습니다. 그런 다음 두 개의 현미경 슬라이드 사이의 조직을 갈아서 조직을 분해합니다. 효소 프리 배양 배지로 슬라이드를 새로운 50 mL 원엽 튜브로 헹구십시오.
- 모든 조직 조각이 해리 될 때까지 3.4 단계를 반복하십시오.
- 3.3-3.5단계의 솔루션을 하나의 튜브로 결합합니다. 생성된 현탁액을 100 μm 셀 스트레이너를 통해 새로운 50 mL 원엽 튜브로 변형시.
- 220 x g, 4 °C에서 원심 분리기를 5 분 동안. 이전 용액을 흡인하고 신선한 효소가없는 배양 배지에서 세포 펠릿을 부드럽게 재중단시다.
- 셀을 계산하고 셀 카운터를 사용하여 생존 가능성을 확인합니다. DPBS 500 mL과 2-5% 소 혈청 알부민 (BSA)의 10-25 mL를 포함하는 차가운 FACS 염색 버퍼로 세포를 1 x 106/mL로 희석하십시오. 세포는 염색 및 정렬 될 준비가되어 있습니다.
4. FACS를 사용하여 원유 세포 혼합물에서 pericytes의 정화
- 모든 대조군 및 세포 샘플에 대해 5mL FACS 튜브를 준비하고 라벨을 붙입니다. 비염색 시료에 대한 세포(튜브당 1 mL)를 알리쿼트하고, 형광을 뺀 1(FMO) 대조군, 및 이소타입-일치대조군을 위한 것이다. 정렬에 나머지 셀을 사용합니다. 모든 컨트롤과 샘플을 동시에 준비하고 염색할 수 있습니다.
참고:0.5 x 10에서 총 13 mL6세포 /mL은 한 쪽 심장에서 대표적인 정렬에 사용되었습니다. 그러나, 부피는 조사자가 그들의 고립에서 얻는 얼마나 많은 세포, 얼마나 많은 심혼을 사용하는지, 그리고 얼마나 잘 심혼 조직이 소화되는지에 달려 있습니다; 각 심장의 크기는 볼륨을 변경할 수있는 변수이기도합니다.- 보정 비드(재료표)를사용하여 형광 보정 제어를 최적화합니다. 표지된 5 mL FACS 튜브에서 실험에서 각 불소에 대해 하나의 보상 대조군을 준비한다. 이 실험을 위해 NG2-FITC, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, 및 세포 생존-APC를 포함한 마커 패널의 2가지 무스테인 비드 및 7가지 형플루오로크롬을 총 9가지 보정 컨트롤로 준비합니다. 재료표)를 참조하십시오.
- 각 튜브에 스퀴즈 바이알에서 보상 비드 한 방울(~ 50 μL)을 추가합니다. 그런 다음 구슬에 항체 1 μL을 추가합니다. 마커 패널에서 각 항체에 대해 반복합니다. 펄스 소용돌이에 의해 활발하게 섞으세요. 4°C에서 30분 동안 배양하여 빛으로부터 보호된 실온에서 방치될 수 있는 세포 생존비드를 제외하고는 빛으로부터 보호한다.
- 다음으로, 각 튜브에 FACS 염색 완충제 3 mL을 추가하고 4 °C에서 5 분 동안 300 x g에서 원심 분리기를 넣습니다. 용액을 흡인하고 FACS 염색 완충액의 400 μL에서 각 비드 펠릿을 다시 중단합니다. 보정 컨트롤을 사용할 준비가 되었습니다. 얼음에 보관하십시오.
- FMO 컨트롤을 사용하여 스펙트럼 중복으로 인한 배경 염색을 최적화합니다.
- FMO 대조군을 5 mL FACS 튜브에서 섹션 4.1로부터 aliquoted된 세포의 1 mL을 사용하고 1:100 희석에서 4.1.1 단계에서 기재된 마커 패널로부터 모든 항체를 첨가하였으나 하나의 항체를 제외한다. 예를 들어, NG31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, 세포 생존성 염료를 포함하지만 NG2-AF488 항체를 포함하지 않음으로써 NG2-AF488 FMO를 준비한다. 펄스 와류로 부드럽게 섞으세요. 총 7개의 대조군을 위해 각 항체에 대해 반복한다. 4 °C에서 30 분 동안 배양하여 빛으로부터 보호합니다.
- 다음으로, 각 튜브에 FACS 염색 완충제 3 mL을 추가하고 4 °C에서 5 분 동안 300 x g에서 원심 분리기를 넣습니다. 용액을 흡인하고 FACS 염색 완충액의 400 μL에서 각 세포 펠릿을 재중단시켰다. FMO 컨트롤을 사용할 준비가 되었습니다. 얼음에 보관하십시오.
- 비특이적 염색을 위해 이소타입 일치 대조군 항체(재료 표)를 사용하십시오.
- 1mL FACS 튜브에서 각각 1:100 희석에서 섹션 4.1에서 제조된 세포 샘플의 1 mL에 등유형 일치 대조군 항체(TableofMaterials)를 추가하여 이소타입 대조군을 준비한다. 펄스 와류로 부드럽게 섞으세요. 4 °C에서 30 분 동안 배양하여 빛으로부터 보호합니다.
- 다음으로, 각 튜브에 FACS 염색 완충제 3 mL을 추가하고 4 °C에서 5 분 동안 300 x g에서 원심 분리기를 넣습니다. 용액을 흡인하고 FACS 염색 완충액의 400 μL에서 각 세포 펠릿을 재중단시켰다. 아이소타이프 컨트롤을 사용할 준비가 되었습니다. 얼음에 보관하십시오.
- 갓 분리된 세포에 항체 칵테일을 추가하여 분류될 세포를 준비합니다.
- 항 마우스 NG2-AF488, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7을 1:100 희석 및 세포 생존성 염료를 1:100에서 각각 1:100에서 포함하는 항체 칵테일에 추가하여 섹션 4.1에서 세포 샘플을 준비합니다. 부드럽게 소용돌이를 섞어 주세요. 4°C에서 30분 동안 배양시 광으로부터 보호합니다.
- 염색 후, FACS 염색 완충액으로 세포를 300 x g에서 5 분 4 °C로 씻어. 용액을 흡인하고 FACS 염색 버퍼에서 세포 펠릿을 0.5 x 106 세포/mL로 다시 중단합니다.
- 35 μm 필터 상판이 있는 새로운 FACS 튜브를 사용하여, 피펫 스테인드 셀 샘플을 뚜껑에, 중력 여과액에 사용하여 단일 셀 현탁액을 얻습니다. 얼음에 보관하십시오.
- 보정 비드(재료표)를사용하여 형광 보정 제어를 최적화합니다. 표지된 5 mL FACS 튜브에서 실험에서 각 불소에 대해 하나의 보상 대조군을 준비한다. 이 실험을 위해 NG2-FITC, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, 및 세포 생존-APC를 포함한 마커 패널의 2가지 무스테인 비드 및 7가지 형플루오로크롬을 총 9가지 보정 컨트롤로 준비합니다. 재료표)를 참조하십시오.
- 셀 선별기를 사용하여 세포를 정화합니다.
- 셀 선별기에서 스테인드되지 않은 셀을 실행하여 전압을 설정하고 배경 신호에 대해 올바르게 설정합니다(예: 정방향 산란전압을 490−560으로 설정하고 측면 산란을 180−250으로 설정).
- 각 단일 색상 보정 비드 샘플을 한 번에 하나씩 실행하여 각 채널의 전압을 조정하고 포지티브 신호에 대한 게이트를 조정합니다. 데이터를 수집합니다. 보정 행렬을 계산하여 스펙트럼 중복을 계산하려면 소프트웨어를 사용합니다. 모든 전압이 준비되어 있습니다.
- 각 isotype 컨트롤을 한 번에 하나씩 실행하면 이 데이터를 사용하여 비특이적 바인딩에 대한 게이트를 조정할 수 있습니다.
- 각 FMO 샘플을 한 번에 하나씩 실행하고 각 채널의 전압을 조정하여 다중 색상 패널로 인해 스펙트럼 블리드를 수정합니다.
- 15 mL 원추형 튜브에서 스테인드 세포 샘플을 세포 선별기에서 실행하고 10 mL 효소없는 배양 배지 (DMEM + 20 % FBS + 1 % P / S)에서 세포를 수집합니다. 단일 셀용 게이트, 라이브 셀용 게이트, CD45 음성 셀용 게이트, CD34 및 CD31 음성 셀게이트, NG2 양성 세포에 대한 게이트, CD146 및 CD140b 양성 세포에 대한 최종 게이트.
5. 세포의 배양
- 0.2% 젤라틴으로 24웰 플레이트를 5분 동안 코팅하고 젤라틴 용액을 흡인합니다. DMEM에서 4.2.5 단계 + 20 % FBS + 1 % P / S최대 2 x 104 세포 / cm2에서 갓 얻은 세포를 시드. 37°C, 5%CO2 및 95% O2로 설정된 세포인큐베이터에서 배양 세포.
- pericytes의 통과
- 세포가 95% 결합되면 따뜻한 1x DPBS로 세포를 씻고 실온에서 3-5 분 동안 각 우물에서 0.1 % 트립신의 200 μL로 세포를 들어 올립니다.
- 접시를 부드럽게 눌러 세포를 느슨하게 합니다.
- 트립신을 배양 배지의 3.5배(700 μL DMEM + 20% FBS + 1% P/S)로 중화시키고, 종자 통로 2(P2) 세포를 코팅되지 않은 6웰 플레이트상에 2 x 104 세포/cm2로 중화시켰다.
- 각각의 잘, 결합 할 때, 다음 1 :6 비율로 분할 할 수있는 P3 세포로 단일 T-75 플라스크로 이동할 수 있습니다.
6. 회신세포의 특성화
-
유세포분석
- 섹션 4에 설명된 것과 동일한 FACS 염색 프로토콜 및 게이팅 전략을 사용하십시오.
- 유량 세포계에서 컨트롤 및 스테인드 샘플을 실행합니다. 분석 소프트웨어(자료표)를 사용하여데이터를 수집하고 분석합니다.
- 브라이트필드 이미지를 수집하려면 37°C, 5% CO2 및 95% O2로 설정된 세포 인큐베이터에서 플라스크에서 세포를 성장시다. 세포가 표면에 부착된 후 현미경으로 이미지를 캡처합니다.
-
면역 세포 화학
- 96 웰 플레이트에서 세포를 90 % 수렴 할 때까지 성장시다. 따뜻한 1x DPBS로 세포를 세척하고 실온에서 30 분 동안 4 % 파라 포름 알데히드로 고정하십시오.
- 세포를 1x DPBS로 3x 세척하고 실온에서 10 분 동안 0.1 % 세제로 투과하십시오.
- 실온에서 1 시간 동안 차단 버퍼로 세포를 배양하십시오. 차단 후, 1차 항체(웰당 1체 항체)를 1:100 희석하여 완충액을 차단하고 밤새 4°C에서 배양한다. 1차 항체는 항NG2, 항-CD140b, 항-CD31, 항-비멘틴, 안티데스민, 및 항-알파 평활근 액틴이다.
- 다음날, 세척 완충제 (재료표)로 셀을 3 배 씻어 주세요. 차단 완충액에 1:1,000희석된 이차 항체를 추가하고 어둠 속에서 실온에서 2시간 동안 배양한다. 이차 항체는 FITC에 공액된 항토끼이다.
- 세척 버퍼로 셀을 3x 세척하십시오. 실온에서 5분 동안 1:1,000에서 희석된 300 μM 핵 얼룩을 추가합니다.
- 1x DPBS로 셀을 3x 세척하고 마운팅 매체로 마운트합니다.
- 공초점 현미경을 가진 심상 세포.
결과
전체 심장의 효소 소화 및 해리 후 세포의 FACS 정제 전에, 세포는 심장으로부터 많은 상이한 세포 유형을 포함하는조잡한 혼합물이다 (도 1A). FACS 정제 및 배양 후 세포는 균일합니다. 그(것)들은 단 하나 핵화되고, 아주 평평하고, 전형적인 pericyte 마름모꼴 형태를 가지고 있다 (그림1B).
FACS를 사용하여 세포는 균질화로 정제됩니다. 얼룩지지 않은 대조군 세포 샘플은 게이팅 전략을나타내기 위해 사용된다(도 2). 첫째, 파편과 이중은 전진 및 측면 산란 분포를 기반으로 게이트아웃되었습니다. 그런 다음 죽은 세포는 살아있는 세포보다 더 크고 더 강렬한 신호를 생성하는 염료와의 아민 반응으로 인해 문을 두었습니다. 살아있는 세포 중, 조혈 세포는 CD45+가됨으로써 문을 두는. 조혈 및 내피 세포를 추가로 제거하기 위해, CD34+ 및 CD31+ 세포를 문질제거하였다. 마지막으로, NG2+ 및 CD140b+/CD146+세포는 전형적인 pericyte 마커의 발현을 가진 시반 세포에 대해 선택되었다(도 3). 마커 패널은 또한 대조군으로서 마우스 관상동맥 내피 세포에서 시험하였다(보충도도1). 원유 세포 혼합물의 약 1 %만이 선별 후 pericytes로 구성되었습니다.
세포가 참으로 pericytes이었다는 것을 확인하기 위하여는, 우리는 추가 특성화를 위해 세포를 계의했습니다. 세포는 T-75 플라스크에서 P3에 도달하면 생존력의 변화없이 급속히 성장했습니다 (보충그림2). 인간의 뇌 와 비교했을 때, 세포는 유사한 형태를가졌다 (도 4A). 마우스 및 인간 평활근 세포와 비교했을 때,세포는 상이한 형태를 가졌다(도 4A). 또한 면역염색 또는 유세포분석 후 유세포분석후 P7에서의 형태또는 마커 발현에서 관찰된 변화가없었다(도4B,C).
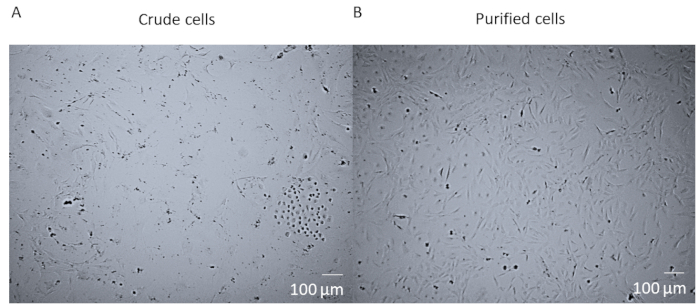
그림 1 : 원유 세포 대 정제 된 세포. (A) 14일 동안 T25 플라스크에서 배양된 조세포 혼합물의 밝은 면상이 심장 전체 효소 소화 및 해리를 포스트한다. (B) 14일 후 심박수의 균질한 집단의 밝은 시야 이미지 배율 표시줄 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
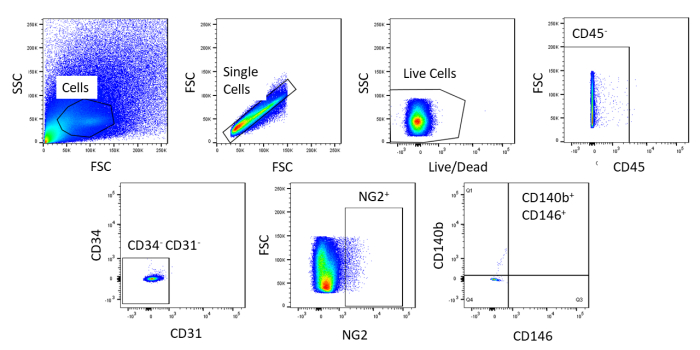
그림 2 : 얼룩지지 않은 세포의 FACS 분석의 대표적인 이미지. 조세포 혼합물을 정화하는 데 사용되는 게이팅 전략의 개략적 표현. 단일, 라이브, CD45-CD31-CD34-- , NG2+, CD146+및 CD140b+셀게이트 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
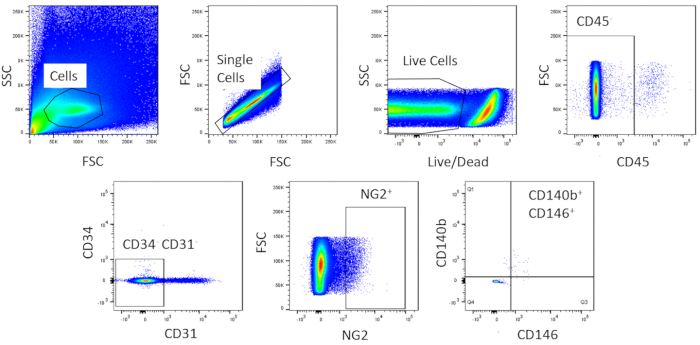
그림 3 : 원유 세포의 FACS 분석의 대표적인이미지. 심장 pericytes의 동질적인 인구를 얻기 위하여 이용된 분류의 개략적인 표현. 원유 세포의 약 1%는 CD31-CD34-CD45-CD140b + NG2+CD146+ 입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
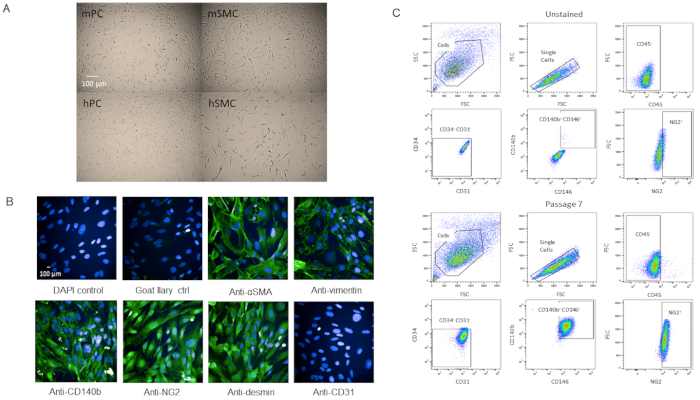
그림 4 : 1차 분리된 심장 마비의 특성화 (a) 인간의 뇌(hPC) 및 마우스 하트(mPC)로부터 배양된 세포의 브라이트필드 이미지는 인간 평활근 세포 hSMC) 및 마우스 평활근 세포(mSMC)와 는 유사한 pericyte 세포 형태이지만 상이한 형태를 보여준다. 스케일 바 = 100μm. (B) Pericyte 마커에 대한 면역 세포 화학에 의해 P7에서 세포의 Phenotypic 특성. 스케일 바 = 100μm. (C) P7에서 의 유세포세포분석에 의한 분석은 음극 마커 CD31, CD34, CD45 및 양성 마커 NG2, CD140b 및 CD146에 대해 문이 매어졌다. 인구는 균일 한 남아있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 도 1: 마커 패널을 사용하여 내피 세포의 유세포 분석의 대표적인 이미지. 마우스 관상 동맥 내피 세포주는 마커에 대한 결합 특이성에 대한 대조군으로서 사용하였다. 음의 게이트 대신 CD31에 대한 양수 게이트를 제외한 정렬에서 사용된 것과 동일한 게이팅 전략을 사용하여, 내피 세포는 CD45, CD34, NG2, CD140b 및 CD146에 대해 음수였지만 예상대로 CD31에 대해 양수였다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 2: mPC의 상이한 계의 유세포 분석의 대표적인 이미지. 1차 분리된 심장 pericytes는 배양되고 통로 12까지 통과되었습니다. 세포는 프로피듐 요오드화물로 염색하고 유세포계에서 분석하였다. 제어 집단은 죽은 세포와 살아있는 세포의 혼합물이다. 대부 사이 실행 가능한 세포의 수에 있는 중요한 다름이 없었습니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
토론
심장 pericytes에 대한 연구는 상대적으로 새로운, 심장 혈관 생리학 및 병리생리학에 있는 pericytes의 역할은 아직 정의되지 않았습니다. 다른 기관에서는 혈관 항상성과 관류1,2에서중요한 역할을하는 것으로 나타났습니다. 뇌와 같은 다른 기관의 pericytes 문헌에 비해 심장 pericytes에 훨씬 적은 간행물이 있습니다. 심장 pericytes의 격리는 그들의 기능적인 특성 및 신호 기계장치의 이해에 중요합니다. 따라서,이 프로토콜은 더 쉽게 사용할 수있는 조직 소스에서 심장 pericytes에 액세스하고 자신의 생물학에 대한 연구를 촉진하는 쉬운 방법을 조사원을 제공 할 것입니다. 그것은 심장 pericytes가 심장 항상성 및 병리생리학에 기여하는 방법에 대한 질문에 대답하는 것을 도울 것입니다 뿐만 아니라 그들의 치료 잠재력을 조사하는 것을 도울 것입니다.
뮤린 심장에서 분리된 pericyte 인구는 CD31-CD34-CD45-CD140b+NG2+CD146+를 여러 번 통과되었습니다 (P12까지 그리고 여전히 강해졌습니다),하지 않습니다. 생존력의 감소와 빠르게 전파됩니다(보충그림2). 세포는 또한 냉동 및 적어도 95% 생존율로 복구되었습니다. 그러나, 우리는 우리의 실험을 위해 세포 P7 이하를 사용하는 것을 선호합니다. 인간의 뇌 pericytes와 우리의 pericytes의 밝은 필드 이미지를 비교, 두 세포 주 (그림4A)그들은 평활근 세포에서 형태에서 다른 동안 (그림4A). 우리의 P7 세포는 pericyte 마커를 위한 면역세포화학을 특징으로 하고, 일부는 우리의 FACS 패널 (NG2 및 CD140b)에서, 그리고 몇몇은 패널 (vimentin, desmin, αSMA)에서, 우리는 세포가 동질적으로 pericyte 마커를 발현한다는 것을 것을을 발견하였다 (도4B). 추가적으로, 우리의 P7 세포는 통과때문에 마커 발현에 있는 변경을 평가하기 위하여 동일 마커 패널로 유세포 측정에 의해 다시 분석되고 우리는 아무 변경도 없었다는 것을 것을을 발견했습니다 (도4C). 따라서, 전형적으로 그리고 형태학적으로 둘 다, 우리의 세포는 pericytes입니다.
Nees et al.10,Avolio et al.11,Chen et al.12,및 Baily et al.13에 의한 연구는 성공적인 심장 pericyte 격리를 보여주었습니다. 그러나, Nees et al.10에 의해 마이크로 혈관에서 pericytes를 분리하기 위하여 사내 주문을 받아서 만들어진 장비의 사용은 메쉬 그물 스택을 통해 앞뒤로 프로테아제 용액을 관상하는 펌프를 가진 2개의 약실을 관련시켰습니다, 이는 복제하기 어려웠습니다 장치의 개략적 및/또는 그림을 제공하지 않았으며, 어떻게 지어졌는지 에 대한 정보를 제공하지 않았습니다. Nees 등10 성공적으로 많은 종에서 심장 pericytes 를 격리, 우리는 그들의 방법을 재현할 수 없었다. 우리의 프로토콜에 있는 우리의 pericyte 분리 단계는 단순히 궤도 셰이커를 사용 하 여 (모든 세포를 해리) 대부분의 사용할 수 있는, 모든 실험실, 조직 및 효소 솔루션 원추형 튜브에 다음 기계적 해리 단계. 사용자 지정 장치가 필요하지 않습니다. 둘째, 나머지 프로토콜은 인간 조직의 사용을 포함하고 따라서 인간 조직의 조달은 조사자에게 제한된다. 당사의 프로토콜은 마우스 모델(야생 유형, 유전자 변형, 질병)을 사용하여 현재 프로토콜9,12의 수정 및 최적화이며 모든 조사자가 쉽게 사용할 수 있는 물질입니다.
일반적으로 세포 주체는 민감하기 때문에, 세포의 생존력은 양호한 수율을 얻는 데 중요하다. 심장 조직의 조달 및 세포의 염색 하는 동안, 조직/세포 얼음 차가운 유지 될 필요가. 둘째, 조직의 효소 소화는 개별적으로 최적화를 요구할 수 있습니다. 효소의 하나의 바이알에 활동의 단위에 따라, 농도 및 소화 시간을 최적화 해야 할 수 있습니다. 효소 용액이 그렇지 않으면 수율이 감소 할 때마다 신선한 준비되어 있는지 확인하십시오. 셋째, 원유 혼합물은 많은 세포를 포함, 일부 죽은 및 / 또는 죽어, 5 %에서 2 %로 염색 버퍼에 FBS의 농도를 낮추는 것이 가장 좋습니다. 정렬 하는 동안 노즐을 막힘 세포에 문제가 있는 경우, 죽은 셀 제거 키트를 사용 하 여 먼저 세포를 풍부 하 게. 또한 EDTA/HEPES 버퍼 또는 DNase 처리를 세포 응집을 방지하기 위해 사전 정렬에 추가할 수 있습니다. 마지막으로, 항체 패널이 다소 크고 많은 형광질을 사용하기 때문에 FMO 제어 및 보상 제어가 올바르게 수행되었는지 확인하십시오.
이 방법의 한 가지 제한은 심장 당 얻을 수있는 심장 pericytes의 양입니다. 우리의 경우에, 단지 1.1% 한 마우스 심혼에서 우리의 조류 혼합물의 인간 적인 심혼 격리에 있는 백분율에 필적하는 pericytes, 그러나 세포의 수는 마우스가 제공하는 심혼 조직의 양 때문에 현저하게 더 적습니다. 세포의 시작 수는 FACS 후 너무 낮기 때문에, 한 번에 여러 마음에서 격리하는 것이 좋습니다. 그러나, 그 문제는 하루에 통해 정렬 해야 하는 셀의 깎아 지른듯한 수. 3천만 개 이상의 세포가 있는 경우 세포의 생존 가능성에 영향을 미치지 않으면서 정렬을 통과하기가 어려울 것입니다. 조사관이 여러 셀 선별기를 가지고 있다면, 하루에 여러 마음에서 고립시키는 것이 가능할 것입니다. 또 다른 제한은 골격 근(15,16)이있는것처럼 심장에 pericytes의 하위 인구가 있는지 모르기 때문에, 우리는 우리의 게이팅 전략에서 아류형을 제거하고 있는지 모른다. 우리는 우리의 심장 pericytes를 특성화하는 과정에 있고 지금까지 우리의 미공개 데이터에서, 그들은 기능적으로 문학의 다른 pericytes 같이 입니다.
우리의 프로토콜은 연구원이 심장 항상성 및 혈역학에 대한 기여를 정의하는 데 도움이되는 심장 pericyte 특성, 특성, 기능 및 기타 측면에 대한 질문에 대답 할 수 있게합니다. 이 세포는 일단 그들의 생물학이 더 잘 이해되면 심장 혈관 질병에 치료 잠재력을 가질 수 있었습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 형광판 패널 설계, 문제 해결 및 세포 선별에 도움을 준 암젠 유동 세포 분석 코어에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-053-Cl | dilute with 1x DPBS to get 0.1% |
| 100 μM Cell strainer | FisherSci | 22363549 | |
| 15 mL Falcon conical tubes | BD | 352096 | |
| 24-well plate | Corning | CLS3527 | |
| 25 G butterfly needle | FisherSci | 22-253-146 | |
| 31 G needle syringe | FisherSci | B328446 | |
| 50 mL Falcon conical tubes | BD | 352098 | |
| 6-well plate | Corning | CLS3516 | |
| anti-alpha smooth muscle actin rabbit mAb | abcam | ab32575 | Antibody used in ICC 1:100 dilution |
| anti-CD140b rabbit mAb | Cell Signaling | 28E1 | Antibody used in ICC 1:100 dilution |
| anti-CD31 rabbit pAb | abcam | ab28364 | Antibody used in ICC 1:100 dilution |
| anti-desmin rabbit pAb | abcam | ab8592 | Antibody used in ICC 1:100 dilution |
| anti-NG2 conjugated to AF488 | Millipore | MAB5384A4 | Antibody used in ICC 1:100 dilution |
| anti-vimentin rabbit mAb | abcam | ab92547 | Antibody used in ICC 1:100 dilution |
| ArC Amine Reactive Compensation bead kit | Invitrogen | A10346 | compensation beads for Live/Dead Near IR dye |
| Brightfield Microscope | camera attached | ||
| CD140b-PE (clone APB5) | eBioscience | 12-1402-81 | Antibody used in FACS 1:100 dilution |
| CD146-BV605 (clone ME-9F1) | BD | 740434 | Antibody used in FACS 1:100 dilution |
| CD31-APC (clone MEC 13.3) | BD | 551262 | Antibody used in FACS 1:100 dilution |
| CD34-BV421 (clone RAM 34) | BD | 56268 | Antibody used in FACS 1:100 dilution |
| CD45-PE-Cy7 (clone 30-F11) | BD | 552848 | Antibody used in FACS 1:100 dilution |
| Centrifuge | eppendorf | ||
| Collagenase B | Roche | 11088815001 | 0.226 U/mg lyo. |
| Confocal Microscope | |||
| DAPI | ThermoFisher | D1306 | nuclear stain |
| DMEM with 4.5 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-013-CV | 500 mL |
| Dowell scissors | FST | 15040-11 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Corning | 21-030-CV | 500 mL |
| Dulbecco's Phosphate-Buffered Saline without Ca and Mg (CMF-DPBS) | Corning | 21-031-CV | 500 mL |
| Dumont #5 Fine Forceps | FST | 11254-20 | |
| FACSAria cell sorter | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| FACSAria software | BD | ||
| Falcon tube round-bottom polypropylene, 5 mL | BD | 38057 | |
| Falcon tube with cell strainer cap, 5 mL | BD | 08-771-23 | |
| Fetal Bovine Serum | Corning | 35-015-CV | 500 mL |
| Fine scissors | FST | 14060-09 | |
| FlowJo software | FlowJo LLC | ||
| Fortessa LSR flow cytometer | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| Gelatin-based coating | Cell Biologics | 6950 | |
| Goat anti-rabbit IgG (H+L) Cross-Absorbed Secondary antibody, Alexa Fluor 488 | Invitrogen | A-11008 | Antibody used in ICC 1:1000 dilution |
| Graefe Forceps | FST | 11049-10 | |
| Heparin sodium solution | Hospira | NDC 0409-2720-02 | 10,000 USP units/10 mL; from porcine intestines |
| Incubator | set at 37 °C, 5% CO2, 95% O2 | ||
| Live/Dead-Near IR | Life Technologies | L10119 | |
| Microscope slides | FisherSci | 12-550-343 | |
| NG2-FITC | Millipore | AB5320A4 | Antibody used in FACS 1:100 dilution |
| Oribital shaker | VWR | Inside 37 °C incubator or room | |
| Paraformaldehyde | FisherSci | 50-980-487 | dilute with 1x DPBS to get 4% |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Petri dish | FisherSci | FB0875714 | |
| Pipette and tips | |||
| ProLong Diamond | ThermoFisher | P36965 | mounting media |
| Propidum Iodide | ThermoFisher | cell viability dye for supplemental figure 2 | |
| Rabbit IgG FITC | eBiosciences | 11-4614-80 | Isotype control antibody - FITC |
| Rat IgG2a APC | Biolegend | 400512 | Isotype control antibody - APC |
| Rat IgG2a BV421 | Biolegend | 400536 | Isotype control antibody - BV421 |
| Rat IgG2a BV605 | BD | 563144 | Isotype control antibody - BV605 |
| Rat IgG2a PE | Biolegend | 400308 | Isotype control antibody - PE |
| Rat IgG2b PE-Cy7 | Biolegend | 400617 | Isotype control antibody - PE-Cy7 |
| SuperBlock | ThermoFisher | 37515 | blocking buffer |
| T75 | ThermoFisher | 156499 | |
| Triton X-100 | Sigma | X100 | detergent, dilute with x DPBS to get 0.1% |
| UltraComp beads | Invitrogen | 01-2222-42 | compensation beads |
| Variable-Flow Peristaltic Pump | FisherSci | 13-876-1 | |
| ViCell Cell counter | Beckman | ||
| Wash buffer | 1:10 dilution of Superblock in 1x DPBS |
참고문헌
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Sengillo, J. D., et al. Deficiency in mural vascular cells coincides with blood-brain barrier disruption in Alzheimer's disease. Brain Pathology. 23 (3), 303-310 (2013).
- Avolio, E., Madeddu, P. Discovering cardiac pericyte biology: From physiopathological mechanisms to potential therapeutic applications in ischemic heart disease. Vascular Pharmacology. 86, 53-63 (2016).
- Dore-Duffy, P. Isolation and characterization of cerebral microvascular pericytes. Methods in Molecular Medicine. 89, 375-382 (2003).
- Bryan, B. A., D'Amore, P. A. Pericyte isolation and use in endothelial/pericyte coculture models. Methods in Enzymology. 443, 315-331 (2008).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant outgrowth, propagation and characterization of human pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Crisan, M., Corselli, M., Chen, W. C., Peault, B. Perivascular cells for regenerative medicine. Journal of Cellular Molecular Medicine. 16 (12), 2851-2860 (2012).
- Crisan, M., et al. Purification and long-term culture of multipotent progenitor cells affiliated with the walls of human blood vessels: myoendothelial cells and pericytes. Methods in Cellular Biology. 86, 295-309 (2008).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology Heart Circulatory Physiology. 302 (1), H69-H84 (2012).
- Avolio, E., et al. Expansion and characterization of neonatal cardiac pericytes provides a novel cellular option for tissue engineering in congenital heart disease. Journal of the American Heart Association. 4 (6), e002043 (2015).
- Chen, W. C., et al. Human myocardial pericytes: multipotent mesodermal precursors exhibiting cardiac specificity. Stem Cells. 33 (2), 557-573 (2015).
- Baily, J. E., et al. Isolation of Perivascular Multipotent Precursor Cell Populations from Human Cardiac Tissue. Journal of Visualized Experiments. (116), e54252 (2016).
- Murray, I. R., et al. Skeletal and cardiac muscle pericytes: Functions and therapeutic potential. Pharmacology & Therapeutics. 171, 65-74 (2017).
- Birbrair, A., et al. Role of pericytes in skeletal muscle regeneration and fat accumulation. Stem Cells Development. 22 (16), 2298-2314 (2013).
- Birbrair, A., et al. Skeletal muscle pericyte subtypes differ in their differentiation potential. Stem Cell Research. 10 (1), 67-84 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유